利用蛋白质水解物的蛋白质多糖类双涂层乳酸菌制备方法与流程
本发明涉及利用蛋白质水解物的蛋白质多糖类双涂层乳酸菌的制备方法及由此方法制备的具有双涂层的乳酸菌。
背景技术:
乳酸菌(lacticacidbacteria)也称为乳酸菌或乳酸,它是一种生活在哺乳类的肠道内并防止由杂菌引起的异常发酵并用作理肠剂的重要细菌。例如,保加利亚乳酸菌(l.bulgaricus)是已知时间最长的乳酸菌,用于酸奶的制备,也用作制备奶酪和发酵黄油时的起子。并且,好氧性乳酸菌(l.acidophilus)存在于人类及所有哺乳类和其他动物的肠道中,用在黄油或牛奶的制备或肠道内自我中毒的治疗中。并且,乳酸乳杆菌(l.lactis)生成dl-乳酸,其总是存在于牛奶中并用于制备黄油或奶酪,作为乳酸乳杆菌最为重要的菌。
如上所述的有用的乳酸菌落在肠道中,通过激活肠内运动来改善便秘或腹泻症并使排便活动顺畅,除此之外,具有免疫力提高、抗高血脂、抗过敏性皮炎、减肥效果、抗糖尿病等各种生理活性,因此广泛使用于健康功能食品、控制肠道用药品、改善皮肤用化妆品、饲料添加剂等中。但是,为了发挥上述的生理作用,需要摄取比以往通过酸奶等食品摄取量更多的乳酸菌。因此,通过仅分离乳酸菌来以粉末或胶囊形式简单食用的方法已被大众化。
与主要利用发酵产物的其他产业用微生物不同,由于这些乳酸菌利用活菌本身,因此存在有效期及摄取时消化过程中存活率的保持非常重要的问题。即,乳酸菌本身是益生菌,当口服摄取时人体内ph降至3以下,并且生长被胃肠和小肠中分泌的消化酶及胆汁酸抑制,不仅导致到达大肠的活菌数量减少,而且肠道内落实率下降。
因此,即使乳酸菌是在效能和价值方面非常有益的菌,但是由于非常不稳定,因此在长期保管和使用方面有很多局限性,使用它们的发酵乳产品及益生菌由于制备过程和保管期间中氧气或氧化应激而导致存活率大大降低,从而对产业应用或口服摄取时的功效发挥造成了障碍。
为了解决如上所述的问题,开发了涂敷乳酸菌的多种方法,最初,有使用胶囊剂的肠溶涂敷剂和明胶、使用多糖类、胶类的微胶囊化等,但是已被指出使用昂贵的涂敷剂或添加工序的问题。
为了解决该问题,竞争性地开发了制备高浓度的乳酸菌存活的双重结构的果冻的方法、通过添加具有水溶性聚合物、透明质酸、多孔颗粒的涂敷剂及蛋白质来进行四重涂敷的方法(韩国专利申请第10-2011-0134486号)、利用水溶性聚合物、功能性水合透明质酸、多孔颗粒及蛋白质进行四重涂敷的方法(韩国专利申请第10-2015-0129986号)、为了增进肠内存活率而用酪蛋白、涂敷剂、食用油脂、植物乳杆菌的细胞外聚合物(extracellularpolymericsubstance)及海藻酸涂敷乳酸菌的方法(韩国专利申请第10-2016-0172568号)、为了提高肠道内落实性而用丝素蛋白涂敷的方法(韩国专利申请第10-2017-0045326号)。
但是,这种改进的乳酸菌涂敷技术也未能完全涂敷乳酸菌的表面,并且在冷冻干燥存活率、乳酸菌的耐热性、耐酸性及耐胆汁性、肠内落实性等仍然不够优秀,存在在保管及流通过程中存活率下降的问题。
在本说明书中提及的专利文献及参照文献通过引用并入本文,如同每个文献通过引用被特定为单独且明确的。
现有技术文献
专利文献
专利文献1:韩国专利申请第10-2011-0134486号
专利文献2:韩国专利申请第10-2015-0129986号
专利文献3:韩国专利申请第10-2016-0172568号
专利文献4:韩国专利申请第10-2017-0045326号
技术实现要素:
本发明分为开发可提高乳酸菌的冷冻干燥存活率、储存稳定性、耐酸性及耐胆汁性的乳酸菌涂敷方法而进行研究努力的结果,通过实验确认,若在水解蛋白质后利用其与多糖类及冷冻保护剂一起双重涂敷乳酸菌,则可大大提高乳酸菌的冷冻干燥存活率、耐酸性、耐胆汁,从而完成了本发明。
因此,本发明的目的在于,通过利用以提高提供乳酸菌的冷冻干燥存活率、储存稳定性、耐酸性及耐胆汁性的方式水解的蛋白质来有效地双重涂敷乳酸菌的方法。
本发明的再一目的在于,提供因形成双重涂敷而乳酸菌的冷冻干燥存活率、储存稳定性、耐酸性及耐胆汁性得以提高的乳酸菌。
本发明的另一目的在于,提供包含上述双重涂敷的乳酸菌的食品组合物。
通过下述发明的详细说明发明要求保护范围及附图来进一步示出本发明的其他目的及技术特征。
在本发明的一实施方式中,提供具有蛋白质多糖类涂层的双涂层的乳酸菌的制备方法,包括:步骤(a),通过对蛋白质水溶液处理蛋白质水解酶来制备蛋白质的水解率为45~95%的蛋白质水解水溶液;步骤(b),向所制备的上述蛋白质水解水溶液中添加用于培养乳酸菌的的糖成分及氮源成分并进行杀菌后,通过接种乳酸菌来进行培养;步骤(c),从经过培养获得的上述乳酸菌的发酵培养液回收乳酸菌的菌体;步骤(d),通过向所回收的上述乳酸菌的菌体中添加冷冻保护剂水溶液及多糖类水溶液来进行混合及均质化;以及步骤(e),冷冻干燥所均质化的上述乳酸菌菌体水溶液。
蛋白质水解物的制备
在本发明中,使用于乳酸菌的涂敷的蛋白质通过水解处理后使用。
在本发明的一实例中,蛋白质的水解处理可通过向包含蛋白质的蛋白质水溶液中添加蛋白质水解酶后进行水解反应来进行。
在本发明的一实例中,优选地,上述蛋白质的水解率范围在45~95%。
在本发明中,蛋白质的水解率是指蛋白质被酶水解的程度,可通过使用i)测定用酶水解处理之前和之后的蛋白质水溶液的吸光度差异的方法;ii)测定通过离心分离用酶水解处理之前和之后的蛋白质水溶液来得到的沉淀物的重量的差异的方法;或者iii)通过使用上述两种方法来测定的值的平均值来计算。
在本发明的一实例中,在本发明中,上述蛋白质的水解率为作为处理蛋白质水解酶之前的蛋白质水溶液的吸光度(od,opticaldensity)测定值(“起点od”)与处理蛋白质水解酶之后的蛋白质水溶液的吸光度测定值(“终点od”)之差的δod值除以上述起点od值的百分比(%)。即,上述蛋白质的水解率可通过如下公式来计算:水解率(%)=[δod]/[起点od]×100。
在本发明的再一实例中,在本发明中,上述蛋白质的水解率为作为通过离心分离处理蛋白质水解酶之前的蛋白质水溶液来得到的沉淀物的重量测定值(“起点ppt”)与通过离心分离处理蛋白质水解酶之后的蛋白质水溶液来得到的沉淀物的重量测定值(“终点ppt”)之差的δppt除以上述起点ppt值的百分比(%)。即,上述蛋白质的水解率可通过如下公式来计算:水解率(%)=[δppt]/[起点ppt]×100。
在本发明的另一实例中,可使用通过上述两种方法测定的水解率的平均值。
在本发明的一实例中,使用于乳酸菌涂敷的蛋白质可以为脱脂奶粉、大豆分离蛋白(isp)或脱脂奶粉及大豆分离蛋白的混合物。
在本发明的一实例中,在本发明中,脱脂奶粉的水解率可以为59~93%,优选地可以为75~92%,更优选地可以为80~90%。
在本发明的一实例中,在本发明中,大豆分离蛋白的水解率可以为45~86%,优选地可以为61~80%,更优选地可以为70~80%。
在本发明的一实例中,在本发明中,上述脱脂奶粉及大豆分离蛋白的混合物的水解率可以为75~93%,优选地可以为76~85%,更优选地可以为78~83%。
使用于本发明的蛋白质水解酶是指将蛋白质分解成氨基酸或肽水平的酶。在本发明中,蛋白质水解酶可选择使用常用化的碱性蛋白酶(alcalase)、风味酶(flavourzyme)、中性蛋白酶(neutrase)、复合蛋白酶(protamax)等,但并不限定于此。
在本发明中,若对蛋白质进行水解处理,则推断可生成半水溶性肽(peptide)。上述半水溶性肽是指蛋白质水解处理时未完全水解成氨基酸而留下的肽,在本发明的方法中,水解率越高半水溶性肽的量越少,水解率越多,其量增加。上述半水溶性肽缓解由冷冻干燥时施加到细胞的物理冲击引起的蛋白质变性,从而起到提高冷冻干燥存活率的作用。相反,在蛋白质水解水溶液中存在过量上述半水溶性肽的情况下,培养液变为疏水性,从而诱导乳酸菌的聚集并可抑制乳酸菌的培养性。
因此,在本发明中,在蛋白质水解物低于上述的范围的蛋白质的水解率的情况下,因未水解的大量半水溶性肽而培养液的疏水性变高且聚集有乳酸菌,导致分解不顺利,最终导致乳酸菌的培养性不良。相反,在蛋白质水解物高于上述的范围的蛋白质的水解率的情况下,由于未分解的半水溶性肽的量不足,而不能够足以缓解由冷冻干燥时施加在乳酸菌的物理冲击引起的蛋白质变性,因此存在冷冻存活率下降的问题。
在本发明的一实例中,当水解脱脂奶粉时,相对于脱脂奶粉水溶液,脱脂奶粉的浓度为0.5~10.0重量百分比,优选地可以为1.0~6.0重量百分比,蛋白质水解酶的浓度为0.0005~0.010重量百分比,优选地可以为0.001~0.008重量百分比。
在本发明的一实例中,当水解大豆分离蛋白时,相对于大豆分离蛋白水溶液,大豆分离蛋白的浓度为0.10~3.0重量百分比,优选地可以为0.15~1.0重量百分比,蛋白质水解酶的浓度为0.001~0.10重量百分比,优选地可以为0.005~0.030重量百分比。
在本发明的一实例中,当水解脱脂奶粉及大豆分离蛋白的混合物时,相对于脱脂奶粉及大豆分离蛋白的混合物水溶液,脱脂奶粉及大豆分离蛋白的混合物的浓度为0.05~2.0重量百分比,优选地可以为0.10~0.40重量百分比,蛋白质水解酶的浓度为0.05~4.0重量百分比,优选地可以为0.5~3.0重量百分比。
乳酸菌培养及蛋白质涂敷
向上述制备的蛋白质水解水溶液添加用于培养乳酸菌的糖成分及氮源成分并进行杀菌后,通过接种乳酸菌来进行培养。
在本发明中,成为上述涂敷的对象的乳酸菌是生成酸并在弱酸性条件下也可以增殖的乳酸菌,可以为选自由乳杆菌属(lactobacillussp.)、双歧杆菌属(bifidobacteriumsp.)、链球菌属(streptococcussp.)、乳球菌属(lactococcussp.)、肠球菌属(enterococcussp.)、片球菌属(pediococcussp.)明串珠菌属(leuconostocsp.)及魏斯氏菌属(weissellasp.)中的一种以上,但并不限定于此,优选地,可以为植物乳杆菌(lactobacillusplantarum)、干酪乳杆菌(lactobacilluscasei),鼠李糖乳杆菌(lactobacillusrhamnosus)、消化乳杆菌(lactobacillusalimentarius)、沙克乳酸杆菌(lactobacillussakei)、嗜酸乳杆菌(lactobacillusacidophilus)、格氏乳杆菌(lactobacillusgasseri)、德氏乳杆菌(lactobacillusdelbrueckii)、发酵乳杆菌(lactobacillusfermentum)、保加利亚乳杆菌(lactobacillusbulgaricus)、肠膜明串珠菌(leuconostocmesenteroides)、屎肠球菌(enterococcusfaecium)、粪肠球菌(enterococcusfaecalis)、嗜热链球菌(streptococcusthermophilus)、乳链球菌(streptococcuslactis)、粪链球菌(streptococcusfaecalis)、比菲德氏菌(bifidobacteriuminfantis)、两歧双歧杆菌(bifidobacteriumbifidum)、长双歧杆菌(bifidobacteriumlongum)、短双歧杆菌(bifidobacteriumbreve)及乳酸乳球菌(lactococcuslactissubsp.lactis)组成的组中的一种以上。
并且,在本发明中,优选地,作为上述乳酸菌可以为选自由植物乳杆菌cbt-lp(植物乳杆菌cbt-lp,保藏号:kctc10782bp)、德氏乳杆菌亚种cbt-lg(lactobacillusdelbrueckiisubsp.bulgaricuscbt-lg,保藏号:kctc11864bp)、嗜酸乳杆菌cbt-la(lactobacillusacidophiluscbt-la,保藏号:kctc11906bp)、鼠李糖乳杆菌cbt-lr(lactobacillusrhamnosuscbt-lr,保藏号:kctc12202bp)、罗伊氏乳杆菌cbt-lu(lactobacillusreutericbt-lu,保藏号:kctc12397bp)、干酪乳杆菌cbt-lc(lactobacilluscaseicbt-lc,保藏号:kctc12398bp)、副干酪乳杆菌cbt-lpc(lactobacillusparacaseicbt-lpc,保藏号:kctc12451bp)、瑞士乳杆菌cbt-lh(lactobacillushelveticuscbt-lh,保藏号:kctc12670bp)、比菲德氏菌cbt-bt(bifidobacteriuminfantiscbt-bt,保藏号:kctc11859bp)、乳双歧杆菌cbt-bl(bifidobacteriumlactiscbt-bl,保藏号:kctc11904bp)、两歧双歧杆菌cbt-bf(bifidobacteriumbifidumcbt-bf,保藏号:kctc12199bp)、长双歧杆菌cbt-bg(bifidobacteriumlongumcbt-bg,保藏号:kctc12200bp)、短双歧杆菌cbt-br(bifidobacteriumbrevecbt-br,保藏号:kctc12201bp)、戊糖片球菌cbt-pp(pediococcuspentosaseuscbt-pp,保藏号:kctc10297bp)、乳酸乳球菌亚种cbt-sl(lactococcuslactissubsp.lactiscbt-sl,保藏号:kctc11865bp)、嗜热链球菌cbt-st(streptococcusthermophiluscbt-st,保藏号:kctc11870bp)、粪肠球菌cbt-efl(enterococcusfaecaliscbt-efl,保藏号:kctc12394bp)及屎肠球菌cbt-ef(enterococcusfaeciumcbt-ef,保藏号:kctc12450bp)组成的组中的一种以上,优选地,可以为选自由嗜酸乳杆菌cbt-la(lactobacillusacidophiluscbt-la)、植物乳杆菌cbt-lp(lactobacillusplantarumcbt-lp)、嗜热链球菌cbt-st(streptococcusthermophiluscbt-st)及屎肠球菌cbt-ef(enterococcusfaeciumcbt-ef)、长双歧杆菌cbt-bg(bifidobacteriumlongumcbt-bg)组成的组中的一种以上,更优选地,可以为嗜热链球菌cbt-st(streptococcusthermophiluscbt-st)、短双歧杆菌cbt-br(bifidobacteriumbrevecbt-br)、嗜酸乳杆菌cbt-la(lactobacillusacidophiluscbt-la)。
在本发明中,如下所示,为了乳酸菌的涂敷,原料可不受剂型或制备方法的限制地使用,只要包含乳酸菌的活菌即可,但是,优选地,可使用乳酸菌的培养液。
在本发明中,用于获得上述乳酸菌的培养液的乳酸菌的培养条件也不受特别限制,只要是在本技术领域中为培养乳酸菌而通常使用的条件,则可以不受限制地使用,但是,例如,可通过在mrs、bl、m17、nb或bhi等培养基中接种乳酸菌来在35~40℃的温度及氮气气体或二氧化碳气体置换的厌氧条件下培养6~48小时。
在本发明中,用于培养上述乳酸菌的糖成分可使用混合乳糖、果糖、白糖(sucrose)或葡萄糖,优选地,可选择使用符合菌株特性的。
在本发明中,用于培养上述乳酸菌的氮源成分可使用酵母提取物或大豆蛋白胨,但并不限定于此。
除此之外,为了培养乳酸菌,作为微量成分可添加二磷酸钾、硫酸镁、硫酸锰、氯化钙、柠檬酸钾、醋酸钠、l-抗坏血酸、l-谷氨酸、l-半胱氨酸盐酸盐、聚山梨酯80等。
乳酸菌菌体的回收及浓缩
尽可能从培养乳酸菌的培养液中去除大量滤液,并浓缩至作为固体成分的乳酸菌菌体(cellmass)的比重高的状态。将乳酸菌菌体浓缩地越密,在冷冻干燥乳酸菌制备中具有如下优点:i)每托盘(tray)的接种量减少且需要增发的水分的量也减少,ii)在冷冻感召过程中因渗透压差异而引起的水分流出,导致冷冻速度加快,iii)冰晶小而均匀,细胞形态的变化也小,因此冷冻中的乳酸菌细胞膜的损伤少,iv)在冻结过程中也很少发生变性。
在本发明中,回收及浓缩乳酸菌的方法并不受特别限制,但是,优选地,可通过离心分离方法来回收及浓缩,例如,可通过利用盘式(distype)高速离心分离机或管式(tubulartype)高速离心分离机来进行浓缩,但并不限定于此。
冷冻保护剂的添加
在本发明的方法中,可通过冷冻干燥乳酸菌来增加乳酸菌的储存稳定性。为了进行冷冻干燥处理,通过向回收及浓缩的乳酸菌菌体中添加冷冻保护剂来进行混合及均质化。优选地,可使用添加冷冻保护剂成分的冷冻保护剂水溶液。
可用于本发明的方法的冷冻保护剂有选自由海藻糖、麦芽糊精、甘露醇及脱脂奶粉组成的组中的一种或两种个以上的混合物。优选地,冷冻保护剂可使用由海藻糖、麦芽糊精、甘露醇及脱脂奶粉组成的混合物。将在本发明中冷冻保护剂可制备成包冷冻保护剂成分含1~90重量百分比、1~80重量百分比、1~75重量百分比、1~70重量百分比、1~65重量百分比或1~60重量百分比的水溶液的形态,并可通过添加到浓缩的乳酸菌菌体来使用。
相对于乳酸菌菌体,可通过添加适当量的上述冷冻保护剂水溶液来使用,优选地,相对于乳酸菌菌体重量,可添加0.001~99重量百分比、0.01~95重量百分比、0.1~95重量百分比的范围。
多糖类涂层
在本发明中,为了提高乳酸菌的冷冻干燥存活率、耐酸性及耐胆汁性,可用多糖类涂层浓缩的乳酸菌。
为了多糖类涂层,向浓缩的乳酸菌菌体添加多糖类成分后进行混合及均质化。优选地,可使用添加多糖类成分的多糖类水溶液。
在本发明中,可用于乳酸菌的多糖类涂层的多糖类可以为选自由胶类、水溶性膳食纤维、难消化性麦芽糊精、不溶性膳食纤维、淀粉、果聚糖(levan)及抗性淀粉组成的组中的一种以上。上述胶类可以为选自由黄原胶(xantangum)、阿拉伯胶(arabicgum)、瓜尔胶(guargum)、明胶(gellangum)、卡拉亚胶(karayagum)及槐树豆胶(locustbeangum)组成的组中的一种以上的成分。上述水溶性膳食纤维可以为聚葡萄糖(polydextrose)、葡甘露聚糖(glucomannan)、β-葡聚糖(β-glucan)、果胶(pectin)或海藻酸(alginicacid)。上述不溶性膳食纤维可以为菊苣提取物粉末、纤维素、半纤维素、木质素或菊粉。
在本发明的一实例中,使用于上述多糖类涂层的多糖类可以为黄原胶及纤维素的混合物。
在本发明中,多糖类涂层可通过将多糖类制备成包含多糖类成分1~80重量百分比、1~75重量百分比、1~70重量百分比、1~65重量百分比、1~60重量百分比或1~50重量百分比的多糖类水溶液的形态并添加到浓缩的乳酸菌菌体后通过混合及均质化的方式来进行。
相对于乳酸菌菌体重量,可添加适当量的上述多糖类水溶液来使用,优选地,相对于乳酸菌菌体重量,可添加0.001~99重量百分比、0.01~95重量百分比、0.1~95重量百分比的范围的上述多糖类水溶液来使用。
冷冻干燥
如上所述,向涂敷蛋白质的乳酸菌菌体中添加冷冻保护剂及多糖类成分,并冷冻干燥混合及均值化的乳酸菌菌体。
在本发明的还有一实施方式中,提供具有通过如上所述的方法制备的蛋白质多糖类双涂层的乳酸菌。
在本发明的又一实施方式中,提供包含具有通过如上所述的方法制备的蛋白质多糖类双涂层的乳酸菌的食品组合物。
本发明涉及利用蛋白质水解物的蛋白质多糖类双涂层乳酸菌的制备方法及由此方法制备的具有双涂层的乳酸菌。根据本发明制备的具有蛋白质多糖类双涂层的乳酸菌的冷冻干燥存活率、耐酸性、耐胆汁性非常优秀。因此,本发明的具有蛋白质多糖类双涂层的乳酸菌可在制备发酵乳、加工乳、酱类、加工食品、功能性饮料、功能性食品、普通食品等时非常有用。
附图说明
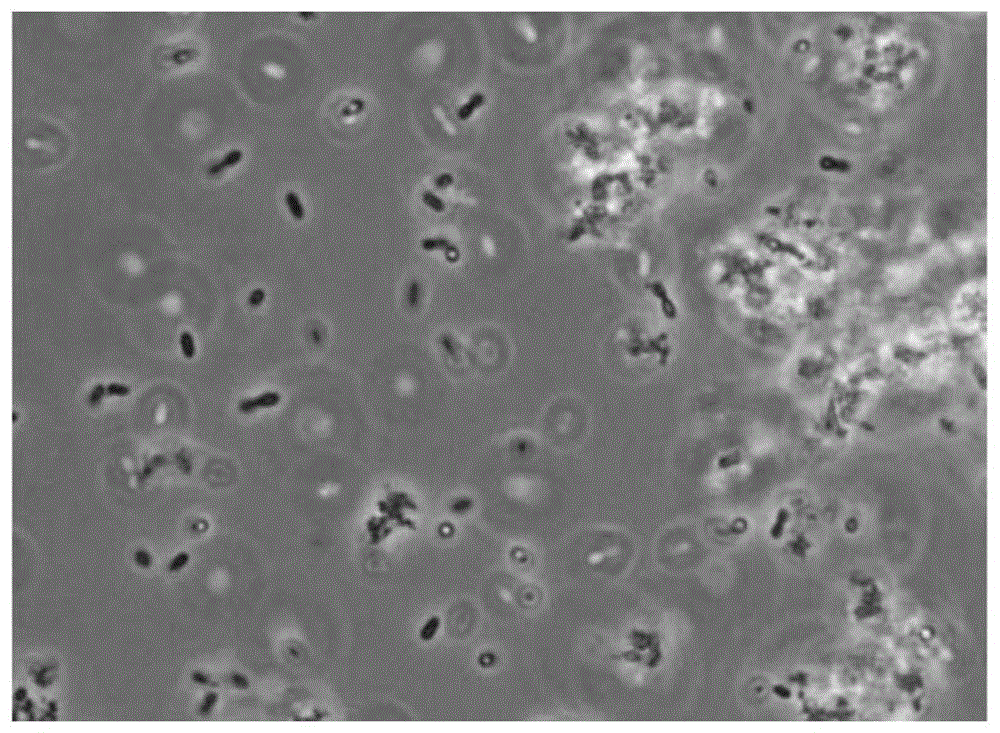
图1为嗜热链球菌cbtst3(streptococcusthermophiluscbtst3)培养液(6.0%的脱脂奶粉、0.003%的蛋白分解酶)的显微镜观察照片。
图2为短双歧杆菌cbtbr3(bifidobacteriumbrevecbtbr3)培养液(0.90%的大豆分离蛋白、0.015%的蛋白分解酶)的显微镜观察照片。
图3为嗜酸乳杆菌cbtla1(lactobacillusacidophiluscbtla1)培养液(2.0%的脱脂奶粉、0.90%的大豆分离蛋白、0.015%的蛋白分解酶)的显微镜观察照片。
图4为根据本发明的方法对嗜热链球菌cbtst3进行双重涂敷的菌体的扫描电子显微镜(sem)照片。
图5为根据本发明的方法对短双歧杆菌cbtbr3进行双重涂敷的菌体的扫描电子显微镜照片。
图6为根据本发明的方法对嗜酸乳杆菌cbtla1进行双重涂敷的菌体的扫描电子显微镜照片。
具体实施方式
在本说明书中说明的具体的实施例是指本发明的优选的实例或例示,本发明的范围并不限定于此。对于本领域技术人员而言,本发明的变形和其他用途不脱离本说明书发明要求保护范围中记载的发明范围是显而易见的。
实施例
实施例1:蛋白质的水解率测定
1-1.水解率测定方法
作为使用于乳酸菌双重涂敷的蛋白质源,测定基于蛋白分解酶的脱脂奶粉(skimmilk)、大豆分离蛋白、脱脂奶粉及大豆分离蛋白的混合物的水解率。制备了包含不同浓度的各个脱脂奶粉和大豆分离蛋白的各浓度的蛋白质水溶液。将制备的各浓度的蛋白质水溶液放入安装有搅拌器的反应容器中,在60℃的温度下以100rpm进行悬浮剂均质化后,向制备的悬浮液添加1n的naoh并将ph调至8.2±0.2。在以下表1、表2及表3中示出分别以不同浓度制备脱脂奶粉、大豆分离蛋白及脱脂奶粉+大豆分离蛋白的混合物悬浮液的例。
表1
表2
表3
通过向调节ph的悬浮液中加入不同浓度的蛋白分解酶(蛋白酶、碱性蛋白酶)并反应2小时来以水解至ph为6.8以下。以悬浮液的ph调节前为起点(酶处理前)及酶反应2小时后为重点,测定蛋白质源的水解率。
利用分光光度计(shimadzu,uv-1280)测定610nm处脱脂奶粉的水解率的吸光度。
水解率s(%)=[δod]/[起点od]×100%
[δod]=起点od-终点od
大豆分离蛋白的水解率是通过利用微型离心机(韩日,micro-12)以13000rpm进行第一次离心15分钟来废弃上清液,通过再次进行第二次离心15分钟来测定沉淀物(ppt)的重量。
水解率i(%)=[δppt]/[起点ppt]×100%
[δppt]=起点ppt-终点ppt
脱脂奶粉及大豆分离蛋白的混合物的水解率通过测定吸光度及沉淀物两种特性来以平均值计算。
水解率s&i(%)=[水解率s+水解率i]/2
1-2.水解率测定结果
测定根据脱脂奶粉的浓度及酶浓度的脱脂奶粉的水解率的结果如下述表4所示。
表4
浓度基准:脱脂奶粉溶液基准,w/w%
使用酶:蛋白酶(产品名:碱性蛋白酶2.4lfg,制造商:丹麦诺维信a/s(novozymesa/sdenmark))
实验结果,在相同的酶浓度下,水解率具有随着脱脂奶粉的浓度增加而减少,随着酶的浓度的增加而增加的倾向。
测定大豆分离蛋白的浓度和根据浓度的大豆分离蛋白的水解率的结果如下述表5所示。
表5
浓度基准:分离大豆蛋白溶液基准,w/w%
使用酶:蛋白酶(产品名:碱性蛋白酶2.4lfg,制造商:丹麦诺维信a/s)
在相同的酶浓度下,大豆分离蛋白的水解率具有随着大豆分离蛋白的浓度增加而减少,随着浓度的增加而增加的倾向。
测定根据脱脂奶粉及大豆分离蛋白的浓度的水解率的结果如下述表6所示。
表6
浓度基准:脱脂奶粉和大豆分离蛋白混合溶液基准,w/w%
使用酶:使用0.015%的蛋白酶(产品名:碱性蛋白酶2.4lfg,制造商:丹麦诺维信a/s)
在相同的酶浓度下,水解率具有随着脱脂奶粉及大豆分离蛋白的混合物的浓度增加而减少的倾向。在相同酶浓度下,与单独使用大豆分离蛋白时相比水解率更高。
实施例2:根据蛋白质的水解率的培养性测定
2-1:根据脱脂奶粉各浓度的水解率的培养性实验
向在实施例1中制备的蛋白质水解水溶液溶解30kg的混合乳糖、6kg的大豆蛋白胨、12kg酵母提取物、1.2kg二磷酸钾、120g的硫酸镁、600g的l-抗坏血酸、240gl-谷氨酸、600g聚山梨酯-80,并将最终液体量为1200l,利用热交换器(瑞典阿法拉伐(alfalaval))在130℃的温度、1850l/h的流量的条件下杀菌,并转移到1.2kl容量的厌氧发酵管,接种5l的嗜热链球菌cbtst3种菌后,利用氨保持ph6.0并发酵13小时。发酵后,测定根据脱脂奶粉及蛋白分解酶各浓度的水解率的乳酸菌的培养性。乳酸菌培养性测定通过取1ml的培养液加入9ml的稀释水中来实施涡旋(vortexing)后,通过十进制稀释法分析活菌数量。测定结果如下述表7所示。
表7
实验结果,如表7所示,当使用2%以上脱脂奶粉、0.003%以上蛋白分解酶时,可确保优秀的培养性。在将脱脂奶粉浓度继续增加规定水平之后,具有随着未酶分解的比率增加培养性反而下降的倾向。从图1的显微镜照片中也可以看出,推断这些结果是由于未分解的非共价键的疏水性的半水溶性肽量而培养液的疏水性变高,且乳酸菌聚集导致菌分裂不顺利。
2-2:根据大豆分离蛋白各浓度的水解率的培养实验
与脱脂奶粉相同,向在实施例中确保的水解溶解液溶解24kg的葡萄糖、6kg的大豆蛋白胨、18kg的酵母提取物、1.2kg的醋酸钠、1.2kg的柠檬酸钾、120g的硫酸镁、1.8kg的l-半胱氨酸盐酸盐、600g的l-抗坏血酸、1.2kg的聚山梨酯-80,并将最终液体量为1200l,利用热交换器(瑞典阿法拉伐)在130℃的温度、1850l/h的流量的条件下杀菌,并转移到1.2kl容量的厌氧发酵管,接种5l的短双歧杆菌cbtbr3种菌后,利用氨保持ph6.5并发酵14小时。发酵后,测定根据大豆分离蛋白及蛋白分解酶各浓度的水解率的乳酸菌的培养性。
乳酸菌的培养性测定通过取1ml的培养液加入9ml的稀释水中来实施涡旋后,通过十进制稀释法分析活菌数量。测定结果如下述表8所示。
表8
实验结果,如表8所示,使用0.45%以上的大豆分离蛋白、0.015%以上的蛋白质分解酶时可确保优秀的培养性。在将大豆分离蛋白浓度继续增加规定水平之后,具有随着未酶分解的比率增加培养性反而下降的倾向。从图2的显微镜照片中也可以看出,推断这些结果是由于未分解的半水溶性肽(peptide)量增加而培养液的疏水性变高,乳酸菌聚集导致菌分裂不顺利。
2-3:根据脱脂奶粉和大豆分离蛋白各混合浓度的水解率的培养性实验
相在实施例1中确保的脱脂奶粉及大豆分离蛋白的混合物的水解溶解液溶解36kg的结晶果糖、36kg的酵母提取物、2.4kg的二磷酸钾、6kg的醋酸钠、1.2kg的硫酸镁、6g的硫酸锰、1.2kg的l-半胱氨酸盐酸盐、1.2kg的l-抗坏血酸、2.4kg的聚山梨酯-807.2kg的精制盐,并将最终液体量为1200l,利用热交换器(瑞典阿法拉伐)在130℃的温度、1850l/h的流量的条件下杀菌,并转移到1.2kl容量的厌氧发酵管,接种5l的嗜酸乳杆菌cbtla1种菌后,利用氨保持ph6.5并发酵20小时。发酵后,确认根据按脱脂奶粉、大豆分离蛋白浓度的水解率的乳酸菌的培养性。乳酸菌的培养性测定通过取1ml的培养液加入9ml的稀释水中来实施涡旋后,通过十进制稀释法分析活菌数量。测定结果如下述表9所示。
表9
实验结果,如表9所示,混合使用1.5%以上的脱脂奶粉、0.3%水平以上的大豆分离蛋白时可确保优秀的培养性。继续增加混合浓度使其达到规定水平之后,具有培养性反而减少的倾向。从图2的显微镜照片中也可以看出,推断这些结果是由于未分解的半水溶性肽量增加而培养液的疏水性变高,乳酸菌聚集导致菌分裂不顺利。
实施例3:根据蛋白质的水解率的冷冻干燥存活率测定
3-1:根据按脱脂奶粉浓度的水解率的存活率实验
以4.0l/min的流速利用管式高速离心分离机(rpm15000以上,g-force13,200以上)沉淀菌体和残留蛋白质成分并通过涂敷来回收在实施例2-1中确保的发酵液。通过加压杀菌来制备由3kg的海藻糖、1kg的麦芽糊精、1kg的甘露醇、1kg的脱脂奶粉组成的10l的冷冻保护剂水溶液,并通过加压杀菌来制备溶解20g的黄原胶、20g的纤维素的10l的多糖类水溶液。然后,将回收的菌体和制备的上述冷冻保护剂水溶液及多糖类水溶液在安装有搅打器的立式混合器中以200rpm搅拌并均质化,在-40℃的预冷冻库中快速冷冻后,将冷冻干燥机隔板温度从0℃以2小时为单位逐步升高10℃,最后在37℃的温度条件下进行冷冻干燥。在基于蛋白分解酶的水解过程中,包括菌体在内的半水溶性残留蛋白成分形成蛋白质涂层,黄原胶、纤维素多糖类成分通过菌体之间的结合来形成具有非常致密的结构的菌块。此时,与特定量相比,具有半水溶性的肽量越高菌成团倾向,并且培养性下降,适当量的半水溶性肽保护菌体免受在冷冻干燥过程中施加的热量,从而具有优秀的冷冻存活率、加速稳定性、耐酸性、耐胆汁性。基于此的实验结果如下述表10所示。
表10
冷冻干燥存活率(%):通过考虑冷冻干燥前/后的活菌数量和重量来确定冷冻干燥工序后的存活率。
[冷冻干燥后每一克活菌数量×冷冻干燥后重量(g)]/[冷冻干燥前每一克活菌数量×冷冻干燥前重量(g)]×100%
如上述表10所示,在2%的脱脂奶粉、0.003%的蛋白分解酶水平下具有最优秀的冷冻干燥存活率(81.5%)。具有随着脱脂奶粉浓度增加水解率减少且冷冻干燥存活率下降的倾向。确认一定水平的未分解的半水溶性肽使由施加到细胞的物理因素引起的蛋白质变性并提高冷冻干燥存活率减少。确认培养性及冷冻干燥存活率的结果显示,处理2.0%的脱脂奶粉及0.003%的酶时培养性和冷冻干燥存活率均优秀。
3-2:根据按大豆分离蛋白浓度的水解率的冷冻干燥存活率实验
根据实施例3-1所述的实验方法,通过使用在实施例2-2中确保的发酵液来进行根据按大豆分离蛋白浓度的水解率的冷冻干燥存活率实验的结果,如下述表11所示。
表11
冷冻干燥存活率(%):通过考虑冷冻干燥前后的活菌数量和重量来确定冷冻干燥工序后的存活率。
[冷冻干燥后每一克活菌数量×冷冻干燥后重量(g)]/[冷冻干燥前每一克活菌数量×冷冻干燥前重量(g)]×100%
如上述表11所示,在0.45%的大豆分离蛋白及0.015%的蛋白分解酶水平下,可确保优秀的冷冻干燥存活率(85.2%)。具有随着大豆分离蛋白浓度增加水解率减少,冷冻干燥存活率下降的倾向。一定水平的未分解的半水溶性肽使由施加到细胞的物理因素引起的蛋白质变性,并提高冷冻干燥存活率。确认培养性及冷冻干燥存活率结果显示,处理0.45%的大豆分离蛋白及0.015%的酶时培养性和冷冻干燥存活率均优秀。
3-3:根据按脱脂奶粉及大豆分离蛋白浓度的水解率的冷冻干燥存活率实验
根据实施例3-1所述的实验方法,通过使用在上述实施例2-3中确保的发酵液来进行根据按脱脂奶粉及大豆分离蛋白的浓度的水解率的冷冻干燥存活率实验的结果,如下述表12所示。
表12
冷冻干燥存活率(%):通过考虑冷冻干燥前后的活菌数量和重量来确定冷冻干燥工序后的存活率。
[冷冻干燥后每一克活菌数量×冷冻干燥后重量(g)]/[冷冻干燥前每一克活菌数量×冷冻干燥前重量(g)]×100%
如上述表12所示,混合使用1.5%的脱脂奶粉、0.3%的大豆分离蛋白时可确保优秀的冷冻干燥存活率(83.1%)。具有随着混合浓度增加水解率减少,冷冻干燥存活率下降的倾向。一定水平的未分解的半水溶性肽使由施加到细胞的物理因素引起的蛋白质变性,并提高冷冻干燥存活率。确认培养性及冷冻干燥存活率结果显示,分别处理1.5%、0.3%的脱脂奶粉及大豆分离蛋白的混合物时培养性和冷冻干燥存活率均优秀。
实施例4:基于双重涂敷的加速稳定性、耐酸性、耐胆汁性实验
在不涂敷乳酸菌的情况、在仅涂敷蛋白质的情况、在双重涂敷的情况下,进行加速稳定性、耐酸性及耐胆汁性实验。其结果如下述表13所示。
表13
cmc-na:纤维素
xg:黄原胶
加速稳定性:通过取1ml的培养液加入9ml的稀释水中来实施涡旋后,通过十进制稀释法分析初始活菌数量。进一步地,在40℃的温度下培养试样后,以1周为单位分析活菌数量至4周为止,并确认相比于初始活菌数量的存活率。
耐酸性:向用1m的hcl溶液校准的ph2.1的9.9ml的mrs肉汤(mrsbroth)溶液溶解0.1g的各个试样后,将温度保持在37℃,并通过分析第零小时、第二小时的活菌来确认相比于第零小时的存活率。
耐胆汁性:向添加0.5%的牛胆汁(oxgall)的9.9ml的mrs肉汤溶液分别溶解0.1g的试样后,将温度保持在37℃,并通过分析第零小时、第二小时的活菌来确认相比于第零小时的存活率。
非涂敷、蛋白涂敷、双重涂敷比较分析结果,双重涂敷的乳酸菌相比于非涂敷、单一(蛋白质)涂敷乳酸菌可确保优秀的加速稳定性、耐酸性、耐胆汁性。由施加到细胞的物理因素引起的凋亡率低,可能不会失去乳酸菌生理活性功能,因此提高加速稳定性、耐酸性、耐胆汁性。
以上,详述了本发明的特定部分,对于本领域普通技术人员而言,这些具体描述仅为优选的实例,显然本发明的范围并不限定于此。因此,本发明的实质范围旨在由所附权利要求及其等同物限定。
- 还没有人留言评论。精彩留言会获得点赞!