一种穿心莲内酯衍生物及其工业色谱制备方法和应用与流程
1.本发明涉及一种穿心莲内酯衍生物10-(r)-17-氢-7-去氢穿心莲内酯及其制备方法和应用。
背景技术:
2.穿心莲内酯是从爵床科植物穿心莲[andrographis paniculata(burm.f.)nees]全草中提取的半日花烷型二萜类化合物,具有抗菌消炎,解毒等功效,是一种重要的活性天然产物。穿心莲内酯及其衍生物已经被制成多种剂型(片剂、滴丸、胶囊等)广泛应用于临床,如喜炎平注射液、莲必治注射液、炎琥宁注射液、穿心莲内酯片等在临床均表现出良好的清热解毒、抗菌消炎功效。luvone等认为,一氧化氮(no)与急慢性炎症的发生均相关[luvone t,carnuccio r,di rm.modulation of granuloma formation endogenous nitric oxide[j].eur j pharmacol,1994,265(1/2):89-92.]。穿心莲内酯能够明显下调脂多糖诱导的小鼠巨噬细胞raw264.7中炎症因子no、肿瘤坏死因子-α(tnf-α)、白细胞介素(il)-6的表达,从而抑制炎症反应。
[0003]
目前临床上广泛使用的喜炎平注射液的有效成分为穿心莲内酯总磺化物,为穿心莲内酯的衍生物,具有清热解毒、抗菌消炎等功能,但是喜炎平的活性成分为穿心莲内酯的磺化产物,并非单一结构,因此采用单一结构的小分子化合物以进一步明确机理,对其药效及其毒理学研究具有重要意义;尽管穿心莲内酯类化合物已取得一些研究成果,但是对于多种疾病,尤其抗炎领域仍然没有新的特别有效的穿心莲内酯衍生物或类似物用于临床。因此,开发新的具有抗炎活性的穿心莲内酯单体药物具有重要的社会意义。
技术实现要素:
[0004]
本发明提供了新的具有抗炎活性的穿心莲内酯衍生物10-(r)-17-氢-7-去氢穿心莲内酯(式i)及其制备方法和用于制备炎症疾病药物方面的应用。
[0005]
本发明第一方面,提供10-(r)-17-氢-7-去氢穿心莲内酯式(ι)化合物,
[0006][0007]
本发明第二方面,提供10-(r)-17-氢-7-去氢穿心莲内酯式(ι)化合物的制备方法,包括以下步骤:
[0008]
(1)取穿心莲内酯总磺化物溶解于水,上样于大孔吸附树脂柱,采用有机溶剂和水
混合溶剂进行洗脱,合并含有10-(r)-17-氢-7-去氢穿心莲内酯的洗脱液,浓缩,得粗品1;
[0009]
(2)将粗品1用混合有机溶剂(a/b)溶解,上样于硅胶柱,用混合有机溶剂(a/b)进行洗脱,合并含有10-(r)-17-氢-7-去氢穿心莲内酯的洗脱液,浓缩,得粗品2;
[0010]
(3)将粗品2用有机溶剂和水混合溶剂溶解,上样于hplc制备柱,用有机溶剂和水混合溶剂进行梯度洗脱,用紫外在线检测器检测分离情况,根据出峰时间及色谱峰高度,确定洗脱液收集起止时间,合并含有10-(r)-17-氢-7-去氢穿心莲内酯的洗脱液,浓缩。
[0011]
优选的,所述步骤(1)中,大孔吸附树脂为苯乙烯型大孔吸附树脂;
[0012]
更优选的,苯乙烯型大孔吸附树脂型号为hpd-100s、d101s或lx-1180。
[0013]
优选的,所述步骤(1)中,有机溶剂为醇类,如甲醇或乙醇。
[0014]
优选的,有机溶剂和水的混合溶剂0%~70%(v/v)甲醇-水溶液(优选20-60%(v/v)甲醇-水溶液)或0%~70%(v/v)乙醇-水溶液(优选20-60%(v/v)乙醇-水溶液)。
[0015]
优选的,所述步骤(1)中,洗脱的方式为梯度洗脱,如依次用体积比20%、40%、60%乙醇-水溶液,或,依次用体积比20%、35%、45%、60%乙醇-水溶液进行洗脱,或,依次用体积比20%、35%、50%、60%甲醇-水溶液进行洗脱。
[0016]
优选的,所述步骤(1)中,浓缩为减压浓缩。
[0017]
优选的,所述步骤(1)中,浓缩温度为40~50℃。
[0018]
优选的,所述步骤(2)中,混合有机溶剂(a/b)中,a为石油醚或环己烷中的一种或多种,b为乙酸乙酯、二氯甲烷、氯仿或丙酮中的一种或多种;
[0019]
更优选的,混合有机溶剂(a/b)优选石油醚/丙酮溶液;
[0020]
进一步优选的,溶解时采用的混合有机溶剂(a/b)为5:1~4:1(v/v)石油醚/丙酮溶液;洗脱时采用的混合有机溶剂(a/b)为5:1~1:1(v/v)(优选4:1~1:1(v/v))石油醚/丙酮溶液。
[0021]
优选的,所述步骤(2)中,洗脱的方式为梯度洗脱,如依次用4:1、3:1、2:1、1:1(v/v)石油醚丙酮溶液洗脱。
[0022]
优选的,所述步骤(2)中,浓缩优选减压浓缩。
[0023]
优选的,所述步骤(2)中,浓缩温度优选为40~50℃。
[0024]
优选的,所述步骤(3)中,hplc制备柱填料为反相c
18
填料,更优选为xaqua、ods-a或ods-aq。
[0025]
优选的,所述步骤(3)中,紫外在线检测器的检测波长为200~300nm。
[0026]
优选的,所述步骤(3)中,有机溶剂为甲醇或乙腈;
[0027]
更优选的,溶解时采用的有机溶剂和水的混合溶剂为5~15%(v/v)甲醇水溶液或5~15%(v/v)乙腈水溶液;洗脱时采用的有机溶剂和水的混合溶剂为20%~60%(v/v)甲醇水溶液或20%~60%(v/v)乙腈水溶液。
[0028]
优选的,所述步骤(3)中,浓缩为减压浓缩。
[0029]
优选的,所述步骤(3)中,浓缩温度为40~50℃。
[0030]
本发明第三方面,提供一种以10-(r)-17-氢-7-去氢穿心莲内酯作为药物活性成分的药物制剂,该制剂类型包括但不限于注射剂、片剂、胶囊或分散片。
[0031]
本发明第四方面,提供上述的10-(r)-17-氢-7-去氢穿心莲内酯或上述的药物制剂在制备治疗炎症疾病药物中的应用;所述炎症疾病优选肺炎;所述肺炎优选新型冠状病
毒肺炎;所述新型冠状病毒肺炎优选covid-19。
[0032]
本发明的有益技术效果
[0033]
1.提供一种全新的手性的10-(r)-17-氢-7-去氢穿心莲内酯式(ι)化合物,经验证具有较好的治疗炎症疾病的效果;进一步的,可用于治疗肺炎,如新型冠状病毒肺炎(covid-19)。
[0034]
2.本发明所述的10-(r)-17-氢-7-去氢穿心莲内酯制备方法,操作方便,收率高,可采用工业色谱技术大量制备高纯度该化合物,用于工业规模化生产。
附图说明
[0035]
图1:实施例2的10-(r)-17-氢-7-去氢穿心莲内酯核磁共振氢谱图;
[0036]
图2:实施例2的10-(r)-17-氢-7-去氢穿心莲内酯核磁共振碳谱图;
[0037]
图3:实施例2的10-(r)-17-氢-7-去氢穿心莲内酯核hplc检测图;
[0038]
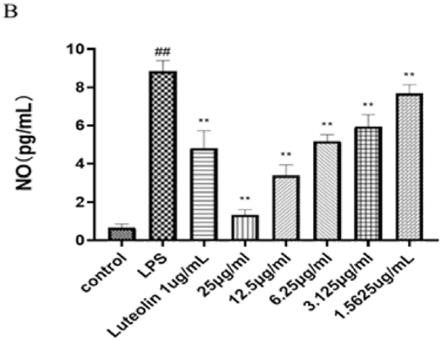
图4:实施例2的10-(r)-17-氢-7-去氢穿心莲内酯抗炎活性测试。
具体实施方式
[0039]
在如下的实施例中所指的10-(r)-17-氢-7-去氢穿心莲内酯的化学结构式(结构中的阿拉伯数字是化学结构中碳原子的标位):
[0040][0041]
实施例1:穿心莲内酯总磺化物的制备
[0042]
取无水乙醇50l,置反应釜中,缓慢加入20l浓硫酸,搅拌均匀后,加入50.00kg穿心莲内酯,搅拌,常温放置72小时。控制温度加入50l 95%乙醇,搅拌,加入50%氢氧化钠溶液调ph至7.0,加入乙醇至含醇量85%,静置24小时,过滤,滤液回收乙醇,浓缩成稠膏,真空干燥即得穿心莲内酯总磺化物。
[0043]
实施例2:10-(r)-17-氢-7-去氢穿心莲内酯的制备
[0044]
取穿心莲内酯总磺化物200.01g,加适量纯化水溶解后上样于d101s大孔吸附树脂柱,依次用体积比20%、40%、60%乙醇-水溶液进行洗脱,合并含有10-(r)-17-氢-7-去氢穿心莲内酯的洗脱流份,50℃减压浓缩干,得粗品1;
[0045]
粗品1用适量5:1(v/v)石油醚/丙酮溶解后上样硅胶柱,依次用4:1、3:1、2:1、1:1(v/v)石油醚/丙酮溶液洗脱,收集洗脱液,合并含有10-(r)-17-氢-7-去氢穿心莲内酯的洗脱流份,50℃减压浓缩干,得粗品2;
[0046]
粗品2用适量15%甲醇-水溶液溶解后进行hplc制备(ods-a,10μm填料),用体积比20%、35%、45%、60%甲醇-水溶液进行梯度洗脱,根据225nm波长检测条件下吸收峰高、峰型接收流份,50℃减压浓缩干,得10-(r)-17-氢-7-去氢穿心莲内酯3.21g,纯度95.05%。
[0047]
经nmr、esi ms等现代光谱技术鉴定了化合物10-(r)-17-氢-7-去氢穿心莲内酯的化学结构,并通过ecd计算确定了该化合物绝对构型,其理化性质如下:
[0048]
白色粉末,分子式为:c
20
h
30
o5;
[0049]
高分辨质谱hresims m/z373.1995[m+na]
+
(cald.for.c
20
h
30
o5na,373.1991)。
[0050]
核磁共振氢谱1h-nmr(400mh
z
)及核磁共振碳谱
13
c-nmr(100mh
z
),见图1和图2,数据见表1。核hplc检测图如图3所示。
[0051]
表1 10-(r)-17-氢-7-去氢穿心莲内酯的氢谱和碳谱数据(400/100mhz,dmso)
[0052][0053]
实施例3:10-(r)-17-氢-7-去氢穿心莲内酯的制备
[0054]
取穿心莲内酯总磺化物199.97g,加适量纯化水溶解后上样于hpd100s大孔吸附树
脂柱,依次用体积比20%、35%、50%、60%甲醇-水溶液进行洗脱,合并含有10-(r)-17-氢-7-去氢穿心莲内酯的洗脱流份,40℃减压浓缩干,得粗品1;
[0055]
粗品1用适量4:1(v/v)石油醚/丙酮溶液溶解后上样硅胶柱,依次用4:1、3:1、2:1、1:1(v/v)石油醚/丙酮溶液洗脱,收集洗脱液,合并含有10-(r)-17-氢-7-去氢穿心莲内酯的洗脱流份,40℃减压浓缩干,得粗品2;
[0056]
粗品2用适量5%甲醇-水溶液溶解后进行hplc制备(ods-aq,10μm填料),用体积比20%、40%、50%、60%甲醇-水溶液进行梯度洗脱,根据225nm波长检测条件下吸收峰高、峰型接收流份,40℃减压浓缩干,得10-(r)-17-氢-7-去氢穿心莲内酯3.27g,纯度94.87%。
[0057]
实施例4:10-(r)-17-氢-7-去氢穿心莲内酯的制备
[0058]
取穿心莲内酯总磺化物200.15g,加适量纯化水溶解后上样于lx-1180大孔吸附树脂柱,依次用体积比20%、35%、45%、60%乙醇-水溶液进行洗脱,合并含有10-(r)-17-氢-7-去氢穿心莲内酯的洗脱流份,50℃减压浓缩干,得粗品1;
[0059]
粗品1用适量5:1(v/v)石油醚-丙酮溶解后上样硅胶柱,依次用4:1、3:1、2:1、1:1(v/v)石油醚/丙酮溶液洗脱,收集洗脱液,合并含有10-(r)-17-氢-7-去氢穿心莲内酯的洗脱流份,40℃减压浓缩干,得粗品2;
[0060]
粗品2用适量5%乙腈-水溶液溶解后进行hplc制备(ods-a,10μm填料),用体积比20%、35%、45%、60%乙腈-水溶液进行梯度洗脱,根据225nm波长检测条件下吸收峰高、峰型接收流份,50℃减压浓缩干,得10-(r)-17-氢-7-去氢穿心莲内酯3.08g,纯度94.93%。
[0061]
实施例5:10-(r)-17-氢-7-去氢穿心莲内酯的制备
[0062]
取穿心莲内酯总磺化物199.25g,加适量纯化水溶解后上样于lx-1180大孔吸附树脂柱,依次用体积比20%、35%、45%、60%乙醇-水溶液进行洗脱,合并含有10-(r)-17-氢-7-去氢穿心莲内酯的洗脱流份,40℃减压浓缩干,得粗品1;
[0063]
粗品1用适量4:1(v/v)石油醚/丙酮溶液溶解后上样硅胶柱,依次用4:1、3:1、2:1、1:1(v/v)石油醚/丙酮溶液洗脱,收集洗脱液,合并含有10-(r)-17-氢-7-去氢穿心莲内酯的洗脱流份,50℃减压浓缩干,得粗品2;
[0064]
粗品2用适量15%乙腈-水溶液溶解后进行hplc制备(xaqua,10μm填料),用体积比20%、30%、40%、60%乙腈-水溶液进行梯度洗脱,根据225nm波长检测条件下吸收峰高、峰型接收流份,40℃减压浓缩干,得10-(r)-17-氢-7-去氢穿心莲内酯3.15g,纯度95.01%。
[0065]
实施例6:10-(r)-17-氢-7-去氢穿心莲内酯的制备
[0066]
取穿心莲内酯总磺化物20.08kg,加适量纯化水溶解后上样于d101s大孔吸附树脂柱,依次用体积比20%、40%、60%乙醇-水溶液进行洗脱,合并含有10-(r)-17-氢-7-去氢穿心莲内酯的洗脱流份,50℃减压浓缩干,得粗品1;
[0067]
粗品1用适量5:1(v/v)石油醚/丙酮溶解后上样工业色谱系统纯化(dac-hb300动态轴向压缩柱,硅胶填料),依次用4:1、3:1、2:1、1:1(v/v)石油醚/丙酮溶液洗脱,收集洗脱液,合并含有10-(r)-17-氢-7-去氢穿心莲内酯的洗脱流份,40℃减压浓缩干,得粗品2;
[0068]
粗品2用适量15%甲醇-水溶液溶解后工业色谱hplc制备(dac-hb150动态轴向压缩柱ods-a,10μm填料),用体积比20%、40%、50%、60%甲醇-水溶液进行梯度洗脱,根据225nm波长检测条件下吸收峰高、峰型接收流份,40℃减压浓缩干,得10-(r)-17-氢-7-去氢穿心莲内酯335.19g,纯度95.13%。
[0069]
实施例7:10-(r)-17-氢-7-去氢穿心莲内酯抗炎活性试验
[0070]
将单体化合物(10-(r)-17-氢-7-去氢穿心莲内酯)作用于脂多糖(lps)诱导的raw264.7小鼠巨噬细胞,用griess试剂显色法检测培养上清液中no水平,以受试药物抑制no释放的能力作为筛选指标,评价化合物的抗炎活性。
[0071]
1.药物溶液的配制
[0072]
将单体化合物用dmso溶解配制成1.564、3.125、6.250、12.50、25.00μg/ml溶液。
[0073]
2.试验方法
[0074]
(1)单个小鼠巨噬细胞悬液用含10%的胎牛血清培养液配制而成,取对数期的小鼠巨噬细胞raw264.7接种到96孔板中,每孔105细胞数,设置3个复孔。
[0075]
(2)经过24小时培养,每孔加入不同浓度的受试药物同时加入1ug/ml lps。
[0076]
(3)37℃培养24小时后,每孔加griess溶液100ul继续培养5分钟,停止培养。
[0077]
(4)用酶联免疫检测仪测定570m波长处的光密度(od)值,并计算no抑制率。
[0078]
3.实验结果
[0079]
单体化合物(10-(r)-17-氢-7-去氢穿心莲内酯)对raw264.7细胞中的no抑制作用ic50为6.237μg/ml。结果如图4所示。
[0080]
结果表明化合物对脂多糖(lps)诱导的小鼠巨噬细胞raw264.7 no的生成有显著抑制作用,表明本发明所述化合物具有明显的抗炎活性,因此可以用于制备新的抗炎活性药物。进一步的,单体化合物(10-(r)-17-氢-7-去氢穿心莲内酯)还可用于治疗新型冠状病毒肺炎(如covid-19)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1