一种人肝微粒体与细胞共培养体系及其构建方法和应用与流程
1.本发明属于细胞共培养技术领域,具体涉及一种人肝微粒体与细胞共培养体系及其构建方法和应用。
背景技术:
2.肝微粒体是从肝细胞内质网碎片中得到的小型囊泡,直径约为0.1μm,具有完整的i相代谢酶(如细胞色素p450、黄素单加氧酶、单胺氧化酶等),ii相代谢酶(如葡萄糖醛酸转移酶,硫酸基转移酶)、酯酶等,这些酶参与人体内药物代谢情况,是fda指定预测人体内代谢及抑制试验的研究工具。
3.在进行与细胞共同参与的代谢活化试验时,通常将无菌鼠肝微粒体+代谢活化体系与外源物质加入培养基中共同作用细胞。而由于种属差异的存在,鼠肝微粒体中代谢酶并不能完全符合实验的需要,如研究报道鼠肝微粒体中cyp2a6酶低表达或者不表达。cyp2a6酶是cyp450酶系亚家族cyp2a中的重要一员,负责烟碱、咖啡因等药物的代谢。因此,在做烟碱及咖啡因等药物代谢相关研究时,通常需选择供体来源丰富的人源肝微粒体如25供体人肝微粒进行代谢活化实验研究,而由于人的肝源很难保证无菌,在制备人源肝微粒体时,几乎无法获得无菌的肝微粒,因此,将有菌的人肝微粒体用于无菌的细胞实验需保证人肝微粒体中的污染源无法对细胞的无菌环境造成影响,以维持细胞正常生长的无菌状态。目前,将人肝微粒体用于无菌的细胞实验鲜有报道。
技术实现要素:
4.本发明的第一个目的在于提供一种人肝微粒体与细胞共培养体系的构建方法,抑制了人肝微粒体的有菌污染源,使人肝微粒体在无菌体系不影响细胞生长。
5.本发明的第二个目的在于提供上述构建方法的应用。
6.本发明的第三个目的在于提供一种人肝微粒体与细胞共培养体系。
7.为了实现上述目的,本发明采用以下技术方案:
8.一种人肝微粒体与细胞共培养体系的构建方法,包括以下步骤:
9.1)以二甲胺四环素盐酸盐、青霉素、链霉素、nadph再生系统、人肝微粒体和基础培养基配制孵育代谢培养基溶液;所述孵育代谢培养基溶液中,二甲胺四环素盐酸盐的终浓度为2~3μg/ml,青霉素的终浓度为80~120u/ml,链霉素的终浓度为80~120μg/ml;最优为:所述二甲胺四环素盐酸盐的终浓度为2.5μg/ml,所述青霉素的终浓度为100u/ml,所述链霉素的终浓度为100μg/ml。
10.2)使用孵育代谢培养基溶液培养细胞,实现人肝微粒体与细胞的共培养。
11.人的肝源很难保证无菌,在制备人源肝微粒体时,几乎无法获得无菌的肝微粒。为了将人源肝微粒体与细胞共培养进行体外代谢试验研究,本发明提供了一种能够将有菌的人肝微粒体与无菌细胞直接接触的共培养方法,成功构建了人肝微粒体与细胞共培养体系。试验证明,本发明的构建方法能够保证人肝微粒体中的污染源无法对细胞的无菌环境
造成影响,维持细胞正常生长的无菌状态。
12.该方法因为使肝微粒体在无菌体系不影响细胞生长,即抑制了肝微粒体的有菌污染源,适用于beas
‑
2b等常用细胞。基础培养基为共培养细胞常用培养基。
13.一般而言,步骤1)中,人肝微粒体的终浓度为1mg/ml,nadph再生系统的体积百分浓度为6%。
14.作为一种示例形式,步骤2)中,细胞为beas
‑
2b细胞,步骤1)中所述基础培养基为begm bulletkit,或者含终体积5
‑
10%fbs、终浓度80~120u/ml青霉素和终浓度80~120μg/ml链霉素的dmem培养基溶液。其中begm bulletkit(lonza,cc
‑
3171&cc
‑
4175),fbs(gbico,北美优级),dmem培养基(gbico,11965092)。采用上述方式,能够将有菌的人肝微粒体与beas
‑
2b无菌细胞进行直接接触的共培养,成功构建了人肝微粒体与beas
‑
2b细胞共培养体系。
15.进一步优选的,步骤2)中,使用孵育代谢培养基溶液培养细胞包括将指数生长期的beas
‑
2b细胞的原培养基移除,然后加入孵育代谢培养基溶液进行共培养。nadph再生系统(汇智泰康)由a液和b液按照5:1的比例混合配制。
16.上述构建方法在药物体外代谢方面的应用,向共培养体系中加入受试外源物质,代谢后,检测受试外源物质的浓度和/或细胞的存活率。
17.利用上述方式可进行受试外源物质(如烟碱、卷烟烟气)的体外代谢研究,为人源肝微粒体与细胞共同作用的体外代谢研究奠定了基础。
18.作为一种示例性的说明,所述受试外源物质为烟碱或烟气。
19.一种人肝微粒体与细胞共培养体系,所述共培养体系包括基础培养基、二甲胺四环素盐酸盐、青霉素、链霉素、nadph再生系统、人肝微粒体及细胞;其中,二甲胺四环素盐酸盐的终浓度为2~3μg/ml,青霉素的终浓度为80~120u/ml,链霉素的终浓度为80~120μg/ml。
20.该共培养体系能够实现有菌的人肝微粒体与无菌细胞直接接触的共培养。
21.优选的,细胞为beas
‑
2b细胞,基础培养基为begm bulletkit,或者含终体积5
‑
10%fbs、终浓度80~120u/ml青霉素和终浓度80~120μg/ml链霉素的dmem培养基溶液。
22.优选的,所述共培养体系还包括受试外源物质。
23.优选的,所述受试外源物质为烟碱或烟气。该共培养体系适用于外源物质(如烟碱、卷烟烟气)体外代谢研究,为人源肝微粒体与细胞共同作用的体外代谢研究奠定了基础。
附图说明
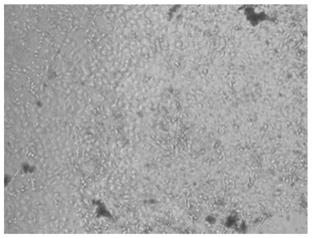
24.图1为试验例1培养基组的细胞形态;
25.图2为试验例1对照代谢培养基组的细胞形态;
26.图3为试验例1孵育代谢培养基组的细胞形态;
27.图4为不同抗生素的对比实验图。
具体实施方式
28.下面结合具体实施方式对本发明作进一步描述,但本发明的保护范围并不仅限于
此;实施例及试验例中所用的各类培养基、试剂、细胞系试剂等均为市售商品。25供体人肝微粒体购自汇智泰康生物技术有限公司。
29.实施例1人肝微粒体与beas
‑
2b细胞共培养体系的构建方法
30.该实施例提供了一种人肝微粒体与细胞共培养体系的构建方法,包括以下步骤:
31.(1)配制250μg/ml的二甲胺四环素盐酸盐水溶液。用无菌水溶市售二甲胺四环素盐酸盐,配制成250μg/ml的二甲胺四环素盐酸盐水溶液,装于无菌离心管中。
32.配制10ku/ml的青霉素水溶液。用无菌水溶市售青霉素,配制成10ku/ml的青霉素水溶液,装于无菌离心管中。
33.配制10mg/ml的链霉素水溶液。用无菌水溶市售链霉素,配制成10mg/ml的青霉素水溶液,装于无菌离心管中。
34.配制nadph再生系统a+b混合液。将市售nadph再生系统(汇智泰康)a液和b液按照5:1的比例混合,装于无菌离心管中。
35.0.22μm孔径的无菌滤器过滤除菌。将装有250μg/ml的二甲胺四环素盐酸盐水溶液、10ku/ml的青霉素水溶液、10mg/ml的链霉素水溶液和nadph再生系统a+b混合液的无菌离心管置于超净台,利用无菌注射器分别移取上述溶液至无菌注射器中,并于注射器针头端置换成0.22μm孔径的无菌滤器,按压无菌注射器活塞,将注射器中溶液经无菌滤器过滤至无菌离心管待用。
36.人肝微粒体与
‑
80℃冰箱取出解冻置于4℃环境中待用。
37.(2)配制含有人肝微粒体的孵育代谢培养基溶液:孵育代谢培养基溶液由begm bulletkit(lonza,cc
‑
3171&cc
‑
4175)和二甲胺四环素盐酸盐、青霉素、链霉素、nadph再生系统a+b混合液及人肝微粒体组成,其中,二甲胺四环素盐酸盐的终浓度为2.5μg/ml,青霉素的终浓度为100u/ml,链霉素的终浓度为100μg/ml,nadph再生系统a+b混合液的体积百分浓度为6%,人肝微粒体的终浓度为1mg/ml。
38.在其他实施情形下,也可使用含终体积5
‑
10%fbs、终浓度80~120u/ml青霉素和终浓度80~120μg/ml链霉素的dmem培养基溶液进行替换,优选的,fbs终体积为10%,青霉素终浓度为100u/ml,链霉素终浓度为100μg/ml。
39.(3)从培养箱中取出接种好的beas
‑
2b细胞培养板于超净台中,移除培养基并加入孵育代谢培养基溶液后,置于培养箱中孵育或培养。
40.实施例2外源物质体外代谢方面的应用
41.该实施例提供了人肝微粒体与细胞共培养体系的构建方法在受试外源物质体外代谢方面的应用,包括以下步骤:
42.步骤1)参见实施例1;
43.2)在含有人肝微粒体的孵育代谢培养基溶液中加入受试外源物质,所述孵育代谢培养基溶液由受试外源物质和基础培养基、二甲胺四环素盐酸盐、青霉素、链霉素、nadph再生系统a+b混合液、人肝微粒体组成,其中,受试外源物质为烟碱,烟碱的终浓度为8μg/ml,二甲胺四环素盐酸盐的终浓度为2.5μg/ml,青霉素的终浓度为100u/ml,链霉素的终浓度为100μg/ml,nadph再生系统a+b混合液的体积百分浓度为6%,人肝微粒体的终浓度为1mg/ml;
44.3)从培养箱中取出接接种好的beas
‑
2b细胞培养板于超净台中,移除培养上清液
并加入孵育代谢培养基溶液后,置于培养箱中培养;
45.4)检测共培养结束后培养板细胞上清液中烟碱的浓度。
46.在其他实施例中,步骤2)中受试外源物质为烟草制品烟气总粒相物(total particulate matter,tpm),终浓度为50μg/ml;步骤4)中检测共培养结束后beas
‑
2b细胞的存活率。
47.实施例3人肝微粒体与细胞共培养体系
48.该实施例提供一种人肝微粒体与细胞共培养体系,由基础培养基、二甲胺四环素盐酸盐、青霉素、链霉素、nadph再生系统a+b混合液、人肝微粒体及beas
‑
2b细胞组成,其中,二甲胺四环素盐酸盐的终浓度为2.5μg/ml,青霉素的终浓度为100u/ml,链霉素的终浓度为100μg/ml,nadph再生系统a+b混合液的体积百分浓度为6%,人肝微粒体的终浓度为1mg/ml。
49.在其他实施例中,共培养体系还包括受试外源物质;受试外源物质为烟碱,烟碱的终浓度为8μg/ml;在另一实施例中,受试外源物质为烟草制品烟气总粒相物,终浓度为50μg/ml。
50.对比例1人肝微粒体与细胞共培养体系的构建方法
51.对比例的人肝微粒体与细胞共培养体系的构建方法,与实施例1的区别仅在于:孵育代谢培养基溶液不含二甲胺四环素盐酸盐、青霉素和链霉素。
52.试验例1人肝微粒体与细胞共培养体系的构建
53.分别采用本发明实施例1与对比例1提供的方法构建beas
‑
2b细胞与25供体人肝微粒体共培养体系。具体的,按照表1配制孵育代谢培养基溶液(参见实施例1)以及对照代谢培养基溶液(参见对比例1)。将接种24h后的细胞培养板从培养皿中取出,移除培养上清液,分别加入孵育代谢培养基溶液、对照代谢培养基溶液和培养基后,置于培养箱中培养48h后显微镜下观察细胞形态。
54.表1代谢培养基溶液配制
55.项目孵育代谢培养基溶液(μl)对照代谢培养基溶液(μl)250μg/ml二甲胺四环素盐酸盐水溶液10010ku/ml青霉素水溶液10010mg/ml链霉素水溶液100nadph再生系统a+b混合液606020mg/ml 25供体人肝微粒体5050培养基860890总体积10001000
56.结果如图1
‑
3所示,培养基组细胞生长状态良好(图1),提示未做任何处理的细胞生长状态良好;对照代谢培养基组未观察到完整形态细胞(图2),由于nadph再生系统a+b混合溶液时无菌过滤处理,提示加入的肝微粒体入引起了细胞污染;孵育代谢培养基组细胞良好(图3),提示孵育代谢培养基溶液配方能够抑制肝微粒体引起的细胞污染,使细胞良好生长。
57.试验例2烟碱体外代谢试验
58.采用本发明实施例1
‑
2的方法构建beas
‑
2b细胞与25供体人肝微粒体共培养体系,
并将该体系应用于烟碱体外代谢的研究。
59.表2代谢培养基溶液配制
60.项目孵育代谢培养基溶液(μl)对照代谢培养基溶液(μl)250μg/ml二甲胺四环素盐酸盐水溶液202010ku/ml青霉素水溶液202010mg/ml链霉素水溶液2020nadph再生系统a+b混合液12012020mg/ml 25供体人肝微粒体100100(灭活*)800μg/ml烟碱溶液2020培养基17001700总体积20002000
61.注:*灭活条件:100℃高温煮沸5min
62.具体的,按照表2配制孵育代谢培养基溶液以及对照代谢培养基溶液(现用现配)。配好后,及时分别取孵育代谢培养基溶液和对照代谢培养基溶液500μl,加入等体积500μl含内标(烟碱和可替宁)的乙腈溶液终止反应,记为孵育前孵育代谢培养基组和孵育前对照代谢培养基组。
63.将接种24h后的细胞培养板从培养皿中取出,移除培养上清液,分别立即加入孵育代谢培养基溶液和对照代谢培养基溶液1ml后,置于培养箱中培养3h后分别取出培养板细胞上清液500μl,加入等体积500μl含内标(烟碱和可替宁)的乙腈溶液终止反应,记为孵育后孵育代谢培养基组和孵育后对照代谢培养基组。将四组液体混匀后离心(13000r/min,20min),取上清过滤后于hplc
‑
ms/ms分析,测定烟碱和可替宁浓度。
64.表3孵育后烟碱和可替宁浓度(μg/ml)
65.项目孵育代谢培养基组(μg/ml)对照代谢培养基组(μg/ml)孵育前烟碱8.08.0孵育前可替宁00孵育后烟碱5.37.9孵育后可替宁1.10
66.试验结果表3所示,孵育代谢培养基组培养基组在孵育3h后,烟碱浓度发生变化且有可替宁的生成;对照代谢培养基组在孵育3h后,烟碱浓度未发生明显变化且无可替宁产生,由此提示按照本发明方法将beas
‑
2b细胞与人25供体肝微粒体共培养后,未灭活的肝微粒体可对烟碱进行正常的体外代谢。
67.试验例3卷烟烟气体外代谢试验
68.采用本发明实施例1
‑
2的方法构建beas
‑
2b细胞与人25供体肝微粒体共培养体系,并将该体系应用于卷烟烟气体外代谢的研究。烟气总粒相物(tpm),烟草制品通过吸烟机抽吸,剑桥滤片捕集烟草制品烟气中总粒相物,然后利用dmso萃取剑桥滤片中的烟气总粒相物,定容至10mg/ml,经培养基、pbs或dpbs稀释为5mg/ml。
69.表4代谢培养基溶液配制
[0070][0071]
具体的,按照表4配制孵育代谢培养基溶液、对照染毒溶液和对照培养基溶液(现用现配)。将接种24h后的细胞培养板从培养皿中取出,移除培养上清液,分别立即加入孵育代谢培养基溶液、对照染毒溶液和对照培养基溶液1ml后,置于培养箱中培养24h后分别移出培养板细胞上清液后,利用cck
‑
8法测定细胞存活率。
[0072]
表5各组细胞存活率
[0073][0074][0075]
试验结果如表5所示,孵育代谢培养基组培养基组的细胞存活率显著高于对照染毒溶液组的细胞存活率,提示未灭活的肝微粒体可代谢烟气中化学成分,从而引起烟气成分对beas
‑
2b的细胞毒性降低。
[0076]
试验例4抗生素之间的对比试验
[0077]
配制培养基溶液,培养基溶液由终浓度为100u/ml青霉素、100μg/ml链霉素的begm bulletkit组成。分别配制仅含有25供体人肝微粒体的培养基溶液(对照组)以及终浓度为200mg/l红霉素溶液(深圳子科生物科技有限公司;红霉素组)、25mg/l氯霉素(碧云天公司;氯霉素组)和2.5mg/l二甲胺四环素盐酸盐(碧云天公司;二甲胺四环素盐酸盐组)的含25供体人肝微粒体的培养基溶液。
[0078]
将指数生长期的beas
‑
2b悬液(5
×
104个/ml)接种于6孔板,细胞贴壁后,移除细胞上清液,将五种溶液分别用于培养beas
‑
2b细胞,记为培养基组(a)、对照组(b)、红霉素组(c)、氯霉素组(d)和二甲胺四环素盐酸盐组(e),48h后观察细胞形态,结果如图4所示。
[0079]
由图4可知,对照组(b)、红霉素组(c)和氯霉素组(d)均不见生长良好细胞、呈现污
染状态;二甲胺四环素盐酸盐组(e)可见生长良好细胞、无污染状态,且与培养基组(a)细胞形态一致,提示二甲胺四环素盐酸盐组可抑制本实验肝微粒体中的污染源且不影响细胞的生长。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1