一种线粒体粘度探针及其制备方法和应用
1.本发明涉及荧光探针领域,具体涉及一种线粒体粘度探针及其制备方法和应用。
背景技术:
2.细胞微环境主要包括粘度、极性、温度、缺氧、酸碱性等,微环境的稳定是保持细胞正常增殖、分化、代谢和功能活动的重要条件。其中,细胞粘度是反映蛋白质、脂类和多糖等物质流动状态的重要参数,对细胞内生物分子间的信号传递和相互作用具有重要意义,此外,细胞粘度还影响细胞功能的执行,如凋亡和自噬;异常的细胞粘度与各种疾病密切相关,如阿尔茨海默病、糖尿病和癌症。线粒体是荧光生物影像研究最受关注的亚细胞器之一,该细胞器是细胞呼吸作用的主要场所,除了为细胞供能量外,还参与细胞分化、信息传递、凋亡、生长调控等过程。线粒体的粘度在调节生物过程中起着重要作用,反映了细胞器的状况和功能;异常的线粒体粘度会导致细胞障碍或严重的疾病,例如,线粒体粘度的增加降低了电子传递链的活性,促进了细胞色素c的释放,最终增加了恶性肿瘤和动脉粥样硬化的发生。长期以来,人们一直推测异常的线粒体粘度与神经退行性疾病、动脉粥样硬化和糖尿病相关。因此,实时原位监测细胞粘度的变化对于了解细胞功能的表现和阐明相关疾病的发展机制具有重要意义。
3.传统的粘度计(如毛细管粘度计、旋转粘度计和落球粘度计)仅适用于检测流体的粘度,而不适用于检测生物体。荧光技术由于其固有的可视化、非侵入性、敏感性和实时监测等优点,成为研究生物现象的最强大的细胞生物学工具之一。利用这种技术,可以以高时空分辨率实现活细胞或整个生物体中各种生物物种的成像和跟踪,这在很大程度上提高了我们对生物系统的理解,也促进了药物开发、临床诊断和疾病治疗。目前,大量粘度荧光探针被报道,它们的化学结构通常是由荧光团结合一个相对于整个分子可以旋转的基团组成。在低粘度条件下,快速的旋转消耗了分子的激发态能量,探针以非辐射形式跃迁回到基态,导致低的荧光量子产率和短的荧光寿命;随着粘度的增加,旋转得到有效抑制,降低了非辐射跃迁的可能性,探针的荧光得以恢复。然而,目前报道的大多数粘度探针由于缺乏线粒体靶向能力,在细胞中显示出非特异性分布,为了使该类探针定位于线粒体,不得不在其结构中引入额外的靶向基团(如三苯基膦盐和季铵盐)。在本发明中,我们开发了一个新型的粘度探针,该探针具有水溶性好、化学和光稳定性强等优点;重要的是,由于正离子的特性,该探针具有优良的水溶性、细胞膜穿透性和天然的线粒体靶向性。该探针成功用于检测药物诱导下细胞内线粒体的粘度变化。
技术实现要素:
4.针对上述问题本发明提供了一种具有线粒体靶向能力的粘度荧光探针及其制备、应用,该探针是由碳二吡咯甲烷染料(cardipy)与苯环经化学反应偶联制得。由于苯环的旋转导致的非辐射跃迁过程,探针本身仅有较弱的荧光信号;随着粘度增加,苯环旋转导致的非辐射跃迁过程被有效抑制,探针表现出强荧光信号。此外,该探针具有好的水溶性、高的
化学及光稳定性以及优良的线粒体靶向能力,成功用于检测药物诱导前后细胞线粒体中粘度的变化。
5.为了达到上述目的,本发明采用了下列技术方案:
6.一种线粒体粘度探针,其结构式为:
[0007][0008]
一种所述线粒体粘度探针的制备方法,包括以下步骤:
[0009][0010]
(1)在氮气下,将2,4
‑
二甲基吡咯(化合物1)和氢氧化钾溶于溶剂中,搅拌后加入二氯甲烷反应,反应液冷却至室温后,加入水,萃取水层,洗涤合并的有机相,干燥,粗品经柱色谱分离得到双(2,4
‑
二甲基
‑
1h
‑
吡咯
‑1‑
基)甲烷(化合物2);
[0011]
(2)将步骤(1)得到的双(2,4
‑
二甲基
‑
1h
‑
吡咯
‑1‑
基)甲烷溶于甲苯中,然后加入三光气,回流搅拌反应,冷却后除去残留的光气、甲苯,粗品经柱色谱分离得到碳二吡咯酮(化合物3);
[0012]
(3)将溴苯和无水四氢呋喃混合,溶液冷却到
‑
78℃,加入正丁基锂溶液混合搅拌30分钟,加入步骤(2)得到的碳二吡咯酮的无水四氢呋喃溶液,反应液恢复至室温并搅拌过夜,之后加入盐酸溶液搅拌10分钟,萃取、干燥,粗品经柱色谱分离后,得到所述线粒体粘度探针cardipy
‑
vis。
[0013]
进一步,所述步骤(1)中2,4
‑
二甲基吡咯、二氯甲烷、氢氧化钾的摩尔比为4:6:3。
[0014]
进一步,所述步骤(1)中溶剂为二甲基亚砜,加入二氯甲烷反应的温度为40℃,反应的时间为4小时。
[0015]
进一步,所述步骤(1)中柱色谱分离展开剂二氯甲烷:石油醚的体积比为1:4。
[0016]
进一步,所述步骤(2)中双(2,4
‑
二甲基
‑
1h
‑
吡咯
‑1‑
基)甲烷与三光气的摩尔比为5:2。
[0017]
进一步,所述步骤(2)中回流搅拌反应的温度为120℃(甲苯沸点为110.6℃),时间为5h;所述柱色谱分离展开剂为二氯甲烷。
[0018]
进一步,所述步骤(3)中溴苯、正丁基锂、碳二吡咯酮的摩尔比为1:1:0.3,所述正丁基锂的浓度为1.6mol/l,所述盐酸溶液的浓度为2mol/l。
[0019]
进一步,所述步骤(3)中柱色谱分离展开剂二氯甲烷:甲醇的体积比为10:1。
[0020]
一种所述线粒体粘度探针的应用,在制备细胞成像试剂中的应用。
[0021]
一种所述线粒体粘度探针的应用,用于检测药物诱导前后细胞线粒体中粘度的变化。探针检测粘度的机理如图17所示,该探针在低粘度环境下,连接荧光团和苯环的c
‑
c键
可以快速旋转,快速的旋转消耗了分子的激发态能量,导致探针以非辐射跃迁方式回到基态,探针的荧光被猝灭;然而,随着粘度的增加,降低了由旋转导致的非辐射跃迁过程,探针的荧光得以恢复。
[0022]
与现有技术相比本发明具有以下优点:
[0023]
(1)探针水溶性好、化学及光稳定强;
[0024]
(2)探针具有天然线粒体靶向能力,检测药物诱导前后细胞线粒体中粘度的变化;
[0025]
(3)该探针生物兼容性好,有望应用于活体中。
附图说明
[0026]
图1为化合物2的1h nmr图(cdcl3,600mhz);
[0027]
图2为化合物2的
13
c nmr图(cdcl3,150mhz);
[0028]
图3为化合物2的hrms图;
[0029]
图4为化合物3的1h nmr图(cdcl3,600mhz);
[0030]
图5为化合物3的
13
c nmr图(cdcl3,150mhz);
[0031]
图6为化合物3的hrms图;
[0032]
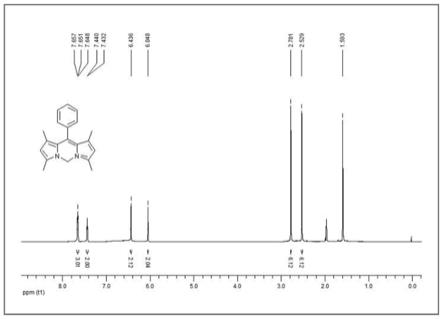
图7为探针cardipy
‑
vis的1h nmr图(cd3cn,600mhz);
[0033]
图8为探针cardipy
‑
vis的
13
c nmr图(cd3cn,150mhz);
[0034]
图9为探针cardipy
‑
vis的hrms图;
[0035]
图10为探针cardipy
‑
vis在(图10a)pbs和(图10b)乙腈中吸光度随浓度(0
‑
40μm)的变化图。
[0036]
图11为探针cardipy
‑
vis以及商业化染料cy5.5和cy7在氙灯照射下归一化的荧光强度的变化图;
[0037]
图12为探针cardipy
‑
vis在不同ph缓冲体系中紫外可见光谱及荧光光谱随时间的变化图,ex=470nm,slit 5/5nm,pmt 600v,图12(a)为在ph=2~5缓冲体系中紫外可见光谱及荧光光谱随时间的变化图,图12(b)为在ph=6~9缓冲体系中紫外可见光谱及荧光光谱随时间的变化图,图12(c)为在ph=10~12缓冲体系中紫外可见光谱及荧光光谱随时间的变化图;
[0038]
图13(a)为探针cardipy
‑
vis在不同比例的水和甘油体系(ph 2
‑
12)中的荧光光谱图;图13(b)为探针在512nm处的荧光强度随粘度的变化图,ex=470nm,slit 5/10nm,pmt 500v;
[0039]
图14为探针cardipy
‑
vis(1μm)/mitotracker red cmxros(100nm,15min)在hela细胞中的共定位荧光图像;收集波长为490
‑
550nm(λex=488nm)/590
‑
690nm(λex=559nm);
[0040]
图15为探针cardipy
‑
vis(1μm)/lysotracker red dnd
‑
99(100nm,15min)在hela细胞中的共定位荧光图像;收集波长为490
‑
550nm(λex=488nm)/590
‑
690nm(λex=559nm);
[0041]
图16为探针影像药物诱导hela细胞线粒体粘度变化的成像图;收集波长为490
‑
550nm(λex=488nm),图16(a)为未经处理过的细胞没有任何背景荧光信号;图16(b)仅用探针处理过的细胞展现出较弱的绿色荧光信号;图16(c)用探针处理预先负载了制霉菌素的细胞显示出强的绿色荧光信号;
[0042]
图17为本发明探针cardipy
‑
vis检测粘度的机理示意图。
具体实施方式
[0043]
实施例1
[0044]
一种线粒体粘度探针,其结构式为:
[0045][0046]
一种所述线粒体粘度探针的制备方法,其特征在于,包括以下步骤:
[0047]
(1)在氮气下,将2,4
‑
二甲基吡咯(0.95g,10mmol)和koh(0.84g,15mmol)溶解于20ml干燥dmso中,室温搅拌1h后,加入ch2cl2(0.64g,7.5mmol),然后在40℃搅拌4h。反应液冷却至室温后,加入100ml水,用乙醚萃取水层,合并的有机相用3
×
100ml水和nacl洗涤,用na2so4干燥。粗品经柱色谱分离(二氯甲烷/石油醚,1/4)得到双(2,4
‑
二甲基
‑
1h
‑
吡咯
‑1‑
基)甲烷(化合物2)为白色固体(0.12g,11.9%);
[0048]1h nmr(600mhz,cdcl3)δ6.35(s,2h),5.77(s,2h),5.59(s,2h),2.25(s,6h),2.05(s,6h).
13
c nmr(150mhz,cdcl3)δ128.1,118.6,117.4,109.6,56.4,145.5,142.6,132.8,132.0,131.7,131.0,127.5,120.1,117.7,115.1,113.0,110.8,99.7,1.96,11.8;esi
‑
ms[m+h]
+
:calcd for 203.1543,found 203.1545;
[0049]
(2)将三光气(0.178g,0.6mmol)搅拌下加入到步骤(1)得到的双(2,4
‑
二甲基
‑
1h
‑
吡咯
‑1‑
基)甲烷(化合物2)(0.3g,1.5mmol)的甲苯(5ml)溶液中,在120℃下回流搅拌反应5h。冷却后,用氮气鼓泡的方式除去残留的光气。在减压下除去甲苯,粗品经柱色谱分离(二氯甲烷)得到碳二吡咯酮(化合物3)为白色固体(0.118g,35%);
[0050]1h nmr(600mhz,cdcl3)δ5.97(s,2h),5.68(s,2h),2.52(s,6h),2.32(s,6h).
13
c nmr(150mhz,cdcl3)δ169.4,131.2,128.2,124.6,112.7,55.6,12.9,11.9;esi
‑
ms[m+h]
+
:calcd for 229.1335,found 229.1333;
[0051]
(3)向充满氮气的烧瓶中依次加入10ml无水四氢呋喃、溴苯(157mg,1.0mmol),溶液冷却到
‑
78℃后,加入1.6m n
‑
buli(625μl,1.0mmol),混合搅拌30分钟。在相同的温度下,将步骤(2)得到的中间体碳二吡咯酮(化合物3)(76mg,0.3mmol)的无水四氢呋喃(10ml)溶液缓慢加入到上述溶液中,然后混合物恢复至室温搅拌过夜。加入2m盐酸使反应失活,搅拌10min,用ch2cl2萃取,有机层在na2so4上干燥并蒸发,粗品经柱色谱分离(ch2cl2/ch3oh=10/1)得探针cardipy
‑
vis为橙色固体(0.107g,95.6%)。
[0052]1h nmr(600hz,cd3cn)δ7.55(t,j=7.2hz,1h),7.47(m,2h),7.28(d,j=7.2hz,1h),6.44(s,2h),6.13(s,2h),2.55(s,6h),2.21(s,3h),1.57(s,6h);
13
cnmr(150mhz,cd3cn)δ151.9,142.9,142.1,135.2,131.1,130.9,130.3,127.4,127.2,126.1,120.1,58.0,18.2,12.8,12.5;esi
‑
ms[m]
+
:calcd for 303.1856,found303.1855.
[0053]
实施例2
[0054]
1.测试溶液配制
[0055]
将探针用乙腈配成2mm的储存液,随后用20mm的pbs(ph 7.4)或者b
‑
r缓冲稀释至测试浓度。
[0056]
2.光稳定性实验
[0057]
将样品溶液置于比色皿中,室温下用氙灯连续照射(1000w,25a),比色皿与氙灯的距离为6cm,在荧光光谱仪上监测cardipy
‑
vis、cy5.5和cy7在最大发射点的荧光强度随时间的变化。
[0058]
3.细胞培养和荧光成像
[0059]
在37℃、5%的二氧化碳湿润环境中,hela细胞培养于含有10%的fbs(胎牛血清)、100u/ml青霉素g钠和100μg/ml链霉素的dmem(高葡萄糖)培养基中。进行细胞影像实验前,预先将细胞置于30mm的玻璃底细胞培养皿上,静置12小时,用磷酸缓冲盐(pbs)洗涤细胞3次,然后使用ceiss lms 710共聚焦显微镜进行荧光成像。
[0060]
4.亚细胞定位
[0061]
在37℃、5%的二氧化碳湿润环境中,hela细胞培养于含有10%的fbs(胎牛血清)、100u/ml青霉素g钠和100μg/ml链霉素的dmem(高葡萄糖)培养基中。实验前,将细胞置于30mm的玻璃底细胞培养皿上,静置12小时,用磷酸缓冲盐(pbs)洗涤3次。为了证实探针能够特异性染色线粒体,在37℃、dmem条件下,首先对hela细胞进行lysotracker red dnd
‑
99(100nm,15min)或mitotracker red cmxros(100nm,15min)标记,pbs洗涤3次后,在37℃、dmem条件下,用探针(1μm,15min)染色;pbs洗涤3次后,在指定的时间点进行荧光图像。对于探针,收集波长为500
‑
550nm(λex=488nm);对于商业化染料,收集波长为590
‑
690nm(λex=559nm)。
[0062]
5.药物诱导凋亡实验
[0063]
将细胞置于30mm的玻璃底细胞培养皿上,静置12小时,用制霉菌素(10μm)继续处理12小时后,备用。
[0064]
测试结果
[0065]
1.水溶性和光稳定性
[0066]
我们首先使用吸收光谱研究探针的水溶性。如图10所示,探针cardipy
‑
vis在pbs(图10a)和乙腈(图10b)中的吸收波长分别为493nm和494nm,且显示出几乎相同的吸收光谱,峰肩比基本不变;此外,滴定研究进一步表明,探针的浓度(0
‑
40μm)与吸光度呈良好的线性关系,这对大多数生物成像应用来说是足够的。不仅如此,当用xe灯连续照射10min时,探针cardipy
‑
vis也比商业化的cy5.5和cy7具有更高的光稳定性(图11)。上述结果表明,阳离子特性赋予了探针cardipy
‑
vis优良的水溶性和光稳定性,这两个特性对于生物应用至关重要。
[0067]
2.光物理特性
[0068]
在b
‑
r缓冲体系中,研究了探针在不同ph(2~12)条件下的紫外可见吸收光谱及荧光光谱随时间的变化,如图12所示,探针在2~12的ph范围内均可以稳定存在,说明不同的ph环境不会影响对粘度的检测。由于苯环自由旋转导致的非辐射跃迁过程,探针本身具有较弱的荧光信号,鉴于探针优良的水溶性,接下来测试了探针在不同比例的水与甘油体系中荧光强度的变化,如图13(a)所示;如图13(b)所示,随着粘度的增加,探针在512nm处的荧光强度逐渐增强,荧光增强约12倍。
[0069]
3.细胞成像实验
[0070]
为了验证探针具有天然的线粒体靶向能力,进一步利用激光共聚焦显微镜测试探
针在hela细胞中的细胞定位情况。如图14和图15所示,探针分别与商业化的线粒体和溶酶体染料共染后,皮尔森系数分别为0.91和0.43,说明探针与商业化线粒体染料有很好的定位效果。共定位实验说明,染料不仅具有良好的细胞渗透能力而且具有天然的线粒体靶向功能。研究表明,制霉菌素可通过引起线粒体肿胀来诱导细胞凋亡,为了验证探针能否影像出细胞在凋亡过程中线粒体的粘度变化,细胞预先用制霉菌素刺激0.5小时后,再孵化探针;结果显示,图16(a)为未经处理过的细胞没有任何背景荧光信号;图16(b)仅用探针处理过的细胞展现出较弱的绿色荧光信号;图16(c)用探针处理预先负载了制霉菌素的细胞显示出强的绿色荧光信号,暗示了药物处理后导致线粒体粘度增加。上述结果说明,探针cardipy
‑
vis具有天然的线粒体靶向能力,并成功用于影像制霉菌素诱导细胞凋亡过程中线粒体粘度的变化。
[0071]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1