宫腔粘连的模型的制作方法
1.本发明涉及生物医药领域,旨在建立用宫血干细胞(menscs)来源的外泌体(exosomes)在体外缓解宫腔粘连的模型。
背景技术:
2.宫腔粘连(intrauterine adhesion,iua)是宫腔镜手术发展引起的一个重要的潜在生育并发症。宫腔镜检查期间基底层子宫内膜损伤会导致反复流产、异常子宫出血、闭经、不孕等。此外,宫腔粘连还可引起子宫内膜腔部分或全部闭塞,导致子宫充血和严重的骨盆疼痛。对于宫腔粘连患者来说,最有效的治疗方式是促进子宫内膜的再生和修复,只有这样才能从根本意义上改善其生殖和生理功能。因此除了预防再粘连,如何有效地促进子宫内膜的修复是提高iua疗效的重中之重。
3.多种来源的干细胞被证明可以通过旁分泌作用发挥促进组织修复和缓解纤维化的作用,而外泌体是旁分泌中的高度活跃成分。
4.但是目前缺乏有效的宫腔粘连模型,以检测或验证待测外泌体是否对于治疗iua有效。
技术实现要素:
5.为了获得有效的宫腔粘连模型,本发明的发明人经过大量、坚持不懈的筛选,发现tgf
‑
β处理后的子宫内膜间质细胞(escs)可以作为宫腔粘连模型,进而为加快治疗iua的药物或外泌体提供了有力保障。
6.本发明的一个方面提供了一种子宫内膜间质细胞,其是通过tgf
‑
β处理过的。
7.本发明的另一方面提供了一种构建宫腔粘连模型的方法,其包括用tgf
‑
β处理子宫内膜间质细胞。
8.本发明还提供了一种用于构建宫腔粘连模型的试剂盒,其包括子宫内膜间质细胞和tgf
‑
β。
9.本发明还提供了tgf
‑
β在制备用于构建宫腔粘连模型的试剂盒中的用途。
10.具体而言,本发明涉及的子宫内膜间质细胞分离自子宫内膜组织或由干细胞诱导分化而来。
11.在本发明的一个实施方式中,用tgf
‑
β处理子宫内膜间质细胞至少2个小时,例如可以为4、8、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38、40、42、44、46、48小时。
12.在本发明的一个实施方式中使用10
‑
50ng/ml tgf
‑
β处理子宫内膜间质细胞,优选地,使用20ng/ml tgf
‑
β处理子宫内膜间质细胞。
13.可以显而易见理解的是,tgf
‑
β处理子宫内膜间质细胞的时间可以随着tgf
‑
β浓度的变化而变化。例如,tgf
‑
β浓度较高的情况下,处理时间可以相应缩短;反之,tgf
‑
β浓度较低的情况下,处理时间可以相应延长。
14.示例性地,本发明提供了一种构建宫腔粘连模型的方法,其包括如下步骤:
15.在培养基中培养子宫内膜间质细胞;
16.向培养基中添加tgf
‑
β;
17.继续培养并分离子宫内膜间质细胞。
18.任选地,本发明的构建宫腔粘连模型的方法还包括从人体子宫内膜组织获得子宫内膜间质细胞的步骤或从干细胞诱导分化并获得子宫内膜间质细胞的步骤。
19.任选地,在向培养基中添加tgf
‑
β后,无菌条件下在
‑
2℃至
‑
4℃下静置一段时间后恢复至培养温度。示例性地,在
‑
2℃至
‑
4℃下静置0.5
‑
1.0小时,然后在0.5
‑
1.0小时内逐渐升温至培养温度,例如37℃。
20.在本发明的一个实施方式中,试剂盒中所包括的子宫内膜间质细胞和tgf
‑
β是分开存放的。
21.进一步地,本发明的试剂盒还包括用于构建子宫内膜间质细胞培养基的组分。
22.优选地,本发明的试剂盒还包括试剂盒说明书,以明示如何操作并获得宫腔粘连细胞模型。
23.本发明的宫腔粘连细胞模型尤其适用于检测或预测待测外泌体是否对宫腔粘连治疗有效。
24.本发明还提供了一种预测外泌体是否对宫腔粘连治疗有效的方法,其包括使外泌体作用于本发明的细胞模型的步骤。
25.本文已采用的术语和表述用作描述性而不是限制性术语,并且在此种术语和表述的使用中不预期排除所示和所述特征或其部分的任何等价物,但应认识到各种修饰在请求保护的本发明的范围内是可能的。因此,应当理解尽管本发明已通过优选实施方案和任选特征具体公开,但本领域技术人员可以采用本文公开的概念的修饰和变化,并且此类修饰和变化被视为在如由附加权利要求定义的本发明的范围内。
26.为更清楚地说明本发明,现结合如下实施例进行详细说明,但这些实施例仅仅是对本发明的示例性描述,并不能解释为对本技术的限制。
附图说明
27.图1:子宫内膜间质细胞的鉴定。
28.图2:menscs光镜下细胞形态观察。
29.图3:menscs生长曲线。
30.图4:menscs表面标志物的鉴定。
31.图5:menscs成骨、成脂、成软骨结果。
32.图6:外泌体的鉴定。
33.图7:tgf
‑
β诱导的escs与外泌体共培养后qpcr检测结果。
34.图8:menscs来源的外泌体可被escs摄取。
35.图9:transwell体系中escs的迁移。
36.图10:menscs来源的外泌体促进划痕愈合。
具体实施方式
37.本发明结合附图和实施例作进一步的说明。
38.实施例1:
39.下面结合附图和具体实施例对本发明的内容做进一步的说明。下述实施例仅为说明本发明的技术构思及特点,其目的在于让本技术领域的人员了解本发明的内容,并不能以此限制本发明的保护范围,凡根据本发明技术方案所作的等效变化,都应覆盖在本法的保护范围之内。
40.材料与试剂
41.组织收集:
42.1.menscs来源
43.根据研究需要,招募20
‑
40岁的健康育龄期女性志愿者,与有意向捐赠宫血干细胞的志愿者沟通,明确意愿,按要求签订科研捐赠协议。告知流程、标准和知情同意书的内容,涉及到的所有文件都经浙江大学伦理委员会审查并获得批准。所获得宫血样本仅用于提取menscs,不作他用,p3
‑
p8代次用于后续实验。
44.2.escs来源
45.招募绝经前因子宫肌瘤或子宫下垂等各种妇科良性适应症行腹腔镜观察或腹腔镜下子宫切除术的女性志愿者,取其增生期子宫内膜样本(n=3)制备子宫内膜间质细胞用于后续实验。排除标准:包括任何子宫内膜异常(增生、息肉或癌症)和手术后3个月内给予任何性激素或促性腺激素释放激素(gnrh)进行拮抗治疗的志愿者。
46.实验试剂:
47.α
‑
mem培养基
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
美国gibco公司
48.dmem
‑
f12培养基
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
美国gibco公司
49.胎牛血清
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
美国gibco公司
50.青霉素/链霉素
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
美国sigma公司
51.pbs缓冲液
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
美国thermo fisher公司
52.单核淋巴细胞分离液
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
美国ge healthcare公司
53.0.25%trypsin
‑
edta
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
美国gibco公司
54.dmso
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
美国sigma
‑
alderich公司
55.primescript
tm rt reagent kit
ꢀꢀꢀꢀꢀ
大连takara公司
56.sybr premix ex大连takara公司
57.bca蛋白检测试剂盒
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
碧云天(上海)生物科技有限公司
58.dapi染料
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
碧云天(上海)生物科技有限公司
59.depc处理水
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
美国thermo fisher公司
60.cck
‑8ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
日本同仁化学公司
61.成骨分化诱导培养基
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
广州赛业生物科技有限公司
62.成脂分化诱导培养基
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
广州赛业生物科技有限公司
63.成软骨分化诱导培养基
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
广州赛业生物科技有限公司
64.transwell小室
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
美国bd biosciences公司
65.sdf
‑
lα因子
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
美国peprotech公司
66.tgf
‑
β1因子
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
美国peprotech公司
67.结晶紫染色液
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
碧云天(上海)生物科技有限公司
68.10kda超滤膜
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
美国millipore公司
69.脂多糖
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
美国sigma公司
70.exoquick
‑
tc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
美国sbi公司
71.pkh26试剂
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
美国sigma公司
72.anti
‑
cd63 polyclonal antibody
ꢀꢀꢀ
美国abcam公司
73.anti
‑
cd81 polyclonal antibody
ꢀꢀꢀ
美国abcam公司
74.重组anti
‑
vimentin抗体
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
美国abcam公司
75.重组anti
‑
cytokeratin 18抗体
ꢀꢀꢀꢀꢀ
美国abcam公司
76.4%多聚甲醛
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
北京索莱宝有限公司
77.脂多糖
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
美国sigma公司
78.实施例1.子宫内膜间质细胞(endometrial stromal cells,escs)的分离
79.(1)将含子宫内膜组织的采集管放入细胞传递窗。
80.(2)采集管中补充生理盐水至45ml,500g离心5min,弃上清,用眼科剪剪碎子宫内膜组织成1mm3片段并用5ml 0.1%i型胶原酶(gibco,美国)和dnase(invitrogen,美国)在37℃培养箱消化45min,期间隔一段时间晃动离心管,使消化更充分。
81.(3)加入5ml dmem/f12+10%fbs+1%双抗(青霉素/链霉素)的培养基终止消化反应,并用pbs补充至20ml,离心5min,弃上清。
82.(4)用pbs多次清洗,并用100μm的滤网去除杂质,离心获得细胞沉淀。
83.(5)用dmem/f12完全培养液重悬,置于75cm2培养瓶中培养。24h后,待细胞贴壁,更换新鲜培养基,去除悬浮的其他杂细胞。待细胞生长状态稳定,细胞长到培养皿底的90%时,用trypsin
‑
edta消化,以1:3进行传代或冻存备用。
84.实施例2.escs的鉴定
85.将实施例1中获得的escs培养在事先铺入细胞爬片的6孔板中,当细胞融合度为70%
‑
80%时,弃去原有培养基,用pbs清洗2次,4%多聚甲醛摇床上固定30min,用0.3%triton x
‑
100溶液对细胞进行通透处理,并用免疫荧光和免疫细胞化学的方法,孵育vimentin和ck18抗体,用显微镜拍照观察escs中vimentin和ck18的表达。结果如图1所示,图1a
‑
b为p2代次escs显微镜下形态特征,细胞呈梭形或短小多角形,簇状生长。图1c为免疫细胞化学ck18阳性;图1d为免疫细胞化学vimentin阳性;图1e免疫荧光结果显示ck18和vimentin表达阳性。图a、b的scale bar分别为200μm、100μm;图c、d、e scale bar均为50μm。以上数据表明escs表达波形蛋白vimentin和细胞角蛋白ck18。vimentin是间质细胞的表面标志物,同时负责维持细胞骨架的完整性。ck18作为上皮细胞表面标记物,表达量相对较低。由此说明分离得到的escs主要是间质细胞,同时包含少部分的上皮细胞。
86.实施例3.menscs的分离、培养
87.在健康女性志愿者月经期经血量最大当天,采用截石位将月事杯放入体内几小时采集经血。将经血样本拿到超净台后,先进行过滤去除黏液和凝块,通过离心使细胞沉淀,然后用一定量的pbs重悬细胞,再缓慢加入淋巴细胞分离液,离心获得单核细胞,并用pbs多次清洗以去除多余的杂质和血细胞,然后将分离纯化的细胞用α
‑
mem培养基(含15%血清和1%青霉素/链霉素)重悬,转入75cm2培养瓶中培养。血样和细胞样本均送去做病原体检测。挑选形态正常、生长状态良好的细胞株继续培养,每隔3
‑
5天换一次液,去除死细胞、代谢废
物和其他杂质。当细胞密度合适,形态稳定时,可用0.25%的trypsin
‑
edta 37℃消化细胞,按照1:3的比例进行传代。后续所有细胞均放置于37℃、5%co2饱和湿度的恒温培养箱(thermo fisher)中培养。第3到第8代次的细胞(p3
‑
p8)用于后续研究,并观察其细胞形态,结果如图2所示。该图显示,menscs传至3代之后发现细胞形态趋于一致,表现为典型的梭形,胞核大,核仁明显,成簇或成涡旋状生长,表现出典型的mscs细胞特征。
88.实施例4.menscs的鉴定
89.menscs扩增培养至第5代左右,当细胞密度合适时,用trypsin
‑
edta消化,以每孔100μl,5x103/ml的细胞密度加入96孔板,用cck8试剂盒检测并绘制menscs生长曲线,以此来反映体系中细胞的增殖情况,结果如图3所示,其显示menscs细胞增殖趋势明显,从接种开始呈指数型生长,于第6天开始进入平台期,具有良好的生长增殖能力;用流式细胞仪来检测menscs表面cd73、cd90、cd105、cd117、cd29、cd34、cd45和hla
‑
dr的表达,并用flow
‑
jo软件进行分析,结果如图4所示,menscs高表达间充质干细胞表面标记cd29、cd73、cd90、cd105(均>90%),低表达cd45(<10%),几乎不表达cd34、cd117和hla
‑
dr(均<1%),表明menscs是非造血细胞,同时免疫原性也比较低;为了检测menscs的体外分化能力,也进行了成骨成脂和成软骨分化诱导实验,诱导结束后分别用茜素红、油红o和阿利辛蓝进行染色,显微镜下拍照观察,结果如图5所示,其显示menscs在体外能够诱导分化为骨、脂肪和软骨细胞,即具有三系分化潜能,符合间充质干细胞的特性。
90.实施例5.外泌体(exosomes)的提取
91.当menscs细胞融合度为70
‑
80%时,换为无血清α
‑
mem培养基继续培养48h,收集上清用于提取外泌体(exosomes)。首先4℃,300g离心上清10min以去除死细胞,然后4℃,2000g离心20min去除细胞碎片,用0.22μm滤膜过滤上清液去除较大囊泡,随后将上清液加入到10kda mwco超滤管中,4℃,4000g离心进行超滤,目的是浓缩上清液。将最后超滤膜截流得到的浓缩液按照5:1的比例加入外泌体提取试剂(exoquick
‑
tc),混合均匀后4℃垂直放置过夜,过程中不要摇动或倾斜。
92.第二天,首先将外泌体和提取试剂混合物4℃,1500g离心30min,使外泌体沉淀。然后弃除大部分上清,再次4℃,1500g离心5min使沉淀更彻底。用200μl无菌pbs重悬外泌体,吹打均匀,
‑
80℃保存。
93.实施例6.外泌体的鉴定
94.将得到的外泌体用bca法测浓度,并根据浓度进行稀释。然后用western blot鉴定表面标志物cd63、cd81的表达,结果如图6a所示,menscs来源的外泌体(exosomes)表达cd63和cd81,符合exosomes的特性;用冷冻透射电镜(tem)鉴定其形态及颗粒大小,结果如图6b所示,其表明exosomes大小不一,但直径都在30
‑
150nm之间,呈明显的圆形或椭圆形杯状结构,具有双层脂质膜,立体感明显;用纳米颗粒跟踪分析仪(nta)检测外泌体的粒径大小、颗粒数等,结果如图6c所示,其表明外泌体平均粒径为148nm,这些结果与文献中关于外泌体的描述一致,表明已经获得了exosomes,并可用于后续实验。
95.实施例7.menscs来源的外泌体对于tgf
‑
β诱导的escs纤维化标志基因表达水平的作用
96.首先将escs培养在6孔板中,20ng/ml tgf
‑
β处理24h后,撤掉tgf
‑
β,将100μg/ml的外泌体加入escs培养基里共培养。24h后,收集细胞,用rna提取试剂盒从6孔板中提取rna,
然后使用反转录(rt)试剂盒将提取的rna反转录为cdna,并用sybr green分析法进行实时荧光定量pcr,检测collagen i、α
‑
sma、ctgf的表达。
97.表1.1反转录过程反应体系
[0098][0099][0100]
反应条件(表1.2):
[0101]
表1.2反转录过程反应条件
[0102][0103]
qpcr扩增:
[0104]
将制备好的cdna产物与pcr反应各组分混合均匀,配制成反应液。
[0105]
表1.3qpcr扩增反应体系
[0106][0107]
反应程序:
[0108]
将上述混合液加入qpcr反应孔板中进行扩增反应,程序为:
[0109]
预变性:95℃,180s;变性:95℃,5s;退火:60℃,30s;从变性到退火进行39个循环。然后是熔解曲线的分析程序:95℃变性10s,65℃运行5s,95℃变性10s,然后从65℃到95℃,每5s升温0.5℃,最后16℃运行30s。
[0110]
表1.4qpcr所用引物(人源)
[0111][0112]
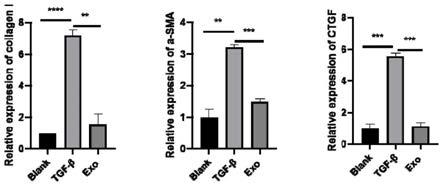
结果如图7所示,其显示经过tgf
‑
β处理的escs中其纤维化标志基因collagen i、α
‑
sma、ctgf的表达显著高于对照组。
[0113]
另外,为了获得标志基因collagen i、α
‑
sma、ctgf的更高水平表达,以获得严重程度更高的宫腔粘连模型,发明人发现间隔性的低温处理可以实现这一目的。首先如本实施例那样,将escs培养在6孔板中,添加20ng/ml tgf
‑
β处理后,无菌条件下在
‑
2℃至
‑
4℃下静止0.5
‑
1.0小时,然后在0.5
‑
1.0小时内逐渐升温至37摄氏度,继续培养24h后,撤掉tgf
‑
β,将100μg/ml的外泌体加入escs培养基里共培养。结果发现,collagen i、α
‑
sma、ctgf的表达显著高于本实施例中未经过低温处理的实验组,其相对表达水平分别为12.6,4.5和8.1,且外泌体也显示出类似的降低标志基因表达的作用。
[0114]
实施例8.menscs来源的外泌体在escs内的定位
[0115]
(1)铺板:取escs,trypsin
‑
edta消化计数后,按每孔5x104个细胞铺入24孔板中培养,并用tgf
‑
β处理24h。
[0116]
(2)将之前制备好的对照menscs来源的外泌体用pkh26染料进行标记。
[0117]
(3)将标记过的外泌体加入escs细胞中培养24h,并以pbs组作为对照。
[0118]
(4)24h后将24孔板拿出细胞房,pbs清洗3次。
[0119]
(5)弃去pbs,多聚甲醛固定30min。
[0120]
(6)加入鬼笔环肽(phalloidin)染料,避光孵育30min。
[0121]
(7)加入dapi避光孵育10min。
[0122]
(8)载玻片上滴加8μl抗荧光淬灭封片剂。
[0123]
(9)用镊子或10μl枪头将爬片取出,有细胞的那一面朝下放置在载玻片上风干。
[0124]
(10)干燥后用荧光共聚焦显微镜63x油镜观察拍照,也可4℃避光短暂保存。
[0125]
结果如图8所示,其表明外泌体与escs共培养一段时间后,可以明显观察到与pbs对照组相比,外泌体组有红色荧光标记的外泌体进入escs细胞内,说明它能够被escs摄取,且能够降低tgf
‑
β诱导的escs纤维化标志基因的表达水平。
[0126]
实施例9.menscs来源的外泌体促进escs细胞迁移
[0127]
为了说明menscs来源的外泌体对escs细胞迁移作用的影响,选用8μm孔径的transwell培养板进行了transwell迁移实验。将escs铺在上层小室中并用tgf
‑
β处理24h,下室中加入20μg/ml的外泌体,无血清培养基作阴性对照,20%血清作阳性对照。48h后取出培养板,多聚甲醛固定30min,弃去固定液,pbs清洗3次。下室加入0.1%的结晶紫溶液700μl,室温染色10min。染色结束后,pbs清洗上室小孔,然后用棉签将上室未迁移过去的细胞擦除。用倒置显微镜观察细胞迁移情况。
[0128]
结果如图9所示,其表明menscs分泌的外泌体同时也能够促进escs细胞的迁移。
[0129]
实施例10.menscs来源的外泌体促进划痕愈合
[0130]
(1)首先在12孔板的底部用记号笔划2条横线作为标记。
[0131]
(2)取escs,trypsin
‑
edta消化计数后,按每孔3x105个细胞铺入12孔板中培养。
[0132]
(3)第二天,待细胞长满后,用pbs清洗细胞2次。
[0133]
(4)用200μl黄色枪头垂直于孔板进行划痕,pbs轻柔清洗2次,将划下的细胞去除。
[0134]
(5)加入无血清培养基放入培养箱继续培养。
[0135]
(6)实验组加入20μg/ml的外泌体,同时设置空白组和对照组。
[0136]
(7)于0h、12h、24h拍照观察,计算同一位置划痕区域的愈合情况。
[0137]
结果如图10所示,其表明menscs分泌的外泌体能够促进划痕区域的愈合。
[0138]
由上可以看出,tgf
‑
β诱导escs细胞构造纤维化的模型是成功的,并且menscs来源的外泌体能够在体外发挥促进创伤愈合,改善纤维化的作用。
[0139]
虽然用上述实施方式描述了本发明,应当理解的是,在不背离本发明的精神的前提下,本发明可进行进一步的修饰和变动,且这些修饰和变动均属于本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1