MRKH综合征诊断标记物及其应用的制作方法
mrkh综合征诊断标记物及其应用
技术领域
[0001]
本发明属于医学检测技术领域,特别涉及一种mrkh综合征诊断标记物及其应用。
背景技术:
[0002]
女性胚胎期苗勒管发育异常,导致先天性无阴道合并无子宫或仅有始基子宫,即mrkh综合征(mayer-rokitansky-k
ü
ster-hauser syndrome),发病率为1/5000-1/4000。主要临床特征包括:无子宫或实性始基子宫结节,极少部分患者虽有功能性子宫内膜但子宫发育不良;阴道完全缺失,或阴道上2/3缺失、下1/3呈穴状,其顶端为盲端;输卵管、卵巢发育正常,第二性征为正常女性,染色体核型为女性核型46,xx。mrkh综合征主要分为两种类型,其中ⅰ型(单纯型)表现为单纯子宫、阴道发育异常,而泌尿系统、骨骼系统发育正常,此型最为常见;ⅱ型(复杂型)表现为除子宫、阴道发育异常外,还伴有泌尿、骨骼系统或其他系统发育异常。
[0003]
mrkh综合征的患者女性第二性征发育正常,多因青春期原发性闭经就诊发现,少数患者以婚后性生活困难或周期性下腹痛为主诉症状。因患者青春期后无月经来潮、无法正常性生活、不具生育能力,仅可成年后通过人工阴道成型术解决性生活的困难,对患者身心影响巨大。
[0004]
应用微阵列、比较基因组杂交(array-cgh)、dna测序等技术已检测出某些染色体畸变(chromosomal aberration)、基因突变等可能是mrkh综合征的致病因素。研究者通过检测染色体畸变位点来筛选相关的基因,并判别相关基因在mrkh综合征中的致病性。既往文献报道,染色体16p11.2区域的片段缺失在约2%的mrkh综合征患者中发现,是mrkh综合征最常见的染色体畸变之一,而定位于该区域的tbx6基因被认为是可能性较大的可疑致病基因。sandakan等在mrkh综合征患者中发现tbx6基因的剪切位点突变(622-2a>t),该突变位于五号外显子的剪接受体位点,因此该突变很可能降低了五号外显子的正确剪接;tewes等人在167名mrkh患者中发现5例携带tbx6基因的错义突变;tbx6基因敲除的雌性小鼠中也表现出泌尿生殖系统畸形。
[0005]
因此研究人员猜想tbx6基因突变可能是mrkh综合征的致病原因之一,在早期对基因突变位点进行检测能够实现尽早、尽快确诊。
技术实现要素:
[0006]
本发明的发明目的是提供一种mrkh综合征诊断标记物及其应用。
[0007]
为实现上述发明目的,本发明的技术方案如下:
[0008]
mrkh综合征诊断标记物,该mrkh综合征诊断标记物为cdna序列中存在突变位点c.839+5g>a的tbx6基因片段。
[0009]
本发明通过对442名mrkh受试患者进行外显子组测序,首次在tbx6基因上发现了该突变位点c.839+5g>a,该突变位点经sanger测序确认为真性突变;经验证,该突变位点c.839+5g>a所在的六号内含子产生了新的剪接位点,导致tbx6基因上六号内含子前96bp碱
基滞留在mrna中,进而导致tbx6基因产物失去功能而引发mrkh。
[0010]
基于此,本发明提供了上述的mrkh综合征诊断标记物在制备mrkh综合征诊断试剂盒中的应用。
[0011]
同时,本发明还提供了一种mrkh综合征诊断试剂盒,该mrkh综合征诊断试剂盒中至少包含用于扩增上述的mrkh综合征诊断标记物的pcr扩增引物。
[0012]
通过采集受检者外周血,提取基因组dna,而后采用上述的mrkh综合征诊断试剂盒检测基因组dna的tbx6基因上是否存在该突变位点c.839+5g>a,即可辅助mrkh综合征的快速诊断。
[0013]
本实施例的试剂盒对mrkh综合征诊断标记物的长度没有特殊要求,只要作为mrkh综合征诊断标记物的tbx6基因片段上包含上述突变位点即可。不过,为了pcr扩增引物特异、灵敏地对上述mrkh综合征诊断标记物进行检测,作为优选,所述的tbx6基因片段的长度为突变位点c.839+5g>a前后150-250bp。
[0014]
在上述的mrkh综合征诊断试剂盒中,所述的pcr扩增引物包括:
[0015]
上游引物:5
’-
tcacttaccactgcatttctga-3’;
[0016]
下游引物:5
’-
cttccccgagaccacattca-3’。
[0017]
作为优选,上述的mrkh综合征诊断试剂盒中还包含有:高保真pcr酶、缓冲液、脱氧核苷三磷酸和pcr增强剂。
[0018]
为了实现mrkh综合征的早期诊断,本发明还提供了上述mrkh综合征诊断标记物在制备胎儿mrkh综合征产前筛查试剂盒中的应用。通过在妊娠期进行mrkh综合征产前筛查,能够尽早了解胎儿是否患有mrkh综合征,从源头上降低出生缺陷婴儿的降生率。
[0019]
进一步地,本发明还提供了一种胎儿mrkh综合征产前筛查试剂盒,该胎儿mrkh综合征产前筛查试剂盒中至少包含用于扩增上述mrkh综合征诊断标记物的pcr扩增引物。
[0020]
由于带有该突变位点c.839+5g>a的患者患有mrkh综合征,但其母亲却仍能生育,表明该突变位点有可能是自体突变,也可能是遗传自父亲。若该突变位点是遗传自父亲,虽然父亲本身不致病,但却会导致其女性后代患mrkh综合征的可能性大大提高。因此,本发明还提供了上述mrkh综合征诊断标记物在制备男性孕前遗传病筛查试剂盒中的应用。
[0021]
进一步地,本发明还提供了一种男性孕前遗传病筛查试剂盒,该试剂盒中至少包含用于扩增上述mrkh综合征诊断标记物的特异性扩增引物。
[0022]
通过在孕前或婚前对男性tbx6基因上是否携带突变位点c.839+5g>a进行筛查,可以及早地避免mrkh综合征患儿的降生。
[0023]
本发明中,该胎儿mrkh综合征产前筛查试剂盒、男性孕前遗传病筛查试剂盒中所包含的内容物可以是与上述mrkh综合征诊断试剂盒相同的,仅使用场合和检测对象不同。
[0024]
与现有技术相比,本发明的有益效果体现在:
[0025]
(1)本发明通过对442名mrkh受试患者进行外显子组测序,首次在tbx6基因上发现了该突变位点c.839+5g>a,该突变位点经sanger测序确认为真性突变;经验证,该突变位点c.839+5g>a所在的六号内含子产生了新的剪接位点,导致tbx6基因上六号内含子前96bp碱基滞留在mrna中,进而导致tbx6基因产物失去功能而引发mrkh;基于此,本发明还提供了一种mrkh综合征诊断试剂盒,通过采集受检者外周血,提取基因组dna,而后采用上述的mrkh综合征诊断试剂盒检测基因组dna的tbx6基因上是否存在该突变位点c.839+5g>a,即可辅
助mrkh综合征的快速诊断。
[0026]
(2)为了实现mrkh综合征的早期诊断,本发明提供了上述mrkh综合征诊断标记物在制备胎儿mrkh综合征产前筛查试剂盒中的应用以及一种胎儿mrkh综合征产前筛查试剂盒,通过在妊娠期进行mrkh综合征产前筛查,能够尽早了解胎儿是否患有mrkh综合征,从源头上降低出生缺陷婴儿的降生率。
[0027]
(3)本发明mrkh综合征诊断标记物中存在的突变位点c.839+5g>a极有可能是遗传自父亲,该突变位点虽然对男性不致病,但却会导致其女性后代患mrkh综合征的可能性大大提高;因此,本发明还提供了一种男性孕前遗传病筛查试剂盒,通过在孕前或婚前对男性tbx6基因上是否携带突变位点c.839+5g>a进行筛查,可以及早地避免mrkh综合征患儿的降生。
附图说明
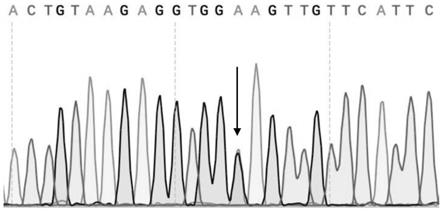
[0028]
图1为对受试mrkh患者外周血dna进行sanger测序结果图;箭头处为突变位点;
[0029]
图2为经minigene实验对受试mrkh患者带有突变位点c.839+5g>a的tbx6基因作功能验证的凝胶电泳分析结果图;
[0030]
其中,“wt”表示未发生突变的正常tbx6基因,“mt”表示存在突变位点c.839+5g>a的tbx6基因。
[0031]
图3为经minigene实验对受试mrkh患者带有突变位点c.839+5g>a的tbx6基因作功能验证的测序分析结果图;
[0032]
其中,“wt”表示未发生突变的正常tbx6基因,“c.839+5g>a”表示存在突变位点c.839+5g>a的tbx6基因,“exon”表示外显子。
具体实施方式
[0033]
下面结合附图和具体实施方式对本发明的技术方案做进一步详细说明。
[0034]
实施例
[0035]
本专利权人共招募了来自北京协和医院(pumch)和深圳罗湖医院的442名mrkh患者,通过妇科超声、盆腔mri、染色体核型分析和收集的医疗记录确诊为mrkh。每个受试者均签署了知情同意书,北京协和医院和深圳罗湖医院伦理委员会批准了这项研究。
[0036]
分别提取每个受试者的外周血dna,并对所有受试者进行了外显子组测序。从dna样品制备illumina配对末端文库并进行外显子组捕获,然后在illumina hiseq 4000平台上测序;使用内部开发的分析管道(peking union medical college pipeline,pump)调用和过滤变体。
[0037]
从外显子组数据中提取了所有tbx6基因(正常tbx6基因的核苷酸序列如seq no.1所示)存在的意义未明的基因突变,通过spliceai预测软件鉴定出一个可能影响剪切的突变位点c.839+5g>a,该突变位点在exac、gnomad数据库中均未报道,为专利权人首次发现的突变位点(突变后tbx6基因的核苷酸序列如seq no.2所示)。出现该突变位点的患者均为mrkh i型,即除了无子宫无阴道生殖系统畸形外,其他系统未发现异常。
[0038]
专利权人首先通过sanger测序确认该突变位点为真性突变,测序结果见图1,箭头处为突变位点;sanger测序所采用的引物如表1所示。
[0039]
表1
[0040]
上游引物5
’-
tcacttaccactgcatttctga-3’下游引物5
’-
cttccccgagaccacattca-3’[0041]
然后进一步采用minigene实验对上述突变位点c.839+5g>a对剪接产生的影响进行验证。验证方法如下:
[0042]
一、minigene表达载体的构建
[0043]
1、tbx6-minigene-mt突变型质粒的构建
[0044]
(1)突变型目的插入基因获取
[0045]
采用无缝克隆方式设计引物扩增携带tbx6(nm_004608.3c.839+5g>a)突变位点的人基因组dna,获得突变型目的插入基因(seq id no.2)。
[0046]
pcr扩增引物如表2所示。
[0047]
表2
[0048][0049]
pcr的反应体系及反应条件如表3所示。
[0050]
表3
[0051][0052]
1%琼脂糖凝胶回收上述pcr产物,回收后的产物命名为tbx6-839mini-mt pcr产物,于4℃下冷藏备用。
[0053]
(2)酶切
[0054]
采用xhoi/bamhi双酶切体系对载体pegfp-c1进行酶切,酶切体系如表4所示。
[0055]
表4
[0056]
pegfp-c110μlxhoi2μlbamhi2μl3.1buffer10μlddh2o76μl总计100μl
[0057]
在37℃下酶切0.5h后回收酶切产物。
[0058]
(3)重组
[0059]
将tbx6-839mini-mt pcr产物与pegfp-c1酶切产物重组,重组体系如表5所示。
[0060]
表5
[0061]
pegfp-c1酶切产物1μltbx6-839mini-mt pcr产物1μlexnase ii2μl5
×
ce ii buffer4μlddh2o12μl总计20μl
[0062]
将重组体系混匀后,置于37℃下重组反应30min,反应结束后立即将重组反应液冰浴5min。
[0063]
(4)转化
[0064]
向重组反应液中加入100μl top10感受态细胞,混匀,42℃热激60s,冰水浴120s,将转化好的混合物均匀涂在含有kan抗性的lb平板中,37℃过夜培养。
[0065]
(5)阳性克隆筛选与鉴定
[0066]
挑取lb平板上生长的单克隆进行鉴定,筛选出阳性克隆。阳性克隆鉴定引物如表6所示。
[0067]
表6
[0068]
pegfp-c-5
’5’-
catggtcctgctggagttcgtg-3’tbx6-839mini-cx-1r5
’-
ccaaacctatccttgcctca-3’[0069]
将阳性克隆送测序显示tbx6-minigene-mt突变型质粒构建成功。
[0070]
2、tbx6-minigene-wt野生型质粒的构建
[0071]
(1)野生型目的插入基因的获取
[0072]
以步骤1中构建好的tbx6-minigene-mt突变型质粒为模板,设计突变引物,经突变pcr扩增获得野生型目的插入基因(seq id no.1)。突变引物如表7所示。
[0073]
表7
[0074]
tbx6-839mini-wt-f5
’-
agaggtgggagttgttcattcatttgttcatgca-3’tbx6-839mini-wt-r5
’-
gaacaactcccacctcttacagtttctgccgt-3’[0075]
突变pcr的反应体系及反应条件如表8所示。
[0076]
表8
[0077][0078]
1%琼脂糖凝胶回收上述pcr产物,回收后的产物命名为tbx6-839mini-wt pcr产物,于4℃下冷藏备用。
[0079]
(2)重组
[0080]
重组体系如表9所示。
[0081]
表9
[0082]
tbx6-839mini-wt pcr产物1μlexnase ii2μl5
×
ce ii buffer4μlddh2o13μl总计20μl
[0083]
将重组体系混匀后,置于37℃下重组反应30min,反应结束后立即将重组反应液冰浴5min。
[0084]
(4)转化
[0085]
向重组反应液中加入100μl top10感受态细胞,混匀,42℃热激60s,冰水浴120s,将转化好的混合物均匀涂在含有kan抗性的lb平板中,37℃过夜培养。
[0086]
(5)阳性克隆筛选与鉴定
[0087]
挑取lb平板上生长的单克隆进行鉴定,筛选出阳性克隆。阳性克隆鉴定引物与表5相同。
[0088]
将阳性克隆送测序显示tbx6-minigene-wt野生型质粒构建成功。
[0089]
二、细胞转染
[0090]
1、根据试剂盒说明书提取去内毒素质粒,并且确保260/280数值在1.8-2.0之间;
[0091]
2、转染前一天分别将293t细胞接种至35mm培养皿,直至细胞密度生长至60%左右;
[0092]
3、将tbx6-minigene-wt野生型质粒和tbx6-minigene-mt突变型质粒分别转染4μg至接种好的293t细胞;
[0093]
4、6小时后换液。
[0094]
三、pcr和测序检测
[0095]
1、转染48h后,收集细胞,提取rna;
[0096]
2、根据试剂盒说明书。将rna反转录为cdna;
[0097]
3、设计引物进行pcr扩增及产物测序,引物序列如表10所示(野生型和突变型一样)。
[0098]
表10
[0099]
pegfp-c-5'5
’-
catggtcctgctggagttcgtg-3’pegfp-c-3'5
’-
tatggctgattatgatcagt-3’[0100]
pcr反应体系和反应条件如表11所示。
[0101]
表11
[0102][0103]
1%琼脂糖凝胶分析pcr产物,分析结果如图2所示;凝胶回收上述pcr产物并送测序,测序分析结果见图3。
[0104]
由图2可见,从tbx6-minigene-mt突变型质粒扩增获得的目标条带的片段大小大于从tbx6-minigene-wt野生型质粒扩增获得的目标条带的片段大小。
[0105]
由图3可见,tbx6-minigene-mt突变型质粒中,tbx6基因在突变位点c.839+5g>a所在的六号内含子中产生了新的剪接位点,造成了六号内含子前96bp碱基滞留在mrna中(这与图2的分析结果相一致),从而导致tbx6基因产物失去功能,最终引发mrkh。
[0106]
在上述实验结果的基础上,专利权人推出一种mrkh综合征诊断试剂盒、一种胎儿mrkh综合征产前筛查试剂盒和一种男性孕前遗传病筛查试剂盒,上述试剂盒中均包含有表1所示的特异扩增引物,用以sanger测序。
[0107]
其中,mrkh综合征诊断试剂盒可用于对疑似mrkh综合征女性患者进行mrkh筛查,作为mrkh综合征确诊的辅助手段。
[0108]
而胎儿mrkh综合征产前筛查试剂盒则用于在妊娠期对胎儿进行mrkh综合征产前
筛查,能够尽早了解胎儿是否患有mrkh综合征,降低出生缺陷。男性孕前遗传病筛查试剂盒则用于在孕前或婚前对男性进行遗传病筛查,查看男性tbx6基因上是否携带突变位点c.839+5g>a,以及早地避免mrkh综合征患儿的降生。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1