一种快速鉴定大量群体洋葱细胞核育性的KASP标记及其应用的制作方法
一种快速鉴定大量群体洋葱细胞核育性的kasp标记及其应用
技术领域
[0001]
本发明属于分子生物技术领域,具体涉及一种快速鉴定大量群体洋葱细胞核育性的kasp标记及其应用。
背景技术:
[0002]
公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
[0003]
洋葱(allium cepa l.)为石蒜科葱属二年生蔬菜,是世界上广泛种植的重要蔬菜之一,种植面积仅次于番茄和马铃薯,总产量在所有蔬菜作物中居第三位(fao,2018)。洋葱是我国重要的出口创汇特色蔬菜,面积和产量均居世界首位。洋葱不仅可鲜食,还大量用于加工制品,富含多种硫化物和糖类是其具有独特风味的主要原因。从医疗保健角度来讲,洋葱具有抗血栓、促进血液循环、抗癌等功效,其营养和医疗价值逐渐被全世界所公认。
[0004]
洋葱起源于中亚地区,在我国栽培历史较短,品种资源相对匮乏。在杂交种选育方面远远落后于日本、美国、荷兰等国家。目前高端品种通常需要进口,种子价格是国产同类型品种的2~3倍,甚至更多。随着农业产业结构的调整,对洋葱优良品种的需求日益增加,生产上主要以品种引进和常规品种选育为主,缺少具有我国自主知识产权的杂交一代品种,需要花费大量的外汇从国外进口种子,使生产成本居高不下。
[0005]
洋葱是最早应用细胞质雄性不育系进行杂交种选育的蔬菜作物,杂交种生产主要利用质核互作的cms-s雄性不育系统,其不育性是由不育的细胞质因子(s)和一对核隐性单基因(msms)共同控制的,不育系的基因型为s(msms),保持系的基因型为n(msms)。因此杂交种选育的关键环节是不育系及其保持系的选育。由于洋葱是两年生异花授粉蔬菜,自交衰退严重,通过传统的测交方法鉴定雄性不育基因型需要4~8年时间,具有费时、费工、效率低的问题。利用常规育种与分子标记辅助育种相结合能够。利用细胞质雄性不育基因分子标记辅助选择技术,可以大大提高洋葱雄性不育系及其保持系的选择效率。
[0006]
由于洋葱基因组dna巨大(17.9pg),每1条染色体上的核苷酸有15,290mbp,是玉米基因组的6倍、番茄的16倍、拟南芥的107倍。cms-s系统的核基因标记与其他大多数蔬菜作物相比研究进展缓慢,但也取得了实质性进展。目前比较有效的几个分子标记用于核基因ms位点的分子标记。aob272、opt和psao三个标记在与之连锁遗传的分离群体中,能够用于保持系的选育,但不能应用于未知背景的群体,只能减少分离群体测交的工作量,不能缩短选育进程。本研究团队开发的与洋葱雄性不育基因ms和育性恢复基因ms紧密连锁的共分离scar标记,可以鉴定出洋葱单株在ms位点的基因型,但是需要两次pcr扩增才可以确定。最近,huo等(2015)开发出共显性的pcr分子标记acskp1,可通过一次pcr鉴定ms位点的基因型。这些标记的开发与应用有效的避免了保持系筛选的盲目性,提高了选择效率。但是,发明人发现,这些标记均以pcr为基础,然后进行电泳来判断细胞核的育性,虽然较田间鉴定快速的多,但是每次最多只能检测96个样品,对于大量样本检测来说,检测效率偏低,扩增
结果不太稳定,具有一定的局限性。
技术实现要素:
[0007]
针对上述现有技术,经长期的技术与实践探索,本发明提供一种快速鉴定大量群体洋葱细胞核育性的kasp标记及其应用,其可用于辅助选育洋葱雄性不育系和配套保持系,具有高通量、低成本和高准确性的特点,将在洋葱细胞核基因型大量群体的检测中发挥重要作用,因此具有良好的实际应用之价值。
[0008]
本发明是通过如下技术方案实现的:
[0009]
本发明的第一个方面,提供一种快速鉴定大量群体洋葱细胞核育性的kasp标记,用于扩增所述kasp标记的引物核苷酸序列如下:
[0010]
seq id no.1(kasp-ms):
[0011]
5'-gcaacatcttcttctacttgttgtataga-3';
[0012]
seq id no.2(kasp-ms):
[0013]
5'-gcaacatcttcttctacttgttgtatagt-3';
[0014]
seq id no.3(kasp-c):
[0015]
5'-tcatttatatggrtaaaaactgctgatggc-3'。
[0016]
优选的,序列1和序列2的5'端还设计有荧光标签;
[0017]
更优选的,所述序列1的5'端设计有第一荧光标签,所述序列2的5'端设计有第二荧光标签,所述第一荧光标签和第二荧光标签并不相同;在本发明的一个具体实施方式中,所述第一荧光标签可以为fam,所述第二荧光标签可以为hex。
[0018]
因此,所述用于扩增所述kasp标记的引物核苷酸序列如下:
[0019]
seq id no.4:下划线部分为fam荧光标签序列
[0020]
5'-gaaggtgaccaagttcatgcgcaacatcttcttctacttgttgtataga-3';
[0021]
seq id no.5:下划线部分为hex荧光标签序列
[0022]
5'-gaaggtcggagtcaacggagcaacatcttcttctacttgttgtatagt-3';
[0023]
seq id no.3:
[0024]
5'-tcatttatatggrtaaaaactgctgatggc-3'。
[0025]
本发明的第二个方面,提供上述kasp标记的扩增引物,所述扩增引物包括:
[0026]
seq id no.1(kasp-ms):
[0027]
5'-gcaacatcttcttctacttgttgtataga-3';
[0028]
seq id no.2(kasp-ms):
[0029]
5'-gcaacatcttcttctacttgttgtatagt-3';
[0030]
seq id no.3(kasp-c):
[0031]
5'-tcatttatatggrtaaaaactgctgatggc-3'。
[0032]
优选的,序列1和序列2的5'端还设计有荧光标签;
[0033]
更优选的,所述序列1的5'端设计有第一荧光标签,所述序列2的5'端设计有第二荧光标签,所述第一荧光标签和第二荧光标签并不相同;在本发明的一个具体实施方式中,所述第一荧光标签可以为fam,所述第二荧光标签可以为hex。
[0034]
因此,所述用于扩增所述kasp标记的引物核苷酸序列如下:
[0035]
seq id no.4:下划线部分为fam荧光标签序列
[0036]
5'-gaaggtgaccaagttcatgcgcaacatcttcttctacttgttgtataga-3';
[0037]
seq id no.5:下划线部分为hex荧光标签序列
[0038]
5'-gaaggtcggagtcaacggagcaacatcttcttctacttgttgtatagt-3';
[0039]
seq idno.3:
[0040]
5'-tcatttatatggrtaaaaactgctgatggc-3'。
[0041]
本发明的第三个方面,提供上述kasp标记和/或kasp标记的扩增引物在快速鉴定大量群体洋葱细胞核育性中的应用。
[0042]
本发明的第四个方面,提供一种快速鉴定大量群体洋葱细胞核育性的方法,所述方法包括:
[0043]
基于上述kasp标记的扩增引物对待测洋葱材料的基因组dna进行pcr扩增;检测并判断pcr扩增产物中多态位点的基因型。
[0044]
具体的,所述pcr扩增的反应程序包括:94℃预变性15min;94℃变性20s,61-55℃退火1min(每一个循环降低0.6℃),10个循环;94℃变性20s,55℃退火1min,26-29个循环。
[0045]
更具体的,所述方法包括:
[0046]
a)提取待测洋葱材料的总dna;
[0047]
b)将样本从96孔板中转移至384孔板中,再最终转移至1536孔板中,确保样本dna终浓度约为10ng/μl;
[0048]
c)将装有dna样本的1536孔板进行干燥处理;
[0049]
d)干燥后的dna样本进行pcr体系构建;优选的,每个反应仅需1μl反应体系,包括10ng dna、0.5μl kasp标记的扩增引物、2x master mix standard rox、0.014μl kasp-by-design assay mix、ddh
2
o补至1μl;
[0050]
e)将加好反应体系的孔板进行封膜,并低速快速离心;
[0051]
f)离心后进行水浴pcr,反应程序包括94℃预变性15min;94℃变性20s,61-55℃退火1min(每一个循环降低0.6℃),10个循环;94℃变性20s,55℃退火1min,26-29个循环;
[0052]
g)将完成反应的孔板,吹干降温后在酶标仪pherastar上进行读板,采用snpviewer2软件对扫描数据进行分析,根据分析结果确定洋葱细胞核的基因型即检测洋葱样品的细胞核育性。
[0053]
更具体的,若待测个体扩增产物的荧光信号呈红色圆点标记,则该洋葱样本的细胞核基因型为隐形纯合的msms;若待测洋葱扩增产物的荧光信号呈蓝色圆点标记,则该洋葱样本的细胞核基因型为显性纯合的msms;若待测洋葱扩增产物的荧光信号呈绿色圆点标记,则该洋葱样本的基因型为杂合的msms。
[0054]
本发明的第五个方面,提供上述kasp标记、kasp标记的扩增引物和/或鉴定方法在洋葱雄性不育系和配套保持系选育中的应用。
[0055]
本发明的第六个方面,提供一种检测试剂盒,所述检测试剂盒包含上述kasp标记的扩增引物。
[0056]
具体的,所述试剂盒还包括荧光探针以及pcr体系构建所需试剂。
[0057]
上述一个或多个技术方案取得的有益技术效果:
[0058]
(1)快速、高效、高通量:利用本发明的kasp标记引物,对洋葱细胞核的基因型进行
检测,可用于96孔板、384孔板、1536孔板的高通量pcr,通过读板后的数据显示即可快速、高通量的判断细胞核类型,大大提高了检测效率,减少时间和人工成本,非常有利于洋葱田间育种材料高通量的基因分型选择,而且特别适用于大量样本的操作。
[0059]
(2)标记稳定便捷:对已知细胞核基因型的洋葱材料进行验证,其鉴定结果与表型完全一致。且与现有的scar标记相比,上述技术方案中的kasp标记引物筛选方法简单易行,pcr反应结束后不需要进行任何电泳,只需要利用酶标仪pherastar读板后即可确定洋葱细胞核的基因型,扩增效率高,结果准确可靠,方便快捷,成本低,可以实现实验操作的批量化、自动化、标准化,因此具有良好的实际应用之价值。
附图说明
[0060]
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
[0061]
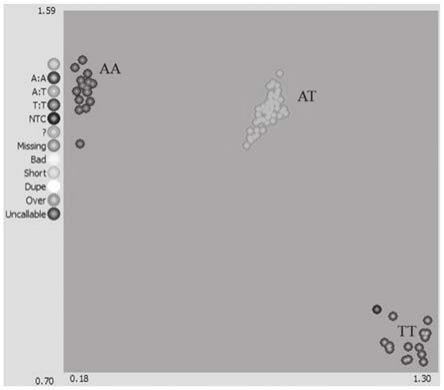
图1为本发明实施例1中kasp分子标记的分型聚类图。
[0062]
图2为本发明实施例2中利用成熟的scar分子标记对kasp标记检测结果的验证。其中:1-19、41-59、81-95分别为来源于op群体的杂交种152、172、153;21-39、61-79分别为来源于不同自交系的杂交种121、132;20、40为阳性对照303,细胞核基因型为msms;60、80为阳性对照203,细胞核基因型为msms;96为无模板对照ntc;m为dna分子量标准dl2000。
具体实施方式
[0063]
应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
[0064]
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。
[0065]
结合具体实例对本发明作进一步的说明,以下实例仅是为了解释本发明,并不对其内容进行限定。如果实施例中未注明的实验具体条件,通常按照常规条件,或按照试剂公司所推荐的条件;下述实施例中所用的试剂、耗材等,如无特殊说明,均可从商业途径得到。
[0066]
如前所述,现有针对洋葱细胞质雄性不育基因分子标记检测效率偏低,扩增结果不太稳定,具有一定的局限性。
[0067]
有鉴于此,本发明提供一种快速准确鉴定大量群体洋葱细胞核类型的kasp标记及相应扩增引物,其可用于辅助选育洋葱雄性不育系和配套保持系,具有高通量、低成本和高准确性的特点,将在洋葱细胞核基因型大量群体的检测中发挥重要作用。
[0068]
具体的,一种鉴定洋葱细胞核类型的kasp标记,其包括kasp-ms、kasp-ms和kasp-c,用于扩增所述标记的引物核苷酸序列如序列表中序列3-5所示:
[0069]
seq id no.4:下划线部分为fam荧光标签序列
[0070]
5'-gaaggtgaccaagttcatgcgcaacatcttcttctacttgttgtataga-3';
[0071]
seq id no.5:下划线部分为hex荧光标签序列
[0072]
5'-gaaggtcggagtcaacggagcaacatcttcttctacttgttgtatagt-3';
[0073]
seq id no.3:
[0074]
5'-tcatttatatggrtaaaaactgctgatggc-3'。
[0075]
需要说明的是,所述荧光标签序列还可以采用其他本领域通用的荧光标签序列。
[0076]
kasp是竞争性等位基因特异性pcr标记(kompetitiveallele specific pcr,kasp),可在广泛的基因组dna样品中*(甚至是一些复杂基因组的dna样品),对snps和特定位点上的indels进行精准的双等位基因判断。此种标记具有高通量、低成本和高准确性的特点,在分子标记辅助育种应用中具有重要作用。
[0077]
本发明中,依据genbank数据库中洋葱skp1-ms(genbank no.km065384.1)以及skp1-ms(genbank no.km065385.1)基因序列的snp突变位点信息,设计特有的成套kasp引物,由两条上游引物(kasp-ms、kasp-ms)和一条下游引物(kasp-c)组成,两条上游引物5'端连接有荧光标签序列,3'末端包含等位变异碱基t/a,用于区分等位基因,引物kasp-ms和kasp-c扩增读出可育的细胞核类型msms,kasp-ms和kasp-c扩增读出不育的细胞核类型msms,如果是杂合型的,kasp-ms,kasp-ms都有可以与kasp-c扩增。pcr反应结束后,酶标仪pherastar上进行读板,采用snpviewer2软件对扫描数据进行分析,根据分析结果确定洋葱细胞核的基因型,若待测个体扩增产物的荧光信号数据经snpviewer2分析后呈红色圆点标记,则该洋葱样本的细胞核基因型为隐形纯合的msms;若待测洋葱扩增产物的荧光信号呈蓝色圆点标记,则该洋葱样本的细胞核基因型为显性纯合的msms;若待测洋葱扩增产物的荧光信号呈绿色圆点标记,则该洋葱样本的基因型为杂合的msms。若待测样本扩增产物的荧光信号数据经snpviewer2分析后呈粉色,则为无效结果。
[0078]
以下通过实施例对本发明做进一步解释说明,但不构成对本发明的限制。应理解这些实施例仅用于说明本发明而不用于限制本发明的范围。
[0079]
实施例1 kasp标记及检测方法的建立
[0080]
(一)kasp标记引物序列的获得
[0081]
依据genbank数据库中洋葱skp1-ms(genbank no.km065384.1)以及skp1-ms(genbank no.km065385.1)基因序列的snp突变位点信息,采用primer premier 5.0和primer 3.0(http://bioinfo.ut.ee/primer3-0.4.0/primer3/input.htm)设计特有的成套kasp标记引物,由两条上游引物(kasp-ms、kasp-ms)和一条下游引物(kasp-c)组成,引物核苷酸序列如序列表中seq id no.1、seq id no.2和seq id no.3所示。
[0082]
seq id no.1(kasp-ms):
[0083]
5'-gcaacatcttcttctacttgttgtataga-3';
[0084]
seq id no.2(kasp-ms):
[0085]
5'-gcaacatcttcttctacttgttgtatagt-3';
[0086]
seq id no.3(kasp-c):
[0087]
5'-tcatttatatggrtaaaaactgctgatggc-3'。
[0088]
两条上游引物5'端连接有荧光标签序列,3'末端包含等位变异碱基t/a,其中引物kasp-ms的5'端连接fam荧光标签序列:5'-gaaggtgaccaagttcatgc-3'(seq id no.6),引物
kasp-ms的5'端连接为hex荧光标签序列:5'-gaaggtcggagtcaacgga-3'(seq id no.7)。上述引物序列由上海贝晶生物技术有限公司合成。
[0089]
(二)kasp标记的检测
[0090]
利用父本自交系303[基因型为s(msms)]与不育系203[基因型为s(msms)]杂交后获得的f
1
代,在亲本和杂交后代中随机选择96个样品作为样本群体。
[0091]
a)洋葱材料总dna提取方法采用北京全式金生物技术有限公司生产的plantzol基因组提取试剂盒,提取方法参照说明书。琼脂糖凝胶电泳检测dna的浓度和质量。
[0092]
b)用核苷酸序列如序列表中seq no.4、seq no.5和seq no.3所示的引物进行pcr反应。
[0093]
c)将样本从96孔板中通过replikator转移至384孔板中,再最终转移至1536孔板中,确保样本dna终浓度约为10ng/μl;
[0094]
d)将装有dna的1536孔板置于65℃烘箱中干燥30min;
[0095]
e)干燥后的dna进行pcr体系构建,每个反应仅需1μl反应体系,包括10ng dna,0.5μl kasp标记引物,2x master mix standard rox(lcg genomics,teddington,middlesex,uk,beverly,ma,usa)和0.014μl kasp-by-design assay mix(lgc genomics,beverly,ma,usa),ddh
2
o补至1μl;
[0096]
f)将加好反应体系的孔板进行封膜,并低速快速离心;
[0097]
g)离心后进行水浴pcr,反应程序包括94℃预变性15min;94℃变性20s,61-55℃退火1min(每一个循环降低0.6℃),10个循环;94℃变性20s,55℃退火1min,26-29个循环;将完成反应的孔板,吹干降温后在酶标仪pherastar上进行读板,采用snpviewer2软件对扫描数据进行分析,根据分析结果确定洋葱细胞核的基因型,若待测个体扩增产物的荧光信号数据经snpviewer2分析后呈红色圆点标记,则该洋葱样本的细胞核基因型为隐形纯合的msms;若待测洋葱扩增产物的荧光信号呈蓝色圆点标记,则该洋葱样本的细胞核基因型为显性纯合的msms;若待测洋葱扩增产物的荧光信号呈绿色圆点标记,则该洋葱样本的基因型为杂合的msms(图1)。
[0098]
实施例2利用scar分子标记对kasp分子标记检测结果进行验证。
[0099]
参试的洋葱杂交材料共5组:其中121和132来源于不同遗传背景的自交系[基因型为s(msms)],152、153和172为来源于op群体的杂交种。
[0100]
对上述不同来源的5组杂交材料进行kasp标记验证,细胞核基因型为隐形纯合的msms的洋葱个体扩增产物的荧光信号呈红色圆点标记;细胞核基因型为显性纯合的msms的洋葱个体扩增产物的荧光信号呈蓝色圆点标记;基因型为杂合的msms的洋葱个体扩增产物的荧光信号呈绿色圆点标记。基因型汇总结果见表1。
[0101]
表1 kasp分子标记分型结果
[0102][0103][0104]
利用已开发的可以准确鉴定洋葱细胞核基因型的scar分子标记对上述5组不同来源的杂交种进行细胞核基因型鉴定,scar分子标记检测洋葱细胞核基因型的具体方法参考已授权发明专利zl201410256193.7,具体如下:
[0105]
pcr扩增引物:
[0106]
fn1:5'-atacacagcttctagctgaattttta-3'(seq id no.8);
[0107]
fn2:5'-tgtgtgtgtaatttctctgtgcg-3'(seq id no.9);
[0108]
rn1:5'-acagagtgagaaattttatatatataggaat-3'(seq id no.10);
[0109]
rn2:5'-cggaagattaatattttgcgtatacat-3'(seq id no.11)。
[0110]
用上述引物扩增不同来源杂交群体的dna。pcr产物经1%琼脂糖凝胶电泳分析检测多态性。细胞核基因型为msms的样本只扩增出886bp的片段,细胞核基因型为msms的样本扩增出886bp和621bp两条谱带,细胞核基因型为msms的样本只扩增出621bp的谱带(图2)。
[0111]
利用scar分子标记对不同来源杂交群体的分析结果见图2,可见,该发明的判断结果与kasp分型结果完全一致。
[0112]
最后应该说明的是,以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分进行等同替换。凡在本发
明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。上述虽然结合附图对本发明的具体实施方式进行了描述,但并非对本发明保护范围的限制,所属领域技术人员应该明白,在本发明的技术方案的基础上,本领域技术人员不需要付出创造性劳动即可做出的各种修改或变形仍在本发明的保护范围以内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1