一种去氢孕酮的合成方法与流程
[0001]
本发明涉及医药制备领域,特别涉及一种去氢孕酮的合成方法。
背景技术:
[0002]
去氢孕酮又名地屈孕酮,英文名称为:dydrogesterone,化学名为9β,10α-孕甾-4,6-二烯-3,20-二酮,主要应用于女性生育和生殖保健等方面,既广泛用于保胎及预防流产,还广泛用于治疗内源性孕酮不足引起的各种疾病,如:痛经、子宫内膜异位症、继发性闭经、月经周期不规则、功能失调性子宫出血、经前期综合征、孕激素缺乏所致先兆性流产或习惯性流产、黄体不足所致不孕症等。
[0003]
目前市场上销售的产品均来自于苏威公司,除其之处国内外暂时无法进行大规模工业化生产的厂家。虽然现有文献及专利都报道了不同的合成工艺路线,但均停留在小试阶段,不能进行放大生产。
[0004]
专利号gb929271,公开日19630619的专利,公开了以光甾-4,7,22-三烯-3-酮为原料经4步反应来合成地屈孕酮。其中,其起始原料难得,每步反应的收率低,不满足进行大规模工业化生产的条件。
[0005]
据荷兰皇家化学会社(1960,79,p771)报道,荷兰的苏威制药公司生产去氢孕酮产品的原料药,采用的工艺路线是:采用生产维生素d的副产物——光甾醇经沃氏氧化、重排、锂氨还原、臭氧化、20位络合、氧化、脱氢等化学反应得到去氢孕酮产品,其中,参与反应的部分原料不易得,且部分反应条件苛刻,如臭氧化反应过程中需要用到臭氧,反应温度需达-80℃,反应条件苛刻造成工业化生产难度和生产成本高。该方法存在反应步骤较长,收率较低(总收率只约3%),成本较高等缺陷。
[0006]
专利号us3198792,公开日19650803的专利,公开了以反式孕酮为原料,以四氯苯醌为氧化剂来合成地屈孕酮的方法.其具有反应路线短的优势,但反式孕酮并非天然产物,而合成得到反式孕酮却很困难,市场上不存在该工业化产品。故而不具备进行大规模工业化生产的条件。
[0007]
此外,还有相关专利公开了地屈孕酮合成的关键中间体的合成方法:
[0008]
专利申请号ep93200423.7,公开日20140611,公开了以中、高压汞灯为光源,以9α,10β-去氢黄体酮二乙二缩醛为原料来制备9β,10α-去氢黄体酮二乙二缩酮的方法。
[0009]
专利申请号cn201010621400.6,公开日20140423,公开了通过高压汞灯作为光源,以9-α,10-β-去氢黄体酮缩酮为原料合成9-β,10-α-去氢黄体酮缩酮的方法。
[0010]
现有各种合成工艺,包括普通化学合成和光化学合成,其中化学合成方法存在合成路线长、收率低,不容易放大生产等缺陷。而光化学合成虽然简单,但会存在单次反应收率低、异构体杂质多等缺陷,更重要的是受限于现有的光电技术,采用光化学合成方法,其放大生产遇到很大阻碍。
[0011]
鉴于地屈孕酮全球市场庞大,且该药品现有厂家的垄断地位,患者的用药成本不言而喻。因此亟待开发一种可以适合工业化生产的工艺路线,这样既能解决药品来源的问
题,又能创造可观的经济价值和重要的社会价值。
技术实现要素:
[0012]
现有的合成去氢孕酮的方法存在收率低,技术受限不容易放大生产等问题。为解决上述问题,本发明提供一种去氢孕酮的合成方法,其包括以下步骤:
[0013]
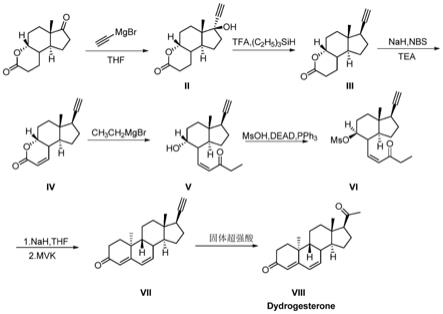
s100、将a环降解物与乙炔卤化镁进行加成反应得到化合物ii;与传统的方法相比较,本发明以廉价易得的a环降解物为起始合成原料,通过简单的格氏反应,即可得化合物ii。
[0014]
s200、对化合物ii进行脱羟基反应,且构型翻转得到得到化合物iii;
[0015]
s300、在碱性条件下,化合物iii与溴代试剂进行酯基α氢溴代反应后,采用有机碱进行消除反应,得到化合物iv;s300中经历两个阶段,首先在碱的作用下,酯基α氢被溴取代;接着用碱进行消除反应,生成重要的中间体化合物iv。其中,所述有机碱可采用三乙胺、dipea、dbu、pyridine等有机碱,优选三乙胺。
[0016]
s400、将化合物iv和乙基卤化镁进行格氏反应生成化合物v;所述乙基卤化镁可采用如乙基溴化镁、乙基氯化镁等常用格氏试剂。
[0017]
s500、将化合物v与甲磺酸或对甲苯磺酸进行mitsunobu反应生成化合物vi;s500中的反应手性控制也是本发明的重点。根据经典的mitsunobu反应,即将手性醇转化为构型翻转且易离去的磺酸酯基。
[0018]
s600、在碱性条件下,化合物vi进行分子内robinson增环反应,而后加入mvk试剂进行二次robinson增环反应,生成的化合物vii;s600中robinson增环反应的手性控制也具有同等重要意义,本发明采用一锅法,两次增环反应,利用分子内空间位阻效应,合成化合物vii。
[0019]
s700、加入酸试剂,化合物vii与水加成并重排反应生成化合物viii,即得到去氢孕酮;s700中,化合物vii的末端炔基在酸催化下,与水加成后再重排,得化合物viii,即去氢孕酮粗品,粗品经重结晶得到去氢孕酮产物纯品。
[0020]
其中,所述化合物ii的结构式为:所述化合物iii的结构式为:所述化合物iv的结构式为:所述化合物v的结构式为:
所述化合物vi的结构式为:所述化合物vii的结构式为:所述化合物viii的结构式为:
[0021]
优选地,所述s100中的反应温度控制在-60~-40℃。由于受反应选择性的影响,设计反应在低温下进行,优选温度范围为-60~-40℃,温度过低反应速度过慢,且降温能耗高;温度过高则反应选择性较差,杂质明显增多。
[0022]
优选地,所述s400中反应温度控制在-20~-10℃。
[0023]
优选地,所述s100中的乙炔卤化镁的用量为1~1.1摩尔当量。
[0024]
优选地,所述s400中的乙基卤化镁的用量为1~1.05摩尔当量。
[0025]
优选地,所述s300中,所述溴代试剂为n-溴代丁二酰亚胺。
[0026]
优选地,所述s500中还包括三价膦试剂和偶氮试剂。所述三价膦试剂可采用如三苯基膦、三丁基膦、三环己基膦等mitsunobu反应常用三价膦试剂,所述偶氮试剂可以是dead(即偶氮二甲酸二乙酯)、diad(即偶氮二甲酸二异丙酯)、diea等mitsunobu反应常用偶氮试剂。
[0027]
优选地,s700中,所述酸试剂包括了固体超强酸、无机酸;所述酸试剂首选固体酸超强,同时也可以是硫酸等其它无机酸。
[0028]
优选地,所述s700中,还包括了催化剂,所述催化剂为汞盐催化剂。
[0029]
优选地,所述s200中在et3sih/tfa还原体系中进行脱羟基反应。脱羟基反应过程中,三级醇,即化合物ii在三氟乙酸,即tfa的作用下,脱去羟基生成碳正离子,与s100相似,由于受邻位甲基的位阻效应,导致三乙基硅烷,即et3sih中的氢负离子进攻碳正离子时,只能从位阻小的反式进攻,其构型翻转生成化合物iii。
[0030]
优选地,所述s100、s200、s300、s500以及s600中溶剂为四氢呋喃;所述s400中溶剂为四氢呋喃或乙醚;所述s700中溶剂为水和四氢呋喃或二氧六环的混合液。
[0031]
优选地,所述s100中加成反应后还进行淬灭反应;所述s400中格氏反应后还进行淬灭反应;所述s500中mitsunobu反应后还进行淬灭反应。
[0032]
本发明提供的去氢孕酮的合成方法,与现有的技术相比,具有以下有益效果:现有
的合成方法的大多以黄体酮为起始原料,而本发明以a环降解物为起始原料,利用它分子内固有的手性构型,不断地利用空间位阻效应,实现各步的手性控制;同时a环降解物的价格是黄体酮的十分之一,具有价格优势;且本发明具有中间体手性选择性高,易于纯化、异构体杂质少等优势,故而产物收率高;本发明合成步骤简短、操作简单、对设备的要求低,所有步骤均为常规化学反应且试剂简单易得,容易实现工业化生产。
附图说明
[0033]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
[0034]
图1为本发明提供的实施例1中目标产物去氢孕酮的合成工艺路线;
[0035]
图2为本发明提供的实施例1中s100的反应中手性诱导机理示意图;
[0036]
图3为本发明提供的实施例1中s200的反应中脱羟基手性翻转过程示意图;
[0037]
图4为本发明提供的实施例1中s600的robinson增环反应机理示意图;
[0038]
图5为本发明提供的实施例1中目标产物去氢孕酮的1h-nmr图;
[0039]
图6为本发明提供的实施例1中目标产物去氢孕酮的
13
c-nmr图。
具体实施方式
[0040]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合附图对本发明实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0041]
本发明提供如下所示实施例:
[0042]
实施例1:
[0043]
提供了如图1-4中实施例1所示的去氢孕酮的合成方法,具体步骤如下:
[0044]
s100:在装有滴液漏斗、温度计及机械搅拌的5l四口瓶中分别加入a环降解物(200g,0.9mol),thf(2000ml,10v/w),氮气保护,接着开启搅拌并降温至≤-50℃,再将0.5m的乙炔基溴化镁四氢呋喃溶液(1.9l,0.95mol,1.05eq)滴加到上述反应体系,控制反应温度不超过-45℃,滴加结束,再恒温搅拌30min。tlc监控反应结束后,将上述反应液倒入氯化铵饱和溶液中淬灭,静置分层后水相再萃取一次,合并有机相使用饱和氯化钠溶液洗涤、无水硫酸钠干燥、过滤、浓缩,得淡黄色油状物,即化合物ii(210g,收率92%)。
[0045]
s200:将上述所得淡黄色油状物,即化合物ii(210g,0.85mol)溶解于四氢呋喃3l中,并转移至装有温度计、机械搅拌及滴液漏斗的5l反应釜中,氮气保护,将上述体系降温至-10℃,再滴加三氟乙酸(290g,2.55mol,3eq),控制反应温度不超过0℃。三氟乙酸加入结束后,再将三乙基硅烷(296g,2.55mol,3eq)滴加至反应体系,控制反应温度不超过0℃,并恒温反应过夜。tlc监控反应结束。将反应液倒入冰水中,静置、分层后水相再使用乙酸乙酯萃取。合并有机相分别使用饱和碳酸氢钠、饱和氯化钠洗涤、无水硫酸钠干燥、过滤、浓缩,得到化合物iii(196g,0.84mol,收率86%)。
[0046]
s300:在装有滴液漏斗、温度计及机械搅拌的5l四口瓶中加入2l的四氢呋喃并降温至0℃,在氮气保护下,缓慢的加入氢化钠(71g,1.77mol,2.1eq,60%含量分散于矿物油中),然后再将体系降温并维持在≤-10℃。10min后,将溶解于300ml四氢呋喃的化合物iii(196g,0.84mol),缓慢的加入至反应体系,控制滴加速度,使反应温度≤-5℃,滴加结束,再恒温30min。将nbs(315g,1.77mol,2.1eq)溶解于500ml的四氢呋喃溶液中,再缓慢地滴加至上述体系中,控制反应温度≤0℃,滴加结束,自然回温并室温过室。反应结束后,将反应液缓慢地倒入饱和氯化铵溶液中,分层后水相再使用乙酸乙酯萃取一次。合并有机相,使用饱和氯化钠洗涤、无水硫酸钠干燥、过滤、浓缩、得到油状物溴代中间体。
[0047]
在该溴代中间体中加入dmf(500ml,2.5v/w),tea(179g,1.77mol,2.1eq),并加热至80℃反应4h。反应结束后,倒入3l冰水中使用乙酸乙酯萃取两次。合并有机相,分别使用1m的盐酸溶液洗涤至ph<6、饱和氯化钠洗涤、无水硫酸钠干燥、过滤、浓缩得粗品化合物iv。再经过硅胶柱纯化,得纯品化合物iv(128g,0.56mol,收率66%)。
[0048]
s400:在装有滴液漏斗、温度计及机械搅拌的3l四口瓶中分别加入化合物iv(128g,0.56mol),thf(1300ml,10v/w),接着将上述混合体系降温至内温≤-10℃。并恒温搅拌10min,再将2.0m的乙基溴化镁四氢呋喃溶液(295ml,0.59mol,1.05eq)滴加到上述反应体系,控制反应温度不超过-15℃。滴加结束,再恒温搅拌30min。tlc监控反应结束后,将上述反应液倒入至氯化铵饱和中淬灭,静置分层后水相再萃取一次,合并有机相使用饱和氯化钠溶液洗涤、无水硫酸钠干燥、过滤、浓缩,得淡黄色油状物,即化合物v(133g,收率92%)。
[0049]
s500:在装有滴液漏斗、温度计及机械搅拌的3l四口瓶中分别加入化合物v(133g,0.51mol),thf(1300ml,10v/w)和三苯基膦(160g,0.61mol,1.2eq),接着将上述混合体系降温至内温≤-0℃,并搅拌10min,再将dead(106g,0.61mol,1.2eq)滴加到上述反应体系,控制反应温度不超过5℃,滴加结束,再恒温搅拌60min。最后将甲磺酸滴加至反应液,控制反应温度不超过5℃,滴加完再继续反应4h。tlc监控反应结束后,将上述反应液倒入至氯化铵饱和中淬灭,静置分层后水相再萃取一次,合并有机相使用饱和氯化钠溶液洗涤、无水硫酸钠干燥、过滤、浓缩,得淡黄色油状物,即化合物vi(151g,收率87%)。
[0050]
s600:在装有滴液漏斗、温度计及机械搅拌的5l四口瓶中加入2l的四氢呋喃并降温至0℃,在氮气保护下,缓慢的加入氢化钠(54g,1.35mol,3.1eq,60%含量分散于矿物油中),然后再将体系降温并维持在≤-10℃。10min后,将溶解于200ml四氢呋喃的化合物vi(151g,0.45mol),缓慢的加入至反应体系,控制滴加速度,使反应温度≤-5℃,加完再恒温4h。然后再将mvk(34g,0.48mol,1.05eq)溶解于50ml的四氢呋喃溶液中,再缓慢地滴加至上述体系中,控制反应温度≤0℃,滴加结束,自然回温并室温过室。反应结束后,将反应液缓慢地倒入饱和氯化铵溶液中,分层后水相再使用乙酸乙酯萃取一次。合并有机相,使用饱和氯化钠洗涤、无水硫酸钠干燥、过滤、浓缩,得到中间体,即化合物vii(112g,收率85%)。
[0051]
s700:在装有回流冷凝器、温度计及机械搅拌的3l四口瓶中分别加入:中间体化合物vii(112g,0.38mol)、500ml的二氧六环、100ml水、0.1g的硫酸汞及50g的固体超强酸,开启加热升温至回流,在氮气保护下,反应12小时。反应结束后,过滤回收固体超强酸,滤液再加入1000ml的饱和氯化钠溶液,乙酸乙酯萃取三次。合并有机相,使用饱和氯化钠洗涤、无水硫酸钠干燥、过滤、浓缩,得到淡黄色固体粗品,即化合物viii粗品,即去氢孕酮粗品
(130g,粗品收率110%)。
[0052]
将化合物viii粗品(130g)及活性碳加入至500ml的丙酮中,加热回流30min,趁热过滤,并使用50ml热丙酮洗涤滤饼,滤液在-20℃静置析晶12小时,过滤、洗涤、干燥得纯品去氢孕酮(106g,收率89%),总收率32%;m.p.=168.5-170.5℃;[α]d=+27.5。
[0053]
所述纯品去氢孕酮的核磁共振表征结果如图5-6所示,具体数据如下:
[0054]
1h nmr(400mhz,cdcl3):δ(ppm):6.14-6.19(m,2h),5.68(s,1h),2.53
–
2.58(m,2h),2.41-2.47(m,2h),2.26-2.30(m,1h),2.19-2.25(m,1h),2.13(s,3h),1.95
–
2.03(m,2h),1.64
–
1.88(m,7h),1.32-1.38(m,1h),1.30(s,3h),1.71(s,3h);13cnmr(100mhz,cdcl3)δ208.93,199.39,162.94,140.39,127.06,123.88,63.36,49.84,44.21,39.64,38.56,37.70,37.15,35.56,33.92,31.47,25.13,22.54,22.26,20.53,12.04。
[0055]
对于实施例中,s100中,采用的格氏试剂还可以是其他乙炔基卤化镁格氏试剂。对于上述中其他反应条件,如溶剂的具体用量、恒温搅拌时长等,在本发明的设计构思中,本领域技术人员可以进行适应的调整。
[0056]
s200中,对于上述反应条件,如溶剂的具体用量、萃取溶剂种类、洗涤液种类等,在本发明的设计构思中,本领域技术人员可以进行适应的调整。
[0057]
s300中,有机碱还可以采用除三乙胺(即tea)外的其他有机碱,如dipea、dbu、pyridine等有机碱;对于上述中其他反应条件,如溶剂的具体用量、恒温时间、萃取溶剂种类等,在本发明的设计构思中,本领域技术人员可以进行适应的调整。
[0058]
s400中,采用的溶剂还可以是乙醚,采用的格氏试剂还可以是乙基氯化镁,对于上述中其他反应条件,如溶剂的具体用量、恒温搅拌时长、淬灭反应溶液、洗涤剂溶液种类等,在本发明的设计构思中,本领域技术人员可以进行适应的调整。
[0059]
s500中,采用的mitsunobu反应原料还可以是对甲苯磺酸,采用的三价膦试剂还可以是其他mitsunobu反应常用三价膦试剂,如三丁基膦、三环己基膦等;采用的偶氮试剂可以是其他mitsunobu反应常用偶氮试剂,如diad(即偶氮二甲酸二异丙酯)等。对于上述中其他反应条件,如溶剂的具体用量、恒温搅拌时长、反应具体温度等,在本发明的设计构思中,本领域技术人员可以进行适应的调整。
[0060]
s600中,对于上述反应条件,如溶剂的具体用量、恒温时长、碱性试剂种类等,在本发明的设计构思中,本领域技术人员可以进行适应的调整。
[0061]
s700中,采用的溶剂还可以是水和四氢呋喃混合液,采用的酸试剂还可以是硫酸等其它无机酸。对于上述中其他反应条件,如溶剂的具体用量、反应时长、萃取溶剂种类等,在本发明的设计构思中,本领域技术人员可以进行适应的调整。
[0062]
实施例2:
[0063]
以实施例1为基础,本实施例中在s100采用乙炔基氯化镁作为格氏试剂进行反应,其他条件不变,则化合物ii的收率为85%,其他s200-s700的反应条件不变,其s200-s700的各步骤的收率不变。则得到纯品去氢孕酮的总收率为29.6%。
[0064]
实施例3:
[0065]
以实施例1为基础,本实施例中在s300以dipea代替tea,其它条件不变,则化合物iv收率为60%.其他s100-s200和s400-s700的反应条件不变,则上述各步骤的收率不变。则得到纯品去氢孕酮的总收率为29.1%。
[0066]
实施例4:
[0067]
以实施例1为基础,本实施例中在s300以dbu代替tea,其它条件不变,则化合物iv收率为52%。其他s100-s200和s400-s700的反应条件不变,则上述各步骤的收率不变。则得到纯品去氢孕酮的总收率为25.2%。
[0068]
实施例5:
[0069]
以实施例1为基础,本实施例中在s400以乙基氯化镁代替乙基溴化镁,其它条件不变,则化合物v的收率分别为85%。其他步骤的反应条件不变,则上述各步骤的收率不变。则得到纯品去氢孕酮的总收率为29.6%。
[0070]
实施例6:
[0071]
以实施例1为基础,本实施例中在s400以乙醚代替四氢呋喃,其它条件不变,则化合物v的收率分别为90%。其他步骤的反应条件不变,则上述各步骤的收率不变。则得到纯品去氢孕酮的总收率为31.3%。
[0072]
实施例7:
[0073]
以实施例1为基础,本实施例中在s500以对甲苯磺酸代替甲磺酸,其它条件不变,则化合物vi的收率分别为77%。其他步骤的反应条件不变,则上述各步骤的收率不变。则得到纯品去氢孕酮的总收率为28.3%。
[0074]
实施例8:
[0075]
以实施例1为基础,本实施例中在s500以三环己基膦和diea代替三苯基膦和dead参与反应,其它条件不变,则化合物vi的收率分别为80%。其他步骤的反应条件不变,则上述各步骤的收率不变。则得到纯品去氢孕酮的总收率为29.4%。
[0076]
实施例9:
[0077]
以实施例1为基础,本实施例中在s600以lihmds代替氢化钠,其它条件不变,则化合物vii的收率分别为77%。其他步骤的反应条件不变,则上述各步骤的收率不变。则得到纯品去氢孕酮的总收率为29.0%。
[0078]
实施例10:
[0079]
以实施例1为基础,本实施例中在s600以lda代替氢化钠,其它条件不变,则化合物vii的收率分别为80%。其他步骤的反应条件不变,则上述各步骤的收率不变。则得到纯品去氢孕酮的总收率为30.1%。
[0080]
实施例11:
[0081]
以实施例1为基础,本实施例中在s700中固体超强酸使用量增加至75g,其它条件不变,则化合物viii的收率分别为83%。其他步骤的反应条件不变,则上述各步骤的收率不变。则得到纯品去氢孕酮的总收率为29.8%。
[0082]
实施例12:
[0083]
以实施例1为基础,本实施例中在s700中固体超强酸使用量减少至25g,其它条件不变,则化合物viii的收率分别为66%。其他步骤的反应条件不变,则上述各步骤的收率不变。则得到纯品去氢孕酮的总收率为23.7%。
[0084]
实施例13:
[0085]
以实施例1为基础,本实施例中在s700中以硫酸代替固体超强酸,其它条件不变,则化合物viii的收率分别为70%。其他步骤的反应条件不变,则上述各步骤的收率不变。则
得到纯品去氢孕酮的总收率为25.2%。
[0086]
对比例1:
[0087]
专利号为wo2018109622的专利,公开了一种以黄体酮为原料,经过普通化学合成的方法,即经脱氢、氧化、脱羧、氢化、还原、成a环及脱氢制备得到去氢孕酮产品,其总收率约12%。
[0088]
对比例2:
[0089]
专利公开号为cn110818760a的专利公开的一种可工业化合成地屈孕酮的生产工艺,其以黄体酮为原料,通过羰基保护、溴代、脱溴、光化学开环反应、光化学闭环反应、脱保护、双键异构的步骤制得地屈孕酮,其总收率为38%
[0090]
综上,总结所述实施例和对比例的测试结果如下表1所示:
[0091]
表1
[0092]
项目实施例1实施例2实施例3实施例4实施例5总收率/%3229.629.125.229.6项目实施例6实施例7实施例8实施例9实施例10总收率/%31.328.329.429.030.1项目实施例11实施例12实施例13对比例1对比例2总收率/%29.823.725.21238
[0093]
与对比例1相比较,本发明实施例的收率均高于对比例1收率。本发明以a环降解物为起始原料,利用它分子内固有的手性构型,不断地利用空间位阻效应,实现各步的手性控制;物料成本价格低;具有中间体手性选择性高;易于纯化、异构体杂质少等优势,因此制得产物的收率高;且所有步骤均为常规化学反应容易实现工业化生产。
[0094]
对比例2的技术方案则主要受制于现有的光电技术,无法实现大规模生产。现有led技术在紫外及深紫外的光电转化效率低,大约只有将不到1%的电功率转化为光功率。因此,采用现有的光化学合成方法无法实现大规模工业生产。
[0095]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1