一种2-氟代苯乙腈衍生物及其制备方法与应用
一种2
‑
氟代苯乙腈衍生物及其制备方法与应用
技术领域
1.本发明属于有机物合成技术领域,尤其是涉及一种2
‑
氟代苯乙腈衍生物及其制备方法与应用。
背景技术:
2.氟原子的引入往往能够提高生物活性分子的亲脂性,增强其代谢稳定性,改善其生物可利用度。四取代的含氟手性碳结构存在于许多生物活性分子中(zhu,y.;han,j.;wang,j.;shibata,n.;sodeoka,m.;soloshonok,v.a.;coelho,j.a.s.;toste,f.d.modern approaches for asymmetric construction of carbon
‑
fluorine quaternary stereogenic centers:synthetic challenges and pharmaceutical needs.chem.rev.2018,118,3887
‑
3964)。因此,发展高效的合成四取代的含氟手性碳结构的方法,对于药物研发有着重要的意义。
[0003]2‑
氟代苯乙腈作为方便易得的含氟试剂,其与亚胺的缩合反应制备3
‑
胺基
‑2‑
氟腈类化合物的方法已见诸报道((a)ding,r.;de los santos,z.a.;wolf,c.acs catal.2019,9,2169
‑
2176;(b)balaji,p.v.;brewitz,l.;kumagai,n.;shibasaki,m.achiral trisubstituted thioureas as secondary ligands to cu(i)catalysts:direct catalytic asymmetric addition ofα
‑
fluoronitriles to imines.angew.chem.int.ed.2019,58,2644
‑
2648)。但2
‑
氟代苯乙腈与活泼烯烃发生加成反应,用来制备含有四氟代含氟手性碳结构的2
‑
氟代苯乙腈衍生物的方法尚未见诸报道。
[0004]
考虑到四取代的含氟手性碳结构的重要性,以及2
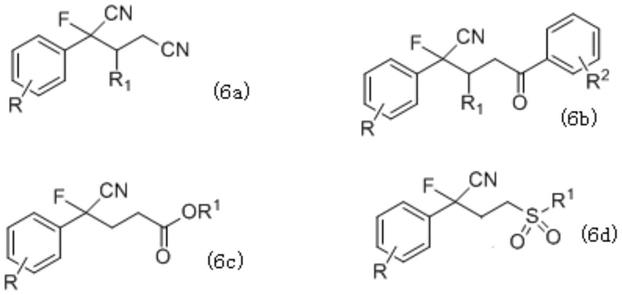
‑
氟代苯乙腈衍生物还可以进行多样性的转化,发展简洁高效的制备方法对于含氟生物活性分子开发具有重要的意义。
技术实现要素:
[0005]
本发明的目的是提供一种2
‑
氟代苯乙腈衍生物及其制备方法与应用。该方法用到的原料易于制备,反应易于操作且方法高效,甚至可以用水作为反应溶剂,反应绿色,制备得到的2
‑
氟代苯乙腈衍生物的纯度高。
[0006]
本发明的目的可以通过以下技术方案来实现:
[0007]
一种制备2
‑
氟代苯乙腈衍生物的方法,在反应溶剂中,2
‑
氟代苯乙腈与α,β
‑
不饱和化合物在碱作用下发生加成反应,得到2
‑
氟代苯乙腈衍生物。
[0008]
其中,所述的2
‑
氟代苯乙腈具有如下结构式(式1):
[0009][0010]
其中:r为c1‑8的烷氧基、卤素、腈基或硝基。
[0011]
所述的α,β
‑
不饱和化合物包括α,β
‑
不饱和腈、α,β
‑
不饱和酮、α,β
‑
不饱和酯和α,
β
‑
不饱和砜。
[0012]
所述的α,β
‑
不饱和腈具有如下结构式(式2):
[0013][0014]
其中:r为氢、或c1‑4的烷基。
[0015]
所述的α,β
‑
不饱和酮具有如下结构式(式3):
[0016][0017]
其中:r为氢、卤素、烷氧基或硝基;r1为氢,苯基或取代苯基;所述的取代苯基为硝基取代的苯基c1‑4的烷基取代的苯基。
[0018]
所述的α,β
‑
不饱和酯具有如下结构式:
[0019][0020]
其中:r为苯基、c1‑
10
的烷基、c1‑
10
含有醚键结构的烷基取代基。
[0021]
所述的α,β
‑
不饱和砜具有如下结构式:
[0022][0023]
其中:r为c1‑4的烷基。
[0024]
所述的碱选自碳酸钠、碳酸钾、氢氧化钠、氢氧化钾、三乙胺(net3)、二异丙基乙基胺(ipr2net)、1,8
‑
二氮杂二环十一碳
‑7‑
烯(dbu)、1,5,7
‑
三氮杂二环[4.4.0]癸
‑5‑
烯(tbd)、1,1,3,3
‑
四甲基胍(tmg)或2
‑
叔丁基
‑
1,1,3,3
‑
四甲基胍中的一种或几种。
[0025]2‑
氟代苯乙腈、α,β
‑
不饱和化合物以及碱的摩尔比为1:(0.8~3):(0.05~1)。
[0026]
所述的反应溶剂选自水、乙醚、四氢呋喃、甲苯、二氯甲烷、n,n
‑
二甲基甲酰胺、乙腈或二甲基亚砜中的一种或几种。
[0027]
反应条件为:
‑
20℃~60℃下,反应0.5~12个小时。
[0028]
典型反应如下(式6):
[0029][0030]
上述式(1)中2
‑
氟代苯乙腈可利用相应的醇通过氟化进行制备(turkmann.;shavrin,a.;ivanov,r.a.;rabinovich,b.;volgin,a.;gelovani,j.g.;alauddin,m.m.fluorinated cannabinoid cb2 receptor ligands:synthesis and in vitro binding characteristics of 2
‑
oxoquinoline derivatives.bioorg.med.chem.2011,19,5698
–
5707。
[0031]
上述式(2)~(5)所述的活泼不饱和烯烃基本上是市场上的商品,亦可通过成熟的方法制备。
[0032]
本发明还提供基于上述制备方法制备得到的2
‑
氟代苯乙腈衍生物,具有如下结构式:
[0033][0034]
其中式(6a)中,r为氢、c1‑8的烷氧基、卤素、腈基或硝基,r1为氢或c1‑4的烷基;
[0035]
式(6b)中,r为氢、c1‑8的烷氧基、卤素、腈基或硝基,r2为氢、卤素、烷氧基或硝基;r1为氢、苯基或取代苯基,所述的取代苯基为:硝基取代的苯基、c1‑4的烷基取代苯基;
[0036]
式(6c)中,r为氢、c1‑8的烷氧基、卤素、腈基或硝基,r1为苯基、c1‑
10
的烷基、c1‑
10
的含有醚键结构的烷基取代基;
[0037]
式(6d)中,r为氢、c1‑8的烷氧基、卤素、腈基或硝基,r1为c1‑4的烷基。
[0038]
在本发明的一些实施方式中,所述2
‑
氟代苯乙腈衍生物,选自如下结构:
[0039][0040][0041]
本发明还提供所述2
‑
氟代苯乙腈衍生物的应用。所述2
‑
氟代苯乙腈衍生物作为生物活性分子合成砌块,在含氟精细化学品以及含氟生物活性分子制备中的应用。
[0042]
本发明采用2
‑
氟代苯乙腈和活泼的烯烃作为起始原料,通过发生迈克尔加成反应,得到2
‑
氟代苯乙腈衍生物。这种方法简洁高效,普适性高,并且能够以水作为反应溶剂。本发明制备得到的2
‑
氟代苯乙腈衍生物,为一种潜在的生物活性分子合成砌块,能够进行丰富的化学转化,有望在医药研发领域得到应用。
具体实施方式
[0043]
下面结合具体实施例对本发明进行详细说明。
[0044]
以下实施例中,反应的产率指的是分离收率。
[0045]
实施例1
[0046]
在27℃下,依次将式(1a)所示2
‑
氟代苯乙腈(135毫克,1.0mmol)、式(2a)所示烯烃(106毫克,2mmol)、水(3.0ml)、碳酸钠(1mmol)加入到20ml的反应瓶中。在此温度下反应2小
时。反应结束后,将反应液转移到分液漏斗中,用乙酸乙酯萃取(10ml
×
3)。有机相用无水硫酸钠干燥后,减压下除去溶剂。用乙酸乙酯/石油醚(1:4)快速柱层析,得到产品3aa,产率为92%(173毫克)。
[0047][0048]
化合物3aa的表征数据:
[0049][0050]
无色液体。1h nmr(500mhz,cdcl3)δ7.53(s,5h),2.83
–
2.43(m,4h).
19
f nmr(376mhz,cdcl3)δ
‑
150.71(s).
13
c nmr(126mhz,cdcl3)δ134.11(d,j=22.5hz),130.77(s),129.44(s),124.48(d,j=6.3hz),117.29(s),115.98(d,j=33.9hz),90.15(d,j=186.9hz),37.27(d,j=25.9hz),12.51(d,j=4.3hz).hrms(esi)m/z:calcd for c
11
h
10
fn
2+
[m+h]
+
189.0828,found 189.0831.
[0051]
实施例2
[0052]
在27℃下,依次将式(1a)所示2
‑
氟代苯乙腈(135毫克,1.0mmol)、式(2b)所示烯烃(58毫克,0.8mmol)、四氢呋喃(3.0ml)、三乙胺(net3)(0.05mmol)加入到20ml的反应瓶中。在此温度下反应12小时。反应结束后,将反应液转移到分液漏斗中,用乙酸乙酯萃取(10ml
×
3)。有机相用无水硫酸钠干燥后,减压下除去溶剂。用乙酸乙酯/石油醚(1:4)快速柱层析,得到产品3ab,产率为72%(145毫克)。
[0053][0054]
化合物3ab的表征数据:
[0055][0056]
无色液体。1h nmr(400mhz,cdcl3)δ7.51
–
7.44(m,5h),2.71
–
2.53(m,2h),2.39(ddd,j=26.9,16.7,10.1hz,2h),1.26(dd,j=21.3,6.8hz,3h).
19
f nmr(376mhz,cdcl3)δ
‑
150.61(d,j=13.7hz),
‑
155.25(d,j=16.3hz).
13
c nmr(126mhz,cdcl3)δ133.16(d,j=22.8hz),130.70(d,j=1.6hz),129.30(s),124.94(d,j=6.7hz),116.77(s),115.69(d,j=32.9hz),93.34(d,j=98.7hz),40.94(d,j=25.9hz),20.20(d,j=5.1hz),13.73(d,j=3.5hz).hrms(esi)m/z:calcd for c
12
h
12
fn
2+
[m+h]
+
203.0985,found 203.0981.
[0057]
实施例3
[0058]
在60℃下,依次将式(1b)所示2
‑
氟代苯乙腈(165毫克,1.0mmol)、式(1a)所示烯烃(53毫克,1mmol)、甲苯(3.0ml)、氢氧化钠(1mmol)加入到20ml的反应瓶中。在此温度下反应2小时。反应结束后,将反应液转移到分液漏斗中,用乙酸乙酯萃取(10ml
×
3)。有机相用无水硫酸钠干燥后,减压下除去溶剂。用乙酸乙酯/石油醚(1:2)快速柱层析,得到产品3ba,产率为89%(184毫克)。
[0059][0060]
化合物3ba的表征数据
[0061][0062]
无色液体。1h nmr(500mhz,cdcl3)δ7.43(t,j=8.2hz,1h),7.10
–
7.06(m,1h),7.03(d,j=6.8hz,2h),3.87(s,3h),2.69
–
2.56(m,4h).
19
f nmr(471mhz,cdcl3)δ
‑
150.95(s).
13
c nmr(126mhz,cdcl3)δ160.28(s),135.47(d,j=22.4hz),130.66(s),117.32(s),116.49(d,j=6.3hz),116.02(d,j=1.4hz),115.99(d,j=115.8hz),110.34(d,j=7.1hz),89.94(d,j=187.3hz),55.54(s),37.22(d,j=25.8hz),12.46(d,j=4.4hz).hrms(esi)m/z:calcd for c
12
h
12
fn2o
2+
[m+h]
+
235.0883,found 235.0889.
[0063]
实施例4
[0064]
在0℃下,依次将式(1c)所示2
‑
氟代苯乙腈(213毫克,1.0mmol)、式(1a)所示烯烃(53毫克,1mmol)、二甲基亚砜(3.0ml)、1,8
‑
二氮杂二环十一碳
‑7‑
烯(1mmol)加入到20ml的反应瓶中。在此温度下反应3小时。反应结束后,将反应液转移到分液漏斗中,用乙酸乙酯萃取(10ml
×
3)。有机相用无水硫酸钠干燥后,减压下除去溶剂。用乙酸乙酯/石油醚(1:5)快速柱层析,得到产品3ca,产率为78%(207毫克)。
[0065][0066]
化合物3ca的表征数据
[0067][0068]
无色液体。1h nmr(500mhz,cdcl3)δ7.66(d,j=8.4hz,2h),7.40(d,j=8.6hz,2h),2.70
–
2.51(m,4h).
19
f nmr(376mhz,cdcl3)δ
‑
168.43(s).
13
c nmr(126mhz,cdcl3)δ133.19(d,j=22.9hz),132.71(s),126.19(d,j=6.3hz),125.28(d,j=1.7hz),117.11(s),115.53(d,j=33.9hz),89.74(d,j=187.7hz),37.11(d,j=25.7hz),12.52(d,j=4.2hz).hrms(esi)m/z:calcd for c
11
h9brfn
2+
[m+h]
+
266.9933,found 266.9938.
[0069]
实施例5
[0070]
在0℃下,依次将式(1d)所示2
‑
氟代苯乙腈(160毫克,1.0mmol)、式(1a)所示烯烃(80毫克,1.5mmol)、n,n
‑
二甲基甲酰胺(3.0ml)、二异丙基乙基胺(1mmol)、加入到20ml的反应瓶中。在此温度下反应1小时。反应结束后,将反应液转移到分液漏斗中,用乙酸乙酯萃取(10ml
×
3)。有机相用无水硫酸钠干燥后,减压下除去溶剂。用乙酸乙酯/石油醚(1:3)快速柱层析,得到产品3da,产率为80%(170毫克)。
[0071][0072]
化合物3da的表征数据
[0073][0074]
无色液体。1h nmr(500mhz,cdcl3)δ7.85(d,j=8.5hz,2h),7.68(d,j=8.5hz,2h),2.75
–
2.70(m,2h),2.68
–
2.58(m,2h).
19
f nmr(471mhz,cdcl3)δ
‑
153.66(s).
13
c nmr(126mhz,cdcl3)δ138.82(d,j=22.9hz),133.29(s),125.38(d,j=6.8hz),117.07(d,j=77.3hz),115.08(s),115.05(d,j=16.9hz),89.45(d,j=189.5hz),37.21(d,j=25.2hz),12.52(d,j=4.1hz).hrms(esi)m/z:calcd for c
12
h9fn
3+
[m+h]
+
214.0781,found 214.0781.
[0075]
实施例6
[0076]
在50℃下,依次将式(1e)所示2
‑
氟代苯乙腈(180毫克,1.0mmol)、式(1b)所示烯烃(106毫克,2mmol)、乙腈(3.0ml)、1,5,7
‑
三氮杂二环[4.4.0]癸
‑5‑
烯(1mmol)加入到20ml的反应瓶中。在此温度下反应4小时。反应结束后,将反应液转移到分液漏斗中,用乙酸乙酯萃取(10ml
×
3)。有机相用无水硫酸钠干燥后,减压下除去溶剂。用乙酸乙酯/石油醚(1:4)快速柱层析,得到产品3eb,产率为95%(171毫克)。
[0077][0078]
化合物3eb的表征数据
[0079][0080]
无色固体,m.p.93.7
‑
95.8℃.1h nmr(500mhz,cdcl3)δ8.40(d,j=8.7hz,2h),7.76(d,j=8.8hz,2h),2.78
–
2.72(m,2h),2.71
–
2.61(m,2h).
19
f nmr(471mhz,cdcl3)δ
‑
153.35(s).
13
c nmr(126mhz,cdcl3)δ149.29(s),140.47(d,j=22.9hz),125.83(d,j=6.8hz),124.71(s),116.72(s),114.99(d,j=33.8hz),89.39(d,j=189.8hz),37.28(d,j=25.2hz),12.53(d,j=4.2hz).hrms(esi)m/z:calcd for c
11
h9fn3o
2+
[m+h]
+
234.0679,found 234.0679.
[0081]
实施例7
[0082]
在40℃下,依次将式(1a)所示2
‑
氟代苯乙腈(135毫克,1.0mmol)、式(2c)所示烯烃(520毫克,2.5mmol)、乙醚(3.0ml)、1,1,3,3
‑
四甲基胍(1mmol)加入到20ml的反应瓶中。在此温度下反应0.5小时。反应结束后,将反应液转移到分液漏斗中,用乙酸乙酯萃取(10ml
×
3)。有机相用无水硫酸钠干燥后,减压下除去溶剂。用乙酸乙酯/石油醚(1:4)快速柱层析,得到产品3ac,产率为92%(173毫克)。。
[0083][0084]
化合物3ac的表征数据
[0085][0086]
无色固体,m.p.153.8
‑
155.2℃.1h nmr(400mhz,cdcl3)δ7.94(d,j=8.5hz,1h),7.91(d,j=7.2hz,1h),7.58(t,j=7.3hz,1h),7.48(d,j=3.7hz,1h),7.46(d,j=7.5hz,1h),δ7.36(d,j=5.0hz,5h),7.22(d,j=6.8hz,5h),4.25(ddd,j=22.5,10.2,3.4hz,1h),3.92(ddd,j=23.5,17.6,9.8hz,1h),3.64(ddd,j=55.8,17.6,3.5hz,1h).
19
f nmr(376mhz,cdcl3)δ
‑
153.82(d,j=21.6hz).
13
c nmr(101mhz,cdcl3)δ195.66(s),136.49(s),135.26(s),134.72(d,j=23.0hz),133.44(s),129.83(s),129.59(s),128.68(s),128.55(s),128.27(s),128.02(s),125.19(d,j=6.3hz),117.02(d,j=33.3hz),94.38(d,j=189.7hz),50.85(d,j=24.1hz),39.29(d,j=2.2hz).hrms(esi)m/z:calcd for c
23
h
19
fno
+
[m+h]
+
344.1451,found 344.1448.
[0087]
实施例8
[0088]
在25℃下,依次将式(1a)所示2
‑
氟代苯乙腈(135毫克,1.0mmol)、式(2d)所示烯烃(400毫克,1.8mmol)、水(3.0ml)、2
‑
叔丁基
‑
1,1,3,3
‑
四甲基胍(1mmol)加入到20ml的反应瓶中。在此温度下反应0.5小时。反应结束后,将反应液转移到分液漏斗中,用乙酸乙酯萃取(10ml
×
3)。有机相用无水硫酸钠干燥后,减压下除去溶剂。用乙酸乙酯/石油醚(1:6)快速柱层析,得到产品3ad,产率为85%(303毫克)。
[0089][0090]
化合物3ad的表征数据
[0091][0092]
无色固体,m.p.123.5
‑
124.7℃.1h nmr(400mhz,cdcl3)δ7.96
–
7.88(m,2h),7.57(ddd,j=4.6,4.1,1.2hz,1h),7.47(dt,j=13.8,6.1hz,2h),7.43
–
7.35(m,5h),7.10(t,j=7.2hz,2h),7.04(d,j=7.9hz,1h),4.29
–
4.17(m,1h),3.97
–
3.80(m,1h),3.68(dd,j=17.5,3.8hz,1h),2.28(s,3h).
19
f nmr(376mhz,cdcl3)δ
‑
152.48(s).
13
c nmr(126mhz,cdcl3)δ196.01(d,j=66.0hz),137.76(s),136.53(d,j=13.1hz),134.75(d,j=23.0hz),133.42(d,j=4.3hz),132.14(s),129.85(s),129.39(d,j=1.0hz),129.21(s),129.06(d,j=7.4hz),128.67(s),128.57(s),128.05(d,j=2.5hz),125.29(d,j=6.2hz),117.03(d,j=33.2hz),94.45(d,j=189.2hz),50.40(d,j=24.4hz),39.93
–
37.93(m),21.07(s)
.hrms(esi)m/z:calcd for c
24
h
21
fno
+
[m+h]
+
358.1607,found 358.1609.
[0093]
实施例9
[0094]
在15℃下,依次将式(1a)所示2
‑
氟代苯乙腈(135毫克,1.0mmol)、式(2e)所示烯烃(253毫克,1mmol)、水(3.0ml)、碳酸钠(1mmol)加入到20ml的反应瓶中。在此温度下反应0.5小时。反应结束后,将反应液转移到分液漏斗中,用乙酸乙酯萃取(10ml
×
3)。有机相用无水硫酸钠干燥后,减压下除去溶剂。用乙酸乙酯/石油醚(1:4)快速柱层析,得到产品3ae,产率为84%(326毫克)。
[0095][0096]
化合物3ae的表征数据
[0097][0098]
无色固体,m.p.164.8℃.1h nmr(500mhz,cdcl3)δ8.11(d,j=8.8hz,1h),8.08(d,j=8.8hz,1h),7.92(d,j=7.4hz,2h),7.61(t,j=7.4hz,1h),7.49(t,j=7.8hz,2h),7.45
–
7.35(m,7h),4.35(ddd,j=23.4,10.6,2.9hz,1h),4.00(dd,j=17.9,10.6hz,1h),3.69(dd,j=17.9,3.0hz,1h).
19
f nmr(471mhz,cdcl3)δ
‑
155.11(s).
13
c nmr(126mhz,cdcl3)δ195.04(s),147.58(s),142.90(s),135.94(s),133.93(s),130.50(d,j=1.6hz),130.33(d,j=1.4hz),128.96(s),128.86(s),128.04(s),124.89(s),124.84(s),123.40(s),116.49(d,j=33.2hz),93.78(d,j=190.8hz),50.82(d,j=23.9hz),39.33(d,j=2.1hz).hrms(esi)m/z:calcd for c
23
h
18
fn2o
3+
[m+h]
+
389.1301,found 389.1302.
[0099]
实施例10
[0100]
在5℃下,依次将式(1a)所示2
‑
氟代苯乙腈(135毫克,1.0mmol)、式(2f)所示烯烃(253毫克,0.8mmol)、乙腈(3.0ml)、碳酸钠(1mmol)加入到20ml的反应瓶中。在此温度下反应2小时。反应结束后,将反应液转移到分液漏斗中,用乙酸乙酯萃取(10ml
×
3)。有机相用无水硫酸钠干燥后,减压下除去溶剂。用乙酸乙酯/石油醚(1:4)快速柱层析,得到产品3af,产率为75%(291毫克)。
[0101][0102]
化合物3af的表征数据
[0103][0104]
无色固体,m.p.147.4
‑
148.5℃.1h nmr(500mhz,cdcl3)δ8.31(d,j=8.6hz,2h),
8.08(d,j=8.7hz,1h),8.05(d,j=8.6hz,1h),7.40
–
7.35(m,3h),7.33(d,j=7.5hz,2h),7.24(t,j=7.5hz,3h),7.17(t,j=7.0hz,2h),4.21(ddd,j=23.5,10.0,3.3hz,1h),3.95(dd,j=17.7,9.9hz,1h),3.67(dd,j=17.6,3.4hz,1h).
19
f nmr(471mhz,cdcl3)δ
‑
147.37(s),
‑
155.18(s).
13
c nmr(126mhz,cdcl3)δ194.46(s),150.54(s),140.76(s),134.71(s),134.35(d,j=22.9hz),129.96(s),129.49(d,j=1.3hz),129.09(d,j=1.6hz),128.63(s),128.42(s),128.29(s),125.07(d,j=6.4hz),116.95(d,j=33.2hz),94.10(d,j=190.2hz),50.87(d,j=24.1hz),40.01(d,j=2.6hz).hrms(esi)m/z:calcd for c
23
h
18
fn2o
3+
[m+h]
+
389.1301,found 389.1301.
[0105]
实施例11
[0106]
在
‑
20℃下,依次将式(1a)所示2
‑
氟代苯乙腈(135毫克,1.0mmol)、式(2f)所示烯烃(238毫克,1mmol)、二甲亚砜(3.0ml)、碳酸钾(1mmol)加入到20ml的反应瓶中。在此温度下反应1小时。反应结束后,将反应液转移到分液漏斗中,用乙酸乙酯萃取(10ml
×
3)。有机相用无水硫酸钠干燥后,减压下除去溶剂。用乙酸乙酯/石油醚(1:4)快速柱层析,得到产品3ag,产率为90%(214毫克)。
[0107][0108]
化合物3ag的表征数据
[0109][0110]
无色固体,m.p.68.3
‑
77.8℃.1h nmr(500mhz,cdcl3)δ7.47(dd,j=7.2,5.2hz,1h),7.45
–
7.41(m,1h),7.39
–
7.35(m,5h),7.26
–
7.19(m,3h),7.15(dd,j=8.9,5.3hz,2h),6.98(t,j=7.0hz,1h),6.93(t,j=7.5hz,1h),4.22
–
4.11(m,1h),3.94(s,3h),3.92
–
3.77(m,1h),3.66(dd,j=17.7,3.7hz,1h).
19
f nmr(471mhz,cdcl3)δ
‑
152.92(s).
13
c nmr(126mhz,cdcl3)δ197.98(s),158.43(s),135.47(s),134.93(d,j=23.0hz),133.84(s),130.51(s),129.73(d,j=1.3hz),128.46(d,j=1.9hz),128.29(s),128.11(s),127.86(s),127.56(s),125.28(d,j=6.3hz),120.74(s),117.02(d,j=33.2hz),111.45(s),94.45(d,j=189.4hz),55.58(s),51.12(d,j=24.1hz),44.45(d,j=2.6hz).hrms(esi)m/z:calcd for c
24
h
21
fno
2+
[m+h]
+
374.1556,found 374.1552.
[0111]
实施例12
[0112]
在25℃下,依次将式(1a)所示2
‑
氟代苯乙腈(135毫克,1.0mmol)、式(2f)所示烯烃(396毫克,3mmol)、水(3.0ml)、氢氧化钾(1mmol)加入到20ml的反应瓶中。在此温度下反应3小时。反应结束后,将反应液转移到分液漏斗中,用乙酸乙酯萃取(10ml
×
3)。有机相用无水硫酸钠干燥后,减压下除去溶剂。用乙酸乙酯/石油醚(1:4)快速柱层析,得到产品3ah,产率为92%(246毫克)。
[0113][0114]
化合物3ah的表征数据
[0115][0116]
无色固体,m.p.57.9
‑
60.5℃.1h nmr(500mhz,cdcl3)δ8.00
–
7.95(m,2h),7.62(d,j=7.4hz,1h),7.60(d,j=2.6hz,2h),7.58(d,j=0.7hz,1h),7.52(s,1h),7.51(s,1h),7.50(s,1h),7.50(s,1h),7.50(s,1h),7.49(s,1h),3.43
–
3.26(m,2h),2.85
–
2.62(m,2h).
19
f nmr(471mhz,cdcl3)δ
‑
147.63(s).
13
c nmr(126mhz,cdcl3)δ197.03(s),136.26(s),135.69(d,j=22.7hz),133.56(s),130.22(d,j=1.8hz),129.13(s),128.76(s),128.05(s),124.68(d,j=6.2hz),117.07(d,j=34.4hz),91.41(d,j=184.2hz),35.89(d,j=25.4hz),33.01(d,j=2.3hz).hrms(esi)m/z:calcd for c
17
h
15
fno
+
[m+h]
+
268.1138,found 268.1135.
[0117]
实施例13
[0118]
采用与实施例6相同的方法,其中:
[0119]
采用的烯烃为2i,采用的2
‑
氟苯乙腈为1a:产率为89%。
[0120][0121]
化合物3ai的表征数据
[0122][0123]
无色固体,m.p.67.9
‑
68.8℃.1h nmr(500mhz,cdcl3)δ8.02(dd,j=8.8,5.4hz,2h),7.59(d,j=2.0hz,2h),7.58(s,1h),7.51(s,1h),7.50(d,j=1.4hz,2h),7.18(t,j=8.6hz,2h),3.41
–
3.23(m,2h),2.85
–
2.61(m,2h).
19
f nmr(471mhz,cdcl3)δ
‑
104.28(s),
‑
147.52
–‑
148.09(m).
13
c nmr(126mhz,cdcl3)δ195.40(s),166.01(d,j=255.6hz),135.53(s),132.70(d,j=3.1hz),130.73(d,j=9.4hz),130.26(d,j=1.8hz),129.15(s),124.66(d,j=6.0hz),117.01(d,j=34.3hz),115.91(d,j=22.0hz),91.35(d,j=184.2hz),35.86(d,j=25.4hz),32.94(d,j=2.3hz).hrms(esi)m/z:calcd for c
17
h
14
f2no
+
[m+h]
+
286.1043,found 286.1039.
[0124]
实施例14
[0125]
采用与实施例7相同的方法,其中:
[0126]
采用的烯烃为2j,采用的2
‑
氟苯乙腈为1a:产率为81%。
[0127][0128]
化合物3aj的表征数据
[0129][0130]
无色液体。1h nmr(500mhz,cdcl3)δ7.56
–
7.47(m,5h),3.70(s,3h),2.68
–
2.52(m,4h).
19
f nmr(376mhz,cdcl3)δ
‑
148.93(s).
13
c nmr(126mhz,cdcl3)δ171.75(s),135.32(d,j=22.6hz),130.22(d,j=1.7hz),129.10(s),124.62(d,j=6.2hz),116.75(d,j=34.2hz),90.98(d,j=185.0hz),52.05(s),36.72(d,j=25.7hz),28.62(d,j=3.5hz).hrms(esi)m/z:calcd for c
12
h
13
fno
2+
[m+h]
+
222.0930,found 222.0930.
[0131]
实施例15
[0132]
采用与实施例8相同的方法,其中:
[0133]
采用的烯烃为2k,采用的2
‑
氟苯乙腈为1a:产率为92%。
[0134][0135]
化合物3ak的表征数据
[0136][0137]
无色液体。1h nmr(400mhz,cdcl3)δ7.60(d,j=3.9hz,2h),7.58(d,j=1.5hz,3h),7.55
–
7.51(m,2h),7.44
–
7.39(m,1h),7.31
–
7.24(m,2h),7.12(d,j=1.1hz,1h),7.10(d,1h),2.95
–
2.89(m,2h),2.83
–
2.62(m,2h).
19
f nmr(376mhz,cdcl3)δ
‑
150.61(d,j=13.7hz),
‑
155.25(d,j=16.3hz).
13
c nmr(126mhz,cdcl3)δ169.94(s),150.45(s),135.65
–
134.84(m),130.28(d,j=12.7hz),129.28(t,j=24.8hz),129.02
–
128.30(m),126.09(s),124.65(d,j=6.2hz),121.38(s),116.76(d,j=34.1hz),91.00(d,j=185.2hz),36.69(d,j=25.6hz),28.95(dd,j=22.4,3.3hz).hrms(esi)m/z:calcd for c
17
h
15
fno
2+
[m+h]
+
284.1087,found 284.1086.
[0138]
实施例16
[0139]
采用与实施例1相同的方法,其中:
[0140]
采用的烯烃为2l,采用的2
‑
氟苯乙腈为1a:产率为78%。。
[0141][0142]
化合物3al的表征数据
[0143][0144]
无色液体。1h nmr(500mhz,cdcl3)δ7.55
–
7.46(m,5h),4.21
–
4.16(m,1h),4.16
–
4.09(m,1h),4.03(dd,j=11.1,6.9hz,1h),3.90(dd,j=14.9,6.9hz,1h),3.82(dd,j=14.4,7.3hz,1h),2.70
–
2.53(m,4h),2.08
–
1.98(m,1h),1.97
–
1.87(m,2h),1.64
–
1.57(m,1h).
19
f nmr(471mhz,cdcl3)δ
‑
148.92(d,j=84.3hz).
13
c nmr(126mhz,cdcl3)δ171.32(s),
135.30(d,j=22.7hz),130.20(s),129.10(s),124.62(d,j=6.1hz),116.76(d,j=34.1hz),90.95(d,j=185.0hz),68.46(s),67.04(s),36.77(s),36.57(s),28.72(s),27.96(s),25.64(s).hrms(esi)m/z:calcd for c
16
h
19
fno
3+
[m+h]
+
292.1349,found 292.1353.
[0145]
实施例17
[0146]
采用与实施例3相同的方法,其中:
[0147]
采用的烯烃为2m,采用的2
‑
氟苯乙腈为1a:产率为93%。
[0148][0149]
化合物3am的表征数据
[0150][0151]
无色固体,m.p.67.2
‑
67.8℃.1h nmr(500mhz,cdcl3)δ7.56
–
7.51(m,5h),3.35
–
3.28(m,2h),3.01(s,3h),2.86
–
2.69(m,2h).
19
f nmr(376mhz,cdcl3)δ
‑
148.43(s).
13
c nmr(126mhz,cdcl3)δ134.32(d,j=22.6hz),130.77(s),129.43(s),124.51(d,j=6.2hz),116.10(d,j=34.2hz),90.05(d,j=186.8hz),49.40(d,j=2.1hz),41.33(s),34.12(d,j=26.3hz).hrms(esi)m/z:calcd for c
11
h
13
fno2s
+
[m+h]
+
242.0651,found 242.0648.
[0152]
实施例18
[0153]
将实施例1得到的2
‑
氟代苯乙腈衍生物(3aa,1mmol,188mg)室温下溶于dmso中。冰水浴下,加入碳酸钾(1mmol)和双氧水(30%,3mmol)。在此温度下反应5h。然后将反应液转移至分液漏斗中,用乙酸乙酯萃取(10ml
×
3)。有机相用无水硫酸钠干燥后,减压下除去溶剂。用乙酸乙酯/石油醚(1:1)快速柱层析,得到产品4a,产率为75%(155毫克)。
[0154][0155]
化合物4a的表征数据
[0156][0157]
无色固体,m.p.79
‑
82.8℃.1h nmr(500mhz,cdcl3)δ7.55(d,j=7.3hz,2h),7.42(t,j=7.1hz,3h),6.31(d,j=154.2hz,2h),2.73(ddd,j=24.4,14.8,7.8hz,1h),2.55(ddd,j=29.3,14.7,7.4hz,1h),2.47
–
2.41(m,2h).
19
f nmr(376mhz,cdcl3)δ
‑
163.90(s).
13
c nmr(126mhz,cdcl3)δ171.76(d,j=23.3hz),136.43(d,j=21.7hz),129.15(d,j=1.2hz),128.82(d,j=1.7hz),124.19(d,j=10.0hz),118.61(s),98.06(d,j=192.1hz),34.07(d,j=22.0hz),11.98(d,j=4.5hz).hrms(esi)m/z:calcd for c
11
h
12
fn2o
+
[m+h]
+
207.0934,found 207.0938.
[0158]
实施例19
[0159]
将实施例12得到的2
‑
氟代苯乙腈衍生物(3ah,1mmol,267mg)冰水浴下溶于甲醇
中。然后,加入硼氢化钠(1.0mmol)。在此温度下反应1h。然后将反应液转移至分液漏斗中,用乙酸乙酯萃取(10ml
×
3)。有机相用无水硫酸钠干燥后,减压下除去溶剂。用乙酸乙酯/石油醚(1:1)快速柱层析,得到产品4b,产率为95%(256毫克)。。
[0160][0161]
化合物4b的表征数据
[0162][0163]
无色固体,m.p.94.5
‑
95.4℃.1h nmr(500mhz,cdcl3)δ7.51(t,j=5.3hz,2h),7.47(dd,j=4.2,1.8hz,3h),7.39(dd,j=11.2,3.8hz,5h),7.34(dd,j=7.0,4.9hz,3h),4.76(t,j=6.4hz,1h),2.52
–
2.20(m,2h),2.11
–
2.00(m,2h).
19
f nmr(471mhz,cdcl3)δ
‑
146.55(s),
‑
147.35(s).
13
c nmr(126mhz,cdcl3)δ143.59(s),136.09(d,j=3.2hz),129.98(s),129.00(s),128.73(s),128.03(s),125.71(s),124.69(d,j=1.9hz),117.39(d,j=9.7hz),92.51(d,j=21.7hz),73.39(s),37.97(d,j=8.1hz),33.03(d,j=2.8hz).hrms(esi)m/z:calcd for c
17
h
17
fno
+
[m+h]
+
270.1294,found 270.1293.
[0164]
实施例20
[0165]
将实施例1得到的2
‑
氟代苯乙腈衍生物(3aa,1mmol,188mg)和浓盐酸(3.0ml)在100℃加热12h。然后将反应液转移至分液漏斗中,用乙酸乙酯萃取(10ml
×
3)。有机相用无水硫酸钠干燥后,减压下除去溶剂。用乙酸乙酯/石油醚(1:1)快速柱层析,得到产品4c,产率为65%(135毫克)。
[0166][0167]
化合物4c的表征数据
[0168][0169]
无色液体。1h nmr(400mhz,cdcl3)δ7.55
–
7.52(m,2h),7.51(t,j=2.0hz,2h),7.49(d,j=2.5hz,1h),2.74
–
2.65(m,2h),2.65
–
2.52(m,2h).
19
f nmr(471mhz,cdcl3)δ
‑
149.31(s).
13
c nmr(126mhz,cdcl3)δ177.40(s),135.17(d,j=22.6hz),130.32(s),129.17(s),124.59(d,j=6.2hz),116.66(d,j=34.0hz),90.83(d,j=185.2hz),36.40(d,j=25.7hz),28.61(d,j=2.8hz).hrms(esi)m/z:calcd for c
11
h
11
fno
2+
[m+h]
+
208.0774,found 208.0776.
[0170]
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1