一种水中病毒的富集及检测方法
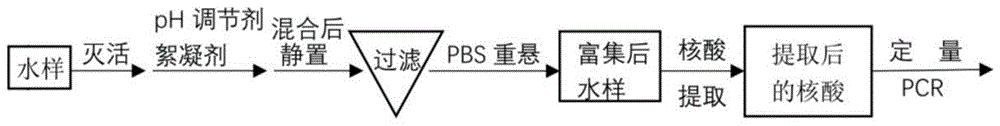
本发明涉及一种水中病毒的富集及检测方法,特别涉及污水中新型冠状病毒的富集及检测方法,属于生物分析测试和环境监测领域。
背景技术:
:环境中存在的各种致病病毒对人类健康造成了极大的危害。目前已经证实,污水中含有多种不同种类的病毒,如诺如病毒、脊髓灰质炎病毒、甲肝病毒、轮状病毒等等,这些病毒以水为媒介,经常引起传染病的爆发,因此有必要对其进行快速高效的检测,从而预防传染病大规模爆发流行。新冠疫情发生以来,许多地方已经在未经处理的污水和/或污泥中检测到sars-cov-2的rna片段,例如意大利、西班牙、澳大利亚、荷兰、美国、法国等。有研究表明,在新冠病例确诊前4-7天可检测到sars-cov-2rna浓度的变化,从而可以发出预警。相比于对人体的直接检测,检测污水厂进水中的病毒能够覆盖的人数更加广泛,包括不能及时进行人体检测或者未出现症状而不进行检测的感染者。因此,对污水中病毒尤其是新型冠状病毒的检测,是非常必要的,这可以为新冠疫情的爆发提供有效的预警,为公共卫生部门决定是否封锁城市争取宝贵的时间,从而有利于避免大范围传播和扩散。但是,水样体积巨大,其中病毒含量相对较少,现有的研究手段很难直接从水中检出病毒,因此在检测前先对水中的病毒进行富集就十分必要。病毒的富集不同于细菌,由于病毒颗粒直径较小,很难依靠机械阻留于膜上实现富集。世界各国各地学者及机构对如何实现水体中病毒的有效富集进行了大量探索,美国和欧盟也颁布了相应的指导性文件,如美国“水和废水检测标准方法”中的9510部分以及欧洲标准协会发布的bsen14486-2005等。总结下来,对病毒的富集浓缩主要有以下几种方法:吸附洗脱法、絮凝沉淀法、免疫学法、超滤法、超速离心法、电泳法、反渗透等方法。尽管富集方法较多,但是却存在诸如操作复杂、价格昂贵、耗费时间较长、效果不稳定、易受到水质水量的影响、难以推广等许多问题。本发明能够实现对水中病毒的富集,之后采用研磨的方式将病毒从富集后的胶体中释放,再进行核酸提取及荧光定量pcr检测,操作简单、病毒回收率高,能够快速高效获得结果,避免了因方法耗费时间长而错过良好决策时机的问题。技术实现要素:本发明的目的是针对现有水中病毒浓度检测过程中由于富集低浓度病毒存在的技术问题,提供一种水中病毒的富集及检测方法,本发明方法中病毒富集不受待测水体的水质水量的影响,病毒富集效率高,效果稳定,病毒浓度检测结果准确。为实现本发明的目的,本发明一方面提供一种水中病毒的富集方法,包括首先测定或/和调节水的ph;接着加入絮凝剂,对水中病毒进行絮凝处理;然后进行过滤处理,获得富集病毒。其中,所述病毒为新冠病毒、猪流行性腹泻病毒(pedv)、猪传染性胃肠炎病毒(tgev)、轮状病毒(porv)、禽流感病毒(aiv)、猪伪狂犬病毒(prv)、猪细小病毒(ppv)或猪圆环病毒(pcv),优选为猪流行性腹泻病毒(pedv)、猪传染性胃肠炎病毒(tgev)、新冠病毒;所述水选择农村或城市生活污水、医院污水、畜禽养殖厂污水、屠宰污水、农贸市场污水、河,湖等自然水体或饮用水;所述调节水的ph为调节水的ph值为4-9,优选为5-7,进一步优选为6。若测定的水的ph值为4-9,则不需要进行ph调节;如果测定的水的ph值不在4-9之间,则添加ph调节剂,调整水的ph至4-9,优选为5-7,进一步优选为6。ph调节剂选盐酸或氢氧化钠溶液,优选为1m盐酸溶液或氢氧化钠溶液。特别是,所述絮凝剂选择铝盐絮凝剂,优选为氯化铝、硫酸铝、聚合氯化铝或聚合硫酸铝铁,优选为氯化铝。尤其是,加入絮凝剂后,水样中的絮凝剂铝离子浓度为0.001-0.01m,优选为0.001-0.003m,进一步优选为0.003m。本发明另一方面提供一种水中病毒的检测方法,包括如下顺序进行的步骤:1)向水中加入絮凝剂,接着加入ph调节剂,调整水的ph值为4-9,絮凝剂对水体中的病毒进行絮凝处理,获得絮凝混合液;2)对絮凝混合液进行过滤处理,并将过滤后的固体重新悬浮于缓冲溶液中,制得重悬混合液;3)对重悬混合液进行研磨处理,制得研磨液;4)对研磨液进行核酸提取,并进行核酸定量pcr测定。其中,步骤1)中所述絮凝剂为铝盐絮凝剂,优选为氯化铝、硫酸铝、聚合氯化铝或聚合硫酸铝铁,优选为氯化铝。特别是,加入絮凝剂后,水中的铝盐絮凝剂的铝离子浓度为0.001-0.01m,优选为0.001-0.003m,进一步优选为0.003m。特别是,加入絮凝剂之后,调节水的ph值为5-7,优选为6。特别是,在加入絮凝剂之前,还包括测定或/和调节水的ph值,在水的ph为4-9的条件下,加入所述的絮凝剂。尤其是,调节水的ph值为5-7,优选为6。其中,所述絮凝处理是将调节ph值后的水进行搅拌,絮凝剂与水液充分混合。特别是,絮凝处理时间至少15min,优选为15-20min。尤其是,将调节ph值后的水置于摇床中,在转速为100-200rpm的条件下混合至少15min,优选为15-20min。特别是,在向水中加入絮凝剂之前,还包括测定或/和调节水的ph值,使水的ph值为4-9,优选为ph为5-7,进一步优选为6。尤其是,在测定或调解水的ph值之前,还包括步骤1a),对水中病毒进行灭活处理。其中,选用巴氏消毒法进行所述的灭活处理。特别是,巴氏消毒法的温度为56-62℃,优选为60-62℃,进一步优选为60℃;消毒时间至少30min,优选为30-120min,进一步优选为30-90min,更进一步优选为30min。其中,步骤2)中所述的缓冲溶液选择pbs缓冲溶液、tris-hcl缓冲液、hepes缓冲液,优选为pbs缓冲液。特别是,所述pbs缓冲液的浓度为0.01m;ph为7.2-7.4。尤其是,所述缓冲溶液的浓度为0.01m;ph为7.2-7.4。特别是,还包括对过滤后的固体进行称重,获得絮凝处理后沉淀的固体的重量后再重新悬浮于缓冲溶液中。其中,如果固体重量≤1.5g时,则重悬缓冲溶液用量为1-5ml,优选为2-4ml,进一步优选为3ml;如果固体重量≥1.5g时,则重悬缓冲液用量按照公式(1b)来确定:y=a(x-1.5)+3(1b)公式(1b)中:y为重悬缓冲液的体积(ml);x为过滤后的固体的重量(g);a为比例系数,a=1-3,优选为2。特别是,在进行过滤处理之前,还包括将絮凝混合液进行静置处理至少15min,优选为15-30min,使得吸附于絮凝剂上的病毒,充分沉淀。尤其是,所述过滤处理为采用滤纸进行过滤,滤除上清液。特别是,过滤后的固体的含水率为78%-98%,优选为85-95%,进一步优选为89-95%。其中,步骤3)中所述研磨处理为采用研磨仪,在研磨频率为20-30hz的条件下,对重悬混合液研磨3-15min,优选为5-15min,进一步优选为5min。特别是,所述研磨处理过程中研磨频率为30hz,研磨时间5min。尤其是,精确吸取100-600μl的重悬混合液进行所述的研磨处理,优选为200-400μl,进一步优选为300μl。特别是,还包括对重悬混合液进行混合处理,所述混合处理选择涡旋处理,使得重悬混合液混合均匀。尤其是,涡旋处理时间≥1min,优选为1-5min。特别是,还包括对重悬混合液进行搅拌处理,使得重悬混合液混合均匀。尤其是,搅拌处理,混匀的时间≥1min,优选为1-5min。其中,步骤4)中采用磁珠法、离心柱法、酚/氯仿抽提法进行所述的核酸提取,优选为磁珠法。特别是,核酸提取过程按照核酸提取试剂盒的操作方法进行。其中,所述核酸定量pcr测定选择逆转录定量pcr或数字pcr进行检测特别是,采用荧光定量pcr法、核酸依赖性扩增检测技术(nasba)或数字pcr(dpcr)法测定病毒核酸含量,优选为荧光定量pcr。特别是,采用荧光定量pcr法测定过程中,获得病毒pcr扩增后的ct值,然后按照公式(1a)计算水样中病毒拷贝数,其中公式(1a)如下:式(1a)中:ct1为待测水样的荧光定量pcr的ct值;ct2为已知病毒浓度的样品的ct值;c1为待测水样中病毒浓度,copies/μl;c2为已知样品中病毒浓度,copies/μl。其中,所述已知病毒浓度样品的ct值按照与待测病毒的荧光定量pcr法相同的pcr程序进行扩增,并收集荧光,获得相应的ct值。与现有技术相比,本发明具有如下优点和好处:1、本发明方法简单高效,操作简便迅速,六小时内即可获得结果,为及时预防病毒尤其是新冠病毒的传播和扩散争取了宝贵的时间。2、本发明不受水质水量的影响,避免了因巨量体积采样而导致的实际不可操作性,省时省力,方便检测工作,适合大范围应用和推广。3、本发明采用一步浓缩的方法,省去了二次浓缩所加入的有机或无机物质对后续结果的影响,提高了方法的准确度和检测灵敏性。4、本发明方法无需对待检测水体进行预处理,避免了因预过滤操作所导致的病毒损失,病毒浓度检测结果准确度高。5、本发明方法使用的试剂成本低,设备要求不高,一次性投入较少,易于基层单位操作,具有广泛的适用性。附图说明:图1为本发明水中病毒富集、检测操作流程图。具体实施方式下面结合附图和具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。本发明具体实施方式结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。本发明具体实施方式中的病毒均来自于疫苗,其中:猪流行性腹泻病毒(pedv,(porcineepidemicdiarrheavirus)、猪传染性胃肠炎病毒(tgev,porcinetransmissiblegastroenteritisvirus)来自于活疫苗(即猪传染性胃肠炎、猪流行性腹泻二联活疫苗(hb08株+zj08株),腹康牌;兽用非处方药),购自于中牧实业有限公司;成都药械厂;中牧批号:1901001;其中tgev为hb08株;pedv为zj08株;轮状病毒(porv,porcinerotavirus)为g5型nx株,来自于猪传染性胃肠炎、猪流行性腹泻、猪轮状病毒(g5型)三联活疫苗(弱毒华毒株+弱毒cv777株+nx株),购自于哈尔滨维科生物技术有限公司;禽流感病毒(aiv,avianinfluenzavirus)为h7-re2株,来自于禽流感病毒疫苗(购自于哈尔滨维科生物技术有限公司);猪伪狂犬病毒(prv,porcinepseudorabiesvirus)为hb-98株,来自于猪伪狂犬病疫苗活疫苗,购自于中牧实业有限公司;猪细小病毒(ppv,porcineparvovirus)为wh-1株,来自于猪细小病毒疫苗,购自于中牧实业有限公司;实施例1:絮凝-过滤方法对水中病毒的富集和检测1、配制含病毒水样取适量猪传染性胃肠炎、猪流行性腹泻二联活疫苗加入到pbs缓冲液中,溶解,制成病毒母液,利用数字pcr法(采用美国伯乐bioradqx200数字pcr(qx200tmdropletdigitaltmpcr)仪器及相关试剂)测定病毒母液的浓度,其中,猪流行性腹泻病毒(porcineepidemicdiarrheavirus,pedv)的初始浓度为6.7×107copies/μl。将一定体积(50μl)的浓度为6.7×107copies/μl的猪流行性腹泻病毒(porcineepidemicdiarrheavirus,pedv)稀释到50ml自来水中,使得水样中病毒浓度数量级为104copies/μl,配制成含病毒的水样,备用;本实施例中的病毒以pedv为例,本领域中现有已知的其他病毒均适用于本发明,例如新冠病毒、猪流行性腹泻病毒(pedv)、猪传染性胃肠炎病毒(tgev)、轮状病毒(porv)、禽流感病毒(aiv)、猪伪狂犬病毒(prv)、猪细小病毒(ppv)或猪圆环病毒(pcv)等。通常为了保证操作人员的安全,在富集、检测过程中,应该首先对水体、病毒进行灭活操作。本实施例中猪流行性腹泻病毒对人无害,因此未进行病毒灭活处理。2、絮凝处理首先向步骤1)制备的含病毒的水样中加入ph调节剂,对水样进行第一次ph调节,调节水样ph值为6(ph通常为4-9,优选为5-7)后加入絮凝剂(alcl3),搅拌混合均匀,使得水样中絮凝剂铝离子的浓度为0.003m(通常为0.001-0.01m);接着再加入ph调节剂,对含病毒的水样进行第二次ph调节,调节含病毒水样ph值为6(通常为4-9,优选为5-7)后将水样置于摇床中,以150rpm(通常为100-200rpm)的转速混合均匀;第二次ph调节后,加入到水样中的絮凝剂alcl3形成氢氧化铝胶体,形成的胶体与水体中的病毒充分接触并吸附于胶体,絮凝、沉淀水体中的病毒。本发明中絮凝剂除了氯化铝之外,其他硫酸铝、聚合氯化铝、聚合硫酸铝铁均适用于本发明;加入絮凝剂氯化铝后,水体中铝离子的浓度除了0.003m之外,其他浓度0.001-0.01m均适用于本发明;ph调节剂为1m盐酸溶液或氢氧化钠溶液。3、过滤、重悬处理摇床混合15min(通常摇床混合时间至少15min,优选为15-20min)后,将水样于室温静置15min(通常静置处理时间≥15min,优选为15-30min);然后将上清液缓慢倒掉,剩下的液体用滤纸过滤;将滤纸上的固体转移到已知重量的离心管中,称量离心管与其内部的固体的总质量,固体重量为0.7322g(过滤后滤纸上的固体质量小于1.5g,固体含水率为89.16%,通常为85-95%),接着加入3ml、浓度为0.01m、ph为7.3的缓冲液pbs(磷酸缓冲盐溶液),使得滤纸上的固体重新悬浮于缓冲液pbs中,即重悬处理,获得重悬混合液;本领域中一定量的固体中加入3mlpbs中,所得总体积准确地说是大于3ml的,但是也根据固体的量及其在pbs中的溶解情况来共同决定,通常本领域以pbs的体积来进行计算。本发明中过滤后的固体重悬过程中重悬液的用量按照如下方法进行:当固体重量≤1.5g时,重悬缓冲溶液的体积为3ml(通常为1-5ml);固体重量≥1.5g时,重悬缓冲液与固体重量按照公式(1)来确定重悬缓冲溶液的体积:y=a(x-1.5)+3(1)公式(1)中:y为重悬缓冲液的体积(ml);x为过滤后的固体的重量(g);a为比例系数,a=1-3,优选为2;本实施例中重悬处理使用的缓冲液的用量在过滤后的固体重量低于1.5g时,以3ml为例,其他用量如1-5ml均适用于本发明。本发明具体实施方式中重悬处理的缓冲液以浓度为0.01m、ph为7.3的pbs为例,其他浓度0.01m;ph为7.2-7.4的pbs均适用于本发明;而且其他浓度为0.01m、ph为7.2-7.4的tris-hcl、hepes也适用于本发明。4、研磨处理对全部的重悬混合液涡旋混匀2min(通常涡旋混合时间≥1min,优选为1-5min),接着从中精确吸取300μl(通常为100-600μl),放入研磨仪,以30hz(通常为20-30hz)的频率,进行研磨处理5min(通常为3-5min),获得研磨混合液;5、病毒核酸提取与定量检测按照核酸提取试剂盒(磁珠法:magmaxtmcorenucleicacidpurificationkit)对研磨处理后的研磨混合液进行核酸提取;然后对pedv进行荧光定量pcr检测,在pcr反应体系中加入荧光定量pcr检测的mix(酶、四种三磷酸脱氧核苷酸(dntp)、mg2+、荧光基团、扩增缓冲液),ddh2o,与病毒pedv相对应的引物、模板样品;pedv为rna病毒,按照程序进行pcr扩增,其中pcr反应程序为:45℃,15min;95℃,2min;95℃,15s及60℃,1min,对于95℃,15s及60℃,1min循环40次,并在最后一步收集荧光。每个实验3次重复,获得3次重复的pedvct值分别为24.71、24.14、25.32。如果待检测病毒为dna病毒,则其pcr反应程序为95℃,2min;95℃,15s及60℃,1min,对于95℃,15s及60℃,1min循环40次,并在最后一步收集荧光。将利用数字pcr测得的已知浓度为6.7×107的pedv病毒按照上述荧光定量pcr程序进行扩增,并收集荧光,3次重复,获得已知浓度pedv的ct值为16.67。根据荧光定量pcr结果的ct值,按照公式(1a)计算回收病毒拷贝数;式(1a)中:ct1为待测水样的荧光定量pcr的ct值;ct2为已知浓度样品的ct值;c1为待测水样中病毒浓度,copies/μl;c2为已知样品中病毒浓度,copies/μl。利用已知浓度的病毒及其ct值的结果,可以根据式(1a),通过待测病毒的ct值计算待测病毒的拷贝数,而后根据水样中病毒富集及病毒核酸提取过程中的水样的体积变化,计算得到水样富集后病毒的的总拷贝数,即是回收病毒的拷贝数,分别为2.73×108、4.04×108、1.79×108。然后按照公式(1)计算病毒回收率,式(1)中回收病毒拷贝数由定量pcr结果计算得到;投加病毒拷贝数根据水样中病毒投加量确定,测定结果如表1。本发明实施例采用磁珠法提取核酸,其他本领域中现有的已知的合适提取法例如酚/氯仿抽提法、离心柱法均适用于本发明,采用本领域现有已知的核酸提取试剂盒提取核酸。本发明采用荧光定量pcr检测病毒核酸含量,即根据测定的ct值,计算病毒回收率,本领域中其他定量检测方法如核酸依赖性扩增检测技术(nasba)或数字pcr(dpcr)法测定病毒核酸含量均适用于本发明。荧光定量pcr检测,在pcr反应体系中加入荧光基团,酶、四种三磷酸脱氧核苷酸(dntp)、扩增缓冲液、mg2+、ddh2o、引物、模板样品。如果待检测的病毒为rna病毒,则其pcr反应程序为:45℃,15min;95℃,2min;95℃,15s及60℃,1min,对于95℃,15s及60℃,1min循环40次,并在最后一步收集荧光。每个实验3次重复。如果待检测的病毒为dna病毒,则其pcr反应程序为:95℃,2min;95℃,15s及60℃,1min,对于95℃,15s及60℃,1min循环40次,并在最后一步收集荧光。每个实验3次重复。对照例1a:絮凝-离心-洗脱离心方法对水中病毒的富集和检测1、配制含病毒水样与实施例步骤1)相同。2、絮凝处理与实施例步骤2)相同。3、离心、重悬处理摇床混合15min(通常摇床混合时间至少15min,优选为15-20min)后,将水样于离心机中进行第一次离心处理(1700g,20min);然后将离心上清液缓慢倒掉,剩下的液体用10mlph为7.4的质量百分比为3%的牛肉浸提液进行第一次重悬处理;将第一次重悬处理后的混合液放入摇床中,以150rpm的速度混合10min后,再于离心机中进行第二次离心处理(1900g,30min);将第二次离心处理后的上清液缓慢倒掉,固体用1ml、浓度为0.01m、ph为7.3的缓冲液pbs(磷酸盐缓冲盐溶液)重悬,获得重悬混合液;4、研磨处理对全部的重悬混合液涡旋混匀2min(通常涡旋混合时间≥1min,优选为1-5min),接着从中精确吸取300μl(通常为100-600μl),放入研磨仪,以30hz(通常为20-30hz)的频率,进行研磨处理5min(通常为3-5min),获得研磨混合液;5、病毒核酸提取与定性、定量检测与实施例1的步骤5)相同。检测过程中测定2个平行样,计算得回收率后取平均值。荧光定量pcr测定的结果为:2次平行样的pedvct值分别为28.47、29.29。根据公式(1a)计算获得回收病毒的拷贝数,分别为7.24×106、4.08×106。按照公式(1)计算病毒回收率的结果如表1。对照例1b:絮凝-过滤-洗脱离心方法对水中病毒的富集和检测1、配制含病毒的水样与实施例步骤1)相同。2、絮凝处理与实施例步骤2)相同。3、过滤、离心处理摇床混合15min(通常摇床混合时间至少15min,优选为15-20min)后,将水样于室温静置15min(通常静置处理时间≥15min,优选为15-30min);然后将上清液缓慢倒掉,剩下的液体用滤纸过滤;将滤纸上的固体转移到已知重量的离心管中,并加入1ml、质量百分比浓度为3%的牛肉浸提液进行第一次重悬处理,使得滤纸上的固体重新悬浮于牛肉浸提液中;将第一次重悬处理后的混合液放入摇床中,以150rpm的速度混合10min后,再于离心机中进行离心处理(1900g,30min);上清液缓慢倒掉,固体用1ml、浓度为0.01m、ph为7.3的缓冲液pbs(磷酸盐缓冲盐溶液)进行第二次重悬处理,获得重悬混合液;4、研磨处理对全部的重悬混合液涡旋混匀2min(通常涡旋混合时间≥1min,优选为1-5min),接着从中精确吸取300μl(通常为100-600μl),放入研磨仪,以30hz(通常为20-30hz)的频率,进行研磨处理5min(通常为3-5min),获得研磨混合液;5、病毒核酸提取与定性、定量检测与实施例1的步骤5)相同。检测过程中测定2个平行样,算得回收率后取平均值。荧光定量pcr测定的结果为:2次平行样的pedvct值分别为26.14、24.79。根据公式(1a)计算获得回收病毒的拷贝数,分别为9.28×107、3.64×107。按照公式(1)计算病毒回收率的结果如表1。表1实施例1与对照例1a、1b的病毒回收率结果对比编号pedva回收率实施例18.52%±3.38%对照例1a0.17%±0.07%对照例1b1.93%±1.19%每个样品均有2-3次平行实验。对照例1a-1b中猪流行性腹泻病毒(pedv)的回收率均不足1%,与本发明的实施例1相比,对照例的两种方法(絮凝-离心、絮凝-过滤-洗脱离心)均无法实现水样中病毒的有效富集,而本发明(实施例1)可以有效实现对水样中病毒的有效富集,病毒回收率达到8%以上。实施例2:对富集前病毒浓度数量级为105copies/μl的水样进行富集和检测对两种冠状病毒(rna病毒):pedv、tgev(猪传染性胃肠炎病毒,porcinetransmissiblegastroenteritisvirus)探究本发明方法对其富集前不同浓度的适应性。二联疫苗是指两种互相之间没有影响的疫苗混合在一起而形成的联合疫苗,因此疫苗中两种病毒浓度的比例关系是确定的。将tgev与pedv二联疫苗加入到pbs缓冲液中,溶解,制成病毒母液,利用数字pcr法(采用美国伯乐bioradqx200数字pcr(qx200tmdropletdigitaltmpcr)仪器及相关试剂)测定病毒母液的浓度,其中,猪流行性腹泻病毒(pedv)的初始浓度为6.7×107copies/μl;tgev的初始浓度为6.59×106copies/ul。1、配制含病毒的水样取一定体积(500ul)的tgev与pedv二联疫苗(病毒母液)稀释到50ml自来水中,使得水样中pedv、tgev病毒的初始浓度数量级分别为105copies/μl、104copies/μl,配制成含病毒水样,备用;2、絮凝处理与实施例1的步骤2)“絮凝处理”相同。ph调节剂为1m盐酸溶液或氢氧化钠溶液。3、过滤、重悬处理除了固体重量为0.7847g(过滤后滤纸上的固体质量小于1.5g),加入3mlpbs之外,其余与实施例1的步骤3)“过滤、重悬处理”相同。4、研磨处理与实施例1的步骤4)“研磨处理”相同。5、病毒核酸提取与定性、定量检测按照核酸提取试剂盒(磁珠法:magmaxtmcorenucleicacidpurificationkit)对研磨处理后的研磨混合液进行核酸提取;然后对pedv、tgev分别进行荧光定量pcr检测,在pcr反应体系中加入荧光定量pcr检测的mix(酶、四种三磷酸脱氧核苷酸(dntp)、mg2+、荧光基团、扩增缓冲液),ddh2o,与病毒pedv、tgev分别相对应的引物、模板样品;pedv、tgev为rna病毒,按照程序进行pcr扩增,其中pcr反应程序为:45℃,15min;95℃,2min;95℃,15s及60℃,1min,对于95℃,15s及60℃,1min循环40次,并在最后一步收集荧光。3次重复,pedv、tgev的ct值如表1a。同时,将利用数字pcr测得的已知浓度为6.7×107的pedv;6.59×106的tgev病毒分别按照上述荧光定量pcr程序进行扩增,并收集荧光,3次重复,获得已知浓度pedv的ct值为16.67;tgev的ct值为19.86。根据公式(1a)计算获得回收病毒的拷贝数,如表1a。按照公式(1)计算病毒回收率的结果如表2。实施例2a:对富集前病毒浓度数量级为104copies/μl的水样进行富集和检测1、配制含病毒的水样取按照实施例2制备的病毒母液,一定体积(50ul)的tgev与pedv二联疫苗(病毒母液)稀释到50ml自来水中,使得水样中pedv、tgev病毒的初始浓度数量级分别为104copies/μl、103copies/μl,配制成含病毒水样,备用;2、絮凝处理首先向步骤1)制备的含病毒的水样中加入ph调节剂,对水样进行第一次ph调节,调节水样ph值为6(ph通常为4-9)后加入絮凝剂(alcl3),搅拌混合均匀,使得水样中絮凝剂铝离子的浓度为0.003m(通常为0.001-0.01m);接着再加入ph调节剂,对含病毒的水样进行第二次ph调节,调节含病毒水样ph值为6(通常为4-9)后将水样置于摇床中,以150rpm(通常为100-200rpm)的转速混合均匀;第二次ph调节后,加入到水样中的絮凝剂alcl3,形成氢氧化铝胶体,形成的胶体与水体中的病毒充分接触并吸附于胶体,絮凝、沉淀水体中的病毒;3、过滤、重悬处理摇床混合15min(通常摇床混合时间至少15min,优选为15-20min)后,将水样于室温静置15min(通常静置处理时间≥15min,优选为15-30min);然后将上清液缓慢倒掉,剩下的液体用滤纸过滤;将滤纸上的固体转移到已知重量的离心管中,称量离心管与固体的总重量,固体重量为0.6890g(固体质量小于1.5g),接着加入3ml、浓度为0.01m、ph为7.3的缓冲液pbs,使得滤纸上的固体重新悬浮于缓冲液pbs中,即重悬处理,获得重悬混合液;4、研磨处理对全部的重悬混合液涡旋混匀2min(通常涡旋混合时间≥1min,优选为1-5min),接着从中精确吸取300μl(通常为100-600μl),放入研磨仪,以30hz(通常为20-30hz)的频率,进行研磨处理5min(通常为3-5min),获得研磨混合液;5、病毒核酸提取与定性、定量检测按照核酸提取试剂盒(磁珠法:magmaxtmcorenucleicacidpurificationkit)对研磨处理后的研磨混合液进行核酸提取;然后对pedv、tgev分别进行荧光定量pcr检测,在pcr反应体系中加入荧光定量pcr检测的mix(酶、四种三磷酸脱氧核苷酸(dntp)、mg2+、荧光基团、扩增缓冲液),ddh2o,与病毒pedv、tgev分别相对应的引物、模板样品;pedv、tgev为rna病毒,按照程序进行pcr扩增,其中pcr反应程序为:45℃,15min;95℃,2min;95℃,15s及60℃,1min,对于95℃,15s及60℃,1min循环40次,并在最后一步收集荧光。3次重复,pedv、tgev的ct值如表1a。同时,将利用数字pcr测得的已知浓度为6.7×107的pedv;6.59×106的tgev病毒分别按照上述荧光定量pcr程序进行扩增,并收集荧光,3次重复,获得已知浓度pedv的ct值为16.67;tgev的ct值为19.86。根据公式(1a)计算获得回收病毒的拷贝数,如表1a。按照公式(1)计算病毒回收率的结果如表2。实施例2b:对富集前病毒浓度数量级为103copies/μl的水样进行富集和检测除了步骤1)“配制含病毒水样”中将tgev与pedv二联疫苗稀释10倍后,取50ul稀释到50ml自来水中,使得水样中pedv病毒的初始浓度数量级为103copies/μl;tgev病毒的初始浓度数量级为102copies/μl;步骤3)“过滤、重悬处理”中固体重量为0.5765g之外,其余与实施例2a相同。荧光定量pcr检测结果如表1a。按照公式(1)计算病毒回收率的结果如表2。实施例2c:对富集前病毒浓度数量级为102copies/μl的水样进行富集和检测除了步骤1)“配制含病毒水样”中将tgev与pedv二联疫苗稀释100倍后,取50ul稀释到50ml自来水中,使得水样中pedv病毒的初始浓度数量级为102copies/μl;tgev病毒的初始浓度数量级为101copies/μl;步骤3)“过滤、重悬处理”中固体重量为0.7098g之外,其余与实施例2a相同荧光定量pcr检测结果如表1a。按照公式(1)计算病毒回收率的结果如表2。实施例2d:对富集前病毒浓度数量级为101copies/μl的水样进行富集和检测除了步骤1)“配制含病毒水样”中将tgev与pedv二联疫苗稀释1000倍后,取50ul稀释到50ml自来水中,使得水样中pedv病毒的初始浓度数量级为101copies/μl;tgev病毒的初始浓度数量级为100copies/μl;步骤3)“过滤、重悬处理”中固体重量为0.7721g之外,其余与实施例2a相同。荧光定量pcr检测结果如表1a。按照公式(1)计算病毒回收率的结果如表2。表1a实施例2-2d病毒荧光定量pcr测定结果实施例3a:改变加入的氯化铝溶液和水样的比例后进行富集和检测除了步骤2)“絮凝处理”过程中加入的絮凝剂alcl3后,水样中絮凝剂铝离子的浓度为0.00375m(通常为0.001-0.01m);步骤3)“过滤、重悬处理”中固体重量为1.3675g之外,其余与实施例2a相同。荧光定量pcr检测结果如表2a。按照公式(1)计算病毒回收率的结果如表2。实施例3b:改变加入的氯化铝溶液和水样的比例后进行富集和检测除了步骤2)“絮凝处理”过程中加入的絮凝剂alcl3后,水样中絮凝剂铝离子的浓度为0.00225m(通常为0.001-0.01m);步骤3)“过滤、重悬处理”中固体重量为0.5245g之外,其余与实施例2a相同。荧光定量pcr检测结果如表2a。按照公式(1)计算病毒回收率的结果如表2。实施例3c:改变加入的氯化铝溶液和水样的比例后进行富集和检测除了步骤2)“絮凝处理”过程中加入的絮凝剂alcl3后,水样中絮凝剂铝离子的浓度为0.0015m(通常为0.001-0.01m);步骤3)“过滤、重悬处理”中固体重量为0.4980g之外,其余与实施例2a相同。荧光定量pcr检测结果如表2a。按照公式(1)计算病毒回收率的结果如表2。实施例3d:改变加入的氯化铝溶液和水样的比例后进行富集和检测除了步骤2)“絮凝处理”过程中加入的絮凝剂alcl3后,水样中絮凝剂铝离子的浓度为0.00075m(通常为0.001-0.01m);步骤3)“过滤、重悬处理”中固体重量为0.3298g之外,其余与实施例2a相同。荧光定量pcr检测结果如表2a。按照公式(1)计算病毒回收率的结果如表2。表2a实施例3a-3d病毒的荧光定量pcr测定结果实施例4a:改变重悬固体用磷酸盐缓冲液体积除了步骤3)“过滤、重悬处理”中将过滤后的固体(0.8002g)重新悬浮与1ml的浓度为0.01m、ph为7.3的缓冲液pbs中之外,其余与实施例2a相同。荧光定量pcr检测结果如表3a。按照公式(1)计算病毒回收率的结果如表2。实施例4b:改变重悬固体用磷酸盐缓冲液体积除了步骤3)“过滤、重悬处理”中将过滤后的固体(0.7690g)重新悬浮与2ml的浓度为0.01m、ph为7.3的缓冲液pbs中之外,其余与实施例2a相同。荧光定量pcr检测结果如表3a。按照公式(1)计算病毒回收率的结果如表2。实施例4c:改变重悬固体用磷酸盐缓冲液体积除了步骤3)“过滤、重悬处理”中将过滤后的固体(0.7815g)重新悬浮与4ml的浓度为0.01m、ph为7.3的缓冲液pbs中之外,其余与实施例2a相同。荧光定量pcr检测结果如表3a。按照公式(1)计算病毒回收率的结果如表2。表3a实施例4a-c病毒的荧光定量pcr测定结果实施例5a:改变研磨操作的时间除了对重悬混合液不进行研磨处理之外,其余与实施例2a相同。荧光定量pcr检测结果如表4a。按照公式(1)计算病毒回收率的结果如表2。实施例5b:改变研磨操作的时间除了步骤4)中对重悬混合液研磨处理10min之外,其余与实施例2a相同。荧光定量pcr检测结果如表4a。按照公式(1)计算病毒回收率的结果如表2。实施例5c:改变研磨操作的时间除了步骤4)中对重悬混合液进行研磨处理15min之外,其余与实施例2a相同。荧光定量pcr检测结果如表4a。按照公式(1)计算病毒回收率的结果如表2。表4a实施例5a-c病毒的荧光定量pcr测定结果实施例6a:对富集后样品选用不同提取方式提取除了步骤5)“病毒核酸提取与定性、定量检测”中采用tianampvirusdna/rnakit(dp315)试剂盒(离心柱法)进行病毒提取之外,其余与实施例2a相同。荧光定量pcr检测结果如表5a。按照公式(1)计算病毒回收率的结果如表2。实施例6b:对富集后样品选用不同提取方式提取除了步骤5)“病毒核酸提取与定性、定量检测”中采用用酚/氯仿抽提法进行病毒提取之外,其余与实施例2a相同。荧光定量pcr检测结果如表5a。按照公式(1)计算病毒回收率的结果如表2。表5a实施例6a-6b病毒的荧光定量pcr测定结果表2实施例2-6b中pedv、tgev两种病毒的回收率测定结果表明:1)由表2中实施例2-2d的测定结果可知:两种病毒(pedv、tgev)在富集前的水样中不同的初始浓度,病毒pedv回收率均在4.79%以上,病毒tgev的回收率在4.92%以上,并且富集前病毒浓度较高,实验重现性较好;对于低浓度病毒,虽然测定结果有波动,但是病毒回收率高,因此,本发明的水样中病毒富集方法对不同浓度的病毒均可行。2)由实施例2a、3a-3d的测定结果可知:本发明方法中添加不同体积的絮凝剂,使得水样中铝离子浓度为0.00075m-0.00375m,采用本发明方法富集的病毒的回收率均>1%,适用于本发明,其中水样中铝离子浓度为0.003m的效果最优。3)由实施例2a、4a-4c的测定结果可知:实施例4a-4c回收率在递增;但与实施例2a相比,回收率小于实施例2a,因此改变本发明重悬沉淀所用pbs的体积,3ml加入量为最优。4)由实施例2a、5a-5c的测定结果可知:实施例5a与实施例2a相比,增加研磨可以增加回收率;实施例2a与实施例5c、5d相比,高频研磨5min即可以实现病毒的有效释放,增加研磨时间会增加处理时间和电耗,故5min的高频研磨为优选结果。5)由实施例2a、6a-6b的测定结果可知:实施例6a-6b与实施例2a相比,磁珠法提取效率最高,故核酸提取优选方式为磁珠法。实施例1-6表明,该发明对于水中初始浓度为100copies/μl~105copis/μl的病毒均适用,优选反应条件为:絮凝剂选用alcl3,加入絮凝剂后,含病毒水样中铝离子浓度为0.003m,用3mlpbs重悬过滤得到的固体,研磨5min后用磁珠法提取。实施例7a:污水中多种病毒的富集和检测将适量tgev、pedv、porv三联疫苗、禽流感疫苗、猪伪狂犬病毒疫苗、猪细小病毒疫苗分别加入到pbs缓冲液中,溶解,制成病毒母液,分别利用数字pcr法(采用美国伯乐bioradqx200数字pcr(qx200tmdropletdigitaltmpcr)仪器及相关试剂)测定各病毒母液中各自对应病毒的浓度,其中,pedv、tgev、porv、aiv、prv、ppv的初始浓度分别为3.3×106、4.76×106、4.5×106、6.13×106、8.18×106、1.41×107copies/μl。以北京某市政污水厂的进水为对象,将病毒(pedv、tgev、porv、aiv、prv、ppv)的初始浓度分别为3.3×106、4.76×106、4.5×106、6.13×106、8.18×106、1.41×107copies/μl的病毒母液分别稀释100倍,然后取50μl稀释后的病毒溶液分别加入到50ml污水中,配制成含病毒水样,其中使得富集前水样中pedv、tgev、porv、aiv、prv病毒浓度数量级为101copies/μl,ppv病毒浓度数量级为102copies/μl,其他操作同实施例2a,病毒ct值如表6a。将tgev与pedv二联疫苗;tgev、pedv与porv三联疫苗、禽流感疫苗、猪伪狂犬病毒疫苗、猪细小病毒疫苗分别加入到pbs缓冲液中,溶解,分别制成病毒母液,分别利用数字pcr法(采用美国伯乐bioradqx200数字pcr(qx200tmdropletdigitaltmpcr)仪器及相关试剂)测定各病毒母液中病毒的浓度,其中,pedv、tgev、porv、aiv、prv、ppv的初始浓度分别为6.7×107、6.59×106、4.5×105、6.13×105、8.18×105、1.41×106copies/μl。病毒核酸提取与定量检测过程中还同时,将上述用数字pcr测得的已知浓度为6.7×107copies/μl的pedv;6.59×106copies/μl的tgev、4.5×105copies/μl的porv、6.13×105copies/μl的aiv、8.18×105copies/μl的prv、1.41×106copies/μl的ppv病毒分别按照上述荧光定量pcr程序进行扩增,并收集荧光,3次重复,分别获得已知浓度pedv的ct值为16.67;tgev的ct值为19.86、porv的ct值为23.94、aiv的ct值为18.50、prv的ct值为22.00、ppv的ct值为17.18。根据荧光定量pcr结果的ct值,按照公式(1a)计算回收病毒拷贝数;按照公式(1)计算病毒回收率,回收率结果见表3。荧光定量pcr检测结果如表6a。按照公式(1)计算病毒回收率的结果如表3。实施例7b:自来水中多种病毒的富集和检测除了以采集北京某小区龙头水为对象,将各病毒母液稀释100倍后,各取50μl,分别加入到50ml自来水中(即以北京某小区龙头水自来水替代实施例7a中的污水),制成含病毒水样之外,其余与实施例7a相同。荧光定量pcr检测结果ct值、回收病毒拷贝数如表6a;病毒回收率见表3。实施例8a:对水中病毒灭活后进行富集和检测将适量tgev、pedv、porv三联疫苗、猪伪狂犬病毒疫苗分别加入到pbs缓冲液中,溶解,制成病毒母液,分别利用数字pcr法(采用美国伯乐bioradqx200数字pcr(qx200tmdropletdigitaltmpcr)仪器及相关试剂)测定各病毒母液中各自对应病毒的浓度,其中,pedv、tgev、porv、prv的初始浓度分别为3.3×106、4.76×106、4.5×106、8.18×106copies/μl。以采集北京某小区龙头水为对象,将初始浓度分别为3.3×106、4.76×106、4.5×106、8.18×106copies/μl的病毒(pedv、tgev、porv、prv)稀释100倍,然后各取50μl分别加入到50ml龙头水中,配制成含病毒水样,其中使得富集前水样中pedv、tgev、porv、prv病毒浓度数量级为101copies/μl;接着将含病毒水样于60℃条件下对水样中的病毒进行灭活30min之外,其余与实施例7b相同。荧光定量pcr检测结果ct值、回收病毒拷贝数如表6a;病毒回收率见表3。实施例8b:对水中病毒灭活后进行富集和检测除了对水样中的病毒进行灭活60min之外,其余与实施例8a相同。荧光定量pcr检测结果ct值、回收病毒拷贝数如表6a;病毒回收率见表3。实施例8c:对水中病毒灭活后进行富集和检测除了对水样中的病毒进行灭活90min之外,其余与实施例8a相同。荧光定量pcr检测结果ct值、回收病毒拷贝数如表6a;病毒回收率见表3。表6a实施例7a-7b、8a-8c病毒的荧光定量pcr测定结果表3不同实施和对照例中多种病毒的回收率表3的病毒回收率测定结果表明:1)由实施例7a、7b的结果可知:本发明方法处理的不管是污水还是饮用水,本发明方法的6种水中病毒回收率皆大于1%,表明本发明方法方法对不同水质具有高的适应性。2)由实施例8a-8c的结果可知:对水样进行病毒灭活处理,降低了水中病毒的回收率,但是为了降低操作者的风险,保障生命安全,和保证检测结果的有效性,选择对水样进行巴氏消毒,对待检测水样进行病毒灭活,其中巴氏消毒温度为60℃,消毒灭活时间至少30min,优选为30-90min。以巴氏消毒温度为60℃,消毒灭活时间30min,病毒回收率高,为优选。试验例1:实际医院污水检测检测北京市某医院污水处理系统的进水中是否含有病毒porv。1、灭活处理对采集自北京市某医院污水处理系统的进水作为检测水样,并对水样于60℃进行巴氏灭菌处理,进行病毒灭活处理,灭活处理30min后制得病毒灭活水样;2、絮凝处理向步骤1)制备的病毒灭活的水样中加入ph调节剂,对水样进行第一次ph调节,调节水样ph值为6(ph通常为4-9);接着加入絮凝剂(alcl3),搅拌混合均匀,使得水样中絮凝剂铝离子的浓度为0.003m(通常为0.001-0.01m);接着再加入ph调节剂,对含病毒的水样进行第二次ph调节,调节含病毒水样ph值为6(通常为4-9)后将水样置于摇床中,以150rpm(通常为100-200rpm)的转速混合均匀;第二次ph调节后,加入到水样中的絮凝剂alcl3形成氢氧化铝胶体,形成的胶体与水体中的病毒充分接触并吸附于胶体,絮凝、沉淀水体中的病毒;3、过滤、重悬处理摇床混合15min后,将水样于室温静置15min;然后将上清液缓慢倒掉,剩下的液体用滤纸过滤;将滤纸上的固体转移到已知重量的离心管中,称量离心管与其内部的固体的总重量,固体重量为0.9632g(小于1.5g),接着加入3ml、浓度为0.01m、ph为7.3的缓冲液pbs,使得滤纸上的固体重新悬浮于缓冲液pbs中,获得重悬混合液;4、研磨处理对全部的重悬混合液涡旋混匀2min,接着从中精确吸取300μl(通常为100-600μl),放入研磨仪,以30hz(通常为20-30hz)的频率,进行研磨处理5min(通常为3-5min),获得研磨混合液;5、病毒核酸提取与定性、定量检测按照核酸提取试剂盒(磁珠法:magmaxtmcorenucleicacidpurificationkit)对研磨处理后的研磨混合液进行核酸提取;然后对需要检测的病毒(porv)进行荧光定量pcr检测,在pcr反应体系中加入荧光定量pcr检测的mix(酶、四种三磷酸脱氧核苷酸(dntp)、mg2+、荧光基团、扩增缓冲液),ddh2o,与病毒porv相对应的引物、模板样品;porv为rna病毒,按照程序进行pcr扩增,其中pcr反应程序为:45℃,15min;95℃,2min;95℃,15s及60℃,1min,对于95℃,15s及60℃,1min循环40次,并在最后一步收集荧光。每个实验3次重复,获得3次重复的porv的ct值分别为35.86、35.89、35.82。将用数字pcr测得的已知浓度为8.18×105的porv病毒按照上述荧光定量pcr程序进行扩增,并收集荧光,3次重复,获得已知浓度porv的ct值为23.94。根据公式(1a)计算获得回收病毒porv的拷贝数,污水中porv病毒浓度约为5.63×104cipies/l。本发明上述实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1