工程化的人内源性病毒样颗粒及使用其递送至细胞的方法与流程
工程化的人内源性病毒样颗粒及使用其递送至细胞的方法
1.优先权要求
2.本技术要求于2019年6月13日提交的美国专利申请系列号62/861,186的权益。其全部内容通过引用并入本文。
3.联邦资助的研究或开发
4.本发明由美国国立卫生研究院(national institutes of health)授予的授权号gm118158在政府的支持下完成。美国政府享有本发明的某些权利。
技术领域
5.本文描述了工程化的人内源性病毒样颗粒(hevlp),其包含在外侧的、包含磷脂双层的膜;和在所述膜内侧的、置于所述hevlp的核心中的载物,例如,生物分子和/或化学载物,其中所述hevlp不包含来自非人gag或pol的蛋白,以及使用其将载物递送至细胞的方法。
背景技术:
6.将比如蛋白质、核酸和/或化学品的载物递送至活细胞的胞质溶胶中已是生物治疗发展的一项重大障碍。
技术实现要素:
7.本文描述了能够将dna、rna、蛋白质、化学化合物和/或分子,以及这四种实体的任何组合包装和递送至真核细胞中的hevlp。本文描述的非病毒hevlp系统具有比传统的人工衍生的脂质/金纳米颗粒和基于病毒颗粒的递送系统更简单、更有效和更安全的潜能,这是因为hevlp由人源组分组成。内部的载物可以是或可以不是人源的,但hevlp完全由来自人和合成的非免疫原性组分组成。“合成的”组分包括表面scfv/纳米抗体/darpin肽,这些已被证明不是免疫刺激性的,并可用于增强hevlp的靶向和细胞摄取。这意味着颗粒的外表面缺少显著免疫刺激性的组分,这应该使这些颗粒的免疫原性和抗体中和作用最小化。除载物外,hevlp不含有其他vlp固有的外源性病毒组分,并且这代表了技术的重大的和新颖的进步。此外,hevlp可利用(但不需要)基于化学的二聚物,并且hevlp具有包装和递送载物分子的能力,所述载物分子包括治疗或诊断剂,包括生物分子和化学品,例如,特殊的(specialty)单和/或双链dna分子(例如,质粒、微环、封闭末端线性dna、aav dna、附加体、噬菌体dna、同源定向修复模板等)、单和/或双链rna分子(例如,单向导rna、引导编辑(prime editing)向导rna、信使rna、转移rna、长链非编码rna、环状rna、rna复制子、环状或线性剪接rna、微小rna、小干扰rna、短发夹rna、piwi相互作用rna、支点开关rna、可由rna结合蛋白结合的rna、噬菌体rna、含有rna的内部核糖体进入位点等)、蛋白质、化学化合物和/或分子(例如,小分子),以及上面列出的载物的组合(例如aav颗粒)。
8.本文描述的hevlp不同于传统的逆转录病毒颗粒、病毒样颗粒(vlp)、外泌体(exosome)和其他先前描述的可负载有载物的细胞外囊泡,至少因为hevlp可通过在人细胞
中的人源组分的战略性过表达来生产,hevlp具有很多不同的可能的载物和负载策略,hevlp缺少限制性dna/rna长度约束,hevlp缺少源自pol和外源性gag的蛋白质,并且hevlp具有独特的细胞进入的机制。
9.本文描述了用于载物递送的组合物和方法,其可与多种多样的蛋白质和核酸分子,包括适用于许多疾病治疗的基因组编辑、表观基因组调节、转录组编辑和蛋白质组调节试剂,一起使用。
10.因此,本文提供了工程化的hevlp,其包含在外侧的、包含具有一种或多种herv衍生的env/糖蛋白的磷脂双层(例如,在hevlp生产细胞中,由外源性来源比如质粒或稳定整合的转基因过表达)(例如,如在表1中显示的)的膜;和在所述膜内侧的、置于所述hevlp的核心中的人内源性gag蛋白、其他细胞质膜募集结构域和/或生物分子/化学载物,其中所述生物分子载物可以或可以不与人内源性gag或其他细胞质膜募集结构域(例如,如在表6中显示的)融合,并且hevlp不包含非人gag和/或pol蛋白,不表达除了在人基因组中编码的gag蛋白或源自在人基因组中发现的gag蛋白的共有序列编码的gag蛋白以外的gag和/或pol蛋白。在hevlp生产细胞中,与生物分子载物融合的人源gag或其他细胞质膜募集结构域,可由外源性来源比如质粒或稳定整合的转基因过表达。
11.在一些实施方案中,herv env可以是截短的或与scfv或其他靶向多肽融合。
12.在一些实施方案中,herv gag可与细胞质膜募集结构域(例如,如在表6中显示的)融合。
13.在另一实施方案中,工程化的hevlp包含在外侧的、包含具有一种或多种herv衍生的env/糖蛋白(例如,在hevlp生产细胞中,由外源性来源比如质粒或稳定整合的转基因过表达)(例如,如在表1中显示的)的磷脂双层的膜;和,如需要的,细胞质膜募集结构域(例如,如在表6中显示的);以及,如需要的,在颗粒内的生物分子/化学品。
14.还提供了将载物递送至靶细胞例如体内或体外细胞的方法,所述方法通过使细胞与包含作为载物的生物分子和/或化学品的权利要求1的hevlp接触。
15.此外,本文提供了用于生产包含生物分子载物的hevlp的方法。所述方法包括提供一种细胞,所述细胞表达(例如,工程化以表达或过表达)一种或多种herv衍生的包膜蛋白(例如,如在表1中显示的)和载物,其中所述细胞不表达除了在人基因组中编码的gag蛋白或源自在人基因组中发现的gag蛋白的共有序列编码的gag蛋白以外的gag和/或pol蛋白;和将所述细胞维持在使所述细胞生产hevlp的条件下。在一些实施方案中,所述方法还包括收获和任选地纯化和/或浓缩生产的hevlp。
16.本文还提供了细胞(例如,分离的细胞,优选地哺乳动物,例如人细胞),所述细胞以组合表达,例如,已经被诱导过表达,一种或多种herv衍生的包膜蛋白(例如,(由外源性来源,比如质粒或稳定整合的转基因过表达)(例如,如在表1中显示的),以及与人内源性gag或其他细胞质膜募集结构域(例如,如在表6中显示的)融合的载物,其中所述细胞不表达除了在人基因组中编码的gag蛋白或源自在人基因组中发现的gag蛋白的共有序列编码的gag蛋白以外的gag蛋白(由外源性来源,比如质粒或稳定整合的转基因过表达)。在一些实施方案中,所述细胞是原代或稳定的人细胞系,例如人胚肾(hek)293细胞、hek293 t细胞或bewo细胞。所述细胞可用于产生如本文描述的hevlp。
17.在一些实施方案中,所述方法包括使用这样的细胞,其已经过或未经过操作以表
达除herv包膜(例如,如在表1中显示的)以外的任何外源性蛋白,和,如需要的,细胞质膜募集结构域(例如,如在表6中显示的)。在这个实施方案中,通过利用与载物混合的纯化颗粒的核转染、脂质、聚合物、或cacl2转染、超声处理、冻融和/或热冲击,所生产的“空”颗粒可负载有生物分子或化学分子载物。在所有实施方案中,生产者细胞不表达任何人外源性gag蛋白。这种类型的负载允许载物通过与细胞质膜募集结构域的融合而不被修饰,显示了与先前的vlp技术相比的重大进步。
18.在另一实施方案中,通过利用与载物混合的纯化颗粒的核转染、脂质、聚合物、或cacl2转染、超声处理、冻融、在不同温度下孵育和/或热冲击,所生产和分离的含有载物hevlp可负载有附加的生物分子或化学分子载物。
19.在一些实施方案中,所述载物是治疗性或诊断性蛋白质或编码治疗性或诊断性蛋白质的核酸。
20.在一些实施方案中,所述载物是化学化合物或化学分子。
21.在一些实施方案中,所述化学分子是蛋白质-蛋白质二聚化或多聚化的触发器,比如a/c异二聚物或雷帕霉素。
22.在一些实施方案中,所述化学化合物是dna pk抑制剂,比如有效地增强同源定向修复基因编辑m3814、nu7026或nu7441。
23.在一些实施方案中,所述生物分子载物是基因编辑试剂。
24.在一些实施方案中,所述基因编辑试剂包含锌指(zf)、转录激活因子样效应物(tale)和/或基于crispr的基因组编辑或调节蛋白;编码锌指(zf)、转录激活因子样效应物(tale)和/或基于crispr的基因组编辑或调节蛋白的核酸;或包含基于crispr的基因组编辑或调节蛋白的核糖核蛋白复合体(rnp)。
25.在一些实施方案中,所述基因编辑试剂选自在表2、3、4和5中列出的蛋白质。
26.在一些实施方案中,所述基因编辑试剂包含基于crispr的基因组编辑或调节蛋白,并且所述hevlp还包含一种或多种向导rna,所述向导rna结合至所述基于crispr的基因组编辑或调节蛋白,并将所述基于crispr的基因组编辑或调节蛋白引导至靶序列。
27.在一些实施方案中,所述载物包含与人内源性gag或其他细胞质膜募集结构域、优选地如在表6中显示的细胞质膜募集结构域的共价或非共价连接。共价连接,例如,可包括从单一阅读框产生的直接的蛋白质-蛋白质融合、可形成肽键的内含肽、可在r基团和/或rna剪接处形成共价连接的其他蛋白质。非共价连接,例如,可包括dna/dna、dna/rna和/或rna/rna杂交体(核酸通过氢键相互作用与其他核酸碱基配对)、需要或不需要化学化合物/分子诱导蛋白质-蛋白质结合的二聚化或多聚化的蛋白结构域、单链可变片段、纳米抗体、亲和体、与dna和/或rna结合的蛋白质、具有四级结构相互作用的蛋白质、在特定光波长的存在下可二聚化或多聚化的光遗传(optogenetic)蛋白结构域和/或自然重构分裂蛋白。
28.在一些实施方案中,所述载物包含与二聚化结构域或蛋白质-蛋白质结合结构域的融合物,其可以需要或可以不需要分子来触发二聚化或蛋白质-蛋白质结合。
29.在一些实施方案中,所述生产者细胞是fda批准的细胞系、同种异体细胞和/或源自供体的自体细胞。
30.在一些实施方案中,人cd47的完整或活性肽结构域可并入hevlp表面以降低免疫原性。
31.本文包括的aav蛋白的示例是aav rep 52、rep 78和vp1-3。可插入蛋白质的衣壳位点是从vp1氨基酸计数开始的t138。例如,可在衣壳的这一位点处插入二聚化结构域。
32.本文包括的可以需要或可以不需要小分子诱导剂的二聚化结构域的示例是ddzf1、ddzf2、dmra、dmrb、dmrc、fkbp、frb、gcn4 scfv、10x/24x gcn4、gfp纳米抗体和gfp。
33.本文包括的断裂型内含肽(split intein)的示例是npu dnae、cfa、vma和ssp dnae。
34.本文包括的其他一起形成共价键的断裂型蛋白质(split protein)的示例是spy tag和spy catcher。
35.本文包括的rna结合蛋白的示例是ms2、com和pp7。
36.本文包括的合成的dna结合锌指的示例是zf6/10、zf8/7、zf9、mk10、锌指268和锌指268/nre。
37.由本文包括的四级结构导致的多聚化的蛋白质的示例是大肠杆菌(e.coli)铁蛋白和铁蛋白的其他嵌合形式。
38.本文包括的光遗传“光诱导蛋白”的示例是cry2、cibn和lov2-ja。
39.本文包括的增强转导肽的示例是l17e、vectofusin-1、kala和不同形式的乳酸链球菌肽(nisin)。
40.除非另有定义,本文使用的所有技术和科学术语与本发明所属领域的普通技术人员通常理解的含义相同。本文描述了用于本发明的方法和材料;也可以使用本领域已知的其他合适的方法和材料。材料、方法和实施例仅是说明性的而不是限制性的。本文提及的所有出版物、专利申请、专利、序列、数据库条目和其他参考文献均通过引用整体并入。如有冲突,以本说明书(包括定义)为准。
41.本发明的其他特征和优点将从以下详细描述和附图以及权利要求中显而易见。
附图说明
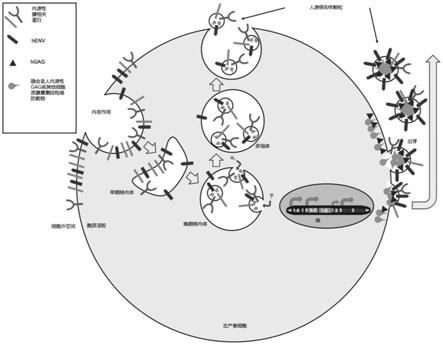
42.图1:用于rnp/蛋白质递送的示例性t2hevlp/t4hevlp生产和转导的描述。所有hevlp表达构建体稳定地整合至生产者细胞的基因组中。构建体1-0对应于人内源性gag(hgag)。构建体1-1对应于人内源性gag或其他磷脂双层募集结构域。1-2对应于载物。2对应于任选的向导rna。1-0、1-1和1-2在胞质溶胶中翻译,其中1-1和1-2的融合物与向导rna复合,然后募集至磷脂双层。3对应于herv衍生的糖蛋白(henv)。herv衍生的糖蛋白在细胞质膜上作为跨膜蛋白表达。hgag驱动含有载物的hevlp从细胞质膜至细胞外空间的出芽(budding)。这些颗粒被纯化,并能够与靶细胞融合以及通过与在靶细胞表面的表面受体相互作用来递送载物。
43.图2:纯化的hevlp进入靶细胞并将载物递送至胞质溶胶中的描述。重要的是,只要载物具有核定位序列,人内源性gag或其他磷脂双层募集结构域允许载物进入靶细胞核。
44.图3:示例性t1hevlp递送的spcas9体外基因组编辑。采用靶向vegf位点#3的t1hevlp转导hek 293t细胞,所述t1hevlp含有与spcas9融合的plc ph、与spcas9融合的hgagk
con
,或与spcas9融合的人活性调节细胞骨架相关蛋白(harc)。hevlp采用henvw(左图)或henvfrd(右图)假型化。基因修饰通过扩增子测序来测量。
45.图4:t1hevlp/t3hevlp生产的描述。参与转染的质粒dna构建体编码载物、任选的
向导rna、hgag和herv衍生的糖蛋白。质粒或其他类型的dna分子将分布在整个生产细胞中,因此置于核中的构建体将表达hevlp组分和载物,置于细胞质膜或核内体附近的构建体将被包封在出芽的hevlp中。
46.图5:示例性hevlp和载物构造的描述
47.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过表达载物的生产者细胞将载物包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
48.图6:示例性hevlp和载物构造的描述
49.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过表达载物-gag融合的生产者细胞将载物包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
50.图7:示例性hevlp和载物构造的描述
51.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过表达载物-ph融合的生产者细胞将载物包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
52.图8:示例性hevlp和载物构造的描述
53.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过表达载物-gag/ph融合的生产者细胞将载物包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
54.图9:示例性hevlp和载物构造的描述
55.该颗粒是由表达包膜蛋白的生产者细胞创建的。在二聚化分子(a/c异二聚物)存在下,通过表达与dmra或dmrc融合的载物和gag的生产者细胞,将载物包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
56.图10:示例性hevlp和载物构造的描述
57.该颗粒是由表达包膜蛋白的生产者细胞创建的。在二聚化分子(a/c异二聚物)存在下,通过表达与dmra或dmrc融合的载物和ph的生产者细胞,将载物包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
58.图11:示例性hevlp和载物构造的描述
59.该颗粒是由表达包膜蛋白的生产者细胞创建的。在二聚化分子(a/c异二聚物)存在下,通过表达与dmra或dmrc融合的载物和gag/ph的生产者细胞,将载物包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
60.图12:示例性hevlp和载物构造的描述
61.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过生产者细胞将载物包装在颗粒内,所述生产者细胞表达载物以及与rna结合蛋白(rbp)ms2融合的gag,所述ms2结合至其ms2 rna茎环(ms2 sl),所述ms2 rna茎环与载物复合,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
62.图13:示例性hevlp和载物构造的描述
63.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过生产者细胞将载物包装在颗粒内,所述生产者细胞表达载物以及与rna结合蛋白(rbp)ms2融合的ph,所述ms2结合至其ms2 rna茎环(ms2 sl),所述ms2 rna茎环与载物复合,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
64.图14:示例性hevlp和载物构造的描述
65.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过生产者细胞将载物包装在颗粒内,所述生产者细胞表达载物以及与rna结合蛋白(rbp)ms2融合的gag/ph,所述ms2结合至其ms2 rna茎环(ms2 sl),所述ms2 rna茎环与载物复合,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
66.图15:示例性hevlp和载物构造的描述
67.该颗粒是由表达包膜蛋白的生产者细胞创建的。在二聚化分子(a/c异二聚物)存在下,通过生产者细胞将载物包装在颗粒内,所述生产者细胞表达载物以及与dmra或dmrc融合的gag和rna结合蛋白(rbp)ms2,所述ms2结合至其ms2 rna茎环(ms2 sl),所述ms2 rna茎环与载物复合,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
68.图16:示例性hevlp和载物构造的描述
69.该颗粒是由表达包膜蛋白的生产者细胞创建的。在二聚化分子(a/c异二聚物)存在下,通过生产者细胞将载物包装在颗粒内,所述生产者细胞表达载物以及与dmra或dmrc融合的ph和rna结合蛋白(rbp)ms2,所述ms2结合至其ms2 rna茎环(ms2 sl),所述ms2 rna茎环与载物复合,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
70.图17:示例性hevlp和载物构造的描述
71.该颗粒是由表达包膜蛋白的生产者细胞创建的。在二聚化分子(a/c异二聚物)存在下,通过生产者细胞将载物包装在颗粒内,所述生产者细胞表达载物以及与dmra或dmrc融合的gag/ph和rna结合蛋白(rbp)ms2,所述ms2结合至其ms2 rna茎环(ms2 sl),所述ms2 rna茎环与载物复合,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
72.图18:示例性hevlp和载物构造的描述
73.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过生产者细胞将载物包装在颗粒内,所述生产者细胞表达载物以及与重复的gcn4结构域融合的gag,所述重复的gcn4结构域由与载物融合的scfv结合,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
74.图19:示例性hevlp和载物构造的描述
75.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过生产者细胞将载物包装在颗粒内,所述生产者细胞表达载物以及与重复的gcn4结构域融合的ph,所述重复的gcn4结构域由与载物融合的scfv结合,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
76.图20:示例性hevlp和载物构造的描述
77.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过生产者细胞将载物包装在颗粒内,所述生产者细胞表达载物以及与重复的gcn4结构域融合的gag/ph,所述重复的gcn4结构域由与载物融合的scfv结合,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
78.图21:示例性hevlp和载物构造的描述
79.该颗粒是由表达包膜蛋白的生产者细胞创建的。在二聚化分子(a/c异二聚物)存在下,通过表达与dmra或dmrc融合的gag和重复的gcn4结构域的生产者细胞,将载物包装在颗粒内。gcn4由与也在生产者细胞中表达的载物融合的scfv结合。还可通过本文描述的不同的颗粒负载方法比如电穿孔而负载颗粒。
80.图22:示例性hevlp和载物构造的描述
81.该颗粒是由表达包膜蛋白的生产者细胞创建的。在二聚化分子(a/c异二聚物)存
在下,通过表达与dmra或dmrc融合的ph和重复的gcn4结构域的生产者细胞,将载物包装在颗粒内。gcn4由与也在生产者细胞中表达的载物融合的scfv结合。还可通过本文描述的不同的颗粒负载方法比如电穿孔而负载颗粒。
82.图23:示例性hevlp和载物构造的描述
83.该颗粒是由表达包膜蛋白的生产者细胞创建的。在二聚化分子(a/c异二聚物)存在下,通过表达与dmra或dmrc融合的gag/ph和重复的gcn4结构域的生产者细胞,将载物包装在颗粒内。gcn4由与也在生产者细胞中表达的载物融合的scfv结合。还可通过本文描述的不同的颗粒负载方法比如电穿孔而负载颗粒。
84.图24:示例性hevlp和载物构造的描述
85.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过表达载物的生产者细胞将载物(avv颗粒)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
86.图25:示例性hevlp和载物构造的描述
87.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过表达载物和gag的生产者细胞将载物(avv颗粒)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
88.图26:示例性hevlp和载物构造的描述
89.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过表达载物和ph的生产者细胞将载物(avv颗粒)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
90.图27:示例性hevlp和载物构造的描述
91.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过表达载物和gag/ph的生产者细胞将载物(avv颗粒)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
92.图28:示例性hevlp和载物构造的描述
93.该颗粒是由表达包膜蛋白的生产者细胞创建的。在dmrb二聚物分子存在下,通过表达与dmrb融合的载物和gag的生产者细胞将载物(具有在衣壳蛋白vp2中插入的dmrb的aav颗粒)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
94.图29:示例性hevlp和载物构造的描述
95.该颗粒是由表达包膜蛋白的生产者细胞创建的。在dmrb二聚物分子存在下,通过表达与dmrb融合的载物和ph的生产者细胞将载物(具有在衣壳蛋白vp2中插入的dmrb的aav颗粒)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
96.图30:示例性hevlp和载物构造的描述
97.该颗粒是由表达包膜蛋白的生产者细胞创建的。在dmrb二聚物分子存在下,通过表达与dmrb融合的载物和gag/ph的生产者细胞将载物(具有在衣壳蛋白vp2中插入的dmrb的aav颗粒)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
98.图31:示例性hevlp和载物构造的描述
99.该颗粒是由表达包膜蛋白的生产者细胞创建的。在dmrb二聚物和a/c异二聚物分子存在下,通过表达与dmra、dmrb或dmrc融合的载物和gag的生产者细胞将载物(具有在衣壳蛋白vp2中插入的dmrb的aav颗粒)包装在颗粒内,或由本文描述的不同的颗粒负载方法
比如电穿孔负载颗粒。
100.图32:示例性hevlp和载物构造的描述
101.该颗粒是由表达包膜蛋白的生产者细胞创建的。在dmrb二聚物和a/c异二聚物分子存在下,通过表达与dmra、dmrb或dmrc融合的载物和ph的生产者细胞将载物(具有在衣壳蛋白vp2中插入的dmrb的aav颗粒)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
102.图33:示例性hevlp和载物构造的描述
103.该颗粒是由表达包膜蛋白的生产者细胞创建的。在dmrb二聚物和a/c异二聚物分子存在下,通过表达与dmra、dmrb或dmrc融合的载物和gag/ph的生产者细胞将载物(具有在衣壳蛋白vp2中插入的dmrb的aav颗粒)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
104.图34:示例性hevlp和载物构造的描述
105.该颗粒是由表达包膜蛋白的生产者细胞创建的。载物(单链dna)可由本文描述的不同的颗粒负载方法比如电穿孔包装在颗粒内。
106.图35:示例性hevlp和载物构造的描述
107.该颗粒是由表达包膜蛋白和gag的生产者细胞创建的。载物(单链dna)可由本文描述的不同的颗粒负载方法比如电穿孔包装在颗粒内。
108.图36:示例性hevlp和载物构造的描述
109.该颗粒是由表达包膜蛋白和ph的生产者细胞创建的。载物(单链dna)可由本文描述的不同的颗粒负载方法比如电穿孔包装在颗粒内。
110.图37:示例性hevlp和载物构造的描述
111.该颗粒是由表达包膜蛋白和gag/ph的生产者细胞创建的。载物(单链dna)可由本文描述的不同的颗粒负载方法比如电穿孔包装在颗粒内。
112.图38:示例性hevlp和载物构造的描述
113.该颗粒是由表达包膜蛋白的生产者细胞创建的。载物(双链dna)可由本文描述的不同的颗粒负载方法比如电穿孔包装在颗粒内。
114.图39:示例性hevlp和载物构造的描述
115.该颗粒是由表达包膜蛋白和gag的生产者细胞创建的。载物(双链dna)可由本文描述的不同的颗粒负载方法比如电穿孔包装在颗粒内。
116.图40:示例性hevlp和载物构造的描述
117.该颗粒是由表达包膜蛋白和ph的生产者细胞创建的。载物(双链dna)可由本文描述的不同的颗粒负载方法比如电穿孔包装在颗粒内。
118.图41:示例性hevlp和载物构造的描述
119.该颗粒是由表达包膜蛋白和gag/ph的生产者细胞创建的。载物(双链dna)可由本文描述的不同的颗粒负载方法比如电穿孔包装在颗粒内。
120.图42:示例性hevlp和载物构造的描述
121.该颗粒是由表达包膜蛋白和与锌指蛋白(zfp)融合的gag的生产者细胞创建的,所述锌指蛋白将结合载物中的特异性序列。载物(双链dna)可由本文描述的不同的颗粒负载方法比如电穿孔包装在颗粒内。
122.图43:示例性hevlp和载物构造的描述
123.该颗粒是由表达包膜蛋白和与锌指蛋白(zfp)融合的ph的生产者细胞创建的,所述锌指蛋白将结合载物中的特异性序列。载物(双链dna)可由本文描述的不同的颗粒负载方法比如电穿孔包装在颗粒内。
124.图44:示例性hevlp和载物构造的描述
125.该颗粒是由表达包膜蛋白和与锌指蛋白(zfp)融合的gag/ph的生产者细胞创建的,所述锌指蛋白将结合载物中的特异性序列。载物(双链dna)可由本文描述的不同的颗粒负载方法比如电穿孔包装在颗粒内。
126.图45:示例性hevlp和载物构造的描述
127.该颗粒是在a/c异二聚物分子存在下,由生产者细胞创建的,所述生产者细胞表达包膜蛋白以及与dmra或dmrc融合的gag和锌指蛋白(zfp),所述锌指蛋白将结合载物中的特异性序列。载物(双链dna)可由本文描述的不同的颗粒负载方法比如电穿孔包装在颗粒内。
128.图46:示例性hevlp和载物构造的描述
129.该颗粒是在a/c异二聚物分子存在下,由生产者细胞创建的,所述生产者细胞表达包膜蛋白以及与dmra或dmrc融合的ph和锌指蛋白(zfp),所述锌指蛋白将结合载物中的特异性序列。载物(双链dna)可由本文描述的不同的颗粒负载方法比如电穿孔包装在颗粒内。
130.图47:示例性hevlp和载物构造的描述
131.该颗粒是在a/c异二聚物分子存在下,由生产者细胞创建的,所述生产者细胞表达包膜蛋白以及与dmra或dmrc融合的gag/ph和锌指蛋白(zfp),所述锌指蛋白将结合载物中的特异性序列。载物(双链dna)可由本文描述的不同的颗粒负载方法比如电穿孔包装在颗粒内。
132.图48:示例性hevlp和载物构造的描述
133.该颗粒是由表达包膜蛋白和与锌指蛋白(zfp)融合的gag的生产者细胞创建的,所述锌指蛋白将结合载物中的特异性序列。载物(由cas9 rnp-zfp融合物结合的双链dna)可由本文描述的不同的颗粒负载方法比如电穿孔包装在颗粒内。或者,cas9 rnp-zfp融合物可由生产者细胞表达,并可由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
134.图49:示例性hevlp和载物构造的描述
135.该颗粒是由表达包膜蛋白和与锌指蛋白(zfp)融合的ph的生产者细胞创建的,所述锌指蛋白将结合载物中的特异性序列。载物(由cas9 rnp-zfp融合物结合的双链dna)可由本文描述的不同的颗粒负载方法比如电穿孔包装在颗粒内。或者,cas9 rnp-zfp融合物可由生产者细胞表达,并可由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
136.图50:示例性hevlp和载物构造的描述
137.该颗粒是由表达包膜蛋白和与锌指蛋白(zfp)融合的gag/ph的生产者细胞创建的,所述锌指蛋白将结合载物中的特异性序列。载物(由cas9 rnp-zfp融合物结合的双链dna)可由本文描述的不同的颗粒负载方法比如电穿孔包装在颗粒内。或者,cas9 rnp-zfp融合物可由生产者细胞表达,并可由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
138.图51:示例性hevlp和载物构造的描述
139.该颗粒是在a/c异二聚物分子存在下,由生产者细胞创建的,所述生产者细胞表达
包膜蛋白以及与融合至dmra或dmrc的锌指蛋白(zfp)融合的gag,所述锌指蛋白将结合载物中的特异性序列。载物(由cas9 rnp-zfp融合物结合的双链dna)可由本文描述的不同的颗粒负载方法比如电穿孔包装在颗粒内。或者,cas9 rnp-zfp融合物可由生产者细胞表达,并可由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
140.图52:示例性hevlp和载物构造的描述
141.该颗粒是在a/c异二聚物分子存在下,由生产者细胞创建的,所述生产者细胞表达包膜蛋白以及与融合至dmra或dmrc的锌指蛋白(zfp)融合的ph,所述锌指蛋白将结合载物中的特异性序列。载物(由cas9 rnp-zfp融合物结合的双链dna)可由本文描述的不同的颗粒负载方法比如电穿孔包装在颗粒内。或者,cas9 rnp-zfp融合物可由生产者细胞表达,并可由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
142.图53:示例性hevlp和载物构造的描述
143.该颗粒是在a/c异二聚物分子存在下,由生产者细胞创建的,所述生产者细胞表达包膜蛋白以及与融合至dmra或dmrc的锌指蛋白(zfp)融合的gag/ph,所述锌指蛋白将结合载物中的特异性序列。载物(由cas9 rnp-zfp融合物结合的双链dna)可由本文描述的不同的颗粒负载方法比如电穿孔包装在颗粒内。或者,cas9 rnp-zfp融合物可由生产者细胞表达,并可由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
144.图54:示例性hevlp和载物构造的描述
145.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过表达载物的生产者细胞将载物(rna)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
146.图55:示例性hevlp和载物构造的描述
147.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过表达载物和gag的生产者细胞将载物(rna)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
148.图56:示例性hevlp和载物构造的描述
149.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过表达载物和ph的生产者细胞将载物(rna)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
150.图57:示例性hevlp和载物构造的描述
151.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过表达载物和gag/ph的生产者细胞将载物(rna)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
152.图58:示例性hevlp和载物构造的描述
153.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过表达载物以及与ms2融合的gag的生产者细胞将载物(具有ms2茎环的rna)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
154.图59:示例性hevlp和载物构造的描述
155.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过表达载物以及与ms2融合的ph的生产者细胞将载物(具有ms2茎环的rna)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
156.图60:示例性hevlp和载物构造的描述
157.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过表达载物以及与ms2融合的
gag/ph的生产者细胞将载物(具有ms2茎环的rna)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
158.图61:示例性hevlp和载物构造的描述
159.该颗粒是由表达包膜蛋白的生产者细胞创建的。在a/c异二聚物存在下,通过表达载物以及与dmra或dmrc融合的gag和ms2的生产者细胞,将载物(具有ms2茎环的rna)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
160.图62:示例性hevlp和载物构造的描述
161.该颗粒是由表达包膜蛋白的生产者细胞创建的。在a/c异二聚物存在下,通过表达载物以及与dmra或dmrc融合的ph和ms2的生产者细胞,将载物(具有ms2茎环的rna)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
162.图63:示例性hevlp和载物构造的描述
163.该颗粒是由表达包膜蛋白的生产者细胞创建的。在a/c异二聚物存在下,通过表达载物以及与dmra或dmrc融合的gag/ph和ms2的生产者细胞,将载物(具有ms2茎环的rna)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
164.图64:示例性hevlp和载物构造的描述
165.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过表达与一种rbp融合的载物和与另一种rbp融合的gag的生产者细胞将载物(具有rbp茎环的rna)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
166.图65:示例性hevlp和载物构造的描述
167.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过表达与一种rbp融合的载物和与另一种rbp融合的ph的生产者细胞将载物(具有rbp茎环的rna)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
168.图66:示例性hevlp和载物构造的描述
169.该颗粒是由表达包膜蛋白的生产者细胞创建的。通过表达与一种rbp融合的载物和与另一种rbp融合的gag/ph的生产者细胞将载物(具有rbp茎环的rna)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
170.图67:示例性hevlp和载物构造的描述
171.该颗粒是由表达包膜蛋白的生产者细胞创建的。在a/c异二聚物分子存在下,通过表达融合至dmra或dmrc的与一种rbp融合的载物和与另一种rbp融合的gag的生产者细胞,将载物(具有rbp茎环的rna)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
172.图68:示例性hevlp和载物构造的描述
173.该颗粒是由表达包膜蛋白的生产者细胞创建的。在a/c异二聚物分子存在下,通过表达融合至dmra或dmrc的与一种rbp融合的载物和与另一种rbp融合的ph的生产者细胞,将载物(具有rbp茎环的rna)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
174.图69:示例性hevlp和载物构造的描述
175.该颗粒是由表达包膜蛋白的生产者细胞创建的。在a/c异二聚物分子存在下,通过表达融合至dmra或dmrc的与一种rbp融合的载物和与另一种rbp融合的gag/ph的生产者细
胞,将载物(具有rbp茎环的rna)包装在颗粒内,或由本文描述的不同的颗粒负载方法比如电穿孔负载颗粒。
具体实施方式
176.治疗性蛋白质和核酸具有极大的前景,但对于这些大生物分子中的许多递送至细胞中是临床开发的障碍。基因组编辑试剂,比如锌指核酸酶(zfn)或rna向导的、酶活性/非活性dna结合蛋白比如cas9,在特异性和可执行的编辑类型方面取得了快速进展,但安全体内递送的障碍仍然妨碍有效的基因编辑治疗。以下详细说明了hevlp使其成为用于基因组编辑试剂的递送的新颖和最佳平台的特征,并将hevlp与规范递送方式进行了对比。
177.已开发逆转录病毒颗粒,比如慢病毒,以递送逆转录为dna的rna,该dna可能会或可能不会整合至基因组dna中。已开发vlp,其以它们的自组装能力模拟病毒颗粒,但由于它们缺少一些核心病毒基因,不具有传染性。慢病毒和vlp载体通常是通过采用质粒瞬时转染生产者细胞系来生产的,所述质粒编码生产慢病毒颗粒或vlp必要的所有组分。我们已发现的关于通过这种传统瞬时转染方法生产的慢病毒颗粒和基于vsvg的vlp的一个主要缺陷是,除了它们的常规载物外,这些颗粒包装和递送在初始瞬时转染中使用的质粒dna。这种非目的质粒dna递送可以是产生免疫原性的并导致不期望的作用,比如质粒dna整合至基因组dna中。指定在颗粒中待被递送的生物分子和/或化学品的类型是重要的,并且hevlp已被设计为具有这种恰当的能力。
178.本文描述的hevlp可仅递送dna、dna+rna+蛋白质或rna+蛋白质。重要的是,hevlp是第一种vlp递送方式,其充分利用来自人内源性逆转录病毒(herv)的选择组分来创建用于将可定制的载物递送至真核细胞中的颗粒。hevlp能够控制载物的形式(dna、蛋白质和/或rna)。除了目的蛋白质和/或rna载物外,所有其他先前描述的vlp和病毒颗粒包装并递送通过瞬时转染引入颗粒生产者细胞的不需要的质粒dna(或其他类型的基于dna的基因表达构建体)。
179.hevlp的另一个非显而易见的方面是hevlp的表面的env蛋白。env蛋白负责hevlp有效地递送载物至细胞中的能力。大多数逆转录病毒env蛋白需要以env蛋白的胞内结构域(icd)的蛋白水解切割形式翻译后修饰,以激活env蛋白的融合性(fusogenicity);这对于感染性是重要的。1表1中描述的包膜蛋白均源自在健康人组织中以不同的水平表达的herv(或herv env共有序列)。这些序列中的一些具有已显示增强融合性的icd截短,但大多数不需要截短。
180.hevlp不需要用于颗粒形成的外源性的、病毒衍生的gag,因为hevlp利用来自herv(或herv gag共有序列)的人内源性gag蛋白。1这些herv gag蛋白能够使hevlp形成,并在健康人组织中以不同的水平表达。重要的是,hevlp与先前描述的病毒颗粒、vlp和细胞外囊泡不同,因为hevlp由herv env和gag组分的新组合构成,并且hevlp缺少来自外源性病毒的组分。
2,3
由于上述设计优化,hevlp特别适用于递送dna、rna、蛋白质,或生物分子和/或化学品的组合,比如编码dna或基于rnp的基因组编辑试剂。
181.基因组编辑试剂,尤其是基于crispr-cas、锌指和tal核酸酶的试剂具有潜能成为用于遗传疾病治疗的体内治疗剂,但用于将基因组编辑试剂递送至细胞中的技术是严重受限或对患者不安全的。传统的治疗性单克隆抗体递送在利用对于蛋白质的直接注射是成功
的。不幸的是,用于基因编辑蛋白,比如cas9的直接注射的策略被免疫原性、降解、无效的细胞特异性以及无法穿过细胞质膜或逃逸核内体/溶酶体所阻碍。
4-10
蛋白质治疗和基因编辑的更广泛应用可通过将治疗性蛋白质载物递送至细胞的内部来实现。例如,cas9不能有效地穿过磷脂双层进入细胞,并且已显示具有先天性和适应性免疫原性潜能。
4-8
因此,通过直接注射或作为与具有细胞毒性和免疫原性性质的脂质、蛋白质或基于金属的纳米颗粒的外部/内部缀合物递送cas9是不切实际或不是有利的,并且通常产生低水平的期望的基因修饰。
9-20
182.包封载物的纳米颗粒是另一种递送策略,其可用于将dna、蛋白质、rna和rnp递送至细胞中。
9-18
纳米颗粒可对于细胞特异性工程化,并可触发内吞作用和随后的核内体裂解。然而,由于人工衍生的载体外壳,纳米颗粒可具有不同水平的免疫原性。
9-20
许多纳米颗粒依赖强的相反电荷分布来维持颗粒结构的完整性,并且静电可使其有毒且不适用于许多体内治疗情况。9递送rna的纳米颗粒在最近的临床试验中已取得了成功,但大多数仅已用于递送sirna或shrna。来自这种纳米颗粒的毒性仍然是一个主要的担忧。9递送编码基因组编辑rnp的mrna的纳米颗粒最近也已取得了成功,但与蛋白质递送相比,这些产生了更多数量的脱靶作用,并且rna稳定性低于蛋白质的稳定性。
17
递送基因组编辑rnp和dna的纳米颗粒已是一项重大突破,因为它们可充分利用同源定向修复(hdr)和非同源末端连接(nhej),但在体外和体内表现出极低的基因修饰频率,因此目前在体内作为基因编辑治疗剂的应用有限。
15
183.目前,用于递送基因组编辑治疗剂的临床标准载体是腺相关病毒(aav)。尽管aav载体是一种有前景的递送方式,其可成功地将dna递送至真核细胞中,但aav不能有效地包装和递送大于4.5kb的dna构建体,且这妨碍了需要更大dna表达构建体的许多基于crispr的基因编辑试剂的递送。基于crispr的基因编辑试剂可拆分成多个不同的aav颗粒,但这种策略极大降低递送和编辑效率。根据所需的剂量,aav和腺病毒载体可具有不同水平的免疫原性。此外,aav dna构建体中的反向末端重复(itr)可促进自发的附加体的形成,导致基因组编辑试剂的延长的表达和增加的脱靶作用。itr还可促进不期望的aav dna整合至基因组dna中。
21-24
184.最近,vlp已被利用于将mrna和蛋白质载物递送至细胞的胞质溶胶中。
2,3,25-30
vlp已显现作为逆转录病毒颗粒的替代递送方式。vlp可被设计为缺少整合逆转录病毒dna的能力,并设计为包装和递送蛋白质/rnp/dna。然而,至今已知的大多数vlp包括最近构思的递送基因组编辑试剂的vlp,利用hiv或其他病毒衍生的gag-pol蛋白融合物和病毒蛋白酶以产生逆转录病毒样颗粒。
25-27,29,30
第二,一些含有rgn的vlp还必须包装和表达来自慢病毒dna转录物的向导rna。
27
第三,为了形成功能颗粒并释放基因组编辑载物,一些vlp需要病毒蛋白酶。
25-27,29
由于这种病毒蛋白酶在多个氨基酸基序识别并切割,它可引起对蛋白质载物的损坏,这可能对治疗性应用有害。第四,迄今为止,大多数公布的递送基因组编辑蛋白的vlp方式由于低的包装和转导效率而表现出低的体外和体内基因修饰效率。
25-27
第五,这些vlp组分利用的复杂病毒基因组具有多个阅读框并使用rna剪接,这可导致递送虚假的融合蛋白产物。
25-27,29,30
第六,由于免疫原性和脱靶编辑问题,这些vlp中逆转录酶、整合酶、衣壳和病毒衍生的包膜蛋白的存在对于大多数治疗性应用不理想。最后,大多数逆转录病毒颗粒,比如慢病毒颗粒,都是vsvg假型化的,并且迄今为止,几乎所有描述的递送基因组编辑
试剂的vlp具有并依赖vsvg。
2,3,25-30
我们已发现通过瞬时转染生产者细胞形成的基于vsvg的颗粒包装并递送转染的dna。基于vsvg的vlp的目前的版本无法防止这种dna的无意的递送,这阻碍了vlp在需要最小免疫原性和脱靶作用的情况下的使用。
185.细胞外囊泡是另一种递送方式,其可在外泌体和核外颗粒体(ectosome)中包装和递送载物。
31,32
与vlp类似,细胞外囊泡包括来自哺乳动物细胞的磷脂双层。与vlp不同,细胞外囊泡缺少病毒组分,并因此具有有限的免疫原性。而由于外部融合糖蛋白(vsvg),vlp具有进入细胞的强大能力,细胞外囊泡主要依赖于通过微胞饮作用的细胞摄取,这限制了细胞外囊泡的递送效率。
186.hevlp试图充分利用细胞外囊泡和vlp的递送益处。hevlp是第一种消除所有潜在有害的外源性的、病毒组分衍生的vlp方式。已知hevlp组分参与细胞外囊泡生物发生,已知它们具有局部免疫抑制性质,并且由于中枢耐受,它们在健康人组织中的表达使引发免疫应答的机会最小化。1与先前描述的vlp、细胞外囊泡、aav和纳米颗粒相比,hevlp是一种更安全、更有效的替代物,尤其是用于基因组编辑试剂的递送,因为hevlp由全部人源组分组成,hevlp具有递送dna+rnp或单独的rnp的能力,而其他先前描述的vlp则不可防止瞬时转染dna被无意地包装和递送,hevlp可递送特殊的dna分子,而先前描述的vlp、纳米颗粒和aav不能或不可以,并且hevlp可采用已源自患者的细胞(自体hevlp)和其他fda批准的细胞系(同种异体hevlp)生产,以进一步降低不良免疫反应的风险。本文,我们描述了用于生产、纯化和施用hevlp的方法和组合物,用于基因组编辑、表观基因组调节、转录组编辑和蛋白质组调节的体外和体内应用。期望的编辑结果取决于治疗性情况(context),并且将需要不同的基因编辑试剂。酿脓链球菌(streptococcus pyogenes)cas9(spcas9)和氨基酸球菌属(acidaminococcus sp.)cas12a(功能化)是两种最流行的用于编辑的rna向导的酶,它们充分利用用于引入终止密码子或缺失的nhej,或用于导致插入的hdr。
34-36
cas9-脱氨酶融合物,也称为碱基编辑器,是目前用于单核苷酸的精确编辑而无双链dna切割的标准。
37,38
重要的是,本发明为基因组编辑、表观基因组调节、转录组编辑和蛋白质组调节的应用提供了包装和递送试剂的新方式。重要的是,本发明也是第一次解决在vlp中的无意的dna递送现象,并且第一次控制待递送的生物分子类型(dna、rna和/或蛋白质),从而增加可能的治疗性体内基因组修饰的类型,并使有害的脱靶作用最小化。
187.第1部分:hevlp介导的包括dna、蛋白质、化合物和rna的载物递送
188.已被工程化以包封和递送基于蛋白质的载物的常规vlp一般地将载物融合至int或gag多聚蛋白上。
25-27,29,30,39,40
在生产质粒dna构建体的瞬时转染后,这些蛋白融合物在常规的vlp生产细胞系的胞质溶胶中被翻译,gag基质(matrix)被乙酰化并募集至细胞膜上,并且当vlp从膜上出芽进入细胞外空间时,gag融合物被包封在vlp内(瞬时转染dna也被无意地包封)。
189.相比之下,本文描述的hevlp可通过将所有生产dna整合至生产细胞系的基因组dna中来包装基于蛋白质的载物。一旦创建了细胞系,可以组成型或诱导型方式生产蛋白质递送hevlp。通过将选择的人内源性gag蛋白或其他细胞质膜募集结构域融合至基于蛋白质的载物,将蛋白质包装至hevlp中(例如,如在表6中显示的)。人内源性gag蛋白和人pleckstrin同源(ph)结构域定位于生物膜。ph结构域与生物膜中的磷脂酰肌醇脂质和蛋白质比如pip2、pip3、gpcr的βγ-亚基和pkc相互作用。
41,42
然而,除了定位于磷脂双层之外,人
内源性gag蛋白驱动出芽和颗粒形成。
42
人内源性gag的这种双重功能使载物的包装和颗粒的出芽/形成成为可能。一种用于此目的的这种人内源性gag蛋白是人arc蛋白,它可与基于蛋白质的载物融合,以将载物募集至磷脂双层的胞质侧。
43
无论载物内一个或多个核定位序列(nls)的位置如何,通过不同长度的多肽接头,这些人内源性gag磷脂双层募集结构域可融合至基于蛋白质的载物的n末端或c末端。优选地,基于蛋白质的载物和人内源性gag磷脂双层募集结构域之间的接头是多肽接头,长度为5-20、例如8-12、例如10个氨基酸,主要由甘氨酸和丝氨酸构成。人内源性gag或其他磷脂双层募集结构域将载物定位至磷脂双层,并且这种蛋白质载物被包装在hevlp内,所述hevlp从生产者细胞出芽进入细胞外空间(图1)。在此应用中,这些人内源性gag和其他磷脂双层募集结构域的使用是新颖和独特的,因为这些人内源性gag和其他蛋白质可促进载物定位至hevlp生产细胞中细胞质膜的胞质面,它们还允许载物定位至转导hevlp的细胞的核,不使用外源性逆转录病毒gag或基于化学品和/或光的二聚化系统(图2)。例如,相比与ph细胞质膜募集结构域的融合或完全不融合相比,与人内源性gag蛋白融合cas9的hevlp递送是显著更有效的(图3)。
190.如果hevlp是通过生产细胞系的瞬时转染生产的,hevlp也可包装和递送dna和rna的组合。转染至细胞中的dna将具有尺寸依赖的流动性,因此一部分转染的dna将保留在胞质溶胶中,而另一部分转染的dna将定位至核中。
44-46
在核中的一部分转染的dna将表达创建hevlp所需的组分,并且在胞质溶胶中/细胞质膜附近的其他部分将在hevlp中被包封并递送(图4)。
191.如本文所用,hevlp“载物”可指一种或多种化学品,例如小分子化合物,dna、rna和蛋白质的组合,rna和蛋白质的组合,dna和蛋白质的组合,或蛋白质,例如,用于治疗性或诊断性用途,或用于基因组编辑、表观基因组调节和/或转录组调节的应用。此外,来自生产者细胞的内源性rna和蛋白质被包装和/或并入至hevlp中。为了简化这些区别,外源性dna、外源性rna和蛋白质(外源性和/或内源性蛋白质)的组合将被称为1型载物(t1hevlp),外源性rna和蛋白质(外源性和/或内源性蛋白质)将被称为2型载物(t2hevlp),外源性dna和蛋白质(外源性和/或内源性蛋白质)的组合将被称为3型载物(t3hevlp),蛋白质(外源性和/或内源性蛋白质)将被称为4型载物(t4hevlp)。因此,t1含有dna、rna、+/-外源性蛋白质,t2含有rna+/-外源性蛋白质,t3含有dna+/-外源性蛋白,t4是具有或不具有外源性蛋白质载物的颗粒。因此,不具有外源性蛋白质的t4被认为是“空颗粒”,因为没有“外源性载物”。“外源性载物”是可包装和/或并入hevlp的、非生产者细胞内源性的载物。此外,除了t1-t4 hevlp中存在的载物类型之外,t1-t4hevlp可包装外源性化学分子。例如,rna在这种情况下,可以是单向导rna(sgrna)、成簇的规律间隔的回文重复序列(crispr)rna(crrna)和/或编码载物的mrna。
192.如本文所用,“小分子”指分子量在约3,000道尔顿以下的有机或无机小分子。通常,用于本发明的小分子具有小于3,000道尔顿(da)的分子量。小分子可以是例如从至少约100da至约3,000da(例如,约100至约3,000da之间、约100至约2500da、约100至约2,000da、约100至约1,750da、约100至约1,500da、约100至约1,250da、约100至约1,000da、约100至约750da、约100至约500da、约200至约1500、约500至约1000、约300至1000da或约100至约250da)。
193.载物受到颗粒直径的限制,例如,在一些实施方案中,其范围为150nm至500nm。
194.为基因组编辑的应用开发的载物还包括核酸酶和碱基编辑器。核酸酶包括foki和acui zfn,以及转录激活因子样效应物核酸酶(talen)和基于crispr的核酸酶或其功能衍生物(例如,如在表2中显示的)(zfn描述于例如在美国专利公开20030232410;20050208489;20050026157;20050064474;20060188987;20060063231;和国际公开wo 07/014275中)(talen描述于例如在美国专利公开us9393257b2中;和国际公开wo2014134412a1中)(基于crispr的核酸酶描述于例如在美国专利公开us8697359b1;us20180208976a1;和国际公开wo2014093661a2;wo2017184786a8中)。
34-36
这项工作描述的碱基编辑器包括任何基于crispr的核酸酶直向同源物(wt、切口酶或催化失活(ci)),例如,如在表2中显示的,使用不同长度的多肽接头,在n末端融合至脱氨酶或其功能衍生物(例如,如在表3中显示的)上,在c末端具有或不具有与一种或多种尿嘧啶糖基化酶抑制剂(ugi)的融合(碱基编辑器描述于例如在美国专利公开us20150166982a1;us20180312825a1;us10113163b2;和国际公开wo2015089406a1;wo2018218188a2;wo2017070632a2;wo2018027078a8;wo2018165629a1中)。
37,38
此外,prime编辑器也与hevlp递送方式兼容(例如,在anzalone等,nature.2019dec;576(7785):149-157中描述了prime编辑器)。
195.sgrna在包装过程中与基因组编辑试剂复合,并在hevlp中共同递送。至今,这一概念已通过实验在体外验证了用于内源性位点的位点特异性编辑的rgn rnp的t2hevlp递送(图3)。例如,为了编辑内源性vegf位点#3的目的,t2hevlp已用于将cas9 rnp递送至hek 293t细胞(图3)。
196.为表观基因组调节的目的而设计的载物包括与表观基因组调节子或表观基因组调节子的组合或其功能衍生物通过一个或多个不同长度的多肽接头连接在一起而融合的基于ci crispr的核酸酶、锌指(zf)和tale(表2和表4)。为转录组编辑的目的设计的t1-t4载物包括与表3中的脱氨酶通过一个或多个不同长度的多肽接头而融合的表5中基于crispr的核酸酶或其任何功能衍生物或表5中基于ci crispr的核酸酶或其任何功能衍生物。
197.载物还可包括任何治疗上或诊断上有用的蛋白质、dna、rnp,或dna、蛋白质和/或rnp的组合。参见,例如,wo2014005219;us10137206;us20180339166;us5892020a;ep2134841b1;wo2007020965a1。例如,可将编码或由核酸酶或碱基编辑器蛋白或rnp或其衍生物组成的载物递送至视网膜细胞,用于纠正导致leber先天性黑蒙10型的剪接位点缺陷的目的。在哺乳动物内耳中,用于编辑β-连环蛋白(β-连环蛋白ser 33编辑为tyr、pro或cys)以更好地稳定β-连环蛋白的目的,碱基编辑试剂或hdr促进载物至比如耳蜗支持细胞和毛细胞等感觉细胞的hevlp递送,可以帮助扭转听力损失。
198.在另一应用中,rna编辑试剂或蛋白质组干扰试剂的hevlp递送可导致一种或多种感兴趣的特异性蛋白质在细胞水平(潜在地,在全身水平、特异性器官或特异性细胞亚群比如肿瘤中)暂时降低,并且当可施用二级药物时,这可创建治疗上可操作的窗口(不存在感兴趣的蛋白质或存在更低水平的感兴趣蛋白质下这种二级药物更有效)。例如,在威罗菲尼(vemurafenib)/达拉非尼(dabrafenib)抗性braf驱动的肿瘤细胞中,rna编辑试剂或蛋白质组干扰试剂的hevlp递送可触发mapk和pi3k/akt蛋白及相关mrna的靶向降解,这可为威罗菲尼/达拉非尼的施用打开窗口,因为braf抑制剂抗性被暂时消除(基于在mapk/pi3k/akt通路中的抗性机制被hevlp载物暂时下调)。当与抗原可诱导并因此对肿瘤细胞具有特
异性的hevlp结合时,该示例尤其相关。
199.在另一应用中,hevlp可将山中因子(yamanaka factors)oct3/4、sox2、klf4和c-myc递送至人或小鼠的成纤维细胞,以产生诱导性多能干细胞。
200.在另一应用中,hevlp可提供蛋白质的显性失活形式以引起治疗作用。
201.抗原特异性的hevlp可靶向癌细胞以递送促凋亡蛋白bim、bid、puma、noxa、bad、bik、bax、bak和/或hrk,以触发癌细胞的凋亡。
202.90%的胰腺癌患者存在不可切除的疾病。约30%的具有不可切除的胰腺肿瘤患者将因局部疾病进展而死亡,因此期望采用消融(ablative)放射治疗局部晚期胰腺肿瘤,但肠道不能耐受导致肿瘤消融所需的高剂量放射。肠道的选择性辐射防护使胰腺肿瘤的消融放射治疗成为可能,同时使对周围胃肠道的造成的损害最小化。为此,hevlp可负载有与转录抑制因子krab融合的dcas9,和靶向egln的向导rna。已显示egln抑制显著降低来自消融放射治疗的胃肠道毒性,因为它会导致胃肠道而非胰腺肿瘤的选择性辐射保护。
47
203.未结合的类固醇受体存在于胞质溶胶中。与配体结合后,这些受体将转移至核并启动应答基因的转录。hevlp可将结合并破坏胞质溶胶类固醇受体的单链可变片段(scfv)抗体递送至细胞的胞质溶胶中。例如,scfv可与糖皮质激素受体结合并阻止其与地塞米松结合,这将阻止应答基因的转录,例如与肿瘤发生有关的金属硫蛋白1e。
48
204.hevlp可用于参与蛋白质的靶向破坏的治疗。例如,hevlp可用于通过将抗体/scfvs递送至细胞的胞质溶胶中,靶向和破坏细胞的胞质溶胶中的蛋白质。经典地,将抗体通过细胞质膜递送至细胞的胞质溶胶已众所周知是困难的和低效的。这种蛋白质的抑制模式类似于靶向小分子如何结合并破坏胞质溶胶中的蛋白质,并且可用于治疗多种疾病。
49-51
205.此外,被靶向的小分子的靶向限于特定尺寸的含有与催化功能或蛋白质-蛋白质相互作用相关的结合口袋的蛋白质。scfv不会受到这些限制的阻碍,因为为了破坏催化作用和与其他蛋白质的相互作用,可产生与蛋白质的许多不同部分结合的scfv。例如,ras癌蛋白涉及多种癌症亚型,并且ras是癌症中最常见的癌基因之一。例如,国际癌症基因组联盟(international cancer genome consortium)在其胰腺腺癌样本中的95%发现kras是突变的。已知ras亚型激活不同的在人类癌症中失调的通路,如pi3k和mapk通路。尽管ras在癌症中扮演着异常的角色,但尚未开发出ras的有效的药理学直接或间接小分子抑制剂并批准临床使用。靶向ras的一种策略可以是hevlp,hevlp可特异性地向癌细胞递送结合并破坏多种ras亚型的功能scfv。
49-51
206.图5-69提供了示例性hevlp构造和载物分子的非限制性实例。
207.第2部分:hevlp组成、生产、纯化和应用
208.hevlp由生产者细胞系生产,所述生产者细胞系采用至少一种质粒瞬时转染或稳定表达已整合至生产者细胞系基因组dna中的构建体。在一些实施方案中,对于t1和t3hevlp,如果在转染中使用单一的质粒,其应包含编码以下的序列:一种或多种herv衍生的糖蛋白(例如,如在表1中显示的)、一种或多种herv衍生的gag蛋白、与人内源性gag或其他细胞质膜募集结构域(例如,如在表6中显示的)融合的载物(例如,治疗性蛋白质或基因编辑试剂,比如锌指、转录激活因子样效应物(tale)和/或基于crispr的基因组编辑/调节蛋白和/或rnp,比如见于表2、3、4和5中的那些),以及如有必要,向导rna。优选地,在转染中使用两至三种质粒。这两至三种质粒可包括以下(任何两种或更多种可组合在单一质粒
中):
209.1、包含与人内源性gag或其他细胞质膜募集结构域融合的编码治疗性蛋白质或基因组编辑试剂的序列的质粒。
210.2、包含一种或多种herv衍生的糖蛋白(例如,如在表1中所列举的)的质粒。
211.3、包含一种或多种herv衍生的gag蛋白的质粒。
212.4.如果来自质粒1的基因组编辑试剂需要一种或多种向导rna,包含一种或多种适用于质粒1中的基因组编辑试剂的向导rna的质粒。
213.如果期望递送质粒以外的dna分子类型,可采用双链封闭末端线性dna、附加体、微环、双链寡核苷酸和/或其他特殊的dna分子进行上述转染。或者,对于t2和t4hevlp,可使生产者细胞系稳定表达以上转染中描述的构建体(1至3)。
214.以上描述的质粒或其他类型的特殊的dna分子还将优选地包括其他元件以驱动编码序列的表达或翻译,例如启动子序列;增强子序列,例如5'非翻译区(utr)或3'utr;多腺苷酸化位点;绝缘子序列;或另外的增加或控制表达的序列(例如,诱导型启动子元件)。
215.优选地,合适的生产者细胞系是对转染试剂的作用和由于糖蛋白的融合作用耐受(refractory)的原代或稳定的人细胞系。合适的细胞系的示例包括人胚肾(hek)293细胞、hek293 t/17sf细胞、肾脏来源的phoenix-ampho细胞和胎盘来源的bewo细胞。例如,可针对它们作为贴壁细胞或悬浮细胞生长的能力来选择这类细胞。在一些实施方案中,生产者细胞可在血清条件下、无血清条件下或无外泌体血清条件下的经典的dmem中培养。t1和t3hevlp可从已源自患者(自体hevlp)的细胞和其他fda批准的细胞系(同种异体hevlp)中生产,只要这些细胞可通过本领域已知的不同的技术采用编码上述hevlp生产组分的dna构建体转染即可。
216.此外,如果是期望的,转染中可包括一种以上的基因组编辑试剂。dna构建体可设计为在生产者细胞系中过表达蛋白质。例如,转染中使用的质粒骨架是本领域技术人员熟悉的,比如使用用于rna聚合酶ii转录的cmv启动子或用于rna聚合酶iii转录的u6启动子的pcdna3骨架。本领域已知的不同的技术可用于将核酸分子引入生产者细胞。这种技术包括使用化合物比如磷酸钙、阳离子脂质、阳离子聚合物的化学促进转染,比如阳离子脂质体如lipofectamine(lipofectamine 2000或3000和transit-x2)等脂质体介导的转染,聚乙烯亚胺,比如电穿孔、粒子轰击或显微注射等非化学方法。
217.以组成型和/或诱导型方式稳定表达必要的hevlp组分的人生产者细胞系可用于t2和t4hevlp的生产。t2和t4hevlp可从已源自患者的细胞(自体hevlp)和其他fda批准的细胞系(同种异体hevlp)生产,如果这些细胞已转变为表达上述hevlp组分的稳定细胞系的话。
218.本文还提供了生产者细胞本身。
219.在一些实施方案中,为了将载物有效募集至hevlp中,载物包含与人内源性gag或其他细胞质膜募集结构域、优选地如在表6中显示的细胞质膜募集结构域的共价或非共价连接。共价连接,例如,可包括从单一阅读框产生的直接的蛋白质-蛋白质融合物、可形成肽键的内含肽、可在r基团和/或rna剪接处形成共价连接的其他蛋白质。
52-54
非共价连接,例如,可包括dna/dna、dna/rna和/或rna/rna杂交体(核酸通过氢键相互作用与其他核酸碱基配对)、需要或不需要化学化合物/分子诱导蛋白质-蛋白质结合的二聚化或多聚化的蛋白
结构域(比如dmra/dmrb/dmrc(takara bio)、fkbp/frb、
55
ddzf、
56
和亮氨酸拉链
57
)、单链可变片段、
58
纳米抗体、
59
亲和体、
60
与dna和/或rna结合的蛋白质、具有四级结构相互作用的蛋白质、在特定光波长的存在下可二聚化或多聚化的光遗传蛋白结构域、
61
和/或自然重构分裂蛋白。
62
220.在一些实施方案中,载物包含与二聚化结构域或蛋白质-蛋白质结合结构域的融合物,其可以需要或可以不需要分子以触发二聚化或蛋白质-蛋白质结合。
221.在一些实施方案中,生产者细胞是fda批准的细胞系、同种异体细胞和/或源自供体的自体细胞。
222.在一些实施方案中,人cd47的完整或活性肽结构域可并入hevlp表面以降低免疫原性。
223.本文包括的aav蛋白的示例是aav rep 52、rep 78和vp1-3。可插入蛋白质的衣壳位点是从vp1氨基酸计数开始的t138。
63
例如,可在衣壳的这一位点处插入二聚化结构域。
224.本文包括的可以需要或可以不需要小分子诱导剂的二聚化结构域的示例是ddzf1、
56
ddzf2、
56
dmra(takara bio)、dmrb(takara bio)、dmrc(takara bio)、fkbp、
55
frb、
55
gcn4 scfv、
58 10x/24x gcn4、
58
gfp纳米抗体
59
和gfp。
64
225.本文包括的断裂型内含肽的示例是npu dnae、cfa、vma和ssp dnae。
52
226.本文包括的其他形成共价键的断裂型蛋白质的示例是spy tag和spy catcher。
53
227.本文包括的rna结合蛋白的示例是ms2、com和pp7。
65
228.本文包括的合成的dna结合锌指的示例是zf6/10、zf8/7、zf9、mk10、锌指268和锌指268/nre。
66,67
229.由本文包括的四级结构导致的多聚化的蛋白质的示例是大肠杆菌铁蛋白和铁蛋白的其他嵌合形式。
68,69
230.本文包括的光遗传“光诱导蛋白”的示例是cry2、cibn和lov2-ja。
61
231.本文包括的增强转导肽的示例是l17e、
70
vectofusin-1(miltenyi biotec)、kala、
71
和不同形式的乳酸链球菌肽。
72
232.在另一实施方案中,通过利用与载物混合的纯化颗粒的核转染、脂质、聚合物、或cacl2转染、超声处理、冻融、在不同温度下孵育和/或热冲击,生产和分离的t1-t4 hevlp可负载生物分子或化学分子载物。这些技术改编自用于将载物负载至外泌体中以用于治疗或研究应用的技术。
73-75
例如,100ug的hevlp可重悬浮在200-450ul pbs中的50mm海藻糖中,与期望浓度的载物混合,然后以0.200kv和125uf、在0.4cm小池(cuvette)中电穿孔(具有电容扩展器的genepulser ii电穿孔系统,bio-rad,hercules,ca,美国)。
233.负载载物的hevlp和组合物的生产
234.优选地,在转染后36-48小时或当hevlp在生产者细胞的培养基中达到最大浓度时(生产者细胞将颗粒排出至培养基中,并且在某个时间点,培养基中的颗粒浓度将是对于收获颗粒最佳的),从细胞培养基上清液中收获hevlp。上清液可通过本领域任何已知的方法纯化,比如离心、超速离心、沉淀、超滤和/或色谱法。在一些实施方案中,例如,首先过滤上清液,以去除大于1μm的颗粒,例如通过0.45孔径的聚偏二氟乙烯亲水膜(millipore millex-hv)或0.8μm孔径的混合纤维素酯亲水膜(millipore millex-aa)。过滤后,可进一步纯化和浓缩上清液,例如使用超速离心,例如以80,000至100,000xg的速度、在1℃至5℃
之间的温度下1至2小时,或以8,000至15,000g的速度、在1℃和5℃之间的温度下10至16小时。在此离心步骤后,hevlp以离心物(沉淀物)的形式浓缩,可将其重悬浮至期望的浓度、与转导增强试剂混合、经历缓冲液交换或按原样使用。在一些实施方案中,可将含有hevlp的上清液过滤、沉淀、离心和重悬浮至浓缩溶液。例如,聚乙二醇(peg)例如peg 8000,或与hevlp表面蛋白或膜组分结合的抗体-珠缀合物可用于沉淀颗粒。纯化的颗粒是稳定的,可在4℃下储存长达一周或在-80℃下储存数年而不会失去明显的活性。
235.优选地,hevlp被重悬浮或经历缓冲液交换,使得颗粒悬浮在合适的载体中。在一些实施方案中,可通过超滤(sartorius vivaspin 500mwco 100,000)进行缓冲液交换。用于体外应用的用于hevlp的示例性合适的载体将优选是适合于待由hevlp转导的细胞的细胞培养基。可混合至用于体外应用的纯化和浓缩的hevlp溶液中的转导增强试剂包括本领域技术人员已知的试剂(miltenyl biotec vectofusin-1、millipore polybrene、takara retronectin、sigma protamine sulfate等)。将在合适载体中的hevlp应用于待转导的细胞后,可通过离心进一步提高转导效率。优选地,可在室温下以1,150g的速度离心含有应用于细胞的hevlp的板30分钟。离心后,将细胞放回合适的细胞培养箱(37℃、具有5%co2的加湿孵育箱)。
236.用于施用于哺乳动物、尤其是人的hevlp的合适载体将优选是药学上可接受的组合物。“药学上可接受的组合物”指任何类型的无毒半固体、液体或雾化填充剂、稀释剂、包封材料、胶体悬浮剂或制剂助剂。优选地,该组合物适用于注射。这些可以特别是等渗的、无菌的、盐溶液(磷酸一钠或磷酸二钠、氯化钠、氯化钾、氯化钙或氯化镁以及和类似的溶液或这些盐的混合物)、或根据情况在加入无菌水或生理盐水时允许注射溶液的构成的干燥的、尤其是冷冻干燥的组合物。另一种合适的药物形式将是用于通过鼻内吸入或气管内插管施用的雾化颗粒。
237.适用于注射使用的药物形式包括无菌水溶液或悬浮剂。溶液或悬浮剂可包含与hevlp相容且不防止hevlp进入靶细胞的添加剂。在所有情况下,该形式必须是无菌的,并且必须是可采用注射器施用该形式的程度流动的。它在制造和储存条件下必须是稳定的,并且必须防止微生物比如细菌和真菌的污染作用。合适溶液的示例是缓冲液,比如磷酸盐缓冲盐水。
238.制剂合适的药物组合物的方法是本领域已知的,参见例如remington:the science and practice of pharmacy,第21版,2005;以及系列书籍drugs and the pharmaceutical sciences:a series of textbooks and monographs(dekker,ny)。例如,用于肠胃外、皮内或皮下应用的溶液或悬浮剂可包括以下组分:无菌稀释剂,比如注射用水、盐水溶液、固定油、聚乙二醇、甘油、丙二醇或其他合成溶剂;抗菌剂,比如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂,比如抗坏血酸或亚硫酸氢钠;螯合剂,比如乙二胺四乙酸;缓冲液,比如醋酸盐、柠檬酸盐或磷酸盐,以及调节张力的试剂,比如氯化钠或葡萄糖。ph值可采用酸或碱调节,比如盐酸或氢氧化钠。肠胃外制剂可封装在安瓿、一次性注射器或玻璃或塑料制成的多剂量小瓶中。
239.适用于注射使用的药物组合物可包括无菌水溶液(其中水溶性)或分散剂以及用于临时制备无菌注射溶液或分散剂的无菌粉末。对于静脉施用,合适的载体包括生理盐水、抑菌水、cremophor el
tm
(basf,parsippany,nj)或磷酸盐缓冲盐水(pbs)。在所有情况下,组
合物必须是无菌的并且应该是以存在容易注射的程度流动的。它在制造和储存条件下应该是稳定的,并且必须防止微生物比如细菌和真菌的污染作用。载体可以是含有例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇等)及其合适的混合物的溶剂或分散剂介质。合适的流动性可例如通过比如卵磷脂的涂层的使用、在分散剂的情况下通过所需的颗粒尺寸的维持,以及通过表面活性剂的使用来保持。微生物的作用的防止可通过不同抗菌剂和抗真菌剂,例如对羟基苯甲酸酯、氯丁醇、苯酚、抗坏血酸、硫柳汞等实现。在许多情况下,优选在组合物中包括等渗剂,例如糖、多元醇比如甘露醇、山梨糖醇、氯化钠。注射组合物的延长吸收可通过在组合物中包括延迟吸收的试剂,例如单硬脂酸铝和明胶来实现。
240.无菌注射溶液可通过将所需量的活性化合物并入合适的溶剂中来制备,根据需要,具有以上列举的一种组分或组分组合,然后过滤除菌。通常,分散剂是通过将活性化合物并入至无菌载体中制备的,该载体含有基本的分散剂介质和来自以上列举的那些所需的其他组分。在对于制备无菌注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥,这产生活性组分加上来自其先前无菌过滤的溶液的任何附加的期望组分的粉末。
241.包含负载载物的hevlp的组合物可与施用说明一起包括在容器、包装或分配器中。
242.实施例
243.在以下实施例中进一步描述本发明,但不限制权利要求书中所述的本发明的范围。
244.方法
245.通过使用基于聚乙烯亚胺(pei)的质粒转染的hek293t细胞生产hevlp颗粒。pei是聚乙烯亚胺25kd线性(polysciences#23966-2)。为了制备储备“pei max”溶液,将1g pei添加至预先加热至~80℃的1l无内毒素dh2o中,并冷却至室温。通过添加10n naoh将此混合物中和至ph 7.1,并采用0.22μm聚醚砜(pes)过滤除菌。pei max储存在-20℃。
246.hek293t细胞在转染时分裂至达到70%-90%的汇合度,并在10%fbs dmem培养基中培养。用u6启动子-sgrna编码质粒、hervk
con
gag(hgagk
con
)编码质粒和henvw(合包素-1(syncytin-1))编码质粒共转染载物载体,比如编码cmv启动子的载物载体,所述cmv启动子驱动hplcδ1ph与密码子优化的cas9的融合物的表达。在减血清培养基(opti-mem;gibco#31985-070)中组装转染反应物(transfection reactions)。为了在10cm板上生产hevlp颗粒,将5μg ph-cas9表达质粒、5μg sgrna表达质粒、5μg hervk
con
gag表达质粒和5μg合包素-1表达质粒混合在1ml opti-mem中,然后添加27.5μl pei max。在室温下孵育20-30分钟后,将转染反应物逐滴分散在hek293t细胞上。
247.在转染后48-72小时收获hevlp。hevlp上清液使用0.8μm孔径混合纤维素酯膜过滤器过滤,并转移至与sw28转子(beckman coulter#326823)一起使用的聚丙烯beckman超速离心管中。每个超速离心管装有来自3个10cm板的含有hevlp的上清液,以达到约35-37.5ml的最终体积。hevlp上清液在4℃下以大约100,000xg或25,000rpm经历超速离心2小时。超速离心后,倒出上清液,将hevlp沉淀物重悬浮在dmem 10%fbs培养基中,使其现在比超速离心前浓缩约1,000倍。将hevlp逐滴添加至在转导前24小时接种在24孔板中的细胞中。如有必要,补充聚凝胺(细胞培养基中5-10μg/ml;sigma-aldrich#tr-1003-g)以提高转导效率。如有必要,补充vectofusin-1(细胞培养基中10μg/ml,miltenyi biotec#130-111-163)以
提高转导效率。如有必要,加入hevlp后,立即将24孔板在室温下以1,150xg离心30分钟以提高转导效率。
248.实施例1
249.采用靶向vegf位点#3的t1hevlp转导hek 293t细胞,所述t1hevlp含有与spcas9融合的plc ph、与spcas9融合的hgagk
con
或与spcas9融合的harc。t1hevlp采用henvw(左图)或henvfrd(右图)进行假型化。通过扩增子测序测量基因修饰。通过pvdf过滤和在100,000xg超速离心2小时进行颗粒纯化和浓缩。结果如在图3中显示。重要的是,如果herv衍生的gag(hgagk
con
)没有在生产者细胞中自身过表达,则无法实现有效递送。
250.表1
[0251][0252]
a.“+”和
“‑”
指序列进入中的方向
[0253]
*henvk
con
是源自十种前病毒env序列的共有序列。用于衍生该共有env序列的env序列来自以下herv:herv-k113、herv-k101、herv-k102、herv-k104、herv-k107、herv-k108、herv-k109、herv-k115、herv-k11p22和herv-k12q13。
[0254]
表2|示例性潜在的cas9和cas12a直向同源物
[0255][0256]
切口酶突变残基代表酶的位置,或已知是保守的ruvc核酸酶结构域的催化活性所需的,或是其中缺少结构信息、基于与cjcas9的序列比对而预测为对于该催化活性所需的(*表示缺少足够的结构信息的蛋白质)。所有位置信息指从uniprot.org获得的野生型蛋白质序列。
[0257]
表3|示例性脱氨酶结构域及其底物序列偏好。
[0258][0259]
根据iupac代码注释未明确指定或允许两个或更多个核苷酸的核苷酸位置,其中w=a或t,r=a或g,y=c或t。
[0260]
表4|示例性表观遗传调节子结构域。
[0261][0262][0263]
表5|示例性的基于crispr的rna向导的rna结合酶
[0264][0265]
表6|这项工作中描述的细胞质膜募集结构域。
[0266][0267]
*hgagk
con
是源自十种前病毒gag序列的共有序列。用于衍生该共有gag序列的gag序列来自以下herv:herv-k113、herv-k101、herv-k102、herv-k104、herv-k107、herv-k108、herv-k109、herv-k115、herv-k11p22和herv-k12q13。
[0268]
相关蛋白质序列:
[0269]
智人(homo sapiens):arc
[0270][0271]
》aj289709.1人内源性逆转录病毒h herv-h/env62 herv_h/env_62-henvh1:
[0272][0273]
》aj289710.2人内源性逆转录病毒h herv-h/env60-herv_h_env_60-henvh2:
[0274][0275]
》aj289711.1人内源性逆转录病毒h herv-h/env59-herv_h_env_59-henvh3:
[0276][0277]
》ac074261.3智人染色体12克隆rp11-55f19 envk1-envk1:
[0278][0279]
》ac072054.10智人bac克隆rp11-33p21-envk2:
[0280][0281]
》y17833.1人内源性逆转录病毒k(herv-k)envk3-envk3:
[0282][0283]
》af164615.1智人内源性逆转录病毒herv-k109 envk4-envk4:
[0284][0285]
》ay037928.1人内源性逆转录病毒k113 envk5-envk5:
[0286][0287]
》ay037929.1人内源性逆转录病毒k115 envk6-envk6:
[0288][0289]
》ac078899.1智人染色体19,bac bc371065envt-envt:
[0290][0291]
》ac000064.1人bac克隆rg083m05来自7q21-7q22 envw(合包素-1)-envw(合包素-1):
[0292][0293]
》al136139.6人dna序列,来自克隆rp4-761i2 envfrd-envfrd(合包素-2):
[0294][0295]
》ac073210.8智人bac克隆rp11-460n20 envr-envr:
[0296][0297]
》ac093488.1智人染色体3克隆rp11-10o8 envr(b)-envr(b):
[0298][0299]
》ac016222.4智人克隆rp11-26j6 envf(c)2-envf(c)2:
[0300][0301]
》al354685.17人dna序列,来自克隆rp13-75g22 envf(c)1-envf(c)1:
[0302][0303]
herv-kcon env-henvkcon:
[0304][0305]
herv-kcon gag-hgagkcon:
[0306][0307]
大鼠(rattus norvegicus)&合成的:apobec1-xten l8-nspcas9-ugi-sv40 nls
[0308][0309]
酿脓链球菌:spcas9双向(bipartite)nls
[0310][0311]
金黄色酿脓葡萄球菌(staphylococcus aureus):sacas9
[0312][0313]
氨基酸球菌属:ascas12a
[0314][0315]
智人磷脂酶cδ1(hplcδ1)的pleckstrin同源结构域
[0316][0317]
智人akt1(hakt)的pleckstrin同源结构域
[0318][0319]
智人pdpk1(hpdpk1)的pleckstrin同源结构域
[0320][0321]
智人:cd9完全蛋白
[0322][0323]
智人:cd63完全蛋白
[0324][0325]
智人:cd81完全蛋白
[0326][0327]
智人:cd47“自发夹”10氨基酸
[0328][0329]
智人:cd47“自发夹”21氨基酸
[0330][0331]
智人:cd47完全蛋白
[0332][0333]
合成的:ddzf1
[0334][0335]
合成的:ddzf2
[0336][0337]
合成的:dmra
[0338][0339]
合成的:dmrb
[0340][0341]
合成的:dmrc
[0342][0343]
智人/合成的:fkbp
[0344][0345]
智人/合成的:frb
[0346][0347]
合成的:抗gcn4 scfv
[0348][0349]
合成的:10x-gcn4重复
[0350][0351]
合成的:24x-gcn4重复
[0352][0353]
合成的:gfp-靶向纳米抗体
[0354][0355]
点状念珠藻(nostoc punctiforme):npu dnae n-末端断裂型内含肽
[0356][0357]
点状念珠藻:npu dnae c-末端断裂型内含肽
[0358][0359]
合成的:cfa n-末端断裂型内含肽
[0360][0361]
合成的:cfa c-末端断裂型内含肽
[0362][0363]
酿酒酵母(saccharomyces cerevisiae):vma n-末端断裂型内含肽
[0364][0365]
酿酒酵母:vma c-末端断裂型内含肽
[0366]
[0367]
集胞藻属(synechocystis sp.)pcc 6803:ssp dnae n-末端断裂型内含肽
[0368][0369]
集胞藻属pcc 6803:ssp dnae c-末端断裂型内含肽
[0370][0371]
合成的:spy tag
[0372][0373]
合成的:spy catcher
[0374][0375]
噬菌体ms2:ms2 rna结合蛋白
[0376][0377]
噬菌体ms2:ms2(n55k)rna结合蛋白
[0378][0379]
噬菌体ms2:ms2(n55k)(v29i)rna结合蛋白
[0380][0381]
噬菌体pp7:pp7 rna结合蛋白
[0382][0383]
噬菌体mu:com rna结合蛋白
[0384][0385]
合成的:锌指zf6/10
[0386][0387]
合成的:锌指zf8/7
[0388][0389]
合成的:锌指zf9
[0390][0391]
合成的:锌指mk10
[0392][0393]
合成的:foki锌指核酸酶17-2靶向gfp
[0394][0395]
合成的:foki锌指核酸酶18-2靶向gfp
[0396][0397]
合成的:foki核酸酶结构域
[0398][0399]
合成的:acui核酸酶结构域
[0400][0401]
合成的:截短的acui核酸酶结构域
[0402][0403]
黄化瘤胃球菌(ruminococcus flavefaciens):rfxcas13d(casrx)
[0404][0405]
黄化瘤胃球菌&合成的:失活(dead)rfxcas13d(dcasrx)
[0406][0407]
合成的:l17e
[0408][0409]
合成的:l17e-跨膜
[0410][0411]
合成的:kala
[0412][0413]
合成的:kala-跨膜
[0414][0415]
合成的:vectofusin
[0416]
[0417]
合成的:vectofusin-跨膜
[0418][0419]
合成的:跨膜结构域
[0420][0421]
乳酸乳球菌(lactococcus lactis):乳酸链球菌肽a
[0422][0423]
乳酸乳球菌nizo 22186:乳酸链球菌肽z
[0424][0425]
乳酸乳球菌乳酸亚种(lactococcus lactis subsp.lactis)f10:乳酸链球菌肽f
[0426][0427]
乳酸乳球菌61-14:乳酸链球菌肽q
[0428][0429]
猪肠链球菌(streptococcus hyointestinalis):乳酸链球菌肽h
[0430][0431]
乳房链球菌(streptococcus uberis):乳酸链球菌肽u
[0432][0433]
乳房链球菌:乳酸链球菌肽u2
[0434][0435]
格氏链球菌巴氏亚种(streptococcus galloyticus subsp.pasteurianus):乳酸链球菌肽p
[0436][0437]
乳酸乳球菌(l.lactis)nz9800:乳酸链球菌肽as29a
[0438][0439]
乳酸乳球菌nz9800:乳酸链球菌肽a s29d
[0440][0441]
乳酸乳球菌nz9800:乳酸链球菌肽a s29e
[0442][0443]
乳酸乳球菌nz9800:乳酸链球菌肽a s29g
[0444][0445]
乳酸乳球菌nz9800:乳酸链球菌肽a k22t
[0446][0447]
乳酸乳球菌nz9800:乳酸链球菌肽a n20p
[0448][0449]
乳酸乳球菌nz9800:乳酸链球菌肽a m21v
[0450]
[0451]
乳酸乳球菌nz9800:乳酸链球菌肽a k22s
[0452][0453]
乳酸乳球菌nz9800:乳酸链球菌肽z n20k
[0454][0455]
乳酸乳球菌nz9800:乳酸链球菌肽z m21k
[0456][0457]
aav2:rep52
[0458][0459]
aav2:rep78
[0460][0461]
aav2:vp1
[0462][0463]
aav2:vp2
[0464][0465]
aav2:vp3
[0466][0467]
相关rna序列(5
’‑3’
)
[0468]
合成的:具有终止子用于sgrna的ms2茎环spcas9支架rna示例1
[0469][0470]
合成的:具有终止子用于sgrna的ms2茎环spcas9支架rna示例2
[0471][0472]
合成的:具有终止子用于sgrna的ms2茎环spcas9支架rna示例3
[0473][0474]
合成的:4xms2茎环rna支架示例
[0475][0476]
合成的:ms2茎环示例1
[0477][0478]
合成的:ms2茎环示例2
[0479]
[0480]
合成的:ms2茎环示例3
[0481][0482]
合成的:2xms2茎环示例
[0483][0484]
合成的:具有终止子用于sgrna的2xpp7茎环spcas9支架rna示例
[0485][0486]
合成的:pp7茎环示例
[0487][0488]
合成的:具有终止子用于sgrna的com茎环spcas9支架rna示例
[0489][0490]
合成的:com茎环示例
[0491][0492]
相关dna序列(5
’‑3’
)
[0493]
合成的:锌指zf6/10结合位点
[0494][0495]
合成的:锌指zf8/7结合位点
[0496][0497]
合成的:锌指zf6/10&zf8/7结合位点
[0498][0499]
合成的:锌指zf6/10&zf8/7结合位点8x重复示例
[0500][0501]
合成的:锌指zf9结合位点
[0502][0503]
合成的:锌指mk10结合位点
[0504][0505]
合成的:锌指268结合位点
[0506][0507]
合成的:锌指nre结合位点
[0508]
[0509]
合成的:锌指268/nre或268//nre结合位点示例1
[0510][0511]
合成的:锌指268/nre或268//nre结合位点示例2
[0512][0513]
合成的:锌指268/nre或268//nre结合位点示例3
[0514][0515]
合成的:在gfp中的foki锌指核酸酶17-2&18-2结合位点
[0516][0517]
引用文献
[0518]
1.parseval,n.等.survey of human genes of retroviral origin:identification and transcriptome of the genes with coding capacity for complete envelope proteins.journal of virology 77,10414-10422,(2003).
[0519]
2.okimoto,t.等.vsv-g envelope glycoprotein forms complexes with plasmid dna and mlv retrovirus-like particles in cell-free conditions and enhances dna transfection.molecular therapy 4,232-238,(2001).
[0520]
3.mangeot,p.等.protein transfer into human cells by vsv-g-induced nanovesicles.molecular therapy 19,1656-1666,(2011).
[0521]
4.wagner,d.等.high prevalence of streptococcus pyogenes cas9-reactive t cells within the adult human population.nature medicine 25,242-248(2019)
[0522]
5.kim,s.等.crispr rnas trigger innate immune responses in human cells.genome research 28,1-7(2018).
[0523]
6.charlesworth,c.等.identification of preexisting adaptive immunity to cas9 proteins in humans.nature medicine 25,249-254(2019)
[0524]
7.ferdosi,s.等.multifunctional crispr-cas9 with engineered immunosilenced human tcell epitopes.nature communications 10,article number:1842(2019).
[0525]
8.wang,d.等.adenovirus-mediated somatic genome editing of pten by crispr/cas9 in mouse liver in spite of cas9-specific immune responses.human gene therapy 26,432-442(2015).
[0526]
9.devanabanda,m.等.immunotoxic effects of gold and silver nanoparticles:inhibition of mitogen-induced proliferative responses and viability of human and murine lymphocytes in vitro.journal of immunotoxicology 13,1547-6901(2016).
[0527]
10.mout,r.等.direct cytosolic delivery of crispr/cas9-ribonucleoprotein for efficient gene editing.acs nano 11,2452-2458(2017).
[0528]
11.yin,h.等.structure-guided chemical modification of guide rna enables potent non-viral in vivo genome editing.nature biotechnology 35,1179-1187(2017).
[0529]
12.qiao,j.等.cytosolic delivery of crispr/cas9 ribonucleoproteins for genome editing using chitosan-coated red fluorescent protein.chemical communications 55,4707-4710(2019).
[0530]
13.li,l.等.a rationally designed semiconducting polymer brush for nir-ii imaging guided light-triggered remote control of crispr/cas9 genome editing.advanced materials 1901187,1-9(2019).
[0531]
14.gao,x.等.treatment of autosomal dominant hearing loss by in vivo delivery of genome editing agents.nature 553,217-221(2018)
[0532]
15.lee,k.等.nanoparticle delivery of cas9 ribonucleoprotein and donor dna in vivo induces homology-directed dna repair.nature biomedical engineering 1,889-901(2017).16.staahl,b.等.efficient genome editing in the mouse brain by local delivery of engineered cas9 ribonucleoprotein complexes.nature biotechnology 35,431-433(2017).
[0533]
17.zuris,j.等.cationic lipid-mediated delivery of proteins enables efficient protein-based genome editing in vitro and in vivo.nature biotechnology 33,73-79(2015).
[0534]
18.finn,j.等.a single administration of crispr/cas9 lipid nanoparticles achieves robust and persistent in vivo genome editing.cell reports 22,2227-2235(2018).
[0535]
19.wang,h.等.nonviral gene editing via crispr/cas9 delivery by membrane-disruptive and endosomolytic helical polypeptide.pnas 115,4903-4908(2018).
[0536]
20.del’guidice,t.等.membrane permeabilizing amphiphilic peptide delivers recombinant transcription factor and crispr-cas9/cpf1 ribonucleoproteins in hard-to-modify cells.plos one 13,e0195558(2018).
[0537]
21.colella,p.等.emerging issues in aav-mediated in vivo gene therapy.molecular therapy:methods&clinical development 8,87-104(2018).
[0538]
22.naso,f.等.adeno-associated virus(aav)as a vector for gene therapy.biodrugs 31,317-334(2017).
[0539]
23.handel,e.等.versatile and efficient genome editing in human cells by combining zinc-finger nucleases with adeno-associated viral vectors.human gene therapy 23,321-329(2012).
[0540]
24.chadwick,a.等.reduced blood lipid levels with in vivo crispr-cas9 base editing of angptl3.circulation 137,975-977(2018).
[0541]
25.schenkwein,d.等.production of hiv-1integrase fusion protein-carrying lentiviral vectors for gene therapy and protein transduction.human gene therapy 21,589-602(2010).26.cai,y.等.targeted genome editing by lentiviral protein transduction of zinc-finger and tal-effector nucleases.elife 3,e01911(2014).
[0542]
27.choi,j.等.lentivirus pre-packed with cas9 protein for safer gene editing.gene therapy23,627-633(2016).
[0543]
28.meyer,c.等.pseudotyping exosomes for enhanced protein delivery in mammalian cells.international journal of nanomedicine 12,3153-3170(2017).
[0544]
29.mangeot,p.等.genome editing in primary cells and in vivo using viral-derived nanoblades loaded with cas9-sgrna ribonucleoproteins.nature communications 10,article number:45(2019).
[0545]
30.lu,b.等.delivering sacas9 mrna by lentivirus-like bionanoparticles for transient expression and efficient genome editing.nucleic acids research 47,e44(2019).
[0546]
31.wang,q.等.armms as a versatile platform for intracellular delivery of macromolecules.nature communications 9,1-7(2018).
[0547]
32.lainscek,d.等.delivery of an artificial transcription regulator dcas9-vpr by extracellular vesicles for therapeutic gene activation.acs synthetic biology 7,2715-2725(2018).
[0548]
33.fuchs,j.等.first-in-human evaluation of the safety and immunogenicity of arecombinant vesicular stomatitis virus human immunodeficiency virus-1gag vaccine(hvtn 090).open forum infectious diseases 2,1-9,(2015).
[0549]
34.cong,l.等.multiplex genome engineering using crispr/cas systems.science 339,819-823,(2013).
[0550]
35.ran,f.等.in vivo genome editing using staphylococcus aureus cas9.nature 520,186-191,(2015).
[0551]
36.zetsche,b.等.cpf1 is a single rna-guided endonuclease of a class 2crispr-cas system.cell 163,759-771,(2015).
[0552]
37.komor,a.等.programmable editing of a target base in genomic dna without double-stranded dna cleavage.nature 533,420-424,(2016).
[0553]
38.gaudelli,n.等.programmable base editing of a
·
t to g
·
c in genomic dna without dna cleavage.nature 551,464-471,(2017).
[0554]
39.voelkel,c.等.protein transduction from retroviral gag precursors.proc natl acad sci usa 107,7805-7810,(2010).
[0555]
40.kaczmarczyk,s.等.protein delivery using engineered virus-like particles.proc natl acad sci usa 108,16998-17003,(2011).
[0556]
41.ebner,m.等.pi(3,4,5)p
3 engagement restricts akt activity to cellular membranes.mol cell 65,416-431,(2017).
[0557]
42.urano,e.等.substitution of the myristoylation signal of human immunodeficiency virus type 1pr55gag with the phospholipase c-d1 pleckstrin homology domain results in infectious pseudovirion production.j.gen virology 89,3144-3149,(2008).
medicine 10,1517-1527,(2014).
[0589]
74.bendix johnsen,k.等.evaluation of electroporation-induced adverse effects on adipose-derived stem cell exosomes.cytotechnology 68,2125-2138(2016).
[0590]
75.luan,x.等.engineering exosomes as refined biological nanoplatforms for drug delivery.acta pharmacologica sinica 38,754-763,(2017).
[0591]
其他实施方案
[0592]
应当理解,虽然已经结合其详细描述描述了本发明,但前述描述旨在说明而非限制本发明的范围,本发明的范围由所附权利要求的范围限定。其他方面、优点和修改在以下权利要求的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1