靶向EPHA3及其用途的制作方法
靶向epha3及其用途
1.本技术要求于2019年10月9日提交的澳大利亚专利申请第2019903802号的优先权,其内容和要素通过引用并入本文以用于所有目的。
技术领域
2.本发明涉及分子生物学领域,更具体地涉及抗体技术。更具体地,本发明涉及至少能够特异性识别或结合epha3的抗体或嵌合抗原受体(car)。本发明还涉及医学治疗和预防方法。
背景技术:
3.已发现ephrin a型受体3(epha3)在来自多种人实体瘤和白血病的肿瘤细胞上过度表达或异常表达,包括结肠癌、乳腺癌、慢性髓性白血病(cml)和多形性胶质母细胞瘤(gbm)。gbm是最具侵袭性的实体脑肿瘤之一。标准治疗包括最大程度的手术切除、放疗以及替莫唑胺的伴随和辅助化疗。然而,即使采用最佳治疗,初次诊断后的中位生存期也少于15个月(1)。使用检查点阻断的最新进展改善了一些人癌症的结果,但gbm似乎对单独的这种治疗方法具有抗性(2)。尽管如此,仍然需要开发不仅针对gbm,而且针对更广泛的癌症的新疗法。
技术实现要素:
4.本发明广泛地涉及一种抗-epha3结合剂,包括人或人源化的重组抗-epha3抗体,及其使用方法。本发明的一个具体形式进一步提供了一种嵌合抗原受体(car),其包含能够特异性结合epha3的抗原结合结构域,以及其使用方法。
5.在广义上,本发明涉及包含本文所述的epha3单克隆抗体的一个或多个cdr的epha3结合剂和car。
6.在一个方面,本发明提供了一种epha3结合剂,其包含至少一个互补决定区(cdr),所述互补决定区具有seq id no:13-72和/或表4-7中所示的氨基酸序列,或与其至少70%同一性的氨基酸序列。
7.在一些实施方案中,epha3结合剂包含:
8.(a)重链免疫球蛋白可变区(vh)多肽,其包含cdr1、cdr和cdr3,所述cdr1具有与seq id no:13-17中任一者至少70%同一性的氨基酸序列;所述cdr具有与seq id no:18-22中任一者至少70%同一性的氨基酸序列;并且所述cdr3具有与seq id no:23-27中任一者至少70%同一性的氨基酸序列;和/或
9.(b)轻链免疫球蛋白可变区(vl)多肽,其包含cdr1、cdr2和cdr3,所述cdr1具有与seq id no:28-32中任一者至少70%同一性的氨基酸序列;所述cdr2具有与seq id no:33-37中任一者至少70%同一性的氨基酸序列;并且所述cdr3具有与seq id no:38-42中任一者至少70%同一性的氨基酸序列。
10.对于这样的实施方案,vh多肽适当地包含seq id no:153所示的氨基酸序列或与
其至少70%同一性的氨基酸序列;和/或vl多肽适当地包含seq id no:154所示的氨基酸序列或与其至少70%同一性的氨基酸序列。
11.在一些相同的实施方案和一些其他实施方案中,epha3结合剂包含:
12.(a)vh多肽,其包含cdr1、cdr2和cdr3,所述cdr1具有与seq id no:43-47中任一者至少70%同一性的氨基酸序列;所述cdr2具有与seq id no:48-52中任一者至少70%同一性的氨基酸序列;并且所述cdr3具有与seq id no:53-57中任一者至少70%同一性的氨基酸序列;和/或
13.(b)vl多肽,其包含cdr1、cdr2和cdr3,所述cdr1具有与seq id no:58-62中任一者至少70%同一性的氨基酸序列;所述cdr2具有与seq id no:63-67中任一者至少70%同一性的氨基酸序列;并且所述cdr3具有与seq id no:68-72中任一者至少70%同一性的氨基酸序列。
14.在该方面,vh多肽能够包含seq id no:155所示的氨基酸序列或与其至少70%同一性的氨基酸序列;和/或vl多肽能够包含seq id no:156所示的氨基酸序列或与其至少70%同一性的氨基酸序列。
15.适当地,epha3结合剂是抗体或抗体片段。在一个实施方案中,抗体或抗体片段是3c3-1或2d4-1单克隆抗体或其片段。在某些实施方案中,epha3结合剂是重组的、人的或人源化的抗体或抗体片段。
16.在另一方面,本发明在于包含抗原结合结构域、跨膜结构域和细胞内信号传导结构域的嵌合抗原受体(car),所述抗原结合结构域包括至少一个cdr,所述cdr具有seq id no:13-72和/或表4-7所示的氨基酸序列或与其至少70%同一性的氨基酸序列。
17.在一些实施方案中,抗原结合结构域包含以下、由其组成或基本上由其组成:
18.(a)重链免疫球蛋白可变区(vh)多肽,其包含cdr1、cdr和cdr3,所述cdr1具有与seq id no:13-17中任一者至少70%同一性的氨基酸序列;所述cdr具有与seq id no:18-22中任一者至少70%同一性的氨基酸序列;并且所述cdr3具有与seq id no:23-27中任一者至少70%同一性的氨基酸序列;和/或
19.(b)轻链免疫球蛋白可变区(vl)多肽,其包含cdr1、cdr2和cdr3,所述cdr1具有与seq id no:28-32中任一者至少70%同一性的氨基酸序列;所述cdr2具有与seq id no:33-37中任一者至少70%同一性的氨基酸序列;并且所述cdr3具有与seq id no:38-42中任一者至少70%同一性的氨基酸序列。
20.对于这样的实施方案,vh多肽可包含seq id no:153所示的氨基酸序列或与其至少70%同一性的氨基酸序列;和/或vl多肽可包含seq id no:154所示的氨基酸序列或与其至少70%同一性的氨基酸序列。
21.在一些实施方案中,抗原结合结构域包含以下、由其组成或基本上由其组成:
22.(a)vh多肽,其包含cdr1、cdr2和cdr3,所述cdr1具有与seq id no:43-47中任一者至少70%同一性的氨基酸序列;所述cdr2具有与seq id no:48-52中任一者至少70%同一性的氨基酸序列;并且所述cdr3具有与seq id no:53-57中任一者至少70%同一性的氨基酸序列;和/或
23.(b)vl多肽,其包含cdr1、cdr2和cdr3,所述cdr1具有与seq id no:58-62中任一者至少70%同一性的氨基酸序列;所述cdr2具有与seq id no:63-67中任一者至少70%同一
性的氨基酸序列;并且所述cdr3具有与seq id no:68-72中任一者至少70%同一性的氨基酸序列。
24.对于这样的实施方案,vh多肽可包含seq id no:155所示的氨基酸序列或与其至少70%同一性的氨基酸序列;和/或vl多肽可包含seq id no:156所示的氨基酸序列或与其至少70%同一性的氨基酸序列。
25.在一些实施方案中,抗原结合结构域包含接头。在一个具体的实施方案中,接头包含seq id no:158所示的氨基酸序列或与其至少70%同一性的氨基酸序列、由其组成或基本上由其组成。
26.合适地,car进一步包含前导或信号肽序列,例如由seq id no:157所示的cd8的前导或信号肽序列,或与其至少70%同一性的氨基酸序列。
27.在某些实施方案中,跨膜结构域包含cd8跨膜结构域,例如包含seq id no:159所示的氨基酸序列或与其至少70%同一性的氨基酸序列的cd8跨膜结构域。
28.适当地,细胞内t细胞信号传导结构域包含cd3 zeta细胞内信号传导结构域。
29.在特定实施方案中,细胞内信号传导结构域包含seq id no:162所示的cd3氨基酸序列或与其至少70%同一性的氨基酸序列。
30.合适地,car进一步包含一个或多个共刺激结构域,例如,cd28共刺激结构域和/或cd137共刺激结构域,所述cd28共刺激结构域具有seq id no:161所示的氨基酸序列或与其至少70%同一性的氨基酸序列,所述cd137共刺激结构域具有seq id no:160所示的氨基酸序列或与其至少70%同一性的氨基酸序列。
31.在一些实施方案中,第一方面的epha3结合剂或第二方面的car用于治疗或预防受试者的癌症,例如实体癌如多形性胶质母细胞瘤。
32.在这方面,上文和本文其他地方描述的抗体和抗原结合分子显示出显著的抗肿瘤活性,并且在降低方面特别有效。在一些实施方案中,本发明的抗原结合分子具有从患有癌症的受试者基本上消除肿瘤的能力。
33.在另一个方面,本发明提供了一种分离的核酸,其编码如上文和本文其他地方所述的epha3结合剂和/或car。
34.在又一方面,本发明在于遗传构建体,其包含上文和本文其他地方描述的分离的核酸。
35.在又一方面,本发明提供了一种宿主细胞,其包含上文或本文其他地方所述的核酸和/或遗传构建体。
36.适当地,宿主细胞是或包含t细胞。
37.在另一个方面,本发明在于一种生产分离的epha3结合剂或car的方法,所述方法包括以下步骤;(i)培养第五方面的宿主细胞;和(ii)从步骤(i)中培养的所述宿主细胞中分离所述epha3结合剂或car。
38.在又一方面,本发明提供通过第六方面的方法生产的epha3结合剂或car。
39.在另一个方面,本发明在于一种抗体或抗体片段,其结合和/或针对:
40.(i)第一方面的epha3结合剂;和/或
41.(ii)第二方面的car。
42.在另一方面,本发明提供了一种组合物,其包含第一或第六方面的epha3结合剂、
第二或第六方面的car、第三方面的核酸、第四方面的遗传构建体和/或第五方面的宿主细胞和药学上可接受的载体稀释剂或赋形剂。
43.在又一方面,本发明在于治疗或预防受试者癌症的方法,所述方法包括向受试者施用治疗有效量的第一或第六方面的epha3结合剂、第二或第六方面的car、第三方面的核酸、第四方面的遗传构建体、第五方面的宿主细胞和/或第九方面的组合物,从而治疗或预防受试者的癌症。
44.在另一方面,本发明提供第一或第六方面的epha3结合剂、第二或第六方面的car、第三方面的核酸、第四方面的遗传构建体和/或第五方面的宿主细胞在制备用于预防和/或治疗受试者癌症的药物中的用途。
45.关于第一、第二、第十和第十一方面,癌症适当地是或包括多形性胶质母细胞瘤。
46.另一方面,本发明在于一种检测epha3或表达epha3的细胞的方法,所述方法包括第一方面的epha3结合剂或第二方面的car与epha3之间形成复合物的步骤,从而检测epha3或表达epha3的细胞。
47.适当地,本发明的方法包括使epha3或表达epha3的细胞与epha3结合剂或car接触的初始步骤。
48.在某些实施方案中,细胞是或包含癌细胞。
49.在又一方面,本发明提供了一种分离的蛋白,其包含、基本上由或由以下组成:seq id no:13-156和/或表4-7中任一者所示的氨基酸序列或与其至少70%同一性的氨基酸序列。
50.在又一方面,本发明提供了一种人t细胞,其表达:(a)通过与cmv抗原结合而激活的t细胞受体(tcr);和(b)嵌合抗原受体(car),其包含与epha3上的表位结合的抗原结合结构域。
51.在一些实施方案中,抗原结合结构域是scfv,其包含重链可变(vh)区和轻链可变(vl)区。
52.在类似的方面,本发明提供了一种t细胞,其包含(a)表达对cmv抗原具有特异性的tcr的t细胞受体(tcr);和(b)与epha3结合的抗原结合分子。
53.在又一方面,本发明在于一种分离的核酸,其包含、由或基本上由seq id no:1-12和/或表3中任一者所示的核酸序列、或与其至少70%同一性的核酸序列组成。
54.在整个说明书中,除非上下文另外要求,否则词语“包括”、“包含”和“包含”将被理解为暗示包括陈述的整数或整数的组,但不排除任何其他整数或整数的组。
55.在氨基酸序列的上下文中,“基本上由...组成”是指所述氨基酸序列在其n-和/或c-末端包括另外的1、2、3、4或5个氨基酸。
56.如本文所用,不定冠词“一(a)”和“一种(an)”在此用于指代或包含单数或复数的元素或特征,不应被视为意味着或定义“一个”或“单个”的元素或特征。
附图说明
57.图1
–
用于expi293f细胞表达的epha3(p29320|21-541)pcdna3.4的克隆策略。
58.图2
–
epha3(p29320|21-541)的sds-page和蛋白印迹分析。泳道m1:蛋白标记物takara,(目录号:3452);泳道m2:蛋白标记物(genscript,目录号m00521);泳道1:还原条
件;泳道2非还原条件;泳道p:多标签(genscript,目录号m0101)作为阳性对照;一抗:小鼠抗-his mab(genscript,目录号a00186)。
59.图3
–
选择用于亚克隆的亲本抗体克隆(图a)。用重组人epha3蛋白(pp29320|21-541)免疫小鼠。产生杂交瘤,并通过elisa和使用表达epha3的lk63肿瘤细胞的facs基于epha3特异性选择5个亲本杂交瘤克隆进行亚克隆(图b)。
60.图4
–
生成的单克隆抗体对epha3具有不同的结合效率。通过elisa(图a)和facs(图b)针对epha3结合效率筛选亚克隆上清液。
61.图5
–
epha3在胶质瘤细胞系上表达。使用3c3-1抗-epha3对培养的u87、d270和u251细胞系进行流式细胞术分析。
62.图6
–
(顶部)pd2109-fa301_ires-rfp和(底部)pd2109-fa302_ires-rfp car构建体的示意图,其中具有3c3-1 scfv结合区和cd28ζ或4-1bbζ信号传导结构域。
63.图7
–
在hek293t细胞中跨越car t片段(546bp)的序列的rt-pcr和琼脂糖凝胶电泳。fw-cagcggctacacctttacca和rev-ccggagaatctatccggcac引物。
64.图8
–
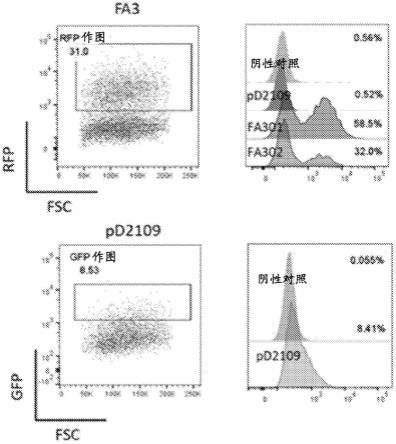
使用为构建体fa301和fa302(rfp报告基因)和pd2109(gfp报告基因)生成的epha3-car慢病毒转导jurkat细胞。
65.图9
–
epha3-car在jurkat细胞中的表面表达。用(左)fa301和(右)fa302慢病毒转导细胞,并与板结合的epha3-his蛋白一起孵育。用或不用αepha3一抗,然后用αhis-tag ab对细胞进行染色,以确定epha3-car的表面表达。
66.图10
–
表达car的jurkat细胞被epha3激活。fa301和fa302转导的jurkat细胞与浓度递增的板结合的epha3蛋白一起孵育。进行细胞染色以通过facs对cd69表达分析,并将表达car的rfp阳性水平与rfp阴性细胞进行比较。
67.图11
–
表达car的jurkat细胞被表达epha3的肿瘤细胞系激活。fa301转导的jurkat细胞与lk63细胞以1:10的比例(jurkat-car:lk63)孵育。对jurkat细胞染色以通过facs进行cd69表达分析,并将rfp阳性细胞水平与rfp阴性细胞进行比较。
68.图12
–
cmv扩增的t细胞转导了pd2109和fa301慢病毒。3天后通过facs测定转导效率。
69.图13
–
体外比较epha3 car t细胞共刺激域。(a)使用cd3/28
+
珠刺激外周血单个核细胞(多克隆扩增),并用epha3慢病毒fa305
–
bbζ或fa306
–
28ζ转导细胞并培养12天。维持非转导(nt)t细胞作为对照。通过抗小鼠igg(car)的表面表达和facs分析评估car表达。(b)epha3 car t细胞效应功能的表征。car转导的t细胞与lk63(epha3+)靶细胞过夜孵育,并使用细胞内tnf检查功能。
70.图14
–
car t细胞的产生。使用cd3/28
+
珠(多克隆扩增)或来自多个cmv抗原的26个hla i类和ii类限制性t细胞肽表位的池刺激外周血单个核细胞。这些细胞用epha3慢病毒转导并培养14天。维持非转导(nt)t细胞作为对照。通过facs分析评估car和cmv特异性的表达,分析抗小鼠igg(car)和cmv的hla复合物-肽四聚体(vte和elk)。
71.图15
–
多克隆和cmv特异性t细胞中epha3 car t细胞效应功能和细胞毒性的比较。(a)car转导的t细胞与lk63(epha3+)靶细胞过夜孵育,并使用细胞内ifn-γ、tnf和细胞表面动员的cd107a检查功能。
72.图16
–
epha3 car t细胞体外细胞毒性的表征。(a)通过u251(epha3+)和u87
(epha3-)胶质瘤细胞系的实时靶诱导细胞溶解测量表达epha3-car的t细胞特异性消除epha3+肿瘤的能力。(b&c)使用u251靶细胞系以1:1、5:1和10:1的效应子与靶标的比率对多克隆和cmv特异性epha3-car进行rtca分析。
73.图17
–
epha3 car t细胞在gbm的异种移植模型中介导有效的抗gbm应答。(a)实验设计的示意图。nrg小鼠在侧腹皮下移植了表达荧光素酶的胶质瘤细胞系u251(epha3+)或u87(epha3-)(异位模型)。通过生物发光测量或确定肿瘤大小。一旦肿瘤达到约25mm2,小鼠接受静脉内epha3-car、nt(非转导)t细胞或car19(非特异性car t细胞)。cd4+和cd8+百分比(b)和第17天收集的血液中ki67表达(c)的代表性facs图分析。(d)每周测定u251肿瘤负荷,以评估car-t细胞疗法对肿瘤消退的影响。(e)带有u251和u87的小鼠中car epha3治疗的比较(f)u251(左)和u87(右)发光肿瘤异种移植小鼠的体内成像。(g)接受epha3-car治疗或对照细胞(nt或car19)的小鼠的kaplan-meier存活曲线。
74.序列简述
75.seq id no:1克隆3c3-1重链cdr1核苷酸序列
76.seq id no:2克隆3c3-1重链cdr2核苷酸序列
77.seq id no:3克隆3c3-1重链cdr3核苷酸序列
78.seq id no:4克隆3c3-1轻链cdr1核苷酸序列
79.seq id no:5克隆3c3-1轻链cdr2核苷酸序列
80.seq id no:6克隆3c3-1轻链cdr3核苷酸序列
81.seq id no:7克隆2d4-1重链cdr1核苷酸序列
82.seq id no:8克隆2d4-1重链cdr2核苷酸序列
83.seq id no:9克隆2d4-1重链cdr3核苷酸序列
84.seq id no:10克隆2d4-1轻链cdr1核苷酸序列
85.seq id no:11克隆2d4-1轻链cdr2核苷酸序列
86.seq id no:12克隆2d4-1轻链cdr3核苷酸序列
87.seq id no:13克隆3c3-1重链cdr1氨基酸序列(chothia)
88.seq id no:14克隆3c3-1重链cdr1氨基酸序列(abm)
89.seq id no:15克隆3c3-1重链cdr1氨基酸序列(kabat)
90.seq id no:16克隆3c3-1重链cdr1氨基酸序列(contact)
91.seq id no:17克隆3c3-1重链cdr1氨基酸序列(imgt)
92.seq id no:18克隆3c3-1重链cdr2氨基酸序列(chothia)
93.seq id no:19克隆3c3-1重链cdr2氨基酸序列(abm)
94.seq id no:20克隆3c3-1重链cdr2氨基酸序列(kabat)
95.seq id no:21克隆3c3-1重链cdr2氨基酸序列(contact)
96.seq id no:22克隆3c3-1重链cdr2氨基酸序列(imgt)
97.seq id no:23克隆3c3-1重链cdr3氨基酸序列(chothia)
98.seq id no:24克隆3c3-1重链cdr3氨基酸序列(abm)
99.seq id no:25克隆3c3-1重链cdr3氨基酸序列(kabat)
100.seq id no:26克隆3c3-1重链cdr3氨基酸序列(contact)
101.seq id no:27克隆3c3-1重链cdr3氨基酸序列(imgt)
102.seq id no:28克隆3c3-1轻链cdr1氨基酸序列(chothia)
103.seq id no:29克隆3c3-1轻链cdr1氨基酸序列(abm)
104.seq id no:30克隆3c3-1轻链cdr1氨基酸序列(kabat)
105.seq id no:31克隆3c3-1轻链cdr1氨基酸序列(contact)
106.seq id no:32克隆3c3-1轻链cdr1氨基酸序列(imgt)
107.seq id no:33克隆3c3-1轻链cdr2氨基酸序列(chothia)
108.seq id no:34克隆3c3-1轻链cdr2氨基酸序列(abm)
109.seq id no:35克隆3c3-1轻链cdr2氨基酸序列(kabat)
110.seq id no:36克隆3c3-1轻链cdr2氨基酸序列(contact)
111.seq id no:37克隆3c3-1轻链cdr2氨基酸序列(imgt)
112.seq id no:38克隆3c3-1轻链cdr3氨基酸序列(chothia)
113.seq id no:39克隆3c3-1轻链cdr3氨基酸序列(abm)
114.seq id no:40克隆3c3-1轻链cdr3氨基酸序列(kabat)
115.seq id no:41克隆3c3-1轻链cdr3氨基酸序列(contact)
116.seq id no:42克隆3c3-1轻链cdr3氨基酸序列(imgt)
117.seq id no:43克隆2d4-1重链cdr1氨基酸序列(chothia)
118.seq id no:44克隆2d4-1重链cdr1氨基酸序列(abm)
119.seq id no:45克隆2d4-1重链cdr1氨基酸序列(kabat)
120.seq id no:46克隆2d4-1重链cdr1氨基酸序列(contact)
121.seq id no:47克隆2d4-1重链cdr1氨基酸序列(imgt)
122.seq id no:48克隆2d4-1重链cdr2氨基酸序列(chothia)
123.seq id no:49克隆2d4-1重链cdr2氨基酸序列(abm)
124.seq id no:50克隆2d4-1重链cdr2氨基酸序列(kabat)
125.seq id no:51克隆2d4-1重链cdr2氨基酸序列(contact)
126.seq id no:52克隆2d4-1重链cdr2氨基酸序列(imgt)
127.seq id no:53克隆2d4-1重链cdr3氨基酸序列(chothia)
128.seq id no:54克隆2d4-1重链cdr3氨基酸序列(abm)
129.seq id no:55克隆2d4-1重链cdr3氨基酸序列(kabat)
130.seq id no:56克隆2d4-1重链cdr3氨基酸序列(contact)
131.seq id no:57克隆2d4-1重链cdr3氨基酸序列(imgt)
132.seq id no:58克隆2d4-1轻链cdr1氨基酸序列(chothia)
133.seq id no:59克隆2d4-1轻链cdr1氨基酸序列(abm)
134.seq id no:60克隆2d4-1轻链cdr1氨基酸序列(kabat)
135.seq id no:61克隆2d4-1轻链cdr1氨基酸序列(contact)
136.seq id no:62克隆2d4-1轻链cdr1氨基酸序列(imgt)
137.seq id no:63克隆2d4-1轻链cdr2氨基酸序列(chothia)
138.seq id no:64克隆2d4-1轻链cdr2氨基酸序列(abm)
139.seq id no:65克隆2d4-1轻链cdr2氨基酸序列(kabat)
140.seq id no:66克隆2d4-1轻链cdr2氨基酸序列(contact)
141.seq id no:67克隆2d4-1轻链cdr2氨基酸序列(imgt)
142.seq id no:68克隆2d4-1轻链cdr3氨基酸序列(chothia)
143.seq id no:69克隆2d4-1轻链cdr3氨基酸序列(abm)
144.seq id no:70克隆2d4-1轻链cdr3氨基酸序列(kabat)
145.seq id no:71克隆2d4-1轻链cdr3氨基酸序列(contact)
146.seq id no:72克隆2d4-1轻链cdr3氨基酸序列(imgt)
147.seq id no:73克隆3c3-1 hfr1氨基酸序列(chothia)
148.seq id no:74克隆3c3-1 hfr1氨基酸序列(abm)
149.seq id no:75克隆3c3-1 hfr1氨基酸序列(kabat)
150.seq id no:76克隆3c3-1 hfr1氨基酸序列(contact)
151.seq id no:77克隆3c3-1 hfr1氨基酸序列(imgt)
152.seq id no:78克隆3c3-1 hfr2氨基酸序列(chothia)
153.seq id no:79克隆3c3-1 hfr2氨基酸序列(abm)
154.seq id no:80克隆3c3-1 hfr2氨基酸序列(kabat)
155.seq id no:81克隆3c3-1 hfr2氨基酸序列(contact)
156.seq id no:82克隆3c3-1 hfr2氨基酸序列(imgt)
157.seq id no:83克隆3c3-1 hfr3氨基酸序列(chothia)
158.seq id no:84克隆3c3-1 hfr3氨基酸序列(abm)
159.seq id no:85克隆3c3-1 hfr3氨基酸序列(kabat)
160.seq id no:86克隆3c3-1 hfr3氨基酸序列(contact)
161.seq id no:87克隆3c3-1 hfr3氨基酸序列(imgt)
162.seq id no:88克隆3c3-1 hfr4氨基酸序列(chothia)
163.seq id no:89克隆3c3-1 hfr4氨基酸序列(abm)
164.seq id no:90克隆3c3-1 hfr4氨基酸序列(kabat)
165.seq id no:91克隆3c3-1 hfr4氨基酸序列(contact)
166.seq id no:92克隆3c3-1 hfr4氨基酸序列(imgt)
167.seq id no:93克隆3c3-1 lfr1氨基酸序列(chothia)
168.seq id no:94克隆3c3-1 lfr1氨基酸序列(abm)
169.seq id no:95克隆3c3-1 lfr1氨基酸序列(kabat)
170.seq id no:96克隆3c3-1 lfr1氨基酸序列(contact)
171.seq id no:97克隆3c3-1 lfr1氨基酸序列(imgt)
172.seq id no:98克隆3c3-1 lfr2氨基酸序列(chothia)
173.seq id no:99克隆3c3-1 lfr2氨基酸序列(abm)
174.seq id no:100克隆3c3-1 lfr2氨基酸序列(kabat)
175.seq id no:101克隆3c3-1 lfr2氨基酸序列(contact)
176.seq id no:102克隆3c3-1 lfr2氨基酸序列(imgt)
177.seq id no:103克隆3c3-1 lfr3氨基酸序列(chothia)
178.seq id no:104克隆3c3-1 lfr3氨基酸序列(abm)
179.seq id no:105克隆3c3-1 lfr3氨基酸序列(kabat)
180.seq id no:106克隆3c3-1 lfr3氨基酸序列(contact)
181.seq id no:107克隆3c3-1 lfr3氨基酸序列(imgt)
182.seq id no:108克隆3c3-1 lfr4氨基酸序列(chothia)
183.seq id no:109克隆3c3-1 lfr4氨基酸序列(abm)
184.seq id no:110克隆3c3-1 lfr4氨基酸序列(kabat)
185.seq id no:111克隆3c3-1 lfr4氨基酸序列(contact)
186.seq id no:112克隆3c3-1 lfr4氨基酸序列(imgt)
187.seq id no:113克隆2d4-1 hfr1氨基酸序列(chothia)
188.seq id no:114克隆2d4-1 hfr1氨基酸序列(abm)
189.seq id no:115克隆2d4-1 hfr1氨基酸序列(kabat)
190.seq id no:116克隆2d4-1 hfr1氨基酸序列(contact)
191.seq id no:117克隆2d4-1 hfr1氨基酸序列(imgt)
192.seq id no:118克隆2d4-1 hfr2氨基酸序列(chothia)
193.seq id no:119克隆2d4-1 hfr2氨基酸序列(abm)
194.seq id no:120克隆2d4-1 hfr2氨基酸序列(kabat)
195.seq id no:121克隆2d4-1 hfr2氨基酸序列(contact)
196.seq id no:122克隆2d4-1 hfr2氨基酸序列(imgt)
197.seq id no:123克隆2d4-1 hfr3氨基酸序列(chothia)
198.seq id no:124克隆2d4-1 hfr3氨基酸序列(abm)
199.seq id no:125克隆2d4-1 hfr3氨基酸序列(kabat)
200.seq id no:126克隆2d4-1 hfr3氨基酸序列(contact)
201.seq id no:127克隆2d4-1 hfr3氨基酸序列(imgt)
202.seq id no:128克隆2d4-1 hfr4氨基酸序列(chothia)
203.seq id no:129克隆2d4-1 hfr4氨基酸序列(abm)
204.seq id no:130克隆2d4-1 hfr4氨基酸序列(kabat)
205.seq id no:131克隆2d4-1 hfr4氨基酸序列(contact)
206.seq id no:132克隆2d4-1 hfr4氨基酸序列(imgt)
207.seq id no:133克隆2d4-1 lfr1氨基酸序列(chothia)
208.seq id no:134克隆2d4-1 lfr1氨基酸序列(abm)
209.seq id no:135克隆2d4-1 lfr1氨基酸序列(kabat)
210.seq id no:136克隆2d4-1 lfr1氨基酸序列(contact)
211.seq id no:137克隆2d4-1 lfr1氨基酸序列(imgt)
212.seq id no:138克隆2d4-1 lfr2氨基酸序列(chothia)
213.seq id no:139克隆2d4-1 lfr2氨基酸序列(abm)
214.seq id no:140克隆2d4-1 lfr2氨基酸序列(kabat)
215.seq id no:141克隆2d4-1 lfr2氨基酸序列(contact)
216.seq id no:142克隆2d4-1 lfr2氨基酸序列(imgt)
217.seq id no:143克隆2d4-1 lfr3氨基酸序列(chothia)
218.seq id no:144克隆2d4-1 lfr3氨基酸序列(abm)
219.seq id no:145克隆2d4-1 lfr3氨基酸序列(kabat)
220.seq id no:146克隆2d4-1 lfr3氨基酸序列(contact)
221.seq id no:147克隆2d4-1 lfr3氨基酸序列(imgt)
222.seq id no:148克隆2d4-1 lfr4氨基酸序列(chothia)
223.seq id no:149克隆2d4-1 lfr4氨基酸序列(abm)
224.seq id no:150克隆2d4-1 lfr4氨基酸序列(kabat)
225.seq id no:151克隆2d4-1 lfr4氨基酸序列(contact)
226.seq id no:152克隆2d4-1 lfr4氨基酸序列(imgt)
227.seq id no:153克隆3c3-1重链氨基酸序列
228.seq id no:154克隆3c3-1轻链氨基酸序列
229.seq id no:155克隆2d4-1重链氨基酸序列
230.seq id no:156克隆2d4-1轻链氨基酸序列
231.seq id no:157cd8信号肽序列
232.seq id no:158间隔区/接头氨基酸序列
233.seq id no:159cd8铰链和跨膜氨基酸序列
234.seq id no:160 4-1bb/cd137共刺激结构域
235.seq id no:161cd28共刺激结构域
236.seq id no:162cd3-ζ细胞内信号传导结构域
237.seq id no:163ires核酸序列
238.seq id no:164m_cayenne rfp氨基酸序列
239.seq id no:165人epha3氨基酸序列(前体)
240.seq id no:166人epha3成熟氨基酸序列
241.seq id no:167人epha3胞外结构域氨基酸序列
242.seq id no:168人epha3跨膜结构域氨基酸序列
243.seq id no:169人epha3胞质结构域氨基酸序列
244.seq id no:170人epha3 eph配体结合结构域氨基酸序列
245.seq id no:171人epha3纤连蛋白iii型结构域氨基酸序列
246.seq id no:172人epha3纤连蛋白iii型结构域氨基酸序列
247.seq id no:173人epha3蛋白激酶结构域氨基酸序列
248.seq id no:174人epha3不育α基序氨基酸序列
具体实施方式
249.本发明至少部分基于针对epha3的单克隆抗体的生产以及随后基于这些单克隆抗体的结合结构域的嵌合抗原受体(car)的生成。这些单克隆抗体可特别适用于治疗和/或预防癌症,例如多形性胶质母细胞瘤。此外,表达这些car的t细胞可适用于癌症患者的过继免疫治疗。
250.本发明涉及与已知的抗epha3抗体相比具有新的和/或改善的特性的新的epha3结合分子。一方面,本发明提供了新的epha3结合分子,其包含至少一个互补决定区(cdr),该互补决定区(cdr)具有seq id no:13-72和/或表2-5中任一者所示的氨基酸序列,或与其至
少70%同一性的氨基酸序列。
251.epha3
252.ephrin a型受体3(epha3;也称为例如eph受体a3;eph样激酶4;人胚胎激酶;酪氨酸蛋白激酶tyro4;和酪氨酸蛋白激酶受体etk1)包括所有已知和天然存在的epha3分子,包括全长epha3蛋白及其片段、变体和衍生物。epha3包括但不限于哺乳动物epha3,例如由uniprotkb登录号p29320标识的人epha3(如seq id no:165所示)。在人中,epha3由epha3基因(也称为etk、etk1、hek和tyro4)编码。epha3的功能在boyd等人j biol chem,267(5):3262-3267中描述了,其全部内容通过引用并入本文。epha3是一种约110kda的单通道i型跨膜蛋白,其作为受体酪氨酸激酶发挥作用,其与位于相邻细胞上的混杂膜结合ephrin家族配体结合,导致向相邻细胞的接触依赖性双向信号传导。
253.seq id no:165的n-末端20个氨基酸构成信号肽,因此成熟形式的epha3(即,经过加工去除信号肽后)具有seq id no:166。seq id no:165的第21至541位形成细胞外结构域(seq id no:167),第542至565位形成跨膜结构域(seq id no:168),并且第566至983位形成胞质结构域(seq id no:169)。细胞外结构域包含eph配体结合结构域(seq id no:165的第29至207位,如seq id no:170所示);和两个纤连蛋白iii型结构域(seq id no:165的第325至435位,以及seq id no:165的第436至531位,分别如seq id no:171和172所示)。胞质结构域包含蛋白激酶结构域(在seq id no:165的第621至882位,如seq id no:173所示)。胞质结构域还包含不育α基序(sam)(seq id no:165的第911至975位,如seq id no:174所示)。
254.epha3成熟氨基酸序列:
255.mdcqlsillllscsvldsfgelipqpsnevnlldsktiqgelgwisypshgweeisgvdehytpirtyqvcnvmdhsqnnwlrtnwvprnsaqkiyvelkftlrdcnsiplvlgtcketfnlyymesdddhgvkfrehqftkidtiaadesftqmdlgdrilklnteirevgpvnkkgfylafqdvgacvalvsvrvyfkkcpftvknlamfpdtvpmdsqslvevrgscvnnskeedpprmycstegewlvpigkcscnagyeergfmcqacrpgfykaldgnmkcakcpphsstqedgsmncrcennyfradkdppsmactrppssprnvisninetsvildwswpldtggrkdvtfniickkcgwnikqcepcspnvrflprqfgltnttvtvtdllahtnytfeidavngvselsspprqfaavsittnqaapspvltikkdrtsrnsislswqepehpngiildyevkyyekqeqetsytilrargtnvtisslkpdtiyvfqirartaagygtnsrkfefetspdsfsisgessqvvmiaisaavaiilltvviyvligrfcgykskhgadekrlhfgnghlklpglrtyvdphtyedptqavhefakeldatnisidkvvgagefgevcsgrlklpskkeisvaiktlkvgytekqrrdflgeasimgqfdhpniirlegvvtkskpvmivteymengsldsflrkhdaqftviqlvgmlrgiasgmkylsdmgyvhrdlaarnilinsnlvckvsdfglsrvleddpeaayttrggkipirwtspeaiayrkftsasdvwsygivlwevmsygerpywemsnqdvikavdegyrlpppmdcpaalyqlmldcwqkdrnnrpkfeqivsildklirnpgslkiitsaaarpsnllldqsnvdittfrttgdwlngvwtahckeiftgveysscdtiakistddmkkvgvtvvgpqkkiissikaletqskngpvpv[seq id no:165]
[0256]
在本说明书中,“epha3”是指来自任何物种的epha3,包括来自任何物种的epha3同种型、片段、变体(包括突变体)或同源物。
[0257]
如本文所用,蛋白的“片段”、“变体”或“同源物”可任选地表征为与参照蛋白(例如,参照同种型)的氨基酸序列具有至少60%,优选70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%之一的氨基酸序列同一性。在一些实
施方案中,参照蛋白的片段、变体、同种型和同源物可以通过执行参照蛋白所执行的功能的能力来表征。
[0258]“片段”一般指参照蛋白的区段、结构域、部分或区域,其构成小于100%的蛋白氨基酸序列。“变体”一般指具有氨基酸序列的蛋白质,所述氨基酸序列相对于参照蛋白的氨基酸序列包含一个或多个氨基酸取代、插入、缺失或其他修饰,但保留与参照蛋白的氨基酸序列相当程度的序列同一性(例如,至少60%)。“同种型”一般是指与参照蛋白的物种相同的物种表达的参照蛋白的变体。“同源物”通常是指由与参照蛋白的物种相比不同的物种产生的参照蛋白的变体。同源物包括直系同源物。
[0259]
片段可以是任何长度(按氨基酸数计),尽管可以任选地是参照蛋白(即,片段所来自的蛋白质)长度的至少20%,并且可以具有最大长度为参照蛋白长度的50%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%之一。epha3片段可具有的最小长度为10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、200、250、300、350、400、450、550或至多约600个氨基酸之一,并且可以具有的最大长度为20、30、40、50、60、70、80、90、100、110、120、130、140、150、200、250、300、350、400、450、550或至多约600个氨基酸。
[0260]
在一些实施方案中,epha3是来自哺乳动物的epha3(例如,灵长类动物(恒河猴、食蟹猴、非人灵长类动物或人)和/或啮齿动物(例如,大鼠或鼠)epha3)。epha3的同种型、片段、变体或同源物可任选表征为与来自给定物种例如人的未成熟或成熟epha3同种型的氨基酸序列具有至少70%,优选80%、85%、90%、91、92、93、94、95、96、97、98、99或100之一的氨基酸序列同一性。
[0261]
同种型、片段、变体或同源物可以任选地是功能同种型、片段、变体或同源物,例如,具有参照epha3的功能特性/活性,如通过对功能特性/活性的合适测定法分析所确定的。例如,epha3的同种型、片段、变体或同源物可以例如显示与epha5的联合,或保留激酶活性。
[0262]
在一些实施方案中,epha3包含或由氨基酸序列组成,所述氨基酸序列与seq id no:165或166具有至少70%,优选80%、85%、90、91、92、93、94、95、96、97、98、99、或100之一的氨基酸序列同一性。在一些实施方案中,epha3的片段包含或由氨基酸序列组成,所述氨基酸序列与seq id no:167、170、171、172之一或其组合具有至少70%,优选80、85、90、91、92、93、94、95、96、97、98、99、或100之一的氨基酸序列同一性。
[0263]
epha3是蛋白酪氨酸激酶家族的ephrin受体亚家族的成员,并且已知在多种人癌症中异常表达,包括恶性黑素瘤、胶质母细胞瘤、肺癌和乳腺癌。epha3的表达增加可促进肿瘤细胞增殖、血管生成和侵袭。
[0264]
靶标分子上的感兴趣区域
[0265]
本发明的抗原结合分子被特别设计为靶向特别感兴趣的epha3区域。在两步法中,在分析预测的抗原性、功能和安全性后,选择待靶向的epha3区。然后使用对应于靶标区的肽作为免疫原制备特异性针对epha3靶标区的抗体,以产生特异性单克隆抗体,并随后筛选以鉴定能够在天然状态下与epha3结合的抗体。这种方法提供了对抗体表位的控制。
[0266]
本发明的抗原结合分子可以参照它们结合的epha3区定义。本发明的抗原结合分子可以与epha3的特定感兴趣区结合。在一些实施方案中,抗原结合分子可以结合epha3的线性表位,所述线性表位由连续的氨基酸序列(即,氨基酸一级序列)组成。在一些实施方案
中,抗原结合分子可以结合epha3的构象表位,构成氨基酸序列的不连续氨基酸序列。
[0267]
在一些实施方案中,抗原结合分子结合epha3。在一些实施方案中,抗原结合分子结合epha3的细胞外区(例如,seq id no:167所示的区)。在一些实施方案中,抗原结合分子结合eph配体结合结构域的结构域(例如,seq id no:170所示的区)。在一些实施方案中,抗原结合分子结合纤连蛋白iii型结构域之一或两者(例如,seq id no:171和172所示的区)。
[0268]
抗体结合的肽/多肽的区可以由技术人员使用本领域熟知的各种方法确定,包括x射线晶体学、抗体抗原复合物的任何分析、肽扫描、诱变作图、通过质谱的氢-氘交换分析、噬菌体展示、竞争elisa和基于蛋白质水解的“保护”方法。例如,在gershoni等人biodrugs,2007,21(3):145-156中描述了这样的方法,其全部内容通过引用并入本文。
[0269]
在一些实施方案中,抗原结合分子能够结合与包含本文所述的抗体克隆3c3-1或2d4-1之一的vh和vl序列的抗体结合的epha3区相同的epha3区、或重叠的epha3区。
[0270]
如本文所用,“分离的”是指已从其自然状态中移出或以其他方式经受人为操作的物质,例如“epha3结合分子”。分离的物质可以基本上或实质上不含在其自然状态下通常伴随它的成分,或者可以被操作以便与通常在其自然状态下伴随的成分一起处于人工状态。分离的物质可以是重组的、化学合成的、富集的、纯化的或部分纯化的形式。
[0271]
如本文所用,“蛋白质”是氨基酸聚合物,其中氨基酸可以包括d-氨基酸、l-氨基酸、天然和/或非天然氨基酸。如本文中通常使用的,“肽”是一种包含不超过五十(50)个连续氨基酸的蛋白质。如本文中通常使用的,“多肽”是一种包含超过五十(50)个连续氨基酸的蛋白质。术语“蛋白质”也应理解为包括含蛋白质的分子,例如糖蛋白和脂蛋白,但不限于此。
[0272]
在一些实施方案中,本发明的抗原结合分子能够结合多肽,所述多肽包含seq id no:165、166、167、170、171或172之一的氨基酸序列或由其组成。
[0273]
抗原结合分子结合给定肽/多肽的能力可以通过技术人员熟知的方法分析,包括通过elisa、免疫印迹(例如蛋白印迹)、免疫沉淀、表面等离子共振(spr;参见,例如,hearty等人hearty等人methods mol.biol.(2012)907:411-442)或生物层干涉法(参见,例如,lad等人(2015)j.biomol.screen 20(4):498-507)分析。
[0274]
在抗原结合分子能够结合包含参照氨基酸序列的肽或多肽的实施方案中,肽或多肽可以在参照氨基酸序列的一端或两端包含一个或多个另外的氨基酸。在一些实施方案中,例如,肽/多肽在参照氨基酸序列的一端或两端包含1-5、1-10、1-20、1-30、1-40、1-50、5-10、5-20、5-30、5-40、5-50、10-20、10-30、10-40、10-50、20-30、20-40或20-50个另外的氨基酸。
[0275]
在一些实施方案中,在参照序列的一端或两端(即,n-末端和c-末端)提供的另外的氨基酸在epha3氨基酸序列的情况下对应于在参照序列的末端位置。举例来说,其中抗原结合分子能够结合包含seq id no:#3#和在seq id no:#3#的c-末端的另外两个氨基酸的序列的肽或多肽,所述另外两个氨基酸可以都是缬氨酸,对应于seq id no:165的第542和543位。
[0276]
在一些实施方案中,抗原结合分子能够结合肽/多肽,该肽/多肽被包含本文所述的抗体克隆3c3-1或2d4-1之一的vh和vl序列的抗体结合。
[0277]
抗原结合分子
[0278]
本发明提供能够与epha3结合的抗原结合分子。
[0279]“抗原结合分子”是指能够与靶标抗原结合的分子,包括单克隆抗体、多克隆抗体、单特异性抗体和多特异性抗体(例如双特异性抗体)和抗体片段,只要它们显示与相关靶标分子的结合。
[0280]
在特定实施方案中,本文所述的epha3结合分子是抗体或抗体片段。如本文所用,“抗体”是或包含免疫球蛋白。术语“免疫球蛋白”包括哺乳动物免疫球蛋白基因复合物的任何抗原结合蛋白产物,包括免疫球蛋白同种型iga、igd、igm、igg和ige及其抗原结合片段。在术语“免疫球蛋白”中包括重组的、嵌合的或人源化的或以其他方式包含改变或变异的氨基酸残基、序列和/或糖基化的免疫球蛋白,无论是天然存在的还是通过人为干预产生的(例如,通过重组dna技术)。
[0281]
通常,抗体和抗体片段可以是多克隆的或单克隆的。在特定实施方案中,抗体或抗体片段是图1中提供的那些单克隆抗体之一(或其片段),例如3c3-1或2d4-1单克隆抗体或其片段。
[0282]
本发明还在其范围内包括抗体片段,例如本文所述的多克隆或单克隆抗体的fv、fc、fab或f(ab')2片段。或者,本发明的epha3结合剂可包含单链fv(scfv)和/或scfab抗体。此类scfv可以例如根据分别在美国专利号5,091,513、欧洲专利号239,400或winter&milstein,1991,nature 349:293的文章中描述的方法制备,其通过引用并入本文。本发明还预期包括多价重组抗体片段,即所谓的双抗体、三抗体和/或四抗体,其包含多个scfv,以及二聚化激活的片体(demibody)(例如,wo/2007/062466)。例如,此类抗体可根据holliger等人1993proc natl acad sci usa 90:6444-6448;或kipriyanov,2009methods mol biol562:177-93中描述的方法制备,其通过引用的方式整体并入本文。
[0283]
还应当理解,通过在合适的宿主细胞中表达编码抗体或抗体片段的核酸,抗体可以作为重组合成抗体或抗体片段产生。在coligan等人,current protocols in immunology的第17章和zuberbuhler等人2009,protein engineering,design&selection 22 169中提供了重组抗体表达和选择技术的非限制性示例。
[0284]
通常,抗体包含:相应的轻链可变区(v
l
或vl)和重链可变区(vh或vh),其各自包含互补决定区(cdr)1、2和3的氨基酸序列;以及相应的轻链恒定区(c
l
)和重链恒定区(ch1,ch2,ch3)。因此,抗体通常包含六个cdr(三个在重链可变区,三个在轻链可变区)。六个cdr共同限定了抗体的互补位,即与靶标抗原结合的抗体部分。
[0285]
可以使用能够与epha3结合的单克隆抗体(mab)的序列来设计和制备本发明的抗原结合分子。也可以使用/提供抗体的抗原结合区,例如单链可变片段(scfv)、fab和f(ab')2片段。“抗原结合区”是抗体的任何片段,其能够结合对于给定抗体是特异性的靶标。
[0286]vh
区和v
l
区包含每个cdr两侧的框架区(fr),其为cdr提供支架。从n-末端到c-末端,vh区包含以下结构:n末端-[hc-fr1]-[hc-cdr1]-[hc-fr2]-[hc-cdr2]-[hc-fr3]-[hc-cdr3]-[hc-fr4]-c末端;并且vh区包含以下结构:n末端-[lc-fr1]-[lc-cdr1]-[lc-fr2]-[lc-cdr2]-[lc-fr3]-[lc-cdr3]-[lc-fr4]-c末端。
[0287]
可以根据任何已知的cdr编号系统对cdr进行鉴定和编号,包括kabat(kabat等人,sequences of proteins of immunological interest,第5版,public health service,national institutes of health,bethesda,md(1991)),chothia(chothia等人,
j.mol.biol.196:901-917(1987)),abm和contact。
[0288]
在一些实施方案中,抗原结合分子包含能够结合epha3的抗原结合分子的cdr。在一些实施方案中,抗原结合分子包含能够结合epha3的抗原结合分子的fr。在一些实施方案中,抗原结合分子包含能够结合epha3的抗原结合分子的cdr和fr。也就是说,在一些实施方案中,抗原结合分子包含能够结合epha3的抗原结合分子的vh区和v
l
区。
[0289]
在一些实施方案中,抗原结合分子包含vh区和v
l
区,其是或源自本文所述的epha3结合抗体克隆的vh/vl区(即,抗epha3抗体克隆3c3-1或2d4-1)。
[0290]
cdr氨基酸序列的非限制性示例示于seq id no:13-72和/或表2-5中。使用abysis 3.4.1版和imgt/v-quest进行cdr鉴定和编号。根据本发明的抗体可以包含1、2或3个v
l cdr氨基酸序列(例如,cdr1、cdr2和/或cdr3)和/或1、2或3个v
h cdr氨基酸序列(例如,cdr1、cdr2和/或cdr3),例如在seq id no:13-72和/或表2-5中列出的那些。
[0291]
在一些实施方案中,epha3结合剂包含:
[0292]
(a)重链免疫球蛋白可变区(vh)多肽,其包含cdr1、cdr2和cdr3,所述cdr1具有与seq id no:13-17中任一者至少70%同一性的氨基酸序列;所述cdr2具有与seq id no:18-22中任一者至少70%同一性的氨基酸序列;并且所述cdr3具有与seq id no:23-27中任一者至少70%同一性的氨基酸序列;和/或
[0293]
(b)轻链免疫球蛋白可变区(vl)多肽,其包含cdr1、cdr2和cdr3,所述cdr1具有与seq id no:28-32中任一者至少70%同一性的氨基酸序列;所述cdr2具有与seq id no:33-37中任一者至少70%同一性的氨基酸序列;并且所述cdr3具有与seq id no:38-42中任一者至少70%同一性的氨基酸序列。
[0294]
对于这样的实施方案,vh多肽适当地包含seq id no:153所示的氨基酸序列或与其至少70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列;和/或vl多肽适当地包含seq id no:154所示的氨基酸序列或与其至少70%、75%、80%、85%、90%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。
[0295]
在一个替代实施方案中,epha3结合剂包括:
[0296]
(a)vh多肽,其包含cdr1、cdr2和cdr3,所述cdr1具有与seq id no:43-47中任一者至少70%同一性的氨基酸序列;所述cdr2具有与seq id no:48-52中任一者至少70%同一性的氨基酸序列;并且所述cdr3具有与seq id no:53-57中任一者至少70%同一性的氨基酸序列;和/或
[0297]
(b)vl多肽,其包含cdr1、cdr2和cdr3,所述cdr1具有与seq id no:58-62中任一者至少70%同一性的氨基酸序列;所述cdr2具有与seq id no:63-67中任一者至少70%同一性的氨基酸序列;并且所述cdr3具有与seq id no:68-72中任一者至少70%同一性的氨基酸序列。
[0298]
在这方面上,vh多肽可以包含seq id no:155所示的氨基酸序列或与其至少70%同一性的氨基酸序列;和/或vl多肽可以包含seq id no:156所示的氨基酸序列或与其至少70%同一性的氨基酸序列。
[0299]
本文所述的抗体克隆的vh区和vl区的cdr和fr根据国际imgt(immunogenetics)信息系统(lefranc等人nucleic acids res.,(2015)43(database issue):d413-22)定义如下:其使用lefranc等人,dev.comp.immunol.(2003)27:55-77中描述的imgt v-domain编号
规则。在一些实施方案中,抗原结合分子包含根据以下(1)或(2)的vh区:
[0300]
(1)(3c3-1)并入以下cdr的vh区:
[0301]
具有seq id no:16的氨基酸序列的hc-cdr1;
[0302]
具有seq id no:22的氨基酸序列的hc-cdr2;
[0303]
具有seq id no:27的氨基酸序列的hc-cdr3;
[0304]
或其变体,其中hc-cdr2、hc-cdr2或hc-cdr3中的一个或多个中的一个或两个或三个氨基酸被另一氨基酸取代。
[0305]
(2)(2d4-1)并入以下cdr的vh区:
[0306]
具有seq id no:47的氨基酸序列的hc-cdr1;
[0307]
具有seq id no:52的氨基酸序列的hc-cdr2;
[0308]
具有seq id no:57的氨基酸序列的hc-cdr3;
[0309]
或其变体,其中hc-cdr2、hc-cdr2或hc-cdr3中的一个或多个中的一个或两个或三个氨基酸被另一氨基酸取代。
[0310]
在一些实施方案中,抗原结合分子包含根据以下(3)或(4)的vh区:
[0311]
(3)(3c3-1)并入以下fr的vh区:
[0312]
具有seq id no:97的氨基酸序列的hc-fr1;
[0313]
具有seq id no:102的氨基酸序列的hc-fr2;
[0314]
具有seq id no:107的氨基酸序列的hc-fr3;
[0315]
具有seq id no:112的氨基酸序列的hc-fr4;
[0316]
或其变体,其中hc-fr1、hc-fr2、hc-fr3或hc-fr4中的一个或多个中的一个或两个或三个氨基酸被另一氨基酸取代。
[0317]
(4)(2d4-1)并入以下fr的vh区:
[0318]
具有seq id no:137的氨基酸序列的hc-fr1;
[0319]
具有seq id no:142的氨基酸序列的hc-fr2;
[0320]
具有seq id no:147的氨基酸序列的hc-fr3;
[0321]
具有seq id no:152的氨基酸序列的hc-fr4;
[0322]
或其变体,其中hc-fr1、hc-fr2、hc-fr3或hc-fr4中的一个或多个中的一个或两个或三个氨基酸被另一氨基酸取代。
[0323]
在一些实施方案中,抗原结合分子包含vh区,该vh区包含根据以上(1)和(2)之一的cdr和根据以上(3)或(4)的fr。
[0324]
在一些实施方案中,抗原结合分子包含根据以下(5)或(6)之一的vh区:
[0325]
(5)vh区,其包含根据(1)的cdr和根据(3)的fr。
[0326]
(6)vh区,其包含根据(2)的cdr和根据(4)的fr。
[0327]
在一些实施方案中,抗原结合分子包含根据以下(7)或(8)的vl区:
[0328]
(7)(3c3-1)并入以下cdr的vl区:
[0329]
具有seq id no:32的氨基酸序列的lc-cdr1;
[0330]
具有seq id no:37的氨基酸序列的lc-cdr2;
[0331]
具有seq id no:42的氨基酸序列的lc-cdr3;
[0332]
或其变体,其中lc-cdr2、lc-cdr2或lc-cdr3中的一个或多个中的一个或两个或三
个氨基酸被另一氨基酸取代。
[0333]
(8)(2d4-1)并入以下cdr的vl区:
[0334]
具有seq id no:62的氨基酸序列的lc-cdr1;
[0335]
具有seq id no:67的氨基酸序列的lc-cdr2;
[0336]
具有seq id no:72的氨基酸序列的lc-cdr3;
[0337]
或其变体,其中lc-cdr2、lc-cdr2或lc-cdr3中的一个或多个中的一个或两个或三个氨基酸被另一氨基酸取代。
[0338]
在一些实施方案中,抗原结合分子包含根据以下(9)或(10)的vl区:
[0339]
(9)(3c3-1)并入以下fr的vl区:
[0340]
具有seq id no:97的氨基酸序列的lc-fr1;
[0341]
具有seq id no:102的氨基酸序列的lc-fr2;
[0342]
具有seq id no:107的氨基酸序列的lc-fr3;
[0343]
具有seq id no:112的氨基酸序列的lc-fr4;
[0344]
或其变体,其中lc-fr1、lc-fr2、lc-fr3或lc-fr4中的一个或多个中的一个或两个或三个氨基酸被另一氨基酸取代。
[0345]
(10)(2d4-1)并入以下fr的vl区:
[0346]
具有seq id no:137的氨基酸序列的lc-fr1;
[0347]
具有seq id no:142的氨基酸序列的lc-fr2;
[0348]
具有seq id no:147的氨基酸序列的lc-fr3;
[0349]
具有seq id no:152的氨基酸序列的lc-fr4;
[0350]
或其变体,其中lc-fr1、lc-fr2、lc-fr3或lc-fr4中的一个或多个中的一个或两个或三个氨基酸被另一氨基酸取代。
[0351]
在一些实施方案中,抗原结合分子包含vl区,该vl区包含根据以上(1)和(2)之一的cdr和根据以上(3)或(4)的fr。
[0352]
在一些实施方案中,抗原结合分子包含根据以下(11)或(12)之一的vh区:
[0353]
(11)vh区,其包含根据(7)的cdr和根据(9)的fr。
[0354]
(12)vh区,其包含根据(8)的cdr和根据(10)的fr。
[0355]
抗体的抗原结合区的vh和vl区一起构成fv区。在一些实施方案中,根据本发明的抗原结合分子包含结合epha3的fv区或由其组成。在一些实施方案中,fv的vh和vl区作为通过接头区连接的单个多肽提供,即单链fv(scfv)。
[0356]
在一些实施方案中,本发明提供了本发明的分离抗体和car的片段。
[0357]
本发明的片段可以通过本文所述的那些方法产生。或者,可以例如通过用蛋白酶例如endolys-c、endoarg-c、endoglu-c和v8蛋白酶消化抗体或car蛋白来产生片段。消化的片段可以通过本领域公知的色谱技术进行纯化。
[0358]
本发明的特定实施方案提供了本发明的epha3抗原结合分子的免疫原性片段。“免疫原性”是指在对动物如人、小鼠或兔施用时能够引发免疫反应。免疫反应可以包括产生、激活或刺激免疫系统的先天性和/或适应性组,包括免疫细胞如b和/或t淋巴细胞、nk细胞、粒细胞、巨噬细胞和树突细胞和/或分子如抗体、细胞因子和趋化因子,但不限于此。
[0359]
抗体片段包括fab和fab'2片段、双抗体、三抗体、双特异性抗体和单链抗体片段
(例如,scfv),但不限于此。在一些实施方案中,抗体片段可至少包含cdr1、2和/或3氨基酸序列的一部分,例如seq id no:13-72所示,或vh和/或v
l
氨基酸序列,例如seq id no:153-156所示。优选的抗体片段包含至少一个完整的轻链可变区cdr和/或至少一个完整的重链可变区cdr。
[0360]
在一些实施方案中,本文提供的epha3结合剂是重组的、人或人源化的抗体或抗体片段。如本文广泛使用的,“人源化的”抗体可以包括完全或至少部分来源于人的抗体,包括从非人“外来”物种获得的修饰抗体或抗体片段。在一些实施方案中,抗体和抗体片段可以被修饰以便施用给的一个物种,其在相同或另一“外来”物种中产生或来源于其,而不会引发对“外来”抗体的有害免疫反应。例如,包含互补决定区(cdr)或可变区(即,vh和v
l
结构域)的人或非人抗体片段可以“移植”到人抗体支架或骨架上以产生“人源化”抗体或抗体片段。在一些实施方案中,人或非人cdr或v
l
和v
l
结构域与人抗体恒定区重组移植。
[0361]
在一些实施方案中,本发明的抗原结合分子包含免疫球蛋白重链恒定序列的一个或多个区。在一些实施方案中,免疫球蛋白重链恒定序列是或源自igg(例如,igg1、igg2、igg3、igg4)、iga(例如,iga1、iga2)、igd、ige、或igm的重链恒定序列。
[0362]
在一些实施方案中,免疫球蛋白重链恒定序列是人免疫球蛋白g1恒定序列(ighg1:uniprot登录号:p01857,v1;seq id no:175)。seq id no:175的第1至98位形成ch1区(seq id no:176)。seq id no:175的第99至110位形成在ch1和ch2区之间的铰链区(seq id no:177)。seq id no:175的第111至223位形成ch2区(seq id no:178)。seq id no:175的第222至330位形成ch3区(seq id no:179)。
[0363]
免疫球蛋白重链恒定γ1
[0364]
astkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk[seq id no:175]
[0365]
在一些实施方案中,chl区包含或由序列seq id no:176,或与seq id no:176的氨基酸序列具有至少60%、优选70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%之一的氨基酸序列同一性的序列组成。
[0366]
在一些实施方案中,本发明的抗原结合分子包含免疫球蛋白轻链恒定序列的一个或多个区。在一些实施方案中,免疫球蛋白轻链恒定序列是人免疫球蛋白入恒定序列(igla;ca),例如iglc1、iglc2、iglc3、iglc6或iglc7。在一些实施方案中,cl区包含或由序列seq id no:180,或与seq id no:180的氨基酸序列具有至少60%、优选70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%之一的氨基酸序列同一性的序列组成。
[0367]
免疫球蛋白λ恒定区
[0368]
mrpgtgqggleapgepgpnlrqrwpllllglavvthgllrptaasqsralgpgapggssrsslrsrwgrfllqrgswtgprcwprgfqskhnsvthvfgsgtqltvlsqpkatpsvtlfppsseelqankatlvclmndfypgiltvtwkadgtpitqgvemttpskqsnnkyaassylsltpeqwrsrrsyscqvmhegstvektvapaecs[seq id no:180]
[0369]
免疫球蛋白κ恒定区
[0370]
rtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec[seq id no:212]
[0371]
抗体的抗原结合区的vl和轻链恒定(cl)区,以及vh区和重链恒定1(ch1)区一起构成fab区。在一些实施方案中,抗原结合分子包含fab区,所述fab区包含vh、ch1、vl和cl(例如,cκ或cλ)。在一些实施方案中,fab区包含vh和ch1(例如,vh-ch1融合多肽)。在一些实施方案中,fab区包含多肽,所述多肽包含vh和cl(例如,vh-cl融合多肽)。在一些实施方案中,fab区包含包含vh和cl的多肽(例如,vh-cl融合多肽)和包含vl和ch的多肽(例如,cl-ch1融合多肽;也就是说,在一些实施方案中,fab区是crossfab区。在一些实施方案中,fab或crossfab的vh、ch1、vl和cl区作为通过接头区连接的单个多肽提供,即作为单链fab(scfab)或单链crossfab(sccrossfab)提供。
[0372]
在一些实施方案中,本发明的抗原结合分子包含与epha3结合的fab区、由其或基本上由其组成。
[0373]
在一些实施方案中,本文所述的抗原结合分子包含与epha3结合的完整抗体或由其组成。如本文所用,“完整抗体”是指具有与免疫球蛋白(ig)的结构基本相似的结构的抗体。例如,在schroeder和cavacini,j allergy clin immunol(2010)125(202):s41-s52中描述了不同种类的免疫球蛋白及其结构,其全部内容通过引用并入本文。
[0374]
g型免疫球蛋白(即igg)是约150kda的糖蛋白,其包含两条重链和两条轻链。从n-末端到c-末端,重链包含vh,随后是包含三个恒定结构域(ch1、ch3和ch3)的重链恒定区,并且类似地,轻链包含vl,随后是cl。取决于重链,免疫球蛋白可分类为igg(例如,igg1、igg2、igg3、igg4)、iga(例如,iga1、iga2)、igd、ige或igm。轻链可以是kappa(κ)或lambda(λ)。
[0375]
在一些实施方案中,本文所述的抗原结合分子包含与epha3结合的igg,例如,igg1、igg2、igg3、igg4)、iga(例如,iga1、iga2)、igd、ige或igm、由其或基本上由其组成。
[0376]
合适地,epha3结合剂与epha3蛋白的表位结合。如本文一般使用的,“表位”是包含蛋白质的连续或不连续氨基酸序列的抗原性蛋白片段,其中该表位可以被免疫系统的元件(例如抗体或其他抗原受体)识别或结合。
[0377]
本发明还包括本文公开的epha3结合剂的变体。
[0378]
在一个实施方案中,变体是epha3结合剂,其包含与seq id no:13-72中任一者至少70%同一性的氨基酸序列,本文称为cdr“变体”。在另一个实施方案中,变体包含与seq id no:153-156中任一者的vh和/或v
l
氨基酸序列至少70%同一性的氨基酸序列。
[0379]
合适地,包含至少一个cdr或其他变体的epha3结合剂能够结合epha3蛋白。
[0380]
在特定实施方案中,变体与参照蛋白(例如参照同种型)的氨基酸序列(例如如seq id no:13-156中任一者所示)具有至少70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的氨基酸序列同一性。本文公开的蛋白“变体”氨基酸可以具有一个或多个氨基酸缺失、插入或被不同氨基酸取代。本领域众所周知的是,一些氨基酸可以被取代或缺失而不改变肽的生物学活性(保守取代)。在一些实施方案中,片段、变体、同种型和同源物或参照蛋白可以通过执行参照蛋白所执行的功能的能力来表征。
[0381]
保守氨基酸取代是本领域已知的,并且包括这样的氨基酸取代,其中具有某些物
理和/或化学特性的一个氨基酸替换具有相同或相似化学或物理特性的另一个氨基酸。例如,保守氨基酸取代可以是用酸性/带负电的极性氨基酸取代另一个酸性/带负电的极性氨基酸(例如,asp或glu),用具有非极性侧链的氨基酸取代另一个具有非极性侧链的氨基酸(例如,ala、gly、val、ile、leu、met、phe、pro、trp、cys、val等),用碱性/带正电的极性氨基酸取代另一个碱性/带正电的极性氨基酸(例如lys、his、arg等),用具有极性侧链的不带电氨基酸取代另一个具有极性侧链的不带电氨基酸(例如,asn、gln、ser、thr、tyr等),用具有β-支化侧链的氨基酸取代另一个具有β-支化侧链的氨基酸(例如,ile、thr和val),用具有芳香侧链的氨基酸取代另一个具有芳香侧链的氨基酸(例如,his、phe、trp和tyr)等。
[0382]
本文一般用于描述相应的蛋白质和核酸之间的序列关系的术语包括“比较窗口”、“序列同一性”、“序列同一性百分比”和“实质的同一性”。因为相应的核酸/蛋白质可以各自包含(1)核酸/蛋白质共有的完整核酸/蛋白质序列的仅一个或多个部分,和(2)在核酸/蛋白之间散在的一个或多个部分,所以通常通过在“比较窗口”上比较序列来进行序列比较,以鉴定和比较序列相似性的局部区域。“比较窗口”是指与参照序列进行比较的通常为6、9或12个连续残基的概念片段。与参照序列相比,比较窗口可以包含约20%或更少的添加或删除(即,空位),用于相应序列的最佳比对。可以通过计算机执行的算法(intelligenetics的geneworks程序;威斯康星遗传软件版本7.0中的gap、bestfit、fasta和tfasta,遗传计算机集团,美国威斯康星州575science drive madison,其通过引用并入本文)、或者通过各种选定方法中的任何方法生成的检测和最佳比对来进行用于比对窗口的最佳比对(即,在比较窗口中形成最高的同源性百分比)。还可以参考blast程序家族,例如由altschul等人,1997,nucl.acids res.25:3389所公开的,其通过引用并入本文。序列分析的详细讨论可以在current protocols in molecular biology eds.ausubel等人(john wiley&sons inc ny,1995-2015)的第19.3单元中找到。
[0383]
术语“序列同一性”在本文中以其最广泛的意义使用,包括核苷酸或氨基酸匹配的精确数目,考虑了使用标准算法的适当比对、考虑了序列在比较窗口上相同的程度。因此,通过以下计算“序列同一性百分比”:在比较窗口上比较两个最佳比对序列,确定在两个序列中出现相同核酸碱基(例如,a、t、c、g、i)的位置数目,以产生匹配位置的数目,用匹配位置的数目除以比较窗口中的总位置数(即,窗口大小),再将结果乘以100,得出序列同一性的百分比。例如,“序列同一性”可以理解为表示由dnasis计算机程序(windows版本2.5;可从美国加利福尼亚州南旧金山的日立软件工程有限公司获得)计算的“匹配百分比”。
[0384]
还提供了本文公开的抗体、抗体片段或其变体的衍生物。
[0385]
如本文所用,“衍生的”抗体、抗体片段或其变体已被改变,例如通过与其他化学部分缀合或复合,通过翻译后修饰(例如,磷酸化、泛素化、糖基化)、化学修饰(例如,交联、乙酰化、生物素化、氧化或还原等)、与标记物缀合(例如,荧光团、酶、放射性同位素)和/或包括本领域将理解的其他氨基酸序列。
[0386]
在这方面上,本领域技术人员参照current protocols in protein science,eds.coligan等人(john wiley&sons ny 1995-2015)的第15章,以了解与蛋白质化学修饰相关的更广泛的方法。
[0387]
其他氨基酸序列可以包括产生融合蛋白的融合配偶体氨基酸序列。例如,融合配偶体氨基酸序列可以帮助检测和/或纯化分离的融合蛋白。非限制性例子包括金属结合(例
如,多组氨酸)融合配偶体、麦芽糖结合蛋白(mbp)、蛋白a、谷胱甘肽s-转移酶(gst)、荧光蛋白序列(例如,gfp、rfp)、表位标签,例如myc、flag和血凝素标签。
[0388]
本发明的分离的蛋白(例如,epha3抗体、抗体片段和car)、变体、片段和/或衍生物可以通过本领域已知的任何方式产生,包括但不限于化学合成、重组dna技术和蛋白质水解切割以产生肽片段。
[0389]
化学合成包括固相合成和液相合成。这些方法在本领域中是众所周知的,尽管参照了synthetic vaccines ed.nicholson(blackwell scientific publications)的第9章和current protocols in protein science eds.coligan等人(john wiley&sons,inc.ny usa 1995-2008)的第15章中提供的化学合成技术的示例。在这方面,也参照国际公布wo 99/02550和国际公布wo 97/45444。
[0390]
在一个优选的实施方案中,本发明的epha3抗体、抗体片段和/或car蛋白是重组蛋白。
[0391]
本领域技术人员可以使用标准方案方便地制备重组蛋白,例如sambrook等人,molecular cloning.a laboratory manual(cold spring harbor press,1989)中所述的示例,特别是第16和17节;current protocols in molecular biology eds.ausubel等人(john wiley&sons,inc.ny usa1995-2008),特别是第10章和第16章;以及current protocols in protein science eds.coligan等人(john wiley&sons,inc.ny usa1995-2008),特别是第1、5和6章。
[0392]
嵌合抗原受体(car)
[0393]
本发明还提供了包含本发明的抗原结合分子或多肽的嵌合抗原受体(car)。
[0394]
因此,在本发明的相关方面提供了包含抗原结合结构域、跨膜结构域和细胞内t细胞信号传导结构域的嵌合抗原受体(car),所述抗原结合结构域包括至少一个cdr,所述cdr具有seq id no:13-72所示的氨基酸序列或与其至少70%同一性的氨基酸序列。
[0395]
car是人工构建的杂合蛋白或多肽,其含有与t细胞信号传导结构域连接的抗体的抗原结合结构域(例如,单链可变片段(scfv))。car的特征包括其能够以非mhc限制性方式将t细胞特异性和反应性重定向到选定的靶标,并利用单克隆抗体的抗原结合特性。非mhc限制性抗原识别使表达car的t细胞能够不依赖于抗原加工而识别抗原,从而绕过肿瘤逃逸的主要机制。此外,当在t细胞中表达时,有利地,car不与内源性t细胞受体(tcr)α和β链二聚化。例如,在dotti等人immunol rev(2014)257(1)中综述了car结构和工程化,该文献通过引用将其全部并入本文。car包含与细胞膜锚定区(也称为跨膜结构域)连接的抗原结合区和信号传导区。任选的铰链区可以提供抗原结合区和细胞膜锚定区之间的分离,并且可以充当柔性接头。本发明的car包含抗原结合区,该抗原结合区包含根据本发明的多肽、由其或基本上由其组成。
[0396]
细胞膜锚定区提供在car的抗原结合结构域和信号传导区之间,并且提供用于将car锚定到表达car的细胞的细胞膜上,其中抗原结合区在细胞外空间中,并且信号传导区在细胞内。在一些实施方案中,car包含或源自cd3-ζ、cd4、cd8或cd28之一的跨膜区氨基酸序列。合适地,跨膜结构域源自选自以下的膜蛋白:cd8α、cd8β、4-1bb/cd137、cd28、cd34、cd4、fcεriγ、cd16、ox40/cd134、cd3-ζ、cd3ε、cd3γ、cd3δ、tcrα、cd32、cd64、vegfr2、fas、fgfr2b及其任意组合。在一些具体的实施方案中,跨膜结构域可以源自cd8和/或cd28跨膜
结构域,其通常提供良好的受体稳定性。如本文所用,“源自”参照氨基酸序列的区包含氨基酸序列,所述氨基酸序列至少具有与参照序列具有至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列同一性的氨基酸序列。在一些实施方案中,跨膜结构域包含在seq id no:159中所示的氨基酸序列或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。
[0397]
本文所述的嵌合受体的跨膜结构域(即细胞膜锚定区)可以是本领域已知的任何形式。如本文所用,“跨膜结构域”是指任何蛋白结构,其在细胞膜,优选在真核细胞膜中是热力学稳定的。适用于本文所用的嵌合受体的跨膜结构域可以从天然存在的蛋白质中获得。或者,其可以是合成的、非天然存在的蛋白区段(例如,在细胞膜中热力学稳定的疏水蛋白区段;参见,例如,美国专利号7,052,906和pct公开号wo2000/032776,其通过引用并入本文)。为此,跨膜结构域可以包含疏水性α螺旋。
[0398]
任何细胞内或胞质t细胞信号传导结构域(例如,cd3-ζ或fcεr1γ)可用于构建本文所述的嵌合受体,例如包含基于免疫受体酪氨酸的激活基序(itam)的嵌合受体,用于磷酸化和激活表达car的t细胞的。如本文所用,“itam”是一种保守的蛋白质基序,其通常存在于许多免疫细胞中表达的信号传导分子的尾部。抗原识别后,受体聚集并将信号传递给细胞。最常用的t细胞信号传导组分是包含三个itam的cd3-ζ的组分。其在抗原结合后将激活信号传递给t细胞。然而,应当理解,cd3-ζ胞质信号传导结构域可能不提供完全有效的激活信号,并且可以使用另外的共刺激信号传导结构域,例如上文所述的那些。例如,嵌合cd28和/或4-1bb/cd137可以与cd3-ζ一起使用来传递增殖/存活信号,或者三者可以一起使用。因此,本发明的car的胞内域可以包含cd28共刺激结构域(例如,seq id no:161)、4-1bb/cd137共刺激结构域(例如,seq id no:160)和cd3-ζ细胞内信号传导结构域(例如,seq id no:162)。
[0399]
car的信号传导区也可以包含源自共刺激分子的信号传导区的共刺激序列,以在结合靶蛋白后促进表达car的t细胞的激活。激活宿主细胞中的共刺激信号传导结构域(例如,免疫细胞)可以诱导细胞增加或减少细胞因子的产生和分泌、吞噬特性、增殖、分化、存活和/或细胞毒性。任何共刺激分子的共刺激信号传导结构域可以适用于本文所述的嵌合受体。可以基于以下因素选择共刺激信号传导结构域的类型,例如表达嵌合受体的免疫细胞的类型(例如,t细胞、nk细胞、巨噬细胞、中性粒细胞或嗜酸性粒细胞)和期望的免疫效应功能(例如,adcc效应)。换句话说,如本文所用,术语“共刺激信号传导结构域”指蛋白质的至少一部分,其介导细胞内的信号转导以诱导免疫反应,例如效应功能。本文所述的嵌合受体的共刺激信号传导结构域可以是来自共刺激蛋白的胞质信号传导结构域,其转导信号并调节由免疫细胞介导的反应,例如t细胞、nk细胞、巨噬细胞、中性粒细胞或嗜酸性粒细胞。
[0400]
用于嵌合受体的示例性共刺激信号传导结构域可以是共刺激蛋白的胞质信号传导结构域,包括但不限于b7/cd28家族的成员(例如,b7-1/cd80,b7-2/cd86,b7-h1/pd-l1,b7-h2,b7-h3,b7-h4,b7-h6,b7-h7,btla/cd272,cd28,ctla-4,gi24/vista/b7-h5,icos/cd278,pd-1,pd-l2/b7-dc和pdcd6);tnf超家族成员(例如,4-1bb/tnfsf9/cd137,4-1bb配体/tnfsf9,baff/blys/tnfsf13b,baff-r/tnfrsf13c,cd27/tnfrsf7,cd27配体/tnfsf7,cd30/tnfrsf8,cd30配体/tnfsf8,cd40/tnfrsf5,cd40/tnfsf5,cd40配体/tnfsf5,dr3/
tnfrsf25,gitr/tnfrsf18,gitr配体/tnfsf18,hvem/tnfrsf14,light/tnfsf14,淋巴毒素-α/tnf-β,ox40/tnfrsf4,ox40 ligand/tnfsf4,relt/tnfrsf19l,taci/tnfrsf13b,tl1a/tnfsf15,tnf和tnf rii/tnfrsf1b);slam家族的成员(例如,2b4/cd244/slamf4,blame/slamf8,cd2,cd2f-10/slamf9,cd48/slamf2,cd58/lfa-3,cd84/slamf5,cd229/slamf3,cracc/slamf7,ntb-a/slamf6和slam/cd150);和任何其他共刺激分子,例如cd2,cd7,cd53,cd82/kai-1,cd90/thy1,cd96,cd160,cd200,cd300a/lmir1,i类hla,hla-dr,ikaros,整合素α4/cd49d,整合素α4β1,整合素α4β7/lpam-1,lag-3,tcl1a,tcl1b,crtam,dap12,dectin-1/clec7a,dppiv/cd26,ephb6,tim-1/kim-1/havcr,tim-4,tslp,tslp r,淋巴细胞功能相关抗原-1(lfa-1)和nkg2c。在一些实施方案中,共刺激信号传导结构域是4-1bb,cd28,ox40,icos,cd27,gitr,hvem,tim1,lfa1(cd11a)或cd2,或其任何变体。在一些实施方案中,共刺激信号传导结构域源自4-1bb(例如,seq id no:160)和/或cd28(例如,seq id no:161)。
[0401]
本文所述的任何共刺激信号传导结构域的变体也在本公开的范围内,使得该共刺激信号传导结构域能够调节免疫细胞的免疫反应。此外,设想嵌合受体可以包含多于一个的共刺激信号传导结构域(例如,2、3、4或更多个)。在一些实施方案中,嵌合受体包含两个或更多个相同的共刺激信号传导结构域,例如cd28的共刺激信号传导结构域的两个拷贝。在一些实施方案中,嵌合受体包含来自不同共刺激蛋白的两个或更多个共刺激信号传导结构域,例如本文所述的任何两个或更多个共刺激蛋白。在某些情况下,car被工程化以提供不同细胞内信号传导通路的共刺激。例如,与cd28共刺激相关的信号传导优先激活磷脂酰肌醇3-激酶(p13k)通路,而4-1bb介导的信号传导是通过tng受体相关因子(traf)衔接蛋白的。因此,car的信号传导区有时包含源自多于一个共刺激分子的信号传导区的共刺激序列。在一些实施方案中,本发明的car包含一个或多个共刺激序列,所述共刺激序列包含以下氨基酸序列或由其组成,所述氨基酸序列包含cd28、ox30、4-1bb、icos和cd27中一个或多个的细胞内结构域的氨基酸序列、由其组成或由其衍生。
[0402]
任选的铰链区可以提供抗原结合结构域和跨膜结构域之间的分离,并且可以充当柔性接头。铰链区可以源自igg1。在一些实施方案中,本发明的car包含铰链区,所述铰链区包含或由氨基酸序列组成,所述氨基酸序列包含igg1铰链区的氨基酸序列、由其组成或由其衍生。
[0403]
设想本发明的car可以被认为是例如第一代、第二代、第三代或第四代(即,如本领域已知的,与通用细胞因子介导杀伤的重定向t细胞(truck)相关)。第一代car通常通过铰链和跨膜结构域将抗体衍生的scfv连接到t细胞受体的cd3-zeta(ζ或z)细胞内信号传导结构域。第二代car并入一个另外的结构域(例如,cd28、4-1bb或icos)以提供共刺激信号。第三代car通常包含与tcr cd3-ζ链融合的两个共刺激结构域。第三代共刺激结构域可以包括例如cd3-ζ、cd27、cd28、4-1bb、icos、dap-10或ox40的组合。因此,本发明的car可以包含通常源自单链可变片段(scfv)的胞外域、铰链、跨膜结构域和具有一个(第一代)、两个(第二代)或三个(第三代)源自cd3-ζ和/或共刺激分子的信号传导结构域的胞内域。
[0404]
在一些实施方案中,car与细胞因子活性的t细胞重定向(例如,truck)相关,也称为第四代car。truck是car重定向t细胞,其用作触发car t细胞的效应活性的载体,并且另外地产生和释放转基因细胞因子(例如,il-12),其在靶标组织(例如,表达epha3的肿瘤组
织)中累积。转基因细胞因子是组成型制备的或在car与靶标结合时释放。truck细胞可以在靶标部位沉积多种治疗性细胞因子。这可以导致靶标部位的治疗浓度,并避免这些相同细胞因子的全身毒性。
[0405]
本发明的car适当地具有对epha3的抗原特异性。如本文所用,短语“具有抗原特异性”和“引发抗原特异性反应”意指car可以特异性结合并在免疫学上识别抗原,使得car与抗原的结合引发免疫反应。不受特定理论或机制的束缚,据信通过引发针对epha3的抗原特异性反应,本文所述的car提供以下任何一项或多项:靶向和破坏表达epha3的癌细胞,减少或消除癌细胞,促进免疫细胞浸润到肿瘤部位,增强/延长抗癌反应。
[0406]
本发明的一个实施方案提供了一种car,其包含本文所述的单克隆抗体之一的抗原结合结构域,例如图1中提供的那些。在特定实施方案中,car包含特异性结合epha3的3c3或2d4单克隆抗体的抗原结合结构域。在这方面,本发明的一个优选实施方案提供了包含抗原结合结构域的car,所述抗原结合结构域包含由3c3或2d4的抗原结合结构域的单链可变片段(scfv)、由其或基本上由其组成。
[0407]
抗原结合结构域可以包含轻链可变区和/或重链可变区。在本发明的一个实施方案中,重链可变区包括cdr1区、cdr2区和cdr3区。在这方面,抗原结合结构域可以包含重链cdr1区、重链cdr2区和重链cdr3区中的一个或多个,所述重链cdr1区包含seq id no:13-17中的任一者或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列;所述重链cdr2区包含seq id no:18-22中的任一者或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列;并且所述重链cdr3区包含seq id no:23-27中的任一者或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。在一个替代实施方案中,抗原结合结构域包含重链cdr1区、重链cdr2区和重链cdr3区中的一个或多个,所述重链cdr1区包含seq id no:43-47中的任一者或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列;所述重链cdr2区包含seq id no:48-52中的任一者或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列;并且所述重链cdr3区包含seq id no:53-57中的任一者或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。优选地,重链包含选自seq id no:13-27或seq id no:43-57、或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列的cdr1区、cdr2区和cdr3区的全部。
[0408]
在本发明的一个实施方案中,轻链可变区可以包括轻链cdr1区、轻链cdr2区和轻链cdr3区。在这方面,抗原结合结构域可以包含轻链cdr1区、轻链cdr2区和轻链cdr3区中的一个或多个,所述轻链cdr1区包含seq id no:28-32中的任一者或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列;所述轻链cdr2区包含seq id no:33-37中的任一者或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列;并且所述轻链cdr3区包含seq id no:38-42中的任一者或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序
列。在一个替代实施方案中,抗原结合结构域包含轻链cdr1区、轻链cdr2区和轻链cdr3区中的一个或多个,所述轻链cdr1区包含seq id no:58-62中的任一者或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列;所述轻链cdr2区包含seq id no:63-67中的任一者或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列;并且所述轻链cdr3区包含seq id no:68-72中的任一者或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。优选地,轻链包含选自seq id no:28-42或seq id no:58-72、或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列的cdr1区、cdr2区和cdr3区的全部。
[0409]
抗原结合结构域的重链可变区可以包含以下、由其或基本上由其组成:seq id no:153或155或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。抗原结合结构域的轻链可变区可以包含、由或基本上由以下组成:seq id no:154或156或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。因此,在本发明的一个实施方案中,抗原结合结构域包含重链可变区和/或轻链可变区,所述重链可变区包含seq id no:153或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列,所述轻链可变区包含seq id no:154或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。在一个替代实施方案中,抗原结合结构域包含重链可变区和/或轻链可变区,所述重链可变区包含seq id no:155或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列,所述轻链可变区包含seq id no:156或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。优选地,所述抗原结合结构域包含seq id no:153和154、或seq id no:155和156、或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。
[0410]
在本发明的一个实施方案中,轻链可变区和重链可变区可以通过间隔或接头序列连接。接头可以包含任何合适的氨基酸序列。在本发明的一个实施方案中,接头可以包含、由或基本上由以下组成:seq id no:158所示的氨基酸序列、或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列。
[0411]
此外,car可以包含另外的间隔或接头序列,以将抗原结合结构域与跨膜结构域连接并且在空间上将抗原结合结构域与其胞内域分开。柔性间隔或铰链区允许抗原结合结构域在不同的方向上定向,以实现epha3结合。例如,抗体(例如igg、iga、igm、ige或igd抗体)的铰链结构域,也适用于本文所述的嵌合受体。在一些实施方案中,铰链结构域是连接抗体恒定结构域ch1和ch2的铰链结构域。因此,例如,另外的间隔序列可以包含igg1 fc区、igg1铰链或cd8柄或铰链,或其组合。
[0412]
设想抗原结合结构域可以进一步包括前导或信号肽序列。前导序列可以是存在于
新合成的蛋白质的n-末端(例如,位于邻近重链可变区)的肽序列(例如,约5、约10、约15、约20、约25或约30个氨基酸长度),其引导蛋白质进入分泌通路。前导序列可以包含本领域已知的任何合适的前导序列,例如源自cd8、粒细胞-巨噬细胞集落刺激因子(gm-csf)受体、cd28、鼠κ链和cd16的那些。在一个实施方案中,前导序列是cd8前导序列。在这方面,抗原结合结构域可包含前导序列,所述前导序列包含、由或基本上由seq id no:157或与其至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同一性的氨基酸序列组成。在本发明的一个实施方案中,虽然前导序列可以促进car在细胞表面上的表达,但是在表达的car中存在前导序列对于car发挥功能并不是必需的。因此,当car在细胞表面表达时,可以从car切下前导序列。因此,在本发明的一个实施方案中,car缺少前导序列。
[0413]
car的抗原结合结构域通常通过间隔和/或铰链区和跨膜结构域与胞内域融合,所述胞内域包含细胞内或胞质t细胞信号传导结构域、或与其结合。当car与靶抗原结合时,会导致激活信号传递到其表达的t细胞。胞内域是参与信号传递的car的一部分,并且以这种方式其可以包含一个或多个共刺激结构域和/或一个或多个细胞内t细胞信号传导结构域。
[0414]
本文所述的car的功能部分包括在本发明的范围内。当用于提及car时,术语“功能部分”指本发明的car的任何部分或片段,该部分或片段保留其作为一部分的car(亲本car)的生物学活性。功能部分包括,例如,以与亲本car相似的程度、相同的程度或更高的程度保留识别靶细胞或检测、治疗或预防疾病的能力的car的那些部分。参照亲本car,功能部分可以包括,例如,亲本car的约10%、25%、30%、50%、68%、80%、90%、95%或更多。
[0415]
功能部分可以在该部分的氨基或羧基末端,或在两个末端包含另外的氨基酸,这些另外的氨基酸在亲本car的氨基酸序列中不存在。理想地,另外的氨基酸不干扰功能部分的生物学功能,例如识别靶细胞、检测癌症、治疗或预防癌症等。更理想地,与亲本car的生物学活性相比,另外的氨基酸增强生物学活性。
[0416]
本文所述的car的功能变体包括在本发明的范围内。如本文所用,术语“功能变体”是指与亲本car具有实质或显著的序列同一性或相似性的car、多肽或蛋白质,该功能变体保留作为其变体的car的生物学活性。功能变体包括,例如,以与亲本car相似的程度、相同的程度或更高的程度保留识别靶细胞的能力的本文所述car(亲本car)的那些变体。参照亲本car,功能变体可以,例如在氨基酸序列上与亲本car至少约30%、约50%、约75%、约80%、约90%、约98%、约99%或更多同一性。
[0417]
例如,功能变体可以包含亲本car的氨基酸序列,其中具有至少一个保守氨基酸取代。或者或另外地,功能变体可包含亲本car的氨基酸序列,其中具有至少一个非保守氨基酸取代。在这种情况下,优选不干扰或抑制功能变体的生物学活性的非保守氨基酸取代。非保守氨基酸取代可以增强功能变体的生物学活性,使得功能变体的生物学活性与亲本car相比增加。
[0418]
本发明实施方案的car(包括功能部分和功能变体)可以是任何长度,即可以包含任何数量的氨基酸,只要car(或其功能部分或功能变体)保持其生物学活性(例如,特异性结合抗原、检测哺乳动物中的患病细胞或治疗或预防哺乳动物疾病的能力等)。例如,car可以是约50至约5000个氨基酸长,例如50、70、75、100、125、150、175、200、300、400、500、600、700、800、900、1000或更多的氨基酸长度。
[0419]
还提供了包含根据本发明的car的细胞。根据本发明的car可用于产生表达car的免疫细胞,例如car t细胞或car nk细胞。可以在体外培养过程中将car工程化到免疫细胞中。
[0420]
本发明的car的抗原结合区可以以任何合适的形式提供,例如scfv、scfab等。
[0421]
核酸和载体
[0422]
本发明提供一种核酸或多种核酸,其编码根据本发明的抗原结合分子、多肽或car。
[0423]
在一些实施方案中,核酸例如从其他核酸或天然存在的生物物质中纯化或分离。在一些实施方案中,核酸包含或由dna和/或rna组成。
[0424]
因此,在另一个方面,本发明考虑了分离的核酸,其编码本文公开的分离的蛋白质(例如抗体和car蛋白,包括其片段、变体和衍生物)、或与编码本文公开的分离的蛋白质的核酸序列互补。
[0425]
编码本发明的分离蛋白的核苷酸序列可以容易地从本文提供的一种或多种完整核酸序列(参见,例如seq id no:1-12)推导,但不限于此。
[0426]
该方面还包括所述分离的核酸的片段、变体和衍生物,例如本文之前描述的那些。
[0427]
如本文所用,术语“核酸”是指单链或双链dna和rna。dna包括基因组dna和cdna。rna包括mrna、rna、rnai、sirna、crna和自催化rna。核酸也可以是dna-rna杂合体。核酸包含核苷酸序列,该核苷酸序列通常包括包含a、g、c、t或u碱基的核苷酸。然而,核苷酸序列可以包括其他碱基,例如肌苷、甲基胞嘧啶、甲基肌苷、甲基腺苷和/或硫尿苷,但不限于此。
[0428]
因此,在特定实施方案中,分离的核酸是cdna。
[0429]“多核苷酸”是具有八十(80)个或更多个连续核苷酸的核酸,而“寡核苷酸”具有少于八十(80)个连续核苷酸。
[0430]“探针”可以是单链或双链寡核苷酸或多核苷酸,例如,为了检测northern或southern印迹中的互补序列而适当标记。
[0431]“引物”通常是单链寡核苷酸,优选具有15-50个连续核苷酸,其能够与互补核酸“模板”退火并通过dna聚合酶的作用以模板依赖性方式延伸,所述dna聚合酶例如taq聚合酶、rna依赖性dna聚合酶、或sequenase
tm
。
[0432]
在一个实施方案中,核酸变体编码本发明的分离蛋白质的变体。
[0433]
在另一个实施方案中,核酸变体与本发明的分离的核酸共有至少40%、45%、50%、55%、60%或65%、66%、67%、68%、69%,优选至少70%、71%、72%、73%、74%或75%,更优选至少80%、81%、82%、83%、84%或85%,甚至更优选至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的核苷酸序列同一性。
[0434]
在一个具体实施方案中,本方面的分离的核酸由以下组成:(a)核酸,其:(i)编码本文所述的抗体和/或分离的car蛋白的片段、结构域、部分或区,例如根据seq id no:13至156和表1的那些,包括其变体或衍生物;(b)任选一种或多种另外的核酸序列。在这方面,另外的核酸序列可以是异源核酸序列,其可以位于分离的核酸序列的5'(5-prime)和/或3'(3-prime)末端,但不限于此。
[0435]
本发明还考虑了已被修饰的核酸,例如通过利用密码子序列冗余。在更具体的示例中,可以修改密码子的使用以优化核酸在特定生物体或细胞类型中的表达。
[0436]
本发明进一步提供了修饰的嘌呤(例如,肌苷、甲基肌苷和甲基腺苷)和修饰的嘧啶(例如,硫尿苷和甲基胞嘧啶)在本发明的核酸中的用途。
[0437]
本领域技术人员将很好地理解,本发明的分离的核酸可以使用标准方案方便地制备,例如在current protocols in molecular biology(eds.ausubel等人john wiley&sons ny,1995-2008)的第2章和第3章中描述的那些。
[0438]
在另一个实施方案中,互补核酸在高度严格条件下与本发明的核酸杂交。
[0439]“杂交(hybridise,hybridisation)”在本文中用于表示至少部分互补的核苷酸序列配对以产生dna-dna、rna-rna或dna-rna杂合体。包含互补核苷酸序列的杂交序列通过碱基配对发生。
[0440]
如本文所用,“严格”指杂交过程中的温度和离子强度条件,以及某些有机溶剂和/或去污剂的存在或不存在。严格性越高,杂交核苷酸序列之间所需的互补性水平就越高。
[0441]“严格的条件”指仅具有高频率互补碱基的核酸将杂交的那些条件。
[0442]
严格条件是本领域众所周知的,例如在ausubel等人(同上)的第2.9和2.10章中描述的那些条件,其通过引用并入本文。熟练的技术人员也将认识到可以操纵各种因素来优化杂交的特异性。优化最终洗涤的严格性可用于确保高度杂交。
[0443]
互补核苷酸序列可以通过印迹技术鉴定,所述印迹技术包括将核苷酸固定在基质(优选合成膜,例如硝酸纤维素)上的步骤、杂交步骤和检测步骤,通常使用标记的探针或其他互补核酸。southern印迹用于鉴定互补dna序列;northern印迹用于鉴定互补rna序列。斑点印迹和狭缝印迹可用于鉴定互补dna/dna、dna/rna或rna/rna多核苷酸序列。此类技术为本领域技术人员所熟知,并已在ausubel等人(同上)的第2.9.1至2.9.20页中描述了。根据这些方法,southern印迹包括通过凝胶电泳根据大小分离dna分子,将大小分离的dna转移到合成膜上,并将膜结合的dna与互补核苷酸序列杂交。当鉴定cdna或基因组dna文库中的互补核酸时,使用可替代的印迹步骤,例如通过噬斑或菌落杂交过程。此过程的其他典型示例在sambrook等人,molecular cloning.a laboratory manual(cold spring harbor press,1989)的第8-12章中描述了。
[0444]
用于检测与固定核酸杂交的标记核酸的方法为本领域从业人员所熟知。这样的方法包括放射自显影、化学发光、荧光和比色检测。
[0445]
还可以使用核酸序列扩增技术分离、检测核酸和/或对核酸进行重组dna技术。
[0446]
涵盖热法和等温法的合适核酸扩增技术是熟练的技术人员熟知的,包括聚合酶链反应(pcr);链置换扩增sda);滚环复制(rcr);基于核酸序列的扩增(nasba)、q-β复制酶扩增、重组酶聚合酶扩增(rpa)和解旋酶依赖性扩增,但不限于此。
[0447]
如本文所用,“扩增产物”是指通过核酸扩增产生的核酸产物。
[0448]
核酸扩增技术可以包括具体的定量和半定量技术,例如qpcr、实时pcr和竞争性pcr,如本领域公知的。
[0449]
在一些实施方案中,核酸可以在促进核酸递送和表达的遗传构建体中。在一些实施方案中,本发明提供一种或多种载体,其包含根据本发明的一种或多种核酸。
[0450]
因此,在又一方面,本发明提供了一种遗传构建体,其包含:(i)本文所述的分离的核酸;(ii)包含与其互补的核苷酸序列的分离的核酸。在一个实施方案中,分离的核酸与载体(例如,表达载体)中的一种或多种调节序列可操作地连接或连接。
[0451]
适当地,遗传构建体是本领域熟知的质粒、噬菌体、粘粒、酵母或细菌人工染色体的形式或包含其遗传组分。遗传构建体可以适合于在细菌或其他宿主细胞中维持和繁殖分离的核酸,用于通过重组dna技术进行操作和/或表达本发明的核酸或编码的蛋白质。
[0452]
出于宿主细胞表达的目的,遗传构建体可以是表达构建体。合适地,表达构建体包含与表达载体中的一种或多种附加序列可操作地连接的本发明的核酸。如本文所用,“载体”是核酸分子,其用作将外源核酸转移到细胞中的运载体。载体可以是用于在细胞中表达核酸的载体。“表达载体”可以是自我复制的染色体外载体,例如质粒,也可以是整合到宿主基因组中的载体。在这方面,载体可以能够将本发明的核酸转移至宿主细胞,例如t细胞,使得细胞表达epha3特异性car或epha3结合剂。为此,理想地,该载体应该能够在t细胞中维持高水平表达。
[0453]
这样的载体可以包括与编码待表达的序列的核苷酸序列可操作地连接的启动子序列。载体还可以包括终止密码子和表达增强子。
[0454]“可操作地连接”是指所述另外的核苷酸序列(例如,调节核酸序列)相对于本发明的核酸定位,优选地以启动、调节或以其他方式控制转录。通常,选择的核酸序列和调节核酸序列(例如,启动子和/或增强子)以使核酸序列的表达置于调节序列的影响或控制之下的方式共价连接(从而形成表达盒)。
[0455]
调节核苷酸序列通常适用于用于表达的宿主细胞。对于多种宿主细胞,本领域已知多种类型的合适的表达载体和合适的调节序列。
[0456]
通常,所述一种或多种调节核苷酸序列可以包括但不限于启动子序列、前导或信号序列、核糖体结合位点、转录起始和终止序列、翻译起始和终止序列以及增强子或激活子序列。
[0457]
本发明涵盖本领域已知的组成型或诱导型启动子。
[0458]
合适的载体包括质粒、二元载体、dna载体、mrna载体、病毒载体、基于转座子的载体和人工染色体。
[0459]
在特定实施方案中,表达载体是或包含一种或多种病毒递送系统,例如腺病毒载体、腺相关病毒(aav)载体、疱疹病毒载体、逆转录病毒载体(例如,γ逆转录病毒载体;例如,鼠白血病病毒)(mlv)衍生载体)、慢病毒载体、牛痘病毒载体和杆状病毒载体。
[0460]
在一些实施方案中,载体可以是真核载体,例如,包含在真核细胞中从载体表达蛋白质所必需的元件的载体。在一些实施方案中,载体可以是哺乳动物载体,例如,包含巨细胞病毒(cmv)或sv40启动子以驱动蛋白表达的载体。
[0461]
在另一方面,本发明提供了用本文所述的核酸分子或遗传构建体转化的宿主细胞。
[0462]
适合表达的宿主细胞可以是原核的或真核的。例如,合适的宿主细胞可以包括但不限于哺乳动物细胞(例如,m hela,hek293t,jurkat细胞)、酵母细胞(例如,酿酒酵母(saccharomyces cerevisiae))、使用或不使用杆状病毒表达系统的昆虫细胞(例如,sf9、粉纹夜蛾(trichoplusia ni))、植物细胞(例如,莱茵衣藻(chlamydomonas reinhardtii)、三角褐指藻(phaeodactylum tricornutum))或细菌细胞,例如大肠杆菌。将遗传构建体引入宿主细胞(无论是原核的还是真核的)在本领域中是众所周知的,例如在current protocols in molecular biology eds.ausubel等人(john wiley&sons,inc.1995-2009)
中描述的那些,特别是第9章和第16章。
[0463]
car表达细胞
[0464]
本公开还提供了包含或表达根据本公开的car的细胞。还提供了包含或表达编码根据本公开的car的核酸的细胞。可以在体外培养过程中将car工程化到t细胞中,用于转导和表达,例如在用于过继性t细胞疗法的t细胞扩增期间发生的。用于工程化免疫细胞以表达car的方法是本领域技术人员已知的并且描述于例如wang and rivi
è
re,mol ther oncolytics,(2016)3:16015中,其全部内容通过引用并入本文。应当理解,“至少一个细胞”包括多个细胞,例如此类细胞的群。
[0465]
包含或表达根据本发明的car的细胞可以是真核细胞,例如哺乳动物细胞。哺乳动物可以是人或非人哺乳动物(例如兔、豚鼠、大鼠、小鼠或其他啮齿动物(包括啮齿目中的任何动物)、猫狗、猪、绵羊、山羊、牛(包括牛,例如奶牛,或牛(bos)目中的任何动物)、马(包括马科(equidae)中的任何动物)、驴和非人灵长类动物)。
[0466]
在一些实施方案中,细胞可以来自或可以已经从人受试者获得。在car表达细胞用于治疗受试者的情况下,细胞可以来自待用car表达细胞治疗的受试者(即,细胞可以是自体的),或者细胞可以来自不同的受试者(即,细胞可以是同种异体的)。
[0467]
在特定实施方案中,细胞是或包含免疫细胞。细胞可以是造血来源的细胞,例如中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、树突细胞、淋巴细胞或单核细胞。淋巴细胞可以是例如t细胞、b细胞、nk细胞、nkt细胞或先天淋巴细胞(ilc)或其前体。细胞可以表达例如cd3多肽(例如cd3γ、cd3ε、cd3ζ或cd3δ)、tcr多肽(tcrα或tcrβ)、cd27、cd28、cd4或cd8。
[0468]
适当地,免疫细胞是或包含t细胞,包括cd4+辅助t细胞和/或cd8+细胞毒性t细胞(例如,细胞毒性t淋巴细胞(ctl))。在这方面,本方面的t细胞可以在cd4+辅助t细胞/cd8+细胞毒性t细胞的混合群中。
[0469]
car t细胞的用途与它们可以全身施用的优点相关,并且将归巢于原发性和转移性肿瘤(参见manzo等人,human mol genetics(2015)r67-73)。
[0470]
在一些实施方案中,细胞是抗原特异性t细胞。在这种类型的实施方案中,“抗原特异性”t细胞是响应于t细胞特异性的抗原、或表达所述抗原的细胞而呈现t细胞的某些功能特性的细胞。在一些实施方案中,这些特性是与效应t细胞(例如细胞毒性t细胞)相关的功能特性。
[0471]
在一些实施方案中,抗原特异性t细胞可以呈现一种或多种以下特性,例如,响应于t细胞特异性抗原或包含/表达t细胞特异性抗原的细胞:细胞毒性,例如,对包含/表达t细胞特异性抗原的细胞的细胞毒性;增殖、ifn-γ表达、cd107a表达、il-2表达、tnf表达、穿孔素表达、颗粒酶表达、粒溶素表达和/或fas配体(fasl)表达。当由适当的mhc分子呈递时,抗原特异性t细胞包含能够识别t细胞特异性抗原的肽的tcr。抗原特异性t细胞可以是cd4+t细胞和/或cd8+t细胞。
[0472]
在一些实施方案中,t细胞特异性抗原可以是病毒的肽或多肽,例如巨细胞病毒(cmv)、爱泼斯坦-巴尔病毒(ebv)、腺病毒、人乳头瘤病毒(hpv)、流感病毒、麻疹病毒、乙型肝炎病毒(hbv)、丙型肝炎病毒(hcv)、人免疫缺陷病毒(hiv)、淋巴细胞脉络丛脑膜炎病毒(lcmv)或单纯疱疹病毒(hsv)。
[0473]
有利地,本发明的分离的car可用于car基因转移,这是一种快速、可靠且能够产生
大量对epha3具有特异性的t细胞(》10
8-10
10
细胞/患者)的方法,而与患者先前存在的免疫库无关。例如,逆转录病毒或慢病毒转导可能只需要48小时与预激活的t细胞培养。此外,大量的自体t细胞可以从受试者血液样品的白细胞分离术或从外周血单个核细胞(pbmc)的分离中获得。因此,可以在几天内工程化10
8-109个转化或转染的t细胞用于输注。
[0474]
因此,本发明的宿主细胞(例如t细胞)可通过过继转移的方式用于治疗epha3相关疾病、疾患或病症,例如癌症。为此,通常从取自受试者(包括供体受试者)的生物样品中分离t细胞,用于遗传修饰细胞的过继转移。
[0475]
优选地,用本发明的car转导或转化的t细胞(例如图4中所示的那些car)包含幼稚、中央记忆和效应记忆细胞的混合物。
[0476]
在替代实施方案中,宿主细胞是或源自干细胞,例如造血干细胞(hsc)。为此,宿主细胞因此可以是基因修饰的干细胞,其在分化后产生表达本发明的car的t细胞。
[0477]
在一些实施方案中,宿主细胞,例如t细胞,经基因工程化以表达细胞因子、趋化因子和/或其受体。
[0478]
为此,可以通过多种方式设计car t细胞,以增强肿瘤的细胞毒性和特异性、逃避肿瘤免疫抑制、避免宿主排斥并延长其治疗半衰期。例如,truck(通用细胞因子杀伤的重定向t细胞)t细胞具有car,但也经工程化以表达和释放促进肿瘤杀伤的细胞因子,如il-12。因为设计这些细胞,以在一旦定位于肿瘤环境后car激活时释放分子有效载荷,所以这些cart细胞有时也被称为“装甲car”。示例性细胞因子包括il-2、il-3、il-4、il-5、il-6、il-7、il-10、il-12、il-13、il-15、il-18、m-csf、gm-csf、ifn-α、ifn-γ、tnf、trail、flt3配体、lymphoactin和tgf-β。
[0479]“自驱动”或“归巢”cart细胞经工程化,以表达除了其car以外的趋化因子受体。由于某些趋化因子可以在肿瘤中上调,趋化因子受体的掺入有助于过继性t细胞向肿瘤的运输和被其浸润,从而增强car t细胞的特异性和功能。通用car t细胞也具有car,但其被工程化使得它们不表达内源性tcr(t细胞受体)或mhc(主要组织相容性复合物)蛋白。从过继性t细胞疗法的信号传导库中去除这两种蛋白质分别防止了移植物抗宿主病和排斥反应。装甲cart细胞也因其逃避肿瘤免疫抑制和肿瘤诱导的car t细胞功能减退的能力而得名。这些特殊的car t细胞具有car,并且可以被工程化为不表达检查点抑制剂。或者,这些car t细胞可以与阻断检查点信号传导的单克隆抗体(mab)共同施用。施用抗pdl1抗体显著恢复了car til(肿瘤浸润淋巴细胞)的杀伤能力。虽然已经研究了pd1-pdl1和ctla-4-cd80/cd86信号传导通路,但可以在设计装甲car-t时靶向其他免疫检查点信号传导分子,包括lag-3、tim-3、ido-1、2b4和kir。til的其他细胞内抑制剂包括磷酸酶(shp1)、泛素连接酶(即,cbl-b)和激酶(即二酰基甘油激酶)。装甲car t细胞也可以被工程化以表达蛋白质或受体,保护它们免受肿瘤分泌的细胞因子的影响或使其对抗肿瘤分泌的细胞因子的影响。例如,用双阴性形式的tgf-β受体转导的ctl(细胞毒性t淋巴细胞)对淋巴瘤分泌的tgf-β的免疫抑制具有抗性。与其对照对应物相比,这些转导的细胞在体内显示出显著增加的抗肿瘤活性。
[0480]
在又一方面,本发明提供了生产本文所述的分离蛋白质的方法(例如,分离的epha3结合剂或car),其包括:(i)培养上文所述的先前转化的宿主细胞;和(ii)从在步骤(i)中培养的所述宿主细胞中分离所述蛋白。
[0481]
本领域技术人员可以使用标准方案方便地制备重组蛋白,例如sambrook等人,molecular cloning.a laboratory manual(cold spring harbor press,1989)中所述的示例,特别是第16和17节;current protocols in molecular biology eds.ausubel等人(john wiley&sons,inc.ny usa1995-2008),特别是第10章和第16章;以及current protocols in protein science eds.coligan等人(john wiley&sons,inc.ny usa1995-2009),特别是第1、5和6章。
[0482]
在相关方面,本发明提供了通过上述方面的方法生产的分离的epha3结合剂或car。
[0483]
在又一个方面,本发明在于一种抗体或抗体片段,其结合和/或针对:
[0484]
(i)第一方面提及的epha3结合剂;和/或
[0485]
(ii)第二方面提及的car,
[0486]
包括其片段、变体和衍生物。
[0487]
合适地,所述抗体或抗体片段特异性结合所述分离的epha3结合剂或car。优选地,抗体或抗体片段特异性地或选择性地结合或识别本文所述的cdr、vh结构域和/或v
l
结构域的完整或部分氨基酸序列(例如,seq id no:13-156)。在这方面,本方面的抗体或抗体片段可适用于检测或分离样品中表达具有特定cdr、vh结构域和/或v
l
结构域的car的t细胞的方法中。为此,本发明的抗体和抗体片段可特别适用于亲和色谱法纯化本文所述的分离的epha3结合剂和car。例如,可参照coligan等人(同上)的第9.5章中描述的亲和色谱法步骤。
[0488]
抗体可以是多克隆或单克隆的、天然的或重组的。适用于抗体生产、纯化和使用的众所周知的方案可以在例如coligan等人(同上)的第2章;harlow,e.&lane,d.antibodies:a laboratory manual,cold spring harbor,cold spring harbor laboratory,1988中找到,两者均以引用的方式并入本文。
[0489]
通常,本发明的抗体结合或缀合本发明的分离的蛋白质、片段、变体或衍生物。例如,抗体可以是多克隆抗体。这样的抗体例如可以通过将本发明的分离的蛋白质、片段、变体或衍生物注射到生产物种中来制备,所述生产物种可以包括小鼠或兔,以获得多克隆抗血清。生产多克隆抗体的方法为本领域技术人员所熟知。可以使用的示例性方案,例如在coligan等人(同上)、和harlow&lane,1988(同上)中描述了。
[0490]
可以使用标准方法生产单克隆抗体,例如,&milstein,1975,nature256,495的文章中所描述的,其通过引用并入本文,或通过最近修改的方法生产单克隆抗体,例如,在coligan等人(同上)中描述的,通过使脾脏或其他生产抗体的细胞永生化,所述细胞源自已接种本发明的一种或多种分离的蛋白质、片段、变体或衍生物的生产物种。
[0491]
cmv特异性t细胞
[0492]
在某些方面,本文提供了表达tcr(例如,αβtcr或γδtcr)的cmv特异性t细胞(例如,cd4 t细胞和/或cd8 t细胞),所述tcr识别包含cmv表位的肽(例如,表1中列出的cmv表位)。因此,在一些优选的实施方案中,本发明的t细胞是识别包含表1中所列cmv表位的肽的t细胞。
[0493]
表1
[0494]
示例性cmv表位
[0495][0496]
[0497][0498]
在这种类型的一些优选实施方案中,t细胞进一步包含结合epha3的抗原结合分子,如上文和/或本文其他地方所述。
[0499]
在一些实施方案中,本文提供的t细胞可以被工程化以表达如上文和本文其他地方所述的car。举例来说,cmv特异性t细胞还包含结合epha3的car。
[0500]
在一些方面,本文提供了产生、激活和/或诱导识别本文所述的一种或多种cmv表位的t细胞(例如,ctl)增殖的方法。在一些实施方案中,分离包含ctl的样品(例如,pbmc样品)、使其暴露于本文公开的免疫原性肽的库、并收集刺激的ctl。优选地,免疫原性肽的库基本上由表1中列出的每个cmv肽表位氨基酸序列组成。在某些实施方案中,将暴露的样品孵育至少14天。在一些这样的实施方案中,将暴露的样品在第0天与il-21孵育。优选地,将暴露的样品在第2天与il-2孵育。在更优选的实施方案中,暴露样品的孵育包括每三天添加il-2。
[0501]
在一些实施方案中,pbmc样品来自健康供体。在某些实施方案中,pbmc源自免疫低下的供体。在一些这样的实施方案中,供体正在经历免疫抑制疗法。在一些实施方案中,供体是实体器官移植接受者。在其他实施方案中,供体正在接受抗病毒疗法。
[0502]
在一些实施方案中,将包含ctl的样品(例如,pbmc样品)与apc(所述apc呈递在i类mhc复合物上包含本文所述的cmv表位的肽)孵育培养。这种类型的合适apc的制备,例如在
国际pct专利公开号wo2019/220209中,该专利通过引用整体并入本文。对于从其获得t细胞的受试者,apc可以是自体的。在一些实施方案中,将含有t细胞的样品与本文提供的apc孵育两次或更多次。在一些实施方案中,在至少一种细胞因子(例如il-2、il-4、il-7、il-15和/或il-21)的存在下,将t细胞与apc孵育。使用apc诱导t细胞增殖的示例性方法提供于,例如美国专利公开号2015/0017723中,其通过引用并入本文。
[0503]
可以通过任何合适的方法,例如流式细胞术评估cmv肽特异性t细胞表达的生物标志物。在一些实施方案中,通过cmv特异性肽刺激cmv肽特异性t细胞,并通过流式细胞术分选。优选地,根据国际pct专利公开号wo2019/220209中描述的方案,对cmv肽特异性t细胞进行刺激和/或表面染色,该专利公开通过引用并入本文。在一些实施方案中,将cmv肽特异性t细胞与一种或多种对cd107a具有特异性的抗体孵育,然后通过流式细胞术进行分选。在一些实施方案中,将cmv肽特异性t细胞与一种或多种结合细胞内细胞因子的抗体孵育,例如,对ifnγ、il-2和/或tnf具有特异性的抗体。在一些实施方案中,将cmv肽特异性t细胞与针对细胞内细胞因子的抗体孵育,然后通过流式细胞术进行分选。
[0504]
在一些实施方案中,该方法进一步包括从供体受试者获得包含t细胞的样品(例如,从供体受试者获得pbmc样品)。在一些实施方案中,从样品中分离自体t细胞(例如,cd4+t细胞或cd8+t细胞)。在一些实施方案中,样品主要或完全由同种异体t细胞组成。
[0505]
在一些实施方案中,样品中至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、40%、50%、60%、70%、80%或90%的t细胞(例如,ctl)表达cd107a。
[0506]
在一些实施方案中,样品中至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、40%、50%、60%、70%、80%或90%的t细胞(例如,ctl)表达ifn-γ。
[0507]
在一些实施方案中,样品中至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、40%、50%、60%、70%、80%或90%的t细胞(例如,ctl)表达tnf。
[0508]
在一些实施方案中,样品中至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、40%、50%、60%、70%、80%或90%的t细胞(例如,ctl)表达il-2。
[0509]
在一些实施方案中,样品中至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%或90%的t细胞(例如,ctl)表达cd107a和ifnγ。
[0510]
在一些实施方案中,样品中至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%或90%的t细胞(例如,ctl)表达cd107a和tnf。
[0511]
在一些实施方案中,样品中至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%或90%的t细胞(例如,ctl)表达cd107a和il-2。
[0512]
在一些实施方案中,样品中至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%或90%的t细胞(例如,ctl)表达ifnγ和tnf。
[0513]
在一些实施方案中,样品中至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%或90%的t细胞(例如,ctl)表达ifnγ和il-2。
[0514]
在一些实施方案中,样品中至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%或90%的t细胞(例如,ctl)表达tnf和il-2。
[0515]
在一些实施方案中,样品中至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、
56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%或90%的t细胞(例如,ctl)表达ifnγ、tnf和il-2。
[0516]
在一些实施方案中,样品中至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%或90%的t细胞(例如,ctl)表达cd107a、tnf和il-2。
[0517]
在一些实施方案中,样品中至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%或90%的t细胞(例如,ctl)表达cd107a、ifnγ和il-2。
[0518]
在一些实施方案中,样品中至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%或90%的t细胞(例如,ctl)表达cd107a、ifn-γ和tnf。
[0519]
在一些实施方案中,样品中至少1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%或90%的t细胞(例如,ctl)表达cd107a、ifn-γ、tnf和il-2。
[0520]
在本文公开的方法的一些实施方案中,t细胞(例如,ctl)显示出对源自多种cmv抗原的多种肽表位的反应性。在这方面,1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%或90%的t细胞(例如,ctl)对多于一种的cmv表位有反应性。在某些
实施方案中,t细胞(例如,ctl)对表1中列出的任一个cmv肽表位氨基酸序列或其组合具有反应性。在一些实施方案中,t细胞(例如,ctl)对pp50、pp65、ie-1、gb、gh中的任一个或其组合具有反应性。
[0521]
可以通过本文公开的任何一种方法,例如通过暴露于免疫原性cmv肽表位的库,在t细胞(例如,ctl)扩增之前或之后,测量和/或分析t细胞生物标志物的表达和/或cmv反应性。
[0522]
在一些实施方案中,在刺激t细胞(例如,ctl)之前定量cmv反应性和生物标志物表达。可选地或另外地,可以在刺激t细胞(例如,ctl)后对cmv反应性和生物标志物表达进行定量。在一些实施方案中,通过定量样品中表达cd107a的t细胞的百分比来测量cmv反应性。在一些实施方案中,通过定量样品中表达ifn-γ的t细胞的百分比来测量cmv反应性。在一些实施方案中,通过定量样品中表达tnf的t细胞的百分比来测量cmv反应性。在一些实施方案中,通过定量样品中表达il-2的t细胞的百分比来测量cmv反应性。在一些实施方案中,cmv反应性测量为表达多种生物标志物(例如,cd107a、ifnγ、tnf和il-2中的两个或更多个,优选全部四个)的t细胞的百分比。在一些实施方案中,通过定量样品中表达cd107a、ifnγ、tnf和il-2的t细胞的百分比来计算cmv反应性。可以在cmv反应性百分比定量之前或之后从样品(例如,pbmc样品或包含t细胞的样品)分离t细胞。因此,在一些实施方案中,cmv反应性是在主要包含t细胞的样品中具有一种或多种所需特征的t细胞的百分比。
[0523]
在一些实施方案中,通过定量样品中表达cd107a的cd8+淋巴细胞的百分比来测量cmv反应性。在一些实施方案中,通过定量样品中表达ifnγ的cd8+淋巴细胞的百分比来测量cmv反应性。在一些实施方案中,通过定量样品中表达tnf的cd8+淋巴细胞的百分比来测量cmv反应性。在一些实施方案中,通过定量样品中表达il-2的cd8+淋巴细胞的百分比来测量cmv反应性。在一些实施方案中,cmv反应性测量为表达多种生物标志物(例如,cd107a、ifnγ、tnf和il-2中的两个或更多个,优选全部四个)的cd8+淋巴细胞的百分比。可以在cmv反应性百分比定量之前或之后从样品(例如,pbmc样品或cd8+淋巴细胞的样品)中分离cd8+淋巴细胞。因此,在一些实施方案中,cmv反应性是在主要包含cd8+淋巴细胞的样品中具有一种或多种所需特征的cd8+淋巴细胞的百分比。
[0524]
在一些实施方案中,通过定量样品中表达cd107a的cd3+淋巴细胞的百分比来测量cmv反应性。在一些实施方案中,通过定量样品中表达ifnγ的cd3+淋巴细胞的百分比来测量cmv反应性。在一些实施方案中,通过定量样品中表达tnf的cd3+淋巴细胞的百分比来测量cmv反应性。在一些实施方案中,通过定量样品中表达il-2的cd3+淋巴细胞的百分比来测量cmv反应性。在一些实施方案中,cmv反应性测量为表达多种生物标志物(例如,cd107a、ifnγ、tnf和il-2中的两个或更多个,优选全部四个)的cd3+淋巴细胞的百分比。可以在cmv反应性百分比定量之前或之后从样品(例如,pbmc样品或cd3+淋巴细胞的样品)中分离cd3+淋巴细胞。因此,在一些实施方案中,cmv反应性是在主要包含cd3+淋巴细胞的样品中具有一种或多种所需特征的cd3+淋巴细胞的百分比。
[0525]
在本发明的一些最优选的实施方案中,t细胞在其表面上呈递epha3抗原结合分子。例如,t细胞可以在其表面上呈递epha3结合car。
[0526]
对于受试者,t细胞可以是自体的或不是自体的。在一些实施方案中,在将t细胞施用于受试者之前,将其存储在细胞库中。在一些优选的实施方案中,t细胞对于受试者是同
种异体的。
[0527]
药物组合物
[0528]
在又一方面,本发明提供包含本文所述的epha3结合剂、本文所述的car、本文所述的分离的核酸、本文所述的遗传构建体和/或本文所述的宿主细胞以及药学上可接受的载体、稀释剂或赋形剂的组合物。
[0529]
在一些方面,本文提供了与药物载体一起配制的包含表达或呈递epha3car的cmv特异性ctl的组合物(例如药物组合物)或其制剂,以及施用此类药物组合物的方法。
[0530]“药学上可接受的载体、稀释剂或赋形剂”是指可安全用于全身施用的固体或液体填充剂、稀释剂或封装物质。
[0531]
在一些实施方案中,组合物可以进一步包含佐剂。如本文所用,术语“佐剂”广义地是指免疫学或药理学试剂,其在体外或体内改变或增强对组合物的免疫应答。例如,佐剂可能增加抗原随时间的存在、帮助吸收抗原呈递细胞抗原、激活巨噬细胞和淋巴细胞、并支持细胞因子的产生。通过改变免疫反应,佐剂可以允许较小剂量的免疫相互作用试剂或制剂,以增加剂量效力或安全性。例如,佐剂可以防止t细胞疲惫,从而增加特定免疫相互作用试剂或制剂的有效性或安全性。佐剂的示例包括但不限于免疫调节蛋白、佐剂65、α-galcer、磷酸铝、氢氧化铝、磷酸钙、β-葡聚糖肽、cpg dna、gpi-0100、脂质a及其修饰形式(例如,单磷酸化脂质a、脂多糖、lipovant、montanide、n-乙酰基-胞壁酰-l-丙氨酰-d-异谷氨酰胺、pam3csk4、quil a和海藻糖二霉菌酸酯。
[0532]
制备这些制剂或组合物的方法包括使本文所述的试剂与载体和任选地,一种或多种辅助成分组合的步骤。通常,通过将本文所述的试剂与液体载体或细分的固体载体或两者均匀且紧密地组合,然后,如果需要,将产品成型来制备制剂。
[0533]
适用于肠胃外施用的本发明的药物组合物包含一种或多种本文所述的试剂,以及一种或多种药学上可接受的无菌等渗水性溶液或非水性溶液、分散液、悬浮液或乳剂、或可以在使用前重构为无菌注射液或分散液的无菌粉末,其中可含有糖、醇、抗氧化剂、缓冲液、抑菌剂、使制剂与预定接受者的血液等渗的溶质、或悬浮剂或增稠剂。
[0534]
根据特定的施用途径,可以使用本领域熟知的多种载体。这些载体可以选自糖、淀粉、纤维素及其衍生物、麦芽、明胶、滑石、硫酸钙、植物油(例如橄榄油)、合成油、多元醇(如甘油、丙二醇、聚乙二醇等)、海藻酸、磷酸盐缓冲溶液、乳化剂、等渗盐水和盐,如无机酸盐,包括盐酸盐、溴化物和硫酸盐,有机酸如乙酸盐、丙酸盐和丙二酸盐以及无热原水。可用于本发明药物组合物的合适的水性和非水性载体的其他示例包括水、乙醇及其合适的混合物,以及可注射的有机酯,例如油酸乙酯。例如,通过使用包衣材料(例如卵磷脂),在分散液的情况下,通过保持所需的粒径,以及通过使用表面活性剂,可以保持适当的流动性。
[0535]
不论选择何种施用途径,都可以通过本领域技术人员已知的常规方法将本发明的试剂(其可以合适的水合形式使用)和/或本发明的药物组合物配制成药学上可接受的剂型。
[0536]
描述药学上可接受的载体、稀释剂和赋形剂的有用参照文献是remington's pharmaceutical sciences(mack publishing co.nj usa,1991),其通过引用并入本文。
[0537]
治疗应用
[0538]
本公开的方面特别涉及如本文所述的抗原结合剂和/或细胞在治疗受试者的癌症
中的用途。
[0539]
因此,本公开提供了一种治疗或预防受试者的癌症的方法,所述方法包括向受试者施用治疗有效量的本文所述的epha3结合剂或至少一种包含本文所述的epha3特异性嵌合抗原受体(car)的t细胞、或本文所述的组合物的步骤,从而治疗或预防受试者的癌症。
[0540]
如本文一般使用的,术语“癌症”、“肿瘤”、“恶性的”和“恶性肿瘤”是指疾病或病症,或与疾病或病症相关的细胞或组织,其特征在于异常或非正常的细胞增殖、分化和/或迁移,通常伴有异常或非正常的分子表型,包括一个或多个基因突变或其他与肿瘤发生、肿瘤标志物表达、肿瘤抑制基因表达或活性丧失和/或异常或非正常的细胞表面标志物表达相关的遗传变化。
[0541]
癌症可包括任何侵袭性或潜在侵袭性癌症、肿瘤或其他恶性肿瘤,例如在http://www.cancer.gov/cancertopics/alphalist上的nci癌症指数中列出的,包括所有主要癌症形式,例如肉瘤、癌、淋巴瘤、白血病和胚细胞瘤,但不限于此。这些可包括乳腺癌、肺癌(包括肺腺癌)、生殖系统癌(包括卵巢癌、宫颈癌、子宫癌和前列腺癌)、脑癌和神经系统癌、头颈癌、胃肠道癌(包括结肠癌、结直肠癌和胃癌)、肝癌、肾癌、皮肤癌(例如黑素瘤和皮肤癌)、血细胞癌(包括淋巴癌和骨髓单核细胞癌)、内分泌系统癌症(例如胰腺癌和垂体癌)、肌肉骨骼癌(包括骨癌和软组织癌),但不限于此。在特定实施方案中,癌症是实体癌,例如多形性胶质母细胞瘤。合适地,癌症表达,例如过表达,epha3。
[0542]
治疗癌症的方法可以是预防性的、预防的或治疗性的,并且适用于治疗哺乳动物,特别是人的癌症。如本文所用,“治疗”、“治疗”或“治疗”是指在癌症和/或其症状至少开始发生之后至少改善癌症症状的治疗性干预、作用过程或方案。癌症的治疗或改善可以有效地防止癌症的进展,例如防止病症恶化或减缓更严重疾病状态的发展速度。如本文所用,“预防”,“防止”或“预防”是指在癌症和/或癌症症状发作之前开始的治疗性干预、作用过程或方案,以预防、抑制或延迟癌症或症状的发展或进展。
[0543]
在一些实施方案中,向受试者施用的每个t-细胞剂量为约1
×
105至约1
×
108个t细胞。在一些实施方案中,向受试者施用的每个t-细胞剂量为约1
×
106至约1
×
107个t细胞。在一些实施方案中,向受试者施用1
×
106、1
×
107、1.5
×
107或2
×
107个t细胞(例如,ctl)。可以向受试者施用多个剂量。在一些实施方案中,施用初始剂量的t细胞(例如,自体ctl),并且例如在治疗过程中以增加的剂量施用一种或多种其他剂量的t细胞(例如,自体ctl)。在一些实施方案中,施用两个或更多个、三个或更多个、四个或更多个、五个或更多个、六个或更多个、七个或更多个、八个或更多个、九个或更多个、或十个或更多个剂量。可以向受试者施用与初始剂量相同或不同的其他剂量。例如,可以施用较低的剂量,然后施用较高的剂量。剂量可以每天一次、每周两次、每周一次、每两周一次、每月一次、每两个月一次、每三个月一次或每六个月一次施用。在一些实施方案中,受试者没有经历任何由于t细胞(例如同种异体ctl)施用的副作用。
[0544]
术语“治疗有效量”描述特定药剂的量,如epha3结合剂或car的量,其足以在用所述药剂治疗的受试者中实现期望的效果。例如,这可以是包含一种或多种本文所述的epha3结合剂和/或car的组合物的量,该量对于减少、减轻和/或预防癌症或癌症相关疾病、疾患或病症(包括癌症转移和复发是必需的。在一些实施方案中,“治疗有效量”足以减轻或消除癌症的症状。在其他实施方案中,“治疗有效量”是足以实现期望的生物学效应的量,例如有
tm1);艾榴素(eleutherobin);水鬼蕉亭(pancratistatin);匍枝珊瑚醇(sarcodictyin);海绵抑制素(spongistatin);氮芥类(nitrogen mustards),如苯丁酸氮芥、萘氮芥(chlornaphazine)、胆磷酰胺(cholophosphamide)、雌氮芥、异环磷酰胺、氮芥(mechlorethamine)、盐酸氧氮芥(mechlorethamine oxide hydrochloride)、美法仑、新恩比兴(novembichin)、苯芥胆甾醇(phenesterine)、泼尼莫司汀、曲磷胺(trofosfamide)、乌拉莫司汀(uracil mustard);亚硝基脲类,如卡莫司汀、氯脲菌素、福莫司汀、洛莫司汀、尼莫司汀(nimustine)和雷莫司汀(ranimnustine);抗生素,如烯二炔类抗生素(enediyne antibiotics)(例如,加里刹霉素(calicheamicin)、尤其是加里刹霉素γ(1,1)和加里刹霉素ω(1,1);达内霉素(dynemicin),包含达内霉素a;二磷酸盐,如氯膦酸盐;埃斯培拉霉素(esperamicin);以及新制癌菌素发色团和相关色蛋白烯二炔抗生素发色团、阿克拉霉素(aclacinomysins)、放线菌素、蒽霉素(authrarnycin)、偶氮丝氨酸(azaserine)、博来霉素、放线菌素c、卡拉比星(carabicin)、卡诺霉素(caminomycin)、嗜癌菌素、色霉素(chromomycinis)、放线菌素d、柔红霉素、地托比星、6-重氮-5-氧代-l-正亮氨酸、阿霉素(包含吗啉代-阿霉素、氰基吗啉代-阿霉素、2-吡咯啉-阿霉素和脱氧阿霉素(deoxydoxorubicin)、表柔比星、依索比星(esorubicin)、伊达比星、麻西罗霉素、丝裂霉素类,如丝裂霉素c、霉酚酸、诺拉霉素、橄榄霉素类(olivomycins)、培洛霉素、泊非霉素(potfiromycin)、嘌呤霉素、三铁阿霉素、罗多比星、链黑菌素、链佐星、杀结核菌素、乌苯美司(ubenimex)、净司他丁(zinostatin)、佐柔比星;抗代谢物,如甲氨蝶呤和5-氟尿嘧啶(5-fu);叶酸类似物,如二甲叶酸、甲氨蝶呤、蝶罗呤、三甲曲沙;嘌呤类似物,如氟达拉滨、6-巯嘌呤、硫咪嘌呤、硫鸟嘌呤;嘧啶类似物,如安西他滨、阿扎胞苷、6-氮尿苷、卡莫氟(carmofur)、阿糖胞苷、二脱氧尿苷(dideoxyuridine)、去氧氟尿苷(doxifluridine)、依诺他滨(enocitabine)、氟尿苷;雄激素类(androgens),如卡鲁睾酮、丙酸屈他雄酮(dromostanolone propionate)、环硫雄醇、美雄烷(mepitiostane)、睾内酯;抗肾上腺素物质(anti-adrenals),如氨鲁米特、米托坦、曲洛司坦;叶酸补充剂(folic acid replenisher),如亚叶酸(frolinic acid);醋葡醛内酯;醛磷酰胺糖苷(aldophosphamide glycoside);氨基乙酰丙酸;恩尿嘧啶;安吖啶;百垂布西(bestrabucil);比生群;依达曲沙(edatraxate);地磷酰胺(defofamine);地美可辛;地吖醌;依氟鸟氨酸(elformithine);依利醋铵(elliptinium acetate);埃坡霉素(epothilone);依托格鲁;硝酸镓;羟基脲;香菇多糖;氯尼达明(lonidainine);美登素类化合物(maytansinoids),如美登素和安丝菌素(ansamitocin);米托胍腙(mitoguazone);米托蒽醌;莫哌达醇(mopidanmol);尼曲吖啶(nitraerine);喷司他丁;蛋氨氮芥;吡柔比星;洛索蒽醌;鬼臼酸;2-乙肼;丙卡巴肼;psk多糖复合物);雷佐生;利索新;西佐喃(sizofuran);锗螺胺(spirogermanium);细交链孢菌酮酸;三亚胺醌;2,2’,2
”‑
三氯三乙胺;单端孢霉烯类(trichothecenes)(尤其是t-2毒素、粘液霉素a(verracurin a)、杆孢菌素a和蛇形菌素(anguidine));氨基甲酸乙酯;长春地辛(vindesine);达卡巴嗪;甘露莫司汀;二溴甘露醇;二溴卫矛醇;哌泊溴烷;加西托新(gacytosine);阿拉伯糖苷(“ara-c”);环磷酰胺;塞替派;紫杉烷类,例如,紫杉醇和多西他赛(doxetaxel);苯丁酸氮芥;吉西他滨;6-硫鸟嘌呤;巯嘌呤;甲氨蝶呤;铂配位络合物,如顺铂、奥沙利铂和卡铂;长春碱;铂;依托泊甙(vp-16);异环磷酰胺;米托蒽醌;长春新碱;长春瑞滨;盐酸米托蒽醌;替尼泊甙;依达曲沙;柔红霉素;氨喋呤;希罗达(xeloda);伊班膦酸
盐(ibandronate);伊立替康(例如,cpt-11);拓扑异构酶抑制剂rfs 2000;二氟甲基鸟氨酸(difluoromethylornithine)(dmfo);类视黄醇(retinoids),如视黄酸;卡培他滨;以及上述中任一种的药学上可接受的盐、酸或衍生物。
[0549]
在一些实施方案中,还向受试者施用免疫治疗剂。免疫疗法是指利用受试者的免疫系统治疗和预防病症的治疗,例如,癌症疫苗、细胞因子、利用靶标特异性抗体、t细胞疗法、和树突状细胞疗法。
[0550]
在一些实施方案中,还向受试者施用免疫调节蛋白。免疫调节蛋白的实例包含(但不限于)b淋巴细胞化学引诱物(“blc”)、c-c基序趋化因子11(“嗜酸性粒细胞趋化因子-1(eotaxin-1)”)、嗜酸粒细胞趋化蛋白2(“嗜酸性粒细胞趋化因子-2(eotaxin-2)”)、粒细胞集落刺激因子(g-csf)、粒-巨噬细胞集落刺激因子(“gm-csf”)、1-309、胞间粘连分子1(“icam-1”)、干扰素γ(“ifn-γ”)、白细胞介素-1α(“il-1α”)、白细胞介素-1β(“il-1β”)、白细胞介素1受体拮抗剂(“il-1ra”)、白细胞介素-2(“il-2”)、白细胞介素-4(“il-4”)、白细胞介素-5(“il-5”)、白细胞介素-6(“il-6”)、白细胞介素-6可溶性受体(“il-6sr”)、白细胞介素-7(“il-7”)、白细胞介素-8(“il-8”)、白细胞介素-10(“il-10”)、白细胞介素-11(“il-11”)、白细胞介素-12β亚基(“il-12p40”或“il-12p70”)、白细胞介素-13(“il-13”)、白细胞介素-15(“il-15”)、白细胞介素-16(“il-16”)、白细胞介素-17(“il-17”)、趋化因子(c-c基序)配体2(“mcp-1”)、巨噬细胞集落剌激因子(“m-csf”)、干扰素γ诱导的单核因子(“mig”)、趋化因子(c-c基序)配体2(“mip-1α”)、趋化因子(c-c基序)配体4(“mip-1β”)、巨噬细胞炎性蛋白-1-δ(“mip-1δ”)、血小板源性生长因子亚基b(“pdgf-bb”)、趋化因子(c-c基序)配体5、调控活化的正常t细胞表达和分泌的因子(“rantes”)、timp金属肽酶抑制剂1(“timp-1”)、timp金属肽酶抑制剂2(“timp-2”)、肿瘤坏死因子淋巴毒素(“tnf”)、肿瘤坏死因子、淋巴毒素-β(“tnfβ”)、可溶性1型tnf受体(“stnfri”)、stnfriiar、脑源性神经营养因子(“bdnf”)、碱性成纤维细胞生长因子(“bfgf”)、骨形态生成蛋白4(“bmp-4”)、骨形态生成蛋白5(“bmp-5”)、骨形态生成蛋白7(“bmp-7”)、神经生长因子(“b-ngf”)、表皮生长因子(“egf”)、表皮生长因子受体(“egfr”)、内分泌腺性血管内皮生长因子(“eg-vegf”)、成纤维细胞生长因子4(“fgf-4”)、角质形成细胞生长因子(“fgf-7”)、生长分化因子15(“gdf-15”)、胶质细胞源性神经营养因子(“gdnf”)、生长激素、肝素结合egf样生长因子(“hb-egf”)、肝细胞生长因子(“hgf”)、胰岛素样生长因子结合蛋白1(“igfbp-1”)、胰岛素样生长因子结合蛋白2(“igfbp-2”)、胰岛素样生长因子结合蛋白3(“igfbp-3”)、胰岛素样生长因子结合蛋白4(“igfbp-4”)、胰岛素样生长因子结合蛋白6(“igfbp-6”)、胰岛素样生长因子1(“igf-1”)、胰岛素、巨噬细胞集落刺激因子(“m-csf r”)、神经生长因子受体(“ngf r”)、神经营养因子-3(“nt-3”)、神经营养因子-4(“nt-4”)、破骨细胞生成抑制因子(“骨保护素(osteoprotegerin)”)、血小板源性生长因子受体(“pdgf-aa”)、磷脂酰肌醇-聚糖生物合成(“pigf”)、skp、滞蛋白(cullin)、含f框的复合物(“scf”)、干细胞因子受体(“scfr”)、转化生长因子α(“tgfα”)、转化生长因子β-1(“tgfβ1”)、转化生长因子β-3(“tgfβ3”)、血管内皮生长因子(“vegf”)、血管内皮生长因子受体2(“vegfr2”)、血管内皮生长因子受体3(“vegfr3”)、vegf-d 6ckine、酪氨酸蛋白激酶受体fifo(“axl”)、细胞素(“btc”)、粘膜相关上皮趋化因子(“ccl28”)、趋化因子(c-c基序)配体27(“ctack”)、趋化因子(c-x-c基序)配体16(“cxcl16”)、c-x-c基序趋化因子5(“ena-78”)、趋化因子(c-c基序)配体26(“嗜酸性粒
细胞趋化因子-3”)、粒细胞趋化蛋白2(“gcp-2”)、gro、趋化因子(c-c基序)配体14(“hcc-l”)、趋化因子(c-c基序)配体16(“hcc-4”)、白细胞介素-9(“il-9”)、白细胞介素-17f(“il-17f”)、白细胞介素-18-结合蛋白(“il-18bpa”)、白细胞介素-28a(“il-28a”)、白细胞介素29(“il-29”)、白细胞介素31(“il-31”)、c-x-c基序趋化因子10(“ip-10”)、趋化因子受体cxcr3(“i-tac”)、白血病抑制因子(“lif”)、轻型趋化因子(c基序)配体(“淋巴细胞趋化因子”)、单核细胞化学诱导物蛋白2(“mcp-2”)、单核细胞化学诱导物蛋白3(“mcp-3”)、单核细胞化学诱导物蛋白4(“mcp-4”)、巨噬细胞源性趋化因子(“mdc”)、巨噬细胞游走抑制因子(“mif”)、趋化因子(c-c基序)配体20(“mip-3α”)、c-c基序趋化因子19(“mip-3β”)、趋化因子(c-c基序)配体23(“mpif-1”)、巨噬细胞刺激蛋白α链(“mspα”)、核小体组装蛋白1样4(“nap-2”)、分泌性磷蛋白1(“骨桥蛋白”)、肺部活化调控细胞因子(“parc”)、血小板因子4(“pf4”)、基质细胞源性因子-1α(“sdf-1α”)、趋化因子(c-c基序)配体17(“tarc”)、胸腺表达趋化因子(“teck”)、胸腺基质淋巴细胞生成素(“tslp4-ibb”)、cd 166抗原(“alcam”)、分化群80(“b7-1”)、肿瘤坏死因子受体超家族成员17(“bcma”)、分化群14(“cd14”)、分化群30(“cd30”)、分化群40(“cd40配体”)、癌胚抗原相关细胞粘连分子1(胆汁糖蛋白)(“ceacam-1”)、死亡受体6(“dr6”)、脱氧胸苷激酶(“dtk”)、1型膜糖蛋白(“内皮素”)、受体酪氨酸蛋白激酶erbb-3(“erbb3”)、内皮细胞白细胞粘连分子1(“e-选择素”)、凋亡抗原1(“fas”)、fms样酪氨酸激酶3(“flt-3l”)、肿瘤坏死因子受体超家族成员1(“gitr”)、肿瘤坏死因子受体超家族成员14(“hvem”)、胞间粘连分子3(“icam-3”)、il-1r4、il-1ri、il-10rβ、il-17r、il-2rγ、il-21r、溶酶体膜蛋白2(“limpii”)、中性粒细胞明胶酶相关脂质运载蛋白(“脂质运载蛋白-2”)、cd62l(“l-选择素”)、淋巴管内皮细胞(“lyve-1”)、i类mhc多肽相关序列a(“mica”)、i类mhc多肽相关序列b(“micb”)、nrgl-βl、β型血小板源性生长因子受体(“pdgf rβ”)、血小板内皮细胞粘连分子(“pecam-1”)、rage、甲型肝炎病毒细胞受体1(“tim-1”)、肿瘤坏死因子受体超家族成员ioc(“trail r3”)、trappin蛋白转谷氨酰胺酶结合域(“trappin-2”)、尿激酶受体(“upar”)、血管细胞粘连蛋白1(“vcam-1”)、xedar、激活素a、刺鼠相关蛋白(“agrp”)、核糖核酸酶5(“血管生长素”)、血管生成素1、血管抑素、组织蛋白酶s、cd40、隐藏家族蛋白ib(“cripto-1”)、dan、dickkopf相关蛋白1(“dkk-1”)、e-钙粘连素、上皮细胞粘连分子(“epcam”)、fas配体(fasl或cd95l)、fcg riib/c、fouistatin、半乳凝素-7、胞间粘连分子2(“icam-2”)、il-13rl、il-13r2、il-17b、il-2ra、il-2rb、il-23、lap、神经元细胞粘连分子(“nrcam”)、纤溶酶原激活物抑制剂-1(“pai-1”)、血小板源性生长因子受体(“pdgf-ab”)、抵抗素、基质细胞衍生因子1(“sdf-1β”)、sgpl30、分泌型卷曲相关蛋白2(“shhn”)、唾液酸结合性免疫球蛋白样凝集素(“siglec-5”)、st2、转化生长因子-β2(“tgfβ2”)、tie-2、血小板生成素(“tpo”)、肿瘤坏死因子受体超家族成员10d(“trail r4”)、骨髓细胞上表达的触发受体1(“trem-1”)、血管内皮生长因子c(“vegf-c”)、vegfrl、脂联素、降脂蛋白(“and”)、甲胎蛋白(“afp”)、血管生成素样4(“angptl4”)、β-2-微球蛋白(“b2m”)、基底细胞粘连分子(“bcam”)、糖抗原125(“ca125”)、癌抗原15-3(“ca15-3”)、癌胚抗原(“cea”)、camp受体蛋白(“crp”)、人表皮生长因子受体2(“erbb2”)、卵泡抑素、促卵泡激素(“fsh”)、趋化因子(c-x-c基序)配体1(“groα”)、人绒毛膜促性腺激素(“βhcg”)、胰岛素样生长因子1受体(“igf-1sr”)、il-1srii、il-3、il-18rβ、il-21、瘦素、基质金属蛋白酶-1(“mmp-1”)、基质金属蛋白酶-2(“mmp-2”)、基质金属蛋白酶-3(“mmp-3”)、基质金属蛋白
酶-8(“mmp-8”)、基质金属蛋白酶-9(“mmp-9”)、基质金属蛋白酶-10(“mmp-10”)、基质金属蛋白酶-13(“mmp-13”)、神经细胞粘连分子(“ncam-1”)、巢蛋白(entactin)(“巢蛋白-1(nidogen-1)”)、神经元特异性烯醇酶(“nse”)、制瘤素m(“osm”)、降钙素原、催乳素、前列腺特异性抗原(“psa”)、唾液酸结合性免疫球蛋白样凝集素9(“siglec-9”)、adam 17肽链内切酶(“tace”)、甲状腺球蛋白、金属蛋白酶抑制剂4(“timp-4”)、tsh2b4、含解聚素和金属蛋白酶的蛋白质9(“adam-9”)、血管生成素2、肿瘤坏死因子配体超家族成员13、酸性富亮氨酸核磷蛋白32家族成员b(“april”)、骨形态生成蛋白2(“bmp-2”)、骨形态生成蛋白9(“bmp-9”)、补体成分5a(“c5a”)、组织蛋白酶l、cd200、cd97、趋化素、肿瘤坏死因子受体超家族成员6b(“dcr3”)、脂肪酸结合蛋白2(“fabp2”)、成纤维细胞活化蛋白α(“fap”)、成纤维细胞生长因子19(“fgf-19”)、半乳凝素-3、肝细胞生长因子受体(“hgfr”)、ifn-α/βr2、胰岛素样生长因子2(“igf-2”)、胰岛素样生长因子2受体(“igf-2r”)、白细胞介素-1受体6(“il-1r6”)、白细胞介素24(“il-24”)、白细胞介素33(“il-33”)、激肽释放酶14、天冬酰胺酰肽链内切酶(“legumain”)、氧化型低密度脂蛋白受体1(“lox-1”)、甘露糖结合凝集素(“mbl”)、脑啡肽酶(“nep”)、易位相关notch同源物1(果蝇(drosophila))(“notch-1”)、肾母细胞瘤过度表达(“nov”)、骨激活素(osteoactivin)、程序性细胞死亡蛋白1(“pd-1”)、n-乙酰胞壁酰-l-丙氨酸酰胺酶(“pgrp-5”)、丝氨酸蛋白酶抑制剂a4、分泌型卷曲相关蛋白3(“sfrp-3”)、血栓调节蛋白、toll样受体2(“tlr2”)、肿瘤坏死因子受体超家族成员10a(“trail rl”)、转铁蛋白(“trf”)、wif-lace-2、白蛋白、amica、血管生成素4、b-细胞活化因子(“baff”)、糖抗原19-9(“ca19-9”)、cd 163、丛生蛋白、crt am、趋化因子(c-x-c基序)配体14(“cxcl14”)、胱抑素c、饰胶蛋白(“dcn”)、dickkopf相关蛋白3(“dkk-3”)、δ样蛋白1(“dll1”)、胎球蛋白a、肝素结合生长因子1(“afgf”)、叶酸受体α(“folr1”)、弗林蛋白酶、gpcr相关分拣蛋白1(“gasp-1”)、gpcr相关分拣蛋白2(“gasp-2”)、粒细胞集落刺激因子受体(“gcsfr”)、丝氨酸蛋白酶hepsin(“hai-2”)、白细胞介素-17b受体(“il-17b r”)、白细胞介素27(“il-27”)、淋巴细胞活化基因3(“lag-3”)、载脂蛋白a-v(“ldl r”)、胃蛋白酶原i、视黄醇结合蛋白4(“rbp4”)、sost、硫酸类肝素蛋白多糖(“syndecan-1”)、肿瘤坏死因子受体超家族成员13b(“taci”)、组织因子通道抑制剂(“tfpi”)、tsp-1、肿瘤坏死因子受体超家族成员10b(“trail r2”)、trance、肌钙蛋白i、尿激酶纤维蛋白溶酶原激活剂(“upa”)、钙粘连素5、2型或ve-钙粘连素(血管内皮细胞)也称为cd144(“ve-钙粘连素”)、wntl诱导的信号通路蛋白1(“wisp-1”)、以及核因子κb受体活化因子(“rank”)。
[0551]
在一些实施方案中,还向受试者施用免疫检查点抑制剂。免疫检查点抑制广义上是指抑制癌细胞产生的妨碍或下调免疫应答的检查点。免疫检查点蛋白的示例包括但不限于ctla4、pd-1、pd-l1、pd-l2、a2ar、b7-h3、b7-h4、btla、kir、lag3、tim-3或vista。免疫检查点抑制剂可以是结合并抑制免疫检查点蛋白的抗体或其抗原结合片段。免疫检查点抑制剂的示例包括但不限于纳武单抗、派姆单抗、匹立单抗(pidilizumab)、amp-224、amp-514、sti-a1110、tsr-042、rg-7446、bms-936559、medi-4736、msb-0020718c、aur-012和sti-a1010。
[0552]
在一些实施方案中,预防性地施用本文提供的组合物(例如本文提供的疫苗组合物)以预防癌症和/或cmv感染。在一些实施方案中,施用疫苗以抑制肿瘤细胞扩增。可以在检测患者的癌细胞或cmv感染的细胞之前或之后施用疫苗。抑制肿瘤细胞扩增被理解为是
指预防、停止、减慢肿瘤细胞的生长或杀死肿瘤细胞。在一些实施方案中,在施用包含本文所述的肽、核酸、抗体或apc的疫苗后,诱导了促炎反应。促炎性免疫反应包括促炎性细胞因子和/或趋化因子的产生,例如ifn-γ和/或il-2。促炎性细胞因子和趋化因子是本领域众所周知的。
[0553]
联合疗法包括相继、同时和分别和/或以下述方式共同施用活性化合物,即在施用后续治疗时,所施用的第一试剂的治疗效果并未完全消失。在一些实施方案中,第二试剂可以与第一试剂共同配制或配制成单独的药物组合物。
[0554]“施用”或“施用”是指将本文公开的分离的epha3结合剂、car、编码核酸、遗传构建体、细胞或组合物通过特定的选择途径引入动物受试者。
[0555]
epha3结合剂、car或其变体、或编码核酸、或遗传构建体、或细胞、或包含其的组合物的施用可以通过任何已知的肠胃外、局部或肠内途径,包括静脉内、肌肉内、腹膜内、颅内、经皮、口服、鼻内、肛门和眼内,但不限于此。
[0556]
剂型包括片剂、分散剂、悬浮剂、注射剂、溶液剂、糖浆剂、锭剂、胶囊剂、栓剂、气雾剂、透皮贴剂等。这些剂型还可以包括专门为此目的设计的注射或植入控释装置或经修改的其他形式的植入物,以额外地以这种方式起作用。治疗剂的控释可以通过例如用疏水聚合物包被所述治疗剂来实现,所述疏水聚合物包括丙烯酸树脂、蜡、高级脂肪醇、聚乳酸和聚乙醇酸以及某些纤维素衍生物例如羟丙基甲基纤维素。此外,可以通过使用其他聚合物基质、脂质体和/或微球来实现控释。
[0557]
适用于口服或肠胃外施用的本发明组合物可以呈离散单元形式,例如胶囊、小袋或片剂,每种都含有预定量的一种或多种本发明的治疗剂,作为粉末或颗粒或溶液或在水性液体、非水性液体、水包油乳液或油包水液体乳液中的悬浮液。此类组合物可以通过任何药学方法制备,但所有方法都包括使一种或多种如上所述的药剂与由一种或多种必需成分组成的载体结合的步骤。通常,通过将本发明的药剂与液体载体或细分的固体载体或两者均匀且紧密地混合,然后,如果需要,将产品成型为期望的外观来制备组合物。
[0558]
在另一个相关方面,本发明在于本文所述的epha3结合剂、本文所述的car、本文所述的分离的核酸、本文所述的遗传构建体和/或本文所述的宿主细胞在制备用于预防和/或治疗受试者的癌症的药物中的用途。
[0559]
在一个实施方案中,癌症是或包括多形性胶质母细胞瘤。
[0560]
标记和缀合物
[0561]
在又一方面,本发明提供了一种检测epha3或表达epha3的细胞的方法,所述方法包括使epha3结合分子或前述car与epha3之间形成复合物的步骤,从而检测epha3或表达epha3的细胞。
[0562]
在一个实施方案中,所述方法包括使epha3或表达epha3的细胞与epha3抗原结合分子或上文或本文其他地方所述的car接触的初始步骤。
[0563]
因此,在一些实施方案中,本发明的抗原结合分子另外包含可检测部分。
[0564]
在某些实施方案中,细胞是或包含癌细胞。
[0565]
因此应当理解,本文公开的epha3结合剂或car可用于辅助癌症的医学诊断。合适地,所述方法包括检测epha3,例如检测存在于生物样品中或从生物样品中获得的癌细胞表达的epha3。在某些实施方案中,生物样品可以是病理样品,其包含一种或多种从人获得的
流体、细胞、组织、器官或器官样品。非限制性示例包括血液、血浆、唾液、血清、淋巴细胞、尿液、粪便、羊水、宫颈样品、脑脊液、组织活检、骨髓和皮肤,但不限于此。
[0566]
在一些实施方案中,抗原结合分子包含可检测部分。例如,epha3抗原结合分子和/或car用荧光标记、磷光标记、发光标记、免疫可检测标记(例如,表位标签)、放射性标记、化学标记、核酸或酶标记进行标记。抗原结合分子可以用可检测部分共价或非共价标记。
[0567]
荧光标记包括例如荧光素、罗丹明、别藻蓝蛋白、曙红和ndb、绿色荧光蛋白(gfp)、稀土螯合物(例如铕(eu)、铽(tb)和钐(sm))、四甲基罗丹明、德克萨斯红、4-甲基伞形酮、7-氨基-4-甲基香豆素、cy3和cy5。
[0568]
放射性标记包括放射性同位素,例如碘
123
、碘
125
、碘
126
、碘
131
、碘
133
、溴
77
、锝
99m
、铟
111
、铟
113m
、镓
67
、镓
68
、钌
95
、钌
103
、钌
105
、汞
207
、汞
203
、铼
99m
、铼
101
、铼
105
、钪
47
、碲
121m
、碲
122m
、碲
125
、铥
165
、铥
167
、铥
16
、铜
67
、氟
18
、钇
90
、钯
100
、铋
217
和锑
211
。
[0569]
发光标记包括放射发光、化学发光(例如吖啶酯、鲁米诺、异鲁米诺)和生物发光标记。免疫可检测标记包括半抗原、肽/多肽、抗体、受体和配体,例如生物素、抗生物素蛋白、链霉亲和素或地高辛。核酸标记包括适体。酶标记包括例如过氧化物酶、碱性磷酸酶、葡萄糖氧化酶、β-半乳糖苷酶和萤光素酶。
[0570]
在一些实施方案中,本发明的抗原结合分子与化学部分缀合。化学部分可以是用于提供治疗效果的部分。抗体-药物缀合物在例如parslow等人biomedicines.2016sep;4(3):14中进行了综述。在一些实施方案中,化学部分可以是药物部分(例如,细胞毒性剂)。在一些实施方案中,药物部分可以是化疗剂。
[0571]
标记可以选自包括生物素、抗生物素蛋白、地高辛、酶(例如,碱性磷酸酶或辣根过氧化物酶)、荧光团(例如,fitc、德克萨斯红、香豆素)、放射性同位素(例如,
125
i、
131
i、
67
ga、
111
in)和/或直接视觉标记(例如,金颗粒),但不限于此。
[0572]
适当地,epha3的检测包括在epha3结合剂或car与epha3或表达epha3的细胞之间形成可检测复合物的步骤。如此形成的复合物可以通过本领域已知的任何技术、测定法或手段检测,包括免疫印迹、免疫组织化学、免疫细胞化学、免疫沉淀、elisa、流式细胞术、磁珠分离、基于生物传感器的检测系统,例如表面等离子共振和成像,例如pet成像,但不限于此。
[0573]
为了便于检测,可以如上文所述直接标记epha3结合剂或car,或者可以使用标记的二抗。标记可以如上文所述。
[0574]
在一些实施方案中,可以提供检测试剂盒,其包含本文公开的抗体或抗体片段以及一种或多种检测试剂,例如酶、酶底物(例如,luminol、amppd、nbt)、二抗和/或磁珠,但不限于此。
[0575]
在另一个方面,本发明提供了一种分离的蛋白质,其包含、基本上由或由seq id no:13至156和/或表4-7中任一者所示的氨基酸序列、或与所述氨基酸序列至少70%同一性的氨基酸序列组成。
[0576]
在最后一方面,本发明提供了一种分离的核酸,其包含、由或基本上由seq id no:1-12和/或表3中任一者所示的核酸序列、或与其至少70%同一性的核酸序列组成。
[0577]
就上述方面而言,术语“受试者”包括但不限于哺乳动物,包括人、表演动物(如马、骆驼、灰狗)、家畜(如牛、羊、马)和伴侣动物(如猫和狗)。在一些实施方案中,受试者是人。
[0578]
为了可以详细地描述优选实施方案并付诸实践,参照以下非限制性实施例。
[0579]
实施例
[0580]
实施例1
[0581]
基本原理
[0582]
使用表达嵌合抗原受体(car)的基因修饰的t细胞的过继性免疫疗法在治疗血癌方面取得了实质性成功4。尽管有这些突破,但car t细胞在治疗实体瘤方面的成功仍然有限。
[0583]
car利用任何抗体或受体配体的肿瘤靶向特异性来重定向t细胞的溶细胞效力。治疗价值在于结合区的定制工程化,以靶向特定的癌症生物标志物或标志物的组合,以实现靶向肿瘤和低的脱靶活性。在gbm和许多其他癌症中,epha3已被鉴定为治疗靶点6。epha3在癌症中过度表达并且与肿瘤生长、侵袭和转移相关
6-9
。epha3似乎在维持肿瘤细胞处于较低分化状态和促进癌症干细胞(csc)的自我更新方面至关重要。因此,靶向抑制epha3是治疗实体癌的一种有前途的治疗方法,并且通过靶向csc,可能对异质性、转移性或被认为对治疗具有抗性的癌症有效。
[0584]
epha3靶向治疗性抗体目前正在复发性胶质母细胞瘤患者中进行临床评估,耐受良好,并在特定癌症群组中显示出有希望的临床活性(10)。然而,鉴于在实现和维持抑制剂的药理学水平方面的挑战,特别是在大脑中(11),本实施例研究了一种使用car t细胞的方法,其可能超越传统策略并在大脑中递送靶向的抗肿瘤反应。
[0585]
设计
[0586]
epha3单克隆抗体
[0587]
人epha3(p29320,21
–
541aa)的胞外结构域序列经设计、优化、合成,并亚克隆到pcdna3.4载体中。制备了大的(maxi)转染级质粒,用于expi293细胞表达。克隆策略如图1所示。
[0588]
在轨道振动台上、在锥形瓶中、在37℃、8%co2下、在无血清expi293
tm
表达培养基中生长expi293f细胞。在转染当天,将dna和转染试剂以最佳比例混合,然后加入烧瓶中。第6天收集细胞培养上清液并加载到亲和纯化柱上进行纯化。在用适当的缓冲液洗涤和洗脱后,将洗脱的级分合并并将缓冲液交换为最终的制剂缓冲液。通过sds-page和蛋白质印迹分析纯化的蛋白质的分子量和纯度测量(图2)。通过bca
tm
测定法测定浓度,其中bsa作为标准,获得纯度约为95%的1.77mg/ml蛋白,并在-80℃下以多个等分试样储存以避免多次冻融。
[0589]
按照下表中所示的免疫方案,用重组人epha3蛋白对三只balb/c和三只c57小鼠进行免疫。
[0590]
表2
[0591]
epha3(p29320|21
–
541)的免疫计划
[0592][0593][0594]
sc-皮下
[0595]
通过电融合对每组动物进行细胞融合和克隆铺板。将来自每个融合的所有融合细胞铺板到96孔板中,并通过elisa用epha3蛋白进行条件培养基筛选。通过elisa证实阳性上清液对无关的his标签蛋白呈阴性。基于epha3的特异性,选择五个亲本杂交瘤克隆进行亚克隆。筛选10个单克隆亚克隆上清液与重组epha3(在elisa中)或表达epha3的白血病细胞系lk63(通过流式细胞仪)的结合效率(图3和4)。选择杂交瘤3c3-1和2d4-1进行测序,排除结合效率较低的克隆(如6c9-1)。
[0596]
对于测序,使用试剂从3c3-1和2d4-1杂交瘤细胞中分离总rna。然后使用同种型特异性反义引物或通用引物、使用primescripttm第一链cdna合成试剂盒将总rna逆转录为cdna。通过cdna末端快速扩增(race)扩增重链和轻链的抗体片段。将扩增的抗体片段分别克隆到标准克隆载体中。进行克隆pcr以筛选表3中列出的具有正确大小的插入和共有序列的克隆。
[0597]
表3
[0598]
互补决定区核酸序列
[0599][0600][0601]
3c3-1和2d4-1的互补决定区(cdr)-1列于表4-7中。
[0602]
我们已经生成了各种epha3特异的高亲和力互补决定区(cdr)。这些独特的序列形成epha3特异性结合结构域,可用于生成单链可变片段(scfv),以使用car t细胞技术以靶向epha3或epha3为靶标的其他应用。
[0603]
表4
[0604]
克隆3c3-1重链cdr1、2和3氨基酸序列
[0605][0606][0607]
hfr=重链框架区
[0608]
表5
[0609]
克隆3c3-1轻链cdr1、2和3氨基酸序列。
[0610]
[0611][0612][0613]
lfr=轻链框架区
[0614]
表6
[0615]
克隆2d4-1重链cdr1、2和3氨基酸序列。
[0616][0617][0618]
表7
[0619]
克隆2d4-1轻链cdr1、2和3氨基酸序列。
[0620][0621][0622]
结果
[0623]
胶质瘤细胞系上的epha3
[0624]
克隆3c3-1用于筛选胶质瘤细胞系的epha3表达(图5)。u87细胞为阴性,但d270细胞表达一定比例的epha3阳性和阴性肿瘤细胞。u251细胞多为epha3阳性。这些肿瘤细胞系对于测试异质肿瘤(d270)的免疫治疗方法很有价值,但也可以评估epha3表达升高的特别侵袭性的gbm(u251)。
[0625]
epha3-car t细胞
[0626]
单链可变片段(scfv)由重链可变区(vh)和轻链可变区(v
l
)通过柔性肽接头连接在一起组成。比较了克隆3c3-1和2d4-1的scfv序列,同一性比对《48%,这意味着这些是不同的序列。这些scfv序列用于生成慢病毒表达质粒,以创建我们的第二代car构建体。简而言之,我们将抗epha3 scfv的各个编码序列与铰链区、cd8跨膜区和人4-1bb或cd28的胞质区
与cd3-ζ连接起来(图6)。将序列亚克隆到pd2109(慢病毒骨架质粒-atum)中以生成慢病毒表达质粒。通过转染hek293t人胚胎肾细胞产生慢病毒颗粒。使用lipofectamine 2000用表达质粒(fa301或fa302)和pmdl、prev和pvsv-g质粒转染细胞。使用pd2109作为对照。通过rt-pcr确认293t细胞中car序列的表达(图7)。在转染后48和72小时收集病毒上清液。
[0627]
表8
[0628]
用于生成car的结构域和序列。从如第2.1节所述的单克隆抗体中测序克隆3c3-1和2d4-1的可变区(vh和v
l
)。从在线数据库中提取或由提供其他序列。
[0629]
[0630][0631]
在jurkat细胞系中表达epha3-car
[0632]
jurkat细胞是一种永生化的人t细胞系,这些细胞用于测定含有慢病毒的上清液的滴度。由于car构建体与ires_rfp串联,因此表面上rfp的表达被用作转导的报告子。因此,通过转导jurkat细胞并定量rfp表达来确定转导效率。范围为32至58%的转导效率(在1x 106个细胞中)产生的滴度范围为3.2至5.8x 105iu/ml。对照pd2109_gfp慢病毒滴度为8x 104iu/ml(图8)。
[0633]
car和rfp序列均以用于表面膜表达的cd8前导序列为首。尽管如此,为了确认car的表面表达和与靶标的结合,将细胞与epha3-his蛋白一起孵育并用αhis-tag ab染色。facs结果显示epha3-car在表面表达,并在高表达rfp的细胞中主要结合epha3(图9)。
[0634]
d69是t细胞中的早期激活标志物,参与增殖和信号转导。我们使用cd69作为epha3特异性激活jurkat-car细胞的标志物。尽管在rfp阴性jurkat细胞中cd69以高水平表达,但结果表明通过与膜结合的epha3相互作用(图10)或通过与lk63细胞(epha3阳性肿瘤细胞系)孵育(图11)在表达car构建体的细胞(rfp阳性细胞)中发生适度的激活。尽管仅观察到cd69表达的适度增加,但jurkat-car中激活标志物的表达是car功能的有希望的指标。因此,推测在这些细胞中发生低水平激活,因为用于转导的感染复数(moi)较低,导致每个细胞的整合数较低(可能只有1个)。我们将在未来通过浓缩慢病毒以增加转导的moi来解决这个问题。
[0635]
用于产生epha3-car的pbmc源t细胞
[0636]
在静脉取血后24小时内通过密度梯度离心从外周血中收集pbmc。移出、洗涤和计数pbmc级分。通过用t细胞transact
tm
刺激cd3和cd28,激活和扩增以产生多克隆t细胞。使用先前描述的方案
10,11
从pbmc扩增cmv特异性t细胞。简而言之,三分之一的pbmc与来自多个cmv抗原的26个t细胞肽表位的定制池孵育一小时,洗涤然后与剩余的pbmc混合,然后以2至5x 106细胞/cm2的密度接种在烧瓶中。
[0637]
在刺激后第2天使用pd2109(gfp报告子)和fa301(rfp报告子)慢病毒转导细胞。细胞在含有重组il-2的培养基中培养,每2-3天添加一次il-2。转导后第3天的facs显示两种慢病毒的转导效率低(图12)。
[0638]
结论
[0639]
我们已经成功地生成了epha3特异性单克隆抗体,这些抗体被用作car慢病毒构建体中的scfv。jurkat-epha3-car在表面表达嵌合蛋白,在识别epha3后,上调早期激活标志物。我们进一步证明了用eph-a3-car转导jurkat细胞和cmv特异性t细胞是可能的。
[0640]
实施例2
[0641]
从构建体中去除ires和rfp报告序列以减小插入的大小,目的是提高病毒滴度和t细胞转导效率。如前所述,这些较小的构建体fa3-05-bbζ和fa3-06-28ζ用于产生如前所述慢病毒,包括10,500rpm(sw 32ti转子)的超速离心步骤,在4℃下4小时。并且如前所述培养多克隆t细胞,在第2天转导。通过用抗小鼠igg af546进行表面染色,并通过流式细胞术分析细胞,检测表达car的t细胞。car转导效率在第12天仍然很低。分选car+表达的细胞,并培养至第20天(图13a)。
[0642]
我们接下来评估了这些fa3-car的体外功能。用epha3+肿瘤细胞系lk63刺激转导的t细胞过夜。使用标准的细胞内染色方案,我们建立了epha3-car t细胞,有4-1bb(fa305)或cd28(fa306)共刺激,进行可比较的靶标诱导的tnf细胞因子分泌、t细胞激活和免疫调节分子(图13b)。
[0643]
通过使用来自biosettia的定制plv-ef1a表达质粒骨架,进一步减小了fa3-06-28ζ构建体的大小。随后的研究是使用用该质粒产生的慢病毒转导的t细胞进行的,被称为car epha3 t细胞。
[0644]
car epha3慢病毒用于转导多克隆t细胞(抗cd3/28
+
刺激的t细胞)和cmv特异性t细胞。如前所述测定car表达,并通过使用cmv的hla复合物-肽四聚体的facs分析测定cmv-car特异性(图14)。如前所述测定epha3-car的体外功能。用lk63细胞刺激转导的t细胞过夜。使用标准的细胞内染色方案,我们确定epha3-car t细胞进行靶标诱导的tnf细胞因子分泌。刺激后,由cmv-pepmix产生的car t细胞表达多种效应分子,包括tnf、ifnγ和cd107a,表明这些细胞具有更大的杀伤潜力(图15)。为了评估epha3-car的特异性和杀伤能力,我们使用xcelligence进行了实时细胞毒性测定法(rtca)。该测定法在100小时期间内测量靶细胞杀伤。具有内源性epha3表达的胶质瘤细胞系u251用作阳性靶标,而epha3阴性胶质瘤细胞u87用作阴性对照。day及其同事先前的研究表明,在原位gbm模型中u251epha3+神经胶质细胞系对抗epha3(克隆iiia4)抗体响应,验证了这些细胞作为靶标
16
。在rtca测定法中,靶细胞与epha3-car t细胞的孵育在处理100小时内诱导了80%的细胞溶解,并且未观察到epha3阴性胶质瘤细胞的杀伤(图16a)。在1:1、5:1和10:1的效应物与靶标的比率下,
通过rtca观察到epha3car对靶细胞的杀伤(图16b)。为了比较epha3-cmv car t细胞与epha3car的杀伤潜力,我们使用t细胞:靶标u251比率1:1、5:1和10:1进行rtca,并观察到靶细胞的有效杀伤,特别是在10:1时使用epha3-cmv car t细胞更明显(图16c)。
[0645]
实施例3
[0646]
epha3-car t细胞表现出强大的体内抗肿瘤作用
[0647]
在表明car epha3 t细胞具有显著的体外针对神经胶质细胞系的细胞毒性后,我们接下来评估了它们在体内的治疗潜力。
[0648]
免疫缺陷的nod.rag1ko.il2rγcko(nrg)小鼠在侧腹皮下移植了表达荧光素酶的胶质瘤细胞系u251(epha3+)或u87(epha3-)(异位模型)(图17a)。通过生物发光测量或确定肿瘤大小。在第10天,肿瘤已达到约25mm2,因此小鼠接受了两次静脉注射细胞中的第一次;epha3-car、nt(非转导)或car19(非特异性car t细胞)t细胞。在第17天检测到循环hcd45,主要是cd4
+
car t细胞(图17b)。此外,在接受epha3-car t细胞的携带u251的小鼠中观察到ki67的表达增加,这表明在该治疗组中靶标诱导了这些car t细胞的增殖(图17c)。
[0649]
引人注目的是,car epha3 t细胞治疗在移植u251(epha3+)肿瘤的小鼠中诱导了完全反应,并在第30天完全清除了肿瘤(图d和f)。接受非转导(nt)或非特异性t细胞(car19 t细胞)的小鼠和携带u87(epha3-)的小鼠不能控制肿瘤生长(图17d
–
g)。
[0650]
结论
[0651]
这些数据清楚地表明这些car t细胞靶向epha3并介导有效的抗肿瘤活性。用epha3 car t细胞的治疗导致在异位移植的gbm肿瘤模型中肿瘤的消退。这些数据支持epha3 car t细胞作为癌症(例如gbm)新疗法的用途。
[0652]
参照文献
[0653]
1.doubrovina,e.et al.adoptive immunotherapy with unselected or ebv-specific t cells for biopsy-proven ebv+lymphomas after allogeneic hematopoietic cell transplantation.blood 119,2644
–
2656(2012)。
[0654]
2.barrett,d.m.,grupp,s.a.&june,c.h.chimeric antigen receptor-and tcr-modified t cells enter main street and wall street.j.immunol.195,755
–
61(2015)。
[0655]
3.day,b.w.et al.epha3 maintains tumorigenicity and is a therapeutic target in glioblastoma multiforme.cancer cell 23,238
–
248(2013)。
[0656]
4.tang,x.x.et al.implications of ephb6,efnb2,and efnb3expressions in human neuroblastoma.proc.natl.acad.sci.(2000)doi:10.1073/pnas.190123297。
[0657]
5.xi,h.q.,wu,x.s.,wei,b.&chen,l.eph receptors and ephrins as targets for cancer therapy.j.cell.mol.med.16,2894
–
2909(2012)。
[0658]
6.wykosky,j.,gibo,d.m.&debinski,w.a novel,potent,and specific ephrina1-based cytotoxin against epha2 receptor expressing tumor cells.mol.cancer ther.(2007)doi:10.1158/1535-7163.mct-07-0200。
[0659]
7.swords,r.t.et al.kb004,a novel non-fucosylatedantibody,targeting epha3,is active and well tolerated in a phase i/ii study of advanced hematologic malignancies.blood 124,(2014)。
[0660]
8.razpotnik,r.,novak,n.,v.&rajcevic,u.targeting malignant brain tumors with antibodies.front.immunol.8,1181(2017)。
[0661]
9.charmsaz,s.et al.epha3 as a target for antibody immunotherapy in acute lymphoblastic leukemia.leukemia 31,1779
–
1787(2017)。
[0662]
10.smith,c.et al.autologous adoptive t-cell therapy for recurrent or drug-resistant cytomegalovirus complications in solid organ transplant recipients:a single-arm open-label phase i clinical trial.clin.infect.dis.68,632
–
640(2019)。
[0663]
11.smith,c.et al.autologous cmv-specific t cells are a safe adjuvant immunotherapy for primary glioblastoma multiforme.j.clin.invest.(2020)doi:10.1172/jci138649。
[0664]
12.day,b.w.et al.epha3 maintains tumorigenicity and is a therapeutic target in glioblastoma multiforme.cancer cell 23,238
–
248(2013)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1