一种针对SARS-CoV-2病毒的中和性抗体的制作方法
一种针对sars-cov-2病毒的中和性抗体
技术领域
1.本发明属于生物技术或医药领域,具体涉及一种抗sars-cov-2病毒中和性单克隆抗体的制备和应用。
背景技术:
2.在急性传染病中,绝大部分都是病毒性传染病,病毒性传染病的发病率高,死亡率也很高。由于检测和诊断手段有限,导致新病毒引发的新疫情爆发往往具有突发性、随机性和不可预测性等特点,一旦爆发,如无有效的防治手段,极易造成大规模流行,严重威胁人民健康生命安全。
3.sars-cov-2病毒入侵宿主细胞的关键步骤之一是其结构蛋白spike的rbd区域与宿主细胞膜表面受体血管紧张素转化酶2(ace2)结合实现,形成ace2-rbd复合物。早在2020年2月,周强团队已通过冷冻电镜的方法解析了spike蛋白的蛋白质结构。wrapp团队更指出sars-cov-2s蛋白结合宿主细胞ace2受体的亲和力比sars-cov高10倍以上。基于这些研究,设计靶向s蛋白的单抗,通过竞争性抑制s蛋白与受体结合,可以阻断病毒与宿主融合,进而抑制病毒感染宿主细胞,由此预防新冠感染或治疗已感染患者。抗体类药物将很有可能成为一种新的新冠治疗方案。
4.在全球范围内,抗体药物研发早已成为研究热点,其中绝大部分以s蛋白为药物靶点。目前,至少有26个国家超过200家机构参与抗体药物研发。截至2020年11月6日,在covid-19antibody therapeutics tracker上可搜索到全球范围内针对s蛋白设计抗体、多肽或重组蛋白研发方案共105种(大部分为单抗),其中临床一期10项(js016、ty027、ct-p59、brii-196、brii-198、scta01、mw33、sti-1499/covi-shield、sab-185、igy-110/anti-sars-cov-2igy),二期2项(dxp-593、apn01),三期4项(regn-cov2、ly3819253、vir-7831、azd7442)。
5.然而,目前暂无针对s蛋白的中和抗体被批准上市,而全球抗体疗法研究中也只有两款:俄罗斯联邦卫生部今年6月批准了levil imab(bcd-089,商品名ilsira)和印度批在7月批准的itolizumab(eq001,h-t1,t1-h),都用于控制细胞因子风暴以减少新冠重症患者死亡率
6.目前,国内已批准的抗病毒药物均有着一定程度的毒副作用,需要在医师监管下使用。恢复期血浆疗法作为目前已被批准的新冠疗法之一,虽然可以一定程度上用来对抗病毒感染,但是血浆来源不一,成分相对复杂不良反应较多,安全性和有效性无法得到保证。但是恢复性血浆的成功应用依然暗示着中和性单克隆抗体可以用于治疗新冠病毒感染。
7.综上所述,本领域迫切需要开发针对sars-cov-2冠状病毒有效诊断和治疗方法,以用于诊断和治疗新型冠状病毒感染引起的肺炎。
技术实现要素:
8.本发明的目的就是提供一种针对sars-cov-2冠状病毒有效诊断和治疗方法,以用于诊断和治疗新型冠状病毒感染引起的肺炎。
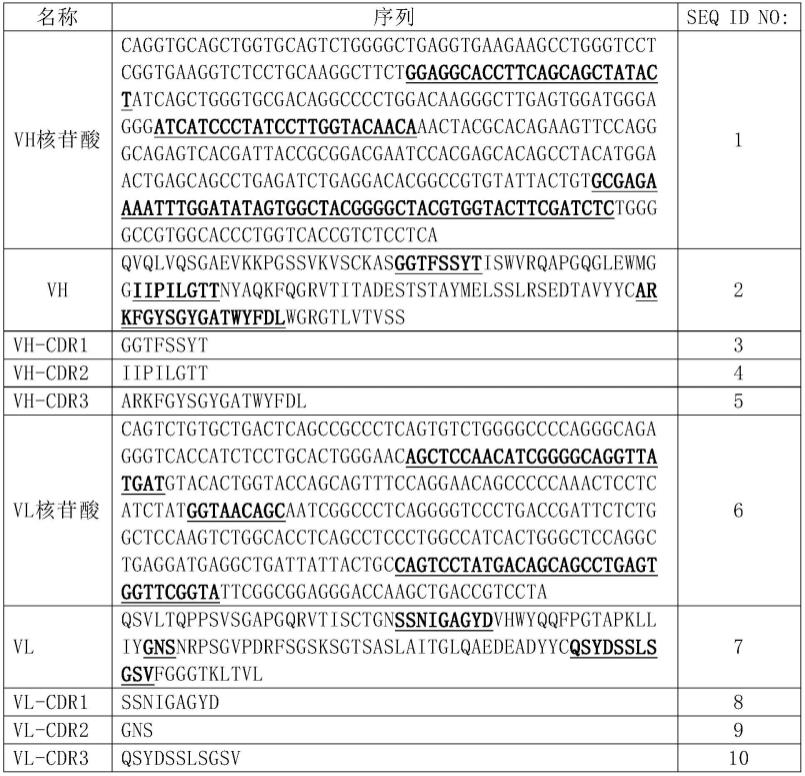
9.在本发明的第一方面,提供了一种抗体的重链可变区,所述的重链可变区具有选自下组的互补决定区cdr:
10.seq id no:3所示的vh-cdr1、seq id no:4所示的vh-cdr2,和seq id no:5所示的vh-cdr3;
11.其中,上述氨基酸序列中任意一种氨基酸序列还包括任选地经过添加、缺失、修饰和/或取代至少一个氨基酸的,并能够保留与sars-cov-2s蛋白rbd结构域的结合亲和力的衍生序列。
12.在另一优选例中,所述重链可变区具有如seq id no:2所示的氨基酸序列。
13.在本发明的第二方面,提供了一种抗体的重链,所述的重链具有如本发明第一方面所述的重链可变区。
14.在另一优选例中,所述重链还包括重链恒定区。
15.在另一优选例中,所述重链恒定区为人源或鼠源的。
16.在另一优选例中,所述重链恒定区为人源抗体重链igg1恒定区。
17.在本发明的第三方面,提供了一种抗体的轻链可变区,所述的轻链可变区具有选自下组的互补决定区cdr:
18.seq id no:8所示的vl-cdr1、seq id no:9所示的vl-cdr2,和seq id no:10所示的vl-cdr3;
19.其中,上述氨基酸序列中任意一种氨基酸序列还包括任选地经过添加、缺失、修饰和/或取代至少一个氨基酸的,并能够保留与sars-cov-2s蛋白rbd结构域的结合亲和力的衍生序列。
20.在另一优选例中,所述轻链可变区具有如seq id no:7所示的氨基酸序列。
21.在本发明的第四方面,提供了一种抗体的轻链,所述的轻链具有如本发明第三方面所述的轻链可变区。
22.在另一优选例中,所述轻链还包括轻链恒定区。
23.在另一优选例中,所述轻链恒定区为人源或鼠源的。
24.在另一优选例中,所述轻链恒定区为人源抗体轻链λ恒定区。
25.在另一优选例中,所述轻链的氨基酸序列如seq id no:7所示。
26.在本发明的第五方面,提供了一种抗体,所述抗体具有如本发明第一方面所述的重链可变区,和/或如本发明第三方面所述的轻链可变区;
27.或者,所述抗体具有如本发明第二方面所述的重链,和/或如本发明第四方面所述的轻链;
28.其中,上述氨基酸序列中任意一种氨基酸序列还包括任选地经过添加、缺失、修饰和/或取代至少一个氨基酸的,并能够保留与sars-cov-2s蛋白rbd结构域的结合亲和力的衍生序列。
29.在另一优选例中,所述添加、缺失、修饰和/或取代的氨基酸数量为1-5个(如1-3个,较佳地1-2个,更佳地1个)。
30.在另一优选例中,所述的经过添加、缺失、修饰和/或取代至少一个氨基酸的,并能够保留sars-cov-2s蛋白rbd结构域的结合亲和力的衍生序列为同源性或序列相同性为至少85%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%的氨基酸序列。
31.在另一优选例中,所述的抗体还包括重链恒定区和/或轻链恒定区。
32.在另一优选例中,所述的重链恒定区为人源的,和/或所述的轻链恒定区为人源的。
33.在另一优选例中,所述重链恒定区为人源抗体重链igg1恒定区,且所述轻链恒定区为人源抗体轻链λ恒定区。
34.在另一优选例中,所述抗体的重链可变区还包括人源的框架区,和/或所述抗体的轻链可变区还包括人源的框架区。
35.在另一优选例中,所述抗体的重链可变区还包括鼠源的框架区,和/或所述抗体的轻链可变区还包括鼠源的框架区。
36.在另一优选例中,所述抗体选自下组:动物源抗体、嵌合抗体、人源化抗体、全人抗体、或其组合。
37.在另一优选例中,所述的抗体是部分或全人源化、或全人的单克隆抗体。
38.在另一优选例中,所述的抗体为双链抗体、或单链抗体。
39.在另一优选例中,所述抗体为抗体全长蛋白、或抗原结合片段。
40.在另一优选例中,所述抗体为双特异性抗体、或多特异性抗体。
41.在另一优选例中,所述的抗体为药物偶联物形式。
42.在另一优选例中,所述抗体具有选自下组的一个或多个特性:
43.(a)特异性结合sars-cov-2s蛋白rbd结构域;
44.(b)阻断sars-cov-2病毒与人血管紧张素转化酶2(ace2)的结合;和
45.(c)有效中和sars-cov-2病毒感染。
46.在另一优选例中,所述的所述抗体具有如本本发明第一方面所述的重链可变区和如本发明第三方面所述的轻链可变区;
47.其中,所述的重链可变区和所述的轻链可变区包括选自下组的cdr:
48.(1)如seq id no:3所示的vh-cdr1、如seq id no:4所示的vh-cdr2、如seq id no:5所示的vh-cdr3、如seq id no:8所示的vl-cdr1、如seq id no:9所示的vl-cdr2,和如seq id no:10所示的vl-cdr3。
49.在另一优选例中,所述抗体的重链可变区的氨基酸序列如seq id no:2所示,并且所述抗体的轻链可变区的氨基酸序列如seq id no:7所示。
50.在另一优选例中,所述重链可变区的氨基酸序列与如seq id no:2所示的氨基酸序列至少有80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的序列同源性或序列相同性。
51.在另一优选例中,所述轻链可变区的氨基酸序列与如seq id no:7所示的氨基酸序列至少有80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的序列同源性或序列相同性。
52.在本发明的第六方面,提供了一种重组蛋白,所述的重组蛋白包括:
53.(i)如本发明第一方面所述的重链可变区、如本发明第二方面所述的重链、如本发
明第三方面所述的轻链可变区、如本发明第四方面所述的轻链、或如本发明第五方面所述的抗体;以及
54.(ii)任选的协助表达和/或纯化的标签序列。
55.在另一优选例中,所述的标签序列包括6his标签。
56.在另一优选例中,所述的重组蛋白(或多肽)包括融合蛋白。
57.在另一优选例中,所述的重组蛋白为单体、二聚体、或多聚体。
58.在本发明的第七方面,提供了一种多核苷酸,所述多核苷酸编码选自下组的多肽:如本发明第一方面所述的重链可变区、如本发明第二方面所述的重链、如本发明第三方面所述的轻链可变区、如本发明第四方面所述的轻链、如本发明第五方面所述的抗体,或如本发明第六方面所述的重组蛋白。
59.在另一优选例中,编码所述重链可变区的多核苷酸如seq id no:1所示;和/或,编码所述轻链可变区的多核苷酸如seq id no:6所示。
60.在本发明的第八方面,提供了一种载体,所述载体含有如本发明第七方面所述的多核苷酸。
61.在另一优选例中,所述的载体包括:细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒如腺病毒、逆转录病毒、或其他载体。
62.在本发明的第九方面,提供了一种遗传工程化的宿主细胞,所述宿主细胞含有如本发明第八方面所述的载体或基因组中整合有如本发明第七方面所述的多核苷酸。
63.在本发明的第十方面,提供了一种抗体偶联物,抗体偶联物含有:
64.(a)抗体部分,所述抗体部分选自下组:如本发明第一方面所述的重链可变区、如本发明第二方面所述的重链、如本发明第三方面所述的轻链可变区、如本发明第四方面所述的轻链、如本发明第五方面所述的抗体、如本发明第六方面所述的重组蛋白,或其组合;和
65.(b)与所述抗体部分偶联的偶联部分,所述偶联部分选自下组:可检测标记物、药物、毒素、细胞因子、放射性核素、酶、金纳米颗粒/纳米棒、纳米磁粒、病毒外壳蛋白或vlp,或其组合。
66.在另一优选例中,所述的抗体部分与所述的偶联部分通过化学键或接头进行偶联。
67.在另一优选例中,所述的放射性核素包括:
68.(i)诊断用同位素,所述的诊断用同位素选自下组:tc-99m、ga-68、f-18、i-123、i-125、i-131、in-111、ga-67、cu-64、zr-89、c-11、lu-177、re-188、或其组合;和/或
69.(ii)治疗用同位素,所述的治疗用同位素选自下组:lu-177、y-90、ac-225、as-211、bi-212、bi-213、cs-137、cr-51、co-60、dy-165、er-169、fm-255、au-198、ho-166、i-125、i-131、ir-192、fe-59、pb-212、mo-99、pd-103、p-32、k-42、re-186、re-188、sm-153、ra223、ru-106、na24、sr89、tb-149、th-227、xe-133yb-169、yb-177、或其组合。
70.在另一优选例中,所述偶联部分为药物或毒素。
71.在另一优选例中,所述的药物为细胞毒性药物。
72.在另一优选例中,所述的细胞毒性药物选自下组:抗微管蛋白药物、dna小沟结合试剂、dna复制抑制剂、烷化试剂、抗生素、叶酸拮抗物、抗代谢药物、化疗增敏剂、拓扑异构
酶抑制剂、长春花生物碱、或其组合。
73.特别有用的细胞毒性药物类的例子包括,例如,dna小沟结合试剂、dna烷基化试剂、和微管蛋白抑制剂、典型的细胞毒性药物包括、例如奥瑞他汀(auristatins)、喜树碱(camptothecins)、多卡霉素/倍癌霉素(duocarmycins)、依托泊甙(etoposides)、美登木素(maytansines)和美登素类化合物(maytansinoids)(例如dm1和dm4)、紫杉烷(taxanes)、苯二氮卓类(benzodiazepines)或者含有苯二氮卓的药物(benzodiazepine containing drugs)(例如吡咯并[1,4]苯二氮卓类(pbds),吲哚啉苯并二氮卓类(indolinobenzodiazepines)和噁唑烷并苯并二氮卓类(oxazolidinobenzodiazepines))、长春花生物碱(vinca alkaloids)、或其组合。
[0074]
在另一优选例中,所述的毒素选自下组:
[0075]
耳他汀类(例如,耳他汀e、耳他汀f、mmae和mmaf)、金霉素、类美坦西醇、篦麻毒素、篦麻毒素a-链、考布他汀、多卡米星、多拉司他汀、阿霉素、柔红霉素、紫杉醇、顺铂、cc1065、溴化乙锭、丝裂霉素、依托泊甙、替诺泊甙(tenoposide)、长春新碱、长春碱、秋水仙素、二羟基炭疽菌素二酮、放线菌素、白喉毒素、假单胞菌外毒素(pe)a、pe40、相思豆毒素、相思豆毒素a链、蒴莲根毒素a链、α-八叠球菌、白树毒素、迈托毒素(mitogellin)、局限曲菌素(retstrictocin)、酚霉素、依诺霉素、麻疯树毒蛋白(curicin)、巴豆毒素、卡奇霉素、肥皂草(sapaonaria officinalis)抑制剂、糖皮质激素、或其组合。
[0076]
在另一优选例中,所述偶联部分为可检测标记物。
[0077]
在另一优选例中,所述偶联物选自:荧光或发光标记物、放射性标记物、mri(磁共振成像)或ct(电子计算机x射线断层扫描技术)造影剂、或能够产生可检测产物的酶、放射性核素、生物毒素、细胞因子(如il-2)、抗体、抗体fc片段、抗体scfv片段、金纳米颗粒/纳米棒、病毒颗粒、脂质体、纳米磁粒、前药激活酶(如dt-心肌黄酶(dtd)或联苯基水解酶-样蛋白质(bphl))、化疗剂(如顺铂)。
[0078]
在另一优选例中,所述免疫偶联物含有:多价(如二价)的(a)。
[0079]
在另一优选例中,所述多价是指在所述免疫偶联物的氨基酸序列中包含多个重复的(a)。
[0080]
在本发明的第十一方面,提供了一种免疫细胞,所述免疫细胞表达或在细胞膜外暴露有如本发明第五方面所述的抗体。
[0081]
在另一优选例中,所述的免疫细胞包括nk细胞、t细胞。
[0082]
在另一优选例中,所述的免疫细胞来自人或非人哺乳动物(如鼠)。
[0083]
在本发明的第十二方面,提供了一种药物组合物,所述药物组合物含有:
[0084]
(i)活性成分,所述活性成分选自下组:如本发明第一方面所述的重链可变区、如本发明第二方面所述的重链、如本发明第三方面所述的轻链可变区、如本发明第四方面所述的轻链、或如本发明第五方面所述的抗体、如本发明第六方面所述的重组蛋白、如本发明第十方面所述的抗体偶联物、如本发明第十一方面所述的免疫细胞、或其组合;以及
[0085]
(ii)药学上可接受的载体。
[0086]
在另一优选例中,所述的药物组合物为液态制剂。
[0087]
在另一优选例中,所述的药物组合物为注射剂。
[0088]
在另一优选例中,所述的药物组合物包括0.01~99.99%的如本发明第五方面所
述的抗体、如本发明第六方面所述的重组蛋白、如本发明第十方面所述的抗体偶联物、如本发明第十一方面所述的免疫细胞、或其组合和0.01~99.99%的药用载体,所述百分比为占所述药物组合物的质量百分比。
[0089]
在本发明的第十三方面,提供了一种活性成分的用途,所述活性成分选自下组:如本发明第一方面所述的重链可变区、如本发明第二方面所述的重链、如本发明第三方面所述的轻链可变区、如本发明第四方面所述的轻链、或如本发明第五方面所述的抗体、如本发明第六方面所述的重组蛋白、如本发明第十方面所述的抗体偶联物、如本发明第十一方面所述的免疫细胞、或其组合,其中所述活性成分被用于(a)制备sars-cov-2病毒感染的诊断试剂或试剂盒;和/或(b)制备预防和/或治疗sars-cov-2病毒感染的药物。
[0090]
在另一优选例中,所述的诊断试剂为检测片或检测板。
[0091]
在另一优选例中,所述诊断试剂或试剂盒用于:检测样品中的sars-cov-2s蛋白或其片段。
[0092]
在另一优选例中,所述的抗体为药物偶联物(adc)形式。
[0093]
在本发明的第十四方面,提供了一种体外检测样品中sars-cov-2病毒或sars-cov-2s蛋白或其片段的方法,所述方法包括步骤:
[0094]
(1)在体外,将所述样品与如本发明第五方面所述的抗体接触;
[0095]
(2)检测是否形成抗原-抗体复合物,其中形成复合物就表示样品中存在sars-cov-2病毒或sars-cov-2s蛋白或其片段。
[0096]
在另一优选例中,所述的检测包括诊断性的或非诊断性的。
[0097]
在本发明的第十五方面,提供了一种试剂盒,所述试剂盒中包括:
[0098]
(1)第一容器,所述第一容器中含有如本发明第五方面的抗体;和/或
[0099]
(2)第二容器,所述第二容器中含有抗本发明第五方面所述抗体的二抗;
[0100]
或者,
[0101]
所述试剂盒含有一检测板,所述检测板包括:基片(支撑板)和测试条,所述的测试条含有如本发明第五方面所述的抗体、如本发明第六方面所述的重组蛋白、如本发明第十方面所述的抗体偶联物、如本发明第十一方面所述的免疫细胞、或其组合。
[0102]
在本发明的第十六方面,提供了一种重组多肽的制备方法,所述的重组多肽是如本发明第五方面所述的抗体或如本发明第六方面所述的重组蛋白,所述的方法包括:
[0103]
(a)在适合表达的条件下,培养如本发明第九方面所述的宿主细胞;和
[0104]
(b)从培养物中分离出所述的重组多肽。
[0105]
在本发明的第十七方面,提供了一种药物组合,包括:
[0106]
(i)第一活性成分,所述第一活性成分包括如本发明第五方面所述的抗体、或如本发明第六方面所述的重组蛋白、或如本发明第十方面所述的抗体偶联物、或如本发明第十一方面所述的免疫细胞、或如本发明第十二方面所述的药物组合物、或其组合;
[0107]
(ii)第二活性成分,所述第二活性成分包括其他治疗sar-cov-2病毒感染的药物。
[0108]
在另一优选例中,所述其他治疗sar-cov-2病毒感染的药物包括:其他保护性单抗或瑞德西韦等小分子化药或其他中成药。
[0109]
在本发明的第十八方面,提供了一种sar-cov-2病毒感染的诊断方法,包括步骤:
[0110]
(i)从诊断对象获取一样品,将所述的样品与如本发明第五方面所述的抗体接触;
和
[0111]
(ii)检测是否形成抗原-抗体复合物,其中形成复合物就表示所述的对象为sar-cov-2病毒确诊患者。
[0112]
在另一优选例中,所述的样品为血液样品或咽拭子样品,或其他组织器官中的样品。
[0113]
在本发明的第十九方面,提供了一种治疗sars-cov-2病毒感染的疾病的方法,包括步骤:向有需要的对象施用有效量的如本发明第五方面所述的抗体、或如本发明第六方面所述的重组蛋白、或如本发明第十方面所述的抗体偶联物、或如本发明第十一方面所述的免疫细胞、如本发明第十二方面所述的药物组合物,或其组合。
[0114]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
[0115]
图1显示了中和抗体表达的sds-page电泳图。
[0116]
其中,1道是蛋白marker;2道是对照抗体igg;3道是单克隆抗体xg-ab008。
[0117]
图2显示了抗体中和效果测试与抗原抗体亲和力测试结果。
[0118]
其中,图2a和2b显示了候选抗体ab001-ab010对(图2a)sars-cov-2以及(图2b)sars-cov慢病毒感染体系中和试验结果。图2c显示了xg-ab008在sars-cov-2假病毒体系中的中和效果,约为1nm。图2d显示了xg-ab008在sars-cov-2真病毒体系中的中和效果,约为4.5nm。
[0119]
图3显示了通过流式细胞仪分选得cd20-/cd38+/igd-/igm-/rbd+的b细胞。
[0120]
图4显示了以b细胞反转录cdna为模板扩增出的轻重链:上重链,中轻链κ,下轻链λ,成功扩增双链模板为:3、4、6、7和8。
[0121]
图5显示了xg-ab008中和抗体亲和力检测结果,kd约为1.39nm。
具体实施方式
[0122]
本发明人经过广泛而深入的研究,经过大量的筛选,首次开发了一种高效地特异性针对2019新型冠状病毒的抗体。具体地,本发明人筛选出了一种从新型冠状病毒痊愈者血液样本中提取的对sars-cov-2病毒表面spike蛋白有高结合力和中和效果的单克隆抗体。实验结果表明,本发明的中和性抗体能够在细胞水平上有效地抑制假病毒的感染,其可以通过抑制ace2受体和rbd蛋白的结合来发挥中和作用。
[0123]
具体地,本发明人从covid-19痊愈者血样中首先分离pbmc,通过磁珠富集得到cd19+b细胞。加入荧光素标记的sars-cov-2靶抗原孵育后,流式分选单个igg+b细胞至96孔板裂解液中。分别对每个单个细胞的重链和轻链进行pcr扩增,重组插入单克隆抗体表达质粒;将重组质粒转染cho细胞后,收集细胞培养上清液并使用protein g进行纯化,获得单克隆抗体。经过体外表达ace2的vero-e6细胞及表达sars-cov-2假病毒体系,筛选出了本发明中对病毒s蛋白具有高中和效果、高结合能力的单克隆抗体。
[0124]
在此基础上,完成了本发明。
[0125]
抗体
[0126]
如本文所用,术语“抗体”或“免疫球蛋白”是有相同结构特征的约150000道尔顿的异四聚糖蛋白,其由两个相同的轻链(l)和两个相同的重链(h)组成。每条轻链通过一个共价二硫键与重链相连,而不同免疫球蛋白同种型的重链间的二硫键数目不同。每条重链和轻链也有规则间隔的链内二硫键。每条重链的一端有可变区(vh),其后是多个恒定区。每条轻链的一端有可变区(vl),另一端有恒定区;轻链的恒定区与重链的第一个恒定区相对,轻链的可变区与重链的可变区相对。特殊的氨基酸残基在轻链和重链的可变区之间形成界面。
[0127]
如本文所用,术语“可变”表示抗体中可变区的某些部分在序列上有所不同,它形成了各种特定抗体对其特定抗原的结合和特异性。然而,可变性并不均匀地分布在整个抗体可变区中。它集中于轻链和重链可变区中称为互补决定区(cdr)或超变区中的三个片段中。可变区中较保守的部分称为构架区(fr)。天然重链和轻链的可变区中各自包含四个fr区,它们大致上呈β-折叠构型,由形成连接环的三个cdr相连,在某些情况下可形成部分β折叠结构。每条链中的cdr通过fr区紧密地靠在一起并与另一链的cdr一起形成了抗体的抗原结合部位(参见kabat等,nih publ.no.91-3242,卷i,647-669页(1991))。恒定区不直接参与抗体与抗原的结合,但是它们表现出不同的效应功能,例如参与抗体的依赖于抗体的细胞毒性。
[0128]
脊椎动物抗体(免疫球蛋白)的“轻链”可根据其恒定区的氨基酸序列归为明显不同的两类(称为κ和λ)中的一类。根据其重链恒定区的氨基酸序列,免疫球蛋白可以分为不同的种类。主要有5类免疫球蛋白:iga、igd、ige、igg和igm,其中一些还可进一步分成亚类(同种型),如igg1、igg2、igg3、igg4、iga和iga2。对应于不同类免疫球蛋白的重链恒定区分别称为α、δ、ε、γ、和μ。不同类免疫球蛋白的亚单位结构和三维构型是本领域人员所熟知的。
[0129]
一般,抗体的抗原结合特性可由位于重链和轻链可变区的3个特定的区域来描述,称为可变区域(cdr),将该段间隔成4个框架区域(fr),4个fr的氨基酸序列相对比较保守,不直接参与结合反应。这些cdr形成环状结构,通过其间的fr形成的β折叠在空间结构上相互靠近,重链上的cdr和相应轻链上的cdr构成了抗体的抗原结合位点。可以通过比较同类型的抗体的氨基酸序列来确定是哪些氨基酸构成了fr或cdr区域。
[0130]
本发明中,“vh-cdr1”与“cdr-h1”可互换使用,均指重链可变区的cdr1;“vh-cdr2”与“cdr-h2”可互换使用,均指重链可变区的cdr2;“vh-cdr3”与“cdr-h3”可互换使用,均指重链可变区的cdr3。“vl-cdr1”与“cdr-l1”可互换使用,均指轻链可变区的cdr1;“vl-cdr2”与“cdr-l2”可互换使用,均指轻链可变区的cdr2;“vl-cdr3”与“cdr-l3”可互换使用,均指轻链可变区的cdr3。
[0131]
本发明不仅包括完整的抗体,还包括具有免疫活性的抗体的片段或抗体与其他序列形成的融合蛋白。因此,本发明还包括所述抗体的片段、衍生物和类似物。
[0132]
在本发明中,抗体包括用本领域技术人员熟知技术所制备的鼠的、嵌合的、人源化的或者全人的抗体。重组抗体,例如嵌合的和人源化的单克隆抗体,包括人的和非人的部分,可以通过标准的dna重组技术获得,它们都是有用的抗体。嵌合抗体是一个分子,其中不同的部分来自不同的动物种,例如具有来自鼠的单克隆抗体的可变区,和来自人免疫球蛋
白的恒定区的嵌合抗体(见例如美国专利4,816,567和美国专利4,816,397,在此通过引用方式整体引入本文)。人源化的抗体是指来源于非人物种的抗体分子,具有一个或多个来源于非人物种的互补决定区(cdrs)和来源于人免疫球蛋白分子的框架区域(见美国专利5,585,089,在此通过引用方式整体引入本文)。这些嵌合和人源化的单克隆抗体可以采用本领域熟知的dna重组技术制备。
[0133]
在本发明中,抗体可以是单特异性、双特异性、三特异性、或者更多的多重特异性。
[0134]
在本发明中,本发明的抗体还包括其保守性变异体,指与本发明抗体的氨基酸序列相比,有至多10个,较佳地至多8个,更佳地至多5个,最佳地至多3个氨基酸被性质相似或相近的氨基酸所替换而形成多肽。这些保守性变异多肽最好根据表a进行氨基酸替换而产生。
[0135]
表a
[0136]
最初的残基代表性的取代优选的取代ala(a)val;leu;ilevalarg(r)lys;gln;asnlysasn(n)gln;his;lys;argglnasp(d)gluglucys(c)sersergln(q)asnasnglu(e)aspaspgly(g)pro;alaalahis(h)asn;gln;lys;argargile(i)leu;val;met;ala;pheleuleu(l)ile;val;met;ala;pheilelys(k)arg;gln;asnargmet(m)leu;phe;ileleuphe(f)leu;val;ile;ala;tyrleupro(p)alaalaser(s)thrthrthr(t)sersertrp(w)tyr;phetyrtyr(y)trp;phe;thr;serpheval(v)ile;leu;met;phe;alaleu
[0137]
本发明中,所述抗体为特异性结合sars-cov-2s蛋白rbd结构域的抗体。本发明提供一种针对sars-cov-2s蛋白rbd结构域的高特异性和高亲和力的抗体,其包括重链和轻链,所述重链含有重链可变区(vh)氨基酸序列,所述轻链含有轻链可变区(vl)氨基酸序列。
[0138]
优选地,
[0139]
所述的重链可变区(vh)具有选自下组的互补决定区cdr:
[0140]
seq id no:3所示的vh-cdr1,
[0141]
seq id no:4所示的vh-cdr2,和
[0142]
seq id no:5所示的vh-cdr3;
[0143]
所述的轻链可变区(vl)具有选自下组的互补决定区cdr:
[0144]
seq id no:8所示的vl-cdr1,
[0145]
seq id no:9所示的vl-cdr2,和
[0146]
seq id no:10所示的vl-cdr3;
[0147]
其中,上述氨基酸序列中任意一种氨基酸序列还包括任选地经过添加、缺失、修饰和/或取代至少一个氨基酸的,并能够保留与sars-cov-2s蛋白rbd结构域的结合亲和力的衍生序列。
[0148]
在另一优选例中,所述经过添加、缺失、修饰和/或取代至少一个氨基酸序列所形成的序列优选为同源性或序列相同性为至少80%,较佳地至少85%,更佳地至少为90%,最佳地至少95%的氨基酸序列。
[0149]
本领域普通技术人员公知的测定序列同源性或相同性的方法包括但不限于:计算机分子生物学(computational molecular biology),lesk,a.m.编,牛津大学出版社,纽约,1988;生物计算:信息学和基因组项目(biocomputing:informatics and genome projects),smith,d.w.编,学术出版社,纽约,1993;序列数据的计算机分析(computer analysis of sequence data),第一部分,griffin,a.m.和griffin,h.g.编,humana press,新泽西,1994;分子生物学中的序列分析(sequence analysis in molecular biology),von heinje,g.,学术出版社,1987和序列分析引物(sequence analysis primer),gribskov,m.与devereux,j.编m stockton press,纽约,1991和carillo,h.与lipman,d.,siam j.applied math.,48:1073(1988)。测定相同性的优选方法要在测试的序列之间得到最大的匹配。测定相同性的方法编译在公众可获得的计算机程序中。优选的测定两条序列之间相同性的计算机程序方法包括但不限于:gcg程序包(devereux,j.等,1984)、blastp、blastn和fasta(altschul,s,f.等,1990)。公众可从ncbi和其它来源得到blastx程序(blast手册,altschul,s.等,ncbi nlm nih bethesda,md.20894;altschul,s.等,1990)。熟知的smith waterman算法也可用于测定相同性。
[0150]
较佳地,本文所述抗体为抗体全长蛋白、抗原抗体结合域蛋白质片段、双特异性抗体、多特异性抗体、单链抗体(single chain antibody fragment,scfv)、单域抗体(single domain antibody,sdab)和单区抗体(signle-domain antibody)中的一种或多种,以及上述抗体所制得的单克隆抗体或多克隆抗体。所述单克隆抗体可以由多种途径和技术进行研制,包括杂交瘤技术、噬菌体展示技术、单淋巴细胞基因克隆技术等,主流是通过杂交瘤技术从野生型或转基因小鼠制备单克隆抗体。
[0151]
所述的抗体全长蛋白为本领域常规的抗体全长蛋白,其包括重链可变区、轻链可变区、重链恒定区和轻链恒定区。所述的蛋白质的重链可变区和轻链可变区与人源重链恒定区和人源轻链恒定区构成全人源抗体全长蛋白。较佳地,所述的抗体全长蛋白为igg1、igg2、igg3或igg4;更佳地为igg1。
[0152]
本发明的抗体可以是双链或单链抗体,并且可以是选自动物源抗体、嵌合抗体、人源化抗体,更优选为人源化抗体、人-动物嵌合抗体,更优选为全人源化抗体。
[0153]
本发明所述抗体衍生物可以是单链抗体、和/或抗体片段,如:fab、fab’、(fab’)2或该领域内其他已知的抗体衍生物等,以及iga、igd、ige、igg以及igm抗体或其他亚型的抗
体中的任意一种或几种。
[0154]
所述的单链抗体为本领域常规的单链抗体,其包括重链可变区、轻链可变区和15~20个氨基酸的短肽。
[0155]
其中,所述动物优选为哺乳动物,如鼠。
[0156]
本发明抗体可以是靶向sars-cov-2spike蛋白的嵌合抗体、人源化抗体、cdr嫁接和/或修饰的抗体。
[0157]
本发明上述内容中,所述添加、缺失、修饰和/或取代的氨基酸数量,优选为不超过初始氨基酸序列总氨基酸数量的40%,更优选为不超过35%,更优选为1-33%,更优选为5-30%,更优选为10-25%,更优选为15-20%。
[0158]
本发明上述内容中,更优选地,所述添加、缺失、修饰和/或取代的氨基酸数量,可以是1-7个,更优选为1-5个,更优选为1-3个,更优选为1-2个。
[0159]
在另一优选例中,所述抗体的重链可变区含有seq id no:2所示的氨基酸序列。
[0160]
在另一优选例中,所述抗体的轻链可变区含有seq id no:7所示的氨基酸序列。
[0161]
在本发明的实施方式中,所述靶向sars-cov-2s蛋白rbd结构域的抗体为xg-ab008。
[0162]
在一个更加优选的实施方式中,本发明各抗体具体地包括以下各vl和vh序列,以及fc、cl和ch1序列。
[0163]
表b xg-ab008抗体序列总结
[0164]
[0165]
编码的多核苷酸
[0166]
本发明还提供一种多核苷酸,其编码上述的抗体或包含其的重组蛋白或其重链可变区或轻链可变区。
[0167]
较佳地,编码所述重链可变区的核酸的核苷酸序列如序列表seq id no:1所示;和/或,编码所述轻链可变区的核酸的核苷酸序列如序列表seq id no:6所示。
[0168]
更佳地,编码所述重链可变区的核酸的核苷酸序列如序列表seq id no:1所示;且编码所述轻链可变区的核酸的核苷酸序列如序列表seq id no:6所示。
[0169]
所述核酸的制备方法为本领域常规的制备方法,较佳地,包括以下的步骤:通过基因克隆技术获得编码上述蛋白质的核酸分子,或者通过人工全序列合成的方法得到编码上述蛋白质的核酸分子。
[0170]
本领域技术人员知晓,编码上述蛋白质的氨基酸序列的碱基序列可以适当引入替换、缺失、改变、插入或增加来提供一个多聚核苷酸的同系物。本发明中多聚核苷酸的同系物可以通过对编码该蛋白序列基因的一个或多个碱基在保持抗体活性范围内进行替换、缺失或增加来制得。
[0171]
载体
[0172]
本发明还提供一种包含所述核酸的重组表达载体。
[0173]
其中所述重组表达载体可通过本领域常规方法获得,即:将本发明所述的核酸分子连接于各种表达载体上构建而成。所述的表达载体为本领域常规的各种载体,只要其能够容载前述核酸分子即可。所述载体较佳地包括:各种质粒、粘粒、噬菌体或病毒载体等。
[0174]
本发明还提供一种包含上述重组表达载体的重组表达转化体。
[0175]
其中,所述重组表达转化体的制备方法为本领域常规的制备方法,较佳地为:将上述重组表达载体转化至宿主细胞中制得。所述的宿主细胞为本领域常规的各种宿主细胞,只要能满足使上述重组表达载体稳定地自行复制,且所携带所述的核酸可被有效表达即可。较佳地,所述宿主细胞为e.coli tg1或e.coli bl21细胞(表达单链抗体或fab抗体),或者hek293或cho细胞(表达全长igg抗体)。将前述重组表达质粒转化至宿主细胞中,即可得本发明优选的重组表达转化体。其中所述转化方法为本领域常规转化方法,较佳地为化学转化法,热激法或电转法。
[0176]
抗体的制备
[0177]
本发明抗体或其片段的dna分子的序列可以用常规技术,比如利用pcr扩增或基因组文库筛选等方法获得。此外,还可将轻链和重链的编码序列融合在一起,形成单链抗体。
[0178]
一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。这通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到有关序列。
[0179]
此外,还可用人工合成的方法来合成有关序列,尤其是片段长度较短时。通常,通过先合成多个小片段,然后再进行连接可获得序列很长的片段。
[0180]
目前,已经可以完全通过化学合成来得到编码所述的本发明的抗体(或其片段,或其衍生物)的dna序列。然后可将该dna序列引入本领域中已知的各种现有的dna分子(或如载体)和细胞中。此外,还可通过化学合成将突变引入本发明蛋白序列中。
[0181]
本发明还涉及包含上述的适当dna序列以及适当启动子或者控制序列的载体。这些载体可以用于转化适当的宿主细胞,以使其能够表达蛋白质。
[0182]
宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;或是高等真核细胞,如哺乳动物细胞。优选的动物细胞包括(但并不限于):cho-s、hek-293细胞。
[0183]
通常,在适合本发明抗体表达的条件下,培养转化所得的宿主细胞。然后用常规的免疫球蛋白纯化步骤,如蛋白a-sepharose、羟基磷灰石层析、凝胶电泳、透析、离子交换层析、疏水层析、分子筛层析或亲和层析等本领域技术人员熟知的常规分离纯化手段纯化得到本发明的抗体。
[0184]
所得单克隆抗体可用常规手段来鉴定。比如,单克隆抗体的结合特异性可用免疫沉淀或体外结合试验(如放射性免疫测定(ria)或酶联免疫吸附测定(elisa))来测定。单克隆抗体的结合亲和力例如可用munson等,anal.biochem.,107:220(1980)的scatchard分析来测定。
[0185]
本发明的抗体可在细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化重组的蛋白。这些方法是本领域技术人员所熟知的。这些方法的例子包括但并不限于:常规的复性处理、用蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超声处理、超离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(hplc)和其它各种液相层析技术及这些方法的结合。
[0186]
抗体-药物偶联物(adc)
[0187]
本发明还提供了基于本发明抗体的抗体偶联药物(antibody-drug conjugate,adc)。
[0188]
典型地,所述抗体偶联药物包括所述抗体、以及效应分子,所述抗体与所述效应分子偶联,并优选为化学偶联。其中,所述效应分子优选为具有治疗活性的药物。此外,所述效应分子可以是毒蛋白、化疗药物、小分子药物或放射性核素中的一种或多种。
[0189]
本发明抗体与所述效应分子之间可以是通过偶联剂进行偶联。所述偶联剂的例子可以是非选择性偶联剂、利用羧基的偶联剂、肽链、利用二硫键的偶联剂中的任意一种或几种。所述非选择性偶联剂是指使效应分子和抗体形成共价键连接的化合物,如戊二醛等。所述利用羧基的偶联剂可以是顺乌头酸酐类偶联剂(如顺乌头酸酐)、酰基腙类偶联剂(偶联位点为酰基腙)中的任意一种或几种。
[0190]
抗体上某些残基(如cys或lys等)用于与多种功能基团相连,其中包括成像试剂(例如发色基团和荧光基团),诊断试剂(例如mri对比剂和放射性同位素),稳定剂(例如乙二醇聚合物)和治疗剂。抗体可以被偶联到功能剂以形成抗体-功能剂的偶联物。功能剂(例如药物,检测试剂,稳定剂)被偶联(共价连接)至抗体上。功能剂可以直接地、或者是通过接头间接地连接于抗体。
[0191]
抗体可以偶联药物从而形成抗体药物偶联物(adcs)。典型地,adc包含位于药物和抗体之间的接头。接头可以是可降解的或者是不可降解的接头。可降解的接头典型地在细胞内环境下容易降解,例如在目标位点处接头发生降解,从而使药物从抗体上释放出来。合适的可降解的接头包括,例如酶降解的接头,其中包括可以被细胞内蛋白酶(例如溶酶体蛋白酶或者内体蛋白酶)降解的含有肽基的接头,或者糖接头例如,可以被葡糖苷酸酶降解的含葡糖苷酸的接头。肽基接头可以包括,例如二肽,例如缬氨酸-瓜氨酸,苯丙氨酸-赖氨酸或者缬氨酸-丙氨酸。其它合适的可降解的接头包括,例如,ph敏感接头(例如ph小于5.5时水解的接头,例如腙接头)和在还原条件下会降解的接头(例如二硫键接头)。不可降解的接
头典型地在抗体被蛋白酶水解的条件下释放药物。
[0192]
连接到抗体之前,接头具有能够和某些氨基酸残基反应的活性反应基团,连接通过活性反应基团实现。巯基特异性的活性反应基团是优选的,并包括:例如马来酰亚胺类化合物,卤代酰胺(例如碘、溴或氯代的);卤代酯(例如碘、溴或氯代的);卤代甲基酮(例如碘、溴或氯代),苄基卤代物(例如碘、溴或氯代的);乙烯基砜,吡啶基二硫化物;汞衍生物例如3,6-二-(汞甲基)二氧六环,而对离子是醋酸根、氯离子或者硝酸根;和聚亚甲基二甲基硫醚硫代磺酸盐。接头可以包括,例如,通过硫代丁二酰亚胺连接到抗体上的马来酰亚胺。
[0193]
药物可以是任何细胞毒性,抑制细胞生长或者免疫抑制的药物。在实施方式中,接头连接抗体和药物,而药物具有可以和接头成键的功能性基团。例如,药物可以具有可以和连接物成键的氨基,羧基,巯基,羟基,或者酮基。在药物直接连接到接头的情况下,药物在连接到抗体之前,具有反应的活性基团。
[0194]
在本发明中,药物-接头可以用于在一个简单步骤中形成adc。在其它实施方式中,双功能连接物化合物可以用于在两步或多步方法中形成adc。例如,半胱氨酸残基在第一步骤中与接头的反应活性部分反应,并且在随后的步骤中,接头上的功能性基团与药物反应,从而形成adc。
[0195]
通常,选择接头上功能性基团,以利于特异性地与药物部分上的合适的反应活性基团进行反应。作为非限制性的例子,基于叠氮化合物的部分可以用于特异性地与药物部分上的反应性炔基基团反应。药物通过叠氮和炔基之间的1,3-偶极环加成,从而共价结合于接头。其它的有用的功能性基团包括,例如酮类和醛类(适合与酰肼类和烷氧基胺反应),膦(适合与叠氮反应);异氰酸酯和异硫氰酸酯(适合与胺类和醇类反应);和活化的酯类,例如n-羟基琥珀酰亚胺酯(适合与胺类和醇类反应)。这些和其它的连接策略,例如在《生物偶联技术》,第二版(elsevier)中所描述的,是本领域技术人员所熟知的。本领域技术人员能够理解,对于药物部分和接头的选择性反应,当选择了一个互补对的反应活性功能基团时,该互补对的每一个成员既可以用于接头,也可以用于药物。
[0196]
本发明还提供了制备adc的方法,可进一步地包括:将抗体与药物-接头化合物,在足以形成抗体偶联物(adc)的条件下进行结合。
[0197]
在某些实施方式中,本发明方法包括:在足以形成抗体-接头偶联物的条件下,将抗体与双功能接头化合物进行结合。在这些实施方式中,本发明方法还进一步地包括:在足以将药物部分通过接头共价连接到抗体的条件下,将抗体接头偶联物与药物部分进行结合。
[0198]
在一些实施方式中,抗体药物偶联物adc如下分子式所示:
[0199][0200]
其中:
[0201]
ab是抗体,
[0202]
lu是接头;
[0203]
d是药物;
[0204]
而且下标p是选自1到8的值。
[0205]
应用
[0206]
本发明还提供了本发明抗体、抗体偶联物adc、重组蛋白、和/或免疫细胞的用途,例如用于制备诊断制剂或制备药物。
[0207]
较佳地,所述的药物是用于预防和/或治疗sars-cov-2病毒感染的疾病的药物。
[0208]
检测用途和试剂盒
[0209]
本发明的抗体或其adc可用于检测应用,例如用于检测样本,从而提供诊断信息。
[0210]
本发明中,所采用的样本(样品)包括细胞、组织样本和活检标本。
[0211]
较佳地,所述的样本是来自于检测对象的血液样本或咽拭子样本。
[0212]
本发明使用的术语“活检”应包括本领域技术人员已知的所有种类的活检。因此本发明中使用的活检可以包括例如肿瘤的切除样本、通过内窥镜方法或器官的穿刺或针刺活检制备的组织样本。
[0213]
本发明中使用的样本包括固定的或保存的细胞或组织样本。
[0214]
本发明还提供了一种指含有本发明的抗体(或其片段)的试剂盒,在本发明的一个优选例中,所述的试剂盒还包括容器、使用说明书、缓冲剂等。在优选例中,本发明的抗体可以固定于检测板。
[0215]
药物组合物
[0216]
本发明还提供了一种组合物。在优选例中,所述的组合物是药物组合物,它含有上述的抗体或其活性片段或其融合蛋白或其adc或相应的免疫细胞,以及药学上可接受的载体。通常,可将这些物质配制于无毒的、惰性的和药学上可接受的水性载体介质中,其中ph通常约为5-8,较佳地ph约为6-8,尽管ph值可随被配制物质的性质以及待治疗的病症而有所变化。
[0217]
配制好的药物组合物可以通过常规途径进行给药,其中包括(但并不限于):瘤内、腹膜内、静脉内、或局部给药。典型地,本发明所述的药物组合物的给药途径较佳地为注射给药或口服给药。所述注射给药较佳地包括静脉注射、肌肉注射、腹腔注射、皮内注射或皮下注射等途径。所述的药物组合物为本领域常规的各种剂型,较佳地为固体、半固体或液体的形式,可以为水溶液、非水溶液或混悬液,更佳地为片剂、胶囊、颗粒剂、注射剂或输注剂等。
[0218]
本发明所述抗体也可以是由核苷酸序列在细胞内表达用于的细胞治疗,比如,所述抗体用于嵌合抗原受体t细胞免疫疗法(car-t)等。
[0219]
本发明所述的药物组合物是用于预防和/或治疗sars-cov-2病毒感染的疾病的药物组合物。
[0220]
本发明的药物组合物可直接用于结合sars-cov-2s蛋白分子或其片段,因而可用于预防和治疗病毒感染所引发的疾病。
[0221]
本发明的药物组合物含有安全有效量(如0.001-99wt%,较佳地0.01-90wt%,更佳地0.1-80wt%)的本发明上述的单克隆抗体(或其偶联物)以及药学上可接受的载体或赋形剂。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。药物制剂应与给药方式相匹配。本发明的药物组合物可以被制成针剂形式,例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。药物组合物如针剂、溶液宜在无菌条件下制造。活性成分的给药量是治疗有效量,例如每天约1微克/千克体重-约5毫克/千克
体重。此外,本发明的多肽还可与其他治疗剂一起使用。
[0222]
本发明中,较佳地,本发明所述的药物组合物还包括一种或多种药用载体。所述的药用载体为本领域常规药用载体,所述的药用载体可以为任意合适的生理学或药学上可接受的药物辅料。所述的药物辅料为本领域常规的药物辅料,较佳的包括药学上可接受的赋形剂、填充剂或稀释剂等。更佳地,所述的药物组合物包括0.01~99.99%的上述蛋白质和0.01~99.99%的药用载体,所述百分比为占所述药物组合物的质量百分比。
[0223]
本发明中,较佳地,所述的药物组合物的施用量为有效量,所述有效量为能够缓解或延迟疾病、退化性或损伤性病症进展的量。所述有效量可以以个体基础来测定,并将部分基于待治疗症状和所寻求结果的考虑。本领域技术人员可以通过使用个体基础等上述因素和使用不超过常规的实验来确定有效量。
[0224]
使用药物组合物时,是将安全有效量的免疫偶联物施用于哺乳动物,其中该安全有效量通常至少约10微克/千克体重,而且在大多数情况下不超过约50毫克/千克体重,较佳地该剂量是约10微克/千克体重-约20毫克/千克体重。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
[0225]
本发明提供上述药物组合物在制备预防和/或治疗sars-cov-2病毒感染的疾病的药物中的应用。较佳地,所述sars-cov-2病毒感染的疾病为肺炎。
[0226]
冠状病毒
[0227]
如本文所用,术语“新型冠状病毒”、“2019-ncov”或“sars-cov-2”可互换使用,该2019新型冠状病毒是已知感染人的第7种冠状病毒,并且造成新冠肺炎(covid-19),是威胁全球人类健康的严重传染性疾病之一。
[0228]
冠状病毒(coronavirus,cov)属于套式病毒目(nidovirales)冠状病毒科(coronaviridae),是一种有包膜的正链rna病毒,其亚科包含α、β、δ及γ四属。
[0229]
目前已知的感染人的冠状病毒中,hcov-229e和hcov-nl63属于α属冠状病毒,hcov-oc43、sars-cov、hcov-hku1、mers-cov和sars-cov-2均为β属冠状病毒。sars-cov-2也被称为2019-ncov。
[0230]
高致病性冠状病毒“非典”sars-cov和“中东呼吸综合征”mers-cov均属于β属冠状病毒。新型冠状病毒(sars-cov-2)与sars-cov有约80%相似性、与mers-cov有40%的相似性,也属于β属冠状病毒。
[0231]
该类病毒的基因组是一条单股正链rna,是基因组最大的rna病毒之一,编码包括复制酶、刺突蛋白、囊膜蛋白、包膜蛋白和核壳蛋白等。在病毒复制的初始阶段,基因组被翻译成两条长达几千个氨基酸的肽链即前体多聚蛋白(polyprotein),随后前体蛋白被蛋白酶切割生成非结构蛋白(如rna聚合酶和解旋酶)和结构蛋白(如刺突蛋白)及辅助蛋白。
[0232]
本发明的主要优点包括:
[0233]
(1)本发明的抗体制备过程简单。本发明使用cho表达系统,操作简单,可持续地表达大量抗体,满足下游的实验和检测需求。
[0234]
(2)本发明提供的单抗为全人抗体,不存在其他异种蛋白的抗原性。
[0235]
(3)通过体外s蛋白慢病毒感染体系验证,本发明抗体对sars-cov-2病毒具有较强的中和效果(4.5nm)。
[0236]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明
而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
[0237]
以下为获得发明目的所述的单抗所需的基本实验方案。
[0238]
1.收集新冠病毒感染痊愈者静脉采血12-15毫升,肝素抗凝。
[0239]
2.外周肝素抗凝血使用lymphoprep密度梯度离心法获得单个核细胞(pbmc)
[0240]
3.使用磁珠负选富集外周血单个核细胞(pbmc)中的b细胞
[0241]
4.再加入荧光抗体及荧光素标记的sars-cov-2靶抗原孵育,流式分选单个igg+b细胞至96孔板中,理论上每孔收集一个细胞,每个孔预先加入含rna酶抑制剂的细胞裂解液
[0242]
5.随后提取单个b细胞rna,逆转录成cdna
[0243]
6.以cdna为模板,进行first pcr,再以first pcr产物为模板用seq-pcr方法扩增轻重链、筛选只能扩增出正确大小单一条带模板并测序。
[0244]
7.用筛选后的模板扩总轻重链基因
[0245]
8.重组轻重链基因,获得表达载体
[0246]
9.将表达载体转染进dh5α感受态细胞中,并用含有氨苄西林的琼脂糖平板筛选挑选单克隆。
[0247]
10.挑选出的单克隆进行小体积培养并纯化表达载体
[0248]
11.用pcr方法扩增轻重链并测序,比较步骤6和步骤11获得的轻重链序列,筛选出结果一致的轻重链载体。
[0249]
12.转染表达载体进cho细胞,表达并纯化获得全人源抗体。
[0250]
13.在bsl-2实验室中,用已建立的s蛋白慢病毒感染体系中,筛选获得有中和效果的候选抗体10株:ab001、002、003至010。通过比较中和效果,获得3.1中目标特异性中和抗体:xg-ab008。(简称为ab008)
[0251]
14.另外,使用octet red 96蛋白质相互作用工作站拟合得到xg-ab008对s蛋白rbd的结合系数。
[0252]
由上述步骤1-12,通过收集cho细胞表达上清溶液,纯化可得所述单克隆中和抗体xg ab-008,经sds-page结果显示(图1),纯化后的候选抗体纯度可满足后续试验需求。
[0253]
由上述步骤13-14,通过过表达ace2的vero-e6细胞作为应答细胞,使用分别表达sars-cov-2、sars-cov s蛋白的假病毒体系,获得候选抗体对sars-cov-2慢病毒(图2a)和sars-cov慢病毒的抑制效果(图2b),证明候选抗体ab008对sars-cov-2病毒有特异性中和能力。其中,ab008抗体特异的对sars-cov-2具有良好的中和效果1nm(图2c)。在真病毒感染体系中对sars-cov-2中和效果能达到4.5nm(图2d)通过链霉亲和素传感器固化s-rbd结构域后(rbd检测梯度浓度范围1.56-50nm),octet仪器检测候选抗体ab008的亲和力,此抗体具有非常强的s-rbd结合能力(kd~1.39nm)(图5)
[0254]
实施例1:新冠痊愈患者血液中获得单个核细胞(pbmc)
[0255]
集新冠痊愈患者肝素抗凝血液12-15ml,500g离心10分钟,吸去上层血浆。之后,按1:1体积加入生理盐水稀释下层血细胞,混合均匀。混合物缓慢叠加到含有等体积lymphoprep溶液的离心管中,用密度梯度离心法获得单个核细胞(pbmc)。
[0256]
以上实施例中所需溶液配方如下所示:
[0257]
生理盐水:0.9%氯化钠,超纯水,0.22um滤膜过滤后使用。
[0258]
lymphoprep溶液:lymphopreptm、1
×
d-pbs、0.9%氯化钠、100
×
青链霉素双抗、0.5m edta,调整ph至8.0。
[0259]
实施例2:b细胞富集
[0260]
按照商业说明书方法准备ls column。
[0261]
准备“抗体稀释混合液”,在150ul抗体稀释液稀释生物素标记的抗cd3、抗cd11b、抗cd14、抗cd16、抗cd56、抗cd235a抗体各0.6ul。
[0262]
准备“抗生物素磁珠悬液”,在200ul抗体稀释液中加入20ul抗生物素磁珠。
[0263]
按商业说明书方法,用抗体稀释混合液孵育实施例1中制得的pbmc悬液,洗去多余抗体后,再用抗生物素磁珠悬液孵育处理后的pbmc悬液,用ls colum收集富集的b细胞。
[0264]
以上实施例中所需溶液配方如下所示:
[0265]
macs溶液:10ml胎牛血清(fbs)、5mm edta、500ml 1
×
dpbs,调整ph至8.0,0.22um滤膜过滤后使用4℃保存。
[0266]
实施例3:b细胞分选
[0267]
准备mouse fc稀释液:抗体稀释液100ul中加入4ul mouse fc
[0268]
准备流式荧光抗体稀释混合:抗体稀释液100ul中加入下表抗体
[0269]
抗体/蛋白名称荧光素用量s-rbdfitc5ug/mls-rbdpe5ug/mligavioblue(pb channel)1/25igma6471/100igdbv5101/100cd3percpcy5.51/250cd20bv7851/100cd38pecy71/250
[0270]
使用实施例2中富集的b细胞,加入100ul mouse fc稀释液,室温避光孵育15分钟。用macs洗去多余抗体,再加入100ul流式荧光抗体稀释液,室温避光孵育15分钟。用macs洗去多余抗体后,用流式细胞仪melody分选特异性结合s-rbd的单个b细胞(图3)。分选出的b细胞用含有4ul细胞裂解液的96孔pcr板收集,每孔一个细胞,分选结束后立即用封膜并用干冰速冻。
[0271]
以上实施例中所需溶液配方如下所示:
[0272]
裂解液:300ul rnasin、40u/ul rnase抑制剂、200ul 1*dpbs、400ul dl-dtt(100mm)、3100ul无核酸酶水。
[0273]
实施例4:筛选备选抗体表达载体模板
[0274]
在实施例3中分选的到的单个b细胞,用superscript iii rt逆转录酶(invitrogen,18080-044)反转获得cdna。
[0275]
之后,以cdna为模板按商业说明书使用transtaq high fidelity(hifi)pcr supermix ii(transgen,as131-22),进行1st pcr,测序pcr和克隆pcr,通过跑琼脂糖胶鉴
定轻重链。挑选可匹配的轻重链对(图4)。
[0276]
实施例5:构建表达载体,抗体表达及纯化
[0277]
以abvec higg抗体表达质粒为骨架,插入实施例4中获得的成对轻重链序列分别构轻链表达质粒和重链表达质粒,按expicho表达系统商业说明书所述方法(expicho
tm expression system kit,a29133),转染并表达cho细胞。500g,10min离心分离收集细胞悬液,并按protein g sepharose商业说明书(protein g4fast flow,17-0618-01)所述方法,纯化igg抗体
[0278]
实施例6:抗体中和效果检测
[0279]
制备sars-cov-2假病毒,构建表达载体,包含:小鼠白血病病毒(mlv)gag/pol,逆转录病毒egfp,sars-cov-2s蛋白全长序列(wuhan-hu-1,genbank:qhd43419.1)或sars-cov s蛋白全长序列(ay569693)。按商业说明书方法,使用pei转染试剂,转染hek293t,并于48小时后,收集上清液中的假病毒。之后使用预混匀的假病毒/抗体悬液侵染高表达hace2的veroe6细胞,为实验组(sd,n=3)(附图2a),单独假病毒悬液侵染为对照组(sd,n=3)(附图2b)通过流式分析可得抗体中和效果约为~10nm(附图2c)。
[0280]
实施例7:抗体亲和力检测
[0281]
按octet red 96蛋白质相互作用工作站商业使用说明书所述,准备biotin溶液(10mm),zb脱盐柱130ul。使用biotin溶液1:1孵育标记s蛋白,用脱盐柱去除多余未结合biotin。在96孔板中依次加入s蛋白样品,xg-ab008梯度稀释溶液50mm、25mm、12.5mm、6.25mm、3.125mm、1.563mm。根据仪器度值拟合得xg-ab008对s蛋白的结合系数(附图2d)。
[0282]
讨论
[0283]
现有常用的sars-cov-2抗体筛选技术包括杂交瘤、噬菌体、转基因小鼠及单个b细胞克隆技术等。通过对传统鼠源抗体进行人源化改造生产出的全人抗体,可以大幅降低抗体的免疫原性(再生元,regn-cov2)。随着流式细胞术的发展,单个b细胞分离技术已被广泛使用。通过标记b细胞表面抗原,筛选的到抗原特异性单个b细胞,之后分别对分选单个b细胞进行抗体基因扩增。之后通过载体构建,抗体表达等方法获得抗原特异性中和抗体(清华大学,brii-198、brii-196)。也有通过高通量单细胞测序的方法筛选有效的中和抗体(百济神州,dxp-593)
[0284]
虽然靶向sars-cov-2病毒s蛋白的单克隆抗体技术以日趋完善,但采用不同的分选策略,扩增条件仍然会出现差异巨大的筛选结果。对此,本发明提供了一种基于单个b细胞扩增并表达单克隆抗体的策略,以及筛选出的靶向s蛋白的高效中和单克隆抗体。
[0285]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1