一种洛克米兰醇酚羟基衍生物、其制备方法和应用
技术领域:
本发明属于药物技术领域,具体地说涉及洛克米兰醇酚羟基衍生物,同时还涉及该洛克米兰醇酚羟基衍生物的制备方法,以及该洛克米兰醇酚羟基衍生物在制备抗肿瘤药物中的应用。
背景技术:
:
癌症或肿瘤是严重威胁人类健康的常见病和多发病,目前死亡率据世界卫生组织统计已经上升到第一位。癌症或肿瘤的治疗方法主要有手术、放射和化学药物治疗三种方法。但是目前临床上很大程度上仍以化学药物治疗为主。现有化疗药物是非手术治疗癌症或肿瘤的常用方法之一,存在有效剂量和中毒剂量非常接近、毒副作用等问题,其中以消化功能受损和骨髓造血功能受抑制等反应最为明显,往往使癌症或肿瘤患者因反应严重而难以接受化疗或不能坚持完成整个疗程。另外,放疗和化疗没有选择性,对正常组织有严重的副作用,并能诱导癌症细胞产生耐药性。高效低毒的抗癌药物研究是目前国内外研究的热点和重点。
技术实现要素:
:
本发明的目的在于克服上述缺点而提供的一种具有纳摩尔级的抗结直肠癌、抗白血病的活性的洛克米兰醇酚羟基衍生物。
本发明的另一目的在于提供该洛克米兰醇酚羟基衍生物的制备方法。
本发明的再一目的在于提供该洛克米兰醇酚羟基衍生物在制备抗结直肠癌、抗白血病、及mapk信号通路抑制剂药物中的应用。
本发明的目的是通过以下技术方法来实现的:
本发明的一种洛克米兰醇酚羟基衍生物,具有下述结构式(ⅰ):
其中:r为甲基,乙基,丙基,丁基,戊基,己基,5-溴戊基,烯丙基,异戊烯基,炔丙基,2-丁炔基,乙酰基,丙酰基,戊酰基,苯甲酰基,对硝基苯甲酰基,乙基磺酰基,丙基磺酰基或苯基磺酰基。
本发明的一种洛克米兰醇酚羟基衍生物的制备方法,包括下述步骤:
(1)中间体化合物4的合成
以2-羟基-4,6-二甲氧基苯乙酮(1)和4-苄氧基苯甲醛(2)为原料,加入25ml无水乙醇和1.5当量的氢氧化钾,于50℃搅拌8小时,加入稀盐酸调ph到2,过滤不溶物,得到不溶固体。取5g滤饼,加入300mg的碘和100ml吡啶,回流过夜,加入100ml的饱和硫代硫酸钠溶液淬灭反应,得到中间体3。称取700mg的中间体3,加入80ml二氯甲烷和60ml丙酮混合溶剂,缓慢加入140ml浓度为11.6g/ml的一硫酸氢钾复合盐水溶液,得到中间体4,反应路线如下:
反应试剂与条件为:(a)乙醇,氢氧化钾,水;(b)吡啶,碘;(c)二氯甲烷,丙酮,碳酸钠,碳酸氢钠;过一硫酸氢钾复合盐,对甲苯磺酸;
(2)中间体化合物5/6的合成
称取800mg的中间体4(2.44mmol),加入40ml乙腈和30ml甲醇和12.6当量的反式肉桂酸甲酯5.0g,用氙气灯进行强光照射,反应17h后,得到产物中间体5/6,反应路线如下:
反应试剂与条件为:反式肉桂酸甲酯,氙气灯;
(3)关键中间体7的合成
称取1g的中间体5/6,加入30ml的甲醇和10ml浓度为0.5m的甲醇钠的甲醇溶液,于70℃条件回流4h,得到中间体7,反应路线如下:
反应试剂与条件为:甲醇,甲醇钠;
(4)关键中间体8的合成
称取2g中间体7,加入100ml的dmso和氯化锂170mg,于100℃的搅拌8h,得到中间体8,反应路线如下:
反应试剂与条件:二甲基亚砜,氯化锂;
(5)关键中间体9的合成
称取3.27g的三乙酰氧基硼氢化钠加入200ml乙腈和1.2ml冰乙酸,然后缓慢加入700mg的中间体8,于40℃搅拌8h,得到中间体9,反应路线如下:
反应试剂与条件:三乙酰氧基硼氢化钠,乙酸,乙腈。
(6)关键中间体10的合成制备
称取500mg的中间体9(0.98mmol),加入30ml无水乙醇和5mg的pd(oh)2,在氢气保护下搅拌4小时,得到关键中间体4'-脱甲氧基洛克米兰醇(10),反应式如下:
反应试剂与条件:乙醇,氢氧化钯,氢气。
(7)系列衍生物11a到11k合成制备
称取4'-脱甲氧基洛克米兰醇(10)30mg,加入5ml丙酮,2.0当量的碳酸钾,1.5当量的溴取代物或者碘取代物,于70℃的恒温油浴锅中,加热回流12h,得到系列衍生物11a到11k,反应路线如下:
(8)系列衍生物11l到11s合成
称取4'-脱甲氧基洛克米兰醇(10)30mg,加入5ml的二氯甲烷和2.0当量的三乙氨,1mg的4-二甲氨基吡啶和1.5当量的各种酰化试剂或者磺酰化试剂,25℃下,反应8小时,得到系列衍生物11l到11s,反应路线如下:
本发明的洛克米兰醇酚羟基衍生物在制备抗结直肠癌和抗白血病药物中的应用。
本发明的洛克米兰醇酚羟基衍生物在制备mapk信号通路抑制剂药物中的应用。
本发明与现有技术相比,具有明显的有益效果,从以上技术方案可知:本发明的洛克米兰醇酚羟基衍生物的制备方法,以2-羟基-2,4-甲氧基-苯甲酮和对苄氧基苯甲醛为原料,在氢氧化钾的作用下得到查尔酮,进一步经过碘和吡啶关环,得到中间体3,其在过一硫酸氢钾复合盐的作用下被氧化为中间体4,中间体4与肉桂酸甲酯在氙灯光照下发生光催化[3+2]反应得到互变中间体5/6,中间体5/6在甲醇的甲醇钠溶液中发生类似频哪醇重排得到中间体7,中间体7在氯化锂作用下脱去甲氧基得到中间体8,其经过三乙酰氧基硼氢化钠还原得到中间体9,中间体9在氢氧化钯和氢气作用下脱去苄基得到活性先导物4'-脱甲氧基洛克米兰醇10。4'-脱甲氧基洛克米兰醇10在不同酰化剂或者溴取代物作用下,得到不同结构的4'-脱甲氧基洛克米兰醇衍生物。本发明化合物具有纳摩尔级的抗结直肠癌、抗白血病的活性,通过抑制mapk信号通路进而诱导结直肠细胞调亡与细胞周期阻滞。用作药物时,可以直接使用,或者以药物组合物的形式使用。
附图说明
图1a为化合物11k对hct116肿瘤细胞处理48小时的周期影响图;
图1b为化合物11k对hct116肿瘤细胞的不同阶段的百分比图;
图2a为化合物11k诱导hct116肿瘤细胞凋亡图;
图2b为化合物11k诱导肿瘤细胞凋亡的柱状统计图;
图3a为化合物11k对相关凋亡蛋白的影响图;
图3b为化合物11k对mapk信号通路关键蛋白的影响图;
具体实施方式:
下面用本发明的实施例来进一步说明本发明的实质性内容,但并不以此来限定本发明。
实施例1:目标化合物11a的制备方法,包括以下步骤:
(1)关键中间体3合成制备
反应试剂与条件为:(a)乙醇,氢氧化钾,水;(b)吡啶,碘;
称取1.31g的2-羟基-4,6-二甲氧基苯乙酮(1)(6.68mmol)和1.42g的4-苄氧基苯甲醛(2)(6.68mmol),置于100ml的圆底烧瓶中,加入25ml的无水乙醇,常温下搅拌5min。再称取560mg的koh,加入10ml的水使其溶解。最后将配置好的koh溶液缓慢加入圆底烧瓶中,之后将圆底烧瓶置于50℃的恒温油浴锅中搅拌8h。薄层硅胶色谱监测,反应完毕。然后将反应体系降至0℃,用稀盐酸将溶液体系调至ph=2,有大量的黄色固体析出,过滤得到固体2.1g。称取5g的固体于250ml的圆底烧瓶中,加入100ml的吡啶,在常温下搅拌溶解,再加入300mg的碘。然后将圆底烧瓶置于120℃的恒温油浴锅中加热回流过夜。薄层硅胶色谱监测,在365nm条件下有亮蓝色的斑点即为目标点,待反应完毕。加入100ml的饱和硫代硫酸钠溶液淬灭反应,用乙酸乙酯进行萃取,饱和氯化钠溶液洗涤,无水硫酸钠干燥,浓缩得到反应物。再进行硅胶拌样,用二氯甲烷:乙酸乙酯=17:3混合溶剂体系,进行快速正相柱层析得到黄色固体2.3g,为中间体3,产率46.3%。
(2)关键中间体4合成制备
反应试剂与条件为:二氯甲烷,丙酮,碳酸钠,碳酸氢钠;过一硫酸氢钾复合盐,对甲苯磺酸
称取700mg的化合物3(2.24mmol),加入1000ml的圆底烧瓶中,然后分别加入80ml二氯甲烷和60ml丙酮,置于常温搅拌器上进行搅拌溶解,然后配置缓冲液200ml(16g碳酸钠、7.6g碳酸氢钠、200ml水),在圆底烧瓶中加入配置好的缓冲液,进行搅拌30分钟。称取过一硫酸氢钾复合盐12g,加入140ml水进行超声溶解。在圆底烧瓶上放置滴液漏斗,加入140ml的盐溶液,进行缓慢滴加,约5-7秒每滴。待盐溶液滴加完之后,用ph试纸对反应液进行检测,使反应体系ph=9。进行搅拌过夜,薄层硅胶色谱进行监测。继续配置140ml的过一硫酸氢钾复合盐溶液,重复进行滴加,待盐溶液滴加完之后,用ph试纸对反应液进行检测,用饱和碳酸钠水溶液调至ph=9。再次进行搅拌过夜,薄层硅胶色谱监测。继续重复前面实验步骤。之后关掉常温搅拌器,静置大约30min。分离得到二氯甲烷层,浓缩有机层,得到少部分的浓缩液,加入一水合对甲苯磺酸调ph=3,室温下搅拌2h。薄层硅胶色谱监测,然后进行拌样。用氯仿:甲醇=50:1,进行快速正相硅胶柱纯化,得到黄色固体350mg,中间体4的产率为50%。
(3)关键中间体5与6的合成制备
反应试剂与条件为:反式肉桂酸甲酯,氙气灯
中间体5/6的合成:称取800mg的中间体4(2.44mmol)于250ml的圆底烧瓶中,加入40ml乙腈和30ml甲醇进行搅拌溶解。再加入反式肉桂酸甲酯5.0g,室温下进行搅拌溶解。使用隔膜泵对其进行氩气(ar)脱气保护,进行多次换气,确保圆底烧瓶内全部充满氩气。将圆底烧瓶置于0℃的低温恒温搅拌器中进行搅拌。之后用氙气灯进行强光照射反应。在0℃条件下搅拌17-20h后,薄层硅胶色谱检测反应,待原料点反应完之后。减压浓缩溶剂得到中间体5/6,直接下一步备用。
(4)关键中间体7的合成制备
反应试剂与条件为:甲醇,甲醇钠;
直接将上一步反应过后的混合物中间体5/6,加入30ml的甲醇溶解,在室温条件下搅拌,缓慢加入10ml浓度为0.5m甲醇钠的甲醇溶液,然后将体系置于70℃条件下,油浴回流4h。薄层硅胶色谱监测反应,待反应完全后,冷却体系至室温,加入20ml的饱和氯化铵溶液淬灭反应,再加入100ml的水。用乙酸乙酯萃取3次,饱和氯化钠水溶液洗涤,无水硫酸钠干燥。之后进行快速柱层析纯化。用氯仿:丙酮9:1的混合溶剂洗脱,得到棕色油状物920mg,产率76.9%。
(5)关键中间体8的合成制备
反应试剂与条件:二甲基亚砜,氯化锂,水;
称取2g的中间体7(0.0035mol)于250ml的圆底烧瓶中,加入100ml的dmso溶解。然后加入170mg的氯化锂(1.1当量),再加入2ml的水在室温条件下搅拌30min,之后将圆底烧瓶置于100℃的恒温油浴锅中加热过夜。薄层硅胶色谱进行反应监测,待反应完成。将反应体系冷却至室温,加入100ml的水,用乙酸乙酯进行萃取,饱和氯化钠溶液洗涤,无水硫酸钠干燥,浓缩得到有机层。用石油醚:乙酸乙酯=7:3的混合溶剂进行快速正相柱层析得到黄色固体820mg,产率46.1%。结构及数据如下:
4'-苄氧基洛克米兰醇-1-酮(8).1hnmr(600mhz,cdcl3)δ(ppm):7.39–7.34(m,4h),7.33–7.29(m,1h),7.09–7.12(m,3h),6.96(m,2h),6.93(m,2h),6.75(m,2h),6.34(d,j=2.0hz,1h),6.11(d,j=2.0hz,1h),4.96(s,2h),3.89(dd,j=12.4,9.9hz,1h),3.85(s,3h),3.83(s,3h),3.04(dd,j=17.0,9.9hz,1h),2.98(dd,j=17.0,12.4hz,1h).13cnmr(150mhz,cdcl3)δ210.9,164.9,161.3,158.6,158.1,137.3,137.0,128.6,128.6,128.1,128.1,128.0,128.0,128.0,128.0,127.6,127.6,127.0,126.3,114.2,114.2,106.6,101.4,92.8,89.8,88.9,69.9,55.9,55.7,48.8,40.0,31.01,29.4.hrms(esi):m/zcalcd.forc32h28o6na[m+na]+531.1776,found531.1778。
(6)关键中间体9的合成制备
反应试剂与条件:三乙酰氧基硼氢化钠,乙酸,乙腈;
称取3.27g的三乙酰氧基硼氢化钠(9.0当量)于250ml的圆底烧瓶中,加入200ml乙腈和1.2ml冰乙酸,室温下搅拌20min。用90ml乙腈将700mg的中间体8(1.38mmol)进行溶解,然后缓慢滴加至反应体系,搅拌30min后,将圆底烧瓶置于40℃的恒温油浴锅中加热。薄层硅胶色谱监测,待反应完成。在反应体系中加入30ml的饱和氯化铵溶液淬灭反应,再加入100ml的水,用乙酸乙酯进行萃取,饱和氯化钠溶液洗涤,无水硫酸钠干燥,浓缩得到反应物。用石油醚:乙酸乙酯=1:0.5的混合溶剂进行正相柱层析,得到白色固体420mg,产率65%。
4'-苄氧基洛克米兰醇(9).1hnmr(600mhz,cdcl3)δ(ppm):7.36(m,4h),7.31(m,1h),7.13–7.07(m,5h),6.99(m,2h),6.75(m,2h),6.28(d,j=2.0hz,1h),6.15(d,j=2.0hz,1h),4.96(s,2h),4.82(d,j=6.2hz,1h),4.00(dd,j=14.0,6.5hz,1h),3.90(s,3h),3.84(s,3h),3.31(s,1h),2.74(td,j=14.0,6.5hz,1h),2.20(dd,j=14.0,6.5hz,1h),1.71(s,1h).3cnmr(150mhz,cdcl3)δ(ppm):δ164.1,161.1,158.0,157.2,138.8,137.0,129.1,129.1,128.7,128.7,128.3,128.3,128.1,127.8,127.8,127.6,127.6,127.3,126.4,113.8,113.8,107.9,103.7,95.0,92.6,89.5,79.2,69.9,55.9,55.8,53.4,36.6.hrms(esi):m/zcalcd.forc32h30o6na[m+na]+533.1931,found533.1935。
(7)关键中间体10的合成制备
反应试剂与条件:乙醇,氢氧化钯,氢气。
中间体10的合成:称取500mg的中间体9(0.98mmol)于100ml的圆底烧瓶中,加入30ml无水乙醇,再称取5mg的pd(oh)2。然后用氢气进行真空脱气2-3次,薄层硅胶色谱监测,大约3-4h反应完毕。加入100ml的水,用乙酸乙酯进行萃取,饱和氯化钠溶液洗涤,无水硫酸钠干燥,浓缩得到有机层。用石油醚:乙酸乙酯=1:1.5的混合溶剂,进行正相柱层析得到白色固体380mg,产率92.3%。
4'-脱甲基洛克米兰醇(10).1hnmr(600mhz,dmso-d6)δ(ppm):9.03(1h,s),7.08(2h,m),7.02(1h,t,j=7.5hz),6.97(2h,m),6.89(2h,m),6.42(2h,m),6.24(1h,d,j=1.9hz),6.11(1h,d,j=1.9hz),4.74(1h,s),4.47(1h,t,j=4.6hz),4.38(1h,d,j=3.3hz),3.85(1h,dd,j=13.6,6.1hz),3.77(3h,s),3.76(3h,s),2.63(1h,td,j=13.6,5.4hz),1.94(1h,dd,j=13.0,6.1hz).13cnmr(150mhz,dmso-d6)δ(ppm):163.0,160.9,158.2,155.9,140.1,129.1,129.1,128.4,128.4,127.9,127.9,127.5,126.2,126.2,113.8,109.3,103.1,94.6,92.2,88.9,78.0,55.9,55.9,53.4,37.6.esi-ms:m/z443.0[m+na]+hrms(esi):m/zcalcd.forc25h24o6na[m+na]+443.1465,found443.1460。
(8)目标化合物11a的制备
反应试剂与条件:(a)碘甲烷,丙酮,碳酸钾;
称取30mg的中间体10(0.071mmol)于15ml的圆底烧瓶中,加入5ml的丙酮溶液,再加入69mg的碳酸钾(7.0当量),常温下搅拌30min。然后再加入1.5当量的碘甲烷,之后将圆底烧瓶置于70℃的恒温油浴锅中,加热回流。薄层硅胶色谱进行反应监测,大概12h反应完成。加入20ml的水,用乙酸乙酯进行萃取,饱和氯化钠溶液洗涤,无水硫酸钠干燥,浓缩得到有机层,直接进行薄层色谱制备得到目标化合物11a,产率为69.2%。
洛克米兰醇(11a).1hnmr(400mhz,cdcl3)δ(ppm):7.13-7.07(5h,m),6.99(2h,d,j=7.1hz),6.69-6.66(2h,m),6.29(1h,d,j=1.9hz),6.14(1h,d,j=1.9hz),4.81(1h,d,j=6.3hz),4.00(1h,dd,j=14.1,6.3hz),3.90(3h,s),3.84(3h,s),3.71(3h,s),3.30(1h,s),2.74(1h,td,j=14.0,6.5hz),2.20(1h,dd,j=14.0,6.9hz),1.72(1h,s).13cnmr(100mhz,cdcl3)δ(ppm):163.9,161.0,158.6,157.0,138.7,128.9,128.9,128.1,128.1,127.6,126.8,126.2,112.7,107.7,103.5,94.8,92.4,89.4,79.0,55.8,55.6,55.0,53.2,36.4.esi-ms:m/z457.0[m+na]+hrms(esi):m/zcalcd.forc26h26o6na[m+na]+457.1622,found457.1613。
实施例2:目标化合物11b的制备
参考上述目标化合物11a的制备方法,将碘甲烷换成溴乙烷,制备得目标化合物11b,产率57.2%。
4'-乙基洛克米兰醇(11b).1hnmr(400mhz,cdcl3)δ(ppm):7.12–7.06(5h,m),6.98(2h,d,j=7.1hz),6.66(2h,d,j=7.1hz),6.27(1h,d,j=2.0hz),6.13(1h,d,j=2.0hz),4.80(1h,d,j=6.2hz),3.98(1h,dd,j=14.0,6.4hz),3.92(2h,q,j=13.8,6.7hz),3.89(3h,s),3.83(3h,s),3.34(1h,s),2.73(1h,td,j=13.8,6.3hz),2.19(1h,d,j=7.2hz),1.82(1h,s),1.34(3h,t,j=7.0hz).13cnmr(100mhz,cdcl3)δ(ppm):163.8,160.9,157.9,157.0,138.7,128.9,128.9,128.1,128.1,127.6,127.6,126.6,126.2,113.2,113.2,107.8,103.5,94.8,92.4,89.4,79.0,63.2,55.7,55.6,53.2,36.4,14.7.esi-ms:m/z471.0[m+na]+hrms(esi):m/zcalcd.forc27h28o6na[m+na]+471.1778,found471.1779。
实施例3:目标化合物11c的制备
参考上述目标化合物11a的制备方法,将碘甲烷换成溴丙烷,制备得目标化合物11c,产率57.2%。
4'-丙烷基洛克米兰醇(11c).1hnmr(400mhz,cdcl3)δ(ppm):7.09-7.04(5h,m),6.96(2h,d,j=7.3hz),6.64(2h,d,j=7.3hz),6.25(1h,d,j=1.9hz),6.10(1h,d,j=1.9hz),4.77(1h,d,j=6.3hz),3.95(1h,dd,j=14.2,6.4hz),3.85(3h,s),3.79(3h,s),3.78(2h,q,j=14.5,6.7hz),3.31(1h,s),2.70(1h,td,j=13.9,6.2hz),2.16(1h,dd,j=13.4,6.7hz),1.78(1h,s),1.70(2h,q,j=7.1hz),0.95(3h,t,j=7.4hz).13cnmr(100mhz,cdcl3)δ(ppm):163.8,160.9,158.1,157.0,138.7,128.9,128.9,128.1,128.1,127.6,126.5,126.2,113.3,113.3,107.8,103.5,94.8,92.4,89.3,79.0,69.2,55.7,55.6,53.2,36.4,22.5,10.5.esi-ms:m/z485.0[m+na]+hrms(esi):m/zcalcd.forc28h30o6na[m+na]+485.1935,found485.1934。
实施例4:目标化合物11d的制备
参考上述目标化合物11a的制备方法,将碘甲烷换成溴丁烷,制备得目标化合物11d,产率59%。
4'-丁烷基洛克米兰醇(11d).1hnmr(400mhz,cdcl3)δ(ppm):7.10(5h,m),6.99(2h,d,j=7.4hz),6.67(2h,d,j=7.4hz),6.28(1h,d,j=2.0hz),6.14(1h,d,j=2.0hz),4.80(1h,d,j=6.3hz),3.98(1h,dd,j=14.1,6.4hz),3.89(3h,s),3.86(2h,d,j=6.5hz),3.83(3h,s),3.34(1h,s),2.73(1h,td,j=13.9,6.4hz),2.20(1h,d,j=6.6hz),1.76(1h,s),1.73–1.66(2h,m),1.48-1.39(2h,m),0.94(3h,t,j=7.4hz).13cnmr(100mhz,cdcl3)δ(ppm):164.0,161.1,158.3,157.1,138.8,129.0,129.0,128.2,128.2,127.8,127.8,126.6,126.4,113.4,113.4,107.9,103.7,94.9,92.5,89.5,79.1,67.6,55.9,55.8,53.3,36.5,31.4,19.3,14.0.esi-ms:m/z477.0[m+h]+hrms(esi):m/zcalcd.forc29h32o6na[m+na]+499.2091,found499.2088。
实施例5:目标化合物11e的制备
参考上述目标化合物11a的制备方法,将碘甲烷换成溴戊烷,制备得目标化合物11e,产率63%。
4'-戊烷基洛克米兰醇(11e).1hnmr(400mhz,cdcl3)δ(ppm):7.13–7.07(5h,m),6.99(2h,d,j=7.0hz),6.67(2h,d,j=7.0hz),6.28(1h,d,j=2.0hz),6.14(1h,d,j=2.0hz),4.80(1h,d,j=6.2hz),3.99(1h,dd,j=14.0,6.5hz),3.89(3h,s),3.84(2h,q,11.5,j=6.6hz),3.83(3h,s),3.32(1h,s),2.73(1h,td,j=13.9,6.4hz),2.23–2.17(1h,m),1.79(1h,s),1.71(2h,m),1.42-1.32(4h,m),0.91(3h,t,j=7.0hz).13cnmr(100mhz,cdcl3)δ(ppm):164.0,161.1,158.3,157.2,138.8,129.0,129.0,128.2,128.2,127.8,127.8,126.7,126.4,113.4,113.4,108.0,103.7,94.9,92.55,89.5,79.2,67.9,55.9,55.8,53.3,36.5,29.0,28.3,22.6,14.1.esi-ms:m/z511.1[m+na]+hrms(esi):m/zcalcd.forc30h32o6na[m+na]+511.2091,found511.2094。
实施例6:目标化合物11f的制备
参考上述目标化合物11a的制备方法,将碘甲烷换成溴己烷,制备得目标化合物11f,产率68%。
4'-己烷基洛克米兰醇(11f).1hnmr(400mhz,cdcl3)δ(ppm):7.09(5h,m),6.99(2h,m),6.66(2h,m),6.28(1h,d,j=1.7hz),6.13(1h,d,j=1.7hz),4.80(1h,d,j=6.2hz),3.98(1h,dd,j=14.1,6.5hz),3.88(3h,s),3.84(2h,q,j=11.0,6.7hz),3.83(3h,s),3.32(1h,s),2.73(1h,td,j=14.1,6.6hz),2.18(1h,dd,j=12.8,6.7hz),1.73–1.68(2h,m),1.36-1.43(2h,m),1.28-1.32(4h,m),0.88(3h,t,j=6.5hz).13cnmr(100mhz,cdcl3)δ(ppm):163.8,161.0,158.1,157.0,138.7,128.8,128.1,127.6,126.5,126.2,113.3,107.8,103.5,94.8,92.4,89.4,79.0,67.8,55.7,55.6,53.2,36.4,31.5,29.1,25.6,22.5,14.0.esi-ms:m/z527.2[m+na]+hrms(esi):m/zcalcd.forc31h36o6na[m+na]+527.2404,found527.2404。
实施例7:目标化合物11g的制备
参考上述目标化合物11a的制备方法,将碘甲烷换成1,5-二溴戊烷,制备得目标化合物11f,产率65%。
4'-(5-溴戊烷基)洛克米兰醇(11g).1hnmr(600mhz,cdcl3)δ(ppm):7.12–7.06(5h,m),6.99(2h,m),6.66(2h,m),6.28(1h,d,j=2.0hz),6.14(1h,d,j=2.0hz),4.80(1h,d,j=6.2hz),3.99(1h,dd,j=14.1,6.5hz),3.89(3h,s),3.86(2h,t,j=6.3hz),3.83(3h,s),3.41(2h,t,j=6.8hz),3.31(1h,s),2.73(1h,td,j=13.4,5.9hz),2.19(1h,dd,j=14.0,7.0hz),1.92–1.87(2h,m),1.75–1.71(2h,m),1.59–1.55(2h,m).13cnmr(150mhz,cdcl3)δ(ppm):164.0,161.1,158.1,157.2,138.8,129.1,129.1,128.3,128.3,127.8,127.8,126.9,126.4,113.4,113.4,107.9,103.7,95.0,92.6,89.5,79.2,67.5,55.9,55.8,53.3,36.5,33.7,32.6,28.5,24.9.esi-ms:m/z591.0[m+na]+hrms(esi):m/zcalcd.forc30h33o6brna[m+na]+591.1353,found591.1348。
实施例8:目标化合物11h的制备
参考上述目标化合物11a的制备方法,将碘甲烷换成烯丙基溴,制备得目标化合物11h,产率85%。
4'-烯丙基洛克米兰醇(11h).1hnmr(600mhz,cdcl3)δ(ppm):7.13–7.06(5h,m),6.98(2h,m),6.69(2h,m),6.28(1h,d,j=1.9hz),6.14(1h,d,j=1.9hz),6.05–5.93(1h,m),5.34(1h,dd,j=17.3,1.6hz),5.24(1h,dd,j=10.5,1.4hz),4.81(1h,d,j=5.1hz),4.43(2h,d,j=5.4hz),3.99(1h,dd,j=14.1,6.6hz),3.90(3h,s),3.83(3h,s),3.32(1h,s),2.73(1h,td,j=13.8,6.4hz),2.18(1h,dd,j=13.6,6.5hz).13cnmr(150mhz,cdcl3)δ(ppm):164.0,161.0,157.7,157.1,138.7,133.2,129.0,129.0,128.1,128.1,127.7,127.7,127.0,126.3,117.6,113.6,113.6,107.8,103.5,94.9,92.5,89.4,79.1,68.6,55.8,55.7,53.3,36.4.esi-ms:m/z483.0[m+na]+hrms(esi):m/zcalcd.forc28h28o6na[m+na]+483.1778,found483.1774。
实施例9:目标化合物11i的制备
参考上述目标化合物11a的制备方法,将碘甲烷换成1-溴-3-甲基-2-丁烯,制备得目标化合物11i,产率76%。
4'-(3-甲基-2-丁烯基)洛克米兰醇(11i).1hnmr(400mhz,cdcl3)δ(ppm):7.12–7.07(5h,m),6.99(2h,m),6.69(2h,m),6.28(1h,d,j=1.9hz),6.13(1h,d,j=1.9hz),5.42(1h,t,j=6.7hz),4.80(1h,d,j=6.2hz),4.40(2h,m),3.99(1h,dd,j=14.1,6.6hz),3.89(3h,s),3.83(3h,s),3.32(1h,s),2.73(1h,td,j=13.9,6.4hz),2.18(1h,dd,j=13.8,7.0hz),1.76(3h,s),1.69(3h,s).13cnmr(100mhz,cdcl3)δ(ppm):164.0,161.1,158.0,157.1,138.8,138.1,129.0,128.2,127.8,126.8,126.4,119.7,113.6,107.9,103.7,94.9,92.5,89.5,79.2,64.7,55.9,55.8,53.3,36.5,25.9,18.3.esi-ms:m/z511.1[m+na]+hrms(esi):m/zcalcd.forc30h32o6na[m+na]+511.2091,found511.2094。
实施例10:目标化合物11j的制备
参考上述目标化合物11a的制备方法,将碘甲烷换成炔丙基溴,制备得目标化合物11j,产率72%。
4'-炔丙基洛克米兰醇(11j).1hnmr(600mhz,cdcl3)δ(ppm):7.13(2h,m),7.11–7.04(3h,m),6.97(2h,m),6.74(2h,m),6.28(1h,d,j=2.0hz),6.14(1h,d,j=2.0hz),4.81(1h,d,j=6.3hz),4.58(2h,m),3.99(1h,dd,j=14.0,6.5hz),3.90(3h,s),3.84(3h,s),3.31(1h,s),2.73(1h,td,j=14.0,6.3hz),2.47(1h,t,j=2.4hz),2.19(1h,dd,j=13.7,6.9hz),1.75(1h,s).13cnmr(150mhz,cdcl3)δ(ppm):164.1,161.1,157.2,156.8,138.7,129.1,129.1,128.2,128.2,128.0,127.8,127.8,126.4,113.8,113.8,107.9,103.6,95.0,92.6,89.5,79.2,78.6,75.6,55.9,55.8,55.8,53.4,36.5.esi-ms:m/z481.1[m+na]+hrms(esi):m/zcalcd.forc28h26o6na[m+na]+481.1622,found481.1616。
实施例11:目标化合物11k的制备
参考上述目标化合物11a的制备方法,将碘甲烷换成1-溴-2-丁炔,制备得目标化合物11k,产率78%。
4'-(2-丁炔基)洛克米兰醇(11k).1hnmr(600mhz,cdcl3)δ(ppm):7.13-7.06(5h,m),6.98(2h,m),6.73(2h,m),6.28(1h,d,j=1.9hz),6.14(1h,d,j=1.9hz),4.81(1h,d,j=6.3hz),4.54(2h,m),3.99(1h,dd,j=14.1,6.4hz),3.89(3h,s),3.83(3h,s),3.32(1h,s),2.73(1h,td,j=13.5,6.4hz),2.19(1h,dd,j=13.4,6.7hz),1.83(3h,s),1.76(1h,s).13cnmr(150mhz,cdcl3)δ(ppm):164.0,161.1,157.1,157.0,138.7,129.1,128.9,128.3,128.2,127.9,127.7,127.5,126.5,113.8,113.7,107.9,103.6,95.0,92.6,89.5,83.8,79.1,74.0,56.4,56.0,55.9,53.4,36.5,3.8.esi-ms:m/z495.1[m+na]+hrms(esi):m/zcalcd.forc29h28o6na[m+na]+495.1778,found495.1774。
实施例12:目标化合物11l的制备
反应试剂与条件:(a)氯乙酰氯,二氯甲烷,三乙氨;
称取30mg的中间体10(0.071mmol)于15ml的圆底烧瓶中,加入5ml的二氯甲烷溶液,再加入2当量的三乙氨,常温下搅拌10min。然后再加入1.5当量的氯乙酰氯,室温搅拌。薄层硅胶色谱进行反应监测,大概12h反应完成。然后冷却至室温,再加入20ml的水,用乙酸乙酯进行萃取,饱和氯化钠溶液洗涤,无水硫酸钠干燥,浓缩得到有机层,直接进行薄层制备色谱得到目标化合物11l,产率68.2%。
4'-乙酰洛克米兰醇(11l).1hnmr(600mhz,dmso-d6)δ(ppm):7.13(2h,m),7.08(2h,m),7.02(1h,t,j=7.3hz),6.99(2h,m),6.80(2h,m),6.27(1h,d,j=2.0hz),6.13(1h,d,j=2.0hz),5.04(1h,s),4.50(1h,t,j=4.4hz),4.47(1h,d,j=3.5hz),3.94(1h,dd,j=14.3,6.1hz),3.78(3h,s),3.76(3h,s),2.71(1h,dt,j=13.8,6.8hz),2.17(3h,s),1.99(1h,dd,j=12.6,6.5hz).13cnmr(150mhz,dmso-d6)δ(ppm):169.0,162.6,160.3,157.8,148.8,139.3,134.5,128.6,128.6,127.9,127.9,127.6,127.6,126.0,119.6,119.6,108.6,102.4,94.5,91.9,88.4,77.5,55.5,55.4,53.2,37.3,20.8.esi-ms:m/z485.1[m+na]+hrms(esi):m/zcalcd.forc27h26o7na[m+na]+485.1571,found485.1566。
实施例13:目标化合物11m的制备
参考上述目标化合物11l的制备方法,将氯乙酰氯换成氯丙酰氯,制备得目标化合物11m,产率45%。
4'-丙酰洛克米兰醇(11m).1hnmr(400mhz,cd3od)δ(ppm):7.23(2h,m),7.09–6.99(5h,m),6.80(2h,m),6.30(1h,d,j=2.0hz),6.20(1h,d,j=2.0hz),4.71(1h,d,j=5.7hz),4.00(1h,dd,j=14.2,6.4hz),3.86(3h,s),3.82(3h,s),2.81(1h,td,j=13.9,6.0hz),2.52(2h,q,j=7.5hz),2.10(1h,dd,j=13.6,6.4hz),1.17(3h,t,j=7.5hz).13cnmr(100mhz,cd3od)δ(ppm):174.7,165.2,162.1,159.2,150.9,140.2,135.2,130.2,130.2,129.2,129.2,128.7,128.7,127.2,120.8,120.8,109.2,104.1,96.1,93.1,90.0,79.9,56.1,56.1,54.8,37.8,28.3,9.3.esi-ms:m/z499.1[m+na]+hrms(esi):m/zcalcd.forc28h28o7na[m+na]+499.1727,found499.1721。
实施例14:目标化合物11n的制备
参考上述目标化合物11l的制备方法,将氯乙酰氯换成氯己酰氯,制备得目标化合物11n,产率55%。
4'-己酰洛克米兰醇(11n).1hnmr(400mhz,cdcl3)δ(ppm):7.21(2h,m),7.09(3h,m),6.95(2h,m),6.86(2h,m),6.28(1h,d,j=2.0hz),6.14(1h,d,j=2.0hz),4.83(1h,d,j=6.2hz),3.99(1h,dd,j=14.0,6.5hz),3.89(3h,s),3.83(3h,s),3.37(1h,s),2.73(1h,td,j=13.8,6.3hz),2.48(2h,t,j=7.5hz),2.17(1h,dd,j=13.6,6.5hz),1.70(2h,t,j=7.4hz),1.36(4h,m),0.91(3h,t,j=6.9hz).13cnmr(100mhz,cdcl3)δ(ppm):172.2,164.1,160.9,157.1,150.0,138.4,132.5,129.0,129.0,128.2,128.2,127.8,127.8,126.6,120.4,120.4,107.8,103.4,95.0,92.7,89.6,79.3,55.9,55.8,53.6,36.4,34.4,31.4,24.7,22.4,14.0.esi-ms:m/z541.2[m+na]+hrms(esi):m/zcalcd.forc31h34o7na[m+na]+543.2197,found541.2190。
实施例15:目标化合物11o的制备
参考上述目标化合物11l的制备方法,将氯乙酰氯换成苯甲酰氯,制备得目标化合物11o,产率53%。
4'-苯甲酰基洛克米兰醇(11o).1hnmr(400mhz,cdcl3)δ(ppm):8.12(2h,m),7.59(1h,m),7.47(2h,m),7.24(2h,m),7.09(3h,m),7.00–6.94(4h,m),6.27(1h,d,j=1.9hz),6.12(1h,d,j=1.9hz),4.82(1h,d,j=6.2hz),3.99(1h,dd,j=14.0,6.5hz),3.87(3h,s),3.81(3h,s),3.38(1h,s),2.73(1h,td,j=13.9,6.4hz),2.17(1h,dd,j=14.6,6.6hz).13cnmr(100mhz,cdcl3)δ(ppm):165.1,164.1,160.9,157.1,150.1,138.4,133.7,132.7,130.2,130.2,129.6,129.1,129.1,128.7,128.7,128.2,128.2,127.9,127.9,126.6,120.5,120.5,107.8,103.4,95.1,92.7,89.5,79.3,55.9,55.8,53.6,36.4.esi-ms:m/z547.0[m+na]+hrms(esi):m/zcalcd.forc32h28o7na[m+na]+547.1727,found547.1721。
实施例16:目标化合物11p的制备
参考上述目标化合物11l的制备方法,将氯乙酰氯换成对硝基苯甲酰氯,制备得目标化合物11p,产率65%。
4'-对硝基苯甲酰基洛克米兰醇(11p).1hnmr(600mhz,dmso-d6)δ(ppm):8.72(1h,m),8.55(1h,m),8.48(1h,m),7.88(1h,t,j=8.0hz),7.21(2h,m),7.12(2h,m),7.06–7.02(5h,m),6.29(1h,d,j=2.0hz),6.14(1h,d,j=2.0hz),5.09(1h,s),4.53–4.49(2h,m),3.98(1h,dd,j=14.4,6.1hz),3.79(3h,s),3.77(3h,s),2.75(1h,td,j=13.7,5.0hz),2.03(1h,dd,j=12.9,6.2hz).13cnmr(150mhz,dmso-d6)δ(ppm):162.7,162.6,160.3,157.8,148.6,148.0,139.3,135.8,135.3,130.9,130.7,128.7,128.7,128.3,127.9,127.9,127.7,127.7,126.0,124.1,119.6,119.6,108.59,102.4,94.6,91.9,88.4,77.4,55.5,55.4,53.2,37.4.esi-ms:m/z592.7[m+na]+hrms(esi):m/zcalcd.forc32h27o9nna[m+na]+592.1578,found592.1567。
实施例17:目标化合物11q的制备
参考上述目标化合物11l的制备方法,将氯乙酰氯换成乙磺酰氯,制备得目标化合物11q,产率65%。
4'-乙基磺酰基洛克米兰醇(11q).1hnmr(600mhz,cdcl3-cd3od)δ(ppm):7.20(2h,m),7.01(3h,m),6.96(2h,m),6.86(2h,m),6.23(1h,d,j=2.0hz),6.10(1h,d,j=2.0hz),4.76(1h,dd,j=6.5,1.6hz),3.91(1h,dd,j=13.8,6.5hz),3.84(3h,s),3.78(3h,s),3.11(2h,q,j=7.4hz),2.65(1h,td,j=13.8,6.5hz),2.07(1h,dd,j=13.7,6.6hz),1.39(3h,t,j=7.4hz).13cnmr(150mhz,cdcl3)δ(ppm):163.9,160.6,157.0,148.0,138.2,134.8,129.5,129.5,128.0,128.0,127.7,127.7,126.5,120.3,120.3,107.8,102.9,94.6,92.6,89.4,79.2,55.8,55.7,53.5,44.8,35.9,8.1.esi-ms:m/z535.2.1[m+na]+hrms(esi):m/zcalcd.forc27h28o8sna[m+na]+535.1397,found535.1393。
实施例18:目标化合物11r的制备
参考上述目标化合物11l的制备方法,将氯乙酰氯换成丙磺酰氯,制备得目标化合物11r,产率78%。
4'-丙基磺酰基洛克米兰醇(11r).1hnmr(400mhz,cdcl3)δ(ppm):7.24(2h,m),7.07(3h,m),7.02(2h,m),6.90(2h,m),6.27(1h,d,j=1.9hz),6.14(1h,d,j=1.9hz),4.82(1h,d,j=6.2hz),3.97(1h,dd,j=13.9,6.5hz),3.89(3h,s),3.83(3h,s),3.43(1h,s),3.38(1h,s),3.07(2h,m),2.69(1h,td,j=14.0,6.4hz),2.13(1h,dd,j=13.8,6.6hz),1.95-1.90(2h,m),1.06(3h,t,j=7.4hz).13cnmr(100mhz,cdcl3)δ(ppm):164.1,160.7,157.0,148.3,138.2,134.4,129.5,128.1,127.8,126.6,120.6,107.6,103.2,94.9,92.7,89.5,79.3,55.9,55.8,53.7,51.8,36.1,17.3,12.9.esi-ms:m/z549.3[m+na]+hrms(esi):m/zcalcd.forc28h30o8sna[m+na]+549.1554,found549.1548。
实施例19:目标化合物11s的制备
参考上述目标化合物11l的制备方法,将氯乙酰氯换成苯磺酰氯,制备得目标化合物11s,产率75%。
4'-苯磺酰基洛克米兰醇(11s).1hnmr(400mhz,cdcl3)δ(ppm):7.69–7.61(3h,m),7.46(2h,m),7.15–7.08(5h,m),6.91(2h,m),6.71(2h,m),6.26(1h,d,j=2.0hz),6.14(1h,d,j=2.0hz),4.80(1h,d,j=6.3hz),3.98(1h,dd,j=14.0,6.6hz),3.90(3h,s),3.83(3h,s),3.30(1h,s),2.68(1h,td,j=14.0,6.3hz),2.13(1h,d,j=7.0hz),1.75(1h,s).13cnmr(100mhz,cdcl3)δ(ppm):164.2,160.7,157.0,148.6,138.2,135.2,134.4,134.3,129.2,129.1,129.1,128.6,128.6,128.1,128.1,127.8,127.8,127.8,126.6,121.2,121.2,107.6,103.3,95.0,92.8,89.5,79.2,56.0,55.8,53.7,36.3.esi-ms:m/z583.2[m+na]+hrms(esi):m/zcalcd.forc31h28o8sna[m+na]+583.1397,found583.1389。
试验例1:体外抗肿瘤活性筛选
细胞株:人红白细胞白血病细胞株(hel)、结直肠癌干细胞(p6c)、人结肠癌细胞(hct116)。
实验原理:采用mtt比色法进行检测。mtt全称3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-di-phenytetrazoliumromide,是一种黄颜色的染料。活细胞线粒体中琥珀酸脱氢酶能够还原mtt,并且在细胞色素c的作用下,可以生成蓝色(或蓝紫色)不溶于水的甲臜(formazan),用酶标仪在490nm处进行测定甲臜的含量。在一般情况下,甲臜的生成量与活细胞数成正相关,所以活细胞的数量可根据光密度od值推测出。
实验方法:将对数生长期细胞以6×103/孔的细胞接种于96孔板,置于37℃,5%co2细胞培养箱培养16h,观察细胞状态良好达到对数生长期时,加入不同浓度梯度的化合物继续培养,以阿霉素作为阳性对照。37℃,5%co2培养72h后,加入20μl/孔mtt(5mg/ml),继续培养4h,将96孔板2500r/min离心15min,弃去上清,加入160μl/孔dmso,置于37℃摇床避光低速摇15min,使沉淀充分溶解。
比色:使用多功能酶标仪测定od值。将吸收波长调至490nm,对96孔板板的每个孔的光吸收值进行测定和记录。然后进行各个孔的抑制率计算,再进行ic50值的测定。
实验结果:合成的20个化合物对hel、p6c和hct116三个细胞系进行体外抗肿瘤活性筛选评估,以阿霉素作为阳性对照组,结果以ic50值进行表示(见表1)。结构显示大多数化合物活性比阳性对照阿霉素具有更好的抗肿瘤活性。
表1.洛克米兰醇衍生物体外抗肿瘤活性
a数据以三个独立实验的平均值±标准差表示
试验例2:抗肿瘤作用机制初步研究
1.化合物11k对细胞周期的作用
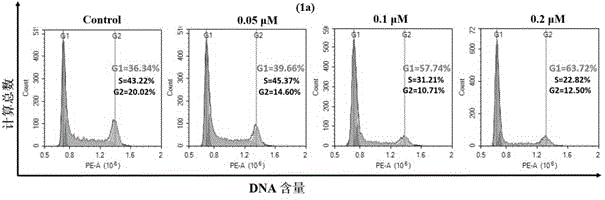
不同浓度的化合物11k(0.05μm,0.1μm和0.2μm),按照下述实验步骤处理hct116肿瘤细胞,结果显示此化合物可以剂量依赖性的阻滞hct116肿瘤细胞于g1期。
化合物11k对hct116肿瘤细胞的周期影响的具体实验步骤如下:
(1)处理样本和收集细胞:取对数生长期的细胞,以3.5×104/ml的浓度接种于接种60mm培养皿中,每个培养皿3ml,放置于37℃,5%co2细胞孵育箱中24h后,将细胞分为不同时间组,每个时间组分为对照组和不同浓度样品干预组,对照组为0.1%dmso。将各组细胞放置于37℃,5%co2细胞孵育箱中24h、48h后收集细胞;
(2)固定:收集细胞培养基,用预冷后的pbs洗细胞,加入1.5ml不含edta的胰酶,进行消化大约3min,观察细胞开始松动,用微量移液枪轻吹细胞,收集细胞悬液,再用1.5mlpbs洗培养皿并收集。用离心机进行1000r/min离心3min,弃去上清液,再用pbs洗细胞,继续1000r/min,离心3min,弃去上清液,加入500μl预冷的75%乙醇,-20℃过夜固定;
(3)染色:在进行染色之前,首先用pbs洗2次,弃去上清液,然后加入500μl用pbs配的染色液(0.05%triton、0.5%rnaase和5%pi),进行避光37℃孵育30min;
(4)上机:用离心机将染色的细胞进行1000r/min,离心3min,弃去上清液,然后用300μlpbs重悬,过滤后上机。
实验结果如下:图(1a)为化合物11k对hct116肿瘤细胞处理48小时的周期影响图;11k阻止hct116细胞周期,细胞用不同浓度的化合物(0.05μm,0.1μm,和0.2μm)处理48小时。图(1b)为化合物11k对hct116肿瘤细胞的不同阶段的百分比图;每次实验至少重复三次,*p<0.05,**p<0.01,结果显示此化合物可以剂量依赖性的阻滞hct116肿瘤细胞于g1期。
2.化合物11k对细胞凋亡的作用
不同浓度的化合物11k(0.125μm,0.25μm和0.5μm),按照下述实验步骤处理hct116肿瘤细胞,结果显示此化合物可以剂量依赖性的诱导hct116肿瘤细胞调亡。
化合物诱导细胞的调亡作用
(1)处理样本和收集细胞:取对数生长期的细胞,以3.0×105/ml的浓度接种于60mm培养皿中,每皿3ml,放置于37℃,5%co2细胞孵育箱中24h后将细胞分为对照组和xy-29样品组,对照组为0.1%dmso组,样品组分别为0.125μm、0.25μm及0.5μm三组,将各组细胞置于细胞培养箱中孵育72h后收集各组细胞;
(2)收集细胞培养基,用pbs洗细胞,加入1.5ml不含edta的胰酶,消化3min,观察细胞开始松动,轻轻吹细胞,收集细胞悬液,再用1.5mlpbs洗培养皿并收集。1000r/min离心3min,弃上清,用pbs洗细胞,重复两次;
(3)染色:加入50μlbindingbuffer重悬细胞,移到流式管中,加药组每管加入碘化丙啶(propidiumiodide,pi)2.5μl/管、磷脂结合蛋白v(annexinv-fitc)2.5μl/管,轻轻混匀细胞,室温下避光孵育20min;
(4)上机:将染色细胞1000r/min离心3min,弃上清,每管加入50μl1×bindingbuffer,尽快进行流式细胞术分析;
图(2a)为化合物11k诱导hct116肿瘤细胞凋亡图;流式细胞仪分析不同浓度化合物11k(0.125μm,0.25μm和0.5m);图(2b)为化合物11k诱导肿瘤细胞凋亡的柱状统计图;每次实验至少重复三次,*p<0.05,**p<0.01与对照组比较。结果显示此化合物可以剂量依赖性的诱导hct116肿瘤细胞调亡。
3.化合物11k对相关细胞凋亡蛋白和mapk信号通路关键蛋白表达的影响
具体方法如下:将hct116细胞培养于1640培养基(由10%胎牛血清、100u/ml青霉素和100ug/ml链霉素组成),细胞置于37℃、5%co2饱和湿度培养箱中培养。取对数生长期的hel细胞接种于96孔培养板中,置于37℃、5%co2及饱和湿度条件下细胞培养箱中培养24h后,弃上清,分别加入浓度为0.125、0.25以及0.5μm的化合物11k,对照组加1.0%dmso。将96孔板置于37℃、5%co2培养箱培养48h后提取蛋白,测定蛋白浓度。配胶后将提取蛋白进行sds-page,转移至pvdf膜。使用抗体稀释液稀释一抗,4℃过夜孵育2h。使用tbst清洗膜3次,每次10分钟。不同的荧光二抗进行孵育,然后置于37℃温箱中孵育1h。荧光二抗孵育时应注意避光。使用tbst清洗膜3-5次,每次10分钟。最后进行检测。
图(3a)为化合物11k对相关凋亡蛋白的影响图;结果表明:β-actin作为内参蛋白,与对照组相比,随着化合物11k浓度升高,可明显使bcl-2家族中阻止细胞凋亡的bcl-2蛋白降低,而使bcl-2家族中促进凋亡的bax蛋白升高,由此表明化合物2诱导hct116细胞发生凋亡。此外,化合物11k可导致caspase3,caspase8和parp产生剪切带,说明caspase3,caspase8和parp被激活,从而诱导了细胞凋亡的发生。图(3b)为化合物11k对mapk信号通路关键蛋白的影响图;结果表明:gapdh作为内参蛋白,与对照组相比,随着化合物11k浓度升高,mapk信号通路中的关键磷酸化蛋白erk,jnk和p38发生明显变化,从而抑制了mapk信号通路。
以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,任何未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明技术方案的范围内。
- 还没有人留言评论。精彩留言会获得点赞!