基于与醇溶蛋白的互作在植物中积累目标蛋白的方法
1.本发明涉及生物技术领域中基于与醇溶蛋白的互作在植物中积累目标蛋白的方法。
背景技术:
2.随着工业和医疗对重组蛋白需求的持续扩大,转基因植物被认为是一种安全,高效和廉价的生产手段(ma et al.,2003)。与传统的表达系统(如酵母,昆虫和哺乳动物细胞培养)相比,转基因植物还具有无人类病原体污染,能够正确地折叠和组装多聚体蛋白质,以及具备直接口服未加工或部分加工的植物材料的潜力(fischer et al.,2004)。在过去的三十年间,转基因植物作为生物反应器在生产疫苗、抗体和工业用酶等方面展示了广泛的应用前景,例如使用植物平台生产各种抗体、疫苗抗原、蛋白质过敏原、酶和酶抑制剂、凝血因子、细胞因子和激素等(giddings et al.,2000;ma et al.,2005)。然而,利用植物平台生产重组蛋白面临的一个主要问题是:重组蛋白在植物中积累水平不足(doran,2006)。重组蛋白在异源环境中的表达具有天然的不固定性,同时也面临着细胞内普遍存在的蛋白降解过程。某些重组蛋白在细胞中没有明确的亚细胞定位,则很有可能进入细胞内蛋白降解途径(faye et al.,2005)。
3.对于重组蛋白在植物表达系统中的亚细胞定位的研究显示,重组蛋白在植物细胞中的亚细胞定位显著影响重组蛋白在细胞中的积累水平。而植物种子中天然的蛋白质储藏结构能够为重组蛋白的储藏提供屏障(conley et al.,2011)。在禾本科植物种子发育过程中,胚乳细胞中内质网的特定位置会自然积累大量的蛋白质,这些区域的内质网向外凸起,形成特殊的内质网衍生区室被称为蛋白体(shewry et al.,1995;herman and larkins,1999)。其中,对玉米胚乳细胞中蛋白体的研究较为深入。蛋白体是玉米胚乳细胞中重要的蛋白质储藏细胞器,蛋白体中的蛋白含量占细胞总蛋白含量60%左右。而且蛋白体高度的稳定,即便在成熟籽粒和储藏多年的籽粒中,蛋白体中储藏的蛋白也是高度完整的。因此玉米蛋白体是外源蛋白高表达、高积累的理想场所。在玉米胚乳细胞的蛋白体中,醇溶蛋白是最主要的储藏蛋白,占储藏蛋白总量的80%左右(shewry et al.,1995;herman and larkins,1999;fuji et al.,2007)。玉米醇溶蛋白主要包括α(19
‑
kd,22
‑
kd),β(14
‑
kd),γ(16
‑
kd,27
‑
kd和50
‑
kd)和δ(10
‑
kd,18
‑
kd)四类,其中α(19
‑
kd,22
‑
kd)类醇溶蛋白的含量最高(esen,1987;coleman andlarkins,1999;song andmessing,2002)。
4.在对蛋白体形成的研究中发现,27
‑
kdγ
‑
zein在蛋白体的发育过程中发挥重要作用(wu andmessing,2010;guo et al.,2013)。通过rnai技术抑制玉米胚乳中27
‑
kdγ
‑
zein的表达,导致细胞中蛋白体的数量显著降低。说明,27
‑
kdγ
‑
zein具有促进蛋白体形成的作用。进一步的研究发现,27
‑
kdγ
‑
zein不仅可以在玉米籽粒中诱导蛋白体的形成,在烟草种子、叶片和拟南芥叶片中都能够诱导蛋白体的形成(torrent et al.,2009;llop
‑
tous et al.,2010;mainieri et al.,2014)。通过序列分析显示,27
‑
kdγ
‑
zein的包含四个区域:a.包含19个氨基酸的信号肽,b.由8个ppvhl六肽重复序列组成的区域(53aa),c.富含脯氨酸
的pro
‑
x结构域(29aa),d.疏水的富含半胱氨酸的c端结构域(111a)。通过对27
‑
kdγ
‑
zein的驻留机制的研究发现,在27
‑
kdγ
‑
zein序列中不存在hdel组成的内质网驻留信号,27
‑
kdγ
‑
zein在内质网中的驻留和诱导蛋白体的形成都依赖于由区域a,b,c组成的结构,这一结构又被成为zera domain(torrent et al.,2009;llop
‑
tous et al.,2010;mainieri et al.,2014)。进一步的研究显示,在27
‑
kdγ
‑
zeinn端的两个半胱氨酸残基对于27
‑
kdγ
‑
zein的寡聚化至关重要,而27
‑
kdγ
‑
zein的的寡聚化被认为是蛋白体形成的第一步。
5.除了27
‑
kdγ
‑
zein,蛋白体中另一类重要的醇溶蛋白为α类醇溶蛋白(19
‑
kd,22
‑
kd),α
‑
zein负责蛋白体的填充(holding et al.,2007),是蛋白体中含量最高的醇溶蛋白类型。通过对α
‑
zein的研究发现,α
‑
zein本身不具有内质网驻留信号,在体外单独表达α
‑
zein也不能够诱导蛋白体的形成,说明α
‑
zein不具备诱导蛋白体形成的能力。kim等通过一系列醇溶蛋白互作研究发现,22
‑
kdα
‑
zein能够与其它类型的醇溶蛋白产生互作(kim et al.,2002)。coleman等在烟草中同时表达27
‑
kdγ
‑
zein和22
‑
kdα
‑
zein,22
‑
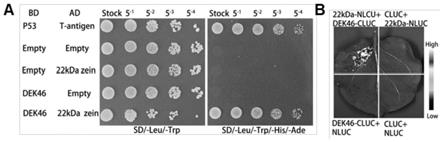
kdα
‑
zein能够进入27
‑
kdγ
‑
zein形成的蛋白体中(coleman et al.,1996)。
6.除了醇溶蛋白外,在玉米胚乳的蛋白体中还存在大量的非醇溶蛋白(nonzeinprotein,nzp)。wang等通过对分离纯化后的玉米胚乳蛋白体进行质谱分析,鉴定到了2000多个非醇溶蛋白,通过进一步的分析发现这些非醇溶蛋白属于不同的代谢途径且带有靶向其它细胞器的信号肽(wang et al.,2016)。对非醇溶蛋白nzp1的研究发现,nzp1本身带有线粒体定位的信号肽,在烟草叶片中表达nzp1发现其定位在线粒体中。在玉米胚乳细胞中,nzp1同时定位在线粒体和蛋白体中。此外,还鉴定到了多个能够通过与22
‑
kd互作积累在蛋白体中的非醇溶蛋白。这种醇溶蛋白介导的非醇溶蛋白在蛋白体中的积累机制,此前并未被明确报道过。而对蛋白体中非醇溶蛋白积累机制的研究,为重组蛋白在玉米胚乳或烟草蛋白体中的高效积累提供了有用的信息。
7.非醇溶蛋白对于维持蛋白体的正常形态和改善蛋白体中蛋白品质具有重要意义。在以往的研究中,o1,fl1和o10是都参与了蛋白体的发育,调控醇溶蛋白在蛋白体中的分布,维持蛋白体的正常形态(holding et al.,2007;wang et al.,2016;yao et al.,2016;)。正常的蛋白体对于维持籽粒的硬度十分重要。当nzp1突变后,籽粒发育受到影响,同时蛋白体发育迟缓,影响了22
‑
kdα
‑
zein在蛋白体中的积累。在蛋白体中,醇溶蛋白是主要的储藏蛋白,醇溶蛋白中,脯氨酸和谷氨酸的含量较高,但色氨酸和丝氨酸的含量较低,因而蛋白品质不高。在nzp1,nzp2和nzp3蛋白中丝氨酸和色氨酸的高于醇溶蛋白,这些蛋白储藏蛋白在蛋白体中,维持了籽粒中氨基酸的平衡,有助于提高籽粒蛋白的品质。此外,蛋白体作为生物反应器,可以作为外源重组蛋白生产平台。将外源蛋白与nzp1,nzp2或nzp3重组后,利用nzp1
‑
3在蛋白体中能够积累的特点,使外源蛋白能够有效积累在蛋白体中。在水稻中,将樱花过敏源蛋白cryj1进行改造后在水稻中表达,可获得稳定积累在蛋白体中的过敏源蛋白,同时过敏源蛋白还具有较好的活性可被用于人的脱敏反应(okada et al.,2003)。
技术实现要素:
8.本发明所要解决的技术问题是如何在植物蛋白体中积累目标蛋白。
9.为了解决以上技术问题,本发明提供了基于与醇溶蛋白的互作在植物中积累目标
蛋白的方法,包括如下步骤:
10.s1、在受体植物中表达所述醇溶蛋白;
11.s2、在受体植物中表达与所述醇溶蛋白互作的所述目标蛋白;
12.所述醇溶蛋白是如下a1、a2或a3的蛋白质:
13.a1、氨基酸序列是序列表中序列8氨基酸序列所示的蛋白质;
14.a2、将序列表中序列8所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与a1)所示的蛋白质具有80%以上的同一性且与蛋白体填充相关的蛋白质;
15.a3、在a1)或a2)的n末端或/和c末端连接蛋白标签得到的融合蛋白质。
16.上述方法中,序列表中的序列8由266个氨基酸残基组成。
17.上述方法中,所述目标蛋白可选为如下b1、b2、b3或b4的蛋白质:
18.b1、氨基酸序列是序列表中序列2、序列4、序列6中任一种氨基酸序列所示的蛋白质;
19.b2、将序列表中序列2、序列4、序列6中任一种所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与b1)所示的蛋白质具有80%以上的同一性且与a1、a2和a3任一所述的蛋白质互作的蛋白质;
20.b3、连接有b1或b2的融合蛋白质;
21.b4、在b1、b2和b3任一所述的蛋白质的n末端或/和c末端连接蛋白标签得到的融合蛋白质。
22.上述方法中,序列表中的序列2由196个氨基酸残基组成;序列表中的序列4由346个氨基酸残基组成;序列表中的序列6由213个氨基酸残基组成。
23.上述方法中,还可包括在受体植物中表达与蛋白体形成相关的蛋白质,所述蛋白体形成相关的蛋白质为如下c1、c2或c3的蛋白质:
24.c1、氨基酸序列是序列表中序列10氨基酸序列所示的蛋白质;
25.c2、将序列表中序列10所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与c1)所示的蛋白质具有80%以上的同一性且与蛋白体形成相关的蛋白质;
26.c3、在c1)或c2)的n末端或/和c末端连接蛋白标签得到的融合蛋白质。
27.上述方法中,序列表中的序列10由93个氨基酸残基组成。
28.上述方法中,同一性是指氨基酸序列的同一性。可使用国际互联网上的同源性检索站点测定氨基酸序列的同一性,如ncbi主页网站的blast网页。例如,可在高级blast2.1中,通过使用blastp作为程序,将expect值设置为10,将所有filter设置为off,使用blosum62作为matrix,将gap existence cost,per residue gap cost和lambda ratio分别设置为11,1和0.85(缺省值)并进行检索一对氨基酸序列的同一性进行计算,然后即可获得同一性的值(%)。
29.上述方法中,所述80%以上的同一性可为至少81%、85%、90%、91%、92%、95%、96%、98%、99%或100%的同一性。
30.上述方法中,在植物中积累目标蛋白可为在植物蛋白体中积累目标蛋白。
31.上述方法中,所述表达所述醇溶蛋白,可通过在所述受体植物中导入编码所述醇
溶蛋白的基因实现;所述编码所述醇溶蛋白的基因为如下d1或d2所示的基因:
32.d1、编码链的编码序列(orf)是序列表序列7的dna分子;
33.d2、核苷酸序列是序列表序列7所示的dna分子。
34.上述方法中,所述表达与所述醇溶蛋白互作的所述目标蛋白,可通过在所述受体植物中导入编码所述目标蛋白的基因实现;所述编码所述目标蛋白的基因为如下e1、e2或e3所示的基因:
35.e1、编码链的编码序列(orf)是序列表序列1或序列3或序列5的dna分子;
36.e2、核苷酸序列是序列表序列1或序列3或序列5所示的dna分子;
37.e3、包含e1或e2的dna分子。
38.上述方法中,所述表达与蛋白体形成相关的蛋白质,可通过在所述受体植物中导入编码所述与蛋白体形成相关的蛋白质的基因实现;所述编码所述与蛋白体形成相关的蛋白质的基因为如下f1或f2所示的基因:
39.f1、编码链的编码序列(orf)是序列表序列9的dna分子;
40.f2、核苷酸序列是序列表序列9所示的dna分子。
41.上述方法中,所述受体植物中导入编码所述与蛋白体形成相关的蛋白质的基因,优选将编码所述与蛋白体形成相关的蛋白质的基因与编码所述醇溶蛋白的基因连接后一起导入受体植物。
42.上述方法中,所述受体植物为单子叶植物或双子叶植物;进一步的,所述单子叶植物为禾本科植物,所述双子叶植物为茄科植物;更进一步,所述禾本科植物为玉米,所述双子叶植物为烟草。
43.本发明的第二个目的是提供上述基于与醇溶蛋白的互作在植物中积累目标蛋白的方法在生产蛋白质中的应用,
44.或,上述醇溶蛋白、上述与蛋白体形成相关的蛋白质与上述目标蛋白在植物中积累目标蛋白中的应用。
45.本发明的第三个目的是提供成套蛋白,由上述醇溶蛋白、上述与蛋白体形成相关的蛋白质与上述目标蛋白组成。
46.本发明通过酵母双杂交系统或lci系统验证了目标蛋白nzp1、nzp2和nzp3分别与醇溶蛋白22
‑
kdα
‑
zein互作。通过对玉米籽粒蛋白体的免疫电镜检测,证明了nzp1在蛋白体中积累,并在22kd醇溶蛋白缺陷的突变体材料中nzp1积累量显著下降。进一步的,通过在烟草中表达zera
‑
22(zera和22
‑
kdα
‑
zein的融合蛋白)和目标蛋白nzp1、nzp2或nzp3,以及在烟草中表达zera和目标蛋白nzp1、nzp2或nzp3的实验,结果表明zera
‑
22在烟草中诱导蛋白体形成,目标蛋白定位在zera
‑
22形成的蛋白体中,证明了目标蛋白nzp1、nzp2和nzp3能够通过与22
‑
kdα
‑
zein的互作积累在zera
‑
22形成的蛋白体中。由此,本发明的方法可基于与醇溶蛋白的互作实现目标蛋白在植物中的积累,进而应用于蛋白质生产中。
附图说明
47.图1为本发明中nzp1与22
‑
kdα
‑
zein的互作结果图;其中图1的a图为实施例1在酵母中互作的结果图,图1的b图为实施例2在lci系统中互作的结果图。
48.图2为本发明中nzp2和nzp3分别与22
‑
kdα
‑
zein的互作结果图;其中图2的a图为实
施例1在酵母中互作的结果图,图2的b图为实施例2在lci系统中互作的结果图。
49.图3为本发明实施例3中nzp1在不同突变体材料中的含量检测结果图。
50.图4为本发明实施例4中nzp1细胞定位的确认。其中,图4的a图为密度梯度离心分离蛋白体,图4的b图为免疫印迹检测nzp1积累在蛋白体中。
51.图5为本发明实施例4免疫电镜观察nzp1在蛋白体中的定位。
52.图6为本发明实施例5的载体构建图,其中图6的a图为phb载体图谱,图6的b图为融合基因构建示意图。
53.图7为本发明实施例5中zera
‑
22
‑
mchery转化烟草后的荧光信号观察结果。
54.图8为本发明实施例5中nzp1分别与zera
‑
22
‑
mcherry和zera
‑
mcherry共同表达的荧光信号观察结果。其中,图8的a图为zera
‑
22
‑
mcherry和nzp1
‑
gfp共同转化烟草后的荧光信号观察结果;图8的b图为zera
‑
mcherry和nzp1
‑
gfp共同转化烟草后的荧光信号观察结果。
55.图9为本发明实施例5中nzp1分别与zera
‑
22
‑
mcherry和zera
‑
mcherry共同表达的免疫印迹法检测结果。其中图9的a图为zera
‑
22
‑
mcherry和nzp1共表达的转基因烟草总蛋白免疫印迹法检测zera
‑
22
‑
mcherry和nzp1蛋白含量的结果。图9的b图为zera
‑
mcherry和nzp1共表达的转基因烟草总蛋白免疫印迹法检测zera
‑
mcherry和nzp1蛋白含量的结果。
56.图10为本发明实施例5中nzp2分别与zera
‑
22
‑
mcherry和zera
‑
mcherry共同表达的荧光信号观察结果。其中,图10的a图为zera
‑
22
‑
mcherry和nzp2
‑
gfp共同转化烟草后的荧光信号观察结果;图10的b图为zera
‑
mcherry和nzp2
‑
gfp共同转化烟草后的荧光信号观察结果。
57.图11为本发明实施例5中nzp3分别与zera
‑
22
‑
mcherry和zera
‑
mcherry共同表达的荧光信号观察结果。其中,图11的a图为zera
‑
22
‑
mcherry和nzp3
‑
gfp共同转化烟草后的荧光信号观察结果;图11的b图为zera
‑
mcherry和nzp3
‑
gfp共同转化烟草后的荧光信号观察结果。
具体实施方式
58.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
59.下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均为常规生化试剂,可从商业途径得到。
60.1、植物品系和菌株
61.下述实施例中opaque1突变体(以下简写为o1),opaque2突变体(以下简写为o2),opaque7突变体(以下简写为o7),floury1突变体(以下简写为fl1)记载于非专利文献“yao d,qi w,li x,et al.maize opaque10 encodes a cereal
‑
specific protein essential for the proper distribution of zeins in endosperm protein bodies[j].plos genetics,2016,12(8):e1006270.”。fl1,o1,o2和o7均由单基因突变产生(fl1突变基因为grmzm2g094532,o1突变基因为grmzm2g449909,o2突变基因为grmzm2g016150,o7突变基因为grmzm2g074759),突变体籽粒发育正常。籽粒成熟后,突变体籽粒呈现粉质不透明,但籽
粒能够正常萌发。o1突变体、o2突变体、o7突变体对应的野生型材料均为玉米自交系w22,fl1突变体对应的野生型材料为玉米b73自交系。上述突变体材料公众可从中国农业大学获得,以重复本技术实验,不可作为其它用途使用。
[0062]
下述实施例中的gv3101土壤农杆菌为上海唯地生物产品,货号为ac1001s。
[0063]
2、载体
[0064]
下述实施例中的pgbkt7和pgadt7来自matchmarker gold yeast
‑
two hybrid system酵母双杂交试剂盒,该试剂盒为clontech公司产品,货号为630442。
[0065]
下述实施例中的p19载体记载于非专利文献goldenbraid 2.0:a comprehensive dna assembly framework for plant synthetic biology.sarrion
‑
perdigones a,vazquez
‑
vilar m,palaci j,castelijns b,forment j,ziarsolo p,blanca j,granell a,orzaez d.plant physiol.2013jul;162(3):1618
‑
31.10.1104/pp.113.217661中,名称为pdgb3alpha2_35s:p19:tnos。公众可从中国农业大学获得,以重复本技术实验,不可作为其它用途使用。
[0066]
下述实施例中的cluc和nluc载体记载于非专利文献“zhang z,yang j,wu y.transcriptional regulation of zein gene expression in maize through the additive and synergistic action of opaque2,prolamine
‑
box binding factor,and o2 heterodimerizing proteins[j].plant cell,2015,27(4):1162.”,公众可从中国农业大学获得,以重复本技术实验,不可作为其它用途使用。
[0067]
下述实施例中phb记载于非专利文献“mao j,zhang yc,sang y,li qh,yang hq.from the cover:a role for arabidopsis cryptochromes and cop1 in the regulation of stomatal opening.proc natl acad sci u s a.2005;102(34):12270
‑
12275.doi:10.1073/pnas.0501011102”的“supportingmethods andmaterials”中,公众可从中国农业大学获得,以重复本技术实验,不可作为其它用途使用。
[0068]
3、抗体和酶
[0069]
下述实施例中的27
‑
kdγ
‑
zein抗体,22
‑
kdα
‑
zein抗体,16
‑
kdγ
‑
zein抗体和19
‑
kdα
‑
zein抗体记载于非专利文献“yao d,qi w,li x,et al.maize opaque10 encodes a cereal
‑
specific protein that is essential for the proper distribution of zeins in endosperm protein bodies[j].plos genetics,2016,12(8):e1006270.”,可从中国农业大学获得,以重复本技术实验,不可作为其它用途使用。
[0070]
胶体金标记羊抗兔igg(d17537)为北京沃凯生物科技有限公司产品,nzp1抗体由abclonal公司制作,项目编号wg
‑
01036d。
[0071]
下述实施例中的所用的聚合酶为phanta高保真dna聚合酶,为南京诺唯赞生物技术公司产品,货号为p511
‑
01。
[0072]
4、试剂
[0073]
下述实施例中的天根多酚多糖总rna抽提试剂盒为天根生物技术公司产品,货号为dp360。
[0074]
下述实施例中的无缝克隆试剂盒为abclonal公司产品,货号rk21020。
[0075]
下述实施例中的酵母
‑
leu/
‑
trp固体培养基(货号为630317)、酵母
‑
leu/
‑
trp液体培养基(货号为630316)、酵母
‑
ade/
‑
his/
‑
leu/
‑
trp固体培养基(货号为630323)均为
clontech公司产品。
[0076]
下述实施例中的luc荧光素底物为promega公司产品,货号为p1041。
[0077]
下述实施例中abclonal多片段重组试剂盒购自武汉爱博泰克生物技术公司,货号为rk21020。
[0078]
下述实施例中,如无特殊说明,序列表中各核苷酸序列的第1位均为相应dna的5
′
末端核苷酸,末位均为相应dna的3
′
末端核苷酸。
[0079]
下述实施例中的定量试验,如无特殊说明,均设置三次重复实验,结果取平均值,*表示显著性分析结果为p<0.05。
[0080]
实施例1、nzp1,nzp2和nzp3与22
‑
kdα
‑
zein在酵母系统的互作验证
[0081]
1、pgbkt7
‑
nzp1,pgbkt7
‑
nzp2,pgbkt7
‑
nzp3及pgadt7
‑
22
‑
kdα
‑
zein载体的构建
[0082]
以天根多酚多糖总rna抽提试剂盒提取玉米b73自交系未成熟籽粒的总rna,反转录得到玉米b73自交系未成熟籽粒的cdna。
[0083]
1.1、pgbkt7
‑
nzp1载体构建
[0084]
nzp1基因的编码序列如序列表序列1所示,其编码的蛋白质为nzp1(序列表序列2)。根据nzp1基因的编码序列设计5’端引物nzp1
‑
f和3’端引物nzp1
‑
r:
[0085]
nzp1
‑
f:5
’‑
ctgcatatggccatggaggccgaattcctggtccggcaggaggcactgcggc
‑3’
;
[0086]
nzp1
‑
r:5
’‑
atgcggccgctgcaggtcgacggatcctcacttctcagccggcgcggccg
‑3’
。
[0087]
以nzp1
‑
f和nzp1
‑
r组成的引物对从玉米b73自交系未成熟籽粒的cdna中扩增nzp1基因的编码dna片段。
[0088]
使用无缝克隆试剂盒,以上述扩增得到的片段替换pgbkt7载体的限制性核酸内切酶bamhi和ecori酶切位点间的片段(包括bamhi的识别位点和ecori酶识别位点在内的小片段),保持pgbkt7载体的其它序列不变,得到nzp1蛋白的重组表达载体,命名为pgbkt7
‑
nzp1。
[0089]
1.2、pgbkt7
‑
nzp2载体构建
[0090]
nzp2基因的编码序列如序列表序列3所示,其编码的蛋白质为nzp2(序列表序列4)。根据nzp2基因的编码序列设计5’端引物nzp2
‑
f和3’端引物nzp2
‑
r:
[0091]
nzp2
‑
f:5
’‑
ctgcatatggccatggaggccgaattctgtaccggagcggcggcggcgaagc
‑3’
;
[0092]
nzp2
‑
r:5
’‑
atgcggccgctgcaggtcgacggatccctagtcgcggttaatgaaggcga
‑3’
。
[0093]
以nzp2
‑
f和nzp2
‑
r组成的引物对从玉米b73自交系未成熟籽粒的cdna中扩增nzp2基因的编码dna片段。
[0094]
使用无缝克隆试剂盒,以上述扩增得到的片段替换pgbkt7载体的限制性核酸内切酶bamhi和ecori酶切位点间的片段(包括bamhi的识别位点和ecori酶识别位点在内的小片段),保持pgbkt7载体的其它序列不变,得到nzp2蛋白的重组表达载体,命名为pgbkt7
‑
nzp2。
[0095]
1.3、pgbkt7
‑
nzp3载体构建
[0096]
nzp3基因的编码序列如序列表序列5所示,其编码的蛋白质为nzp3(序列表序列6)。根据nzp3基因的编码序列设计5’端引物nzp3
‑
f和3’端引物nzp3
‑
r:
[0097]
nzp3
‑
f:5
’‑
ctgcatatggccatggaggccgaattcttgcgcccggccgagggcatccgct
‑3’
;
[0098]
nzp3
‑
r:5
’‑
atgcggccgctgcaggtcgacggatccttaaacccgagacgtccccagct
‑3’
。
[0099]
以nzp3
‑
f和nzp3
‑
r组成的引物对从玉米b73自交系未成熟籽粒的cdna中扩增nzp3基因的dna片段。
[0100]
使用无缝克隆试剂盒,以上述扩增得到的片段替换pgbkt7载体的限制性核酸内切酶bamhi和ecori酶切位点间的片段(包括bamhi的识别位点和ecori酶识别位点在内的小片段),保持pgbkt7载体的其它序列不变,得到nzp3蛋白的重组表达载体,命名为pgbkt7
‑
nzp3。
[0101]
1.4、pgadt7
‑
22
‑
kdα
‑
zein载体构建
[0102]
22
‑
kdα
‑
zein基因的编码序列如序列表序列7所示,其编码的蛋白质为22
‑
kdα
‑
zein(序列表序列8)。根据22
‑
kdα
‑
zein基因的编码序列设计5’端引物22
‑
kdα
‑
zein
‑
f和3’端引物22
‑
kdα
‑
zein
‑
r:
[0103]
22
‑
kdα
‑
zein
‑
f:5
’‑
catatggccatggaggccagtgaattcttcattattccacaatgctcacttgctcct
‑3’
;
[0104]
22
‑
kdα
‑
zein
‑
r:5
’‑
catctgcagctcgagctcgatggatccctaaaagatggcacctccaacgatcg
‑3’
。
[0105]
以5’端引物22
‑
kdα
‑
zein
‑
f和3’端引物22
‑
kdα
‑
zein
‑
r组成的引物对从玉米b73自交系未成熟籽粒的cdna中扩增22
‑
kdα
‑
zein基因的编码dna片段。
[0106]
使用无缝克隆试剂盒,以上述扩增得到的片段替换pgadt7载体的限制性核酸内切酶bamhi和ecori酶切位点间的片段(包括bamhi的识别位点和ecori酶识别位点在内的小片段),保持pgadt7载体的其它序列不变,得到22
‑
kdα
‑
zein蛋白的重组表达载体,命名为pgadt7
‑
22
‑
kdα
‑
zein。
[0107]
2、nzp1,nzp2和nzp3与22
‑
kdα
‑
zein在酵母系统中进行互作验证
[0108]
2.1、nzp1与22
‑
kdα
‑
zein在酵母系统中互作验证
[0109]
将步骤1.1构建的pgbkt7
‑
nzp1与步骤1.4构建的pgadt7
‑
22
‑
kdα
‑
zein共转化酵母感受态ah109菌株后,涂布在酵母
‑
leu/
‑
trp固体培养基上,30℃培养3
‑
5天,挑取单克隆在酵母
‑
leu/
‑
trp液体培养基中进行培养,培养条件为30℃,220rpm,待od
600
=1.0时,取菌液进行梯度稀释,分别涂布在酵母
‑
leu/
‑
trp固体培养基和酵母
‑
ade/
‑
his/
‑
leu/
‑
trp固体培养基上,检测互作。结果如图1的a图所示,表明nzp1与22
‑
kdα
‑
zein在酵母系统中互作。
[0110]
2.2、nzp2与22
‑
kdα
‑
zein在酵母系统中互作验证
[0111]
将步骤1.2构建的pgbkt7
‑
nzp2替换步骤2.1中的pgbkt7
‑
nzp1与步骤1.4构建的pgadt7
‑
22
‑
kdα
‑
zein共转化酵母感受态ah109菌株,保持步骤2.1其它条件均不变,检测互作,结果如图2的a图所示,表明nzp2与22
‑
kdα
‑
zein在酵母系统中互作。
[0112]
2.3、nzp3与22
‑
kdα
‑
zein在酵母系统中互作验证
[0113]
将步骤1.3构建的pgbkt7
‑
nzp3替换步骤2.1中的pgbkt7
‑
nzp1与步骤1.4构建的pgadt7
‑
22
‑
kdα
‑
zein共转化酵母感受态ah109菌株,保持步骤2.1其它条件均不变,检测互作,结果如图2的a图所示,表明nzp3与22
‑
kdα
‑
zein在酵母系统中互作。
[0114]
实施例2、nzp1,nzp2和nzp3与22
‑
kdα
‑
zein在lci系统的互作验证
[0115]
以天根多酚多糖总rna抽提试剂盒提取玉米b73自交系未成熟籽粒的总rna,反转录得到玉米b73自交系未成熟籽粒的cdna。
[0116]
1、cluc
‑
nzp1,cluc
‑
nzp2,cluc
‑
nzp3及22
‑
kdα
‑
zein
‑
nluc载体的构建
[0117]
1.1、cluc
‑
nzp1载体构建
[0118]
nzp1基因的编码序列如序列表序列1所示,其编码的蛋白质为nzp1(序列表序列2)。根据nzp1基因的编码序列设计5’端引物nzp1
‑
f’和3’端引物nzp1
‑
r’:
[0119]
nzp1
‑
f’:5
’‑
acgagctcggtacccgggatccatgacgtccgtgcgcagctgtgccg
‑3’
;
[0120]
nzp1
‑
r’:5
’‑
ggacgcgtacgagatctggtcgactcacttctcagccggcgcggccg
‑3’
。
[0121]
以nzp1
‑
f’和nzp1
‑
r’组成的引物对从玉米b73自交系未成熟籽粒的cdna中扩增nzp1基因的编码dna片段。
[0122]
使用无缝克隆试剂盒,以上述扩增得到的片段替换cluc载体的限制性核酸内切酶bamhi和sali酶切位点间的片段(包括bamhi的识别位点和sali酶识别位点在内的小片段),保持cluc载体的其它序列不变,得到nzp1蛋白的重组表达载体,命名为cluc
‑
nzp1。
[0123]
1.2、cluc
‑
nzp2载体构建
[0124]
nzp2基因的编码序列如序列表序列3所示,其编码的蛋白质为nzp2(序列表序列4)。根据nzp2基因的编码序列设计5’端引物nzp2
‑
f’和3’端引物nzp2
‑
r’:
[0125]
nzp2
‑
f’:5
’‑
acgagctcggtacccgggatccatggtggcctcgcggatcttgctcc
‑3’
;
[0126]
nzp2
‑
r’:5
’‑
ggacgcgtacgagatctggtcgacctagtcgcggttaatgaaggcga
‑3’
。
[0127]
以nzp2
‑
f’和nzp2
‑
r’组成的引物对从玉米b73自交系未成熟籽粒的cdna中扩增nzp2基因的编码dna片段。
[0128]
使用无缝克隆试剂盒,以上述扩增得到的片段替换cluc载体的限制性核酸内切酶bamhi和sali酶切位点间的片段(包括bamhi的识别位点和sali酶识别位点在内的小片段),保持cluc载体的其它序列不变,得到nzp2蛋白的重组表达载体,命名为cluc
‑
nzp2。
[0129]
1.3、cluc
‑
nzp3载体构建
[0130]
nzp3基因的编码序列如序列表序列5所示,其编码的蛋白质为nzp3(序列表序列6)。根据nzp3基因的编码序列设计5’端引物nzp3
‑
f’和3’端引物nzp3
‑
r’:
[0131]
nzp3
‑
f’:5
’‑
acgagctcggtacccgggatccatggaggggctgagctggagaacgg
‑3’
;
[0132]
nzp3
‑
r’:5
’‑
ggacgcgtacgagatctggtcgacttaaacccgagacgtccccagct
‑3’
。
[0133]
以nzp3
‑
f’和nzp3
‑
r’组成的引物对从玉米b73自交系未成熟籽粒的cdna中扩增nzp3基因的编码dna片段。
[0134]
使用无缝克隆试剂盒,以上述扩增得到的片段替换cluc载体的限制性核酸内切酶bamhi和sali酶切位点间的片段(包括bamhi的识别位点和sali酶识别位点在内的小片段),保持cluc载体的其它序列不变,得到nzp3蛋白的重组表达载体,命名为cluc
‑
nzp3。
[0135]
1.4、22
‑
kdα
‑
zein
‑
nluc载体构建
[0136]
22
‑
kdα
‑
zein基因的编码序列如序列表序列7所示,其编码的蛋白质为22
‑
kdα
‑
zein(序列表序列8)。根据22
‑
kdα
‑
zein基因的编码序列设计5’端引物22
‑
kdα
‑
zein
‑
f’和3’端引物22
‑
kdα
‑
zein
‑
r’:
[0137]
22
‑
kdα
‑
zein
‑
f’:5
’‑
ctcgtacgcgtcccggggcggtaccatggctaccaagatattatccc
‑3’
;
[0138]
22
‑
kdα
‑
zein
‑
r’:5
’‑
acgaacgaaagctctgcaggtcgacaaagatggcacctccaacgatcg
‑3’
。
[0139]
使用无缝克隆试剂盒,以上述扩增得到的片段替换nluc载体的限制性核酸内切酶kpni和sali酶切位点间的片段(包括kpni的识别位点和sali酶识别位点在内的小片段),保
持nluc载体的其它序列不变,得到22
‑
kdα
‑
zein蛋白的重组表达载体,命名为22
‑
kdα
‑
zein
‑
nluc。
[0140]
2、nzp1,nzp2和nzp3与22
‑
kdα
‑
zein在lci系统中进行互作验证
[0141]
烟草种子(nicotiana benthamiana)用70%酒精消毒后,种植在含ms+8g/l琼脂培养基的培养皿中,培养箱培养。温度25
±
1℃,湿度70%,16小时光照/8小时黑暗循环光照。待种子萌发后,将萌发后的植株移栽至营养土中,培养温度,湿度和光照条件不变,培养3
‑
4周后,待长到3
‑
4片真叶时,叶片即可用来进行瞬时转化。
[0142]
2.1、nzp1与22
‑
kdα
‑
zein在lci系统中互作验证
[0143]
将p19载体使用热激法转化农杆菌gv3101,得到含有p19的gv3101,命名为p19
‑
gv3101,培养得到od
600
=0.5的p19
‑
gv3101悬浮液。
[0144]
将步骤1.1构建的cluc
‑
nzp1使用热激法转化土壤农杆菌gv3101,得到含有cluc
‑
nzp1的gv3101,命名为cluc
‑
nzp1
‑
gv3101,培养得到od
600
=0.5的cluc
‑
nzp1
‑
gv3101悬浮液。将步骤1.4构建的22
‑
kdα
‑
zein
‑
nluc使用热激法转化土壤农杆菌gv3101,得到含有22
‑
kdα
‑
zein
‑
nluc的gv3101,命名为22
‑
kdα
‑
zein
‑
nluc
‑
gv3101,培养得到od
600
=0.5的22
‑
kdα
‑
zein
‑
nluc
‑
gv3101悬浮液。
[0145]
将p19
‑
gv3101悬浮液、cluc
‑
nzp1
‑
gv3101悬浮液、22
‑
kdα
‑
zein
‑
nluc
‑
gv3101悬浮液按照0.5:1:1的体积比混合,利用一次性注射器从烟草背面注入叶片内进行侵染,25
±
1℃、湿度70%暗培养8h,随后在16小时光照/8小时黑暗的循环光照下培养24
‑
48小时。使用luc荧光素底物(promega,10mm)注射在侵染区域,使用tanon
‑
5200image system进行观察。结果如图1的b图所示,表明nzp1与22
‑
kdα
‑
zein在lci系统中互作。
[0146]
2.2、nzp2与22
‑
kdα
‑
zein在lci系统中互作验证
[0147]
将步骤1.2构建的cluc
‑
nzp2替换步骤2.1中的cluc
‑
nzp1,保持步骤2.1其它条件均不变,检测互作,结果如图2的b图所示,表明nzp2与22
‑
kdα
‑
zein在lci系统中互作。
[0148]
2.3、nzp3与22
‑
kdα
‑
zein在lci系统中互作验证
[0149]
将步骤1.3构建的cluc
‑
nzp3替换步骤2.1中的cluc
‑
nzp1,保持步骤2.1其它条件均不变,检测互作,结果如图2的b图所示,表明nzp3与22
‑
kdα
‑
zein在lci系统中互作。
[0150]
实施例3检测不同突变体的nzp1的含量
[0151]
以o1突变体,fl1突变体,o2突变体,o7突变体及相应野生型为实验材料。
[0152]
分别提取野生型籽粒,fl1突变体,o2突变体,o7突变体籽粒胚乳总蛋白,使用22
‑
kdα
‑
zein抗体,16
‑
kdγ
‑
zein抗体,19
‑
kdα
‑
zein抗体和nzp1抗体进行免疫印迹检测。
[0153]
结果如图3所示,在o2突变体中,19
‑
kdα
‑
zein和22
‑
kdα
‑
zein显著下降,同时nzp1的含量也显著下降。在o7突变体中,19
‑
kdα
‑
zein和16
‑
kdα
‑
zein含量显著下降,nzp1的含量没有显著变化。说明,nzp1的含量与22
‑
kdα
‑
zein的含量相关。
[0154]
实施例4确认nzp1的细胞定位
[0155]
1、密度梯度离心分离与免疫印迹检测确认
[0156]
取玉米自交系b73自交授粉20天后籽粒的胚乳部分,以提取液提取。
[0157]
提取液:10mm tris
‑
cl,10mm mgcl2,5mm kcl,10mm pmsf,1mm dtt,7.2%蔗糖。
[0158]
离心管从下至上一次铺设的蔗糖非连续密度梯度为:0.6m,0.9m,1.2m,1.45m和1.8m蔗糖,36900rpm,4℃,1h 30min离心,分离不同的细胞组份(图4的a图),得到l1(0m/
0.6m的离心产物),l2(0.6m/0.9m的离心产物),l3(0.9m/1.2m的离心产物),l4(1.2m/1.45m的离心产物),l5(1.45m/1.8m的离心产物)共5个细胞组份。
[0159]
使用22
‑
kdα
‑
zein抗体警醒免疫印迹检测各组份中蛋白体的含量。
[0160]
使用nzp1抗体进行免疫印迹检测各组分中nzp1的含量。
[0161]
结果如图4的b所示,在蛋白体的组份(蛋白体主要位于1.45m/1.8m梯度之间,即l5组分)中,nzp1的显著积累。
[0162]
2、免疫电镜确认
[0163]
取得玉米b73自交授粉15天后的未成熟籽粒,制作超薄切片,nzp1一抗(即nzp1抗体)4℃,孵育大约12
‑
24h后在室温孵育2h,胶体金标兔抗羊igg第二抗体用pbs以1:10的比例稀释,室温孵育20
‑
30min。
[0164]
如图5所示,通过免疫电镜观察,确认nzp1分布在蛋白体中。
[0165]
实施例5农杆菌介导的烟草瞬时转化和荧光观察
[0166]
首先在maizegdb网站上分别获取得nzp1基因的编码序列如序列表序列1所示,其编码的蛋白质为nzp1(序列表序列2)。nzp2基因的编码序列如序列表序列3所示,其编码的蛋白质为nzp2(序列表序列4)。nzp3基因的编码序列如序列表序列5所示,其编码的蛋白质为nzp3(序列表序列6)。22
‑
kdα
‑
zein基因的编码序列如序列表序列7所示,其编码的蛋白质为22
‑
kdα
‑
zein(序列表序列8)。zera基因的编码序列为序列表序列9,其编码的蛋白质序列为zera(序列表序列10)。同样的,从ncbi网站的genbank中获得mcherry基因的编码序列如序列表序列11所示,其编码的蛋白质的氨基酸序列为序列表序列12。gfp的基因编码序列如序列表序列13所示,gfp蛋白的氨基酸序列如序列表序列14所示。
[0167]
取得玉米b73自交系授粉后15天未成熟籽粒,使用天根多酚多糖样品总rna提取试剂盒提取总rna,进行琼脂糖凝胶电泳,检测总rna提取质量。使用全式金one
‑
step cdna反转录试剂盒对总rna进行反转录,获得玉米b73自交系未成熟籽粒的cdna。
[0168]
1、构建重组表达载体
[0169]
1.1、构建phb
‑
mcherry载体
[0170]
根据mcherry基因的编码序列(序列表序列11)设计引物如下:
[0171]
mcherry
‑
f:5
’‑
tcgagctgcaggagctcatggtgagca agggcgaggaggat
‑3’
;
[0172]
mcherry
‑
r:5
’‑
tctagaggatcaattcgagctccttgtacagctcgtccatg
‑3’
。
[0173]
以mcherry
‑
f和mcherry
‑
r组成的引物对从玉米b73自交系未成熟籽粒的cdna中扩增mcherry基因的编码dna片段。
[0174]
以上述扩增得到的片段替换phb载体(phb载体的图谱如图6的a图所示)的限制性核酸内切酶saci酶切位点的片段(包括saci酶识别位点),保持phb载体的其它序列不变,得到mcherry的重组表达载体,命名为phb
‑
mcherry。
[0175]
1.2、构建phb
‑
gfp载体
[0176]
根据gfp的基因编码序列(序列表序列13)设计引物,如下:
[0177]
gfp
‑
f:5
’‑
tcgagctgcaggagctcgtgagcaagggcgaggagc
‑3’
;
[0178]
gfp
‑
r:5
’‑
tctagaggatcaattcgagctcttacttgtacagctcgtcca
‑3’
。
[0179]
以gfp
‑
f和gfp
‑
r组成的引物对从玉米b73自交系未成熟籽粒的cdna中扩增gfp的基因编码序列。
[0180]
以上述扩增得到的片段替换phb载体(phb载体的图谱如图6的a图所示)的限制性核酸内切酶saci酶的片段(包括saci酶识别位点在内),保持phb载体的其它序列不变,得到gfp的重组表达载体,命名为phb
‑
gfp。
[0181]
1.3、构建phb
‑
zera
‑
mcherry、phb
‑
zera
‑
22
‑
mcherry载体
[0182]
根据zera基因的编码序列(序列表序列9)设计引物如下:
[0183]
zera
‑
f:5
’‑
tctctctcaagctggatccatgagggtgttgctcgttgcc
‑3’
;
[0184]
zera
‑
r:5
’‑
cgcccttgctcaccatgagctcctgaggccggggcgg
‑3’
。
[0185]
以zera
‑
f和zera
‑
r组成的引物对从玉米b73自交系未成熟籽粒的cdna中扩增zera基因的编码dna片段,用于构建phb
‑
zera
‑
mcherry载体。
[0186]
根据zera基因的编码序列(序列表序列9)设计引物如下:
[0187]
zera(22)
‑
f:5
’‑
tctctctcaagctggatccatgagggtgttgctcgttgcc
‑3’
;
[0188]
zera(22)
‑
r:5
’‑
tcgcaaaaagcgcaagaagctgaggccggggcgg
‑3’
;
[0189]
以zera(22)
‑
f和zera(22)
‑
r组成的引物对从玉米b73自交系未成熟籽粒的cdna中扩增zera基因的编码dna片段,用于构建phb
‑
zera
‑
22
‑
mcherry载体。
[0190]
根据22
‑
kdα
‑
zein基因的编码序列(序列表序列7)设计引物如下:
[0191]
22
‑
kdα
‑
zein
‑
f”:5
’‑
ccgccccggcctcagcttcttgcgctttttgcga
‑3’
;
[0192]
22
‑
kdα
‑
zein
‑
r”:5
’‑
tcgcccttgctcaccatgagctcaaagatggcacctccaacgatg
‑3’
。
[0193]
以22
‑
kdα
‑
zein
‑
f”和22
‑
kdα
‑
zein
‑
r”组成的引物对从玉米b73自交系未成熟籽粒的cdna中扩增22
‑
kdα
‑
zein基因的编码dna片段,用于构建phb
‑
zera
‑
22
‑
mcherry载体。。
[0194]
1.3.1、构建phb
‑
zera
‑
mcherry载体
[0195]
按照图6中的b图所示的从上往下数的第一条融合基因的顺序,将zera克隆至步骤1.1构建的phb
‑
mcherry载体上:使用abclonal多片段重组试剂盒,以phb
‑
mcherry为骨架,将上述扩增得到的zera基因的编码dna片段替换phb
‑
mcherry载体的多克隆位点bamhi酶切位点和saci酶切位点之间的片段(包括bamhi酶的识别位点和saci酶识别位点在内的小片段),保持phb
‑
mcherry载体的其它序列不变,得到zera
‑
mcherry的融合蛋白的重组表达载体,并命名为phb
‑
zera
‑
mcherry。
[0196]
1.3.2、构建phb
‑
zera
‑
22
‑
mcherry载体
[0197]
按照图6中的b图所示的从上往下数的第二条融合基因的顺序,使用融合pcr,在体外连接上述扩增得到的zera基因的编码dna片段和上述扩增得到的22
‑
kdα
‑
zein基因的编码dna片段,得到将zera和22
‑
kdα
‑
zein融合蛋白基因的编码dna片段,并将其克隆至步骤1.1构建的phb
‑
mcherry载体上:使用abclonal多片段重组试剂盒,以phb
‑
mcherry为骨架,将上述扩增得到的融合蛋白基因的编码dna片段替换phb
‑
mcherry载体的多克隆位点bamhi酶切位点和saci酶切位点之间的片段(包括bamhi酶的识别位点和saci酶识别位点在内的小片段),保持phb
‑
mcherry载体的其它序列不变,得到zera
‑
22
‑
mcherry的融合蛋白的重组表达载体,并命名为phb
‑
zera
‑
22
‑
mcherry。
[0198]
1.4、构建phb
‑
nzp1
‑
gfp、phb
‑
nzp2
‑
gfp和phb
‑
nzp3
‑
gfp载体
[0199]
1.4.1、构建phb
‑
nzp1
‑
gfp
[0200]
根据nzp1基因的编码序列(序列表序列1)设计引物如下:
[0201]
nzp1
‑
f”:5
’‑
tctctctcaagctggatccatgacgtccgtgcgcagctgtgccg
‑3’
;
[0202]
nzp1
‑
r”:5
’‑
ctcgcccttgctcacgagctccttctcagccggcgcggccg
‑3’
。
[0203]
以nzp1
‑
f”和nzp1
‑
r”组成的引物对从玉米b73自交系未成熟籽粒的cdna中扩增nzp1基因的编码dna片段。
[0204]
按照图6中的b图所示的从上往下数的第三条融合基因的顺序,将nzp1克隆至步骤1.2构建的phb
‑
gfp载体上:使用abclonal多片段重组试剂盒,以phb
‑
gfp载体为骨架,将上述扩增片段替换phb
‑
gfp载体的限制性核酸内切酶bamhi酶切位点和saci酶切位点之间的片段(包括bamhi酶的识别位点和saci酶识别位点在内的小片段),并命名为phb
‑
nzp1
‑
gfp。
[0205]
1.4.2、构建phb
‑
nzp2
‑
gfp
[0206]
根据nzp2基因的编码序列(序列表序列3)设计引物如下:
[0207]
nzp2
‑
f”:5
’‑
tctctctcaagctggatccatggtggcctcgcggatcttgctcc
‑3’
;
[0208]
nzp2
‑
r”:5
’‑
ctcgcccttgctcacgagctcgtcgcggttaatgaaggcga
‑3’
。
[0209]
以nzp2
‑
f”和nzp2
‑
r”组成的引物对从玉米b73自交系未成熟籽粒的cdna中扩增nzp2基因的编码dna片段。
[0210]
按照图6中的b图所示的从上往下数的第四条融合基因的顺序,将nzp2克隆至步骤1.2构建的phb
‑
gfp载体上:使用abclonal多片段重组试剂盒,以phb
‑
gfp载体为骨架,将上述扩增片段替换phb
‑
gfp载体的限制性核酸内切酶bamhi酶切位点和saci酶切位点之间的片段(包括bamhi酶的识别位点和saci酶识别位点在内的小片段),并命名为phb
‑
nzp2
‑
gfp。
[0211]
1.4.3、构建phb
‑
nzp3
‑
gfp
[0212]
根据nzp3基因的编码序列(序列表序列5)设计引物如下:
[0213]
nzp3
‑
f”:5
’‑
tctctctcaagctggatccatggaggggctgagctggagaacgg
‑3’
;
[0214]
nzp3
‑
r”:5
’‑
ctcgcccttgctcacgagctcaacccgagacgtccccagct
‑3’
。
[0215]
以nzp3
‑
f”和nzp3
‑
r”组成的引物对从玉米b73自交系未成熟籽粒的cdna中扩增nzp3基因的编码dna片段。
[0216]
按照图6中的b图所示的从上往下数的第五条融合基因的顺序,将nzp3克隆至步骤1.2构建的phb
‑
gfp载体上:使用abclonal多片段重组试剂盒,以phb
‑
gfp载体为骨架,将上述扩增片段替换phb
‑
gfp载体的限制性核酸内切酶bamhi酶切位点和saci酶切位点之间的片段(包括bamhi酶的识别位点和saci酶识别位点在内的小片段),并命名为phb
‑
nzp3
‑
gfp。
[0217]
2、瞬时转化烟草的基因表达情况
[0218]
烟草种子(nicotiana benthamiana)用70%酒精消毒后,种植在含ms+8g/l琼脂培养基的培养皿中,培养箱培养。温度25
±
1℃,湿度70%,16小时光照/8小时黑暗循环光照。待种子萌发后,将萌发后的植株移栽至营养土中,培养温度,湿度和光照条件不变,培养3
‑
4周后,待长到3
‑
4片真叶时,叶片即可用来进行瞬时转化。
[0219]
2.1、nzp1分别与zera
‑
22
‑
mcherry和zera
‑
mcherry瞬时转化烟草的基因
[0220]
2.1.1、农杆菌介导的烟草瞬时转化
[0221]
将p19载体使用热激法转化农杆菌gv3101,得到含有p19的gv3101,命名为p19
‑
gv3101,培养得到od
600
=0.5的p19
‑
gv3101悬浮液。
[0222]
将步骤1构建的phb
‑
zera
‑
mcherry载体使用热激法转化转化农杆菌gv3101,得到含有phb
‑
zera
‑
mcherry的gv3101,命名为phb
‑
zera
‑
mcherry
‑
gv3101,培养得到od
600
=0.5的phb
‑
zera
‑
mcherry
‑
gv3101悬浮液。
[0223]
将步骤1构建的phb
‑
zera
‑
22
‑
mcherry载体使用热激法转化转化农杆菌gv3101,得到含有phb
‑
zera
‑
22
‑
mcherry的gv3101,命名为phb
‑
zera
‑
22
‑
mcherry
‑
gv3101,培养得到od
600
=0.5的phb
‑
zera
‑
22
‑
mcherry
‑
gv3101悬浮液。
[0224]
将步骤1构建的phb
‑
nzp1
‑
gfp载体使用热激法转化转化农杆菌gv3101,得到含有phb
‑
nzp1
‑
gfp的gv3101,命名为phb
‑
nzp1
‑
gfp
‑
gv3101,培养得到od
600
=0.5的phb
‑
nzp1
‑
gfp
‑
gv3101悬浮液。
[0225]
将p19
‑
gv3101悬浮液(标为p19),phb
‑
zera
‑
mcherry
‑
gv3101悬浮液(标为zera
‑
mcherry),phb
‑
zera
‑
22
‑
mcherry
‑
gv3101悬浮液(标为zera
‑
22
‑
mcherry)和phb
‑
nzp1
‑
gfp
‑
gv3101(标为nzp1
‑
gfp)悬浮液按照以下组合进行混合,所示比例均为体积比例:
[0226]
组合1:zera
‑
22
‑
mcherry+p19,悬浮液混合比例为1:1;
[0227]
组合2:zera
‑
22
‑
mcherry+nzp1
‑
gfp+p19,悬浮液混合比例为1:1:0.5;
[0228]
组合3:zera
‑
mcherry+nzp1
‑
gfp+p19,悬浮液混合比列为1:1:0.5。
[0229]
每种组合的混合液分别利用一次性注射器从烟草背面注入叶片内进行侵染,25
±
1℃、湿度70%暗培养8h,随后在16小时光照/8小时黑暗的循环光照下培养24
‑
48小时,获得新鲜的转基因烟草片。其中,组合1侵染得到的是zera
‑
22
‑
mcherry单独表达的转基因烟草片;组合2侵染得到的是zera
‑
mcherry和nzp1共同表达的转基因烟草片;组合3侵染得到的是zera
‑
22
‑
mcherry和nzp1共同表达转基因烟草片。
[0230]
2.1.2、荧光观察
[0231]
对步骤2.1.1获得的转基因烟草片利用gfp表达进行荧光观察。
[0232]
如图7所示,当zera
‑
22
‑
mcherry单独表达时(组合1),能够形成蛋白体结构。如图8所示,当zera
‑
mcherry和nzp1共同表达时(组合3,见图8的b图),nzp1不能积累在zera形成的蛋白体中。当zera
‑
22
‑
mcherry和nzp1共同表达时(组合2,见图8的a图),nzp1能够积累在zera形成的蛋白体中,且nzp1
‑
gfp和zera
‑
22
‑
mcherry的荧光信号定位一致,说明nzp1能够重定位在zera
‑
22形成的蛋白体中。
[0233]
2.1.3、western免疫印迹检测
[0234]
取步骤2.1.1获得的转基因烟草片提取总蛋白,对含有总蛋白的提取液使用蛋白定量试剂盒进行定量,蛋白样品经sds
‑
page分离后,利用western免疫印迹方法(western blot)将蛋白转移到pvdf膜上,然后利用nzp1抗体和27
‑
kdγ
‑
zein抗体进行检测。
[0235]
t1
‑
t4为四个不同表达事件,具体分别为
[0236]
如图9的a图所示,当nzp1
‑
gfp与zera
‑
22
‑
mcherry共同表达时,nzp1
‑
gfp存在明显的积累。
[0237]
如图9的b图所示,当nzp1
‑
gfp与zera
‑
mcherry共同表达时,nzp1
‑
gfp没有明显的积累。
[0238]
2.2、nzp2分别与zera
‑
22
‑
mcherry和zera
‑
mcherry瞬时转化烟草的基因
[0239]
将步骤1构建的phb
‑
nzp2
‑
gfp载体替换步骤2.1.1中的phb
‑
nzp1
‑
gfp载体,保持步骤2.1.1别的方法均不变,得到zera
‑
mcherry和nzp2共同表达的转基因烟草片,以及zera
‑
22
‑
mcherry和nzp2共同表达转基因烟草片。对获得的转基因烟草片利用gfp表达进行荧光观察。
[0240]
结果如图10所示,当zera
‑
mcherry和nzp2共同表达时(见图10的b图),nzp2不能积
累在zera形成的蛋白体中。当zera
‑
22
‑
mcherry和nzp2共同表达时(见图10的a图),nzp2
‑
gfp和zera
‑
22
‑
mcherry的荧光信号定位一致,说明nzp2能够重定位在zera
‑
22形成的蛋白体中。
[0241]
2.3、nzp3分别与zera
‑
22
‑
mcherry和zera
‑
mcherry瞬时转化烟草的基因
[0242]
将步骤1构建的phb
‑
nzp3
‑
gfp载体替换步骤2.1.1中的phb
‑
nzp1
‑
gfp载体,保持步骤2.1.1别的方法均不变,得到zera
‑
mcherry和nzp3共同表达的转基因烟草片,以及zera
‑
22
‑
mcherry和nzp3共同表达转基因烟草片。对获得的转基因烟草片利用gfp表达进行荧光观察。
[0243]
结果如图11所示,当zera
‑
mcherry和nzp3共同表达时(见图11的b图),nzp3不能积累在zera形成的蛋白体中。当zera
‑
22
‑
mcherry和nzp3共同表达时(见图11的a图),nzp3
‑
gfp和zera
‑
22
‑
mcherry的荧光信号定位一致,说明nzp3能够重定位在zera
‑
22形成的蛋白体中。
[0244]
综上,本发明通过酵母双杂交系统或lci系统验证了目标蛋白nzp1、nzp2和nzp3分别与醇溶蛋白22
‑
kdα
‑
zein互作。通过对玉米籽粒蛋白体的免疫电镜检测,证明了nzp1在蛋白体中积累,并在22kd醇溶蛋白缺陷的突变体材料中nzp1积累量显著下降。进一步的,通过在烟草中表达zera
‑
22(zera和22
‑
kdα
‑
zein的融合蛋白)和目标蛋白nzp1、nzp2或nzp3,以及在烟草中表达zera和目标蛋白nzp1、nzp2或nzp3的实验,结果表明zera
‑
22在烟草中诱导蛋白体形成,目标蛋白定位在zera
‑
22形成的蛋白体中,证明了目标蛋白nzp1、nzp2和nzp3能够通过与22
‑
kdα
‑
zein的互作积累在zera
‑
22形成的蛋白体中。
[0245]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1