一种预测肝癌复发的产品
1.本发明属于生物医药领域,具体涉及一种预测肝癌复发的产品。
背景技术:
2.肝癌是临床上常见的恶性肿瘤之一,因其恶性程度高、进展速度快、治疗复杂、生存时间短等特点,素有“癌中之王”的称号。肝癌按其肿瘤的形态可分为结节型、巨块型和弥漫型。虽然目前治疗肝癌手段多样,如手术切除、肝移植、放化疗、射频消融、分子靶向治疗等,但其总体生存率仍较低。据统计,在全球范围内,每年大约有748,300新增肝癌病例,同时又有695,900例肝癌死亡病例。全球肝癌的高发区主要分布在东南亚和撒哈拉沙漠以南的非洲国家,低发区多分布在欧洲、美洲和大洋洲的一些国家。由于肝癌的高发病率和高死亡率,肝癌在世界范围内都尤为重视。
3.肝癌治疗后5年复发率高达50%~80%,复发性肝癌的预防和治疗是一个提高肝癌患者长期生存率的重要阶段。肝癌复发是一个多基因、多因素参与的多阶段的过程,存在癌细胞本身、癌细胞与间质细胞、微环境及宿主免疫状态的相互作用,涉及到多种癌基因、抑癌基因及其信号通路的异常表达和活化。同时,随着基因组计划的完成,基因功能成为人们关注的焦点。随着高通量技术的不断成熟,基于第二代测序技术及全基因组表达谱芯片的转录组学分析在功能基因组学的研究中发挥了非常重要的作用,不仅可检测编码蛋白质的mrna,而且能够检测各种调节性非编码rna(microrna和lncrna等)。转录组学的研究对于筛选肝癌复发相关分子、揭示肿瘤的发生发展机制和寻求新的肝癌治疗分子靶点等具有重要的应用前景和临床价值。
技术实现要素:
4.本发明的目的在于提供用于预测肝癌复发的生物标志物。
5.为了实现上述目的,本发明采用的技术方案为:
6.本发明第一方面提供了检测生物标志物表达水平的试剂在制备用于预测肝癌复发的产品中的应用,所述的生物标志物包括atp1b2、aarsd1和/或them4。
7.在本发明中,atp1b2(基因id:482)包括atp1b2基因及其编码的蛋白及其同源物,突变,和同等型。该术语涵盖全长,未加工的atp1b2,以及源自细胞中加工的任何形式的atp1b2。该术语涵盖atp1b2的天然发生变体(例如剪接变体或等位变体)。
8.在本发明中,aarsd1(基因id:80755)包括aarsd1基因及其编码的蛋白及其同源物,突变,和同等型。该术语涵盖全长,未加工的aarsd1,以及源自细胞中加工的任何形式的aarsd1。该术语涵盖aarsd1的天然发生变体(例如剪接变体或等位变体)。
9.在本发明中,them4(基因id:117145)包括them4基因及其编码的蛋白及其同源物,突变,和同等型。该术语涵盖全长,未加工的them4,以及源自细胞中加工的任何形式的them4。该术语涵盖them4的天然发生变体(例如剪接变体或等位变体)。
10.如本文中使用的,术语“生物标志物”一般指其在组织或细胞中/上表达或分泌的
可以通过已知的方法(或本文所披露的方法)来检测且是预测性的或可以用于预测(或帮助预测)细胞、组织或患者对治疗方案的响应性的分子,包括基因、mrna、蛋白质、碳水化合物结构或糖脂。
11.本文所述的生物标志物表达水平“下调”意在指该生物标志物的表达水平比参比表达水平低至少1%、5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、2.1倍、2.2倍、2.3倍、2.4倍、2.5倍、2.6倍、2.7倍、2.8倍、2.9倍、3倍、3.1倍、3.2倍、3.3倍、3.4倍、3.5倍、3.6倍、3.7倍、3.8倍、3.9倍、4倍、5倍、5.1倍、5.2倍、5.3倍、5.4倍、5.5倍、5.6倍、5.7倍、5.8倍、5.9倍、6.0倍、10倍、20倍、50倍或100倍。
12.本文所述的生物标志物表达水平“上调”意在指该生物标志物的表达水平比参比表达水平高至少1%、5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2倍、2.1倍、2.2倍、2.3倍、2.4倍、2.5倍、2.6倍、2.7倍、2.8倍、2.9倍、3倍、3.1倍、3.2倍、3.3倍、3.4倍、3.5倍、3.6倍、3.7倍、3.8倍、3.9倍、4倍、5倍、10倍、20倍、50倍或100倍。
13.进一步,所述的生物标志物包括aarsd1和atp1b2。
14.进一步,所述的生物标志物包括aarsd1和them4。
15.进一步,所述的生物标志物包括atp1b2、aarsd1和them4的组合。
16.进一步,所述的产品包括核酸膜条、芯片或试剂盒。
17.进一步,所述的芯片包括基因芯片、蛋白质芯片,其中基因芯片包括针对所述生物标志物的引物或探针,蛋白质芯片包括特异性结合与所述生物标志物编码的蛋白结的抗体。
18.进一步,所述的试剂盒包括qpcr试剂盒、免疫印迹检测试剂盒、免疫层析检测试剂盒、流式细胞分析试剂盒、免疫组化检测试剂盒、elisa试剂盒和电化学发光检测试剂盒。
19.在本发明中,试剂盒还包括容器、使用说明书、阳性对照物、阴性对照物、缓冲剂、助剂或溶剂,以及附有试剂盒的使用说明书,其中记载了如何采用试剂盒进行检测,和如何利用检测结果对疾病发展进行判断、对治疗方案进行选择。
20.本发明所述的试剂盒可包含适于实用(如针对于不同的检测方法)的多种不同的试剂,并不限于目前所列举的试剂,只要是基于前面所述生物标志物的检测来预测肝癌复发的试剂均包含在本发明范围内。
21.进一步,检测生物标志物表达水平是通过以下步骤进行的:
22.1)获得受试者样本;
23.2)确定所述的样本中所述的生物标志物的表达量。
24.本发明第二方面提供了一种用于预测肝癌复发的产品,所述的产品包括检测生物标志物表达水平的试剂,所述的生物标志物包括atp1b2、aarsd1和/或them4。
25.进一步,所述的生物标志物包括aarsd1和atp1b2。
26.进一步,所述的生物标志物包括aarsd1和them4。
27.进一步,所述的生物标志物包括atp1b2、aarsd1和them4的组合。
28.进一步,所述的试剂包括通过测序技术、核酸杂交技术、核酸扩增技术、蛋白免疫技术检测所述生物标志物表达水平的试剂。
29.进一步,所述的试剂包括探针、引物、抗体、配体。
30.术语“探针”指的是能与另一分子的特定序列或亚序列或其它部分结合的分子。除非另有指出,术语“探针”通常指能通过互补碱基配对与另一多核苷酸(往往称为“靶多核苷酸”)结合的多核苷酸探针。根据杂交条件的严谨性,探针能和与该探针缺乏完全序列互补性的靶多核苷酸结合。探针可作直接或间接的标记,其范围包括引物。杂交方式包括,但不限于:溶液相、固相、混合相或原位杂交测定法。
31.本文中检测前面所述生物标志物的探针是与所述生物标志物多核苷酸“特异性杂交”的寡核苷酸,其具有充分互补序列从而允许在本领域常用预定条件下与目标核苷酸序列杂交的寡核苷酸(有时称为“基本互补”)。尤其,该表述包括一寡核苷酸与本文所述单链dna或rna分子内所含基本上互补的序列杂交,基本上排除该寡核苷酸与非互补序列的单链核酸杂交。
32.术语“引物”指的是能够形成与模板链互补的碱基对(base pair),并且起到用于复制模板链的起始点作用的7个~50个核酸序列。引物通常合成而得,但也可以使用自然生成的核酸。引物的序列并不一定需要与模板的序列完全相同,只要充分互补而能够与模板杂交即可。可以混入不改变引物的基本性质的追加特征。作为可以混入的追加特征的例子,有甲基化、带帽、一个以上的核酸被同系物取代和核酸间的修饰,但不限于此。
33.术语“核酸”泛指:染色体的段;dna、cdna和/或rna的段或部分。核酸可以自最初与任何源分离的核酸样本(例如,与样本dna或rna分离、从样本dna或rna纯化、扩增、克隆或逆转录)获取或获得。
34.本文中探针和引物的具体长度和序列取决于所需核酸靶标的复杂性以及反应条件(例如温度和离子强度)。总体来说,杂交条件是本领域所知的严格杂交条件。“严格”指核苷酸序列能够结合相关或非特异性序列的条件。例如,高温和低盐提高严格性,使得非特异性结合或低熔融温度的结合发生解离。一些实施方式中,与所述生物标志物多核苷酸互补的寡核苷酸与所述生物标志物多核苷酸至少95%、96%、97%、98%、99%或100%互补。
35.术语“寡核苷酸”指的是由脱氧核糖核苷酸、核糖核苷酸或其任意组合构成的短聚合物。寡核苷酸的长度通常在大10个核苷酸和大约100个核苷酸之间。寡核苷酸优选地长度为15个核苷酸到70个核苷酸,最通常的是20个核苷酸到26个核苷酸。
36.术语“抗体”描述了一类免疫球蛋白分子,以及在本发明中以其最广泛的含义进行使用。抗体特异性地包括单克隆抗体偶联物、多克隆抗体偶联物、完整抗体偶联物和抗体片段。
37.术语“免疫球蛋白”是指一类结构相关的蛋白质,通常由两对多肽链、一对轻(l)链和一对重(h)链组成。在完整的免疫球蛋白中,所有这四个链通过二硫键相互连接。所述免疫球蛋白的结构已得到好的表征。参见,例如,paul,fundamental immunology 7th ed.,ch.5(2013)lippincott williams&wilkins,philadelphia,pa。简而言之,每条重链通常包含重链可变区(v)和重链恒定区(c)。所述重链恒定区通常包含三个结构域,c、c和c。每条轻链通常包含轻链可变区(v)和轻链恒定区。所述轻链恒定区通常包含一个结构域,缩写为c。
38.本发明第三方面提供了一种预测肝癌复发的系统,包括:
39.(1)肝癌复发评估装置,其包括控制单元和存储单元,用于评估受试者是否有肝癌复发的风险;和
40.(2)彼此通信地连接的信息通信终端装置,其提供关于来自受试者的生物标志物表达水平的数据;
41.其中,所述肝癌复发评估装置的控制单元包括:
42.1)数据接收单元,其接收从所述信息通信终端设备传输的关于所述生物标志物表达水平的数据;
43.2)判别值计算单元,其基于由所述数据接收单元接收的所述生物标志物表达水平以及具有存储在所述存储单元中的作为解释变量的生物标志物表达水平的判别来计算判别值;
44.3)判别值基准评价单元,其基于由所述判别值计算单元计算的判别值,对所述受试者中的肝癌复发的风险进行评价;以及
45.4)评估结果发送单元,其将由所述判别值基准评估单元获得的所述受试者的评估结果发送到所述信息通信终端装置。
46.所述的生物标志物包括atp1b2、aarsd1和/或them4。
47.进一步,所述的生物标志物包括aarsd1和atp1b2。
48.进一步,所述的生物标志物包括aarsd1和them4。
49.进一步,所述的生物标志物包括atp1b2、aarsd1和them4的组合。
50.本发明第四方面提供了生物标志物在构建预测肝癌复发的计算模型或者嵌入了所述计算模型的系统中的应用,所述的生物标志物包括atp1b2、aarsd1和/或them4。
51.进一步,所述的生物标志物包括aarsd1和atp1b2。
52.进一步,所述的生物标志物包括aarsd1和them4。
53.进一步,所述的生物标志物包括atp1b2、aarsd1和them4的组合。
54.本发明的优点和有益效果如下:
55.本发明首次发现了通过检测生物标志物的表达水平可以预测肝癌复发,所述的生物标志物包括atp1b2、aarsd1、them4。
56.本发明提供了一种用于预测肝癌复发的系统,使用该系统可以判断受试者肝癌复发的风险。
附图说明
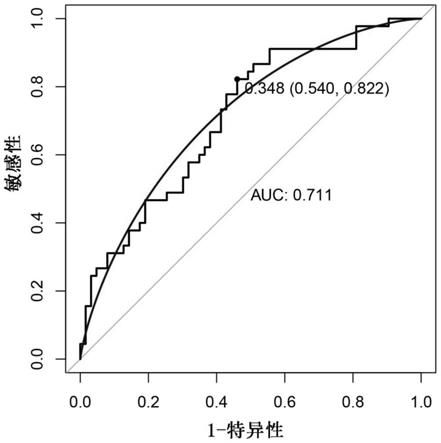
57.图1是atp1b2、aarsd1和them4在训练集中联合诊断预测肝癌复发的roc曲线图。
58.图2是atp1b2、aarsd1和them4在验证集中联合诊断预测肝癌复发的roc曲线图。
具体实施方式
59.以下通过具体的实施例进一步说明本发明的技术方案,具体实施例不代表对本发明保护范围的限制。其他人根据本发明理念所做出的一些非本质的修改和调整仍属于本发明的保护范围。
60.实施例1筛选肝癌复发差异表达基因
61.1、数据来源
62.从geo下载了gse76427数据集的芯片数据及临床信息作为训练集,样本量为未复发:复发=63:45。从tcga数据库下载肝癌复发的rna
‑
seq数据及临床信息作为验证集,样本
量为未复发:复发=203:168。
63.2、数据预处理
64.利用fastp软件对raw data进行接头处理、修剪和质控,分析使用软件默认参数,输出高质量的测序数据进行后续分析。接头处理利用fastp软件默认双端序列自动检测模式。分析得到的clean data使用icgc软件比对到人类参考基因组,参考基因组版本为grch38.d1.vd1,使用voom方法进行标准化。
65.而geo数据使用rma方法进行标准化,通过platform文件进行注释,多个探针对应同一个基因的,取平均值作为该基因的表达量。
66.3、差异表达分析
67.使用r软件中的“limma”包进行差异表达分析,差异基因的筛选标准为adj.pvalue<0.05。
68.4、结果
69.与肝癌未复发样本相比,atp1b2在geo与tcga的肝癌复发样本中表达水平显著下调(geo中p=0.001,tcga中p=0.000);aarsd1在geo与tcga的肝癌复发样本中表达水平显著上调(geo中p=0.045,tcga中p=0.012);them4在geo与tcga的肝癌复发样本中表达水平显著上调(geo中p=0.043,tcga中p=0.047)。
70.实施例2诊断效能验证
71.1、实验方法
72.使用r包“proc”(版本1.15.0)绘制受试者工作曲线(roc),分析auc值、敏感性和特异性,判断指标单独或者联合的诊断效能。在判断指标联合的诊断效能时,对各基因的表达水平进行logistics回归,通过拟合出的回归曲线计算出每个个体患癌与否的概率,确定不同的概率划分阈值,根据确定的概率划分阈值,计算得出联合检测方案的灵敏度、特异性以及准确性等。
73.2、实验结果
74.atp1b2、aarsd1、them4在训练集和验证集中单独或者联合的诊断效能如表1和2以及图1和2所示,atp1b2、aarsd1、them4三者联合不管在训练集还是验证集中都显示较高的诊断效能,auc值分别为0.711和0.709,训练集中的敏感性和特异性分别为0.822、0.540。验证集中的敏感性和特异性分别为0.631、0.744。
75.表1基因在训练集中的auc值
76.基因aucatp1b20.592aarsd10.620them40.554aarsd1+atp1b20.688aarsd1+them40.623atp1b2+aarsd1+them40.711
77.表2基因在验证集中的auc值
78.基因aucatp1b20.616
aarsd10.637them40.647aarsd1+atp1b20.674aarsd1+them40.666atp1b2+aarsd1+them40.709
79.上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1