牛大力多糖或其改性多糖在延缓油脂氧化中的应用
1.本发明涉及多糖的应用领域,特别涉及一种牛大力多糖或其改性多糖在延缓油脂氧化中的应用。
背景技术:
2.牛大力是南药的主要品种,属豆科蝶形花科植物美丽鸡血藤,主要分布于我国的南方地区以及东南亚一些国家。牛大力作为一种药食兼用的中药材,具有治疗关节炎和支气管炎、保护肝脏、强筋健骨、补虚润肺等功效。
3.最近,发现牛大力多糖具有一定的乳化能力,但是牛大力多糖稳定的乳状液不稳定,制备后立即出现严重的分层现象。此外,关于改性多糖对乳液中油脂氧化的影响尚未明确。因此,为了拓宽牛大力多糖(mscp)在食品工业特别是乳状食品领域的应用,有必要对牛大力多糖进行改性以提高其乳化性能,并探究改性前后油脂氧化的变化。
技术实现要素:
4.本发明的目的在于克服现有技术的缺点与不足,提供一种牛大力多糖和/或其改性多糖在延缓油脂氧化中的应用。
5.本发明的目的通过下述技术方案实现:
6.牛大力多糖和/或其改性多糖在延缓油脂氧化中的应用。
7.所述的牛大力多糖可根据中国专利(专利号为201911238835x,名称为一种牛大力多糖及制备方法以及其在抗菌方面中的应用)中的实施例1~3制备得到。
8.所述的牛大力改性多糖为乙酰化牛大力改性多糖,即经乙酸酐法等乙酰化的牛大力改性多糖;优选为通过如下方法准备得到:
9.将牛大力多糖溶于水中,调节ph值至8.0~9.0,然后逐滴滴加乙酸酐,同时滴加碱性溶液使溶液的ph值维持在8.0~8.5,待反应结束后,调节ph值至7.0,透析,冻干,得到改性牛大力多糖。
10.所述的牛大力多糖的用量为按每毫升(ml)水配比30
±
5mg牛大力多糖计算。
11.所述的调节ph值优选为调节ph值至8.0~8.5;更优选为调节ph值至8.0。
12.所述的水优选为蒸馏水。
13.所述的乙酸酐的用量为按每毫升(ml)乙酸酐配比60~300mg牛大力多糖计算。
14.所述的碱性溶液为naoh溶液;优选为浓度为5mol/l的naoh溶液。
15.所述的反应的时间为3~5h;优选为4h。
16.所述的调节ph值至7.0为采用hcl溶液进行调节;优选为采用5mol/l的hcl溶液进行调节。
17.所述的透析为采用截留分子量3500da的透析袋进行透析;优选为采用截留分子量3500da的透析袋透析48h以上。
18.牛大力多糖和/或其改性多糖在延缓油脂氧化中的应用,为将牛大力多糖和/或牛
大力改性多糖加入到油脂中,混合均匀(形成乳液),以延缓油脂氧化。
19.所述的油脂为食用油或工业油;优选为大豆油或散装油等。
20.所述的混合均匀可采用均质的方式进行混合;优选为采用采用高速均质机均质后,再采用微射流设备均质。
21.所述的高速均质机均质的条件优选为:20000rpm下均质3~5min。
22.所述的微射流设备均质的压力优选为:75mpa。
23.所述的牛大力多糖和/或其改性多糖在制备乳化剂中的应用。
24.所述的牛大力多糖和/或其改性多糖在水包油乳液中的应用。
25.本发明相对于现有技术具有如下的优点及效果:
26.(1)本发明采用接枝疏水性基团策略对牛大力多糖进行改性,改性后的牛大力多糖的乳化性能得到了显著提高,且改性牛大力多糖能够用于稳定水包油乳液,因此,可用于开发乳化剂。
27.(2)本发明的改性牛大力多糖稳定乳液的粒径均小于牛大力多糖稳定乳液的粒径,其所形成更小的液滴使接触比表面积变大,一般来说会加快油脂氧化,但实验结果发现,改性牛大力多糖制备的乳液仍与牛大力多糖制备的乳液保持一样的脂质氧化速率,是由于改性后的牛大力多糖有更多的多糖吸附到油水界面,形成了较致密且有粘弹性的界面层,这个界面层对于一些促氧化剂能够起到物理屏蔽作用,因此,牛大力多糖或改性后的牛大力多糖能够有效延缓脂质的氧化速率。
附图说明
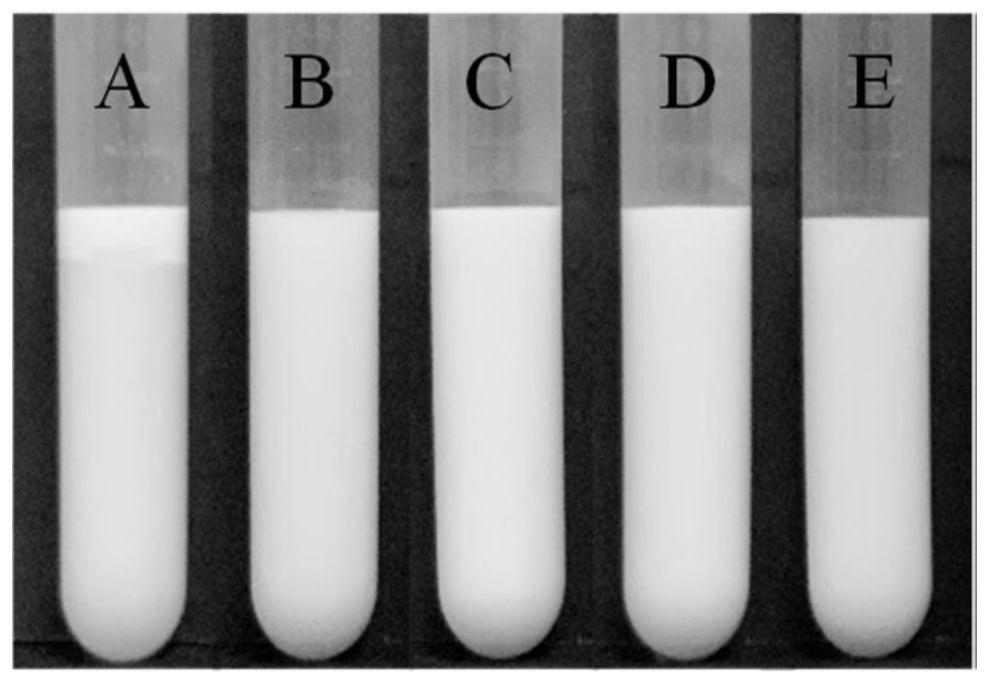
28.图1是牛大力多糖mscp、ac
‑
mscp1、ac
‑
mscp2、ac
‑
mscp3和阿拉伯胶ga所制备的乳液的照片图(图中,a:mscp;b:ac
‑
mscp1;c:ac
‑
mscp2;d:ac
‑
mscp3;e:阿拉伯胶ga)。
29.图2是牛大力多糖mscp、改性牛大力多糖ac
‑
mscp和阿拉伯胶ga所制备的乳液的粒径分布图。
30.图3是牛大力多糖mscp、改性牛大力多糖ac
‑
mscp和阿拉伯胶ga所制备的乳液的平均粒径大小(mean droplet size)图。
31.图4是储存期间牛大力多糖mscp、改性牛大力多糖ac
‑
mscp和阿拉伯胶ga所制备的乳液的平均粒径大小变化图。
32.图5是牛大力多糖mscp、改性牛大力多糖ac
‑
mscp对dpph和羟基(hydroxyl)自由基的清除情况图;其中,a为对dpph的清除率;b为对羟基自由基的清除率。
33.图6是储存期间油脂氢过氧化物(lipid hydroperoxides)和丙二醛(mda)的变化情况图;其中,a为油脂氢过氧化物的变化情况;b为丙二醛的变化情况。
34.图7是流变学动态频率扫描结果图。
具体实施方式
35.下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。下列实施例中未注明具体实验条件的试验方法,通常按照常规实验条件或按照制造厂所建议的实验条件。除非特别说明,本发明所用试剂和原材料均可通过市售获得。
36.本发明实施例中所用ab
‑
8大孔树脂的预处理方法、改性牛大力多糖的含量的测定方法以及牛大力多糖的制备方法可参考中国专利(专利号为201911238835x,名称为一种牛大力多糖及制备方法以及其在抗菌方面中的应用)进行,具体为:
37.1、本发明实施例中所用ab
‑
8大孔树脂(购于上海源叶生物科技有限公司)先进行预处理,具体步骤如下:
38.(1)装柱前清洗层析柱(柱高90cm,内径5cm),以防有害物对树脂的污染,并排净柱子内的水。
39.(2)先于吸附柱内加入相当于装填树脂体积0.4~0.5倍的乙醇或甲醇,然后将新树脂投入柱(ab
‑
8装入层析柱的高度为65cm)中,使其液面高于树脂层约0.3m处,并浸泡24小时。
40.(3)用2bv(bv指柱体积)乙醇或甲醇,以2bv/h的流速通过树脂层,并浸泡4~5小时。
41.(4)用乙醇或甲醇,以2bv/h的流速通过树脂层,洗至流出液加水不呈白色浑浊为止,并以水以同样流速洗净乙醇或甲醇。
42.(5)用2bv的质量分数5%的hcl溶液,以4~6bv/h的流速通过树脂层,并浸泡2~4小时,而后用水以同样流速洗至出水ph中性。
43.(6)用2bv的质量分数2%的naoh溶液,以4~6bv/h的流速通过树脂层,并浸泡2~4小时,而后用水以同样流速洗至出水ph中性。
44.2、本发明实施例中涉及的采用苯酚
‑
硫酸法测定改性牛大力多糖的含量的方法如下:
45.标准曲线的绘制:称取10mg干燥至恒重的葡萄糖,用蒸馏水定容到100ml棕色容量瓶中,配制成浓度为0.1mg/ml的标准葡萄糖溶液,分别吸取0,0.2,0.4,0.6,0.8,1.0,1.2,1.4,1.6ml标准葡萄糖溶液于试管,用蒸馏水补充至2ml,再加1ml质量分数5%的苯酚和5ml浓硫酸(质量分数95.5%),摇匀后室温中放置20min,于490nm测定吸光度值,得到回归方程为:y=0.0119x
‑
0.0023(r2=0.9905)。
46.将待测样品配制成1mg/ml,按照同样方法进行测定,即加1ml质量分数5%的苯酚和5ml浓硫酸,摇匀后室温中放置20min,于490nm测定吸光度值,将吸光度值代入回归方程,即可计算得待测样品的含量。
47.实施例1:改性牛大力多糖的制备
48.(1)牛大力多糖的制备:
49.①
将牛大力(产于中国广东省肇庆市封开县)根块清洗干净后切成片状,经过烘干(60℃干燥15小时)、粉碎,过100目筛,得到牛大力根块粉末;采用热水回流法浸提牛大力根块粉末,条件为温度80℃,料液比1:10,提取时间1h;浸提结束后离心取上清液,按以上条件重复提取两遍,合并上清液,55℃减压浓缩至1/4体积,得到牛大力多糖粗提液;
50.②
为脱除色素和蛋白质,将300ml牛大力多糖粗提液加入ab
‑
8大孔树脂柱(柱高65cm,内径5cm)中,静置吸附4h后用蒸馏水洗脱,收集洗脱液,55℃减压浓缩至100ml;再用sevag法继续脱除残余蛋白,向浓缩液中添加1/5体积的sevag试剂(氯仿:正丁醇=4:1,v/v),于摇床(180rpm)中振荡20min,再在4000r/min条件下离心4min,取上清液,重复操作5遍(即向获得的上清液中加入1/5体积sevag试剂,振荡,离心,取上清液,重复5次);向上清液
中加入4倍体积的无水乙醇进行醇沉,于4℃冰箱放置12h,4000r/min离心4min,取沉淀,加水(30ml)将沉淀复溶,流动水透析(透析袋3500da)48h除小分子杂质,冻干,得到牛大力多糖mscp
‑
1;
51.(2)制备改性牛大力多糖:将300mg牛大力多糖mscp
‑
1溶于10ml蒸馏水中,搅拌至完全溶解,将ph调至8.0,向多糖溶液中逐滴添加1ml乙酸酐,同时滴加naoh(5m)使溶液的ph始终维持在8.0~8.5,整个反应持续4h;反应结束后,用hcl(5m)将ph调回7.0,于蒸馏水中透析48h(透析袋3500da),冻干,得到改性牛大力多糖ac
‑
mscp1。
52.实施例2:改性牛大力多糖的制备
53.(1)牛大力多糖的制备:
54.①
将牛大力(产于中国广东省肇庆市封开县)根块清洗干净后切成片状,经过烘干(60℃干燥15小时)、粉碎,过100目筛,得到牛大力根块粉末;采用热水回流法浸提牛大力根块粉末,条件为温度90℃,料液比1:20,提取时间2h;浸提结束后离心取上清液,按以上条件重复提取两遍,合并上清液,65℃减压浓缩至1/4体积,得到牛大力多糖粗提液;
55.②
为脱除色素和蛋白质,将300ml牛大力多糖粗提液加入ab
‑
8大孔树脂柱(柱高65cm,内径5cm)中,静置吸附4h后用蒸馏水洗脱,收集洗脱液,65℃减压浓缩至100ml;再用sevag法继续脱除残余蛋白,向浓缩液中添加1/5体积的sevag试剂(氯仿:正丁醇=4:1,v/v),于摇床(180rpm)中振荡30min,再在5000r/min条件下离心5min,取上清液,重复操作5遍;向上清液中加入4倍体积的无水乙醇进行醇沉,于4℃冰箱放置12h,5000r/min离心5min取沉淀,加水(30ml)将沉淀复溶,流动水透析(透析袋3500da)48h除小分子杂质,冻干,得到牛大力多糖mscp
‑
2;
56.(2)制备改性牛大力多糖:将300mg牛大力多糖mscp
‑
2溶于10ml蒸馏水中,搅拌至完全溶解,将ph调至8.0,向多糖溶液中逐滴添加3ml乙酸酐,同时滴加naoh(5m)使溶液的ph始终维持在8.0~8.5,整个反应持续4h;反应结束后,用hcl(5m)将ph调回7.0,于蒸馏水中透析48h(透析袋3500da),冻干,得到改性牛大力多糖ac
‑
mscp2。
57.实施例3:改性牛大力多糖的制备
58.(1)牛大力多糖的制备:
59.①
将牛大力(产于中国广东省肇庆市封开县)根块清洗干净后切成片状,经过烘干(60℃干燥15小时)、粉碎,过100目筛,得到牛大力根块粉末;采用热水回流法浸提牛大力根块粉末,条件为温度100℃,料液比1:30,提取时间3h;浸提结束后离心取上清液,按以上条件重复提取两遍,合并上清液,75℃减压浓缩至1/4体积,得到牛大力多糖粗提液;
60.②
为脱除色素和蛋白质,将300ml牛大力多糖粗提液加入ab
‑
8大孔树脂柱(柱高65cm,内径5cm)中,静置吸附4h后用蒸馏水洗脱,收集洗脱液,75℃减压浓缩至100ml;再用sevag法继续脱除残余蛋白,向浓缩液中添加1/5体积的sevag试剂(氯仿:正丁醇=4:1,v/v),于摇床(180rpm)中振荡40min,再在6000r/min条件下离心6min,取上清液,重复操作5遍;向上清液中加入4倍体积的无水乙醇进行醇沉,于4℃冰箱放置12h,6000r/min离心6min取沉淀,加水(30ml)将沉淀复溶,流动水透析(透析袋3500da)48h除小分子杂质,冻干,得到牛大力多糖mscp
‑
3;
61.(2)制备改性牛大力多糖:将300mg牛大力多糖mscp
‑
3溶于10ml蒸馏水中,搅拌至完全溶解,将ph调至8.0,向多糖溶液中逐滴添加5ml乙酸酐,同时滴加naoh(5m)使溶液的ph
international corpotation,newton,ma)将所得粗乳液在75mpa下均质两次,得到最后的乳液,静置12h后拍照,并采用激光粒度分析仪测定新鲜或储存期间的乳液的粒径分布和平均粒径。
77.(2)结果分析:
78.所形成的乳液如图1所示,mscp稳定的乳液在制备结束后迅速发生了明显的分层现象,而改性牛大力多糖ac
‑
mscp1、ac
‑
mscp2、ac
‑
mscp3稳定的乳液没有分层,表明疏水性改造能够有效提高乳液的分层稳定性。
79.粒径分布及平均粒径大小如图2和3所示,mscp稳定的乳液的液滴粒径分布范围较广(0.5~100um),平均粒径为15.51
±
1.09um。相比之下,改性牛大力多糖ac
‑
mscp1、ac
‑
mscp2、ac
‑
mscp3稳定的乳液的液滴粒径分布向较低的粒径范围移动,其中ac
‑
mscp1、ac
‑
mscp2和ac
‑
mscp3稳定的乳液的平均液滴粒径分别为1.57
±
0.02μm、0.24
±
0.01μm和0.31
±
0.01μm。改性牛大力多糖稳定乳液的粒径均小于牛大力多糖稳定乳液的粒径,表明疏水性改造能够有效提高牛大力多糖的乳化能力。此外,ac
‑
mscp2和ac
‑
mscp3稳定的乳液的平均液滴粒径小于ga稳定的乳液的平均液滴粒径(0.71
±
0.03um),表明ac
‑
mscp2和ac
‑
mscp3的乳化性能优于商业多糖乳化剂。
80.储存期间牛大力多糖、改性牛大力多糖和阿拉伯胶ga所制备的乳液的平均粒径大小的变化如图4所示,mscp稳定的乳液在贮存30d后,平均粒径由15.51
±
1.09um显著增大到30.30
±
2.39um,比初始粒径增大近2倍。相比之下,ac
‑
mscp1、ac
‑
mscp2和ac
‑
mscp3稳定的乳液的平均液滴尺寸分别从1.57
±
0.02μm、0.24
±
0.01μm和0.31
±
0.01μm逐渐增大到1.82
±
0.09μm、1.10
±
0.01μm和0.50
±
0.08μm。结果表明,疏水性改造能够有效提高牛大力多糖的乳化稳定性。
81.实施例8:抗氧化活性的测定
82.(1)dpph自由基清除能力的测定:将150ul牛大力多糖mscp
‑
1(简称mscp),及改性牛大力多糖ac
‑
mscp1、ac
‑
mscp2、ac
‑
mscp3溶液(0.25~2mg/ml)分别与50ul 1,1
‑
二苯基
‑2‑
三硝基苯肼(dpph)溶液(1mm)混合,并使反应在黑暗中保持30min。使用微孔板读取器记录517nm处的吸光度。以等量无水乙醇代替dpph溶液作为背景组,以等量蒸馏水代替样品溶液作为空白对照组。
83.(2)羟基自由基清除能力的测定:相应地,向1ml硫酸亚铁(9mm)中加入1ml水杨酸(9mm)和1ml蒸馏水。然后,向混合物中添加1ml待测样品溶液(0.25
‑
2mg/ml)和1ml h2o2(8.8mm)。37℃孵育30min后,测定510nm处的吸光度。以等量蒸馏水代替样品溶液作为空白对照组,以等量蒸馏水代替h2o2作为背景组。按照以下方程计算清除率(scavenging activity):
84.清除率=(1
‑
(a1‑
a2)/a0)
×
100;
85.式中,a0、a1和a2分别代表空白对照组、样品组和背景组。
86.(3)结果分析:如图5a所示,所有样品的dpph自由基清除率随着浓度的增加而逐渐增加。在2mg/ml浓度下,mscp、ac
‑
mscp1、ac
‑
mscp2和ac
‑
mscp3对dpph自由基的清除率分别为93.57%
±
3.03、76.25%
±
1.25、84.17%
±
1.91和86.25%
±
3.54。与牛大力多糖相比,乙酰化牛大力多糖的dpph自由基清除活性下降。同样,在任一浓度下,牛大力多糖对羟自由基的清除率明显高于改性牛大力多糖(图5b),说明所采用的改性方法对牛大力多糖的抗氧
化活性有一定的损害。
87.实施例9:油脂氧化产物的测定
88.(1)测定实施例7中制备的乳液(即牛大力多糖mscp
‑
1(简称mscp)稳定的乳液,以及改性牛大力多糖ac
‑
mscp1、ac
‑
mscp2和ac
‑
mscp3稳定的乳液)中氢过氧化物和丙二醛的含量,以散装油(市售大豆油
‑
金龙鱼品牌)中氢过氧化物和丙二醛作为对照,其中,测定方法如下:
89.①
氢过氧化物的测定:向1.5ml混合物a(异辛烷:2
‑
丙醇=3:1,v/v)中加入0.5ml乳液样品,然后旋涡3次(每次20s)。在3000g离心5min后,收集0.2ml上清液并添加2.8ml混合物b(甲醇:1
‑
丁醇=2:1,v/v)。接下来,添加15ul硫氰酸铵溶液(3.94m)和15ul亚铁离子(将等体积的0.288m的硫酸亚铁溶液与0.264m的氯化钡溶液混合后于5000r/mim离心3min,上清液即获得亚铁离子)。所得混合物在室温下培养20分钟后在510nm处测量吸光度。配置系列浓度的过氧化氢溶液(15.625,31.25,62.5,125umol/l)作为标准品,按照以上同样方法进行测定,绘制标准曲线,所得回归方程为:y=0.0105x+0.0366(r2=0.998,y表示吸光度值,x表示过氧化氢浓度)。
90.②
丙二醛的测定:0.2ml样品乳液与1.8ml蒸馏水和4ml硫代巴比妥酸(tba)(0.375%,w/v)混合,然后将上述混合物放入沸水中15min,在10000rpm离心5min后,取上清液,在532nm处检测吸光度。配置系列浓度(0.1,0.2,0.4,0.6,0.8,1ug/ml)的丙二醛二乙缩醛作为标准品,按照以上同样方法进行测定,绘制标准曲线,所得回归方程为:y=0.4106x+0.0552(r2=0.999,y表示吸光度值,x表示丙二醛浓度)。
91.(2)结果分析:如图6a所示,在储存30d后,散装油(bulk oil)的氢过氧化物浓度从0.0575
±
0.004mmol/kg oil显著增加到0.366
±
0.038mmol/kg oil。然而,在储存期间,牛大力多糖或改性牛大力多糖稳定乳剂中的氢过氧化物(lh)浓度仅略有增加。此外,牛大力多糖mscp或改性牛大力多糖ac
‑
mscp1、ac
‑
mscp2、ac
‑
mscp3所制备乳液中的氢过氧化物浓度在储存30d后未发现显著差异(p<0.05)。同样,牛大力多糖mscp或改性牛大力多糖ac
‑
mscp1、ac
‑
mscp2、ac
‑
mscp3稳定乳剂在贮藏30d后,丙二醛含量也明显低于散装油(图6b)。以上结果表明,牛大力多糖mscp或改性牛大力多糖ac
‑
mscp1、ac
‑
mscp2、ac
‑
mscp3能有效延缓脂质的氧化速率。此外,虽然乙酰化导致了抗氧剂的抗氧化能力下降(图5),但改性牛大力多糖制备的乳液仍与牛大力多糖制备的乳液保持一样的脂质氧化速率,是由于改性后的牛大力多糖有更多的改性多糖吸附到油水界面,形成了较致密且有粘弹性的界面层,这个界面层对于一些促氧化剂能够起到物理屏蔽作用,因此,能够有效延缓脂质的氧化速率。
92.实施例10:流变特性的测定
93.采用流变仪mcr 102(anton paar,奥地利)在25℃下测定了新鲜乳液的界面流变行为。平行板直径40mm,间隙1mm。将样品(即按实施例7中的方法制备的牛大力多糖mscp
‑
1(简称mscp)稳定的乳液,以及改性牛大力多糖ac
‑
mscp1、ac
‑
mscp2和ac
‑
mscp3稳定的乳液)置于流变仪平台上,进行动态频率扫描,记录弹性模量(g
′
)和粘性模量(g
″
)在频率范围为0.1至10rad/s内的变化,所有测量均在线性粘弹性区域内进行(应力固定在0.5%)。
94.结果分析:如图7所示,在所有乳液中,弹性模量(g
′
)在整个频率范围内均高于粘性模量(g
″
),这表明所制备的乳液表现出明显的弹性行为。同时,由于改性牛大力多糖链中疏水乙酰基与油滴之间的相互作用,改性牛大力多糖所制备的乳液的g
′
和g
″
均高于未改性
的牛大力多糖。此外,随着ds值(取代度)的增加,g
′
和g
″
显著增加(即随着取代度增加,ac
‑
mscp1、ac
‑
mscp2及ac
‑
mscp3稳定的乳液的粘弹性也逐渐增加),说明乙酰化程度的提高有助于形成更具弹性和粘性的界面。这些结果说明乙酰化改性对改性牛大力多糖形成的界面层的流变行为有积极的影响。也就是说,接枝乙酰基有助于构建具有强粘弹性的界面层。这种强粘弹性的界面层能够对促氧化剂起到物理屏蔽作用,进而可以延缓油脂氧化。
95.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1