一类千金子二萜衍生物及其应用
本发明属于有机化学领域,具体涉及一类千金子二萜衍生物及其应用。
背景技术:
多药耐药(mdr)是指对一种药物耐药的同时,伴有对其他结构和功能无关的药物也产生耐药的现象;mdr是恶性肿瘤化疗失败的主要原因之一。导致mdr发生的主要机制之一为p-gp的过表达。p-gp作为一个能量依赖的外排泵,可减少细胞内抗癌药物的积累,从而降低药物的疗效。因此,能够抑制p-gp活性的化合物可能具有逆转mdr的潜力。
在众多化合物中,大戟因子l1-l11被发现具有抗肿瘤、抗病毒、抗炎等活性,被视为p-gp介导的mdr的最有希望的逆转剂。但已公开的大戟因子及其衍生物,逆转效果并不显著。
技术实现要素:
本发明的目的是提供一类具有高mdr逆转活性的千金子二萜衍生物及其应用。
为实现上述发明目的,本发明所采用的技术方案是:一类千金子二萜衍生物,结构通式为:
其中,r1为h或p-nitrobenzoyl或benzoyl,
r2为p-nitrobenzoyl或ac或2-thiophenecarbonyl,
r3为p-nitrobenzoyl或benzoyl或2-thiophenecarbonyl,
r4为h或br。
优选的,r1=h,r2=r3=p-nitrobenzoyl,r4=h。
优选的,r1=r2=r3=p-nitrobenzoyl,r4=h。
优选的,r1=r3=benzoyl,r2=ac,r4=h。
优选的,r1=h,r2=r3=2-thiophenecarbonyl,r4=h。
优选的,r1=r3=benzoyl,r2=ac,r4=br。
相应的,所述千金子二萜衍生物在药物领域的应用。
优选的,在逆转mdr上的应用。
本发明具有以下有益效果:本发明从千金子中提取到了4种化合物:对大戟因子化合物18、38、39、41。并对这四种化合物进行结构改造,设计并合成了化合物1~17,19~37、40,共37个衍生化合物,经核磁共振氢谱、质谱、x-ray单晶衍射等方法确定其结构,再对其进行药理活性研究,为寻找多药耐药逆转剂提供了有益的参考。
本发明得到了25个在mcf-7/adr细胞内逆转活性优于维拉帕米的二萜化合物,且化合物17、29的逆转倍数分别为460.32、911.94,分别是vrp的229倍、454倍,远高于目前已知的此类化合物。
附图说明
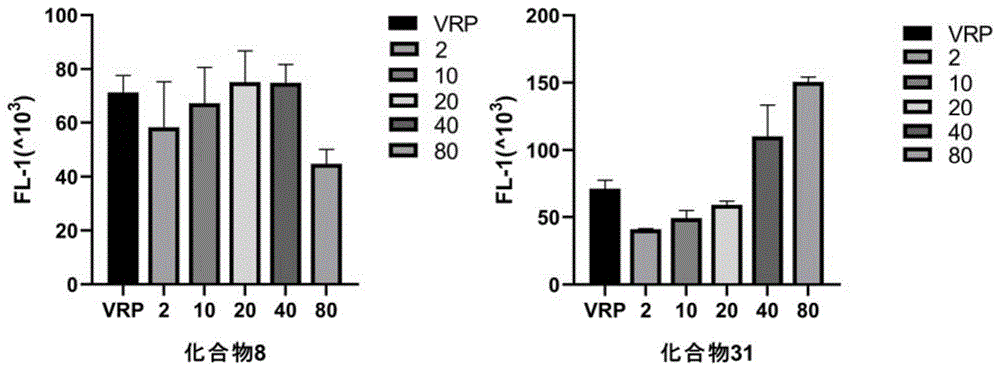
图1为化合物8、化合物31分别在mcf-7/adr细胞内的罗丹明积累变化示意图;
图2为mcf-7/adr在化合物17、29、38不同浓度下处理2h后dox积累,用imagej软件分析得到的荧光数据柱状图;
图3为化合物8、17、29、31和38p-gp表达的westernblot实验结果示意图。
具体实施方式
本发明从大戟植物千金子中提取得到化合物18、38、39、41,并分别对这些化合物进行结构改造,设计并合成了化合物1~17、19~37、40。经核磁共振氢谱、质谱、x-ray单晶衍射等方法确定上述41个化合物的结构,再对其进行药理活性研究,最终筛选得到25个在mcf-7/adr细胞内逆转活性优于维拉帕米的二萜化合物。其中,化合物17、29、38的逆转倍数分别为460.32、911.94、438.69。
化合物1~41的结构式如下所示:
1、
其中,化合物1~25、30、31的各r基分别对应如下:
化合物1:r1=r2=r3=r4=h。
化合物2:r1=r2=h,r3=ac,r4=h。
化合物3:r1=r2=h,r3=p-chlorophenyl,r4=h。
化合物4:r1=r2=h,r3=m-nitrobenzoyl,r4=h。
化合物5:r1=r2=h,r3=p-nitrobenzoyl,r4=h。
化合物6:r1=r2=h,r3=p-tolylaceyl,r4=h。
化合物7:r1=r2=h,r3=cinnamoyl,r4=h。
化合物8:r1=r2=h,r3=1-naphthylacetyl,r4=h。
化合物9:r1=benzoyl,r2=r3=h,r4=h。
化合物10:r1=r2=h,r3=2-naphthoyl,r4=h。
化合物11:r1=r3=benzoyl,r2=h,r4=h。
化合物12:r1=r3=m-nitrobenzoyl,r2=h,r4=h。
化合物13:r1=h,r2=r3=furoyl,r4=h。
化合物14:r1=h,r2=r3=m-nitrobenzoyl,r4=h。
化合物15:r1=h,r2=r3=cinnamoyl,r4=h。
化合物16:r1=h,r2=r3=benzoyl,r4=h。
化合物17:r1=h,r2=r3=p-(trifluoromethyl)benzoyl,r4=h。
化合物18:r1=r3=benzoyl,r2=r4=ac。
化合物19:r1=r2=r3=p-toluoyl,r4=h。
化合物20:r1=r2=r3=m-nitrobenzoyl,r4=h。
化合物21:r1=r2=r3=benzoyl,r4=h。
化合物22:r1=r2=r3=p-nitrobenzoyl,r4=h。
化合物23:r1=r2=r3=p-(trifluoromethyl)benzoyl,r4=h。
化合物24:r1=r2=r3=ac,r4=h。
化合物25:r2=r3=benzoyl,r1=ac,r4=h。
2、
其中,化合物26~29、34的各r基分别对应如下:
化合物26:r1=h,r2=r3=p-nitrobenzoyl,r4=h。
化合物27:r1=r2=r3=p-nitrobenzoyl,r4=h。
化合物28:r1=r3=benzoyl,r2=ac,r4=h。
化合物29:r1=h,r2=r3=2-thiophenecarbonyl,r4=h。
化合物34:r1=r3=benzoyl,r2=ac,r4=br。
3、
其中,化合物30、31的各r基分别对应如下:
化合物30:r1=r3=benzoyl,r2=r5=ac,r4=r5=h。
化合物31:r1=r3=benzoyl,r2=ac,r4=r5=h。
4、
其中,化合物32、33的各r基分别对应如下:
化合物32:r1=r3=benzoyl,r2=r4=r5=ac。
化合物33:r1=r3=benzoyl,r2=ac,r4=r5=propionyl。
5、
化合物35的各r基分别为:r1=r3=benzoyl,r2=r4=ac。
6、
化合物36的各r基分别为:r1=phenylacetyl,r2=r3=ac。
7、
化合物37:r1=h。化合物38:r1=benzoyl。
8、
化合物39:r1=cinamoyl,r2=r3=ac。化合物40:r1=r2=r3=h。
9、
化合物41:r1=phenylacetyl,r2=r3=ac。
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
实施例一:化合物1~41的制备和测定
1、化合物1、37、40的制备。在1%(m/v)naoh/meoh溶液体系中,分别以化合物18、38、39作为原料(化合物18对应化合物1,以此类推),常温反应24h。反应后,用乙酸乙酯萃取,浓缩,色谱柱分离(石油醚与乙酸乙酯混合溶液洗脱),得到目标产物。化合物1、37、40的核磁共振数据分别如下所示。
化合物1:hrms-esi-tof:[m+na]+373;mp226-228℃;1hnmr(400mhz,acetone)δ7.29(d,j=11.6hz,1h,h-12),5.07(s,1h,h-17α),4.96(d,j=8.5hz,1h,h-7),4.81(s,1h,17β),4.68(s,1h,oh-15),4.44(s,1h,h-5),4.37(s,1h,h-3),4.32(s,2h,oh-5,oh-7),4.06(s,1h,oh-3),3.07(dd,j=13.2,8.8hz,1h,h-1α),2.21(dd,j=8.4,3.3hz,1h,h-4),1.96–1.85(m,2h,h-2,h-8α),1.69–1.61(m,4h,h-1β,h-20),1.45(dd,j=11.6,8.4hz,1h,h-11),1.31–1.25(m,2h,h-8β,h-9),1.16(s,3h,h-19),1.12(s,3h,h-18),1.07(d,j=6.8hz,3h,h-16).
化合物37:hrms-esi-tof:[m+na]+357;1hnmr(400mhz,acetone)δ7.87(d,j=12.4hz,1h,h-12),4.40(s,1h,oh-15),3.98-3.95(m,1h,h-3),3.83(d,j=4.9hz,1h,oh-3),3.44(d,j=9.5hz,1h,h-5),3.15(dd,j=12.3,7.3hz,1h,h-1α),2.02–1.98(m,1h,h-2),1.97-1.95(m,1h,h-7α),1.80(d,j=1.0hz,3h,h-20),1.76-1.70(m,1h,h-1β),1.67–1.64(m,1h,h-4),1.63-1.61(m,1h,h-11),1.49–1.41(m,1h,h-7β),1.28(dd,j=9.6,3.3hz,2h,h-8α,h-8β),1.24-1.22(m,1h,h-9),1.20(s,3h,h-18),1.13(s,3h,h-17),1.09(s,3h,h-19),1.05(d,j=6.5hz,3h,h-16).
化合物40:hrms-esi-tof:[m+na]+357;1hnmr(400mhz,acetone)δ7.45(d,j=12.9hz,1h,h-12),5.88(d,j=10.9hz,1h,h-5),4.10(s,1h,oh-15),4.04(d,j=5.2hz,1h,oh-3),3.94–3.86(m,1h,h-3,h-17α),3.52(dd,j=12.0,6.8hz,1h,h-17β),3.39(dd,j=6.8,4.2hz,1h,oh-17),3.31(dd,j=13.5,9.0hz,1h,h-1α),2.35(dd,j=10.9,3.2hz,1h,h-4),2.31–2.26(m,1h,h-9),2.22-2.18(m,1h,h-7α),1.91-1.84(m,1h,h-2),1.76(d,j=1.0hz,3h,h-20),1.62–1.53(m,1h,h-7β),1.52–1.47(m,1h,h-8α),1.44(dd,j=9.3,7.1hz,1h,h-1β),1.29(s,1h,h-8β),1.17(s,3h,h-19),1.15-1.09(m,1h,h-11),1.07(d,j=6.8hz,3h,h-16),1.05(s,3h,h-18).
2、化合物2、24的制备方法:在dcm、bf3·et2o体系中,使用化合物1与乙酸酐反应得到目标产物。制备方法为:在氩气保护下,往冰浴的ch2cl2(5ml)溶液中依次加入化合物1(76mg,0.22mmol)、乙酸酐(21ul,0.22mmol),bf3·et2o(3ul,0.026mmol)。随后,将反应混合物加热至室温,搅拌10分钟,反应完毕后用ch2cl2稀释反应液,加入饱和nahco3中和反应液。反应液用乙酸乙酯萃取三次,合并有机层并减压蒸发。最后柱层析法分离得到化合物2(产率58%,石油醚/乙酸乙酯=4:1)和化合物24(产率30%,石油醚/乙酸乙酯=15:1)。化合物2、24的核磁共振数据分别如下所示。
化合物2:hrms-esi-tof:[m+na]+415;1hnmr(400mhz,acetone)δ6.33(d,j=10.3hz,1h,h-12),5.13(s,1h,h-17α),5.05(s,1h,h-17β),4.97(s,1h,h-7),4.68(s,1h,oh-15),4.49(s,2h,h-5,oh-5),4.25(s,2h,h-3,oh-3),2.75(dd,j=13.5,8.8hz,1h,h-1α),2.36(s,1h,h-4),2.00–1.92(m,1h,h-2),1.92–1.82(m,4h,h-8α,h-20),1.68(dd,j=13.3,11.3hz,1h,h-1β),1.58–1.42(m,2h,h-8β,h-11),1.30–1.22(m,1h,h-9),1.15(s,3h,h-19),1.13(s,3h,h-18),1.05(d,j=6.7hz,3h,h-16).7-oac:2.04(s,3h).
化合物24:hrms-esi-tof:[m+na]+499;1hnmr(400mhz,acetone)δ7.32(d,j=11.3hz,1h,h-12),6.08(d,j=9.0hz,1h,h-5),5.48(t,j=3.6hz,1h,h-3),5.29(s,1h,h-17α),5.21(dd,j=8.4,3.0hz,1h,h-7),5.08(s,1h,h-17β),4.49(s,1h,oh-15),3.01(dd,j=13.5,8.8hz,1h,h-1α),2.72(dd,j=9.0,3.6hz,1h,h-4),2.29-2.21(m,1h,h-2),2.12(dd,j=9.3,5.8hz,1h,h-8α),1.96–1.91(m,1h,h-8β),1.72(d,j=1.0hz,3h,h-20),1.64(dd,j=13.6,11.4hz,1h,h-1β),1.55(dd,j=11.5,8.5hz,1h,h-11),1.38-1.31(m,1h,h-9),1.17(s,3h,h-19),1.16(s,3h,h-18),0.93(d,j=6.8hz,3h,h-16).3-oac:2.03(s,3h).5-oac:1.94(s,3h).7-oac:1.88(s,3h).
3、化合物3~8、10的制备方法:在edci、dmap、dcm体系中,底物化合物1与相应的酸反应得到目标产物。制备方法为:在0℃的ch2cl2(5ml)溶液中,依次加入化合物1(70mg,0.2mmol)、4-氯苯乙酸(39mg,0.23mmol)、edci(44mg,0.23mmol)和dmap(4mg,0.23mmol)。将混合物在室温下搅拌6h。反应完毕后加水,乙酸乙酯萃取反应液三次,合并有机层并用无水na2so4干燥,减压蒸发,柱层析(石油醚/乙酸乙酯=8:1)纯化得到化合物3,为白色无定形固体(产率46%)。其他条件相同,将4-氯苯乙酸改为间硝基苯甲酸,制备得化合物4,将4-氯苯乙酸改为对硝基苯甲酸,制备得化合物5,将4-氯苯乙酸改为对甲基苯乙酸,制备得化合物6,将4-氯苯乙酸改为肉桂酸,制备得化合物7,将4-氯苯乙酸改为1-萘乙酸,制备得化合物8,将4-氯苯乙酸改为2-萘甲酸,制备得化合物10。
化合物3:hrms-esi-tof:[m+na]+525;1hnmr(400mhz,acetone)δ6.40(d,j=10.4hz,1h,h-12),5.11(s,1h,h-17α),5.05–5.00(m,1h,h-7),4.99(s,1h,h-17β),4.67(s,1h,oh-15),4.52(s,1h,h-5),4.47(d,j=4.8hz,1h,oh-5),4.25(s,1h,h-3),4.23(s,1h,oh-3),2.77(dd,j=13.6,8.6hz,1h,h-1α),2.36(t,j=3.5hz,1h,h-4),2.00-1.93(m,1h,h-2),1.93–1.88(m,1h,h-8α),1.86(s,3h,h-20),1.69(dd,j=13.6,11.1hz,1h,h-1β),1.63–1.53(m,1h,h-8β),1.47(dd,j=10.5,8.9hz,1h,h-11),1.23–1.17(m,1h,h-9),1.15(s,3h,h-19),1.13(s,3h,h-18),1.06(d,j=6.8hz,3h,h-16).7-4-chlorophenylacetyl:7.41–7.32(m,4h),3.76(s,2h).
化合物4:hrms-esi-tof:[m+na]+522;1hnmr(400mhz,acetone)δ6.63(d,j=10.5hz,1h,h-12),5.36(t,j=5.5hz,1h,h-7),5.19(s,2h,h-17α,h-17β),4.71(s,1h,oh-15),4.68(d,j=4.8hz,1h,h-5),4.52(d,j=6.0hz,1h,h-3),4.35–4.30(m,1h,oh-3),4.24(d,j=3.7hz,1h,oh-5),2.86–2.81(m,1h,h-1α),2.46(t,j=4.0hz,1h,h-4),2.23-2.16(m,1h,h-8α),1.96(s,1h,h-2),1.90(s,3h,h-20),1.87–1.77(m,1h,h-8β),1.72(dd,j=13.5,11.1hz,1h,h-1β),1.56(dd,j=10.7,8.8hz,1h,h-11),1.40(qd,j=8.7,4.3hz,1h,h-9),1.20(s,3h,h-19),1.16(s,3h,h-18),1.08(d,j=6.8hz,3h,h-16).7-m-nitrobenzoyl:8.87–8.82(m,1h),8.51(d,j=8.6hz,2h),7.86(t,j=8.0hz,1h).
化合物5:hrms-esi-tof:[m+na]+522;1hnmr(400mhz,acetone)δ6.62(d,j=10.5hz,1h,h-12),5.35(t,j=5.5hz,1h,h-7),5.18(s,2h,h-17α,h-17β),4.70(s,1h,oh-15),4.67(d,j=4.8hz,1h,h-5),4.49(d,j=6.0hz,1h,h-3),4.35–4.30(m,1h,oh-3),4.23(d,j=3.7hz,1h,oh-5),2.86–2.81(m,1h,h-1α),2.46(t,j=4.0hz,1h,h-4),2.20-2.12(m,1h,h-8α),2.02-1.98(m,1h,h-2),1.90(s,3h,h-20),1.86–1.78(m,1h,h-8β),1.72(dd,j=13.5,11.1hz,1h,h-1β),1.56(dd,j=10.7,8.8hz,1h,h-11),1.42-1.36(m,1h,h-9),1.20(s,3h,h-19),1.16(s,3h,h-18),1.08(d,j=6.8hz,3h,h-16).7-p-nitrobenzoyl:8.42–8.33(m,4h).
化合物6:hrms-esi-tof:[m+na]+505;1hnmr(400mhz,acetone)δ6.32(d,j=10.4hz,1h,h-12),5.10(s,1h,h-17α),5.02–4.98(m,1h,h-7),4.97(s,1h,h-17β),4.67(s,1h,oh-15),4.45(s,1h,oh-15),4.49(s,1h,h-5),4.24(s,2h,h-3,oh-3),2.76(dd,j=13.6,8.7hz,1h,h-1α),2.36(t,j=3.4hz,1h,h-4),2.01–1.92(m,1h,h-2),1.90–1.83(m,4h,h-8α,h-20),1.68(dd,j=13.6,11.0hz,1h,h-1β),1.58–1.49(m,1h,h-8β),1.46(dd,j=10.5,8.9hz,1h,h-11),1.23-1.18(m,1h,h-9),1.15(s,1h,h-19),1.12(s,1h,h-18),1.06(d,j=6.8hz,1h,h-16).7-p-tolyacetyl:7.20(t,j=7.4hz,2h),7.16–7.09(t,j=7.4hz,2h),3.68(s,2h),2.30(s,3h).
化合物7:hrms-esi-tof:[m+na]+503;1hnmr(400mhz,acetone)δ6.27(d,j=10.4hz,1h,h-12),5.19(s,1h,h-17α),5.12(brs,1h,h-7),5.10(s,1h,h-17β),4.70(s,1h,oh-15),4.60(d,j=5.0hz,1h,oh-5),4.53(s,1h,h-5),4.31-4.29(m,1h,oh-3),4.26(d,j=3.6hz,1h,h-3),2.82–2.73(m,1h,h-1α),2.46(t,j=3.1hz,1h,h-4),2.01-1.97(m,1h,h-2),1.95(s,1h,h-8α),1.94(s,3h,h-20),1.71(dd,j=13.7,10.9hz,1h,h-1β),1.60(dd,j=12.8,2.5hz,1h,h-8β),1.56–1.48(m,1h,h-11),1.35–1.27(m,1h,h-9),1.18(s,3h,h-19),1.14(s,3h,h-18),1.08(d,j=6.8hz,3h,h-16).7-o-cinnamoyl:7.75(d,j=16.2hz,1h),7.73–7.68(m,2h),7.46–7.42(m,3h),6.65(d,j=16.0hz,1h).
化合物8:hrms-esi-tof:[m+na]+541;1hnmr(400mhz,acetone)δ6.26(d,j=10.4hz,1h,c-12),5.10(s,1h,h-17α),4.99(d,j=3.4hz,1h,h-7),4.97(s,1h,h-17β),4.64(s,1h,oh-15),4.22(brs,3h,h-3,h-5,oh-5),4.17(d,j=3.5hz,1h,oh-3),2.73(dd,j=13.6,8.7hz,1h,h-1α),2.35(s,1h,h-4),1.96(s,1h,h-2),1.84(s,3h,h-20),1.83–1.75(m,1h,h-8α),1.67(dd,j=13.6,11.1hz,1h,h-1β),1.53–1.43(m,1h,h-8β),1.41–1.34(m,1h,h-11),1.29(s,1h,h-9),1.12(s,3h,h-19),1.06(s,3h,h-18),1.04(d,j=6.6hz,3h,h-16).7-o-(1-naphthylacetyl):8.08(d,j=8.0hz,1h),7.94(d,j=8.5hz,1h),7.87(d,j=7.8hz,1h),7.52(qd,j=15.1,6.9hz,4h),4.46(s,2h).
化合物10:hrms-esi-tof:[m+na]+527;1hnmr(400mhz,acetone)δ6.38(d,j=10.3hz,1h,h-12),5.34-5.31(m,1h,h-7),5.23(s,1h,h-17α),5.20(s,1h,h-17β),4.73(s,1h,oh-15),4.64(s,1h,h-5),4.35(dd,j=7.3,3.7hz,1h,h-3),4.29(d,j=3.8hz,1h,oh-3),2.85–2.78(m,1h,h-1α),2.54(s,1h,h-4),2.20-2.14(m,1h,h-2),1.98(s,3h,h-20),1.78–1.67(m,2h,h-8α,h-11),1.57(dd,j=10.4,9.0hz,1h,h-1β),1.43-1.36(m,1h,h-8β),1.29(s,1h,h-9),1.22(s,3h,h-19),1.16(s,3h,h-18),1.10(d,j=6.8hz,1h,h-16).7-o-(2-naphthoyl):8.76(s,1h),8.19–8.07(m,2h),8.05–7.99(m,2h),7.74–7.51(m,2h).
4、所述的化合物9、11~17、19~23、26~27和29的制备方法:在dmap、et3n体系中,底物化合物1与相应的酰氯、酸酐反应得到目标产物。化合物9和化合物21的制备方法:在冰浴下的ch2cl2(10ml)溶液中依次加入化合物1(170mg,0.49mmol)、dmap(7mg,0.06mmol)、et3n(204μl,1.47mmol)和苯甲酰氯(226μl,1.96mmol)。将反应逐渐升温至室温,搅拌24h,反应完毕后柱层析进一步纯化,得到化合物9(石油醚/乙酸乙酯=8:1,产率19%)和化合物21(石油醚/乙酸乙酯=12:1,产率31%),均为白色无定形固体。
参照化合物9的制备方法,其他条件相同的情况下,将苯甲酰氯替换为对甲基苯甲酰氯,反应得化合物19,将苯甲酰氯替换为间硝基苯甲酰氯,反应得化合物20,将苯甲酰氯替换为对硝基苯甲酰氯,反应同时得化合物22、化合物26和化合物27,将苯甲酰氯替换为对三氟甲基苯甲酰氯,反应得化合物23,将苯甲酰氯替换为噻吩甲酰氯,反应得化合物29。
化合物12和化合物14的制备方法为:在冰浴下的ch2cl2(10ml)溶液中,依次加入化合物1(140mg,0.49mmol)、dmap(7mg,0.06mmol)、et3n(204μl,1.47mmol)和间硝基苯甲酰酐(113μl,0.98mmol)。反应液逐步升温至室温,搅拌反应12h,反应完毕后柱层析进一步纯化得到化合物12(石油醚/乙酸乙酯=8:1,产率14%)和化合物14(石油醚/乙酸乙酯=12:1,产率13%)。
参照化合物12的制备方法,其他条件相同的情况下,将间硝基苯甲酰酐替换为苯甲酸酐,反应得化合物11和化合物16,将间硝基苯甲酰酐替换为呋喃甲酰氯,反应得化合物13,将间硝基苯甲酰酐替换为肉桂酰氯,反应得化合物15,将间硝基苯甲酰酐替换为对三氟甲基苯甲酰氯,反应得化合物17。
化合物9:hrms-esi-tof:[m+na]+477;1hnmr(400mhz,acetone)δ6.37(d,j=10.4hz,1h,h-12),5.26(dd,j=6.8,3.1hz,1h,h-7),5.21(s,1h,h-17α),5.14(s,1h,h-17β),4.71(s,1h,oh-15),4.60(brs,2h,h-5,oh-5),4.33(dd,j=7.4,3.6hz,1h,h-3),4.27(d,j=3.8hz,1h,oh-7),2.83–2.77(m,1h,h-1α),2.52–2.47(m,1h,h-4),2.14-2.07(m,1h,h-2),1.97-1.95(m,4h,h-8α,h-20),1.73(dd,j=9.5,7.0hz,1h,h-1β),1.70–1.63(m,1h,h-8β),1.55(dd,j=10.4,8.9hz,1h,h-11),1.38-1.32(m,1h,h-9),1.21(s,3h,h-19),1.15(s,3h,h-18),1.09(d,j=6.8hz,3h,h-16).3-o-benzoyl:8.12(d,j=7.2hz,2h),7.66(t,j=7.4hz,1h),7.54(t,j=7.7hz,1h).
化合物11:hrms-esi-tof:[m+na]+581;1hnmr(400mhz,acetone)δ6.44(d,j=10.0hz,1h,h-12),5.86(t,j=3.6hz,1h,h-3),5.25(dd,j=6.3,4.1hz,1h,h-7),5.22(s,1h,h-17α),5.13(s,1h,h-17β),5.08(s,1h,oh-15),4.45(s,1h,oh-5),3.17(d,j=3.2hz,1h,h-5),2.95(dd,j=14.2,9.0hz,1h,h-1α),2.49(s,1h,h-4),2.09(dd,j=7.1,3.4hz,1h,h-2),2.04(s,3h,h-20),1.88(dd,j=14.1,10.9hz,1h,h-1β),1.69–1.60(m,1h,h-8α),1.56(dd,j=10.3,8.9hz,1h,h-11),1.40-1.33(m,1h,h-8β),1.29(s,1h,h-9),1.21(s,3h,h-19),1.16(s,3h,h-18),1.04(d,j=6.7hz,3h,h-16).3-o-benzoyl:8.14(d,j=7.2hz,2h),7.67–7.56(m,1h),7.52(t,j=7.6hz,2h).7-o-benzoyl:8.04(d,j=7.3hz,2h),7.67–7.56(m,1h),7.40(t,j=7.7hz,2h).
化合物12:hrms-esi-tof:[m+na]+671;1hnmr(400mhz,acetone)δ6.79(brs,1h,h-12),5.87(t,j=3.5hz,1h,h-3),5.36(t,j=5.7hz,1h,h-7),5.30(s,1h,h-17α),5.20(s,1h,h-17β),5.08(s,1h,oh-15),4.58(t,j=5.0hz,1h,oh-5),3.28(t,j=4.8hz,1h,h-5),3.02(dd,j=13.9,8.9hz,1h,h-1α),2.53-2.46(m,1h,h-4),2.21-2.15(m,1h,h-2),1.97(s,3h,h-20),1.90(dd,j=13.9,11.2hz,1h,h-1β),1.86–1.77(m,1h,h-8α),1.58(dd,j=10.7,8.7hz,1h,h-11),1.46–1.38(m,1h,h-8β),1.29(s,h,h-9),1.22(s,3h,h-19),1.17(s,3h,h-18),1.05(d,j=6.8hz,3h,h-16).3-m-nitrobenzoyl:8.88(t,j=4hz,1h),8.50(d,j=1.9hz,1h),8.41(dd,j=8.3,2.2hz,1h),7.84(t,j=8.0hz,1h).7-m-nitrobenzoyl:8.74–8.70(t,j=4hz,1h),8.48–8.46(t,j=4hz,1h),8.35(d,j=7.7hz,1h),7.64(t,j=8.0hz,1h).
化合物13:hrms-esi-tof:[m+na]+561;1hnmr(400mhz,acetone)δ7.36(d,j=11.2hz,1h,h-12),6.37(d,j=9.0hz,1h,h-5),5.49(dd,j=8.4,2.9hz,1h,h-7),5.44(s,1h,h-17α),5.20(s,1h,h-17β),4.84(s,1h,oh-15),4.23–4.19(m,1h,h-3),3.95(d,j=5.5hz,1h,oh-3),3.10(dd,j=13.9,9.8hz,1h,h-1α),2.65(dd,j=8.9,3.0hz,1h,h-4),2.39-2.30(m,j=15.2,12.2,8.5hz,1h,h-8α),2.18–2.06(m,2h,h-2,h-1β),1.78(s,3h,h-20),1.68–1.58(m,2h,h-8β,h-11),1.49–1.40(m,1h,h-9),1.25(s,3h,h-19),1.20(s,3h,h-18),1.07(d,j=6.8hz,3h,h-16).5-o-furoyl:7.68(s,1h),7.04(d,j=3.4hz,1h),6.49(dd,j=3.5,1.7hz,1h).7-o-furoyl:7.51(s,1h),6.90(d,j=3.5hz,1h),6.40(dd,j=3.5,1.7hz,1h).
化合物14:hrms-esi-tof:[m+na]+671;1hnmr(400mhz,acetone)δ7.51(t,j=8.0hz,1h,h-12),6.63(d,j=9.8hz,1h,h-5),5.68–5.58(m,2h,h-7,h-17α),5.39(s,1h,h-17β),4.85(s,1h,oh-15),4.21–4.14(brs,1h,h-3),3.85(d,j=5.8hz,1h,3-oh),3.13(dd,j=12.7,10.9hz,1h,h-1α),2.82–2.74(m,1h,h-4),2.55(dd,j=24.7,12.1hz,1h,h-8α),2.32(d,j=17.0hz,1h,h-8β),2.19–2.09(m,1h,h-2),1.77(s,3h,h-20),1.68(dd,j=11.3,2.5hz,1h,h-11),1.62(dd,j=9.8,6.7hz,1h,h-1β),1.56–1.45(m,1h,h-9),1.30(s,3h,h-19),1.23(s,3h,h-18),1.00(d,j=6.8hz,3h,h-16).5-m-nitrobenzoyl:8.30(d,j=8.8hz,2h),8.08(d,j=8.8hz,1h),7.51(t,j=8.0hz,1h),7-m-nitrobenzoyl:8.19(d,j=8.2hz,1h),8.13(d,j=10.4hz,1h),8.01(d,j=8.8hz,1h),7.44(t,j=8.0hz,1h).
化合物15:hrms-esi-tof:[m+na]+633;mp216-218℃;1hnmr(400mhz,acetone)δ6.33(d,j=9.5hz,1h,h-12),5.43(d,j=9.1hz,1h,h-7),5.40(s,1h,h-17α),5.14(s,1h,h-17β),4.79(s,1h,oh-15),4.18(s,1h,h-5),4.03(d,j=4.8hz,1h,h-3),3.12(dd,j=13.8,9.8hz,1h,h-1α),2.82(s,oh-3),2.60(dd,j=9.5,2.7hz,1h,h-4),2.34-2.24(m,1h,h-2),2.17–2.09(m,1h,h-8α),1.73(s,3h,h-20),1.66(dd,j=10.6,7.1hz,1h,h-1β),1.61(dd,j=8.3,5.3hz,1h,h-8β),1.45-1.39(m,2h,h-9,h-11),1.24(s,3h,h-19),1.21(s,3h,h-18),1.08(d,j=6.8hz,3h,h-16).5-o-cinnamoyl:7.69(d,j=16.0hz,1h),7.36(t,j=7.7hz,4h),7.27(t,j=7.4hz,1h),6.54(d,j=16.0hz,1h),7-o-cinnamoyl:7.56(d,j=11.1hz,4h),7.14(t,j=7.6hz,2h),6.28(d,j=16.1hz,1h).
化合物16:hrms-esi-tof:[m+na]+581;1hnmr(400mhz,acetone)δ7.28(d,j=11.1hz,1h,h-12),6.38(d,j=8.1hz,1h,h-5),5.52(dd,j=7.5,3.3hz,1h,h-7),5.43(s,1h,h-17α),5.24(s,1h,h-17β),4.89(s,1h,oh-15),4.24-4.21(m,1h,h-3),3.88(d,j=6.0hz,1h,oh-3),3.09(dd,j=14.0,9.9hz,1h,h-1α),2.75(dd,j=8.1,2.9hz,1h,h-4),2.41-2.32(m,1h,h-8α),2.22–2.10(m,2h,h-2,h-8β),1.84(s,3h,h-20),1.70–1.59(m,1h,h-1β,h-9),1.47-1.42(m,1h,h-11),1.28(s,3h,h-19),1.21(s,3h,h-18),1.07(d,j=6.8hz,3h,h-16).5-o-benzoyl:7.88(d,j=7.3hz,2h),7.50(t,j=7.4hz,1h),7.35(t,j=7.7hz,2h).7-o-benzoyl:7.72(d,j=7.3hz,2h),7.40(t,j=7.4hz,1h),7.16(t,j=7.8hz,2h).
化合物17:hrms-esi-tof:[m+na]+717;1hnmr(400mhz,acetone)δ7.50(s,1h,h-12),6.60(d,j=9.7hz,1h,h-5),5.63–5.59(m,1h,h-7),5.59(s,1h,h-17α),5.34(s,1h,h-17β),4.85(s,1h,oh-15),4.22-4.18(m,1h,h-3),3.89(d,j=5.8hz,1h,oh-3),3.23–3.10(m,1h,h-1α),2.75(dd,j=9.7,2.9hz,1h,h-4),2.59–2.47(m,1h,h-8α),2.30–2.22(m,1h,h-8β),2.18-2.10(m,1h,h-2),1.78(s,3h,h-20),1.70–1.59(m,2h,h-1β,h-11),1.54–1.45(m,1h,h-9),1.29(s,3h,h-19),1.22(s,3h,h-18),1.02(d,j=6.8hz,3h,h-16).5-o-p-(trifluoromethyl)benzoyl:7.92(d,j=8.1hz,2h),7.78(d,j=8.1hz,2h).7-o-p-(trifluoromethyl)benzoyl:7.57(d,j=8.2hz,2h),7.42(d,j=8.2hz,2h).
化合物19:hrms-esi-tof:[m+na]+727;mp222-224℃;1hnmr(400mhz,acetone)δ6.64(d,j=10.4hz,1h,h-12),6.14(d,j=6.5hz,1h,h-7),5.85(t,j=3.6hz,1h,h-3),5.43(t,j=4.9hz,1h,h-5),5.37(s,1h,h-17α),5.29(s,1h,h-17β),4.79(s,1h,oh-15),3.09(dd,j=6.2,3.7hz,1h,h-4),2.99(dd,j=14.0,8.9hz,1h,h-1α),2.55-2.47(m,1h,h-2),2.09-2.06(m,1h,h-8α),2.04(s,3h,h-20),1.81(dd,j=14.0,11.0hz,1h,h-1β),1.68-1.62(m,1h,h-8β),1.52–1.44(m,1h,h-11),1.28(s,1h,h-9),1.26(s,3h,h-19),1.18(s,3h,h-18),0.96(d,j=6.7hz,3h,h-16).3-o-p-toluoyl:7.87(d,j=8.1hz,2h),7.21(d,j=8.0hz,2h),2.39(s,3h).5-o-p-toluoyl:7.65(d,j=8.1hz,2h),7.04(d,j=8.0hz,2h),2.30(s,3h).7-o-p-toluoyl:7.35(d,j=8.1hz,2h),6.74(d,j=8.0hz,2h),2.20(s,3h).
化合物20:hrms-esi-tof:[m+na]+820;1hnmr(400mhz,acetone)δ7.37(dt,j=23.8,8.0hz,1h,h-5).6.71(d,j=9.3hz,1h,h-12),5.85(t,j=3.3hz,1h,h-3),5.73(s,1h,h-17α),5.66(dd,j=8.8,2.1hz,1h,h-7),5.59(s,1h,h-17β),5.34(s,1h,oh-15),3.23(dd,j=9.2,3.5hz,1h,h-4),3.14(dd,j=13.6,8.7hz,1h,h-1α),2.59–2.48(m,1h,h-2),2.44-2.38(m,1h,h-8α),2.30–2.21(m,1h,h-8β),1.89(s,3h,h-20),1.88–1.81(m,1h,h-1β),1.70(dd,j=11.5,8.6hz,1h,h-11),1.59–1.50(m,1h,h-9),1.30(s,3h,h-19),1.23(s,3h,h-18),0.91(d,j=6.8hz,3h,h-16).3-m-nitrobenzoyl:8.56(s,1h),8.46(d,j=8.2hz,1h),8.27(d,j=7.8hz,1h),7.90(s,1h).5-m-nitrobenzoyl:8.19(s,1h),8.08(d,j=8.2hz,2h),7.94(d,j=7.8hz,1h).7-m-nitrobenzoyl:7.77(t,j=8.0hz,1h),7.70(d,j=7.7hz,1h),7.37(dt,j=23.8,8.0hz,2h).
化合物21:hrms-esi-tof:[m+na]+685;mp192-194℃;1hnmr(400mhz,acetone)δ6.75(d,j=10.6hz,1h,h-12),6.23(d,j=6.4hz,1h,h-5),5.89(t,j=3.6hz,1h,h-3),5.48(t,j=5.0hz,1h,h-7),5.42(s,1h,h-17α),5.34(s,1h,h-17β),4.89(s,1h,oh-15),3.13(dd,j=6.3,3.7hz,1h,h-4),3.03(dd,j=13.9,8.9hz,1h,h-1α),2.52(m,1h,h-2),2.16-2.09(m,2h,h-8α,h-8β),2.05(s,3h,h-20),1.85(dd,j=13.9,11.1hz,1h,h-1β),1.67(dd,j=10.8,8.9hz,1h,h-11),1.51(m,1h,h-9),1.28(s,3h,h-19),1.20(s,3h,h-18),0.98(d,j=6.7hz,3h,h-16).3-o-benzoyl:8.01(d,j=7.1hz,2h),7.44(dt,j=15.6,7.7hz,3h).5-o-benzoyl:7.79(d,j=7.2hz,2h),7.31–7.21(m,3h).7-o-benzoyl:7.50(d,j=7.1hz,2h),7.59(t,j=7.4hz,1h),6.97(t,j=7.8hz,2h).
化合物22:hrms-esi-tof:[m+na]+820;1hnmr(400mhz,acetone)δ7.26(brs,1h,h-12),6.62(d,j=9.0hz,1h,h-5),5.85(t,j=3.3hz,1h,h-3),5.70(s,1h,h-17α),5.63(dd,j=8.3,2.6hz,1h,h-7),5.56(s,1h,h-17β),5.23(s,1h,oh-15),3.21(dd,j=9.1,3.5hz,1h,h-4),3.11(dd,j=13.6,8.7hz,1h,h-1α),2.57-2.49(m,1h,h-2),2.42–2.29(m,1h,h-8α),2.27–2.18(m,1h,h-8β),1.91(s,3h,h-20),1.85(dd,j=13.6,11.6hz,1h,h-1β),1.70(dd,j=11.5,8.6hz,1h,h-11),1.58–1.49(m,1h,h-9),1.28(s,3h,h-19),1.22(s,3h,h-18),0.92(d,j=6.7hz,1h,h-16).3-p-nitrobenzoyl:8.27(d,j=8.9hz,2h),7.84(d,j=8.9hz,2h).5-p-nitrobenzoyl:8.13(d,j=8.9hz,2h),7.77(d,j=8.9hz,2h).7-p-nitrobenzoyl:7.90(d,j=8.8hz,2h),7.57(d,j=8.8hz,2h).
化合物23:hrms-esi-tof:[m+na]+889;1hnmr(400mhz,acetone)δ7.50(brs,1h,h-12),6.55(d,j=8.8hz,1h,h-5),5.85(t,j=3.4hz,1h,h-3),5.65(s,1h,h-17α),5.60(dd,j=8.0,2.9hz,1h,h-7),5.52(s,1h,h-17β),5.15(s,1h,oh-15),3.19(dd,j=8.9,3.6hz,1h,h-4),3.09(dd,j=13.7,8.7hz,1h,h-1α),2.55-2.48(m,1h,h-2),2.39–2.27(m,1h,h-8α),2.21-2.15(m,1h,h-8β),1.93(s,3h,h-20),1.85(dd,j=13.6,11.5hz,1h,h-1β),1.69(dd,j=11.4,8.6hz,1h,h-11),1.59–1.49(m,1h,h-9),1.28(s,3h,h-19),1.21(s,3h,h-18),0.93(d,j=6.7hz,3h,h-16).3-o-p-(trifluoromethyl)benzoyl:7.79(d,j=8.3hz,2h),7.43(d,j=8.3hz,2h).5-o-p-(trifluoromethyl)benzoyl:7.74(d,j=8.2hz,2h),7.32(d,j=8.3hz,2h).7-o-p-(trifluoromethyl)benzoyl:8.10(d,j=8.1hz,2h),7.53(d,j=8.2hz,2h).
化合物26:hrms-esi-tof:[m+na]+671;1hnmr(600mhz,acetone)δ6.12(d,j=10.4hz,1h,h-5),5.72(dd,j=11.3,1.4hz,1h,h-7),5.68(s,1h,h-17α),5.41(s,1h,h-17β),4.22(d,j=9.8hz,1h,h-12),3.95(d,j=3.4hz,1h,h-3),3.93-3.89(m,1h,oh-3),2.97(dd,j=11.1,3.4hz,1h,h-4),2.64(dd,j=25.2,11.8hz,1h,h-13),2.38(dd,j=9.8,7.2hz,1h,h-2),2.24(dd,j=12.7,2.9hz,1h,h-1α),1.98-1.93(m,1h,h-8α),1.89(dd,j=12.3,6.7hz,1h,h-8β),1.73(t,j=12.7hz,1h,h-1β),1.25(s,3h,h-18),1.16(d,j=7.2hz,3h,h-20),1.14(s,3h,h-19),1.01(d,j=6.6hz,3h,h-16),0.98-0.93(m,1h,h-9),0.88(d,j=9.2hz,1h,h-11).5-p-nitrobenzoyl:8.10(d,j=8.9hz,2h),8.01(d,j=8.8hz,2h).7-p-nitrobenzoyl:7.93(d,j=8.8hz,4h).
化合物27:hrms-esi-tof:[m+na]+820;1hnmr(400mhz,acetone)δ6.33(d,j=11.1hz,1h,h-5),5.73(d,j=12.8hz,2h,h-17α,h-7),5.63(t,j=3.1hz,1h,h-3),5.53(s,1h,h-17β),4.40(d,j=9.7hz,1h,h-12),3.47(dd,j=11.0,3.7hz,1h,h-4),2.74-2.65(m,1h,h-13),2.53-2.45(m,1h,h-2),2.38–2.30(m,1h,h-8α),2.27(dd,j=14.4,3.1hz,1h,h-8β),2.19(dd,j=13.1,7.0hz,1h,h-1α),1.81(t,j=13.1hz,1h,h-1β),1.46(s,3h,h-20),1.37(s,1h,h-9),1.29(s,3h,h-19),1.20(s,3h,h-18),1.13–1.08(m,1h,h-11),0.93(d,j=6.7hz,3h,h-16).3-p-nitrobenzoyl:8.42(d,j=8.8hz,2h),8.36(d,j=8.8hz,2h).5-p-nitrobenzoyl:7.93(t,j=8.5hz,4h).7-p-nitrobenzoyl:8.12(d,j=8.8hz,2h),7.81(d,j=8.8hz,2h).
化合物29:hrms-esi-tof:[m+na]+593;1hnmr(400mhz,acetone)δ5.96(d,j=10.9hz,1h,h-5),5.63(d,j=10.0hz,1h,h-7),5.57(s,1h,h-17α),5.28(s,1h,h-17β),4.19(d,j=9.8hz,1h,h-12),4.10(d,j=2.2hz,1h,oh-3),3.91–3.83(m,1h,h-3),2.87(dd,j=11.0,3.3hz,1h,h-4),2.53(dd,j=25.0,11.5hz,1h,h-13),2.39-2.32(m,j=14.3,7.2hz,1h),2.13(d,j=16.0hz,1h,h-1α),2.02–1.92(m,1h,h-2),1.88(dd,j=12.2,6.7hz,1h,h-1β),1.73(t,j=12.7hz,1h,h-8α),1.29(s,2h,h-8β,h-9),1.22(s,3h,h-19),1.15(d,j=7.2hz,3h,h-20),1.13(s,3h,h-18),1.03(d,j=6.6hz,3h,h-16),0.95–0.88(m,1h,h-11).5-o-thiophenecarbonyl:7.71(d,j=5.8hz,1h),7.60(d,j=3.7hz,1h),7.04–7.00(m,1h).7-o-thiophenecarbonyl:7.56(d,j=5.8hz,1h),7.50(d,j=3.7hz,1h),6.92–6.85(m,1h).
5、所述的化合物25的制备方法:在甲醇溶液中,底物化合物18、三氯化铟、苯甲酰氯摩尔比为1:1:1,反应得到目标产物。
化合物25:hrms-esi-tof:[m+na]+623;1hnmr(400mhz,cdcl3)δ5.99(d,j=10.1hz,1h,h-12),5.83(t,j=3.5hz,1h,h-3),5.47(d,j=4.6hz,1h,h-5),5.30(s,1h,h-7),5.25(s,1h,h-17α),5.19(s,1h,h-17β),4.24(s,1h,oh-15),2.92–2.86(m,1h,h-4),2.82(dd,j=14.7,9.6hz,1h,h-1α),2.60–2.47(m,1h,h-2),2.13(s,3h,h-20),2.09–1.98(m,1h,h-8α),1.86(dd,j=14.7,10.3hz,1h,h-1β),1.76-1.66(m,1h,h-8β),1.46(dd,j=20.3,10.4hz,1h,h-11),1.33-1.28(m,1h,h-9),1.21(s,3h,h-19),1.14(s,3h,h-18),1.07(d,j=6.7hz,3h,h-16).3-o-benzoyl:8.14(d,j=8.4hz,2h),7.60–7.56(m,1h),7.44(t,j=7.6hz,2h).5-oac:1.31(s,3h).7-o-benzoyl:8.05(d,j=8.4hz,2h),7.56–7.52(m,1h),7.44(t,j=7.6hz,2h).
6、化合物28的制备方法:在甲醇溶液中,底物化合物18、三氯化铟、苯甲酰氯摩尔比为1:1:2,加热反应得到目标产物。
化合物28:hrms-esi-tof:[m+na]+623;mp191-193℃;1hnmr(400mhz,acetone)δ6.09(d,j=10.9hz,1h,h-5),5.66(d,j=10.1hz,1h,h-7),5.55(s,1h,h-17α),5.53(t,j=4hz,1h,h-3),5.23(s,1h,h-17β),4.32(d,j=9.8hz,1h,h-12),3.14(dd,j=11.0,3.7hz,1h,h-4),2.81(s,1h,h-13),2.69-2.60(m,1h,h-1α),2.46-2.39(m,1h,h-2),2.29-2.21(m,1h,h-8α),2.15–2.06(m,1h,h-8β),1.71(t,j=13.0hz,1h,h-1β),1.56(s,3h,h-20),1.29(s,1h,h-11),1.17(t,j=3.5hz,6h,h-18,h-19),1.02–0.94(m,1h,h-9),0.91(d,j=6.7hz,3h,h-16).3-o-benzoyl:8.12(d,j=8.4hz,2h),7.65(t,j=7.4hz,1h),7.38(t,j=7.8hz,2h).5-oac:1.41(s,3h).7-o-benzoyl:7.84(d,j=7.2hz,2h),7.57–7.48(m,3h).
7、所述的化合物30的制备方法:将原料化合物18(150mg,0.23mmol)溶解于20ml二氧六环溶剂中,加入过量nabh4(0.5g),室温搅拌反应6h,加入适量冰终止反应,用2nh2so4调节反应液至中性。乙酸乙酯萃取三次,合并有机层浓缩并用柱层析法纯化,得化合物30(141mg,95%),为白色无定形固体。
化合物30:hrms-esi-tof:[m+na]+667;1hnmr(400mhz,acetone)δ5.86(s,1h,h-5),5.79(dd,j=11.2,7.1hz,2h,h-12,h-14),5.26(s,1h,h-17α),5.23(d,j=7.8hz,1h,h-7),5.01(s,1h,h-17β),4.89(s,1h,oh-15),3.73(s,1h,h-3),2.50(dd,j=13.6,9.0hz,1h,h-1α),2.45(d,j=2.6hz,1h,h-4),2.38(m,1h,h-8α),1.98(s,3h,h-20),1.97–1.87(m,3h,h-1β,h-2,h-8β),1.87–1.79(m,1h,h-9),1.30–1.22(m,1h,h-11),1.20(s,3h,h-19),1.11(s,3h,h-18),1.02(d,j=6.7hz,3h,h-16).3-o-benzoyl:8.18–8.12(m,2h),7.68(t,j=7.4hz,1h),7.56(t,j=7.7hz,2h).5-oac:1.49(s,3h).7-o-benzoyl:8.18–8.12(m,2h),7.62(t,j=7.4hz,1h),7.51(t,j=7.6hz,2h).14-oac:2.09(s,3h).
8、所述的化合物31的制备方法:在氩气保护下,往冰浴的ch2cl2(5ml)溶液中依次加入化合物30(142mg,0.22mmol)、乙酸酐(21ul,0.22mmol),bf3·et2o(3ul,0.026mmol)。随后,将反应混合物加热至室温,搅拌10分钟,反应完毕后用ch2cl2稀释反应液,加入饱和nahco3中和反应液。反应液用乙酸乙酯萃取三次,合并有机层并减压蒸发。最后柱层析法分离得到化合物31(产率24%)。
化合物31:hrms-esi-tof:[m+na]+625.7132,found623.2609;1hnmr(400mhz,acetone)δ5.95(d,j=11.2hz,1h,h-5),5.67(s,1h,h-12),5.53(dd,j=10.3,2.2hz,1h,h-7),5.46–5.43(m,1h,h-3),5.42(s,1h,h-17α),5.36(s,1h,h-17β),5.06(s,1h,h-14),3.08(dd,j=11.2,3.9hz,1h,h-4),2.48(dd,j=22.4,10.1hz,1h,h-8α),2.21-2.16(m,1h,h-2),2.15–2.07(m,2h,h-1α,oh-15),2.02-1.97(m,2h,h-1β,h-8β),1.74(s,3h,h-20),1.30(s,3h,h-19),1.28(s,1h,oh-14),1.12(s,3h,h-18),0.87(d,j=6.2hz,3h,h-16),0.82-0.77(m,2h,h-9,h-11).3-o-benzoyl:8.12(d,j=7.1hz,2h),7.51(t,j=6.8hz,2h),7.34(t,j=7.8hz,1h).5-oac:1.48(s,3h).7-o-benzoyl:7.85(d,j=7.1hz,2h),7.64(t,j=6.9hz,1h),751(t,j=6.8hz,1h),7.34(t,j=7.8hz,1h).
9、所述的化合物32、33的制备方法:在dcm、tmsotf体系中,底物化合物18与相应酸酐反应得到目标产物。具体制备方法为:在氮气保护下,化合物18(100mg,0.16mmol)溶解于冰浴的干燥ch2cl2(10ml)溶液中,依次加入乙酸酐(151ul,1.6mmol),tmsotf(一滴)。将反应混合物搅拌反应5分钟,反应完毕后用ch2cl2稀释反应液,用饱和nahco3中和反应液。乙酸乙酯萃取三次,合并有机层,na2so4干燥,减压蒸发。最后柱层析纯化得到化合物32(18mg,产率18%)。其余条件相同,将乙酸酐替换为丙酸酐,反应得化合物33。
化合物32:hrms-esi-tof:[m+na]+725;1hnmr(400mhz,acetone)δ5.85(t,j=7.7hz,3h,h-3,h-7,h-11),5.72(t,j=9.5hz,1h,h-12),5.61(d,j=7.2hz,1h,h-5),5.24(s,1h,h-17α),5.15(s,1h,h-17β),4.00(s,1h,h-4),3.48(s,1h,oh-15),2.49(dd,j=14.3,5.8hz,1h,h-1α),2.39(dd,j=12.3,2.5hz,1h,h-1β),2.32-2.27(m,1h,h-2),2.15–2.06(m,2h,h-8α,h-10),1.89(dd,j=15.6,9.5hz,1h,h-8β),1.82(s,3h,h-20),1.22(s,3h,h-19),1.17(s,3h,h-18),0.98(d,j=6.2hz,3h,h-16).3-o-benzoyl:8.07(d,j=8.1hz,2h),7.65(dd,j=15.3,7.6hz,1h),7.53(td,j=7.7,2.0hz,2h).5-oac:1.95(s,3h).7-o-benzoyl:8.07(d,j=8.1hz,2h),7.65(dd,j=15.3,7.6hz,1h),7.53(td,j=7.7,2.0hz,2h).12-oac:1.28(s,3h).14-oac:2.16(s,3h).
化合物33:hrms-esi-tof:[m+na]+753;1hnmr(400mhz,acetone)δ5.93–5.81(m,3h,h-3,h-7,h-11),5.73(t,j=9.5hz,1h,h-12),5.62(d,j=7.3hz,1h,h-5),5.24(s,1h,h-17α),5.15(s,1h,h-17β),4.00(s,1h,h-4),3.47(s,1h,oh-15),2.52-2.46(m,1h,h-1α),2.39(dd,j=12.2,2.4hz,1h,h-1β),2.35–2.29(m,1h,h-2),2.19–2.09(m,2h,h-8α,h-10),1.89(dd,j=16.4,9.8hz,1h,h-8β),1.83(s,3h,h-20),1.22(s,3h,h-19),1.17(t,7.6hz,3h,h-18),0.98(d,j=6.2hz,3h,h-16).3-o-benzoyl:8.07(d,j=8.1hz,2h),7.65(dd,j=15.3,7.6hz,1h),7.53(m,2h).5-oac:1.95(s,3h).7-o-benzoyl:8.07(d,j=8.1hz,2h),7.65(dd,j=15.3,7.6hz,1h),7.53(m,2h).12-o-propionyl:2.48(m,2h),1.17(t,7.6hz,3h).14-o-propionyl:1.06(t,j=7.6hz,3h),2.26(dd,j=15.1,7.5hz,2h).
10、所述的化合物34的制备方法:在dcm溶液中,底物化合物25、溴化铜、乙酸酐摩尔比为1:1:10,常温反应得到目标产物。在氮气保护下,将化合物25(96mg,0.16mmol)溶解于冰浴的干燥ch2cl2(10ml)溶剂中,依次加入乙酸酐(151ul,1.6mmol),cubr(36mg,0.16mmol)。室温搅拌反应12h,反应完毕后加水淬灭反应,乙酸乙酯萃取反应液三次,合并有机层,na2so4干燥,减压蒸发。最后柱层析纯化得到化合物38(22mg,石油醚/乙酸乙酯=25:1),无色晶体,产率为20%。
化合物34:hrms-esi-tof:[m+na]+701;mp213-215℃;1hnmr(400mhz,acetone)δ6.84(s,1h,h-5),6.31(d,j=10.8hz,1h,h-12),5.83–5.76(m,1h,h-17α),5.71(d,j=4.2hz,1h,h-17β),5.03(s,1h,h-7),4.93(s,1h,h-3),3.70(dd,j=11.2,5.0hz,1h,h-4),2.98–2.88(m,1h,h-1α),2.80–2.71(m,1h,h-8α),2.24–2.15(m,1h,h-2),2.14–2.07(m,1h,h-1β),1.90(s,3h,h-19),1.88(s,3h,h-18),1.85–1.82(m,1h,h-8β),1.67(s,3h,h-20),1.19(s,1h,h-9),0.99-0.89(m,1h,h-11),0.86(d,j=6.2hz,3h,h-16).3-o-benzoyl:8.12(d,j=7.4hz,2h),7.54(dd,j=16.4,8.2hz,2h),7.37(t,j=7.7hz,1h).5-oac:1.29(s,3h).7-o-benzoyl:7.96(d,j=7.5hz,2h),7.66(t,j=7.3hz,1h),7.54(dd,j=16.4,8.2hz,1h),7.37(t,j=7.7hz,1h).
11、所述的化合物35的制备方法:在dcm溶液中,底物化合物18、tmsotf、乙酸酐摩尔比为10:1:1,反应得到目标产物。
化合物35:hrms-esi-tof:[m+na]+681;1hnmr(600mhz,acetone)δ7.43(s,1h,h-12),5.78(t,j=3.7hz,1h,h-3),5.62(d,j=11.7hz,1h,h-5),5.41(s,1h,h-17α),5.32(dd,j=11.2,2.6hz,1h,h-7),5.04(s,1h,h-17β),3.30(s,1h,h-10),3.10(d,j=10.4hz,1h,h-9),3.05(dd,j=11.7,4.2hz,1h,h-4),2.49-2.41(m,1h,h-2),2.26-2.16(m,1h,h-1α),1.96(s,1h,h-8α),1.88–1.84(m,2h,h-1β,h-8β),1.74(t,j=3.7hz,3h,h-20),1.72(s,3h,h-18),1.65(s,3h,h-19),0.94(d,j=6.6hz,3h,h-16).3-o-benzoyl:8.48–8.40(m,2h),7.68–7.59(m,1h),7.57(dt,j=15.1,4.3hz,2h).5-oac:1.90(s,3h).7-o-benzoyl:7.98(dd,j=8.3,1.2hz,2h),7.68–7.59(m,1h),7.47(t,j=7.7hz,2h).11-oac:2.04(s,3h).
12、所述的化合物36的的制备方法:在dcm溶液中,底物化合物41、三氯化铟、苯甲酰氯摩尔比为1:1:2,反应得到目标产物。
化合物36:1hnmr(600mhz,acetone)δ6.69(d,j=11.3hz,1h,h-12),6.27(s,1h,h-5),5.59(t,j=4.4hz,1h,h-3),3.94(d,j=11.2hz,1h,h-17α),3.90(d,j=11.2hz,1h,h-17β),3.84(d,j=15.2hz,1h,6-oh),3.03(dd,j=11.7,5.3hz,1h,h-1α),2.54(d,j=5.3hz,1h,h-7α),2.27–2.22(m,1h,h-8α),2.03(m,1h,h-2),1.96–1.86(m,2h,h-4,h-8β),1.84(s,3h,h-20),1.65(dd,j=11.2,8.9hz,1h,h-1β),1.51–1.46(m,1h,h-11),1.40–1.35(m,1h,h-7β),1.37(s,3h,h-19),1.20(s,3h,h-18),1.10(dd,j=14.3,9.0hz,1h,h-9),0.70(d,j=6.7hz,3h,h-16).3-o-phenylacetyl:7.36(d,j=7.3hz,2h),7.33(t,j=7.5hz,2h),7.26(t,j=7.2hz,1h),3.76(d,j=16.1hz,2h).5-oac:2.01(s,3h).15-oac:2.21(s,3h).
13、化合物18、38、39、41是从千金子中直接提取得到。提取方法为:用95%的乙醇/丙酮(体积比为5:1)在室温下对千金子粉末(5kg)进行浸泡,溶剂在真空下浓缩得到200g油状物。对油状物进行硅胶柱洗脱,得到3个粗馏分。在对馏分1进行进一步提纯,采用硅胶色谱法(按体积比,石油醚:乙酸乙酯=15:1)得到化合物18(4.6g),馏分2采用硅胶色谱法分离(按体积比,石油醚:乙酸乙酯=12:1)得到化合物38(200mg),化合物39(20mg)。馏分3采用硅胶色谱法(按体积比,石油醚:乙酸乙酯=10:1)得到化合物41(20.7g)。
化合物18:hrms-esi-ms:665[m+na]+;1hnmr(400mhz,acetone)δ6.60(dd,j=11.2,1.2hz,1h,h-12),6.38(d,j=7.9hz,1h,h-5),5.76(t,j=3.2hz,1h,h-3),5.56(dd,j=8.8,3.1hz,1h,h-7),5.49(s,1h,h-17α),5.27(s,1h,h-17β),3.35(dd,j=14.0,8.1hz,1h,h-1α),3.05(dd,j=7.8,3.4hz,1h,h-4),2.43–2.30(m,1h,h-2,h-8α),2.23-2.17(m,1h,h-8β),1.83–1.75(m,1h,h-9),1.77(d,j=1.1hz,3h,h-20),1.62(dd,j=11.2,8.5hz,1h,h-1β),1.51–1.42(m,1h,h-11),1.26(s,3h,h-18),1.22(s,3h,h-19),0.91(d,j=6.7hz,3h,h-16).3-o-benzoyl:8.10(dd,j=8.3,1.3hz,2h),7.66(t,j=7.4hz,1h),7.55(t,j=7.6hz,1h).5-oac:1.30(s,3h).7-o-benzoyl:7.93(dd,j=8.3,1.3hz,2h),7.60(t,j=7.4hz,1h),7.46(t,j=7.7hz,1h).15-oac:2.24(s,3h).
化合物38:hrms-esi-tof:[m+na]+461;1hnmr(400mhz,acetone)δ7.88(d,j=12.0hz,1h,h-12),5.55(t,j=3.6hz,1h,h-3),5.20(s,1h,oh-15),3.43(d,j=9.1hz,1h,h-5),3.24(dd,j=12.5,7.1hz,1h,h-1α),2.00–1.95(m,1h,h-2),1.94–1.90(m,1h,h-7α),1.85(s,3h,h-20),1.79(d,j=13.0hz,1h,h-1β),1.76(dd,j=9.2,4.4hz,1h,h-4),1.65(dd,j=11.5,7.9hz,1h,h-11),1.63–1.53(m,1h,h-8α),1.35-1.27(m,3h,h-7β,h-8β,h-9),1.20(s,6h,h-17,h-18),1.08(s,3h,h-19),0.96(d,j=6.7hz,3h,h-16).3-o-benzoyl:8.16(d,j=7.2hz,2h),7.63(t,j=7.4hz,1h),7.52(t,j=7.6hz,2h).
化合物41:1hnmr(400mhz,acetone)δ6.69(dd,j=11.4,1.1hz,1h,h-12),6.31(d,j=9.0hz,1h,h-5),5.38(t,j=3.1hz,1h,h-3),3.24(dd,j=14.0,8.2hz,1h,h-17α),2.55(d,j=3.6hz,1h,h-7α),2.19(dd,j=3.4,2.1hz,1h,h-17β),2.13–2.09(m,1h,h-2),2.08(d,j=3.6hz,1h,h-8α),2.05(m,2h,h-8β,h-4),1.85(dd,j=9.0,3.4hz,1h,h-7β),1.80(d,j=1.1hz,3h,h-20),1.74(d,j=13.3hz,1h,h-1α),1.62(dd,j=11.4,8.2hz,1h,h-11),1.38(dd,j=13.9,12.3hz,1h,h-1β),1.25(s,3h,h-19),1.22(s,3h,h-18),1.00–0.91(m,1h,h-9),0.64(d,j=6.7hz,3h,h-16).3-o-phenylacetyl:7.34(s,2h),7.33(s,2h),7.27(m,1h),3.70(d,j=15.1hz,1h),3.58(d,j=15.1hz,1h).5-oac:1.99(s,3h).15-oac:2.15(s,3h).
实施例二:化合物1~41的生物体外活性试验
1、千金子二萜衍生物的细胞毒性检测。具体操作:按照1×110个/孔限定数量,将mcf-7、mcf-7/adr细胞接种于96孔板,每孔加入100μl含10%胎牛血清的mem培养基培养15h,至细胞增长至覆盖孔面积的70%,依次加入最终浓度梯度为1μm、5μm、20μm、50μm、100μm的1~41号化合物,化合物皆用dmso溶解,给药体积为1μl。设置终浓度梯度为0.01μm、0.1μm、1μm、5μm、10μm的多柔比星作为阳性对照,化合物dmso溶解,给药体积为1μl。设置dmso为阴性对照,给药体积为1μl。每组设置3个孔作为平行样。37℃培养48h后,抽去原培养基,用无血清mem培养基按将cck-8溶液稀释10倍,每孔加入100μl稀释液,37℃孵育1h,之后在450nm测定吸光度。
数据分析:将各孔细胞吸光度相对于dmso组吸光度的相对百分比作为抑制率,然后将浓度梯度取10的对数,将其作为横坐标,将抑制率作为纵坐标,求得回归方程后带入50%抑制率计算ic50,同时根据每组内数据测得其平均值和方差,每组数据独立重复三次。41个化合物对mcf-7和mcf-7/adr细胞的细胞毒(ic50)见表1。
表1各化合物对mcf-7和mcf-7/adr细胞的细胞毒
2、千金子二萜衍生物逆转耐药能力检测。具体操作:按照1×110个/孔限定数量,将mcf-7/adr细胞接种于96孔板,每孔加入100μl含10%胎牛血清的mem培养基培养15h,至细胞增长至覆盖孔面积的70%,加入最终浓度梯度为10μm的1~41号化合物,以终浓度为10μm的维拉帕米(vrp)作为阳性对照。化合物皆用dmso溶解,给药体积为1μl,37℃下孵育2h。之后加入终浓度梯度为0.01μm、0.1μm、1μm、5μm、10μm的多柔比星,化合物dmso溶解,给药体积为1μl。设置dmso为阴性对照,给药体积为1μl。每组设置3个孔作为平行样。37℃培养48h后,抽去原培养基,用无血清mem培养基按将cck-8溶液稀释10倍,每孔加入100μl稀释液,37℃孵育1h,之后在450nm测定吸光度。
数据分析:将各孔细胞吸光度相对于dmso组吸光度的相对百分比作为抑制率,然后将浓度梯度取10的对数,将其作为横坐标,将抑制率作为纵坐标,求得回归方程后带入50%抑制率计算加入1~41号化合物后对于多柔比星的ec50,同时根据每组内数据测得其平均值和方差,每组数据独立重复三次,将耐药株(mcf-7/adr)对于多柔比星的ic50平均值与加入1~41号化合物的ec50作比值,求出其逆转倍数。逆转倍数=ec50(dox)/ec50(sample+dox)。
41个化合物对于mcf-7/adr细胞的逆转活性数据见表2。
表2各千金子二萜衍生物在mcf-7/adr细胞上的逆转效应
从表2可以看出,有25个化合物逆转活性都优于vrp。其中,化合物17、29、38、39活性最佳,逆转倍数分别是维拉帕米(vrp)的229倍、454倍、218倍和71倍。
实施例三:胞内聚集实验
本实施例提供了化合物8、31进行罗丹明123(rh123)胞内聚集实验检测。具体操作:将mcf-7/adr和mcf-7细胞以2×106个/孔的密度接种到24孔板中,在37℃下孵育16h,用逆转耐药筛选出来的化合物8和化合物31(浓度分别为2、10和20μm)预处理1h,采用终浓度为20μm的维拉帕米作为阳性对照。之后将细胞与终浓度为5μm的rh123在37℃避光孵育1h。用pbs洗涤细胞两次,重悬于pbs缓冲液中,并通过流式细胞仪进行分析。实验结果如图1、表3所示。图1为化合物8、化合物31分别在mcf-7/adr细胞内的罗丹明积累变化示意图。
表3化合物8、31抑制p-gp介导的罗丹明外排实验结果展示表
化合物8、31在mcf-7/adr细胞内均可抑制rh123的外排,并且化合物8、31抑制p-gp的外排能力有明显的浓度依耐性。化合物31随着浓度的增加抑制能力加强,浓度为80μm时基本完全逆转耐药性。化合物8在浓度为20μm抑制p-gp的外排的能力最佳,增加浓度逆转能力反而下降。
实施例四:对多柔比星(dox)的积累实验
将mcf-7/adr细胞以1×107个/孔的密度接种到6孔板盖玻片中,在37℃下孵育16h,用逆转耐药筛选出来的化合物17、29和38(浓度分别为2、10和20μm)预处理2h,再用dox处理2h,终浓度为20μm的维拉帕米作为阳性对照。之后用4%多聚甲醛固定30min,终浓度为5μg/ml的dapi染液(4',6-二脒基-2-苯基吲哚)在于37℃避光孵育1h。用pbs洗涤细胞两次,取出盖玻片,用分片液封于载玻片上,通过荧光显微镜400倍下观察分析。实验结果图2、表4所示。图2为mcf-7/adr在化合物17、29、38不同浓度下处理2h后dox积累,用imagej软件分析得到的荧光数据柱状图。图2从左往右依次为:化合物17、化合物29、化合物38的结果展示图。
表4化合物17、29、38抑制p-gp介导的dox外排实验结果展示表
化合物17、29、38均可以抑制mcf-7/adr细胞内p-gp介导的dox的外排且具有浓度依赖性。化合物17、29、38均有助于细胞内dox的积累;化合物29在浓度为10μm时,抑制dox外排能力优于维拉帕米,在浓度为10μm时,抑制dox外排能力是维拉帕米的2.1倍。
实施例五:对p-gp表达的westernblot实验检测
将mcf-7/adr细胞以1×107个/孔的密度接种到6孔板中,在37℃下孵育16h,用逆转耐药筛选出来的化合物8、17、29、31和38(浓度分别为2、10和20μm)预处理1h,采用终浓度为20μm的维拉帕米作为阳性对照。pbs洗涤细胞两次,加入ripa裂解细胞15min,13000r离心细胞20min,总蛋白浓度用bca试剂盒进行定量检测。之后在8sds-page凝胶中将蛋白质分离,然后在100v的恒定电压下在4℃下电转移到硝酸纤维素膜上。将硝酸纤维素膜用5%牛血清白蛋白封闭2h。然后在4℃下与抗p-gp或抗gapdh抗体(一抗)孵育过夜,gapdh用作加载对照。用tbst(1xtris缓冲盐水,0.1%tween20)洗涤3次后加入山羊抗兔igg二抗,在室温下孵育2h。再次用tbst洗涤3次后,用超敏ecl化学发光底物检测结合的抗体复合物。结果如图3所示。
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形、变型、修改、替换,均应落入本发明权利要求书确定的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!