一种表达非洲猪瘟O61R蛋白的重组杆状病毒及其用途
一种表达非洲猪瘟o61r蛋白的重组杆状病毒及其用途
技术领域
1.本发明涉及一种表达非洲猪瘟o61r蛋白的重组杆状病毒及其用途。
背景技术:
2.非洲猪瘟(african swine fever,asf)是一种由非洲猪瘟病毒(african swine fever virus,asfv)引起猪急性、高度接触性和高度致死性地传染性疾病,主要感染家猪和野猪,可引起猪只发热,食欲减退,呼吸困难,内脏器官广泛性出血,神经系统紊乱等临床症状,一旦感染,致死率高达100%。2018年在我国暴发以来,对我国养猪业的发展造成了严重的影响。目前,仍未有商品化的疫苗问世,由于asfv可以编码蛋白约200种,且大多数功能未知,如何选择有效的抗原组合是非洲猪瘟亚单位疫苗开发的关键。
3.亚单位疫苗通过表达病毒粒子上的免疫原性基因作为抗原来引发保护性免疫应答,无病原基因组,具有副作用少、安全性高、可以快速批量生产,被认为是未来开发asf疫苗的理想选择。o61r编码p12蛋白,由61个氨基酸编码的膜蛋白,位于病毒的外膜及内膜,c末端部分存在一个富含半胱氨酸的区域,该区域可能负责蛋白质形成二聚体,仅在感染后晚期转录,对来自11种不同病毒株的蛋白p12的氨基酸序列的比较揭示了该多肽的高度保守性。研究发现p12可能与病毒的吸附和入侵有关。将o61r克隆到改良牛痘病毒安卡拉(mva)病毒载体中进行免疫,产生了针对p12的特异性抗体,说明该基因具有较好的免疫原性,并且序列高度保守,是未来亚单位疫苗开发的候选基因。
4.昆虫细胞杆状病毒表达载体系统不仅能够大量表达外源蛋白还能对其进行较为完善的翻译后加工修饰。昆虫细胞易于大规模培养,可有效降低生产成本。同时昆虫细胞不能被人类病原体所感染,生物安全性好。
技术实现要素:
5.本发明的目的在于克服现有技术的不足而提供一种非洲猪瘟o61r蛋白重组转移质粒、一种非洲猪瘟o61r蛋白重组穿梭质粒、一种表达非洲猪瘟o61r蛋白的重组杆状病毒及其用途。
6.为实现上述目的,所采取的技术方案:一种非洲猪瘟o61r蛋白重组转移质粒,所述非洲猪瘟o61r蛋白重组转移质粒是将非洲猪瘟o61r基因连接至病毒载体上得到的。
7.优选地,所述非洲猪瘟o61r基因的扩增引物包括如seq id no:3和seq id no:4所示的引物。
8.优选地,所述病毒载体为pacebac1或pfastbac1。
9.优选地,所述非洲猪瘟o61r基因的核苷酸序列如seq id no:1所示。优选地,所述o61r基因为基因ii型的非洲猪瘟病毒毒株中的基因。优选地,所述非洲猪瘟o61r蛋白的氨基酸序列为seq id no:2。
10.本发明提供了一种非洲猪瘟o61r蛋白重组穿梭质粒,所述非洲猪瘟o61r蛋白重组穿梭质粒是将如上述所述的非洲猪瘟o61r蛋白重组转移质粒转化至dh10bac感受态细胞中
得到的。
11.本发明提供了一种表达非洲猪瘟o61r蛋白的重组杆状病毒,所述重组杆状病毒是将上述所述的非洲猪瘟o61r蛋白重组穿梭质粒转染至昆虫细胞,培养至昆虫细胞出现病变,收集上清液得到的。
12.优选地,所述昆虫细胞为sf9细胞或者high 5细胞。
13.本发明提供了一种制备非洲猪瘟o61r蛋白的方法,所述方法是将上述所述的重组杆状病毒接种至含有昆虫细胞的溶液或者活体昆虫中进行表达,得到非洲猪瘟o61r蛋白。优选地,所述昆虫细胞为sf9细胞。优选地,所述重组杆状病毒以moi=0.5接种至含有昆虫细胞的溶液或者活体昆虫中。
14.本发明提供了所述的非洲猪瘟o61r蛋白重组转移质粒、上述所述的非洲猪瘟o61r蛋白重组穿梭质粒、上述所述的重组杆状病毒在制备非洲猪瘟o61r蛋白中的用途。
15.本发明提供了上述所述的非洲猪瘟o61r蛋白重组转移质粒、上述所述的非洲猪瘟o61r蛋白重组穿梭质粒、上述所述的重组杆状病毒在制备诊断非洲猪瘟的制品或制备非洲猪瘟亚单位疫苗中的用途。
16.有益效果:
17.本发明构建了含asfv o61r的重组杆状病毒载体,采用该重组杆状病毒载体,利用杆状病毒表达系统在昆虫细胞中表达了非洲猪瘟o61r蛋白,为建立安全、可靠的非洲猪瘟亚单位疫苗奠定了基础。
18.本发明使用昆虫细胞sf9重组表达非洲猪瘟o61r蛋白,蛋白表达量高,可用于制备鉴别诊断制品,为生产非洲猪瘟亚单位疫苗和诊断试剂奠定了坚实的基础。
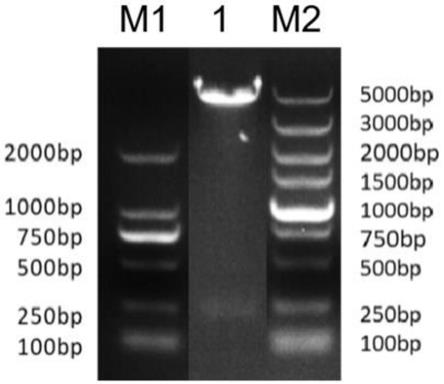
19.杆状病毒表达系统是以杆状病毒为外源基因载体,该真核表达系统既可以在昆虫细胞中表达也可以在活体昆虫中表达;
20.杆状病毒表达系统具有的相对于其他表达系统更为特殊的优势是作为表达载体的杆状病毒基因组可以容纳更多的外源基因;
21.在昆虫细胞中进行蛋白的表达,可以大规模悬浮培养,能够对外源蛋白进行一定的加工修饰,接近于蛋白的天然结构;
22.杆状病毒一般仅仅感染节肢动物,对人和动物没有危害,安全可靠。
23.o61r基因编码p12蛋白,由61个氨基酸编码的膜蛋白,位于病毒的外层,是asfv的结构蛋白,免疫原性良好,是重要的asfv亚单位疫苗备选基因之一。
附图说明
24.图1为本发明重组转移质粒pacebac1
‑
o61r的酶切验证结果,m1为dl2000dna marker,泳道1为双酶切结果,目的产物长度分别约为5000bp和200bp,m2为dl 5000dna marker。
25.图2为重组穿梭质粒菌液pcr鉴定结果,m1为dl 2000dna marker,泳道1为o61r特异性引物pcr鉴定结果,泳道2为m13通用引物pcr鉴定结果,泳道3和4为阴性对照,m2为dl 5000dna marker。
26.图3为间接免疫荧光试验验证结果。其中a为转染了重组杆状病毒的sf9细胞,b为正常的sf9昆虫细胞。
27.图4为western
‑
blot鉴定o61r基因表达结果,m:180kda蛋白marker;1:转染重组杆状病毒的sf9细胞破碎后上清;2:正常sf9细胞破碎后上清。
具体实施方式
28.为更好的说明本发明的目的、技术方案和优点,下面将结合具体实施例对本发明作进一步说明。
29.实施例1
30.1、重组转移质粒pacebac1
‑
o61r的构建,具体包括以下步骤:
31.扩增o61r基因引物的设计:设计扩增o61r基因全长的引物,在引物3’端引入his标签便于后期表达鉴定,在引物5’端添加bamh i,在3’端添加hind iii限制性酶切位点序列,用于后期克隆。设计引物如下,bac
‑
f
‑
o61r:cgcggatccatggcacttgatggttca(bamh i)。bac
‑
r
‑
o61r:cccaagcttttagtgatggtgatggtgatgacttgtttttagggaac(hind iii)。
32.o61r基因的扩增:以asfv gd11毒株核酸作为模板,构建pcr反应体系如下表1,
33.表1 pcr反应体系
[0034][0035]
根据green taq mix说明书推荐pcr程序进行扩增,反应程序如下:预变性94℃3min;变性94℃15s,退火55℃15s,延伸72℃1min,共35个循环;最后终末延伸72℃7min。pcr结束后,进行1%浓度的核酸凝胶电泳,切胶后进行胶回收。
[0036]
使用限制性内切酶bamh i和hind iii进行质粒pacebac1与o61r基因双酶切,50μl酶切体系见下表2:
[0037]
表2酶切体系
[0038][0039]
根据上述配制体系,瞬离后,置于37℃浴锅中,酶切过夜。第二天取出反应体系,进行1%琼脂糖凝胶电泳,如图1所示。将有目的基因区域的凝胶切下,进行胶回收目的基因和酶切后的载体。
[0040]
连接反应,将上述步骤获得的酶切后目的片段和酶切后载体片段按照如下表3体系配制10μl连接体系:
[0041]
表3连接体系
[0042][0043]
根据上述连接体系,依次将各试剂加入到pcr管中,瞬离后,将全部试剂离心到管底,16℃连接过夜。
[0044]
重组质粒转化,取上述实验获得的10μl连接产物,加入到dh5α感受态细胞中,冰上孵育30min;取出离心管进行42℃热激50s,冰上孵育5min,向反应体系中加入800μl无抗lb,将离心管放到37℃摇床220rpm培养45min,将转化的菌均匀地涂到含有庆大霉素抗性培养板上,37℃培养过夜。
[0045]
待平板上菌落长到肉眼可见后,用枪头挑取单菌落置于装有庆大霉素抗性肉汤的2ml ep管中,置于37℃摇床220rpm培养4h,待离心管lb变浑浊后,按照pcr检测体系进行单克隆菌株鉴定,20μl反应体系如下表4:
[0046]
表4反应体系
[0047][0048]
按照上述体系配制pcr反应体系,按照如下反应程序进行扩增:94℃3min;变性94℃15s,退火55℃15s,延伸72℃1min,共35个循环;最后终末延伸72℃7min。pcr结束后,进行1%浓度的核酸凝胶电泳。
[0049]
将上述pcr阳性的菌株取出200μl分装,送到北京华大基因公司进行测序,将测序结果与模板序列进行比对,1:1000扩大测序正确的菌株,甘油保菌并进行质粒提取,即为重组转移质粒pacebac1
‑
o61r。
[0050]
2、表达o61r基因的重组穿梭质粒的构建:
[0051]
取1μg重组转移质粒pacebac1
‑
o61r加入到50μl dh10bac感受态细胞中,手指轻弹ep管使质粒与感受态细胞充分混匀,冰上孵育30min,然后将ep管置于42℃水浴锅热激45s,热激完成后迅速将ep管插入到冰水混合物中,孵育2min,完成以上步骤后在超净台中加入900μl无抗lb,37℃220rpm培养4h;取含有三抗培养板置于超净台中,将上述转化的菌液做100倍和1000倍稀释,分别取500μl稀释液均匀的涂布到培养板上,将培养板做好标记放入37℃培养箱中培养48h,48h后挑取菌落单一,菌斑圆润切较大的白色菌落,将菌落加入至装有三抗肉汤的2ml ep管中,放到37℃220rpm摇床培养4h,待肉汤变浑浊后,进行菌液pcr验证,分别选择o61r基因特异性引物及m13通用引物进行pcr鉴定。o61r基因特异性引物pcr反应体系及反应程序参考pcr鉴定重组转移质粒。m13通用引物pcr反应体系如下,m13
‑
f序列:5
’‑
tgtaaaacgacggccag
‑3’
;m13
‑
r序列:5
’‑
caggaaacagctatgacc
‑3’
。pcr反应体系如下表5.
[0052]
表5 pcr反应体系
[0053][0054]
pcr扩增程序如下:94℃3min;变性94℃15s,退火55℃15s,延伸72℃3min,共35个
循环;最后终末延伸72℃7min。
[0055]
将pcr扩增产物进行核酸凝胶电泳,结果如图2所示,pcr产物的片段大小应为2300bp+目的基因大小,将条带大小一致的菌株进行扩大,该菌株即为转座成功的阳性菌。
[0056]
表达o61r基因的重组穿梭质粒的提取,将上述转座成功的菌株进行1:1000扩大培养,12h后收集细菌,取4ml菌液分两次加入到2ml ep管中,12000g离心2min,完全弃去上清,每管加入250μl solution i,反复吹打使菌体完全重悬,再加入250μl solution ii轻轻上下颠倒ep管6
‑
8次,室温静置2min,加入350μl solution iii反复颠倒混匀直至出现白色絮状沉淀,将离心管置于冰中孵育10min,此时将离心机调成4℃18000g离心10min,取离心后上清,加入到等体积的异丙醇中,此时需要换成1.5ml ep管,反复吹打使液体充分混匀,冰上孵育30min后18000g离心10min,完全弃去上清,加入600μl预冷的75%酒精,此时需要将贴在管底的白色沉淀吹打下来,使其悬浮与液体中,再进行18000g离心10min,完全弃去上清,将ep管打开放在超净台中吹干,待管底的白色沉淀变为透明状,加入30
‑
50μl无菌去离子水涡旋震荡使沉淀完全溶解,分光光度计检测质粒浓度,4℃冰箱保存备用。
[0057]
3、重组杆状病毒的拯救,具体包括以下步骤:
[0058]
转染昆虫细胞sf9,选取大小均一、低传代次数状态良好的细胞,待sf9细胞处于生长对数期,用sf
‑
900
tm ii sfm无血清培养基将细胞从细胞瓶底吹打下来,取50μl细胞悬液用细胞计数仪进行计数,将细胞稀释到8
×
105个/ml,平铺与6孔板,每孔加入2ml稀释后细胞悬液,前后左右轻轻晃动6孔板,使细胞均匀的平铺到各个孔中,27℃胞培养箱静置培养2h;取两排1.5ml ep管,分别加入100μl grace’s insect medium和1μg提取的表达o61r基因的重组穿梭质粒,震荡器上震荡混匀;另一管加入6
‑
8μlii regent脂质体和100μl grace’s insect medium,震荡器上震荡混匀,再将两管溶液集中到一管中反复吹打混匀,置于细胞台中静置孵育30min;半个小时后,取出预先铺好的sf9细胞,小心弃去培养基,沿六孔板侧壁缓慢加入1ml grace’s润洗细胞,弃去润洗液,向装有孵育液的ep管中加入800μl grace’s insect medium补足1ml,吹打混匀后将全部孵育液沿侧壁缓慢加入到六孔板中,轻轻晃动培养板使孵育液均匀的平铺与六孔板中,将培养板置于27℃胞培养箱孵育3
‑
5h,孵育完成后小心去除孵育液,加入2ml sf
‑
900
tm ii无血清培养基,将六孔板放回细胞培养箱,连续培养72
‑
96h,待观察到有细胞产生病变后,收取上清即为拯救完成的一代病毒计为p1代,将病毒液避光保存与4℃冰箱备用。
[0059]
4、间接免疫荧光实验(ifa)验证重组杆状病毒o61r基因表达情况
[0060]
将p1代病毒后的贴壁细胞加入1ml常温pbs置于摇床上清洗5min,重复清洗2次;向六孔板中加入2ml 4%多聚甲醛固定细胞,室温静置20min,弃去固定液,用pbs清洗3次,加入0.5%曲拉通通透细胞,室温静置10min,弃去通透液,用pbs清洗3次,加入2ml/孔5%脱脂奶粉封闭30min,封闭完成后弃去封闭液,pbs清洗3次,用pbs以1:1000比例稀释羊抗鼠his单抗,将稀释抗体加入到各孔中,置于4℃床孵育过夜,过夜孵育后加入2ml/孔的pbst清洗细胞3次,用pbs以1:500稀释fitc标记的羊抗鼠igg二抗,室温避光孵育1h,弃去二抗,加入pbst清洗细胞三次,置于荧光显微镜下观察细胞发光情况,结果如图3所示,转染了重组杆状病毒的sf9细胞出现了明显的荧光,对照组则没有荧光。
[0061]
5、重组蛋白表达验证和表达条件的优化,具体包括以下步骤:
[0062]
将处于生长对数期的细胞sf9稀释到2.5
×
106个/ml,将p1代病毒储液以moi=0.5
感染细胞,27℃培养箱培养72h收取细胞,500g离心5min,收集上清以此为p2代病毒储液,再以相同的条件扩繁p2代病毒,离心收集上清计为p3代病毒储液,一般认为p3代以后病毒毒价会趋于稳定,因此本研究以p3代病毒进行最优接毒moi条件摸索;分别以moi为0.5、1、1.5、2、5将p3代病毒液接到密度为2.5
×
106个/ml的细胞里,72h后同时收取细胞,500g离心5min,弃去上清,用合适体积pbs重悬细胞,置于4℃/
‑
80℃反复冻融三次裂解细胞,将裂解后的细胞13000g离心2min分离上清沉淀,分别取80μl上清和沉淀至1.5ml ep管中,再加入20μl 5
×
protein loading buffer充分混匀,置于沸水中煮10min制备蛋白样品,将制备的蛋白样品进行sds
‑
page和western
‑
blot实验,通过灰度值分析最优的接毒moi=0.5。
[0063]
最佳表达时间探索,按照上述实验得到的最优接毒moi进行接毒,分别在60h、72h、96h和120h收取细胞样品,按照上述步骤制备蛋白样品,进行western
‑
blot实验,通过灰度值分析蛋白最大表达量的时间为72
‑
96h。
[0064]
聚丙烯酰胺凝胶电泳步骤,将蛋白胶组装到电泳仪中,加入1
×
电泳液,按照顺序加入10
‑
20μl制备完的蛋白样品,首先以恒压80v电泳30min将蛋白样品跑过浓缩胶,用恒压120v跑1小时左右,待指示剂跑至蛋白胶底端,蛋白marker条带分离清楚关闭电源,完成凝胶电泳。
[0065]
蛋白质免疫印迹试验(western
‑
blot)将上述步骤的蛋白胶,根据marker切下目的蛋白所在位置,并将其浸泡在转膜液中,根据切下蛋白胶的大小剪切尺寸一致的硝酸纤维素膜(nc膜)放入遇冷的转膜液中浸润,将转膜仪置于冰盒中,加入适量预冷的转膜液,按照黑面板
‑
海绵
‑
三层滤纸
‑
蛋白胶
‑
nc膜
‑
三层滤纸
‑
海绵
‑
白色面板,加入转膜液使转膜板完全浸没到转膜液中,以恒流200ma进行转膜,转膜时间以蛋白大小为参照1kda/min。预先配制5%脱脂奶粉,将完成转印的nc膜放入到封闭液中,室温摇床封闭1h,弃去封闭液,将nc膜置于摇床上用pbs清洗三次,每次10min,最后一次洗涤完全弃去pbs,加入1:4000稀释的his
‑
tag(4c2)monoclonal antibody(用pbs稀释)4℃冰箱孵育过夜,回收his单抗,用pbst清洗非特异性结合的抗体,置于摇床上10min/次清洗三次,完全弃去pbst加入1:10000稀释的800cw goat anti
‑
mouse igg(h+l)secondary antibody(用pbs稀释)室温孵育1h,整个过程要避光,孵育完成后回收二抗,用pbst清洗掉非特异性结合抗体,清洗三次每次10min,将nc膜置于双色激光成像分体系统进行扫描。结果显示,在12kda处出现特异性条带,大小与预期相符(图4)。
[0066]
6、重组蛋白表达表达量测定
[0067]
使用bca蛋白定量试剂盒对实验室保存的蛋白tet进行定量,经测定该蛋白浓度为0.689mg/ml,以该蛋白为标准蛋白,与po61r蛋白用相同条件进行转膜,将扫描后的源文件导入image studio ver 5.0软件进行灰度值定量,将样品灰度值与标准参照品灰度值进行比对,再根据标准参照蛋白浓度计算出po61r蛋白浓度为0.97mg/ml。
[0068]
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1