一种核桃粕抗炎肽FPY及其应用
技术领域:
本发明属于食品深加工技术领域,具体涉及一种分离自核桃粕酶解产物的抗炎肽及其应用。
背景技术:
:
近年来,由慢性炎症引发的各种慢性疾病严重威胁人类的健康,炎症诱导物通过免疫细胞中存在的各种传感器引发多种炎症介质的产生,然后通过几种信号通路触发炎症反应。炎性介质是指在炎症发生过程中由免疫细胞释放或由体液产生的能引起炎症反应的化学物质,按照生化特性可分为七类:血管活性胺、血管活性肽、脂质介质、补体成分片段、细胞因子、趋化因子和蛋白水解酶(medzhitov,2008)。按来源可以分为两类,即细胞源性炎性介质和血浆源性炎性介质,炎性介质不但参与炎症反应,同时具有致炎作用,在炎症的产生和发展过程中非常重要,常见的炎性介质主要包括一氧化氮(nitricoxide,no)、花生四烯酸、细胞因子、补体等。
no属于细胞源性炎性介质,其在机体的信号转导中充当第二信使,参与机体的正常生理和炎症反应过程。no由一氧化氮合酶(nos)产生,nos属于神经系统,分为三种类型,其中神经元型nos(nnos又称nos1)和内皮型nos(enos又称nos3)在机体正常状态下表达,有组合表达能力且在体内分布广泛;顾名思义,诱导型nos(inos又称nos2)只有在细胞损伤后诱导表达,在静息细胞中不表达。正常状态下,nnos和enos的组合表达由钙信号激活,在钙信号动力学中,酶的激活快速而短暂,因此no的产生少而短暂,少量的no对机体有益,可有效促进机体免疫,维持其正常的生命活动。而inos通常不被钙信号激活,一旦表达发生就会持续激活,当机体受到刺激后,脂多糖(lps)或细胞因子诱导inos大量表达,进而持续大量的产生no,损害健康。一方面,大量no可引起血管扩张,导致机体血压降低,血流减慢,引发机体微循环障碍;另一方面,过多的no可与超氧阴离子互作,产生大量剧毒的过氧亚硝酸盐阴离子,导致机体氧化损伤。
细胞因子是细胞受到刺激后释放的一类小分子蛋白,生物活性广泛,参与炎症反应的各个阶段。按作用可以分为促炎细胞因子以及抗炎细胞因子。常见的促炎细胞因子包括tnf-α、il-6、il-1β等,主要由巨噬细胞和肥大细胞生成,在炎症反应中具有激活内皮细胞和诱导急性炎症反应等作用。抗炎细胞因子包括il-4、il-10、il-11等,可通过抑制巨噬细胞和树突状细胞中促细胞因子和趋化因子生成,发挥抗炎作用。
炎症模型主要包括体外细胞模型和体内动物模型,体外模型中以脂多糖(lipopolysaccharide,lps)诱导的小鼠单核巨噬细胞raw264.7细胞株模型最为常见,lps与raw264.7细胞膜上的受体相结合后,小鼠巨噬细胞转换为m1型,可通过分泌多种炎症介质来诱导相应的炎症信号通路(如nf-κb信号通路和mapk信号通路等)激活,激活的炎症通路反过来刺激炎性介质的产生,协调控制炎症的发展。
因传统抗炎药物具有一定的毒副作用,寻找天然的抗炎活性物质迫在眉睫。核桃粕是核桃榨油后的副产物,富含优质蛋白,但深度加工利用不足。针对核桃粕的深度开发利用及新产品的开发是当下研究的热点,其中研究最多的是酶解核桃粕蛋白制备活性多肽。生物活性多肽因不同的结构通常具有不同的生物活性,如抗氧化、抑菌、抗炎、抗肿瘤、降血糖活性等。其中,抗炎活性多肽是可调控炎症产生和发展的一类活性肽。近年来,由炎症尤其是慢性炎症引发的各种疾病已严重威胁人类的健康,且传统抗炎药物具有各种毒副作用,因此寻找安全无毒的抗炎药物成为研究的关键,其中,多肽作为一种天然来源的小分子活性化合物因其安全无毒副作用被认为是抗炎药物的安全替代品。目前,多肽生产中面临的主要问题是纯化成本较高,且纯化方法例如色谱技术通常昂贵且冗长,常规分离时每次运行会产生大量有机废液,对于环境安全具有很大的潜在威胁,同时增加了运营成本,并且在多肽在纯化过程中其溶解性和稳定性对于纯化工艺也是一项挑战。
技术实现要素:
:
为解决以上问题,本申请以核桃粕为原料,通过复合酶解法制备活性多肽,并采用超滤、葡聚糖凝胶色谱进行纯化,lc-ms/ms鉴定多肽序列,并利用分子对接技术筛选抗炎活性片段,针对打分较高的多肽进行人工合成并验证其抗炎活性;最后,再次利用分子对接技术对单个抗炎活性多肽与受体蛋白inos进行分子对接,分析其相互作用的关键氨基酸及作用力。
本发明提供的技术方案之一,是一种提取自核桃粕的抗炎肽,所述抗炎肽自c端至n端的氨基酸序列为:phe-pro-tyr,以下简称fpy;
本发明提供的技术方案之二,是上述抗炎肽在制备抗炎药物或产品中的应用。
有益效果:
本研究从核桃粕中酶解制备了抗炎多肽,采用超滤、葡聚糖凝胶色谱进行纯化,经lc-ms/ms鉴定多肽序列,并利用分子对接技术筛选抗炎活性片段,针对打分较高的多肽进行人工合成并验证了其抗炎活性,进一步通过分子对接技术对单个抗炎活性多肽与受体蛋白inos进行分子对接,分析其相互作用的关键氨基酸及作用力,为核桃粕的深度开发利用奠定了理论基础。人工合成后验证抗炎活性,发现fpy具有抗炎活性,对四种炎性介质(no、tnf-α、il-6、il-1β)生成量的具有不同程度的抑制率。分子对接结果表明,fpy与inos之间主要通过π-π堆积、烷基键、π-烷基键以及氢键相连接。
附图说明:
图1超滤后组分对细胞no生成量的影响;
图2葡聚糖凝胶色谱图;
图3各组分对细胞no生成量的影响;
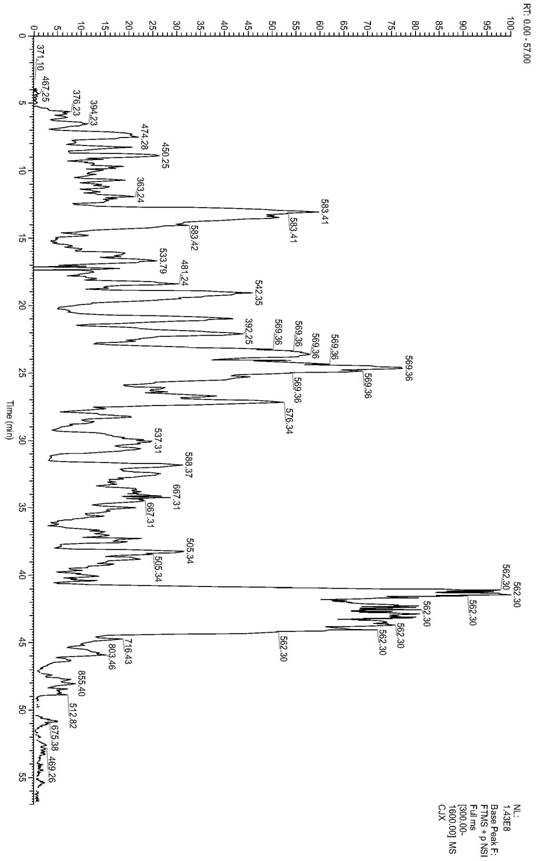
图4f3组分液质分析基峰图;
图5核桃粕多肽与inos对接虚拟筛选结果;
图6多肽fpy的安全性;
图7不同浓度多肽fpy对细胞的no分泌量的影响;
图8不同浓度多肽fpy对细胞的tnf-α分泌量的影响;
图9不同浓度多肽fpy对细胞的il-6分泌量的影响;
图10不同浓度多肽fpy对细胞的il-1β分泌量的影响;
图11抗炎肽fpy与inos的相互作用图。
具体实施方式:
为了使本专利的目的、技术方案及优点更加清楚明白,以下结合具体实施例,对本专利进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本专利,并不用于限定本发明。
本领域技术人员在使用本发明提供的抗炎肽时,可通过人工合成或核桃粕酶解分离获得。
本发明采用的部分实验方法如下:
(1)细胞培养
raw264.7小鼠巨噬细胞维持在dmem培养基(含10%胎牛血清)中,然后将细胞置于含5%co2的37℃培养箱中进行培养,每24h传代一次,且所有实验均使用12~25代之间的细胞。
(2)细胞活力的测定
采用mtt比色法评估核桃粕多肽对raw264.7细胞的毒性。将raw264.7细胞(4.5×104个/孔)接种到96孔板中,置于培养箱中继续培养一天一夜,吸出旧培养液,并加入含不同浓度(0、62.5、125、250、500、1000、2000μg/ml)核桃粕酶解液或多肽的完全培养基100μl,继续培养20h后,弃培养液,并向每个孔中添加20μl(5mg/ml)的mtt溶液,继续置于含5%co2的37℃培养箱培养4h,再次弃上清,最后加入100μldmso,10min后于570nm处测吸光度。细胞活力的计算参见公式1-1。
式1-1中,a2为添加不同浓度多肽组的吸光度,a1为未添加多肽组的吸光度。
(3)no生成量的测定
将raw264.7细胞(4.5×104个/孔)接种到96孔板中,继续培养一天一夜后弃去旧培养液,分别加入不同浓度的各样品(具体浓度由mtt实验筛选确定),并设置空白组与经lps诱导的诱导组以及阳性对照组,具体如下:
空白组:正常培养2h+24h;
诱导组:正常培养2h+lps(1μg/ml)刺激培养24h;
实验组:加样品正常培养2h+lps(1μg/ml)刺激培养24h;
阳性对照组:加阳性对照(100μm的地塞米松(dexamethasone,dex))正常培养2h+lps(1μg/ml)刺激培养24h;
每孔设置3个重复,培养完成后,收集上清。
采用griess法测定上清液中no浓度,其原理为:no在水中被氧化为亚硝酸盐,该法通过测定亚硝酸盐的含量测定no含量。具体步骤为:将50μl细胞上清液与50μlgriessⅰ试剂及50μlgriessⅱ试剂混合,5min后于540nm处测吸光值。根据绘制的亚硝酸盐标准曲线计算各样品中测定细胞液的no含量,no的抑制率采用公式1-2进行计算(模型组即诱导组,样品组即实验组):
(4)细胞因子tnf-α、il-1β、il-6的测定
将raw264.7细胞(5×104个/孔)接种到96孔板中,每孔设置3个重复,实验组、空白组、诱导组、阳性对照组的设置同(3)no生成量的测定,培养完成后收集上清。采用elisa试剂盒测定不同浓度核桃粕水解液对诱导后细胞炎症因子(tnf-α、il-1β、il-6)生成量的影响。各细胞因子抑制率的测定采用公式1-2进行计算。
(5)分子对接
①受体的处理
inos的x射线晶体结构(pdbid:3e6t)从rcsb蛋白数据库下载,使用autodocktools1.5.6软件对受体inos进行加氢、去除水分子等。
②受体准备
采用chem3dultra14.0绘制鉴定出的小分子多肽结构,利用raccoon软件将小分子结构转化为pdbqt格式文件。
③对接过程
将autodockvina作为对接软件,并通过pyrx0.8软件对抗炎多肽进行高通量对接筛选。对接中心坐标设置为(x:121.33,y:110.14,z:36.88),盒子大小设置为
以下将通过具体实施方式对本发明作进一步地解释说明。
实施例1核桃粕抗炎多肽的制备、结构鉴定及分子对接
1、不同分子量多肽的制备
核桃粕酶解:冷榨核桃粕经粉碎后过200目筛,以1:4的料液比加入正己烷浸提14h后过滤,收集残渣,置于通风橱中挥发除去剩余有机溶剂,得脱脂核桃粕,4℃保存备用。
称取一定量的脱脂核桃粕,以1:15(w/v)的料液比加入200ml蒸馏水,用1mol/l的naoh溶液调节ph值至10.0,磁力搅拌5min后进行超声处理,超声条件为50℃,20min,超声结束后室内静置2h,以6000r/min的转速离心15min,将上清用1mol/l的hcl调节ph值至4.5,继续静置1h后离心,所得沉淀水洗至中性,得到核桃粕蛋白。
以1:20(w/v)的料液比将核桃粕蛋白冻干粉与蒸馏水混合,90℃预煮20min使蛋白变性。冷却至室温。碱性和中性蛋白酶按2:1的比例混合成复合酶,酶添加量为8500u/g核桃粕蛋白,在温度55℃、ph7.4条件下酶解5h后,将酶解液煮沸10min,冷却后调ph值至4.5,以6000r/min离心15min,取上清并调ph值至7.0。在此条件下的多肽得率为30.08±0.67%。
多肽分离:将核桃粕酶解液用0.45μm的水相微孔滤膜进行过滤后,采用截留分子量分别为3kda、5kda、10kda的超滤膜进行分离,得到分子量分别为<3kda、3-5kda、5-10kda、>10kda的多肽组分,将各组分收集后冻干,4℃储藏备用。
2、不同分子量多肽对细胞no分泌量的影响
不同分子量酶解液对raw264.7细胞no生成量的影响:经不同分子量的超滤膜过滤后得到了四个组分,并测定了这些组分在500μg/ml时对细胞no分泌量的影响。
结果如图1(白色柱形为空白组,黑色柱形为诱导组),发现相比较其他组分,分子量<3kda的组分处理的细胞no分泌量显著低于其他组分和模型组,抑制率最强。在500μg/ml时,其no抑制率达到39.88±1.41%。
3、多肽纯化
将葡聚糖g-25凝胶用蒸馏水于4℃浸泡12h,装入规格为1.6×60cm的色谱柱中,柱子装好后用4倍体积的水进行压柱,将活性最高的分子量<3kda的多肽超滤组分配制成浓度为50mg/ml的溶液,取5ml进行上样,洗脱液为ph7.0的tris-hcl缓冲液,流速控制在1ml/min,检测波长为220nm。
分子量<3kda的组分经葡聚糖凝胶色谱层析分离后得到4个活性组分,如图2所示,分别命名为f1、f2、f3、f4,其中f3具有最高的多肽得率,达到45.11±1.39%,并对4个组分进行了抗炎活性的测定,结果如图3所示(白色柱形为空白组,黑色柱形为诱导组),在浓度为500μg/ml,经4个组分处理的raw264.7细胞的no分泌量不同,其中组分f3处理的细胞的no分泌量最低,为18.86±0.97μm,即具有最高的抗炎活性,其no抑制率为45.77±1.65%,高于超滤后分子量<3kda在500μg/ml时的抗炎活性,表明通过进一步纯化,高活性多肽进一步被分离出来。
4、多肽结构鉴定
将葡聚糖凝胶色谱过后的高活性f3组分进一步进行lc-ms/ms测定所含多肽的氨基酸序列及分子量。所用色谱柱为75μm×150mm的acclaimpepmapc18分析柱(5μm,
ms和ms/ms参数如下:
(1)ms:扫描范围=100-1500(m/z);分辨率=60,000;最大进样时间=40ms;动态排除时间=20s。
(2)ms/ms:分辨率=7,5000;最大进样时间=120ms;topn=20;nce/steepednce=27;扫描范围(m/z)=100-1500。
利用基于样品种类的mascot软件对原始ms/ms文件进行分析并从uniprot数据库(https://www.uniprot.org/)搜索比对多肽结构,从而确定多肽序列。
f3组分进行lc-ms/ms液质分析,其基峰图如图4所示,经lc-ms/ms分析以及数据库搜索比对,共得到氨基酸序列在10以下的多肽序列579个,为了筛选具有抗炎活性的氨基酸序列,将579个多肽小分子与inos进行虚拟筛选对接,对579个小分子进行打分排序,以筛选活性较高的小分子抗炎多肽序列。
inos是一种只有细胞在受到损伤后才诱导表达的一种神经系统酶,与炎症反映密切相关,机体受到刺激后,lps或细胞因子诱导inos大量表达,进而大量持续的产生no,引起机体炎症的产生。因此,在对抗炎活性物质进行分子对接研究时,常将其作为受体蛋白与活性小分子配体对接筛选抗炎物质。将液质分析后得到的579个小分子多肽与inos进行虚拟筛选,并根据对接能高低对小分子多肽进行排序,对接能通常为负数,其值越小表明多肽与inos之间的结合越稳定,即越可能具有抗炎活性。图5列出了排名前十的小分子多肽的对接能及氨基酸序列。
实施例2核桃粕抗炎多肽的抗炎活性
为了进一步获得抗炎活性多肽,对排名靠前的多肽fpy(phe-pro-tyr,分子量为425.2da)进行了人工合成,以验证其抗炎活性。
多肽fpy委托南京源肽生物有限公司通过固相合成法进行合成,纯度>95%,满足活性检测相关实验的要求。
(1)细胞毒性
首先对多肽fpy的安全性进行了探究,如图6所示,发现在浓度为0~500μm的范围内,四种多肽均具有不同程度的促进细胞增殖作用,即不具有毒性(图6第一列为空白组,第二列为诱导组,安全性实验未设置阳性对照组)。
其中肽fpy对细胞活力的影响均随着浓度的增加呈现先增加后降低的趋势,且在浓度为50μm时具有最高的细胞活力,达到125.62±2.63%。以上数据表明,肽fpy在浓度为0~500μm范围内均不具有毒性,可用于继续测定抗炎活性。
(2)对细胞的no(a)、tnf-α(b)、il-6(c)、il-1β(d)分泌量的影响
为验证虚拟筛选的结果,测定肽fpy对lps诱导的raw264.7细胞的no、tnf-α、il-6、il-1β分泌量的影响(图7-10中,第一列为空白对照,第二列为模型组,第三列为阳性对照)。
如图7,经lps刺激后,诱导组的no生成量显著增加,约是空白组的4.52倍,且肽fpy在浓度分别为50、100、200μm时均可抑制lps诱导的巨噬细胞的no生成量,且随着浓度的增加,抑制作用增强。在最大浓度200μm时显示出最强的抑制作用,在该浓度下,fpy对lps诱导的raw264.7细胞的no生成量为23.64±0.28μm,抑制率39.96±1.25%。
如图8所示,经lps刺激后,诱导组的tnf-α分泌量显著增加,约是未刺激组的10.53倍,肽fpy在浓度分别为50、100、200μm时均可抑制lps诱导的巨噬细胞tnf-α生成,且具有浓度依赖性。在浓度为200μm时最强,抑制率为39.52±2.14%。
如图9所示,发现经lps刺激后,诱导组的il-6分泌量显著增加,约是未刺激组的8.59倍。肽fpy在浓度为50、100μm时,对细胞il-6的分泌量具有抑制作用,且随浓度增加抑制作用增强,而在浓度为200μm,细胞il-6的分泌量相比100μm处理组反而增加,但仍低于模型组。因此,在100μm时,肽fpy对应的细胞il-6抑制率最大,为31.44±1.98%,说明肽fpy对细胞il-6的分泌量的最大抑制作用浓度为100μm。
如图10,经lps刺激后,诱导组的il-1β生成量显著增加,约是空白组的4.29倍,肽fpy在浓度分别为50、100、200μm时均可抑制lps诱导的巨噬细胞的il-1β分泌量,且具有浓度依赖性,在最大浓度200μm时显示出最强的抑制作用,在该浓度下,肽fpy对lps诱导的raw264.7细胞的il-1β分泌量为246.58±18.67pg/ml,抑制率达43.44±2.01%。
(3)多肽与inos的分子对接
为了进一步验证肽fpy的抗炎机理,将其与受体蛋白inos进行了对接,对接结果如图11所示。肽fpy对接于inos的空腔中,且疏水相互作用和氢键是其与inos之间的主要相互作用力。
对接结果表明,肽fpy与inos之间的“cdockerinteractionenergy”为-48.563kcal/mol,表明肽fpy可与受体蛋白紧密结合。
如图11所示,inos的trp188、phe363可与fpy中tyr上的苯环通过π-π堆积相连接,inos的val346、met349、leu119、pro192、arg193可与fpy中pro的吡咯环和phe的苯环通过烷基键以及π-烷基键连接,inos的val346和gly365可与fpy中tyr的羧基上的氧原子形成氢键。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本专利构思的前提下,上述各实施方式还可以做出若干变形、组合和改进,这些都属于本专利的保护范围。因此,本专利的保护范围应以权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!