鲟鱼鱼皮胶原多肽提取方法、应用、化妆品原料及其制备方法与流程
1.本发明属于化妆品技术领域,尤其涉及一种鲟鱼鱼皮胶原多肽提取方法、应用、化妆品原料及其制备方法。
背景技术:
2.鲟鱼是世界上现有淡水鱼类中体形较大、寿命较长的一种鱼类,迄今已有2亿多年的历史。中国是世界鲟鱼品种最多、分布最广、资源最为丰富的国家之一。由于鲟鱼营养价值高、养殖经济效益好,伴随鲟鱼人工繁殖技术的日益成熟,我国鲟鱼养殖总量不断增长。鲟鱼深加工后的主要副产物——鱼皮和鱼骨中均富含胶原蛋白。胶原多肽是胶原蛋白的三螺旋结构彻底打开,肽链被降解成为短的肽链,得到分子质量在几千道尔顿之间的多肽混合物。
3.皮肤衰老是自然的进程,每个人都无法避免,导致衰老的原因也是很复杂的。80%的皮肤老化都源于光老化。基本上,目前被认为抗衰老就是抗光老化还有抗氧化、抗糖化。
4.因此亟需一种具有抗光老化的化妆品。
技术实现要素:
5.本发明的目的在于提出一种鲟鱼鱼皮胶原多肽提取方法、应用、化妆品原料及其制备方法,以鲟鱼鱼皮为原料提取的鲟鱼鱼皮胶原多肽作为化妆品原料,应用于化妆品,使得化妆品具有抗老化功效。
6.为达此目的,本发明采用以下技术方案:
7.本发明提供的鲟鱼鱼皮胶原多肽提取方法,包括以下步骤:s1:将鲟鱼鱼皮割碎成块状,将配置好的naoh溶液与鲟鱼鱼皮按体积质量比为(9
‑
11):1ml/g的比例混合振荡洗涤22
‑
24h,去除杂蛋白,s2:经过步骤s1洗涤结束后用超纯水将鲟鱼鱼皮冲洗干净,然后将正丁醇溶液与鲟鱼鱼皮按体积质量比为(9
‑
11):1ml/g的比例进行第二步洗涤,将混合液振荡22
‑
24h,去除脂肪,s3:经过步骤s2洗涤结束后用超纯水冲洗,直至味道散去,将鲟鱼鱼皮平铺,预冷冻过夜,再进行冻干处理,s4:配制乳酸溶液,将乳酸溶液与鲟鱼鱼皮按体积质量比为(9
‑
11):1ml/g比例混合并振荡1.8
‑
2.2h,使鱼皮膨胀,结束后用超纯水冲洗,收集鲟鱼鱼皮匀浆成糊状待用,s5:采用蛋白酶对糊状的鲟鱼鱼皮进行酶解,获得酶解产物,将酶解产物进行超滤后获得分子量<2325da的鲟鱼鱼皮胶原多肽。
8.优选地,步骤s5中,的蛋白酶为风味蛋白酶;酶解条件为:酶解温度为38
‑
42℃,酶解时间为7.5
‑
8.5min,酶解ph为7
‑
8,料液比为1:(14.5
‑
15.5),以每克鲟鱼鱼皮的干重计,蛋白酶总用量为7500
‑
8500酶活力单位。
9.优选地,步骤s5中采用1kd超滤膜进行超滤。
10.优选地,步骤s1中,鲟鱼鱼皮采用解冻后的鲟鱼鱼皮,naoh溶液的质量浓度为0.08
‑
0.12mol/l,采用0
‑
4℃的摇床进行振荡,步骤s2中,正丁醇溶液的质量分数为10%,采用0
‑
4℃的摇床进行振荡。
11.优选地,步骤s4中,乳酸溶液是质量分数为3%,采用摇床进行振荡。
12.本发明还提供一种如上述的鲟鱼鱼皮胶原多肽提取方法提取得到的鲟鱼鱼皮胶原多肽在化妆品中的应用。
13.优选地,化妆品为具有抗光老化的化妆品。
14.本发明还提供一种如上述的鲟鱼鱼皮胶原多肽提取方法提取得到的鲟鱼鱼皮胶原多肽在制备炎症因子抑制剂的应用。
15.本发明还提供一种如上述的鲟鱼鱼皮胶原多肽提取方法提取得到的鲟鱼鱼皮胶原多肽在制备mmp2或mmp3基质金属蛋白酶的抑制剂上的应用。
16.本发明还提供一种化妆品原料,包括以下的组分:质量百分浓度为18
‑
22%的上述的鲟鱼鱼皮胶原多肽提取方法制备得到的胶原多肽,质量百分浓度为0.18
‑
0.22%的对羟基苯乙酮,体积百分浓度为0.35
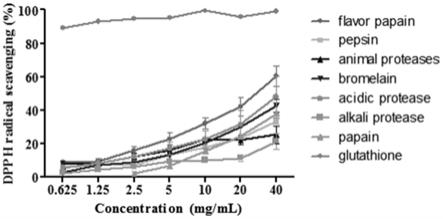
‑
0.45%的防腐剂,余量去离子水。
17.优选地,防腐剂为a91防腐剂。
18.本发明还提供一种化妆品原料的制备方法,其特征在于,配置质量百分浓度为0.18
‑
0.22%的对羟基苯乙酮,并于55
‑
65℃水浴中充分溶解,水为去离子水,冷却至30
‑
40℃后加入体积百分浓度为0.35
‑
0.45%的防腐剂和质量百分浓度为18
‑
22%的鲟鱼鱼皮胶原多肽,充分混匀得化妆品原料。
19.本发明的有益效果为:
20.1、以鲟鱼鱼皮为原料提取的鲟鱼鱼皮胶原多肽作为化妆品原料,应用于化妆品,使得化妆品具有抗老化功效。
21.2、本发明制得的鲟鱼鱼皮胶原多肽对光老化损伤具有保护作用;可以抑制细胞中脂质过氧化,对细胞氧化损伤具有一定的修复作用。
22.3、本发明的鲟鱼鱼皮胶原多肽对炎症因子mrna的表达有一定的抑制作用,对于抗炎症有一定的功效;可以降低细胞内mmp2、mmp9 mrna的表达量,从而改善皮肤组织弹性和保湿性;对l929细胞的迁移有促进作用,可用于制备炎症因子抑制剂及mmp2或mmp3基质金属蛋白酶的抑制剂。
23.4、本发明的化妆品原料无刺激性,具有光老化损伤修复作用,具有良好的应用前景。
附图说明
24.图1是实施例一的不同酶酶解产物的dpph清除活性图。
25.图2是实施例一的不同酶酶解产物的酪氨酸酶抑制活性图。
26.图3是实施例一的ph、酶活力单位、温度交互影响风味蛋白酶酶解鲟鱼的响应面分析图。
27.图4是实施例一的酶活力单位、温度交互影响风味蛋白酶酶解鲟鱼的响应面分析图。
28.图5是实施例一的ph、温度交互影响风味蛋白酶酶解鲟鱼的响应面分析图。
29.图6是实施例一的不同浓度hacp培养l929细胞后细胞增值活性图。
30.图7a是实施例二的hacp对uvb诱导l929细胞炎症因子cox2的影响。
31.图7b是实施例二的hacp对uvb诱导l929细胞炎症因子il
‑
1α的影响。
32.图7c是实施例二的hacp对uvb诱导l929细胞炎症因子tnf
‑
α的影响。
33.图7d是实施例二的hacp对uvb诱导l929细胞炎症因子il
‑
6的影响。
34.图7e是实施例二的hacp对uvb诱导l929细胞炎症因子il
‑
1β的影响。
35.图8是实施例二的hacp对l929细胞迁移率影响图。
36.图9是实施例三中hacp对uvb诱导l929 mmp2表达影响。
37.图10是实施例三中hacp对uvb诱导l929 mmp3表达影响。
38.图11是实施例四的hacp对uvb暴露l929细胞活性影响图。
39.图12是实施例四的hacp对uvb诱导l929细胞内ros清除活性图。
40.图13是实施例四的hacp对uvb诱导l929细胞内mda含量影响图。
具体实施方式
41.现结合附图和具体实施方式对本发明进一步说明。
42.实施例一
43.本实施例公开了鲟鱼鱼皮胶原多肽提取方法,包括以下步骤:
44.s1:鲟鱼皮解冻后将鲟鱼鱼皮割碎成块状,将配置好的0.10mol/l的naoh溶液按naoh溶液:鲟鱼鱼皮=10:1ml/g的比例放置于4℃摇床内震荡洗涤24h,去除杂蛋白。本实施例的鲟鱼为大杂交鲟(huso dauricus
♀×
acipenser schrenckii
♂
)由福建龙鳇鲟业有限公司提供,来自宁德市周宁县钟山桥1号水库。
45.s2:经过步骤s1洗涤结束后用超纯水将鲟鱼鱼皮冲洗干净,然后按照10%质量分数的正丁醇溶液:鲟鱼鱼皮=10:1ml/g的比例进行第二步洗涤,将混合液置于4℃摇床内振荡24h,去除脂肪。
46.s3:经过步骤s2洗涤结束后用超纯水冲洗,直至味道散去,将鲟鱼鱼皮平铺于盘内,在
‑
20℃温度下预冷冻过夜,再放入真空冷冻干燥机内冻干,置于
‑
20℃保存。
47.s4:配制质量分数为3%的乳酸溶液,按照乳酸溶液:鲟鱼鱼皮=10:1ml/g比例混合并放置摇床内振荡2h,使鱼皮膨胀,结束后用超纯水冲洗,收集鲟鱼鱼皮匀浆成糊状待用。
48.s5:采用蛋白酶对糊状的鲟鱼鱼皮进行酶解,获得酶解产物,将酶解产物采用1kd超滤膜进行超滤获得分子量<2325da的鲟鱼鱼皮胶原多肽。本实施例采用蛋白酶为风味蛋白酶;酶解条件为:酶解温度为38
‑
42℃,酶解时间为7.5
‑
8.5min,酶解ph为7
‑
8,料液比为1:(14.5
‑
15.5),以每克鲟鱼鱼皮的干重计,蛋白酶总用量为7500
‑
8500酶活力单位。本技术后文中将本发明制得的鲟鱼鱼皮胶原多肽简写为hacp。
49.本实施例选用风味蛋白酶是通过dpph为评价指标筛选后得到的最佳的水解酶,以下针对筛选过程进行详细描述。
50.(1)酶种类筛选
51.准确称取处理后的鲟鱼鱼皮,以1:10料液比加入七种不同蛋白酶溶液中进行酶解,蛋白酶溶液以10000u/g鱼皮进行配置。依据下表1最适条件反应条件,酶解6h后,至于100℃中5min,使蛋白酶失活,用流水快速降温至室温,离心2次(8000rpm,10min)去除杂质,取上清液,并经过0.45μm滤器过滤上清液,获得酶解产物。对不同酶解产物的抗氧化活性以及酪氨酸酶抑制活性进行测定。如图1和图2所示,结果显示,风味蛋白酶酶解产物具有最优
的dpph清除活性和酪氨酸酶抑制活性。
52.表1.不同蛋白酶酶解条件
[0053][0054][0055]
(2)鲟鱼鱼皮酶解单因素实验
[0056]
选择dpph清除率最佳的蛋白酶(风味蛋白酶),以胶原多肽dpph清除率和水解度为指标,研究时间、温度、ph、酶用量和料液比这五个因素对鲟鱼鱼皮酶解效果的影响,以确定各因素的最佳酶解条件。以温度50℃、料液比1:15、时间6h、酶活10000u/g、ph=7为初始酶解条件,实验时改变其中一个单因素条件,其他条件不变进行酶解。
[0057]
(3)鲟鱼鱼皮酶解响应面分析
[0058]
以水解度为辅助响应值,根据单因素实验确定了温度、酶活力、ph为影响dpph清除率的三因素,应用desgin
‑
expert中的box
‑
belnken中心组合进行了三因素三水平17个组的试验,dpph清除率为响应值,其结果如表2所示:
[0059]
表2.响应面优化试验设计及结果
[0060][0061][0062]
如表2所示该模型显著、失拟项不显著可以得出该模型拟合性较好(p<0.05),且该软件得处的回归线性方程为:y=
‑
453.49+108.23a+0.013b+7.61c
‑
0.0026ab
‑
1.144ac+0.00026bc
‑
3.37a2‑
3.58b2‑
0.029c2,r2=0.8722,说明响应值dpph清除率的变化有87%来源于所选的三个变量,通过表3的f值也可判断三因素之间酶提取物对dpph清除率影响关系为:c温度>b酶活力>a ph。变异系数cv=1.69%,说明该模型的重复性良好。
[0063]
表3基于dpph清除率的方差分析结果
[0064][0065]
通过图3
‑
5可以看出ab与ac曲面较陡,bc较ab、ac平缓,说面交互作用对提取物的影响大小关系为ac>ab>bc。
[0066]
经响应面分析得到本实施例中采用风味蛋白酶的最佳工艺条件:料液比1:15,ph 7.0,酶解温度为40℃,酶解时间为8h,酶活力单位为8000u/g干重鱼皮。该条件下得到的鲟鱼鱼皮胶原多肽的dpph清除率为91%。
[0067]
(4)小分子量的鲟鱼鱼皮胶原多肽(hacp)的分离:
[0068]
将响应面优化的最佳提取工艺制备的hacp进行超滤膜分离,利用1kda超滤膜截留小分子量鲟鱼鱼皮胶原多肽组分,真空冷冻干燥。
[0069]
通过“光
‑
色
‑
热
‑
质
‑
元
‑
化”联用技术和gpc凝胶渗透色谱仪进行分子量检测,结果如表4所示,结果显示,用1kd超滤膜进行超滤后获得分子量<2325da的鲟鱼鱼皮胶原多肽(hacp),且分子量<2206da的鲟鱼鱼皮胶原多肽占总鲟鱼鱼皮胶原多肽的64.3%,hacp重均分子量为2080。
[0070]
表4 hacp分子量分布
[0071][0072]
实施例二
[0073]
本实施例公开了鲟鱼鱼皮胶原多肽在制备炎症因子抑制剂的应用。采用实施例一的鲟鱼鱼皮胶原多肽提取方法,制备得到的鲟鱼鱼皮胶原多肽(hacp)。
[0074]
本实施例的实验过程如下:
[0075]
1、l929细胞的培养:
[0076]
从液氮罐中取出l929细胞冻存管,快速置于37℃水浴锅中,使细胞悬液迅速化冻。融解后移到安全柜中进行操作,将细胞冻存液加入事先准备好的4ml rpmi完全培养基中(10%血清和1%双抗),用移液管轻柔吹打均匀,1500rpm离心3min。吸取2ml的rpmi完全培养基充分吹打沉淀细胞使其充分混匀,移入培养瓶中,加入10ml的rpmi完全培养基,摇匀,放入细胞培养箱(37℃、5%co2)培养。当细胞密度达到约90%时进行传代。吸弃培养瓶中的rpim完全培养基,加入2ml pbs进行清洗残余的培养基,弃去pbs,重复操作一次。每个培养瓶中加入2ml的trypsin
‑
edta solution胰酶消化液,将培养瓶放入培养箱消化2min,在显微镜下观察细胞消化状况,用手轻拍培养瓶,确保细胞悬浮。加入2ml培养基,终止消化,1500rpm离心3min,倒掉上清液。向细胞沉淀中加入3ml的rpmi完全培养基,充分吹打沉淀细胞使其重悬,以1:3的比例进行传代培养,每个培养瓶中加入11ml含有10%血清、1%双抗ripm完全培养基和1ml细胞重悬液,摇匀后置于37℃、5%co2细胞培养箱中培养。
[0077]
2、hacp对l929细胞的毒性影响
[0078]
本实验采用mts法测定不同浓度多肽对细胞活性的影响,如图6所示与对照相比0.125mg/ml
‑
8mg/ml对l929细胞不产生任何毒性,后续实验选择1mg/ml以下浓度进行后续实验。
[0079]
3、hacp对uvb诱导的l929细胞炎症因子的影响
[0080]
(1)总rna的提取
[0081]
将细胞接种于24孔板中,密度为1
×
105cfu/ml,于37℃,5%co2细胞培养箱中过夜培养。饥饿培养12h后,40mj/cm2uvb进行辐射,随后加入不同浓度(0.25、0.5、1mg/ml)含hacp的rpmi培养基。于细胞培养箱中孵育24h后,吸弃培养基,加入细胞裂解液,反复吹打裂
解细胞。细胞总rna提取参照提取试剂盒说明书。
[0082]
(2)cdna的合成
[0083]
酶标仪测得rna浓度后,取1μg细胞总rna反转录cdna。反转录体系参照艾科瑞生物evo m
‑
mlv rt premix for qpcr试剂盒说明书。37℃,15min进行反转录,85℃,5s灭活反转录酶。
[0084]
(3)l929细胞中炎症因子表达水平检测
[0085]
(1)引物设计:设计qpcr产物扩增片段长度、引物序列,加入量为0.5μl。
[0086]
(2)qpcr反应:将l929细胞的cdna稀释3倍后,作为模板,用power sybr green pcr master mix分别配制各基因的qpcr体系。
[0087]
(3)将pcr体系混匀后放入qpcr仪中进行反应。
[0088]
(4)反应结束后,对反应体系直接进行熔解曲线分析实验,分析pcr产物的特异性。全过程采集荧光信号,分析信号峰值,以确定扩增产物的特异性。
[0089]
研究结果如图7a、7b、7c、7d、7e所示,40mj/cm2诱导的l929细胞基质中(tnf
‑
α、il
‑
6、cox2、il
‑
1α、il
‑
1β)mrna含量与未照紫外正常培养组相比有显著性增加,说明紫外辐照炎症模型建立成功。hacp用药组与模型组相比较呈现一定的下降趋势,用药量在1mg/ml浓度的炎症因子mrna含量与紫外诱导组相比有显著性减少,由此说明hacp对炎症因子mrna的表达有一定的抑制作用,对于抗炎症有一定的功效。
[0090]
4、hacp对l929细胞迁移率影响
[0091]
实验方法参照ibidi公司culture
‑
insert 2well inμ
‑
dish伤口愈合插件,主要步骤如下:
[0092]
(1)配制接种密度为3
×
105cfu/ml的细胞悬液,每孔加入70μl于皿中,培养箱培养1d使其可长满小孔。
[0093]
(2)24h后,用已消毒过的镊子将伤口愈合插件拔出,每个培养皿中加入2ml含有hacp的培养液进行培养,观察愈合情况。各组分别为:
[0094]
①
含10%fbs的rpmi培养基;
[0095]
②
含0.5%fbs的rpmi培养基;
[0096]
③
含0.5%fbs和125μg/ml hacp的rpmi培养基;
[0097]
④
含0.5%fbs和250μg/ml hacp的rpmi培养基;
[0098]
⑤
含0.5%fbs和500μg/ml hacp的rpmi培养基;
[0099]
⑥
含0.5%fbs和1000μg/ml hacp的rpmi培养基。
[0100]
(3)孵育hacp后0h、24h和48h时利用显微镜下的ph0模式拍摄照片察看并得到细胞迁移状况。
[0101]
本实验结果如图8所示,在创面伤口愈合的过程中,成纤维细胞和角质细胞的增殖和迁移可代表表皮细胞的生长情况。经过不同浓度(125、250、500、1000μg/ml)的hacp处理24h和48h的l929的迁移率如图8中可以看出:l929细胞随着时间的增加在渐渐地往划痕处迁移,同对照组相比时,随着hacp浓度的不断增加,划痕区域逐渐减小并呈现剂量依赖关系。实验48h后,当hacp浓度为500和1000μg/ml时,伤口划痕区域愈合效果最好。以上结果表明hacp对l929细胞的迁移有促进作用。
[0102]
通以上述的实验可知:hacp可加快l929细胞的迁移速率,可在mrna水平抑制tnf
‑
α、il
‑
6、cox2、il
‑
1α、il
‑
1β等炎症因子的表达。因此,可以用于制备炎症因子抑制剂。
[0103]
实施例三
[0104]
本实施例的实验过程与实施例二相似,mmps家族可以通过分解ecm成分进而影响组织器官的各种形态和功能,所以对mmp的研究,有利于未改善皮肤的形态和功能提供一定的原理支持。
[0105]
实验结果如图9、10所示,紫外辐射会导致mmp2、mmp9含量的升高,进而导致皮肤组织ecm中胶原蛋白的降解,皮肤松弛,皮肤的屏障功能出现障碍。hacp可以降低细胞内mmp2、mmp3 mrna的表达量,从而改善皮肤组织弹性和保湿性。
[0106]
通过上述的实验可知:hacp可以抑制mmp2和mmp3等基质金属蛋白酶的表达。因此,可以用于制备mmp2或mmp3基质金属蛋白酶的抑制剂。
[0107]
实施例四
[0108]
本实施例公开了鲟鱼鱼皮胶原多肽在制备化妆品中的应用。化妆品为具有抗光老化的化妆品。采用实施例一的鲟鱼鱼皮胶原多肽提取方法,制备得到鲟鱼鱼皮胶原多肽(hacp)。
[0109]
本实施例的实验过程如下:
[0110]
l929细胞的培养及hacp对l929细胞的毒性影响的实验过程同实施例二。
[0111]
1、hacp对uvb诱导l929细胞光老化损伤的修复作用
[0112]
将l929细胞接种到96孔板中,待细胞贴壁后,饥饿处理12h后弃去培养基,pbs洗涤1次后加入20μl pbs。空白对照组细胞用锡箔纸遮挡,然后将96孔板放置于紫外照射仪中分别进行(20mj/cm2)紫外辐射后,吸去pbs,加入不同浓度梯度(0.125、0.5、1、2、4、6、8、16、32mg/ml)含hacp的rpmi培养基,每个浓度设置6个复孔。并设置空白对照组(0μg/ml)和uvb辐射模型组,空白对照组和模型组细胞均加入不含hacp的rpmi培养基,将细胞置于培养箱中继续培养24h后进行细胞活性检测。
[0113]
本实验结果如图11所示:模型对照组的细胞暴露于20mj/cm2 uvb照射后,细胞活力降至正常对照组的80%左右,说明uvb辐射对l929细胞造成了伤害,而加入hacp处理细胞后,相比于uvb组细胞活力逐渐上升,呈现剂量依赖关系,说明hacp对uvb诱导的l929细胞光老化损伤具有保护作用。
[0114]
2、hacp对uvb诱导的l929细胞中ros的影响
[0115]
取生长状态良好的l929细胞按1
×
105cfu/ml的密度接种到96孔板中,饥饿培养12h后用提前在37℃水浴锅中预温好的pbs洗涤2次,每孔加入100μl终浓度为20μmol/l的dcfh
‑
da、不含血清的无酚红rpmi培养基,放入细胞培养箱中37℃孵育30min。弃去培养基,pbs重复洗涤3次,加入20μl pbs,空白对照组细胞用锡箔纸包住,然后将96孔板放置于紫外照射仪中进行uvb紫外辐射,辐射强度为100mj/cm2。辐射结束后,弃去pbs,加入含不同hacp浓度(0.125、0.25、0.5、1mg/ml)的rpmi培养基。设置空白对照组(0μg/ml)和uvb辐射模型组。将96孔板置于细胞培养箱中孵育1h后,酶标仪检测荧光,488nm处激发、525nm处发射。
[0116]
本实验利用dcfh
‑
da作为荧光探针来检测stpe对uvb诱导l929细胞中ros的影响,结果如图12所示,与对照组相比,阳性对照荧光显著增强,说明uvb可以诱导模型细胞内ros的大量产生,多肽与阳性对照组相比在0.25~1mg/ml范围内随着浓度的升高而降低,说明在此范围内,hacp可有效清除uvb诱导产生的ros。
[0117]
3、hacp对uvb诱导的l929细胞中氧化应激的影响
[0118]
将l929细胞按2
×
105cfu/ml的密度接种到9cm细胞培养皿中,每个培养皿8ml细胞液,过夜培养后,饥饿处理12h。吸弃培养皿中培养基,每皿加入5ml pbs进行紫外照射。辐射结束后,加入8ml含有hacp的rpmi培养基,将细胞置于培养箱中继续培养24h。实验分正常组、模型组、hacp给药组(0.25、0.5、1mg/ml)。孵育处理24h后3500rpm离心20min收集细胞。每管加入400μl pbs,低温匀浆破碎细胞,采用南京建成生物工程研究所细胞丙二醛(mda)测定试剂盒检测细胞中mda的含量。
[0119]
自由基可以作用于脂质发生过氧化反应,氧化最终产物为mda,能够引起蛋白质、核酸等交联作用,导致细胞毒性,所以mda含量可以间接反应组织过氧化损伤的程度。
[0120]
本实验结果如图13所示,与正常培养细胞相比紫外辐射可导致细胞中mda含量上升,用药组与紫外组相比有明显的下降趋势,说明hacp可以抑制细胞中脂质过氧化,对细胞氧化损伤具有一定的修复作用。
[0121]
实施例五
[0122]
本实施例提供一种化妆品原料,包括以下的组分:质量百分浓度为20%的上述的鲟鱼鱼皮胶原多肽提取方法制备得到的胶原多肽,质量百分浓度为0.2%的对羟基苯乙酮,体积百分浓度为0.4%的a91(甘油辛酸酯、辛酰羟肟酸、丙二醇)防腐剂和余量离子水。鲟鱼鱼皮胶原多肽通过实施例一的方法制得。
[0123]
本实施例的制备方法如下:配置质量百分浓度为0.2%的对羟基苯乙酮,并于60℃水浴中充分溶解,冷却至40℃后加入体积百分浓度为0.4%的a91防腐剂和质量百分浓度为20%的鲟鱼鱼皮胶原多肽,充分混匀得化妆品原料。
[0124]
制得的化妆品原料外观为棕色液体,无特殊气味,ph7.0。通过对该原料的细菌总数、耐热大肠菌群、铜绿假单胞菌、金黄色葡萄球菌、霉菌和酵母菌、甲醛、六六六、滴滴涕、砷、铅、汞、镉等指标进行检测,检测结果显示所有指标均合格。hacp化妆品原料微生物及重金属测试表如表5所示:
[0125]
表5化妆品原料微生物及重金属测试
[0126][0127]
植物来源的甘油辛酸酯、安全性较高的辛酰羟肟酸与对羟基苯乙酮的防腐复配组合是近年来较受各大化妆品品牌推广的“无添加概念”型防腐组合。本原料通过添加对羟基苯乙酮和a91达到抑菌的效果。
[0128]
以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解;其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1