一种重组I型人源化胶原蛋白多肽及其制备方法和用途与流程
一种重组i型人源化胶原蛋白多肽及其制备方法和用途
技术领域
1.本发明属于基因工程技术领域,具体而言,涉及一种重组i型人源化胶原蛋白多肽及其制备方法和用途。
背景技术:
2.胶原蛋白(collagen)是一类蛋白质家族,一般为白色、透明、无分支的原纤维,是皮肤和骨骼的基础支撑物,可以占到蛋白质总量的25%~35%,主要分布于人体的皮肤、血管、骨骼、筋腱、牙齿和软骨等处,是这些组织的主要基质和支架,保护并连结各种组织,在体内发挥着重要的生理功能。因此,胶原蛋白可以广泛的应用在医药和化妆品等行业中。根据胶原蛋白在体内的分布和功能特点,可以将胶原蛋白分成间质胶原、基底膜胶原和细胞外周胶原。间质型胶原蛋白分子占整个机体胶原的绝大部分,包括ⅰ、ⅱ、ⅲ型胶原蛋白分子,ⅰ型胶原蛋白主要分布于皮肤、肌腱等组织,在医学上的应用最为广泛。
3.然而,天然胶原蛋白不溶于水,性质不均一,很难被人体直接利用,往往需要利用化学手段处理之后才能使用。而且,当前市场上销售的胶原蛋白产品都是取自猪、牛、鱼等动物组织,难以避免病毒感染的风险,同时由于无法与人体相容,会导致免疫排斥和过敏症状的出现。如果从人胎盘原料中提取胶原蛋白,不仅来源有限,更面临法律的严惩。所以,目前胶原蛋白只能在化妆品和保健品中使用,根本无法发挥胶原蛋白的原本生物学功能。
4.生产胶原蛋白的传统方法是利用酸、碱、酶解法处理动物来源的组织,提取胶原蛋白衍生物。这些方法提取的胶原蛋白本身已经丧失了原有的生物学活性,无法应用于生物医学领域发挥其真正的功能。大多数经过制备后的胶原蛋白产品拉伸强度较弱,纯胶原蛋白在体内降解较快,可能存在潜在的抗原性,以及由于胶原蛋白的来源、加工工艺和原料配比的差异,产品的营养成分及饲用价值也不相同,并且皮料在加工过程中不仅要接触许多化学物质,且容易受到细菌的污染,这些问题均严重限制了胶原蛋白的应用。虽然国外研究机构通过培育含人胶原蛋白基因的小鼠,得到了含有人胶原蛋白的乳汁,但是这样生产的成本过高,生产周期过长,无法投入大规模生产。
5.tev protease是一种在大肠杆菌中重组表达的带his标签(6
×
his tag)的烟草蚀纹病毒(tobacco etch virus,tev)的半胱氨酸蛋白酶,能特异性地识别七肽序列glu
‑
asn
‑
leu
‑
tyr
‑
phe
‑
gln
‑
gly/ser,并在gln和gly/ser氨基酸残基之间进行酶切,常用于去除融合蛋白的glutathione s
‑
transferase(gst)、his或者其它标签。
6.因此,找到一种既能够被人体迅速吸收、制备方法简单易得、成本低廉,同时能够起到人体胶原蛋白功能和特性的产品是当务之急。
技术实现要素:
7.发明要解决的问题
8.针对上述本领域中异源胶原蛋白生物活性低、容易诱发免疫反应,以及人源胶原蛋白生产成本高、周期长、无法大规模生产等一系列问题所导致的胶原蛋白利用率低的情
况,本发明提供了一种重组i型人源化胶原蛋白多肽,同时提供了其制备方法和用途。
9.用于解决问题的方案
10.第一方面,本发明提供了一种重组i型人源化胶原蛋白多肽,其中,所述重组i型人源化胶原蛋白多肽包含以seq id no.1所示的序列的n个重复,n为大于等于1的整数,其中当n为大于等于2的整数时,各重复序列之间是直接连接的;任选地,在所述重组i型人源化胶原蛋白多肽的n末端包含能够通过tev蛋白酶切除的氨基酸序列。
11.进一步地,在上述重组i型人源化胶原蛋白多肽中,所述能够通过tev蛋白酶切除的氨基酸序列包含seq id no.4所示的序列;优选地,seq id no.4所示的序列与seq id no.1所示的序列直接相连。
12.进一步地,在上述重组i型人源化胶原蛋白多肽中,所述重组i型人源化胶原蛋白多肽包含:a.以seq id no.3所示的氨基酸序列;b.与seq id no.3的氨基酸序列具有90%、92%、95%、96%、97%、98%或99%同一性的氨基酸序列,并且其保留seq id no.3的氨基酸序列的细胞黏附效果;c.seq id no.3的氨基酸序列中添加、取代、缺失或插入1个或多个氨基酸残基的氨基酸序列,并且其保留seq id no.3的氨基酸序列的细胞黏附效果;或d.由核苷酸序列编码的氨基酸序列,所述核苷酸序列与编码seq id no.3的氨基酸序列的多核苷酸序列在严格条件下杂交,并且所述氨基酸序列保留seq id no.3的氨基酸序列的细胞黏附效果,所述严格条件是中等严格条件,中
‑
高严格条件,高严格条件或非常高严格条件。
13.第二方面,本发明提供了编码上述重组i型人源化胶原蛋白多肽的多核苷酸。
14.第三方面,本发明提供了包含上述多核苷酸的表达载体。
15.第四方面,本发明提供了包含上述表达载体的宿主细胞。
16.第五方面,本发明提供了上述重组i型人源化胶原蛋白多肽的生产方法,其包括以下步骤:
①
在培养基中培养根据本发明第四方面中所述的宿主细胞并生产多肽;
②
收获并纯化所述多肽,优选用ni柱和/或阴离子交换层析纯化所述多肽;和
③
任选地对所述多肽进行酶切,优选用tev蛋白酶酶切所述多肽。
17.第六方面,本发明提供了上述重组i型人源化胶原蛋白多肽在制备产品中的用途,其中所述产品优选是组织工程产品、化妆品、保健品或药物。
18.第七方面,本发明提供了包含上述重组i型人源化胶原蛋白多肽的产品,其中所述产品优选是组织工程产品、化妆品、保健品或药物。
19.第八方面,本发明提供了上述重组i型人源化胶原蛋白多肽在制备具有促进细胞黏附作用的产品中的用途。
20.发明的效果
21.通过上述技术方案的实施,本发明所制备的重组i型人源化胶原蛋白相比i型胶原蛋白的其他片段具有更加良好的细胞黏附效果,由于其氨基酸序列选自天然胶原蛋白氨基酸序列,应用于人体不会产生免疫反应,同时其制备方法简单,在低成本下即可获得较高产量的胶原蛋白。
附图说明
22.图1为重组i型人源化胶原蛋白tc1r4诱导表达后的蛋白电泳图;第一泳道为分子量marker,第二泳道为纯化后的tc1r4蛋白;tc1r4蛋白的电泳检测分子量约为38kda,对应
no.4)序列与首个重复序列的n端直接连接,即
33.enlyfqgekgspgadgpagapgtpgpqgiagqrgvvglpgqrgergfpglpgpsgepgkqgpsgasgekgspgadgpagapgtpgpqgiagqrgvvglpgqrgergfpglpgpsgepgkqgpsgasgekgspgadgpagapgtpgpqgiagqrgvvglpgqrgergfpglpgpsgepgkqgpsgasgekgspgadgpagapgtpgpqgiagqrgvvglpgqrgergfpglpgpsgepgkqgpsgas(seq id no.5)。
34.在研究中,发明人发现,以seq id no.3所示的序列的多肽,相比于申请号为201811254050.7的发明申请中所记载的重组i型人源化胶原蛋白相比,具有更高的活性。
35.在本发明中,多肽为重组i型人源化胶原蛋白,它们在本文中与重组人源化胶原蛋白可互换使用。
36.在本发明中,重组人源化胶原蛋白可以通过本领域中常规的方法进行制备。例如,可以如下步骤生产:(1)大肠杆菌基因工程菌的构建;(2)大肠杆菌基因工程菌的发酵培养;(3)重组人源化胶原蛋白的诱导和表达;(4)重组人源化胶原蛋白的纯化和任选的酶切。
37.在上述步骤(1)中,大肠杆菌基因工程菌的构建可以通过如下步骤进行:a.得到目的基因片段;b.将得到的目的基因片段插入pet
‑
32a表达载体中得到重组表达质粒;c.将重组表达质粒转入大肠杆菌感受态细胞bl21(de3)中,筛选得到阳性大肠杆菌基因工程菌。
38.在上述步骤(2)与(3)中,大肠杆菌基因工程菌的发酵培养和重组人源化胶原蛋白的诱导和表达可以通过如下步骤进行:a.从转化好的lb平板中挑取优选后的大肠杆菌基因工程菌单菌落,置于含有氨苄抗生素的1000ml的lb培养基中37℃,220rpm培养至菌液od
600
在0.9
‑
1.1;b.加入终浓度为0.5mm iptg进行诱导,18℃过夜培养,离心收集菌体。
39.在上述步骤(4)中,重组人源化胶原蛋白多肽的纯化和酶切可以通过如下步骤进行:a.用tris缓冲液(25mm tris,200mm nacl,ph 8.0)重悬菌体,破碎菌体,离心收集上清液;b.利用ni6ff亲和柱结合重组人源化胶原蛋白,含有20mm咪唑的洗涤缓冲液漂洗杂蛋白后,含有250mm咪唑的溶液洗脱目的蛋白,加入tev蛋白酶16℃,酶切2h,最后获得目的胶原蛋白多肽。
40.宿主细胞可以是真核细胞,例如真菌和酵母,原核细胞,例如肠杆菌科细菌。应当理解,本领域技术人员可以通过用其它表达菌株替换上述大肠杆菌菌株作为宿主细胞。
41.本发明还提供了核酸分子,所述核酸分子包括编码本发明的多肽的核酸序列。核酸可以是dna或cdna。核酸分子可以主要由编码本发明所述肽的核酸序列组成,或可以仅由编码本发明所述的肽组成。此类核酸分子可以用本领域已知的方法合成。由于遗传密码的简并性,本领域技术人员应理解,不同核酸序列的核酸分子可以编码相同的氨基酸序列。
42.本发明还提供了载体,所述载体中包括本发明所述的核酸序列。合适的载体是载体构建领域已知的,包括启动子的选择和其他调控元件,例如增强子元件。本发明所述的载体包括适合引入细胞的序列。例如,载体可以是表达载体,在该载体中,所述多肽的编码序列受到它自身顺式作用调控元件的控制,载体的设计便于宿主细胞的基因整合或基因替换等。
43.本领域普通技术人员应理解,在本发明中,术语“载体”包括dna分子,例如,质粒、噬菌体、病毒或其他载体,它含有一个或多个异源的或重组的核酸序列。合适的噬菌体和病毒载体包括,但不限于:λ
‑
噬菌体、embl噬菌体、猿猴病毒、牛疣病毒、epstein
‑
barr病毒、腺病毒、疱疹病毒、小鼠肉瘤病毒、鼠类乳癌病毒、慢病毒等。
44.本发明的多肽包含以seq id no.3所示的序列或以seq id no.3所示的序列中取代、缺失、插入和/或添加一个或多个氨基酸的序列,只要本发明的多肽保留seq id no.3的氨基酸序列的细胞黏附效果。“多个”可以是2、3、4、5、6、7、8、9、10或11个。
45.氨基酸添加指在氨基酸序列,例如seq id no.3的c端或n端添加氨基酸,只要本发明的多肽保留seq id no.3的氨基酸序列的细胞黏附效果。
46.氨基酸取代指在氨基酸序列,例如seq id no.3的序列的某个位置的某个氨基酸残基被其他氨基酸残基替代,只要本发明的多肽保留seq id no.3的氨基酸序列的细胞黏附效果。
47.氨基酸插入指在氨基酸序列,例如seq id no.3的序列的适当位置插入氨基酸残基,插入的氨基酸残基也可以全部或部分彼此相邻,或插入的氨基酸之间都不彼此相邻,只要本发明的多肽保留seq id no.3的氨基酸序列的细胞黏附效果。在本文中氨基酸的插入位置不在各重复序列之间。
48.氨基酸缺失指可以从氨基酸序列,例如seq id no.3的序列中删除1、2或3个以上氨基酸,只要本发明的多肽保留seq id no.3的氨基酸序列的细胞黏附效果。
49.在本发明中,取代可以是保守氨基酸取代,指与seq id no.3的氨基酸序列相比,有3个,更佳地2个氨基酸或1个氨基酸被性质相似或相近的氨基酸所替换而形成肽。这些保守性变异肽可以根据下表进行氨基酸替换而产生。
50.最初的残基代表性的取代优选的取代ala(a)val;leu;ilevalarg(r)lys;gln;asnlysasn(n)gln;his;lys;argglnasp(d)gluglucys(c)sersergln(q)asnasnglu(e)aspaspgly(g)pro;alaalahis(h)asn;gln;lys;argargile(i)leu;val;met;ala;pheleuleu(l)ile;val;met;ala;pheilelys(k)arg;gln;asnargmet(m)leu;phe;ileleuphe(f)leu;val;ile;ala;tyrleupro(p)alaalaser(s)thrthrthr(t)sersertrp(w)tyr;phetyrtyr(y)trp;phe;thr;serpheval(v)ile;leu;met;phe;alaleu
51.如本文所使用的,术语“中等严格条件”,“中
‑
高严格条件”,“高严格条件”或“非常
高严格条件”描述了核酸杂交和洗涤的条件。进行杂交反应的指导参见current protocols in molecular biology,john wiley&sons,n.y.(1989),6.3.1
‑
6.3.6,其通过引用并入本文。在该文献中描述了含水的和非含水的方法,且可以使用任一种。例如,具体的杂交条件如下:(1)低严格性杂交条件在6
×
氯化钠/柠檬酸钠(ssc)中,在约45℃,然后在至少50℃,在0.2
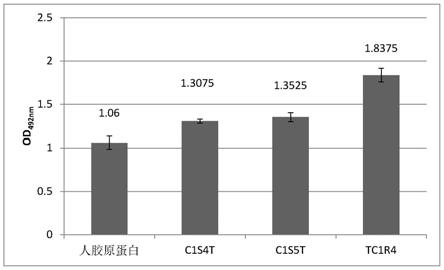
×
ssc,0.1%sds中洗涤2次(对于低严格性条件,可以将洗涤温度升高到55℃);(2)中等严格性杂交条件在6
×
ssc,在约45℃,然后在60℃,在0.2
×
ssc,0.1%sds中洗涤1次或多次;(3)高严格性杂交条件在6
×
ssc,在约45℃,然后在65℃,在0.2
×
ssc,0.1%sds中洗涤1次或多次且优选;(4)非常高的严格性杂交条件是0.5m磷酸钠,7%sds,在65℃,然后在65℃,在0.2
×
ssc,1%sds中洗涤1次或多次。
52.在实际应用中,可以将本发明的多肽或其药用盐、其衍生物或其药用盐、上述偶合物、上述多聚体和上述组合物作为药物直接给予患者、或者与适宜的载体或赋形剂混合后给予患者。这里的载体材料包括但不限于水溶性载体材料(如聚乙二醇、聚乙烯吡咯烷酮、有机酸等)、难溶性载体材料(如乙基纤维素、胆固醇硬脂酸酯等)、肠溶性载体材料(如醋酸纤维素酞酸酯和羧甲乙纤维素等)。其中优选的是水溶性载体材料。使用这些材料可以制成多种剂型,包括但不限于片剂、胶囊、滴丸、气雾剂、丸剂、粉剂、溶液剂、混悬剂、乳剂、颗粒剂、脂质体、透皮剂、口含片、栓剂、冻干粉针剂等。其中,栓剂可为阴道栓剂,也可以是阴道环,也可以是适于阴道应用的药膏、乳霜或凝胶。所述多肽剂型可以是普通制剂、缓释制剂、控释制剂及各种微粒给药系统。为了将单位给药剂型制成片剂,可以广泛使用本领域公知的各种载体。关于载体的例子是,例如稀释剂与吸收剂,如淀粉、糊精、硫酸钙、乳糖、甘露醇、蔗糖、氯化钠、葡萄糖、尿素、碳酸钙、白陶土、微晶纤维素、硅酸铝等;湿润剂与粘合剂,如水、甘油、聚乙二醇、乙醇、丙醇、淀粉浆、糊精、糖浆、蜂蜜、葡萄糖溶液、阿拉伯胶浆、明胶浆、羧甲基纤维素钠、紫胶、甲基纤维素、磷酸钾、聚乙烯吡咯烷酮等;崩解剂,例如干燥淀粉、海藻酸盐、琼脂粉、褐藻淀粉、碳酸氢钠与枸橼酸、碳酸钙、聚氧乙烯、山梨糖醇脂肪酸酯、十二烷基磺酸钠、甲基纤维素、乙基纤维素等;崩解抑制剂,例如蔗糖、三硬脂酸甘油酯、可可脂、氢化油等;吸收促进剂,例如季铵盐、十二烷基硫酸钠等;润滑剂,例如滑石粉、二氧化硅、玉米淀粉、硬脂酸盐、硼酸、液体石蜡、聚乙二醇等。还可以将片剂进一步制成包衣片,例如糖包衣片、薄膜包衣片、肠溶包衣片,或双层片和多层片。为了将单位给药剂型制成丸剂,可以广泛使用本领域公知的各种载体。关于载体的例子是,例如稀释剂与吸收剂,如葡萄糖、乳糖、淀粉、可可脂、氢化植物油、聚乙烯吡咯烷酮、gelucire、高岭土、滑石粉等;粘合剂如阿拉伯胶、黄蓍胶、明胶、乙醇、蜂蜜、液糖、米糊或面糊等;崩解剂,如琼脂粉、干燥淀粉、海藻酸盐、十二烷基磺酸钠、甲基纤维素、乙基纤维素等。为了将单位给药剂型制成栓剂,可以广泛使用本领域公知的各种载体。关于载体的例子是,例如聚乙二醇、卵磷脂、可可脂、高级醇、高级醇的酯、明胶、半合成甘油酯等。为了将单位给药剂型制成注射用制剂,如溶液剂、乳剂、冻干粉针剂和混悬剂,可以使用本领域常用的所有稀释剂,例如,水、乙醇、聚乙二醇、1,3
‑
丙二醇、乙氧基化的异硬脂醇、多氧化的异硬脂醇、聚氧乙烯山梨醇脂肪酸酯等。另外,为了制备等渗注射液,可以向注射用制剂中添加适量的氯化钠、葡萄糖或甘油,此外,还可以添加常规的助溶剂、缓冲剂、ph调节剂等。此外,如需要,也可以向药物制剂中添加着色剂、防腐剂、香料、矫味剂、甜味剂或其它材料。
53.使用上述剂型可以经注射给药,包括皮下注射、静脉注射、肌肉注射和腹腔注射、
脑池内注射或灌输等;腔道给药,如经直肠、阴道和舌下;呼吸道给药,如经鼻腔;粘膜给药。上述给药途径优选的是注射给药,优选的注射途径是皮下注射。
54.本发明的多肽或其药用盐、其衍生物或其药用盐、上述缀合物、上述多聚体和上述组合物的给药剂量取决于许多因素,例如所要预防或治疗疾病的性质和严重程度,患者或动物的性别、年龄、体重及个体反应,所用的具体活性成分,给药途径及给药次数等。上述剂量可以单一剂量形式或分成几个,例如二、三或四个剂量形式给药。对于任何具体的患者,具体的治疗有效剂量水平须根据多种因素而定,所述因素包括所治疗的障碍和该障碍的严重程度;所采用的具体活性成分的活性;所采用的具体组合物;患者的年龄、体重、一般健康状况、性别和饮食;所采用的具体活性成分的给药时间、给药途径和排泄率;治疗持续时间;与所采用的具体活性成分组合使用或同时使用的药物;及医疗领域公知的类似因素。例如,本领域的做法是,活性成分的剂量从低于为得到所需治疗效果而要求的水平开始,逐渐增加剂量,直到得到所需的效果。
55.本发明所述人源胶原蛋白c1s4t和人源胶原蛋白c1s5t由申请号为201811254050.7、发明名称为“多肽、其生产方法和用途”的专利申请所记载。
56.为更清楚地表述本发明的技术方案,下面结合具体实施例进一步说明,但不能用于限制本发明,此仅是本发明的部分实施例。
57.实施例1:重组i型人源化胶原蛋白tc1r4的制备
58.1.tc1r4基因表达载体的构建
59.本实施例中使用的重组i型人源化胶原蛋白tc1r4全长蛋白序列为seq id no.3所示的氨基酸序列,全长240aa。为了在tc1r4蛋白表达后对其进行纯化,本发明在seq id no.3所示的氨基酸序列的n端连接如seq id no.4所示的氨基酸序列、形成seq id no.5所示的氨基酸序列,其全长为246aa。针对大肠杆菌的密码子对该氨基酸序列对应的编码序列进行了密码子优化,其对应的基因全长738bp(具体参见seq id no.6中带下划线标记的序列)。为了便于后续表达载体的构建,在编码序列的5’端添加酶切位点序列,3’端添加终止密码子序列和酶切位点序列。优化后的基因序列为:ggtaccgaaaacctgtatttccagggtgaaaaaggtagtccgggtgcagatggtccggccggtgcacctggtacaccgggtcctcagggcattgcaggccagcgtggtgttgtgggcctgccgggtcagcgcggtgaacgtggttttccgggtctgccgggtccgagcggcgaacctggtaaacagggcccgagtggtgcaagcggtgaaaaaggcagtccgggcgcagatggtcctgcaggtgcccctggtacacctggtccgcagggtattgcaggtcagcgcggcgtggtgggcctgcctggtcaacgtggcgaacgtggtttcccgggcctgccgggaccgtcaggtgaacctggcaaacagggccctagcggtgcaagtggcgaaaaaggtagcccgggcgcagacggcccggcaggtgcacctggcacacctggtcctcagggtattgcgggccagcgcggcgttgttggtctgcctggccagcgtggcgaacgcggttttccgggcctgcctggcccgtcaggcgaacctggaaaacagggcccaagtggtgcaagtggtgaaaaaggaagtccgggcgccgatggcccggccggtgcgcctggtacgcctggtcctcaaggcattgccggtcagcgcggagttgttggcctgccgggccagcgtggagaacgcggtttcccgggtctgcctggtccgagtggtgaaccgggtaaacagggtccgagcggtgcatcataactcgag(seq id no.6)。
60.委托北京盛元科萌基因生物科技有限公司进行基因片段的合成,并将合成后的tc1r4基因片段通过kpni(neb公司货号:r0136l)和xhoi(neb公司,货号:r0146l)的酶切位点插入pet
‑
32a表达载体(emd biosciences(novagen)公司),得到相应的重组表达质粒。
61.2.重组表达质粒的转化
62.将上述构建成功的表达质粒转化大肠杆菌感受态细胞bl21(de3)(merck公司)。具体过程为:
①
取1μl的该质粒于100μl的大肠杆菌感受态细胞bl21(de3)中,冰上静置30min;
②
将该混合物于42℃水浴锅中热激90s,然后迅速置于冰上静置2min;
③
向该混合物中加入700μl无抗性的lb(10g/l蛋白胨,5g/l酵母提取物,10g/l氯化钠),37℃,220rpm条件下培养1h;
④
取200μl该菌液均匀的涂布在含有氨苄青霉素的lb平板上(10g/l蛋白胨,5g/l酵母提取物,10g/l氯化钠,15g/l琼脂,100μg/ml氨苄青霉素);
⑤
将平板倒置培养于37℃恒温箱中,培养约16h,待长出清晰可见的菌落。
63.3.重组i型人源化胶原蛋白tc1r4的诱导表达
64.从转化好的lb平板中挑取单克隆菌落于1000ml lb(含100μg/ml氨苄抗生素)培养基中37℃,220rpm培养至菌液od
600
在0.9
‑
1.1时,加入终浓度为0.5mm iptg(sigma公司,货号:i5502
‑
1g)进行诱导表达,诱导条件为18℃、220rpm过夜培养。最后离心收集菌体,保存于
‑
20℃或者立即进入下步纯化。
65.4.重组i型人源化胶原蛋白tc1r4的纯化
66.用tris缓冲液(25mm tris,200mm氯化钠,ph 8.0)约100ml重悬(1l)上述菌体沉淀,利用均质机(gea)进行破菌后,17000rpm离心30min,使可溶性蛋白与包涵体充分分离。
67.用5倍柱体积的结合缓冲液(binding buffer)(25mm tris,200mm nacl,ph 8.0)平衡ni6ff(cytiva公司,货号:30210)亲和柱。然后加入蛋白上清,使目的重组蛋白充分结合到柱材上。再用含有20mm咪唑(sigma公司)的洗涤缓冲液(washing buffer)(20mm咪唑,25mm tris,200mm nacl,ph 8.0)漂洗杂蛋白,含有250mm咪唑的溶液(250mm咪唑,25mm tris,200mm nacl,ph 8.0)洗脱目的蛋白。然后加入适量的tev蛋白酶(sigma,t4455),于16℃孵育2h后,收集穿流液,即为去除载体蛋白的目的胶原蛋白。所得产物透析过夜,冻干为干粉待用。
68.5.重组i型人源化胶原蛋白tc1r4的纯度检测
69.所得tc1r4蛋白利用sds
‑
page检测纯度。具体过程为:取纯化后的蛋白液20μl,加入5μl 5
×
的蛋白上样缓冲液(250mm的tris
‑
hcl(ph 6.8),10%sds,0.5%溴酚蓝,50%甘油,5%β
‑
巯基乙醇),置于100℃沸水中煮5min,然后每孔10μl加入sds
‑
page蛋白胶中,电压150v电泳1h后,用考马斯亮蓝染色液(0.1%考马斯亮蓝r
‑
250,25%乙醇,10%冰醋酸)进行蛋白染色3min,再利用蛋白脱色液(10%醋酸,5%乙醇)进行脱色。
70.结果如图1所示,tc1r4通过电泳所得的表观分子量为38kda,分子量对应tc1r4的多肽,表明多肽tc1r4得到正确的表达。
71.实施例2:重组i型人源化胶原蛋白tc1r4的质谱检测
72.按照表1中所示的条件进行tc1r4蛋白的质谱检测。
73.表1质谱检测的条件
74.75.tc1r4蛋白样品经dtt还原和碘代乙酰胺烷基化处理后,加入胰蛋白酶酶解过夜。酶解后得到的肽段再经c18ziptip脱盐后,与基质α
‑
cyano
‑4‑
hydroxycinnamic acid(chca)混合点板。最后用基质辅助激光解析电离
‑
飞行时间质谱仪maldi
‑
tof/tofultraflextremetm,brucker,germany进行分析(肽指纹图谱的技术可以参考:protein j.201635:212
‑
7)。
76.数据库检索是通过从本地mascot网站上peptide mass fingerprint页面处理的。蛋白质鉴定结果是根据酶解后所产生的肽段的一级质谱得到的。检索参数:trypsin酶解,设两个漏切位点。设定半胱氨酸的烷基化为固定修饰,甲硫氨酸的氧化为可变修饰。鉴定所用的数据库为swissprot。
77.质谱检出分子量及对应多肽如表2所示。
78.表2质谱检出分子量及对应多肽
[0079][0080]
相比于多肽的序列:
[0081]
gekgspgadgpagapgtpgpqgiagqrgvvglpgqrgergfpglpgpsgepgkqgpsgasgekgspgadgpagapgtpgpqgiagqrgvvglpgqrgergfpglpgpsgepgkqgpsgasgekgspgadgpagapgtpgpqgiagqrgvvglpgqrgergfpglpgpsgepgkqgpsgasgekgspgadgpagapgtpgpqgiagqrgvvglpgqrgergfpglpgpsgepgkqgpsgas
[0082]
经计算,肽段覆盖率为98.75%,检测结果非常可信。
[0083]
实施例3:重组i型人源化胶原蛋白tc1r4的生物活性检测
[0084]
胶原蛋白的活性检测方法可以参考文献juming yao,satoshi yanagisawa,tetsuo asakura,design,expression and characterization of collagen
‑
like proteins based on the cell adhesive and crosslinking sequences derived from native collagens,j biochem.136,643
‑
649(2004)。具体实施方法如下:
[0085]
(1)利用紫外吸收法检测待测蛋白样品的浓度,包括商品化的人胶原蛋白(sigma,c7774)、本发明提供的重组i型人源化胶原蛋白tc1r4、重组iii型胶原蛋白c1s4t、重组iii型胶原蛋白c1s5t(其中所述蛋白c1s4t、c1s5t的序列参见申请号为201811254050.7的专利申请)。
[0086]
具体为分别测定样品在215nm和225nm下的紫外光吸收,利用经验公式c(μg/ml)=
144
×
(a215
‑
a225)计算蛋白质浓度,注意需在a215<1.5的情况下检测。该方法的原理是:测定肽键在远紫外光下的特征吸收,不受生色团含量的影响,干扰物质少,操作简便,适合检测考马斯亮蓝不显色的人胶原蛋白及其类似物。(参考文献为walker jm.the protein protocols handbook,second edition.humanapress.43
‑
45.)。检测完蛋白浓度后,用pbs将所有待测蛋白浓度调整到0.5mg/ml。
[0087]
(2)向96孔板中加入100μl各种蛋白溶液和空白pbs溶液对照,室温静置60min。
[0088]
(3)每孔中加入105个培养状态良好的3t3细胞(来自清华大学童佩老师),37℃孵育60min。
[0089]
(4)每孔用pbs清洗4次。
[0090]
(5)用ldh检测试剂盒(roche,04744926001)检测od
492nm
的吸光度。根据空白对照的数值,可以计算出细胞的贴壁率。计算公式如下:细胞贴壁率=(测试孔
‑
空白孔)
×
100%/(阳性孔
‑
空白孔)。细胞的贴壁率即可以反应胶原蛋白的活性。蛋白的活性越高,越能在短时间给细胞提供优质的外环境,帮助细胞贴壁。
[0091]
结果如图2所示,从对比中可知,相比于商品化的人胶原蛋白、重组iii型胶原蛋白c1s4t、重组iii型胶原蛋白c1s5t,本发明的重组i型人源化胶原蛋白tc1r4具有更加优秀的生物黏附活性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1