一种双酶偶联合成(S)-香茅醇的方法
一种双酶偶联合成(s)-香茅醇的方法
(一)技术领域
1.本发明属于生物催化领域,涉及一种以橙花醇为底物基于辅酶自循环的(s)-香茅醇合成方法。
(二)
背景技术:
2.香茅醇具有玫瑰香气,是香水的重要配料。(s)-香茅醇的香型不同于(r)-香茅醇,可满足高端香水的配制要求。(s)-香茅醇具有多种生物活性,可以抑制伤寒杆菌及金黄色葡萄杆菌活性。(s)-香茅醇是合成手性化学品的重要中间体,可用于合成全顺式的玫瑰醚、(s)-胡薄荷酮和3(s)-甲基-庚酸等。
3.(s)-香茅醇的化学合成通常以橙花醇、香茅醛、柠檬醛等作为底物,利用化学加氢得到(s)-香茅醇。香茅醛和柠檬醛既有c=c键,也有c=o键,它们的还原在化学选择性和对映体选择性上仍是挑战。橙花醇含有两个c=c键,它的还原合成(s)-香茅醇需要满足严格的位点选择性和对映体选择性。与化学法相比,生物法还原橙花醇、香茅醛、柠檬醛等生成(s)-香茅醇,具有优异的位点选择性、化学选择性和对映体选择性,并且条件温和、绿色环保。然而,由于缺乏高活力的专用酶,目前生物法还达不到实际应用的要求。此外,生物法还原橙花醇、香茅醛或柠檬醛需要配置辅酶循环体系,为了驱动辅酶循环,往往需要添加过量的辅底物,因而降低了原子经济性。
4.为了提高(s)-香茅醇的合成效率,生物催化剂选用了高活力的醇脱氢酶ysadh 和老黄酶nemr-ps。为了提高生物催化合成(s)-香茅醇的原子经济性,反应设计融合了辅酶自循环体系:醇脱氢酶ysadh利用nadp
+
催化橙花醇脱氢生成橙花醛和 nadph,而老黄酶nemr-ps利用nadph还原橙花醛生成(s)-香茅醛,该过程辅酶自循环,不需要辅底物驱动;生成的(s)-香茅醛由醇脱氢酶ysadh进一步还原成光学纯的(s)-香茅醇,所建立的方法具有严格的位点选择性、化学选择性以及对映体选择性。与专利文献(申请号:2020112165477;一种双酶偶联合成(r)-香茅醇的方法) 相比,老黄酶nemr-ps替代老黄酶oye2y-hg,与醇脱氢酶ysadh相偶联催化不同的底物(橙花醇)转化为不同的产物(s)-香茅醇,适应底物浓度达100mm,反应更为高效。与专利文献(申请号:2021108203589;一种三酶共表达重组菌及其在(s)
‑ꢀ
香茅醇合成中的应用)相比,老黄酶nemr-ps与醇脱氢酶ysadh二酶偶联替代老黄酶nemr-ps、醇脱氢酶ysadh和葡萄糖脱氢酶bmgdh
m6
三酶偶联,利用不同的底物获得了相同的产物(s)-香茅醇;反应不需要辅底物葡萄糖,提高了反应的原子经济性。
(三)
技术实现要素:
5.本发明目的是提供一种双酶偶联合成(s)-香茅醇的方法,以橙花醇为底物基于辅酶自循环的(s)-香茅醇合成方法,醇脱氢酶ysadh利用nadp
+
催化橙花醇脱氢生成橙花醛和nadph,而老黄酶nemr-ps利用nadph还原橙花醛生成(s)-香茅醛,该过程辅酶自循环,不需要辅底物驱动;(s)-香茅醛在醇脱氢酶ysadh催化下进一步还原生成光学纯的(s)-香茅醇。该方法原子经济性高,具有优越的位点选择性、化学选择性和对映体选择性。
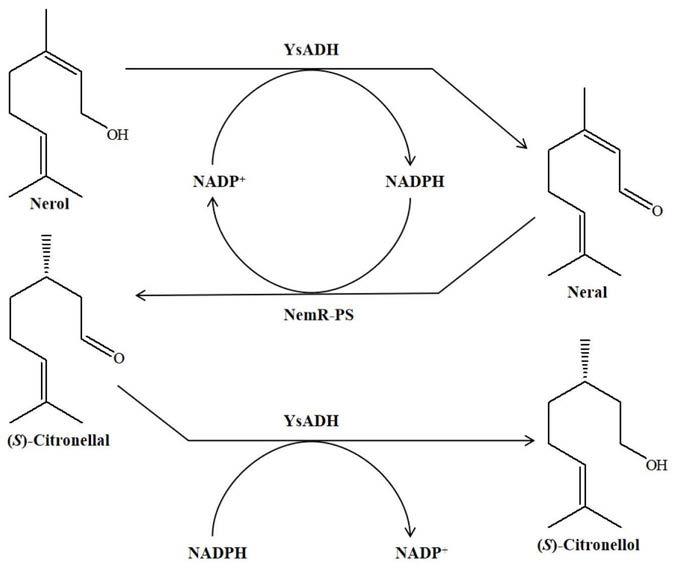
6.本发明采用的技术方案是:
7.本发明提供一种双酶偶联合成(s)-香茅醇的方法,所述方法为:以含醇脱氢酶 ysadh基因的工程菌和含老黄酶nemr-ps基因的工程菌各自经发酵培养获得的湿菌体混合后作为催化剂,以橙花醇为底物,以nadp
+
为辅酶,以ph 6-9缓冲液为反应介质构成反应体系,在25-55℃、0-900rpm条件下反应完全后,反应液分离纯化,最终获得(s)-香茅醇。
8.进一步,所述醇脱氢酶ysadh基因来源于约克氏菌(yokenella sp.wzy002),氨基酸序列为seq id no.1所示,核苷酸序列为seq id no.2所示。所述约克氏菌 (yokenella sp.wzy002)保藏于中国典型培养物保藏中心,地址:中国武汉,武汉大学,邮编:430072,保藏编号:cctcc no:m2013099,保藏日期:2013年3月22 日,已在专利申请cn201310188883.9中公开。
9.进一步,所述含醇脱氢酶ysadh基因的工程菌是将醇脱氢酶ysadh基因导入大肠杆菌构建获得的;具体为:将seq id no.2所示醇脱氢酶ysadh编码基因插入 pet28b载体的nco i和hind iii限制性酶切位点,得到重组载体pet28b-ysadh;将重组载体pet28b-ysadh导入宿主细胞e.coli bl21(de3),得到重组基因工程菌e. coli bl21(de3)/pet28b-ysadh。
10.进一步,所述老黄酶nemr-ps基因来源于斯氏普罗威登斯菌(providencia stuartii; department of infectious diseases,national institute of health dr.ricardo jorge,lisbon, portugal),其氨基酸序列如seq id no.3所示,核苷酸序列如seq id no.4所示。
11.进一步,所述含老黄酶nemr-ps基因的工程菌是将老黄酶nemr-ps基因导入大肠杆菌构建获得的;具体为:将seq id no.4所示老黄酶nemr-ps编码基因插入 pet28b载体的nco i和xho i限制性酶切位点,得到重组载体pet28b-nemr-ps;将重组载体pet28b-nemr-ps导入宿主细胞e.coli bl21(de3),得到基因工程菌e.colibl21(de3)/pet28b-nemr-ps。
12.进一步,所述含醇脱氢酶ysadh基因的工程菌的湿菌体与含老黄酶nemr-ps 基因的工程菌的湿菌体以质量比0.25-4:1混合,优选为2:1。所述催化剂加入量以湿菌体总量计为100-200g/l,优选120g/l。
13.进一步,底物橙花醇用乙醇为溶剂预先配成1m橙花醇溶液,再根据反应体系中底物终浓度酌量添加,所述底物橙花醇加入终浓度为10-100mm,优选为100mm;所述辅酶nadp
+
加入终浓度为0-1.0mm,优选为0.6mm。
14.进一步,所述反应时间为2-12h,优选反应条件为40℃、600rpm下反应12h。
15.进一步,所述缓冲液优选为ph 7.5的50mm tris-hcl缓冲液。
16.进一步,所述含醇脱氢酶ysadh基因工程菌的湿菌体按如下方法制备:将含醇脱氢酶ysadh基因的工程菌(优选e.coli bl21(de3)/pet28b-ysadh)接种于含有终浓度100μg/ml卡那霉素的lb液体培养基中,在37℃和200rpm下培养过夜,然后以体积浓度2%的接种量转接于含有100μg/ml卡那霉素的lb液体培养基中,在 37℃和200rpm培养至菌体浓度od
600
至0.6~0.8,向培养物中加入终浓度0.2mm的 iptg,在21℃下诱导培养12h,获得诱导培养液;再将诱导培养液于4℃和8000rpm 下离心10min,弃去上清液;然后用ph 8.0、50mm tris-hcl缓冲液重悬菌体,于4℃和8000rpm下离心10min,弃去上清液,收集湿菌体。
17.进一步,所述含老黄酶nemr-ps基因工程菌的湿菌体按如下方法制备:将含老黄酶
nemr-ps基因的工程菌(优选e.coli bl21(de3)/pet28b-nemr-ps)接种于含有终浓度100μg/ml卡那霉素的lb液体培养基中,在37℃和200rpm下培养过夜,以体积浓度2%的接种量转接于终浓度100μg/ml卡那霉素的lb液体培养基中,在37℃和200rpm培养至菌体浓度od
600
至0.6~0.8,向培养物中加入终浓度0.2mm的iptg,在24℃下诱导培养12h,获得诱导培养液;再将诱导培养液于4℃和8000rpm下离心10min,弃去上清液;然后用ph 8.0、50mm tris-hcl缓冲液重悬菌体,于4℃和 8000rpm下离心10min,弃去上清液,收集湿菌体。
18.进一步,所述反应液分离纯化方法为:反应液在12000rpm下离心2min,取上清,加入4倍反应液体积的乙酸乙酯,在200rpm和30℃条件下萃取1h,萃取结束后,在12000rpm下离心1min,取上层有机相,经减压蒸馏去除乙酸乙酯,最终获得(s)-香茅醇。
19.与现有技术相比,本发明的有益效果主要体现在:本发明提供了一种以橙花醇为底物基于辅酶自循环的(s)-香茅醇合成方法,在辅酶自循环中,醇脱氢酶ysadh利用nadp
+
催化橙花醇脱氢生成橙花醛和nadph,而老黄酶nemr-ps利用nadph 还原橙花醛生成(s)-香茅醛,该过程辅酶循环不需要辅底物驱动(图1)。当以100mm 橙花醇为底物时,经12h反应后产物(s)-香茅醇的得率高达99.74%,产物e.e.值》99%。与现有技术相比,所建立的(s)-香茅醇合成方法绿色高效,原子经济性高,具有优越的位点选择性、化学选择性和对映体选择性。
(四)附图说明
20.图1为以橙花醇为底物基于辅酶自循环的(s)-香茅醇合成方法示意图。
21.图2为实施例1工程菌诱导前后上清液的sds-page胶图;从左到右,泳道m, blue plus ii protein marker;泳道1,未经诱导基因工程菌e.colibl21(de3)/pet28b-ysadh;泳道2,诱导后的基因工程菌e.colibl21(de3)/pet28b-ysadh,加粗条带对应为ysadh,其分子量大小为37kda;泳道3,未经诱导基因工程菌e.coli bl21(de3)/pet28b-nemr-ps;泳道4,诱导后的基因工程菌e.coli bl21(de3)/pet28b-nemr-ps,加粗条带对应为nemr-ps,分子量大小为39kda。
22.图3为bca法测蛋白质浓度的标准曲线。
23.图4为气相色谱图;a,标样(s)-香茅醛(20.128min)和(r)-香茅醛(21.098min);b,标样(s)-香茅醛(20.128min),橙花醇(27.208min),香茅醇(27.480min),香叶醇(28.419 min),橙花醛(29.890min)和香叶醛(28.842min);c,(s)-香茅醇(95.481min)和(r)-香茅醇(96.249min);d,反应液中萃取获得的(s)-香茅醇(95.481min)。
24.图5为以橙花醇为底物基于辅酶自循环合成(s)-香茅醇的最适催化温度。
25.图6为以橙花醇为底物基于辅酶自循环合成(s)-香茅醇的最适催化ph。
26.图7为以橙花醇为底物基于辅酶自循环合成(s)-香茅醇的最适辅酶nadp
+
添加量。
27.图8为以橙花醇为底物基于辅酶自循环合成(s)-香茅醇的最适搅拌速度。
28.图9为以橙花醇为底物基于辅酶自循环合成(s)-香茅醇的醇脱氢酶ysadh和老黄酶nemr-ps最适质量比。
29.图10为基于辅酶自循环合成(s)-香茅醇时不同底物浓度下的反应进程。
30.图11为底物橙花醇(a)和产物香茅醇(b)的气相-质谱联用(gc-ms)谱图。
31.图12为产物香茅醇的1h(a)和
13
c(b)的核磁共振(nmr)谱图。
(五)具体实施方式
32.下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
33.lb液体培养基组成(1l):胰化蛋白胨10g,酵母提取物5g,nacl 10g。用1 m的naoh调节ph值到7.0~7.5,定容至1l。在121℃高压灭菌20min,4℃储存。
34.实施例1:表达醇脱氢酶ysadh、老黄酶nemr-ps的湿菌体、粗酶液制备
35.1、醇脱氢酶ysadh基因工程菌的构建
36.人工合成已公开的来源于约克氏菌(yokenella sp.wzy002;保藏于中国典型培养物保藏中心,地址:中国武汉,武汉大学,邮编:430072,保藏编号:cctcc no: m2013099,保藏日期:2013年3月22日,已在专利申请cn201310188883.9中公开) 的醇脱氢酶ysadh编码基因,其氨基酸序列和核苷酸序列分别如seq id no.1和 seq id no.2所示。
37.基因工程菌e.coli bl21(de3)/pet-28b-ysadh的构建:将seq id no.2所示醇脱氢酶ysadh编码基因插入pet28b载体的nco i和hind iii限制性酶切位点,得到重组载体pet28b-ysadh;将重组载体pet-28b-ysadh导入宿主细胞e.colibl21(de3),得到基因工程菌e.coli bl21(de3)/pet28b-ysadh。
38.2、老黄酶nemr-ps基因工程菌的构建
39.人工合成已公开的来源于斯氏普罗威登斯菌(providencia stuartii;department ofinfectious diseases,national institute of health dr.ricardo jorge,lisbon,portugal)的老黄酶nemr-ps的编码基因,其氨基酸序列和核苷酸序列分别如seq id no.3和 seq id no.4所示。
40.基因工程菌e.coli bl21(de3)/pet28b-nemr-ps的构建:将seq id no.4所示老黄酶nemr-ps编码基因插入插入pet28b载体的nco i和xho i限制性酶切位点,得到重组载体pet28b-nemr-ps;将重组载体pet-28b-nemr-ps导入宿主细胞e.colibl21(de3),得到基因工程菌e.coli bl21(de3)/pet28b-nemr-ps。
41.3、表达醇脱氢酶ysadh与老黄酶nemr-ps的湿菌体制备
42.湿菌体e.coli bl21(de3)/pet28b-ysadh按如下方法制备:将基因工程菌e.coli bl21(de3)/pet28b-ysadh接种于含有终浓度100μg/ml卡那霉素的lb液体培养基中,在37℃、200rpm下培养过夜,然后以体积浓度2%的接种量转接于含有100μg/ml 卡那霉素的lb液体培养基中,在37℃、200rpm培养至菌体浓度od
600
至0.6~0.8,向培养物中加入终浓度0.2mm的iptg,在21℃下诱导培养12h,获得诱导培养液。同样条件下,以不添加iptg的培养液为未诱导对照培养液。再将诱导培养液于4℃、 8000rpm下离心10min,弃去上清液;然后用ph 8.0、50mm tris-hcl缓冲液重悬菌体,于4℃和8000rpm下离心10min,弃去上清液,收集湿菌体作为生物催化剂,于
ꢀ‑
80℃条件下保存备用。
43.湿菌体e.coli bl21(de3)/pet28b-nemr-ps按如下方法制备:将基因工程菌e. coli bl21(de3)/pet28b-nemr-ps接种于含有终浓度100μg/ml卡那霉素的lb液体培养基中,在37℃、200rpm下培养过夜,然后以体积浓度2%的接种量转接于含有100 μg/ml卡那霉素的lb液体培养基中,在37℃、200rpm培养至菌体浓度od
600
至0.6~ 0.8,向培养物中加入终浓度0.2mm的iptg,在24℃下诱导培养12h,获得诱导培养液。同样条件下,以不添加iptg的培养液为未诱导对照培养液。再将诱导培养液于4℃、8000rpm下离心10min,弃去上清液;
然后用ph 8.0、50mm tris-hcl缓冲液重悬菌体,于4℃和8000rpm下离心10min,弃去上清液,收集湿菌体作为生物催化剂,于-80℃条件下保存备用。
44.sds-page检测样品的制备:取未诱导对照培养液和诱导培养液各1ml,在12000 rpm离心1min,弃去上清,留取菌体。菌体随后各加入100μl超纯水,将菌重悬成菌悬液。之后,各取20μl菌悬液,加入4μl 6x protein loading buffer混匀后,煮沸 10min。煮沸结束后,12000rpm离心1min,各取15μl上清液用于sds-page检测,蛋白质marker为blueplus protein marker(14-120kda)。如图2所示,sds-page检测表明,醇脱氢酶ysadh与老黄酶nemr-ps均在大肠杆菌中成功表达。
45.4、醇脱氢酶ysadh、老黄酶nemr-ps的粗酶液制备
46.将每1g步骤3离心收集的湿菌体中加入20ml的50mm tris-hcl缓冲液(ph 8.0),用玻璃棒搅拌成菌悬液,在冰浴(0℃)条件下超声破碎10min,超声工作1s,间歇2s,超声功率250w。经超声破碎后的菌悬液在8000rpm、4℃下离心10min,所得到的上清液即为粗酶液,放在4℃保存备用。
47.5、醇脱氢酶ysadh和老黄酶nemr-ps的体积比活力测定
48.醇脱氢酶ysadh的酶活力采用分光光度计的单因素动力学方法测定nadph在340nm处吸光值的变化来计算酶活。酶活检测体系为:20mm香叶醇,0.4mm nadp
+
, 50μl粗酶液,加50mm tris-hcl(ph 8.0)补足1ml。酶活力单位(u)定义:在45℃下,每分钟还原1μmol的nadp
+
所需的酶量。每次做三组平行实验,计算平均值和标准误差。醇脱氢酶(adh)的体积酶活力计算如公式1。
49.老黄酶nemr-ps的酶活力采用分光光度计的单因素动力学方法测定nadph在 340nm处吸光值的变化来计算酶活。酶活检测体系为:20mm柠檬醛,0.4mmnadph,50μl粗酶液,加入kh2po4缓冲液(ph 7.0)补足1ml。酶活力单位(u) 定义:在30℃下,每分钟消耗1μmol nadph所需的酶量。每次做三组平行实验,计算平均值和标准误差。老黄酶体积酶活力计算如公式1。
50.公式1:
51.d:稀释倍数,为1;a1:样品吸光度;a2:空白对照吸光度;v
t
:反应总体系,为1ml。
52.e:摩尔吸光系数,为常数6220;vs:酶液体积,为0.05ml;d:比色皿直径,为1cm。
53.经酶活力测定,醇脱氢酶ysadh粗酶液体积比酶活为5.07u/ml;老黄酶 nemr-ps体积比酶活为1.50u/ml。
54.6、醇脱氢酶ysadh和老黄酶nemr-ps粗酶液的蛋白浓度测定
55.根据bca法蛋白质浓度测定试剂盒绘制蛋白浓度标准曲线,以蛋白含量为横坐标,吸光值为纵坐标,绘制标准曲线,如图3所示,测得的线性关系公式为y= 0.4478x+0.20925,其中y为562nm处的吸光度值,x为bsa溶液蛋白浓度(mg/ml),标准偏差为r2=0.99056。
56.在利用bca法蛋白质浓度测定试剂盒测量醇脱氢酶ysadh与老黄酶nemr-ps 时,每次做三组平行实验,计算平均值和标准误差。经测定,醇脱氢酶ysadh粗酶液的蛋白质浓度为7.57mg/ml;老黄酶nemr-ps粗酶液的蛋白质浓度为8.82mg/ml。
57.7、比酶活
58.体积酶活与蛋白质浓度的比值,即可得出相应的比酶活。经计算醇脱氢酶ysadh 粗酶液的比酶活为0.67u/mg,老黄酶nemr-ps粗酶液的比酶活为0.17u/mg。
59.实施例2:以橙花醇为底物基于辅酶自循环合成(s)-香茅醇的初始反应体系构建
60.实施例1步骤3制备的醇脱氢酶ysadh湿菌体与老黄酶nemr-ps湿菌体按一定比例于缓冲液(50mm tris-hcl)中混合为催化剂,以橙花醇为底物,加入辅酶 nadp
+
,构成10ml的反应总体系。底物橙花醇用乙醇为溶剂预先配成1m溶液,再根据反应体系中底物终浓度酌量添加。
61.初始未进行条件优化的反应体系如下:底物橙花醇终浓度60mm、辅酶nadp
+
终浓度0.4mm,湿菌体终浓度120g/l(其中醇脱氢酶ysadh湿菌体与老黄酶 nemr-ps湿菌体按质量比1:1的比例混合),加入ph 8.0的50mm tris-hcl缓冲液中,在ph 8.0、200rpm和30℃下反应4h。同样条件下,以不加催化剂为空白对照。
62.反应结束后取300μl反应液于12000rpm离心3min,取200μl上清加入800μl 乙酸乙酯萃取30min。萃取结束后,在12000rpm下离心1min,取上层有机相600μl 加入0.8g无水硫酸钠,然后在12000rpm下再离心1min,取100μl上清液,补加乙酸乙酯至终体积0.5ml,利用气相色谱法检测样品中各成分的含量。每次做三组平行实验,计算平均值和标准误差。
63.气相色谱条件如下:气相色谱仪,agilent 6890n;手性色谱柱,bgb-174(柱长 30m,柱内径250μm,固定液涂层厚0.25μm);检测器,fid,250℃;载气,n2;载气流量,2.27ml/min;分流比:1:19;进样量:1.0μl;进样口温度:250℃。
64.底物、可能的中间产物和产物升温程序:90℃保持25min,以20℃/min升温至 160℃,保持2min,随后以20℃/min升温至180℃,保持3min,共34.50min。结果如图4中a和b所示,底物(橙花醇、香叶醇)、可能的中间产物((s)-香茅醛,(r)
‑ꢀ
香茅醛,橙花醛,香叶醛)和产物(香茅醇)的保留时间分别如下:(s)-香茅醛,20.128 min;(r)-香茅醛,21.098min;橙花醇,27.208min;香茅醇,27.480min;香叶醇, 28.419min;橙花醛,29.890min;香叶醛,28.842min。
65.(s)-香茅醇和(r)-香茅醇的分析采用特定的升温程序:75℃保持30min,以 0.4℃/min升温至120℃,保持10min,随后以20℃/min升温至180℃,保持3min,共158.50min。如图4中c所示,(s)-香茅醇和(r)-香茅醇的保留时间分别为95.481min 和96.249min。在所有的后续反应中,反应液中萃取获得的产物构型均如图4中d所示,为光学纯(s)-香茅醇。
66.实施例3:以橙花醇为底物基于辅酶自循环合成(s)-香茅醇的最适温度
67.选取25℃、30℃、35℃、40℃、45℃、50℃和55℃,其他操作及反应条件同实施例2。每次做三组平行实验,计算平均值和标准误差,结果如图5所示。在25℃时, (s)-香茅醇的转化率为43.75%;当催化温度为40℃时,转化率已达到72.39%。当温度升高至45和50℃时,转化率降至65.78%和55.27%。综上,最佳反应温度为40℃。
68.实施例4:以橙花醇为底物基于辅酶自循环合成(s)-香茅醇的最适催化ph
69.将反应体系的ph设为6.0、6.5、7.0、7.5、8.0、8.5和9.0,反应温度为40℃。其他操作及反应条件同实施例2。每次做三组平行实验,计算平均值和标准误差。结果如图6所示,当ph为6.0时,(s)-香茅醇的转化率为42.95%。当ph偏中性或弱碱性时,转化率也较高,当ph为7.5时,转化率高达67.38%。当ph 8.0和ph 9.0时,转化率分别为55.94%和40.39%。由此可见,最适的反应ph为7.5。
tris-hcl缓冲液,反应体系为10ml,转速为600rpm,反应温度为 40℃,反应时长为12h。反应结束后,反应液在12000rpm下离心2min,取上清,加入4倍反应液体积的乙酸乙酯,在200rpm和30℃条件下萃取1h,萃取结束后,在12000rpm下离心1min,取上层有机相。由于反应转化率》99%,几乎没有底物和中间产物残留,上层有机相经减压蒸馏去除乙酸乙酯,直接获得产物。产物经手性气相色谱分析,为光学纯的(s)-香茅醇。产物经进一步的1h和
13
c核磁共振分析,所得的结构信息也与香茅醇相符(图12中a和b)。产物1h nmr(600mhz,溶剂氘代氯仿) 的化学位移信息:δ5.08(dddd,j=8.6,5.8,2.7,1.3hz,1h),3.71
–
3.60(m,2h), 1.99
–
1.90(m,2h),1.66(d,j=1.6hz,3h),1.62
–
1.58(m,3h),1.58
–
1.52(m,2h), 1.40
–
1.29(m,2h),1.16(dddd,j=13.4,9.5,7.7,5.8hz,1h),0.89(d,j=6.6hz,3h)。产物
13
c nmr(151mhz,溶剂氘代氯仿)的化学位移信息:δ131.23,124.70,61.11,39.87, 37.21,29.17,25.70,25.45,19.51,17.62。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1