产生促性腺激素的方法与流程
产生促性腺激素的方法
1.本技术是申请日为2016年4月22日、发明名称为“产生促性腺激素 的方法”的中国专利申请no.201680022637.8的分案申请。
2.本发明涉及用于治疗不育的促性腺激素。具体地,其涉及人绒毛膜促 性腺激素(human chorionic gonadotrophin,hcg)。
3.促性腺激素是一组异二聚体糖蛋白激素,其调节男性和女性中的性腺 功能。它们包括促卵泡激素(follicle stimulating hormone,fsh),促黄体 激素(luteinising hormone,lh)和绒毛膜促性腺激素(chorionicgonadotrophin,cg)。
4.人绒毛膜促性腺激素(hcg)主要由妊娠过程中的人胎盘分泌,并且支 持黄体的维持。hcg包含92个氨基酸的α亚基(α链)(其也是其他糖蛋 白激素lh和fsh共有的)和hcg特有的145个氨基酸的β亚基(β链), 所述β亚基指示激素特异性。每个亚基通过添加复杂的糖残基进行翻译 后修饰。α亚基包含在氨基酸52和78的2-n-连接的糖基化位点,β亚基 包含在氨基酸13和30的2-n-糖基化位点和在氨基酸121、127、132和 138的四个o-连接的糖基化位点。
5.从妊娠妇女的尿提取的hcg[choragon(ferring)]已经在不育治疗中 使用多年。从尿提取的hcg的制备包括大量尿液的收集和处理。重组形 式的hcg,即ovitrelle(serono)也可用于不育治疗。该重组产物在中国仓 鼠卵巢(cho)细胞中表达,并且具有与从人尿中产生的hcg不同的药 代动力学模式(pharmacokinetic profile)。
[0006]
存在与hcg制剂相关的相当大的异质性,其涉及在存在的各种同种 型的量上的不同。单独的hcg同种型显示相同的氨基酸序列,但是在它 们翻译后修饰的程度上不同;特定的同种型特征为糖分枝结构的异质性以 及唾液酸(末端糖)结合量的不同,这两者都显示影响具体的同种型生物活 性。
[0007]
重组hcg(“rhcg”)产品的糖基化反映在宿主细胞系中存在的糖基 转移酶范围。现有的rhcg产品ovitrelle源自改造的中国仓鼠卵巢细胞 (cho细胞)。在cho来源的rhcg中的聚糖修饰范围比在源自尿液的天 然产物中发现的那些更有限。在cho来源的rhcg中发现的减少的聚糖 异质性的例子包括缺少平分型葡糖胺和降低含量的核心岩藻糖基化和乙 酰基乳糖胺延伸。此外,cho细胞仅能够使用α2,3连接加入唾液酸 (kagawa等人,1988,takeuchi等人,1988,svensson等人,1990)。
[0008]
迄今已经用于不育治疗的人尿hcg(即,从妊娠妇女的尿提取的 hcg)实际上是胎盘hcg;在(人)胎盘中产生然后在尿中排出的hcg。 该hcg从尿中提取,用作药物产品。bousfield等人(rev endocr metabdisord(2011)12:289-302)阐述“尽管垂体促性腺激素具有α2,3-和α2,6-连 接的唾液酸二者,但是胎盘hcg和在中国仓鼠卵巢细胞中产生的重组促 性腺激素仅具有α2,3-连接的唾液酸”。因此,人尿hcg(也在胎盘中产生) 仅包含α2,3-唾液酸化(如同cho细胞系来源的重组产物)。因此,已知 的包含hcg的药物组合物仅包含α2,3-连接的唾液酸,而不包含α2,6-连 接的唾液酸。
[0009]
已经证明当与垂体、血清或绝经期后尿液fsh比较时,重组fsh制 剂(organon)在具有低于4的等电点(pi)的fsh(被认为是酸性同种型)的量 上不同(ulloa-aguirre等人
.1995)。与重组产物gonal-f(serono)和puregon (organon)比较,在fsh尿制备物中的酸性同种型的量高得多(andersen 等人.2004)。这必定反映在rfsh中更低摩尔含量的唾液酸,因为在fsh 中用硫酸盐修饰的带负电荷的聚糖的含量低。与天然fsh比较,更低的 唾液酸含量是两种商购fsh产品的特征,并且因此必定反映制备方法中 的限制(bassett和driebergen,2005)。已经关于来自多种来源的物质记载 了fsh的循环寿命。这些物质中的一些已经基于总分子电荷进行分离, 总分子电荷如通过它们的pi表征,其中更多的酸等同于更高的负电荷。 对于总分子电荷的主要贡献者是各fsh分子的总唾液酸含量。例如,rfsh (organon)具有约8mol/mol的唾液酸含量,而尿来源的fsh具有更高的 唾液酸含量(de leeuw等人.1996)。在大鼠中的相应血浆清除率是0.34和 0.14ml/min(ulloa-aguirre等人.2003)。在另一个实例中,其中将重组fsh 样品分为高和低pi级分,高pi(更低唾液酸含量)级分的体内功效减少并 且其具有更短的血浆半衰期(d’antonio等人.1999)。本技术人已经发现, 与fsh类似,已知的来源于cho的重组hcg产物(例如,ovitrelle)也 具有比尿hcg更低量的具有低于4的等电点(pi)的hcg(认为是酸性 同种型),这也反映已知的rhcg产品比尿hcg更低的唾液酸含量。
[0010]
申请人已经开发了人来源的重组hcg(即,在人细胞系中产生或表 达的重组hcg,例如,通过改造人细胞系产生),其具有比cho细胞系 来源的rhcg产物ovitrelle更加酸性的模式,并且其具有更高的唾液酸含 量。该rhcg是国际专利申请号pct/gb2010/001854(以wo 2011/042688 公开)的主题。具有α2,3和α2,6-连接的唾液酸二者的混合物的重组hcg 通过改造人细胞系使其表达rhcg和α2,3唾液酸转移酶二者而制备。该表 达的产物是高度酸性的,具有例如19.1mol/mol的唾液酸含量[以唾液酸 摩尔数与蛋白摩尔数的比例表示],并且携带α2,3-和α2,6-连接的唾液酸 二者的混合物;后者由内源性唾液酸转移酶活性提供。申请人的研究表明, 唾液酸连接的类型,α2,3-或α2,6-,可以具有对hcg的生物清除的巨大影 响。与cho细胞系相反,人细胞系可以表达具有通过α2,3和α2,6连接 两者连接的唾液酸的重组hcg。
[0011]
wo 2011/042688的细胞系良好地表达人来源的重组hcg。然而,该 细胞系也表达相对高水平的游离β链(游离β亚基),并且需要纯化(以 从产物hcg中去除该游离的β链)。
[0012]
申请人现在已经开发了表达rhcg和α2,3唾液酸转移酶二者的新细胞 系,并且其产生具有减少量的游离β链的rhcg,由此提高产率并且减少 需要的产物纯化的水平(见图7)。
[0013]
按照本发明,提供一种细胞(例如,宿主细胞),其特征在于,其包 含整合在其基因组中的编码hcg的α链的(核酸)序列,所述序列选自: seq id no:1所示的序列;与seq id no:1的序列具有至少96.5%同源 性的序列(例如,与seq id no:1的序列具有至少96.5%序列同一性的 序列);与seq id no:1的序列具有至少97%同源性(例如,至少98% 或至少99%同源性)的序列(例如,与seq id no:1的序列具有至少97% 序列同一性(例如,至少98%或至少99%序列同一性)的序列);seq idno.4所示的序列;与seq id no:4的序列具有至少96.5%同源性的序列(例如,与seq id no:4的序列具有至少96.5%序列同一性的序列);与 seq id no:4的序列具有至少97%同源性(例如,至少98%或至少99% 同源性)的序列(例如,与seq id no:4的序列具有至少97%序列同一 性(例如,至少98%或至少99%序列同一性)的序列)。优选地,编码hcg 的α链的(核酸)序列不是以ah007338登记的序列
(即,优选地,编码 hcg的α链的(核酸)序列不是seq id no:5所示的序列)。所述细胞可 以进一步包含整合在其基因组中的编码α-2,3-唾液酸转移酶的cdna,例 如,seq id no:3所述的序列。所述细胞可以进一步包含整合在其基因 组中的编码hcg的β链的(核酸)序列,例如,seq id no:2所述的序列。
[0014]
例如,宿主细胞可以是细胞,ht1080细胞,gt-5s细胞等。 优选地,所述细胞是细胞,诸如以ecacc no.96022940保藏的细胞。
[0015]
按照本发明,提供细胞,诸如以ecacc no.96022940保藏 的细胞,其特征在于其进一步包含整合在其基因组中的编码 hcg的α链的(核酸)序列。编码hcg的α链的(核酸)序列可以选自:seqid no:1所示的序列;与seq id no:1的序列具有至少90%同源性的序 列(例如,与seq id no:1的序列具有至少90%序列同一性的序列);与 seq id no:1的序列具有至少97%同源性(例如,至少98%或至少99% 同源性)的序列(例如,与seq id no:1的序列具有至少97%序列同一 性(例如,至少98%或至少99%序列同一性)的序列);seq id no.4所 示的序列;与seq id no:4的序列具有至少90%同源性的序列(例如, 与seq id no:4的序列具有至少90%序列同一性的序列);以及与seq idno:4的序列具有至少97%同源性(例如,至少98%或至少99%同源性) 的序列(例如,与seq id no:4的序列具有至少97%序列同一性(例如, 至少98%或至少99%序列同一性)的序列)。优选地,编码hcg的α链 的(核酸)序列不是以ah007338登记的序列。所述细胞进一步包含整合 在其基因组内的编码α-2,3-唾液酸转移酶的cdna,例如seq id no:3 所述的序列。所述细胞可以进一步包含整合在其基因组中的编码hcg的 β链的(核酸)序列,例如seq id no:2所述的序列。
[0016]
应该理解,术语“编码hcg的α链的序列”或“编码hcg的α链的(核酸)序列”用在本文中还指编码fsh的α链的序列(或编码lh的α链 的序列),原因在于hcg的α链与fsh(和lh)的α链相同。
[0017]
术语“核酸序列”在本文中涉及编码多肽(如肽、蛋白等)的任意核 酸分子。这些核酸分子可以由dna、rna或其类似物制成。然而,优选 由dna制成的核酸分子。
[0018]
本领域技术人员清楚知晓,起始核苷酸序列的修饰描述关于密码子使 用优化的过程。通过比较修饰的序列与所述起始序列,可以容易地鉴定引 入的变化。并且,这两个序列(即,起始序列和优化的序列)将编码相同 的氨基酸序列。
[0019]
人hcg的α-链的氨基酸序列公开在wo2011/042688中(在该文献中 称为seq id1),并且记述在fiddes和goodman 1979中。其以ah007388 登记,并且在下文中显示为seq id no.5。人hcg的β-链的氨基酸序列 以seq id no.2显示,并且以np_000728登记。这些氨基酸序列对应于 人hcg的α-链和β-链的野生型氨基酸序列。术语“野生型核酸序列”或
ꢀ“
起始核酸序列”用于本发明时涉及旨在用于在宿主细胞中(过)表达并 且在该宿主细胞中不适合密码子应用的核酸序列,而是实际的编码所述蛋 白的野生型核酸序列。术语“优化的核酸序列”用于本发明时涉及通过改 变未修饰的/起始核酸序列的序列而修饰以用于在宿主细胞中表达的序 列。优化的核酸序列编码与由未修饰的序列编码的蛋白相同的氨基酸序 列。申请人已经研发了编码hcg的α-链的优化序列(例如,参见seq idno.1和4,图1)。
[0020]
按照本发明,在另一方面,提供一种多核苷酸序列(例如,编码hcg 的α链的多核苷酸序列),其包含选自下述的序列:seq id no:1所示的 核酸序列;seq id no:4所述的核酸
序列;与seq id no:1的核酸具有 至少97%同源性(例如,至少98%或至少99%同源性)的核酸序列(例 如,与seq id no:1的核酸具有至少97%序列同一性(例如,至少98% 或至少99%序列同一性)的核酸序列);以及与seq id no:4的核酸具有 至少97%同源性(例如,至少98%或至少99%同源性)的核酸序列(例 如,与seq id no:4的核酸具有至少97%序列同一性(例如,至少98% 或至少99%序列同一性)的核酸序列)。
[0021]
按照本发明,在另一方面,提供一种在细胞中产生重组hcg的方法, 所述方法包括在适当的培养基中培养所述细胞,并且从所述细胞和/或所 述培养基收集重组蛋白(hcg)(例如,从细胞培养物上清收集重组hcg), 其中所述细胞(宿主细胞)包含整合在其基因组中的编码hcg的α链的(核 酸)序列,所述序列选自:seq id no:1所示的序列;与seq id no:1的 序列具有至少90%同源性的序列(例如,与seq id no:1的序列具有至 少90%序列同一性的序列);与seq id no:1的序列具有至少97%同源 性(例如,至少98%或至少99%同源性)的序列(例如,与seq id no:1 的序列具有至少97%序列同一性(例如,至少98%或至少99%序列同一 性)的序列);seq id no.4所示的序列;与seq id no:4的序列具有至 少90%同源性的序列(例如,与seq id no:4的序列具有至少90%序列 同一性的序列);以及与seq id no:4的序列具有至少97%同源性(例如, 至少98%或至少99%同源性)的序列(例如,与seq id no:4的序列具 有至少97%序列同一性(例如,至少98%或至少99%序列同一性)的序 列)。优选地,所述编码hcg的α链的(核酸)序列不是以ah007338登记 的序列。所述细胞可以进一步包含整合在其基因组中的编码α-2,3-唾液酸 转移酶的cdna,例如seq id no:3所述的序列。所述细胞可以进一步 包含整合在其基因组中的编码hcg的β链的(核酸)序列,例如seq idno:2所述的序列。所述方法可以包括纯化从所述细胞和/或所述培养基得 到的重组hcg(例如,从细胞培养物上清纯化重组hcg)的另外的一个 或多个步骤。
[0022]
例如,(宿主)细胞可以是细胞,ht1080细胞,gt-5s细 胞等。优选地,所述细胞是细胞,诸如以ecacc no.96022940 保藏的细胞。
[0023]
按照本发明,在另一方面,提供一种在细胞中产生重组hcg的方法, 所述方法包括在适当的培养基中培养所述细胞,并且从所述细胞和/或所 述培养基收集重组蛋白(hcg)(例如,从细胞培养物上清收集重组hcg), 其中所述细胞是包含整合在其基因组中的编码hcg的α链的(核酸)序列 的细胞(诸如以ecacc no.96022940保藏的细胞)。 所述编码hcg的α链的(核酸)序列可以选自:seq id no:1所示的序列; 与seq id no:1的序列具有至少90%同源性的序列(例如,与seq idno:1的序列具有至少90%序列同一性的序列);与seq id no:1的序列 具有至少97%同源性(例如,至少98%或至少99%同源性)的序列(例 如,与seq id no:1的序列具有至少97%序列同一性(例如,至少98% 或至少99%序列同一性)的序列);seq id no.4所示的序列;与seq idno:4的序列具有至少90%同源性的序列(例如,与seq id no:4的序列 具有至少90%序列同一性的序列);以及与seq id no:4的序列具有至少 97%同源性(例如,至少98%或至少99%同源性)的序列(例如,与seqid no:4的序列具有至少97%序列同一性(例如,至少98%或至少99% 序列同一性)的序列)。优选地,编码hcg的α链的(核酸)序列不是以 ah007338登记的序列。所述细胞进一步包含整合在其基因组内的编码 α-2,3-唾液酸转移酶的cdna,例如seq id no:3所述的序列。所述细胞 可以进一步包含整合在其基因组中的编码hcg的β链的(核酸)序列,
例 如seq id no:2所述的序列。所述方法可以包括纯化从所述细胞和/或所 述培养基得到的重组hcg(例如,从细胞培养物上清纯化重组hcg)的 另外的一个或多个步骤。
[0024]
术语“宿主细胞”用于本发明时是指常规用于表达的任意细胞,即, 转录并且翻译核酸序列以用于产生例如多肽的任意细胞。具体地,术语“宿 主细胞”或“生物体”涉及原核生物、低等真核生物、植物、昆虫细胞或 哺乳动物细胞培养系统。优选地,所述宿主细胞是哺乳动物细胞,更优选 地,所述宿主细胞是人细胞,甚至更优选地是细胞。
[0025]
在本发明的意思内的术语“重组核酸分子”旨在包括能够被引入到宿 主细胞中并且影响包含在所述重组核酸分子内的核酸序列的表达的所有 种类的核酸分子。例如,该术语包括质粒载体和病毒载体(例如,腺病毒、 慢病毒和反转录病毒载体),这些在本领域中是公知的。
[0026]
按照本发明,在另一方面,提供包含编码hcg的α链的(第一)核 酸序列的重组核酸分子,所述(第一)核酸序列选自下述:seq id no:1 所示的序列;与seq id no:1的序列具有至少96.5%同源性的序列(例 如,与seq id no:1的序列具有至少96.5%序列同一性的序列);与seqid no:1的序列具有至少97%同源性(例如,至少98%或至少99%同源 性)的序列(例如,与seq id no:1的序列具有至少97%序列同一性(例 如,至少98%或至少99%序列同一性)的序列);seq id no.4所示的序 列;与seq id no:4的序列具有至少96.5%同源性的序列(例如,与seqid no:14的序列具有至少96.5%序列同一性的序列);以及与seq id no: 4的序列具有至少97%同源性(例如,至少98%或至少99%同源性)的 序列(例如,与seq id no:4的序列具有至少97%序列同一性(例如, 至少98%或至少99%序列同一性)的序列)。优选地,本发明这一方面的 重组核酸分子包含编码人hcg的α-链的优化的核酸序列和编码hcg的β
‑ꢀ
链的核酸序列二者。优选地,所述(第一)核酸序列处于在宿主细胞中有 活性的启动子的控制下。优选地,所述重组核酸分子还包含编码hcg的 β链的第二核酸序列。编码hcg的β链的第二核酸序列可以是seq id no. 2所示的序列。第二核酸序列可以处于在宿主细胞中有活性的分开的启动 子的控制下。第一核酸序列和/或第二核酸序列可以处于病毒启动子(例 如,cmvie启动子)的控制下。
[0027]
按照本发明,在另一方面,提供包含或包括上述重组核酸分子的宿主 细胞(例如,包含编码hcg的α链的(第一)核酸序列的重组核酸分子 的宿主细胞,所述(第一)核酸序列选自:seq id no:1所示的序列; 与seq id no:1的序列具有至少96.5%同源性的序列(例如,与seq idno:1的序列具有至少96.5%序列同一性的序列);与seq id no:1的序 列具有至少97%同源性(例如,至少98%或至少99%同源性)的序列(例 如,与seq id no:1的序列具有至少97%序列同一性(例如,至少98% 或至少99%序列同一性)的序列);seq id no.4所示的序列;与seq idno:4的序列具有至少96.5%同源性的序列(例如,与seq id no:4的序 列具有至少96.5%序列同一性的序列);与seq id no:4的序列具有至少 97%同源性(例如,至少98%或至少99%同源性)的序列(例如,与seqid no:4的序列具有至少97%序列同一性(例如,至少98%或至少99% 序列同一性)的序列))。
[0028]
申请人已经发现本发明的细胞(宿主细胞)、掺入这些宿主细胞的细 胞系、重组核酸分子、多核苷酸和方法可以以高产率和纯度(例如,几乎 没有游离的β链)产生重组hcg。
[0029]
按照本发明,在另一方面,提供包含α2,3-和α2,6-唾液酸化的重组hcg (“rhcg”或“rechcg”),其中所述重组hcg在本文所述和要求保护的细胞 中产生。所述重组hcg可以具
有12mol/mol至20mol/mol的唾液酸含量 [以唾液酸摩尔数与蛋白摩尔数之比表示],例如12mol/mol至15.5 mol/mol,例如12mol/mol至14.9mol/mol。rhcg(或rhcg制剂)可以具 有12.5mol/mol至14.5mol/mol的唾液酸含量,例如12.8mol/mol至13.2 mol/mol的唾液酸含量。本发明所述的rhcg(或rhcg制剂)可以具有13 mol/mol的唾液酸含量。
[0030]
在本发明的实例中,rhcg可以作为单种同种型或作为多种同种型的 混合物存在。
[0031]
通过本发明的方法和细胞产生的重组hcg(或rhcg制剂)包括α2,3
‑ꢀ
和α2,6-唾液酸化。唾液酸化意指在hcg糖结构上存在的唾液酸残基的量。 α2,3-唾液酸化意指在2,3位(这是本领域中公知的)的唾液酸化;α2,6唾 液酸化意指在2,6位(这也是本领域中公知的)的唾液酸化。因此,此处, 词语“总唾液酸化的%可以是α2,3唾液酸化”是指hcg中存在的唾液酸 残基总数中在2,3位唾液酸化的%。术语“总唾液酸化的%可以是α2,6
‑ꢀ
唾液酸化”是指hcg中存在的唾液酸残基总数中在2,6位唾液酸化的%。 术语“总唾液酸化的%可以是α2,8-唾液酸化”是指hcg中存在的唾液酸 残基总数中在2,8位唾液酸化的%。
[0032]
通过本发明的方法和细胞产生的rhcg(或rhcg制剂)具有的总唾液 酸化的1%至99%可以为α2,3-唾液酸化。通过本发明的方法和细胞产生 的rhcg(或rhcg制剂)具有的总唾液酸化的1%至90%可以为α2,3-唾液 酸化。本发明所述的rhcg(或rhcg制剂)具有的总唾液酸化的10%以上 可以为α2,3-唾液酸化,例如,总唾液酸化的10%至90%可以是α2,3-唾液 酸化。例如,总唾液酸化的20,30,40,45,50,55,60,70,80或90% 以上可以是α2,3-唾液酸化。总唾液酸化的45%至80%可以是α2,3-唾液酸 化,例如,总唾液酸化的50%至70%可以是α2,3-唾液酸化,例如,总唾 液酸化的55至65%可以是α2,3-唾液酸化。所述rhcg(或rhcg制剂)包 含的α2,3-唾液酸化的量可以为总唾液酸化的65至95%,例如,总唾液酸 化的70至90%,例如,总唾液酸化的85至90%。
[0033]
通过本发明的方法和细胞产生的rhcg(或rhcg制剂)具有的总唾液 酸化的1至99%可以为α2,6-唾液酸化。本发明的rhcg(或rhcg制剂)具 有的总唾液酸化的5至50%可以为α2,6-唾液酸化。例如,总唾液酸化的 5至45%,例如,6至40%,例如,7至30%,例如,8至20%,可以是 α2,6-唾液酸化。所述rhcg(或rhcg制剂)包含的α2,6-唾液酸化的量可以 为总唾液酸化的20-75%,例如,总唾液酸化的30-60%,例如,总唾液酸 化的35-45%。所述rhcg(或rhcg制剂)包含的α2,6-唾液酸化的量可以为 总唾液酸化的5至35%。例如,总唾液酸化的10至20%。例如,总唾液 酸化的11-55%可以是α2,6-唾液酸化。
[0034]
通过所述方法和细胞产生的rhcg或rhcg制剂可以任选地进一步包 含α2,8唾液酸化。本发明的rhcg(或rhcg制剂)具有的总唾液酸化的 5%以下可以为α2,8-唾液酸化,例如,总唾液酸化的0至4%,例如,0.1-4%, 可以是α2,8-唾液酸化。本发明的rhcg(或rhcg制剂)可以没有α2,8
‑ꢀ
唾液酸化。
[0035]
通过本发明的方法和细胞产生的rhcg(或rhcg制剂)具有的唾液 酸含量(每个hcg分子的唾液酸化的量)(基于蛋白的质量,而非蛋白加 碳水化合物的质量)按质量计可以为6%以上(例如,6%-15%,例如, 7%-13%,例如,8%-12%,例如,11%-15%,例如,12%-14%)。
[0036]
所述rhcg(或rhcg制剂)可以在人细胞系中产生或表达,例如, 在细胞系、ht1080细胞系等中产生或表达。所述rhcg(或rhcg 制剂)可以在来源于人的细胞系或改良的人细胞系中产生或表达,例如, 在来源于的细胞系或改良的细
胞系、改良的ht1080 细胞系或来源于ht1080的细胞系等中产生或表达。在优选的实例中, rhcg在细胞系、来源于的细胞系或改良的细胞系中产生或表达。在人细胞系(例如,细胞系,ht1080 细胞系,gt-5s细胞系)中产生或表达的rhcg包含一些由[所述细胞系的] 内源性唾液酸转移酶活性提供的α2,6-连接的唾液酸(α2,6唾液酸化),并 且将包含一些由[所述细胞系的]内源性唾液酸转移酶活性提供的α2,3-连 接的唾液酸(α2,3唾液酸化)。所述细胞系可以用α2,3-唾液酸转移酶修饰。 备选地或另外地,所述细胞系可以用α2,6-唾液酸转移酶修饰。这可以简 化(并且使其更有效)生产方法,原因在于,与使用已知的方法相比,例 如,操作和控制细胞生长培养基以保留唾液酸化可以较不重要。该方法也 可以是更有效的,原因在于与已知的rhcg产物的生产相比几乎不产生碱 性rhcg;产生更酸性的rhcg,并且碱性hcg的分离/去除较容易。
[0037]
rhcg可以使用α2,3-唾液酸转移酶产生,例如,使用用α2,3-唾液酸 转移酶修饰的人细胞系产生。rhcg可以包含由内源性唾液酸转移酶活性 提供的α2,6-连接的唾液酸(α2,6唾液酸化)。rhcg可以使用α2,3-和/或α2,6
‑ꢀ
唾液酸转移酶产生,例如,使用用α2,3-唾液酸转移酶和/或α2,6-唾液酸转 移酶修饰的人细胞系产生。
[0038]
按照本发明,在另一方面,提供本文所述的重组hcg或重组hcg制 剂,其通过本文所述的方法产生或表达。
[0039]
rhcg结构包含聚糖结构部分。可以发生分支,结果是聚糖可以具有 1,2,3,4个以上的末端糖残基或“触角”,这是本领域中公知的。本发 明各方面所述的rhcg可以具有单触角和/或双触角和/或三触角和/或四触 角聚糖结构的聚糖。rhcg可以包含单触角和/或双触角和/或三触角和/或 四触角聚糖结构,例如,相对量如下:0.1至3%单触角;65%至85%双触 角;15至25%三触角以及0.5至1.5%四触角(例如,如通过带电荷聚糖的 wax分析所示)。
[0040]
按照本发明,在另一方面,提供包含具有α2,3-唾液酸化和α2,6-唾液 酸化的重组hcg(rhcg)的药物组合物,其中所述重组hcg通过本文公开 的方法和/或细胞产生。所述rhcg可以具有12mol/mol至15.5mol/mol, 例如12mol/mol至14.9mol/mol(例如,如上文所述)的唾液酸含量[以唾 液酸摩尔数与蛋白摩尔数之比表示]。所述rhcg可以具有12.5mol/mol 至14.5mol/mol的唾液酸含量,例如,12.8mol/mol至13.2mol/mol的唾 液酸含量。优选地,本发明的rhcg具有13mol/mol的唾液酸含量。
[0041]
所述药物组合物可以进一步包含fsh和/或lh。
[0042]
fsh可以通过本领域已知的任何方式获得。本文中使用的fsh包括 来源于人的和重组的fsh。来源于人的fsh可以通过本领域已知的任何 方法从任何适当的来源(例如,尿)纯化。fsh可以是重组fsh
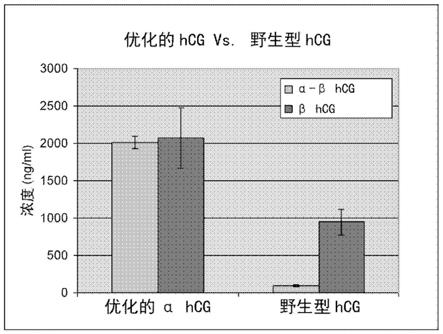
–
例如 在人细胞系中表达的。表达和纯化重组fsh的方法在本领域中是公知的。
[0043]
lh可以通过本领域已知的任何方式获得。本文中使用的lh包括来 源于人的和重组的lh。来源于人的lh可以通过本领域已知的任何方法 从任何适当的来源(例如,尿)纯化。表达和纯化重组lh的方法在本领 域中是公知的。
[0044]
所述药物组合物可以用于治疗不育,或用于不育治疗的应用中,例 如,用于例如辅助生殖技术(art)、排卵诱导或子宫内人工受精 (intrauterine insemination,iui)的应用中。所述药物可以用于引发最终 成熟/排卵和黄体化、刺激具有严重lh和fsh缺乏的妇
女中的卵泡发育、 和/或黄体支持(rhcg/rlh),或用在上述的应用中。所述药物组合物可以 用于诱导不排卵who ii型妇女中的单卵泡发育(例如,rhcg与rlh), 用于增强进行coh的患者中对lh致敏的多卵泡响应(例如,rhcg与 rlh),以及用于对coh的补充以改善植入/妊娠率(例如,rhcg与rlh), 和/或提高辅助生殖技术中的妊娠率,或用于上述中的应用中。药物组合 物可以用于预防流产和/或早产预防,或用于上述应用中。药物组合物可 以用于子宫内膜异位症(endometriosis)的治疗,或用于子宫内膜异位症 治疗的应用中。
[0045]
例如,药物组合物可以用于其中使用已知的hcg制剂的医学适应证。 本发明还提供本文所述的(本发明的各个方面所述的)rhcg和/或rhcg 制剂用于或在治疗不育的药物的制备中的应用。
[0046]
本发明的药物组合物可以配制成用于任何药物给药途径的公知的组 合物,例如,口服、直肠、肠胃外、经皮(例如,贴片技术)、静脉内、 肌肉内、皮下、池内、阴道内、腹膜内、局部(粉剂、软膏剂或滴剂)或 作为口腔或鼻喷雾剂。典型的组合物包含药用载体,诸如水溶液,无毒赋 形剂,包括盐和防腐剂,缓冲剂等,特别如在remington’s pharmaceuticalsciences(雷明顿药典)第十五版(matt publishing company,1975)第 1405-1412页和第1461
–
87页和national formulary xiv(国家处方xiv) 第十四版(american pharmaceutical association,1975)中所述。适当的水性 和非水性药物载体、稀释剂、溶剂或赋形剂的实例包括水、乙醇、多元醇 (如甘油、丙二醇、聚乙二醇等)、羧甲基纤维素和它们适当的混合物、 植物油(如橄榄油)和可注射的有机酯(如油酸乙酯)。本发明的组合物 还可以包含添加剂,诸如但不限于防腐剂、湿润剂、乳化剂和分散剂。可 以包含抗细菌剂和抗真菌剂,以防止微生物生长,并且包括,例如,间
‑ꢀ
甲酚、苯甲醇、对羟苯甲酸酯、氯丁醇、苯酚、山梨酸等。此外,可以理 想地包含等渗剂,如糖类、氯化钠等。
[0047]
在一些情形中,为了实现延长的作用,需要减缓来自皮下或肌肉内 注射的hcg(以及其他活性成分,如果存在的话)的吸收。这可以通过 使用具有差水溶性的晶形或无定形物质的脂质混悬液实现。然后hcg的 吸收率取决于其溶出度,而溶出度又可能取决于晶体粒度和晶型。备选地, 通过将hcg组合溶解或悬浮在油性赋形剂中而实现肠胃外施用的hcg组 合形式的延缓的吸收。可以通过在可生物降解的聚合物(如聚乳酸-聚乙 交酯)中形成hcg(和其他成分,如果存在的话)的微胶囊基质而制备 可注射的长效制剂形式。取决于hcg与聚合物之比和所用的具体聚合物 的性质,可以控制hcg释放的速率。其他可生物降解的聚合物包括聚乙 烯吡咯烷酮,聚(原酸酯),聚(酸酐)等。长效可注射制剂还通过将hcg 截留在与身体组织相容的脂质体或微乳液中制备而成。例如,可注射的制 剂可以经由细菌-拦截滤器过滤而灭菌,或通过掺入无菌固体组合物形式 的杀菌剂而灭菌,所述杀菌剂可以刚好在使用之前溶解或分散在无菌水中 或其他无菌可注射介质中。可注射的制剂可以提供在任何适当的容器中, 例如,小瓶,预装的注射器、注射筒等中。
[0048]
制剂(例如,可注射的制剂)可以提供为具有包含hcg(任选地具 有fsh,lh等)的药物组合物的产品。如果存在多于一种活性成分(即, hcg,以及例如,fsh或lh),这些可以适用于分开或一起施用。如果 分开施用,施用可以是顺序的。产品可以提供在任意适当的包装中。例如, 产品可以包含多个预装的注射器或小瓶,其包含hcg,fsh,或fsh与 hcg二者的组合。注射器或小瓶可以包装在泡包装中或其他形式中以保 持无菌性。产品可以任选地包括关于使用hcg和fsh制剂的使用说明。
[0049]
药物组合物的多种成分的ph和准确的浓度按照本领域的常规实践 进行调节。参见goodman和gilman的the pharmacologicalbasis for therapeutics(治疗剂的药理学基础),第7版。在优选 的实施方案中,本发明的组合物作为用于肠胃外施用的组合物提供。关于 制备肠胃外制剂的通用方法在本领域中是已知的,并且记述在 remington;the science and practice of pharmacy(雷明 顿;制药科学和实践)(同前所述)第780-820页中。肠胃外组合物可以 以液体制剂或作为固体提供,所述固体将刚好在施用之前与无菌注射介质 混合。在一个实施方案中,肠胃外组合物以单位剂型提供,以便于施用和 剂量的均一性。
[0050]
发明详述
[0051]
现在将参考下述实施例和附图更详细地描述本发明,在所述附图中:
[0052]
图1显示优化的hcgα序列的核酸和衍生的氨基酸序列;
[0053]
图2显示hcgβ(野生型β链)序列的核酸和衍生的氨基酸序列;
[0054]
图3显示st3gal4的核酸和衍生的氨基酸序列;
[0055]
图4显示phcgα/β表达载体的质粒图谱(cmv=巨细胞病毒启动子, bghp(a)=牛生长激素多腺苷酸化序列,f1 ori=f1复制起点,sv40=猿猴 病毒40启动子,neo=新霉素抗性标记,hyg=潮霉素抗性标记,sv40 p(a)= =猿猴病毒40多腺苷酸化序列,hcgα=人绒毛膜促性腺激素α多肽,hcg β=人绒毛膜促性腺激素β多肽,st3gal4=α2,3-唾液酸转移酶, st6gal1=α2,6-唾液酸转移酶,cole1=cole1复制起点,amp=氨苄青 霉素抗性标记);
[0056]
图5显示α2,3-唾液酸转移酶(st3gal4)表达载体(cmv=巨细胞病 毒启动子,bghp(a)=牛生长激素多腺苷酸化序列,f1 ori=f1复制起点, sv40=猿猴病毒40启动子,neo=新霉素抗性标记,hyg=潮霉素抗性标记, sv40 p(a)==猿猴病毒40多腺苷酸化序列,hcgα=人绒毛膜促性腺激素 α多肽,hcgβ=人绒毛膜促性腺激素β多肽,st3gal4=α2,3-唾液酸转 移酶,st6gal1=α2,6-唾液酸转移酶,cole1=cole1复制起点,amp= 氨苄青霉素抗性标记);
[0057]
图6显示通过用考马斯蓝染色的ief检测本发明的组合物中的rhcg 同种型(泳道4,5,6和7,15μg/泳道);现有技术中来源于cho的组
[0058]
图7比较使用本发明包含“优化的”α亚基核酸序列的细胞产生的 hcg(“α-βhcg”)和游离β链(“βhcg”)的浓度,其与在包含wt(野生型) α亚基的比较例细胞中产生的hcg(“α-βhcg”)和游离β链(“βhcg”)的浓 度相比较。
[0059]
实施例1-7
[0060]
细胞系开发过程概述
[0061]
将携带分别由分开的cmvie启动子驱动的hcgα和β链的单个质粒 通过电穿孔转染到细胞中。
[0062]
该质粒携带新霉素抗性基因盒(图4),其允许使用g418(遗传霉素 (geneticin))选择转染子。扩增转染子库,然后在96孔平板中在g418选 择下进行有限稀释克隆。扩增克隆系,并且基于细胞培养物上清中的hcg 效价鉴定高表达克隆。
[0063]
基于高生产率,选择五个领先的克隆,然后将每一个克隆转染表达 α2,3-唾液酸转移酶基因st3gal4以及潮霉素选择标记的第二质粒(图 5)。将这五个转染库中的每一个
扩增,并且评估细胞培养物上清的hcg 浓度和体内药物代谢动力学(pk)。
[0064]
然后将有希望的库进行另一轮有限稀释克隆。将得到的克隆扩增, 并且评估细胞培养物上清的hcg浓度和在hcg蛋白上暴露的半乳糖(通 过凝集素elisa)。使具有低水平暴露的半乳糖的那些进行进一步的分析, 包括体内pk。针对生产率和生长特征评估并选择产生具有最佳pk特征 曲线的hcg、具有低暴露的半乳糖并且以高水平表达蛋白的克隆。
[0065]
实施例1:序列选择和质粒载体
[0066]
hcgα多肽的基因的编码区显示在图1中。hcgα多肽序列的基因的 编码区在本文中称为seq id no:1。
[0067]
按照fiddes和goodman(1980)使用hcgβ多肽的基因的编码区。该 序列以np_000728登记,并且与cgβ3、cgβ5和cgβ7的蛋白序列一致。 该序列在本文中称为seq id no:2。
[0068]
按照kitagawa和paulson(1994)使用β-半乳糖苷α-2,3-唾液酸转移酶 4(α2,3-唾液酸转移酶,st3gal4)的基因的编码区。该序列以l23767登 记并且在本文中称为seq id no:3。
[0069]
使用两种质粒:第一种是phcg,共表达hcgα和β链;第二种表达 唾液酸转移酶基因st3gal4。
[0070]
实施例2a:构建hcg表达载体
[0071]
phcg是合成的hcgα链,其针对在哺乳动物细胞中的密码子使用进 行优化,包含天然的hcgα信号肽。其可以通过本领域公知的方法进行 改造。
[0072]
使用本领域公知的方法(例如,参见以wo2011/042688公布的国际 专利申请)通过pcr扩增hcgα多肽(seq id no:1)和hcgβ多肽 (np_000728,seq id no:2)的编码序列。将phcgαdna用bamhi和nhei消化,并且插入到cmv驱动的哺乳动物表达载体(crucell载体 pcdna3002neo)的位点bamhi和nhei中。这使所述基因位于正确的方向, 以通过cmvie启动子与下游bgh多腺苷酸(polya)信号驱动表达。将 包含天然信号肽的天然hcgβ基因用限制酶asci和hpai消化,并且插入 到asci和hpai位点中,使得表达由第二cmvie启动子与另外的下游bgh 多腺苷酸(poly a)信号驱动。载体骨架还包含新霉素抗性标记以及在原 核细胞中选择和复制所需要的元件。扩增所述载体并使用本领域已知的通 用方法测序。优化的hcgα和天然(野生型)β链的序列分别提供在图1 和2中。
[0073]
选择用于测序的所有集落包含seq id no:1和seq id no:2所示的 正确序列。选择质粒phcg a+b用于转染(图4)。
[0074]
实施例2b:构建st3表达载体
[0075]
st3gal4基因在pst3中表达。使用引物组合2,3stfw和2,3strev 通过pcr扩增β-半乳糖苷α-2,3-唾液酸转移酶4(st3,l23767,seq idno:3,图3)的编码序列。
[0076]
2,3stfw 5
’‑
ccaggatccgccaccatgtgtcctgcaggctggaagc-3’[0077]
2,3strev 5
’‑
tttttttcttaagtcagaaggacgtgaggttcttg-3’[0078]
将得到的扩增的st3 dna用限制酶bamhi和aflii消化,并且插入 到携带潮霉素抗性标记的cmv驱动的哺乳动物表达载体(载体 pcdna3002neo)的bamhi和aflii位点中,使得其位于cmvie启动子下 游和bgh多腺苷酸(polya)序列上游。载体骨架还包含潮霉素抗性标 记以及在原核细胞中选择和复制所需要的元件。将所述载体如之前所述进 行扩增并测序。
克隆pst3#1(图5)包含seq id no:3所示的正确的序列, 并且选择用于转染。
[0079]
实施例3-质粒转染
[0080]
质粒phcg(图4)具有位于原核β-内酰胺酶基因中的单个pvui位点, 将其用pvui(new england biolabs cat.no.r0150)线性化。按下述将线性 化的质粒dna转染到细胞中。
[0081]
将细胞培养物维持在250ml erlenmeyer烧瓶中的完全permab培养 基(cd4permab(hyclone cat.no.sh30871.01),所述培养基补充有l
‑ꢀ
谷氨酰胺至3mm终浓度(invitrogen cat.no.25030-123)和终浓度为1.0g/l 的pluronic f68(invitrogen cat.no.24040-032))中。在转染前将细胞维持 在设为100rpm,5%co2和37℃的摇动培养箱(kuhner climo-shakerisf1-x)中达至少14天。在转染前48小时,将细胞以0.5x106个细胞/ml 的密度转移到新鲜培养基中。
[0082]
在转染那天,将细胞在beckman coulter vicell xr中计数以确定细 胞密度并且确保生存力》90%。通过离心收集细胞,并且重悬在新鲜的 permab培养基中,然后与线性化的phcg dna混合。将细胞/dna混 合物在设为250v的电穿孔仪的室中电击5msec,然后快速转移到10ml 预先温热的permab培养基中。共重复该过程6次,并将所有6次转染 物合并到单个t-175cm2的组织培养烧瓶中。将该烧瓶放置在设为37℃, 5%co2的静态培养箱中。48小时后,将细胞重悬在适当体积的选择性 permab(完全permab培养基+g418(125μg/ml))中,以提供0.5x106/ml 的存活细胞密度。
[0083]
将合并的培养物每周传代两次,在选择培养基中保持细胞处于 0.3x106个细胞/ml的密度,直到细胞生存力增加至》50%。在该点,将细 胞转移至250ml erlenmeyer烧瓶中进行摇动培养。在摇动培养几周后,取 样合并的上清并测定hcg浓度。一旦确定合并物对hcg表达是阳性的, 则准备细胞用于有限稀释克隆。
[0084]
在补充了125μg/ml的g-418的permab培养基中制备0.3个存活细 胞/ml的细胞混悬液。将细胞混悬液以200μl/孔分散到96孔平底组织培养 板中,并且在潮湿的气氛中在37℃,5%co2(binder cb150)培养。使用 genetix克隆选择成像仪规律地扫描平板,以追踪每个孔中细胞的生长。
[0085]
两周后,鉴定535个包含活跃生长的细胞集落的孔。取样来自这些 孔的上清并且使用商购试剂盒(drg diagnostics hcg elisa cat.no. eia1469)测定hcg。基于这些测定的结果,将共162个集落转移到包含 0.5ml/孔选择性permab培养基的24孔平板中。当孔中的细胞接近汇合 时,对来自162个孔的每一个的上清取样,并且测定hcg水平。基于这 些结果,选择91个最佳表达细胞系用于在t-25烧瓶中扩增。将这些细胞 系再次生长至汇合,在该点,如上述对上清取样并且测定hcg。基于这 些结果,将58个最佳表达细胞系扩增到t-75烧瓶中。对这58个细胞系 中的每一个,通过本领域已知的方法进行比生产率(specific productionrate,spr)分析,并且比生产率以pg/细胞/天表示。
[0086]
由此,在本实施例中,将掺入了hcgα和β链的质粒转染到细胞中,并且使用含g418的培养基选择转染子。筛选生长的细胞集落的 上清中的hcg浓度,并且进一步扩增表达最高水平的那些集落。在后续 的扩增和筛选轮次中,选择20个表达hcg的克隆用于生长和生产率研究。 基于这些研究的结果,选择5个克隆用于用结合了st3gal4基因的第二 质粒转染。
[0087]
实施例4
–
用st3gal4质粒pst3转染
[0088]
如之前在实施例3中所述产生稳定的克隆。
[0089]
选择通过如实施例3所述的方法产生的五个最佳克隆用于用 st3gal4质粒pst3(见实施例2,图3和5)转染。通过使用实施例3所 述的相同方法,通过电穿孔进行转染,不同之处在于在补充了0.5μg/ml 潮霉素替代g418的完全permab培养基中选择转化子。使用这一方法, 获得表达hcg的五个库。
[0090]
将来自转染库的上清样品在大鼠药物代谢动力学模型中测定,并且 基于该数据以及来自rca-凝集素测定(测量hcg链上暴露的半乳糖) 的数据,通过本领域已知的方法选择单个库用于进一步的有限稀释克隆。
[0091]
该稀释克隆产生》600个克隆,对它们中的每一个还筛选hcg表达和 通过rca-凝集素结合测定的暴露的半乳糖的程度。进一步扩增这些具有 最低水平的暴露的半乳糖的克隆,并且使样品进行体内pk和验证凝集素 结合数据。对来源于单个库的五个克隆进一步测定生长和生产率特征。
[0092]
扩增这些克隆中的每一个,并且按照标准低温保藏方法制备种子储 备细胞库。将来自种子储备细胞库的储备物解冻,并且发现是存活的。
[0093]
实施例5
–
通过等电聚焦分析
[0094]
电泳定义为带电荷分子通过电场经由溶剂的转运。生物分子通过电 场的运动性取决于场强、分子上的净电荷、分子的尺寸和形状、分子迁移 所在的介质的离子强度和特性。
[0095]
等电聚焦(ief)是基于蛋白的pi分离蛋白的电泳技术。pi是蛋白没有 净电荷并且在电场中不迁移的ph。hcg同种型的唾液酸含量微妙地改变 每种同种型的pi点,其可以使用该技术进行研究以显现来自每个克隆的 per.c6 hcg同种型。
[0096]
使用等电聚焦分析per.c6产生的hcg同种型的等电点。如实施例6 所述产生per.c6 hcg。
[0097]
将per.c6 hcg样品在包含5%聚丙烯酰胺的ief凝胶上在非 变性条件下在ph 3.0
–
7.0的两性电解质溶液中以ph 3.0-7.0的梯度分 离。利用本领域公知的方法,用考马斯蓝染色将蛋白可视化。
[0098]
图6显示通过用考马斯蓝染色的ief检测由通过实施例6所述的方 法制备的克隆细胞系产生的本发明的组合物中的rhcg同种型(泳道4,5, 6和7,15μg/泳道);现有技术中来源于cho的组合物,ovitrelle(泳道 2,15μg);和从怀孕的妇女得到的人尿液产物novarel(泳道3,15μg)。 所述条带表示包含不同数量的唾液酸分子的hcg同种型。图6显示,与 ovitrelle和来自怀孕妇女的尿hcg相比,用α2,3-唾液酸转移酶改造的来 源于人细胞系的重组hcg(本发明所述的组合物)更为酸性。
[0099]
图7比较使用本发明包含“优化的”α亚基的细胞(即,使用通过实 施例1-4所述的方法制备的细胞系)产生的hcg(“α-βhcg”)和游离β链(“β hcg”)的浓度,与在包含wt(野生型)α亚基的比较例细胞中产生的hcg (“α-βhcg”)和游离β链(“βhcg”)的浓度相比较。图7显示本发明的细胞 表达大量的hcg和低过量的游离β亚基。换言之,通过本发明的细胞和 方法产生的重组hcg的产量和纯度有显著的提高。
[0100]
表a显示,如通过疏水苯基-5pw hplc色谱确定的,与在包含wt (野生型)α亚基
(“wtαhcg”)的比较例细胞中产生的hcg的半纯化 样品中的游离β-hcg亚基的百分数相比,在使用本发明的细胞(即,使 用通过实施例1-4所述的方法制备的细胞系)产生的包含“优化的”α亚 基(优化的αhcg)的各批次hcg的半纯化样品中游离β-hcg亚基的百 分数。
[0101]
表a显示,与包含wtα亚基的细胞(64
–
66%)相比,本发明的细胞 表达大量的hcg和相对较低过量的游离β亚基(5.7
–
10.6%)。换言之,通 过本发明的细胞和方法产生的重组hcg的产量和纯度有显著的提高。
[0102]
表a
[0103][0104]
实施例6
–
生产和纯化概述
[0105]
开发一种方法以在无血清培养基中悬浮培养的per.c6细胞中生产 重组hcg。该方法记述如下,并且适用于数种产生hcg的per.c6细胞 系。
[0106]
使用上文所述的实施例1-4的方法从转染有α2,3-唾液酸转移酶的克 隆制备重组hcg。
[0107]
将细胞在摇动烧瓶中在6gro培养基(safc)中培养至细胞密度达到 1x10
6-3x106个细胞/ml。将细胞以约1x106个细胞/ml的密度转移到5l玻 璃搅拌罐式生物反应器中。该生物反应器使用proper1培养基(lonza)以灌 注模式工作。
[0108]
然后,通过本领域公知的方法,使用多个超滤步骤、阴离子和阳离 子交换捕获层析、疏水层析和假亲和性层析,进行产物rhcg的纯化。
[0109]
在所有的层析方法过程中,通过elisa(drg eia 1469)和ief(实施 例5)证实免疫反应性重组hcg的存在。
[0110]
实施例7-唾液酸含量
[0111]
唾液酸是一种蛋白结合的糖,其被认为是一种单糖,并且与其他单 糖(如半乳糖、甘露糖、葡糖胺、半乳糖胺和岩藻糖)联合存在。使用基 于stanton等人(j.biochem.biophys.methods.30(1995),37
–
48)的方法 的方法,测定在本发明所述的纯化的rhcg上的总唾液酸。
[0112]
测定用α2,3-唾液酸转移酶修饰的per.c6重组hcg样品(通过实施例 4和6的方法生产)的总唾液酸含量,并且结果在表1中[以唾液酸摩尔 数与蛋白摩尔数之比表示]。
[0113]
实施例8
–
依据usp的hcg生物测定
[0114]
对下述表1的各样品进行hcg生物测定,以确定hcg比活性。活性 按照usp(usp monographs:chorionic gonadotropin(usp专题论文:绒 毛膜促性腺素),uspc official 8/1/09-11/30/09)使用ovitrelle作为标准 物进行测定。ovitrelle具有26,000iu/mg的生物学活性(curr med res opin. 2005年12月;21(12):1969
–
76)。接受界限是》21,000iu hcg/mg。关于 来源于人细胞系的hcg用α2,3-唾液酸转移酶改造的重组hcg的样品的 生物学活性显示在表1中。
[0115]
表1
[0116][0117][0118]
从上文看出,功效与ovitrelle相似并且可以大于ovitrelle(例如,参 见样品7)。
[0119]
参考文献
[0120]
andersen cy,westergaard lg,和van wely m.(2004).fsh isoform composition of commercial gonadotrophin preparations:a neglected aspect?(商购促性腺激素制剂的fsh同种型组成:一个被忽视的方面?)reprod biomed online.9(2),231-236.
[0121]
bassett rm,和driebergen r.(2005).continued improvements in the quality and consistency of follitropin alfa,recombinant human fsh(促卵泡素α, 重组人fsh的质量和一致性的持续改进).reprod biomed online.10(2), 169-177.
[0122]
d’antonio m.,borrelli f.,datola a.,bucci r.,mascia m.,polletta p., piscitelli d.,和papoian r.(1999)biological characterization of recombinant human follicle stimulating hormone isoforms(重组人促卵泡激素同种型的生 物学表
征).human reproduction 14,1160-1167
[0123]
fiddes,j.c.和goodman,h.m.(1979)isolation,cloning and sequence analysis of the cdna for the alpha-subunit of human chorionic gonadotropin (人绒毛膜促性腺激素α亚基的cdna的分离、克隆和序列分析).nature, 281,351-356.
[0124]
fiddes,j.c.和goodman,h.m.(1980)the cdna for the beta-subunit of human chorionic gonadotropin suggests evolution of a gene by readthrough into the 3
’‑
untranslated region(通过通读到3
’‑
不翻译区,人绒毛膜促性腺 激素的β亚基的cdna表明基因的进化).nature,286,684-387.
[0125]
kagawa y,takasaki s,utsumi j,hosoi k,shimizu h,kochibe n,和 kobata a.(1988).comparative study of the asparagine-linked sugar chains of natural human interferon-beta 1and recombinant human interferon-beta 1 produced by three different mammalian cells(天然人干扰素β1和由三种不 同的哺乳动物细胞产生的重组人干扰素β1的天冬氨酸-连接的糖链的比较 研究).j biol chem.263(33),17508-17515.
[0126]
lowry oh,rosebrough nj,farr al,randall rj.(1951)protein measurement with the folin phenol reagent(使用folin苯酚试剂的蛋白测定).j biol chem. 193(1),265-75.
[0127]
lowry,pj,mclean,c,jones rl和satgunasingam n.(1976)purification of anterior pituitary and hypothalamic hormones(垂体前叶和下丘脑激素的 纯化)clin pathol suppl(assoc clin pathol).7,16
–
21.
[0128]
royle l,radcliffe cm,dwek ra和rudd pm(2006)methods in molecular biology(分子生物学方法),ed i brockhausen-schutzbach(humana press), 347:glycobiology protocols,125-144.
[0129]
steelman sl,和pohley fm.(1953)assay of the follicle stimulating hormone based on the augmentation with human chorionic gonadotropin(基于使用人 绒毛膜促性腺激素的增大的促卵泡激素的测定).endocrinology.53(6), 604-616.
[0130]
svensson ec,soreghan b,和paulson jc.(1990)organization of the beta-galactoside alpha 2,6-sialyltransferase gene.evidence for the transcriptional regulation of terminal glycosylation(β-半乳糖苷α2,6-唾液酸 转移酶基因的排列。末端糖基化的转录调节的证据).j biol chem. 265(34):20863-20868.
[0131]
takeuchi m,takasaki s,miyazaki h,kato t,hoshi s,kochibe n,和 kobata a(1988).comparative study of the asparagine-linked sugar chains of human erythropoietins purified from urine and the culture medium of recombinant chinese hamster ovary cells(从尿和重组中国仓鼠卵巢细胞的 培养基纯化的人红细胞生成素的天冬氨酸-连接的糖链的比较研究).j biol chem.263(8),3657-3663.
[0132]
ulloa-aguirre a,midgley ar jr,beitins iz,和padmanabhan v.(1995). follicle-stimulating isohormones:characterization and physiological relevance (促卵泡同工激素:表征和生理学相关性).endocr rev.16(6),765-787.
[0133]
ulloa-aguirre a,timossi c,barrios-de-tomasi j,maldonado a,和nayudu p.
(2003).impact of carbohydrate heterogeneity in function of follicle-stimulating hormone:studies derived from in vitro and in vivo models (糖异质性对促卵泡激素功能的影响:来自体外和体内模型的研究).biol reprod.69(2),379-389.
[0134]
优化的hcgα
[0135]
优化的hcgα的核苷酸序列(seq id no:1)
[0136][0137]
hcg优化的α的蛋白序列
[0138][0139]
人绒毛膜促性腺激素β多肽
[0140]
登记号np_000728
[0141]
hcgβ的核苷酸序列(seq id no:2)
[0142]
核苷酸序列
[0143][0144]
hcgβ的蛋白序列
[0145][0146]
β-半乳糖苷α-2,3-唾液酸转移酶4
[0147]
登记号l23767
[0148]
st3gal4的核苷酸序列(seq id no:3)
[0149][0150]
st3gal4的蛋白序列
[0151][0152]
优化的hcgα链
[0153]
优化的hcgα链的核苷酸序列(seq id no:4)
[0154][0155]
hcg优化的α链的蛋白序列
[0156][0157]
hcgα多肽
[0158]
登记号ah007338
[0159]
hcgα的核苷酸序列(seq id no:5)
[0160][0161]
hcgα的蛋白序列
[0162]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1