希瓦氏菌株代谢乙酸盐改造方法及应用
1.本发明属于基因工程和生物代谢技术领域。具体而言,是通过构建重组质粒以改造希瓦氏菌的代谢通路,拓宽其底物利用范围。使希瓦氏菌由摄取高价值乳酸作为碳源,转变为可利用低廉乙酸盐作为唯一碳源进行生长代谢和能源生产。
背景技术:
2.希瓦氏菌(shewanella oneidensis)是一种常见的电活性微生物,其能够摄取利用环境中的有机物作为电子供体,经过胞内中心碳代谢循环产生电子并传递给胞内电子池,随后在一系列脱氢酶的作用下,电子汇入细胞内膜的醌池中,经过膜上胞外电子传递系统-金属还原mtr途径,最终传递至胞外电子受体,完成放电过程。由于希瓦氏菌特殊的电子传递能力,以希瓦氏菌s.oneidensis mr-1为基础的微生物燃料电池系统被广泛应用于生物放电、化学品生产、环境修复等绿色能源方面。
3.微生物燃料电池可以通过电活性微生物从环境废弃物、工业废水、海洋沉积物中获取生物质以产生电能,这在污染物降解和可持续能源领域方面具有重要前景。乙酸盐作为工业废水和木质纤维素生物质水解物的主要成分,因其具有与糖类碳源竞争的潜力,在生物制造方面受到了广泛关注。因此,如何利用电活性微生物电催化系统将乙酸转化为可持续利用的绿色能源逐渐成为研究热点。在s.oneidensis中,乙酸盐通常通过以下两种途径完成代谢过程:
①
由acka和pta编码的乙酸激酶磷酸转乙酰酶途径;
②
由acs编码的乙酰辅酶a合成酶途径。两者都需要消耗大量atp来驱动。但在微生物燃料电池这种厌氧条件下由于atp产生有限,s.oneidensis细胞不能通过该途径正常代谢乙酸。
4.据报道,在厌氧菌硫还原地杆菌(geobacter sulfurreducens)中,乙酸盐通过琥珀酰辅酶a:乙酰辅酶a转移酶(succinyl-coa:acetate coa-transferase,scact)途径无需消耗atp则可有效地将乙酸转化为乙酰辅酶a,而进入中心碳代谢循环。因此,针对g.sulfurreducens的无耗能乙酸代谢途径,我们通过大量文献检索结合实验结果分析,进一步筛选确定了在该途径中的两个关键基因,乙酰辅酶a转移酶(ato1和ato2),负责将乙酸转化为乙酰辅酶a,而不需要过多的能量消耗。
5.因此,为了提高厌氧条件下的s.oneidensis乙酸代谢效率,我们引入了来自g.sulfurreducens scact途径中的关键基因(ato1和ato2),增强乙酸的摄取率和乙酰辅酶a的转化率。同时,为了进一步提高乙酸的代谢循环效率,我们强化了s.oneidensis本源的乙酰辅酶a进入三羧酸循环的关键基因柠檬酸合酶glta。最终,首次构建了能够利用乙酸为唯一碳源进行生长代谢并且高效产电的希瓦氏菌工程菌株。
技术实现要素:
6.本发明旨在通过异源表达技术,结合基因工程等手段,将g.sulfurreducens中乙酸盐利用代谢途径(scact)的关键基因(ato1和ato2)引入s.oneidensis mr-1中,并同时强化希瓦氏菌自身乙酸代谢通路中的关键基因glta。使得最终工程改造后的希瓦氏菌能够在
以乙酸盐为唯一碳源的环境中进行生长代谢并高效放电。
7.本发明的技术方案概述如下:
8.希瓦氏菌株代谢乙酸盐改造方法,将g.sulfurreducens中乙酸盐利用代谢途径的关键基因ato1和ato2引入s.oneidensis mr-1中,并同时强化希瓦氏菌自身乙酸代谢通路中的关键基因glta;将三个基因ato1,ato2和glta连接到载体质粒pyydt上形成重组质粒,得到一个含有重组质粒的工程希瓦氏菌株,重组质粒的核苷酸序列为seq id no.5。
9.所述的基因ato1核苷酸序列为seq id no.1。
10.所述的基因ato2核苷酸序列为seq id no.2。
11.所述的基因glta核苷酸序列为seq id no.3。
12.所述的方法,其特征是,载体质粒pyydt核苷酸序列为seq id no.4。
13.本发明方法得到的代谢重组希瓦氏菌株用于在厌氧条件下代谢乙酸盐。
14.本发明方法得到的代谢重组希瓦氏菌株用于在以乙酸盐为唯一电子供体的微生物燃料电池中放电。
15.具体说明如下:
16.在ncbi数据库中查找g.sulfurreducens中乙酸盐摄取途径scact的关键基因ato1和ato2序列信息(如seq id no.1-2所示),s.oneidensis中促进tca循环和乙酸盐代谢过程的关键基因glta(如seq id no.3所示),连接到载体质粒pyydt(质粒图谱见图1a所示,序列信息如seq id no.4所示),最终得到一个pyydt上连有三个基因(ato1,ato2,glta)的重组质粒,命名为pau3,该质粒图谱如图1b所示,核苷酸序列如seq id no.5所示。
17.ato1:来自geobacter sulfurreducens中的琥铂酰辅酶a:乙酰辅酶a转移酶基因;
18.ato2:来自geobacter sulfurreducens中的琥铂酰辅酶a:乙酰辅酶a转移酶基因;
19.glta:来自shewanella oneidensis中的柠檬酸合酶基因。
20.本发明将上述经过密码子优化后的基因通过tac启动子和t1终止子完成表达,采用biobrick的构建策略,利用spei与xbai酶是同尾酶,经过处理后留下相同的粘性末端,在t4连接酶的作用下将所需要的外源基因逐个连接到基础质粒上,并且保证已连接的外源基因不受后续内切酶的影响。
21.所选重组质粒扩增的工程菌为营养缺陷型菌株e.coil wm3064(市售可得),最终宿主工程菌为s.oneidensis mr-1,wm3064的转化方法可采用化转方式将重组质粒直接转入e.coil wm3064细胞中,经接合转移到mr-1菌中,得到最终构建的希瓦氏工程菌。导入pyydt空质粒的对照组野生型菌株命名为wt,导入重组质粒(pau3)的工程菌株命名为ace-3。
22.本发明通过上述的构建方法,重构s.oneidensis mr-1的代谢通路,使工程希瓦氏菌能够在以乙酸盐为唯一碳源的sbm液体培养基中进行生长代谢,从而拓宽希瓦氏菌的可用底物谱。在厌氧条件下,wt菌株几乎不能代谢乙酸盐,而工程菌株具有显着的生长优势,ace-3的生长速率与有氧条件相似,并以0.23mm/h的速率消耗乙酸盐。随后,工程菌ace-3在微生物燃料电池中以乙酸盐作为唯一电子供体产生8.3
±
1.2mw/m2的最大功率密度。上述结果证明了经过改造后的希瓦氏菌株能够以乙酸盐为唯一碳源进行生长代谢并进行有效的胞外电子传递。
23.本发明的有益效果是:
24.1、本发明利用异源表达技术,结合基因工程等手段,构建重组质粒,将乙酸盐代谢的关键基因引入s.oneidensis mr-1中,得到能较好摄取利用乙酸盐代谢的工程菌株ace-3,拓宽了希瓦氏菌的可用底物谱。
25.2、本发明通过拓宽模式产电菌s.oneidensis mr-1的可用底物谱,为微生物燃料电池底物共利用的设计提供了现实依据,有利于提高菌株的胞外电子传递效率。
26.3、本发明构建的工程s.oneidensis mr-1菌株在以乙酸盐为唯一电子供体的微生物燃料电池中可以明显增强产电性能,提高功率密度,为改善微生物燃料电池电化学性能以及电活性微生物工程改造提供了有效案例和设计思路。
附图说明
27.图1:(a)为载体pyydt质粒图谱;(b)重组质粒pau3质粒图谱。
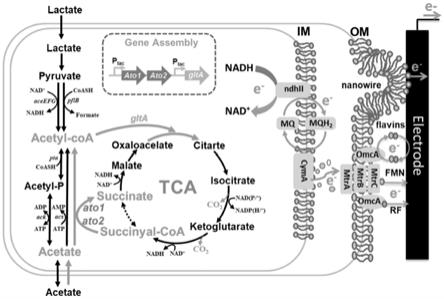
28.图2:为本发明构建的工程希瓦氏菌乙酸盐代谢设计原理图。通过引入异源的乙酰辅酶a转移酶基因ato-1和ato-2,强化乙酸代谢生成乙酰辅酶a的过程;同时,通过强化希瓦氏菌本源的乙酰辅酶a进入三羧酸循环的关键酶基因glta,进一步增强细胞代谢乙酸以及胞外电子传递能力。
29.图3:为本发明工程菌株在有氧条件下,以乙酸盐为唯一碳源的sbm培养基中生长曲线(a)及乙酸盐消耗情况(b)。
30.图4:为本发明工程菌株在无氧条件下,以乙酸盐为唯一碳源的sbm培养基中生长曲线(a)及乙酸盐消耗情况(b)。
31.图5:为本发明工程菌株在以乙酸盐为唯一电子供体的微生物燃料电池中的输出电压曲线。
32.图6:为本发明工程菌株在以乙酸盐为唯一电子供体的微生物燃料电池中的功率密度曲线。
具体实施方式
33.原始菌株野生型希瓦氏菌shewanella oneidensis mr-1,于2010年9月购自atcc(美国,https://www.atcc.org/)公司的atcc 700550菌株。本发明中构建的质粒是本实验室设计,在全合成过程中,需要将发明所需要的各外源基因连接到质粒载体上并保存。下面结合实施例,进一步阐述本发明:
34.实施例1:重组质粒的构建。
35.合成并优化希瓦氏菌摄取乙酸盐代谢利用的基因ato1,ato2和glta。利用biobrick方法,将上述基因通过酶切连接的方式,构建重组质粒pau3。
36.①
在合成的目的基因片段的5’端添加xbai酶切位点,3’端依次添加spei,sbfi酶切位点。首先利用xbai和sbfi酶(公知,市售可得)对基因ato-1进行酶切(核苷酸序列为seq id no.1),利用spei和sbfi酶(公知,市售可得)对自带该酶切位点的pyydt质粒进行酶切(核苷酸序列为seq id no.4)。由于xbai和spei酶是同尾酶,酶切后会产生相同的粘性末端,再通过t4连接酶进行连接,构建含有基因ato1的重组质粒。
37.②
利用xbai和sbfi酶对基因ato2进行酶切(核苷酸序列为seq id no.2),利用spei和sbfi酶对刚构建的含有基因ato1的重组质粒进行酶切,经过t4连接酶后,获得含有
ato1,ato-2两个基因的重组质粒。
38.③
同样按照步骤
②
中的方法,完成基因glta的连接(核苷酸序列为seq id no.3),得到最终连接了三个基因ato1,ato2和glta的重组质粒pau3(核苷酸序列为seq id no.5),质粒图谱如图1b所示。
39.按照上述步骤依次完成重组质粒的构建,另外由于pyydt作为基础质粒载体含有卡那霉素抗性基因序列,可用于后期工程菌株的定向筛选。
40.实施例2:重组希瓦氏菌株的构建。
41.如图2所示,为本发明构建的工程希瓦氏菌乙酸盐代谢设计的原理图,包括促进乙酸盐摄取进入细胞到促进tca循环和胞内代谢的全过程,具体通过以下方法得到一株能进行葡萄糖代谢的工程希瓦氏菌。
42.转化:从-80℃冰箱取出e.coli wm3064感受态细胞100μl,置于冰盒内自然解冻后加入重组质粒pau3 10μl,冰上静置30min,42℃热击90s,再冰上静置2-3min,向ep管中加入1ml lb+dap液体培养基(5g/l酵母提取物、10g/l胰蛋白胨、10g/l nacl、0.059g/l 2,6-二氨基庚二酸),置于37℃、220rpm的摇床中复苏1h。离心后涂布至lb+dap+kan平板上(5g/l酵母提取物、10g/l胰蛋白胨、10g/l nacl、0.059g/l dap、50mg/ml卡那霉素(kan)、15g/l琼脂粉)最后倒置放到37℃的恒温培养箱过夜培养,挑取阳性克隆。
43.接合转移:将上述得到的工程大肠杆菌分别接种到3ml lb+dap+kan液体培养基中培养,37℃,200rpm 10-12h;将野生型菌株mr-1接种到3ml lb液体培养基(5g/l酵母提取物、10g/l胰蛋白胨、10g/l nacl)中培养,30℃,200rpm 10-12h。将得到的大肠杆菌种子液和希瓦氏菌种子液各取500μl混合到一个1.5ml无菌ep管中,混合均匀,5000rpm离心10min,倒掉上清液。用1ml lb+dap液体培养基重悬,在30℃下静置1-2h。静置完成后取50μl菌液涂布于lb+kan(5g/l酵母提取物、10g/l胰蛋白胨、10g/l nacl、15g/l琼脂粉、50mg/ml kan)固体平板上,置于30℃培养箱中培养12h以上,得到希瓦氏工程菌ace-3。
44.菌落pcr进行验证:接合转移涂板的菌长出明显单菌落后,准备菌落pcr验证质粒是否结转成功。需要准备新的lb+kan平板,并分区域做好标记。配制pcr体系(单个pcr反应体系配置:ddh2o 11.55μl;上、下游引物各0.3μl;10
×
buffer 1.5μl;dntps 1.2μl;taq酶0.15μl;一个反应体系共15μl)。分装入pcr小管中,可以比实际需要的多配2-5个体系,防止因枪头沾有溶液造成损失。准备足量的灭菌牙签。在超净台,一根牙签挑取一个单菌落,放入一个体系的孔中;挑完后,每根蘸取菌落的牙签在新平板对应的区域中划线接种,丢弃牙签。全部划完后,将pcr小管密封,放入pcr仪,设定参数(pcr反应条件为:94℃预变性5min,94℃变性30s,50-60℃退火30s,72℃延伸x s(1kb/30s,),30个循环,最后72℃再延伸5min,16℃保温)。划线的平板放入30℃恒温培养箱(生长不少于10h,具体看菌落长势,长到一定程度可以用保鲜膜包好放4℃保存)。
45.琼脂糖凝胶电泳:制胶:1
×
tae缓冲液100ml,琼脂糖1.0g,加热溶解,待适当冷却后加核酸染料5μl,摇匀倒入放好透明垫和梳子的胶槽中,等待凝固。
46.跑胶:pcr结束后,加dna loading buffer,点样,每孔各10μl,电泳8-12min。观察有无目的条带并记录对应编号。
47.保菌:将验证成功的工程希瓦氏菌保菌备用。取过夜培养的希瓦氏工程菌500μl,50%的甘油500μl,加入到保菌管中,置于-80℃保存。
48.实施例3:重组希瓦氏工程菌ace-3在含有浓度为10mm乙酸盐溶液的sbm液体培养液中发酵培养(包含有氧和厌氧)。
49.为了确定细胞生长情况,将wt,ace-3菌株的2ml培养悬液接种到100ml sbm培养基中。细胞培养物在30℃200rpm下摇床培养,定期取样测定细胞密度(600nm处光密度,即od
600
),用紫外可见分光光度计(tu-1810,北京,中国)测定。
50.wt,ace-3菌株均在10ml lb培养基中30℃200rpm下培养过夜。
51.将每种悬浮液的3%接种量转移到补充有10mm乙酸盐作为底物的sbm(ph 7.2)中。在需要时,补充50mg/ml卡那霉素和0.75mm iptg。
52.摇瓶中的代谢物通过配备紫外检测器的高效液相色谱(hplc)系统进行分析。所有发酵样品和标准溶液在进行hplc测试前均通过0.22μm过滤器进行预处理。使用hplc和aminex hpx-87h柱(bio-rad)在65℃下分析乙酸盐浓度,使用5mm h2so4作为洗脱液,通过紫外分光光度计在210nm处以0.6ml/min的流速进行分析。
53.如图3所示,在有氧条件下,野生型菌株wt对乙酸盐的生长和利用能力较弱,工程菌株ace-3显示出明显比wt更高的生长速度。并且工程菌株ace-3的乙酸盐消耗率达到0.40mm/h。而在厌氧条件下,wt菌株几乎不能代谢乙酸盐,但ace-3工程菌株具有显着的生长优势,表明改造后的mr-1可以代谢利用乙酸,并且工程菌株的生长速率与有氧条件相似,达到~0.23mm/h的代谢速率消耗乙酸盐。
54.实施例4:接种重组希瓦氏菌ace-3和野生型希瓦氏菌wt的微生物燃料电池产电。
55.菌株活化:将产电重组希瓦氏菌株ace-3和野生型希瓦氏菌wt从-80℃冰箱取出,在lb+kan培养基里30℃,200rpm,分别过夜培养。过夜培养液按1%的比例分别转接入新的lb+kan+(1mm)iptg培养基里30℃,200rpm,培养10h,测od
600
,计算体积(mfc中od
600
=0.5),5000rpm离心10min,用阳极液重悬后,加入微生物燃料电池阳极室中。
56.微生物燃料电池产电:实验装置采用双室微生物燃料电池,140ml阳极室(包含菌体和阳极液共140ml和140ml阴极室,阳极碳布电极大小为1cm
×
1cm,阴极碳布电极大小为2.5cm
×
3cm,双室之间用质子交换膜隔开,质子交换膜用之前用1m盐酸水溶液过夜浸泡,并用无菌的蒸馏水冲洗三次。阳极液包含6g/l磷酸氢二钠、3g/l磷酸二氢钾、0.5g/l氯化钠、1g/l氯化铵、1mm硫酸镁、0.1mm氯化钙、20mm乳酸钠、5%lb培养基,加ddh2o补齐至1l。阴极液包含50mm铁氰化钾、50mm磷酸氢二钾和50mm磷酸二氢钾,余量是ddh2o。微生物燃料电池放在30℃培养箱中,阴阳两极连接2kω的外电阻。
57.电化学效果分析:输出电压数据使用电子万用表测量,将特定时间下的电压数据记录并绘制成随时间变化曲线。线性扫描伏安法(lsv)从-0.87v扫到-0.1v,扫速为0.1mv/s,仪器为多通道电化学工作站chi1000c。
58.使用20mm乙酸盐作为电子供体,在微生物燃料电池中接种菌株,以验证每个菌株的功率输出能力。如图5所示,wt在以乙酸盐作为唯一碳源时几乎不能产生任何电压输出,这说明wt不能利用乙酸盐产电。而工程菌株ace-3可以产生~50.2
±
1.3mv的最大输出电压。如图6所示,通过线性扫描伏安法(lsv)分析电子转移效率。ace-3菌株具有最佳电化学性能,峰值功率密度为8.3
±
1.2mw/m2,工程菌株可以快速降解乙酸盐,并且表现出更好的电化学性能。
59.本发明公开和提出的技术方案,本领域技术人员可借鉴本文内容,适当改变条件
路线等,尽管本发明的方法和制备技术已通过较佳实施例子进行了描述,相关技术人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和技术路线进行改动或重新组合,来实现最终的制备技术。特别需要指出的是,所有相类似的替换和改动对本领域技术人员来说是显而易见的,他们都被视为包括在本发明精神、范围和内容中。本发明未尽事宜属于公知技术。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1