希瓦氏菌中木糖和葡萄糖共利用代谢的构建方法
d-xylonate,kdx),然后产生α-酮戊二酸半醛(α-ketoglutarate semialdehyde,kgsa)。在最后一步,半醛被α-酮戊二酸半醛脱氢酶(kgsa dehydrogenase,kgsadh,由xyla(cc)编码)以nad(p)+依赖的方式被氧化成α-酮戊二酸进入三羧酸循环,参与代谢。
6.希瓦氏菌(shewanella oneidensis)属是一种兼性厌氧菌,遗传背景清晰,且易于操作。模式产电微生物-奥达奈希瓦氏菌(shewanella oneidensis mr-1简称mr-1,atcc编号:700550)是希瓦氏菌属中在基因组序列注释和遗传特性方面研究最广泛的菌株。该菌株能够在不添加外源媒介的情况下,将电子转移到微生物燃料电池中的阳极,成为研究微生物如何在mfc中产生电流的模式生物之一。野生型希瓦氏菌一般以乳酸为底物进行生长代谢,不能利用葡萄糖、木糖等糖类作为碳源代谢生长或产电,使得菌种可利用底物谱过窄,胞外电子传递效率较低。
7.本发明旨在通过异源表达技术,结合基因工程等手段,将葡萄糖利用代谢的关键基因和木糖利用代谢的weimberg代谢路径关键基因引入mr-1中,使希瓦氏菌能够在以葡萄糖为唯一碳源、木糖唯一碳源及葡萄糖-木糖混合碳源的改良后m9液体培养基中进行生长代谢,从而拓宽希瓦氏菌的可用底物谱。
技术实现要素:
8.为了解决现有技术的问题,本发明提出如下技术方案:
9.一种希瓦氏菌(shewanella oneidensis mr-1,简称mr-1)中木糖和葡萄糖共利用代谢的构建方法,采用biobrick的构建策略,利用同尾酶spei与xbai,处理后产生相同的粘性末端,在t4 dna连接酶的作用将木糖、葡萄糖转运蛋白基因及木糖weimberg代谢路径和葡萄糖代谢相关基因构建于同一个重组质粒表达载体上,将重组质粒通过物理转化、接合转移的方式导入到宿主菌s114中获得以葡萄糖、木糖唯一碳源及葡萄糖-木糖混糖为碳源共利用的工程希瓦氏菌株s163。
10.所述重组工程菌株构建方法,利用同尾酶spei(酶切位点:ctag)与xbai(酶切位点:ctag),处理后产生相同的粘性末端,在t4 dna连接酶的作用下将分别来自中间假丝酵母(candida intermedia,简称c.intermedia)的木糖转运蛋白的基因gxf1(seq id no.5)和来自新月丙杆菌(caulobacter crescentus,简称cc)的木糖weimberg代谢路径相关基因xylb(seq id no.6),xylc(seq id no.7),xyld(seq id no.8),xylx(seq id no.9),xyla(seq id no.10),来自大肠杆菌(escherichia coli,简称e.coli)的葡萄糖转运及代谢相关基因glf(seq id no.11),glk(seq id no.12),edd(seq id no.13)经过密码子优化后,按照gxf1-xylb-xylc-xyld-xylx-xyla-glf-glk-edd的顺序逐个连接到基础质粒pyydt(seq id no.1,pyydt添加有spei酶的酶切位点:ctag)上,上述基因通过pyydt上tac启动子(seq id no.2)和t1终止子(seq id no.3)表达,得到重组质粒(seq id no.14)。
11.所述重组工程菌株构建方法,所选重组质粒扩增菌株为escherichia coli dap营养缺陷型菌株(简称:e.coli wm3064,dap:2,6-二氨基庚二酸),最终宿主菌为s114(在mr-1基因组水平敲除转录抑制因子基因nagr,seq id no.4)。
12.所述重组工程菌株构建方法,将重组质粒导入扩增菌株e.coliwm3064的转化方法采用常规的物理转化法,然后通过将携带重组质粒的e.coliwm3064与宿主菌s114进行接合转移,最终将合成后的重组质粒转移到s114中,得到目标工程菌s163,导入基础质粒pyydt
(seq id no.1)的菌株命名为wt作为空白对照,利用菌落pcr进行验证。
13.所述重组工程菌株构建方法,利用恒温摇床摇瓶培养,紫外分光光度计,高效液相色谱仪(hplc),典型双室微生物燃料电池(microbial fuel cell,简称mfc),电化学工作站进行实验验证构建菌株利用木糖及葡萄糖代谢利用生长情况(见图4)及mfc产电效果(见图5)。
14.本发明的有益效果是:
15.本发明通过该重组质粒表达所实现的技术效果构建成功的重组希瓦氏工程菌s163,能够克服野生型mr-1不能够利用木糖或葡萄糖生长代谢并产电的限制,希瓦氏菌株能够以木糖或葡萄糖唯一碳源进行生长代谢,同时,也可以利用木糖和葡萄糖混合糖碳源进行生长代谢,从而拓宽希瓦氏的底物利用谱,同时提高木质纤维素水解物中木糖、葡萄糖等碳源的资源化利用率,并扩展了其应用范围,以纤维素为原料的水解液中木糖及葡萄糖等进行生物发酵制备产品或产电相关领域。
附图说明
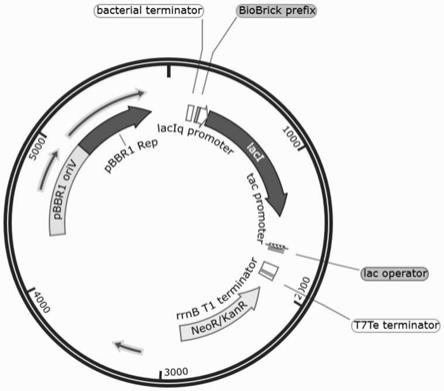
16.图1所示为pyydt质粒图谱,包括质粒表达载体中启动子、终止子等关键组件及名称;
17.图2所示为本发明构建的工程希瓦氏菌木糖和葡萄糖利用路径的设计原理图;
18.图3所示为本发明重组质粒构建示意图;
19.图4所示为本发明工程菌株在有氧条件下,以3g/l木糖+3g/l葡萄糖混合糖溶液为碳源的改良后m9液体培养基中生长曲线及糖消耗曲线:生长曲线为黑色,木糖糖耗曲线为浅灰色,木糖糖耗曲线为深灰色,其中a图为空白对照wt,b图为工程菌株s163利用3g/l木糖+3g/l葡萄糖混合糖溶液为碳源的改良后m9液体培养基中生长曲线及糖消耗曲线,c图为工程菌株s163利用3g/l葡萄糖溶液为唯一碳源的改良后m9液体培养基中生长曲线及糖消耗曲线,d图为工程菌株s163利用3g/l木糖糖溶液为唯一碳源的改良后m9液体培养基中生长曲线及糖消耗曲线,表明改造后的工程菌株都可利用木糖作为唯一碳源生长,葡萄糖为唯一碳源或木糖和葡萄糖混合碳源进行生长代谢,且s163木糖及葡萄糖利用能力显著,生长效果明显,而转入基础质粒pyydt的对照组菌株则不能利用木糖或葡萄糖为碳源生长;
20.图5所示为本发明工程菌株s163以加入3g/l木糖+3g/l葡萄糖混合糖溶液为碳源的改良后m9液体培养基mfc产电效果:a图为微生物燃料电池输出电压效果图,b图为微生物燃料电池功率密度和电流密度效果图,黑色表示:wt,深灰色表示s163,结果表明工程菌株s163具有利用木糖和葡萄糖混合糖为碳源产电能力,s163产电效果较空白对照wt提升明显;
21.图6所示为工程菌菌落pcr验证图:m为maker(1kb),a图:泳道1-8为工程重组菌株s163,重组质粒验证标志目的基因选择xylx(1155bp),b图:泳道1-4为wt,基础质粒验证标志基因为laci(1083bp)。
具体实施方式
22.本发明中设计的质粒是本实验室设计,菌株可市售获得。在全合成的本发明所需要的各外源基因过程中,需要将其连接到质粒载体上表达和保存。下面结合实施例,进一步
阐述本发明。
23.以pyydt为基础质粒构建一种重组质粒,在基础质粒上包括tac启动子、t1终止子,通过酶切连接方式依次将目的基因连接到包含tac启动子和t1终止子的基础质粒上,
24.获得1种重组质粒:pyydt-gxf1-xylb-xylc-xyld-xylx-xyla-glf-glk-edd(seq id no.14)
25.获得1种工程菌株为:s163:pyydt-gxf1-xylb-xylc-xyld-xylx-xyla-glf-glk-edd(in s114)
26.nagr:枯草芽孢杆菌的转录调控因子(gene id:64305260,seq id no.4)
27.glf:来自大肠杆菌k-12中的udp-吡喃半乳糖变位酶基因(gene id:945235,seq id no.11)
28.glk:来自大肠杆菌k-12中的葡萄糖激酶基因(gene id:946858,seq id no.12)
29.edd:来自大肠杆菌k-12中的磷酸葡萄糖酸脱水酶基因(gene id:946362,seq id no.13)
30.gxf1:来自中间假丝酵母的木糖转运蛋白的基因(genbank id:aj937350.1,seq id no.5)
31.xylb:来自新月丙杆菌的d-木糖脱氢酶基因(genbank id:mg681087.1,seq id no.6)
32.xylc:来自新月丙杆菌的d-木糖-γ-内酯内酯酶基因(genbank id:mg681088.1,seq id no.7)
33.xyld:来自新月丙杆菌的d-木糖酸脱水酶基因(genbank id:mg681089.1,seq id no.8)
34.xylx:来自新月丙杆菌的2-酮-3-脱氧-d-木糖酸脱水酶基因(genbank id:mg681090.1,seq id no.9)
35.xyla:来自新月丙杆菌的α-酮戊二酸半醛脱氢酶基因(genbank id:mg681091.1,seq id no.10)
36.具体说明如下:
37.步骤一:重组质粒的设计与合成:基础质粒为pyydt(seq id no.1),其上包含tac启动子(seq id no.2)和t1终止子(seq id no.3),将本发明所述目的基因gxf1、xylb、xylc、xyld、xylx、xyla、glf、glk、edd经密码子优化后,通过tac启动子和t1终止子表达,采用biobrick的构建策略,将使用snapgene设计好的重组质粒,进行核苷酸序列合成,利用同尾酶spei(酶切位点:ctag)与xbai(酶切位点:ctag),处理后留下相同的粘性末端,在t4dna连接酶的作用下将所需要的外源基因逐个连接到基础质粒上,并且保证已连接的外源基因不受后续内切酶的影响。在这两个启动子之间连接不同的基因,由此构建重组质粒,从而发挥不同的功能,合成重组质粒(seq id no.14);
38.步骤二:重组大肠杆菌e.coli wm3064和重组希瓦氏菌株的构建:选取e.coliwm3064为重组质粒扩增的工程菌,用于质粒复制或连接实验;选取s114为最终宿主菌,将重组质粒(seq id no.14)转化进入e.coli wm3064菌株的转化方法采用本领域常规的物理转化法;然后,利用接合转移技术将e.coli wm3064菌株携带的重组质粒(seq id no.14)转移到s114中,得到构建的目的工程菌。导入基础质粒(pyydt,seq id no.1)的野生
型菌株命名为wt作为空白对照,导入重组质粒到s114宿主菌的工程菌株命名为s163。
39.步骤三:进行菌落pcr验证实验:琼脂糖凝胶电泳结果表明,阳性克隆存在,证明目的基因在宿主菌中成功扩增,工程菌株中重组质粒的成功导入和扩增(见图6);
40.步骤四:有氧摇瓶培养发酵及残糖测定实验验证:重组希瓦氏工程菌wt,s163在含有浓度为3g/l木糖溶液、3g/l葡萄糖溶液或3g/l木糖+3g/l葡萄糖混合糖溶液的改良后m9培养液中摇瓶发酵,每隔6h(后期每隔12h)在超净工作台中取发酵液利用紫外分光光度计测定各菌株的od
600
并记录用于绘制工程菌株生长曲线,高效液相液相色谱仪(hplc)测定每个时间点样品中木糖含量用于绘制木糖及葡萄糖消耗曲线,数据表明:生长发酵24h后到达生长平台期,s163生物量(od
600
=1.616)是wt(od
600
=0.114)的14.18倍,培养基中的木糖在12h后消耗约24.13%,96h后消耗约72.4%,葡萄糖在12h后消耗约74.87%,24h内被消耗完毕(见图4)。
41.步骤五:工程菌mfc产电实验验证,重组希瓦氏工程菌wt,s163在含有浓度为3g/l木糖+3g/l葡萄糖混合糖溶液作为碳源的改良后m9培养液上电池验证其产电能力,数据表明:电压稳定后,工程菌株s163输出电压(133.16mv),是wt(10.83mv)的12.30倍,功率密度(137.7181mw/m2)是wt功率密度(6.7289mw/m2)的20.47倍(见图5)。
42.实施例1:重组质粒的构建(seq id no.14)
43.步骤一:合成tac启动子序列(seq id no.2),合成并优化上述能够促进希瓦氏摄取木糖及葡萄糖转运及代谢利用的的基因序列gxf1-xylb-xylc-xyld-xylx-xyla-glf-glk-edd。
44.步骤二:在这些目的基因的5’端添加xbai酶切位点(ctag),3’端添加sbfi酶切位点(tgca)。然后分别将这9个基因通过xbai和sbfi酶切后,连入添加有spei酶(酶切位点:ctag)的pyydt质粒中,得到过渡质粒:pyydt-gxf1质粒、pyydt-xylb质粒、pyydt-xylc质粒、pyydt-xyld质粒、pyydt-xylx质粒、pyydt-xyla质粒、pyydt-glf质粒、pyydt-glk质粒、pyydt-edd质粒。
45.步骤三:分别将pyydt-xylb质粒、pyydt-xylc质粒、pyydt-xyld质粒、pyydt-xylx质粒、pyydt-xyla质粒、pyydt-glf质粒、pyydt-glk质粒、pyydt-edd通过xbai和sbfi酶切后,获得目的基因:xylb(seq id no.6),xylc(seq id no.7),xyld(seq id no.8),xylx(seq id no.9),xyla(seq id no.10),glf(seq id no.11),glk(seq id no.12),edd(seq id no.13)。
46.步骤四:先将xylb基因与进行spei酶和sbfi酶切的pyydt-gxf1质粒用t4 dna连接酶连接,获得对应的pyydt-gxf1-xylb质粒,然后再将xylc基因与进行spei酶和sbfi酶切的pyydt-gxf1-xylb质粒用t4 dna连接酶连接获得pyydt-gxf1-xylb-xylc质粒,随后再将xyld基因与进行spei酶和sbfi酶切的pyydt-gxf1-xylb-xylc质粒用t4 dna连接酶连接获得pyydt-gxf1-xylb-xylc-xyld,之后再将xylx基因与进行spei酶和sbfi酶切的pyydt-gxf1-xylb-xylc-xyld质粒用t4 dna连接酶连接获得pyydt-gxf1-xylb-xylc-xyld-xylx质粒,然后再将xyla基因与进行spei酶和sbfi酶切的pyydt-gxf1-xylb-xylc-xyld-xylx质粒用t4 dna连接酶连接获得pyydt-gxf1-xylb-xylc-xyld-xylx-xyla,将glf基因与进行spei酶和sbfi酶切的pyydt-gxf1-xylb-xylc-xyld-xylx-xyla质粒用t4 dna连接酶连接获得pyydt-gxf1-xylb-xylc-xyld-xylx-xyla-glf,然后将glk基因与进行spei酶和sbfi酶切的
pyydt-gxf1-xylb-xylc-xyld-xylx-xyla-glf质粒用t4 dna连接酶连接获得pyydt-gxf1-xylb-xylc-xyld-xylx-xyla-glf-glk,最后将edd基因与进行spei酶和sbfi酶切的pyydt-gxf1-xylb-xylc-xyld-xylx-xyla-glf-glk质粒用t4 dna连接酶连接获得最终重组质粒pyydt-gxf1-xylb-xylc-xyld-xylx-xyla-glf-glk-edd(seq id no.14)。
47.上述构建的质粒转化入大肠杆菌感受态e.coli wm3064中,菌落pcr筛选,提质粒进行单双酶切验证以及测序验证,以保证目的片段连接正确且碱基序列未发生突变。
48.实施例2:重组大肠杆菌e.coli wm3064和重组希瓦氏菌株的构建
49.步骤一:转化:将上述得到的重组质粒通过物理转化法导入e.coli wm3064中,转化后采用lb+dap+kana平板(5g/l酵母提取物、10g/l胰蛋白胨、10g/lnacl、0.059g/l 2,6-二氨基庚二酸、50μg/l卡那霉素、15g/l琼脂粉)进行筛选,在平板上挑出单菌落后,接种到lb+dap+k液体培养基(5g/l酵母提取物、10g/l胰蛋白胨、10g/lnacl、0.059g/l 2,6-二氨基庚二酸、50μg/l卡那霉素)进行培养,甘油管保菌(500μl菌液,500μl甘油)
50.步骤二:接合转移:将转化后的各重组大肠杆菌e.coli wm3064分别接种到3ml液体培养基lb+dap+kana(5g/l酵母提取物、10g/l胰蛋白胨、10g/lnacl、0.059g/l 2,6-二氨基庚二酸、50μg/l卡那霉素)中培养,37℃,220rpm 10-12h;将s114宿主菌株接种到3ml液体lb培养基(5g/l酵母提取物、10g/l胰蛋白胨、10g/lnacl)中培养,30℃,200rpm 10-12h。
51.步骤三:将得到的重组大肠杆菌e.coli wm3064各种子液和s114等宿主菌株种子液各取500μl混合到一个1.5ml无菌ep管中,5000rpm下离心10min,倒掉上清液。用1ml lb+dap(5g/l酵母提取物、10g/l胰蛋白胨、10g/lnacl、0.059g/l 2,6-二氨基庚二酸)重悬,在30℃下静置2h。静置完成后5000rpm离心10min,倒掉上清液,用500μl lb液体(5g/l酵母提取物、10g/l胰蛋白胨、10g/lnacl)重悬,取50μl接种于lb+kana固体平板上(5g/l酵母提取物、10g/l胰蛋白胨、10g/l nacl、0.059g/l 2,6-二氨基庚二酸、15g/l琼脂粉)30℃培养箱中培养12小时以上,得到重组希瓦氏工程菌。
52.步骤四:菌落pcr进行验证:接合转移涂板的菌长出明显单菌落(直径大约0.5-1mm)后,准备菌落pcr,需要准备lb+kana平板,并画好格子做好标记。配制pcr体系,分装入96孔pcr板,可以比实际需要的多配2-5个体系,防止因枪头沾有溶液造成损失。准备足量的灭菌牙签。在超净台,一根牙签挑取一个单菌落,放入一个体系的孔中;挑完后,每根牙签在新平板-对应的格中划线接种,丢弃牙签。全部划完后,96孔pcr板用封板垫严密封口,放入pcr仪,设定参数,开始运行。平板放入30℃恒温培养箱(生长不少于10h,具体看菌落长势,长到一定程度可以用保鲜膜包好放4℃)。
53.引物设计并合成:
54.xylx引物:
55.上游引物:5
’‑
atgggtgtttctgaattcttacc-3’56.下游引物:5
’‑
ttataataaaccacgaccagct-3’57.laci引物:
58.上游引物:5
’‑
gtgaaaccagtaacgttatacg-3’59.下游引物:5
’‑
tcactgcccgctttcca-3’60.pcr反应体系配置(trans fast taq):ddh208μl;上、下游引物各1μl;taq酶mix:10μl;一个反应体系共20μl。
61.pcr条件为:94℃预变性5min,94℃变性30s,54℃退火30s,72℃延伸x s(1kb需30s,只能时间富裕不能不足),30cycles,最后72℃再延伸7min,4℃保温。
62.然后配好琼脂糖凝胶(1%),等待凝固后用于dna电泳鉴定。
63.大胶(100ml):1xtae缓冲液100ml,琼脂糖1.0g,适当冷却后加核酸染料8μl,摇匀倒入放好透明垫和梳子的槽。中胶50ml,小胶25ml,按比例加。
64.pcr结束后,加dnaloadingbuffer,点样,每孔各10μl,电泳10-15min。
65.观察有无目的条带并记录对应编号(见图6)。
66.将验证成功的重组希瓦氏工程菌保菌备用。
67.导入基础质粒(pyydt,seq id no.1)的野生型菌株命名为wt,向s114两种宿主菌中导入重组质粒后的工程菌株命名为s163。
68.实施例3:重组希瓦氏工程菌wt,s163在含有3g/l木糖+3g/l葡萄糖混合糖溶液改良后m9培养液中摇瓶发酵(有氧)
69.将所述工程菌wt,s163接种到种子培养基活化培养,然后在发酵瓶中进一步分别进行有氧发酵,并加入适量iptg诱导表达,每隔6h(后期每隔12h)在超净工作台中取发酵液用于测各菌株的od
600
并记录;用hplc(型号dgu-20a,示差检测器:rid-20a,色谱柱:aminex hpx-87h(300mm
×
7.8mm,9μm),流动相:5mm h2so4,流速0.3ml/min,柱温:65℃,进样量20μl)检测每次取样发酵液中的残糖含量,并选取导入基础质粒(pyydt seq id no.1)的野生型菌株wt作为对照,每株菌做三组平行实验(见图4)。
70.木糖及葡萄糖代谢生长曲线及残糖测定:
71.步骤一:菌种活化:取经过高压蒸汽灭菌的10ml ep管若干,在超净工作台分别加入3ml lb+kana的液体培养基,从长有目的菌株的固体培养基平板上挑取单菌落,接菌,30℃,200rpm/min,培养10-12h。
72.步骤二:摇瓶发酵:测定活化后菌液od
600
,并将各菌株调至同一生长状态,按1%接种至含有20ml 5
×
m9+10ml 30g/l的木糖溶液或葡萄糖溶液+100μlkana+50μl iptg,用无菌水补齐至100ml,将配置好的液体培养基在无菌操作台中装入250ml三角瓶中,30℃,200rpm/min进行发酵培养。
73.步骤三:测定0-96h发酵液的od
600
,记录数据,并每组留1ml发酵样液离心取上清过液相测残糖(预处理方法:12000rpm,离心15min,过0.22μm水系滤膜)。
74.步骤四:使用高效液相色谱分析预处理完毕的预留的每个时间节点的培养液中残余糖含量。
75.实施例4:重组希瓦氏工程菌wt,s163在含有3g/l木糖+3g/l葡萄糖混合糖溶液作为碳源的改良后m9培养液上电池验证其产电能力:
76.步骤一:一级种子菌液:在无菌超净台中分别挑取四株重组希瓦氏工程菌wt,s163接菌于装有3ml lb+kana液体培养基的10ml离心管中,30℃,200rpm,摇床培养10-12h。
77.步骤二:二级种子菌液:分别取装有100ml lb液体培养基的250ml锥形瓶,将四种重组希瓦氏工程菌一级菌液分别取出1ml菌液按1%接种至4个同样的锥形瓶中(若菌液不足,可每个菌株准备两瓶该种锥形瓶,制备200ml二级菌液即可)、每瓶加入50μl iptg(1:2000)、加入100μl kana(1:1000),30℃,200rpm,摇床培养10-12h。
78.步骤三:电池装置及试剂准备:
79.(1)电池装置:电池瓶身、盖子、垫圈*2、夹子、碳布、塞子(这7个需要高温高压灭菌:121℃,20min)、质子交换膜(通过1m hcl溶液浸泡,及超净台中紫外灯照射过夜灭菌,在超净台中组装)、电阻等(电池为100ml玻璃材质典型双室微生物燃料电池)
80.(2)试剂准备:阴极液、阳极液、5*m9、ddh2o、300mm木糖溶液等
81.1.碳布处理:阳极1
×
1cm,阴极2.5
×
3cm,用1m hcl浸泡8-12h,离子水冲洗三遍,使用丙酮浸泡过夜,ddh2o冲洗,在烘箱中烘干。
82.2.质子交换膜:用1m hcl浸泡8-12h,紫外灯灭菌过夜,ddh2o冲洗三遍
83.3.阳极液(1l):200ml 5*m9、100ml 30g/l木糖溶液、100ml 30g/l葡萄糖溶液、1ml 1mmgso4
·
7h2o、1ml 0.1m cacl2、1ml 4m naoh、iptg(1:2000)、kana(1:1000),用ddh2o补齐至1l。
84.4.阴极液(1l):16.45g k[fe(cn)3]、6.8g kh2po3、11.4g k2hpo3。
[0085]
5. 1m hcl溶液(1l):83ml 37%hcl溶液定容至1l,室温储存。(放置于通风橱中)
[0086]
6. 1m乳酸钠溶液(100ml):18.68g 60%乳酸钠溶液,ddh20定容至100ml,灭菌后降至室温,至于4℃冰箱存储。
[0087]
7. 1m mgso4溶液(100ml):24.65g mgso4·
7h2o,ddh20定容至100ml,灭菌后降至室温,至于4℃冰箱存储。
[0088]
8、0.1m cacl2溶液(100ml):1.109g cacl2,ddh20定容至100ml,灭菌后降至室温,至于4℃冰箱存储。
[0089]
9. 5
×
m9母液(1l):2.5g nacl、5gnh4cl、15g kh2po4、30g na2hpo4,灭菌。
[0090]
10. 4m naoh溶液(100ml):16g naoh固体溶解,并定容至100ml,0.22μm滤膜除菌。
[0091]
11.卡那霉素母液(50mg/ml):0.5g kana粉末,ddh2o定容至10ml,用0.22μm滤膜除菌,分装为1ml/管,-20℃保存。
[0092]
12.iptg母液(1m):1.9064g iptg、ddh2o定容至8ml,用0.22μm滤膜除菌,分装为100μl/管和200μl/管,-20℃保存。
[0093]
上述实验中,配制30g/l的木糖溶液及30g/l的葡萄糖溶液足量,在高温高压灭菌锅中115℃,灭菌15min,4℃保存待用;配制5
×
m9溶液足量,经过高压蒸汽灭菌(121℃,20min),冷却后4℃保存待用。
[0094]
步骤四:微生物电池组装完毕后,放入辰华chi1000c电化学工作站的30℃培养箱中运行,连接好数据采集卡进行电压数据采集。等待电池启动,待电压稳定后进行lsv曲线扫描,获得数据从而计算电池功率密度(见图5)。
[0095]
本发明利用异源表达技术,结合基因工程等手段,构建1种重组质粒(seq id no.14),将木糖摄取进入细胞并利代谢的关键基因:gxf1(seq id no.5),xylb(seq id no.6),xylc(seq id no.7),xyld(seq id no.8),xylx(seq id no.9),xyla(seq id no.10)及葡萄糖摄取进入细胞和代谢的关键基因:glf(seq id no.11),glk(seq id no.12),edd(seq id no.13)引入s114中,重构mr-1的代谢通路,使工程希瓦氏能够在以木糖为唯一碳源、葡萄糖唯一碳源及木糖和葡萄糖混合碳源的改良后m9液体培养基中进行生长代谢,从而拓宽希瓦氏菌底物利用谱。将改造菌株进行有氧发酵,并分别测定其在含有3g/l木糖和3g/l葡萄糖混合糖溶液为碳源的改良m9液体培养基中的生长曲线及残糖量。数据显示,有氧发酵过程中,导入基础质粒pyydt(seq id no.1)的对照菌株wt几乎不摄取代
谢木糖;构建的重组工程菌株s163携带重组质粒pyydt-gxf1-xylb-xylc-xyld-xylx-xyla-glf-glk-edd(in s114)能摄取一定量的木糖和葡萄糖,既能够摄取利用木糖,也可以摄取利用葡萄糖。
[0096]
菌株s163在3g/l葡萄糖+3g/l木糖混合糖为碳源的改良m9液体培养基中的有氧发酵生物量相对较高,且可以摄取利用的葡萄糖和木糖。s163有氧发酵24h后到达生长平台期,生物量(od
600
=1.616)是wt(od
600
=0.114)的14.18倍,培养基中的木糖在12h后消耗约24.13%,96h后消耗约72.4%(培养基中起始木糖浓度为3g/l,发酵96h后剩余木糖浓度为0.828g/l,见图4),葡萄糖在12h后消耗约74.87%,24h内被消耗完毕(培养基中起始葡萄糖浓度为3g/l,见图4);
[0097]
菌株s163在3g/l葡萄糖为唯一碳源的改良m9液体培养基中的有氧发酵生物量积累证明其可以摄取利用的葡萄糖,s163有氧发酵24h后到达生长平台期,生物量(od
600
=1.298)是wt(od
600
=0.115)的11.29倍,培养基中的木糖在12h后消耗约74.8%,24h内被消耗完毕(培养基中起始葡萄糖浓度为3g/l,见图4);
[0098]
菌株s163在3g/l木糖为唯一碳源的改良m9液体培养基中的有氧发酵生物量积累证明其可以摄取利用木糖。s163有氧发酵24h后到达生长平台期,生物量(od
600
=1.549)是wt(od
600
=0.113)的13.71倍,培养基中的木糖在12h后消耗约32.87%,24h内被消耗完毕(培养基中起始木糖浓度为3g/l,见图4)。
[0099]
重组工程菌株产电池数据表明:重组工程菌株s163在电压稳定后,输出电压(133.16mv),是wt(10.83mv)的12.30倍,功率密度(137.7181mw/m2)是wt功率密度(6.7289mw/m2)的20.47倍。(见图5)。可见:
[0100]
1、本发明利用异源表达技术,结合基因工程等手段,构建重组质粒(seq id no.14),将木糖代谢的关键基因引入mr-1中,得到能较好摄取利用木糖代谢的工程菌株:
[0101]
s163:pyydt-gxf1-xylb-xylc-xyld-xylx-xyla-glf-glk-edd(in s114)从而拓宽希瓦氏菌的底物利用谱。
[0102]
2、本发明拓宽了产电微生物mr-1的底物利用谱,木糖、葡萄糖作为木质纤维的水解产物和来源更广泛的糖,同时提高了木糖的资源化利用率及应用范围,为微生物燃料电池底物混合共利用的设计、生物发酵生产化学品、木质纤维素水解产物产电研究提供了技术支撑。
[0103]
本发明公开和提出的技术方案,本领域技术人员可通过借鉴本文内容,适当改变条件路线等环节实现,尽管本发明的方法和制备技术已通过较佳实施例子进行了描述,相关技术人员明显能在不脱离本
技术实现要素:
、精神和范围内对本文所述的方法和技术路线进行改动或重新组合,来实现最终的制备技术。特别需要指出的是,所有相类似的替换和改动对本领域技术人员来说是显而易见的,他们都被视为包括在本发明精神、范围和内容中。本发明未尽事宜属于公知技术。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1