作为透明质酸酶抑制剂的1,3-双取代吲哚类衍生物及其在美容产品中的应用的制作方法
1.本发明涉及一类1,3-双取代吲哚类衍生物及其制备方法,以及其对于透明质酸酶的抑制作用和用来制作美容产品的用途,属于化妆品领域。
背景技术:
2.透明质酸酶是降解透明质酸的关键酶,透明质酸酶通过裂解透明质酸的糖苷键来催化透明质酸降解形成单糖的反应。透明质酸酶可以根据起源和作用机制分为不同的类型。根据透明质酸酶的作用机制,将其分为3大类:第一类主要来源于哺乳动物,为内切-β-n-乙酰氨基葡糖苷酶,作用于β-1,4-糖苷键形成四糖;第二类主要来源于细菌,为内切-β-n-乙酰氨基葡糖苷酶,作用于β-1,4-糖苷键,通过β-消去机制得到4,5-不饱和双糖;第三类为主要来源于水蛭,为内切-β-葡糖苷酸酶,作用于β-1,3-糖苷键。透明质酸是构成皮肤细胞外基质(ecm)系统的主要成分之一,它是一个三维网络,具有维持皮肤结构和保留水分子等重要生理功能。已发表的皮肤病学研究表明,透明质酸酶的异常过度活跃可能导致皮肤表皮透明质酸的降解加剧,这是老化皮肤的组织化学标志。透明质酸-透明质酸酶的稳态是介导各种皮肤老化相关生理事件的关键因素,包括ecm结构完整性、皱纹形成和皮肤保湿。因此,透明质酸酶抑制剂被认为是具有潜在抗皮肤老化作用的有前途的药妆品,从而引起了相当多的研究兴趣。
3.迄今为止,大部分报道的透明质酸酶抑制剂都是天然产物及其类似物。目前被报道的合成透明质酸酶小分子抑制剂相对较少。几种合成吲哚、苯并恶唑和苯并咪唑衍生物被报道具有一定的抑制透明质酸酶的活性(图1),但是他们的抑制活性基本保持在ic
50
为几十微摩尔。对于这类化合物进行理性的修饰,从而提高其对于透明质酸酶的抑制,增强透明质酸酶抑制活性的吲哚类化合物可以用于制备化妆品,且作为抗皮肤老化作用的活性成分。
技术实现要素:
4.针对文献报道一些吲哚、苯并恶唑和苯并咪唑类化合物具有较弱的透明质酸酶抑制活性(图1),以吲哚为母核,对其结构进行优化,从而增强其衍生物对于透明质酸酶的抑制活性。本发明的主要目的在于提供一类1,3-双取代吲哚类衍生物及其制备方法和应用。本发明开发了一类1,3-双取代吲哚类衍生物,且其具有显著增强的透明质酸酶抑制活性,可用于开发抗皮肤衰老的美容产品。
5.为了达到此目的,本发明包括以下技术方案:
6.第一方面,本发明提供一种1,3-双取代吲哚类化合物,所述的结构如通式(i)所示:
[0007][0008]
其中,ra,rb,rc,rd,re各自独立选自氢、氘、氟、氯、溴、羟基、氨基、甲氧基、三氟甲基氧基、甲酰氨基、甲磺酰基、异丙磺酰基、甲磺酸酯基、异丙磺酸酯基、三氟甲基、c
1-8
烷基、c
2-8
链烯基、c
2-8
链炔基。
[0009]
上述c
1-8
是指取代基的碳原子数为1个、2个、3个、4个、5个、6个、7个、8个;c
2-8
是指取代基的碳原子数为2个、3个、4个、5个、6个、7个、8个。
[0010]
本发明所涉及的1,3-双取代吲哚类化合物是一类全新结构的化合物,且其体外具有较齐墩果酸明显增强的透明质酸酶抑制活性。因此可以用来制备抗皮肤衰老的化妆品。
[0011]
优选地,通式(i)中,ra,rb,rc,rd,re各自独立的选自氢、氘、氟、氯、溴、三氟甲基、c
1-4
烷基、c
2-4
链烯基。
[0012]
上述c
1-4
是指取代基的碳原子数为1个、2个、3个、4个;c
2-4
是指取代基的碳原子数为2个、3个、4个。
[0013]
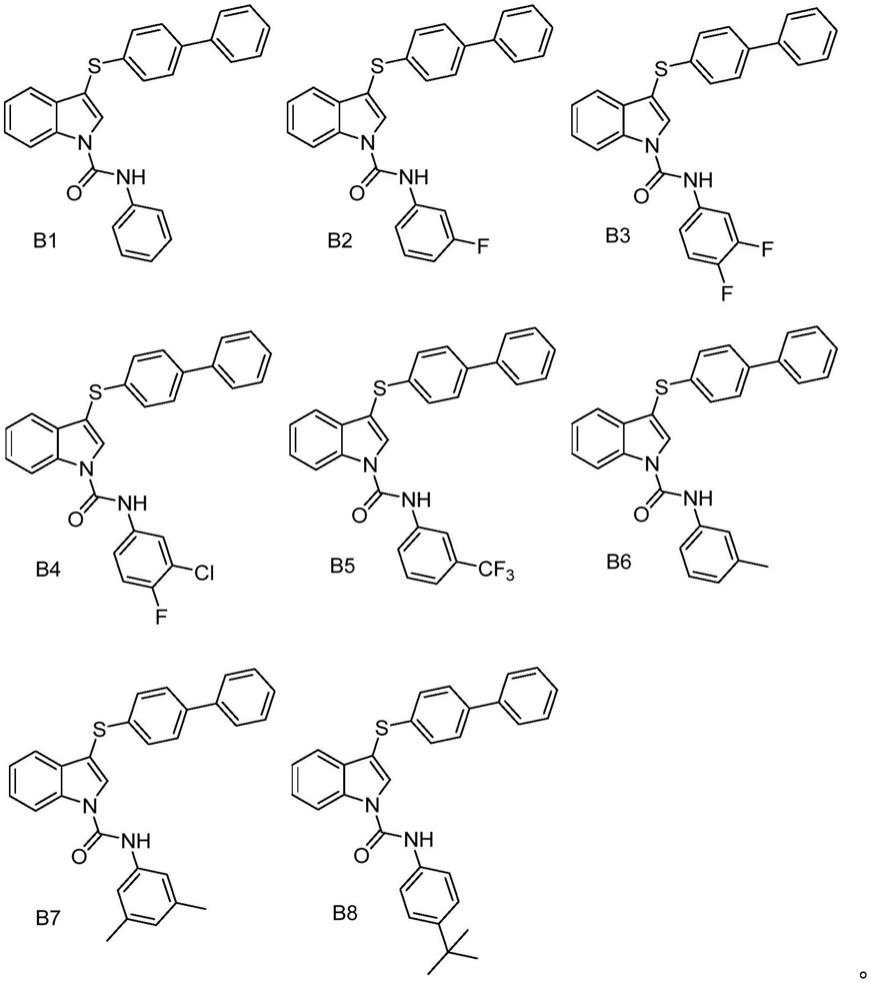
进一步优选地,所述1,3-双取代吲哚类化合物选自如下所述的化合物结构:
[0014]
[0015][0016]
第二方面,本发明提供一种化合物组合物,所述化合物组合物包含如上述第一方面所述的1,3-双取代吲哚类化合物、其立体异构体、其化学上可接受的盐的一种或多种吲哚;优选地,所述化合物组合物还包含化妆品领域可接受的辅料,例如载体、稀释剂、赋形剂、填充剂、粘合剂、润湿剂、崩解剂、乳化剂、助溶剂、增溶剂、渗透压调节剂、表面活性剂、着色剂、ph调节剂、抗氧剂、抑菌剂或缓冲剂等。
[0017]
本发明所涉及的1,3-双取代吲哚类化合物的化学上可接受的盐为1,3-双取代吲哚类化合物与选自如下的碱形成的盐:接受的有机碱包括二乙醇胺、乙醇胺、n-甲基葡糖
胺、三乙醇胺、氨丁三醇等;可接受的无机碱包括氢氧化铝、氢氧化钙、氢氧化钾、碳酸钠和氢氧化钠。
[0018]
第三方面,本发明提供1,3-双取代吲哚类化合物的制备方法:
[0019]
将等量的3-((1,1'-联苯)-4-硫基)-吲哚,alme3,混合反应1h,加入各种异氰酸酯,如反应16h,即得;其中取代基团ra,rb,rc,rd,re的限定范围与第一方面限定的范围一致;
[0020]
其反应式如下所示:
[0021][0022]
优选地,3-((1,1'-联苯)-4-硫基)-吲哚类化合物的制备方如下所述:
[0023]
吲哚、硫醇、tbhp在甲氰溶剂中混合,之后加入i2做催化剂,室温下继续反应,获得中间体3-((1,1'-联苯)-4-硫基)-吲哚,
[0024]
其反应式如下所示:
[0025][0026]
第四方面,本发明提供一种如第一方面所述的1,3-双取代吲哚类化合物,或者如第二方面所述的吲哚化合物组合物在制备通过抑制透明质酸酶活性而延缓皮肤衰老的化妆品中的用途。
[0027]
第五方面,本发明提供一种抗皮肤衰老类面膜,所述面膜包含如第一方面所述的化合物或如第二方面所述的化合物组合物,所述面膜的配方和重量份如下:
[0028]
a相:水92.68份、1,2-丁二醇2份、羟苯甲酯0.1份、卡波姆0.16份、羟乙基纤维素0.05份、edta二钠0.03份、透明质酸钠0.05份、1,2-己二醇0.4份、泛醇0.1份;
[0029]
b相:水3份、三乙醇胺0.12份;
[0030]
c相:如第一方面所述的化合物或如第二方面所述的化合物组合物0.1份、乙醇1份、苯氧乙醇0.1份
[0031]
d相:(日用)香精0.01份、peg-40氢化蓖麻油0.1份
附图说明
[0032]
图1,已经报道的合成类透明质酸酶小分子抑制剂。
具体实施方式
[0033]
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。对于以下全部实施例或制备例,可以使用本领域技术人员已知的标准操作和纯化方法。除非另有说明,所有温度以℃(摄氏度)表示,化合物的结构是通过核磁共振谱(nmr)和/或质谱(ms)来确定。
[0034]
对于以下全部实施例或制备例,化合物的结构是通过核磁共振氢谱(1h nmr)或质谱(ms)来确定的。核磁共振氢谱位移(δ)以百万分之一(ppm)的单位给出。核磁共振谱用mercury-400型核磁共振仪测定,氘代氯仿(cdcl3)作溶剂,四甲基硅烷(tms)或3-(三甲基硅基)氘代丙酸钠(tsm)为内标。
[0035]
电子天平采用日本yanaco ly-300型电子天平。
[0036]
柱层析使用200~300目或300~400目硅胶为载体。
[0037]
无水溶剂均通过标准方法处理。其它试剂均为市售分析纯分别购于sigma-aldrich西格玛奥德里奇(上海)贸易有限公司、北京伊诺凯科技有限公司、阿法埃莎(中国)化学有限公司、上海阿拉丁生化科技股份有限公司。制备例1:3-((1,1'-联苯)-4-硫基)-吲哚
[0038]
本制备例制备3-((1,1'-联苯)-4-硫基)-吲哚,合成路线为:
[0039][0040]
将吲哚(0.5mmol)、硫醇(0.505mmol)和tbhp(0.51mmol)混合溶解于mecn(2.0ml)中,并搅拌加热至60℃。然后向反应液中加入碘(0.10mmol,10mol%)。反应在室温下搅拌1小时,直到通过tlc监测起始材料完全消耗。通过加入饱和的na2s2o3淬灭反应。然后用etoac萃取,分离合并的有机层,mgso4进行干燥,过滤并真空浓缩,粗产物通过柱色谱纯化,使用石油醚/乙酸乙酯作为洗脱剂,得到3-((1,1'-联苯)-4-硫基)-吲哚,白色固体纯产物91.5mg(61%)。对产物进行如下表征:1h nmr(400mhz,cdcl3):δ.d 8.98(br s,1h),7.79(d,j=8.0hz,1h),7.64-7.54(m,1h),7.55-7.41(m,6h),7.38-7.28(m,4h),7.06-7.02(m,1h),6.92-6.84(m,1h);hr-ms(esi):[m+h]+c20h15ns计算值301.4070,实测值301.4021.
[0041]
实施例1:本实施例制备3-([1,1'-联苯]-4-硫基)-n-(苯基-甲酰胺基)-吲哚,其结构式如下:
[0042][0043]
在0℃下,取3ml,6.0mmol的alme3(2m在甲苯)滴加到含有3-((1,1'-联苯)-4-硫基)-吲哚(600mg,2.0mmol)的无水甲苯(6ml)。缓慢向其中在加入甲苯异氰酸酯(577mg,2.2mmol)。继续反应4个小时,且用tlc进行检测,然后用饱和nahco3溶液(8ml)淬灭,产物通过柱色谱法纯化,得到化合物302mg(36%),为白色固体。对产物进行如下表征:1h nmr(400mhz,cdcl3):δ9.97(br s,1h),7.79(d,j=5.0hz,1h),7.65(m,1h),7.63-7.41(m,8h),7.38-7.12(m,7h),7.09-7.05(m,1h),7.03-6.95(m,1h);hr-ms(esi):[m+h]+c27h21n2os计算值421.5380,实测值421.5361.
[0044]
实施例2:本实施例制备3-([1,1'-联苯]-4-硫基)-n-([3-氟-苯基]-甲酰胺基)-吲哚,其结构式如下:
[0045][0046]
在0℃下,取3ml,6.0mmol的alme3(2m在甲苯)滴加到含有3-((1,1'-联苯)-4-硫基)-吲哚(600mg,2.0mmol)的无水甲苯(6ml)。缓慢向其中在加入3-氟苯异氰酸酯(301mg,2.2mmol)。继续反应4个小时,且用tlc进行检测,然后用饱和nahco3溶液(8ml)淬灭,产物通过柱色谱法纯化,得到化合物302mg(36%),为白色固体。对产物进行如下表征:1h nmr(400mhz,cdcl3):δ9.97(br s,1h),7.78(d,j=5.0hz,1h),7.66(m,1h),7.61-7.43(m,8h),7.38-7.12(m,6h),7.09-7.05(m,1h),7.03-6.94(m,1h);hr-ms(esi):[m+h]+c27h20fn2os计算值439.5284,实测值439.5236.
[0047]
实施例3:本实施例制备3-([1,1'-联苯]-4-硫基)-n-([3,4-二氟-苯基]-甲酰胺基)-吲哚,其结构式如下:
[0048][0049]
在0℃下,取3ml,6.0mmol的alme3(2m在甲苯)滴加到含有3-((1,1'-联苯)-4-硫基)-吲哚(600mg,2.0mmol)的无水甲苯(6ml)。缓慢向其中在加入3,4-二氟苯异氰酸酯(341mg,2.2mmol)。继续反应4个小时,且用tlc进行检测,然后用饱和nahco3溶液(8ml)淬灭,产物通过柱色谱法纯化,得到化合物255mg(28%),为白色固体。对产物进行如下表征:1h nmr(400mhz,cdcl3):δ9.97(br s,1h),7.78(d,j=5.0hz,1h),7.66(m,1h),7.60-7.44(m,8h),7.40-7.11(m,5h),7.09-7.05(m,1h),7.03-6.94(m,1h);hr-ms(esi):[m+h]+c27h20fn2os计算值439.5284,实测值439.5236.
[0050]
实施例4:本实施例制备3-([1,1'-联苯]-4-硫基)-n-([3-氯,4-氟-苯基]-甲酰胺基)-吲哚,其结构式如下:
[0051][0052]
在0℃下,取3ml,6.0mmol的alme3(2m在甲苯)滴加到含有3-((1,1'-联苯)-4-硫基)-吲哚(600mg,2.0mmol)的无水甲苯(6ml)。缓慢向其中在加入3-氯,4-氟苯异氰酸酯(376mg,2.2mmol)。继续反应4个小时,且用tlc进行检测,然后用饱和nahco3溶液(8ml)淬灭,产物通过柱色谱法纯化,得到化合物236mg(25%),为白色固体。对产物进行如下表征:1h nmr(400mhz,cdcl3):δ9.97(br s,1h),7.78(d,j=5.0hz,1h),7.66(m,1h),7.60-7.46(m,8h),7.42-7.11(m,5h),7.09-7.05(m,1h),7.03-6.96(m,1h);hr-ms(esi):[m+h]+c27h19clfn2os计算值473.9703,实测值473.9725.
[0053]
实施例5:本实施例制备3-([1,1'-联苯]-4-硫基)-n-([3-三氟甲基-苯基]-甲酰胺基)-吲哚,其结构式如下:
[0054][0055]
在0℃下,取3ml,6.0mmol的alme3(2m在甲苯)滴加到含有3-((1,1'-联苯)-4-硫基)-吲哚(600mg,2.0mmol)的无水甲苯(6ml)。缓慢向其中在加入3-三氟甲基苯异氰酸酯(411mg,2.2mmol)。继续反应4个小时,且用tlc进行检测,然后用饱和nahco3溶液(8ml)淬灭,产物通过柱色谱法纯化,得到化合物370mg(38%),为白色固体。对产物进行如下表征:1h nmr(400mhz,cdcl3):δ9.97(br s,1h),7.78(d,j=5.0hz,1h),7.69(m,1h),7.64-7.43(m,8h),7.38-7.10(m,6h),7.09-7.05(m,1h),7.03-6.96(m,1h);hr-ms(esi):[m+h]+c27h20fn2os计算值489.1248,实测值489.1259.
[0056]
实施例6:本实施例制备3-([1,1'-联苯]-4-硫基)-n-([3-甲基-苯基]-甲酰胺基)-吲哚,其结构式如下:
[0057][0058]
在0℃下,取3ml,6.0mmol的alme3(2m在甲苯)滴加到含有3-((1,1'-联苯)-4-硫基)-吲哚(600mg,2.0mmol)的无水甲苯(6ml)。缓慢向其中在加入3-甲基苯异氰酸酯(292mg,2.2mmol)。继续反应4个小时,且用tlc进行检测,然后用饱和nahco3溶液(8ml)淬灭,产物通过柱色谱法纯化,得到化合物234mg(27%),为白色固体。对产物进行如下表征:1h nmr(400mhz,cdcl3):δ9.97(br s,1h),7.75(d,j=5.0hz,1h),7.64(m,1h),7.56-7.39(m,8h),7.27-7.09(m,6h),7.05-7.01(m,1h),6.95-6.89(m,1h),2.29(s,3h);hr-ms(esi):[m+h]+c28h23n2os计算值435.5650,实测值435.5621.
[0059]
实施例7:本实施例制备3-([1,1'-联苯]-4-硫基)-n-([3,4-二甲基-苯基]-甲酰胺基)-吲哚,其结构式如下:
[0060][0061]
在0℃下,取3ml,6.0mmol的alme3(2m在甲苯)滴加到含有3-((1,1'-联苯)-4-硫基)-吲哚(600mg,2.0mmol)的无水甲苯(6ml)。缓慢向其中在加入3,5-二甲基苯异氰酸酯(323mg,2.2mmol)。继续反应4个小时,且用tlc进行检测,然后用饱和nahco3溶液(8ml)淬灭,产物通过柱色谱法纯化,得到化合物179mg(20%),为白色固体。对产物进行如下表征:1h nmr(400mhz,cdcl3):δ9.97(br s,1h),7.75(d,j=5.0hz,1h),7.64(m,1h),7.59-7.32(m,6h),7.29-7.09(m,7h),7.05-7.01(m,1h),6.95-6.89(m,1h),2.29(s,6h);hr-ms(esi):[m+h]+c29h25n2os计算值449.5920,实测值449.5965.
[0062]
实施例8:本实施例制备3-([1,1'-联苯]-4-硫基)-n-([4-叔丁基-苯基]-甲酰胺基)-吲哚,其结构式如下:
[0063][0064]
在0℃下,取3ml,6.0mmol的alme3(2m在甲苯)滴加到含有3-((1,1'-联苯)-4-硫基)-吲哚(600mg,2.0mmol)的无水甲苯(6ml)。缓慢向其中在加入异氰酸-4-(叔丁基)苯酯(385mg,2.2mmol)。继续反应4个小时,且用tlc进行检测,然后用饱和nahco3溶液(8ml)淬灭,产物通过柱色谱法纯化,得到化合物233mg(26%),为白色固体。对产物进行如下表征:1h nmr(400mhz,cdcl3):δ9.98(br s,1h),7.79(d,j=5.0hz,1h),7.65(m,1h),7.63-7.41(m,8h),7.34-7.11(m,6h),7.07-7.01(m,1h),6.95-6.84(m,1h),2.28(s,9h);hr-ms(esi):[m+h]+c31h29n2os计算值477.6460,实测值477.6453.
[0065]
实施例9:透明质酸酶抑制活性筛选试验
[0066]
实验方法:透明质酸酶来源于牛睾丸,透明质酸酶抑制活性筛选参考文献(molecules,2020;25:1923)。值得注意的是,在低负离子条件下,长链透明质酸和透明质酸酶容易形成无活性的复合物,这会阻碍透明质酸酶的催化活性并干扰透明质酸酶抑制活性筛选试验。所以,在试验时应该避免添加过多的带正电荷的蛋白质从而干扰到缓冲液体系中的负离子浓度,这将恢复透明质酸酶的活性。具体试验时,在20mm pbs,ph 3.75中加入牛
血清白蛋白至终浓度为0.01%,此为制备好的反应缓冲液。将5μl的样品(浓度范围为1-400μg/ml)与95μl含有透明质酸酶(7.5u/ml)反应液混匀,在37℃下孵育10分钟。然后将100μl透明质酸加入到上述反应液中,在37℃下继续孵育45分钟。降解反应后,通过加入含有1ml的终止液(含有0.1%bsa,24mm乙酸钠和79mm乙酸,ph=3.75),混匀10分钟后,没有降解的透明质酸通过沉淀进行去除。使用pe酶标仪检测600nm波长处的吸光值。每个样品至少重复进行测试三次。化合物vcpal(l-ascorbic acid 6-hexadecanoate)是活性筛选对照化合物。
[0067]
通过下面公式计算样品对透明质酸酶的抑制活性:
[0068]
抑制活性(%)=[1
–
(od透明质酸
–
od样品)/(od透明质酸
–
od透明质酸酶)]
×
100%
[0069]
通过不同浓度的抑制活性计算ic
50
,采用软件graphpad prism 8.0进行计算。
[0070]
结果如下:体外透明质酸酶抑制活性筛选显示合成的1,3-二取代吲哚类衍生物具有较强的透明质酸酶抑制活性。其中化合物q5对于透明质酸酶的抑制活性ic
50
为2.1μg/ml,是这一系列中活性最强的抑制剂。化合物q4,q5的抑制活性较之齐墩果酸的抑制活性增强10倍以上。
[0071]
表1,各种化合物对透明质酸酶的抑制活性
[0072][0073]
实施例8:化合物皮肤渗透性的检测
[0074]
实验方法:本发明采用软件swissadme(http://www.swisadme.ch/)来进行皮肤渗透率的预测。具体操作遵照软件使用说明书进行计算。如下,将化合物的结构式或者smiles复制到软件窗口,经过计算获得与皮肤渗透率相关的常数,log k
p
。
[0075]
结果如下:
[0076]
结果如表2,我们采用计算机模拟的方法对上述化合物计算了其log k
p
,这一常数所得到的负数越大,代表化合物能够透过皮肤的可能性越小。根据计算的结果可以看到,8个1,3-双取代吲哚衍生物均有很好脂溶性,也即皮肤渗透效果,因此更适合用于皮肤涂抹抑制皮肤衰老。化合物b8具有最好的皮肤渗透效果,其他化合物的皮肤渗透性相似。
[0077]
表2:各种化合物计算获得的log k
p
[0078][0079]
实施例9:细胞毒性的筛选
[0080]
实验方法:
[0081]
采用cck-8试剂盒进行了化合物细胞毒性的检测。具体操作为,分别接种hepg2细胞、mcf-7细胞、a549细胞,到96孔板中,每孔约5000细胞/200μl培养液,细胞过夜培养。向每孔中加入不同浓度的待测化合物,继续培养48小时。向每孔中加入10μl的cck-8试剂,混匀后继续培养1-4小时,观察培养液颜色发生明显变化,采用酶标仪进行检测,测定450nm吸光值。紫杉醇为阳性对照物。
[0082]
结果如下:
[0083]
结果如表3,细胞实验检测发现,8个1,3-双取代吲哚衍生物均没有明显的细胞毒性。因此,这8个1,3-双取代吲哚衍生物适合用于制备美容产品。
[0084]
表3:各种化合物对于哺乳动物细胞的细胞毒性
[0085][0086]
[0087]
实施例10:化合物b5作为抗皮肤衰老成分制备美容面膜
[0088]
一种抗皮肤衰老面膜,其配方和重量份数如下:
[0089]
文中出现的化妆品成分名称均为inci(international nomenclature of cosmetic ingredients),即国际化妆品原料命名所规定的名称。
[0090]
结合化合物b5对于透明质酸酶的抑制活性,b5的细胞毒性,b5的皮肤渗透性,其选为抗皮肤衰老活性成分用于制备化妆品面膜。
[0091]
a相:水92.68份、1,2-丁二醇2份、羟苯甲酯0.1份、卡波姆0.16份、羟乙基纤维素0.05份、edta二钠0.03份、透明质酸钠0.05份、1,2-己二醇0.4份、泛醇0.1份;
[0092]
b相:水3份、三乙醇胺0.12份;
[0093]
c相:化合物b5 0.1份、乙醇1份、苯氧乙醇0.1份
[0094]
d相:(日用)香精0.01份、peg-40氢化蓖麻油0.1份
[0095]
制备方法,包括以下步骤:按照上述配方,称量各个组分,其中每个质量份为1g。将a相组分混合,均质5分钟(2000r/min)后搅拌加热至80℃,保持温度恒定80℃,继续搅拌5分钟;降温至45℃后边搅拌边加入b相,继续搅拌5分钟;加入c相和d相,继续搅拌混匀,冷却至25℃,灌装。
[0096]
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1