多因子培养免疫细胞的方法与流程
1.本发明属于生物技术领域,具体涉及多因子培养免疫细胞的方法。
背景技术:
2.免疫细胞治疗作为癌症治疗方面继手术、放化疗后又一治疗手段。就目前的效果来看,生物免疫疗法(dc-cik)、自然杀伤细胞(nk细胞)等治疗的效果有限且制备工艺复杂。dc-cik需采取患者大量的外周血单个核细胞(pbmc)来进行培养,对本来就虚弱的患者的免疫系统造成相当大的隐患。nk细胞虽然复制能力强,但是起始细胞量少,局限于nk细胞的杀伤力不足,使用效果较差,亟需一种拥有较强杀伤活性的nk细胞,以提高使用效果。
技术实现要素:
3.本发明的目的在于提供多因子培养免疫细胞的方法,以解决背景技术中的问题。
4.本发明的目的可以通过以下技术方案实现:
5.多因子培养免疫细胞的方法,包括如下步骤:
6.步骤1:采取新鲜外周血100ml,向外周血中加入淋巴分离液并置于离心管中,在2000r/min的条件下离心15-30min,分离获得pbmc和血浆;将抗体因子和辅助培养因子加入基础培养基中制备出复合培养基;
7.外周血和淋巴分离液的用量比为5ml:3ml;
8.步骤2:将血浆装入离心管并在56℃水浴的条件下灭活,然后离心去除杂质,备用;
9.步骤3:将pbmc用生理盐水洗涤2-3次,然后将洗涤后的pbmc与50ml复合培养基混合并接种于培养瓶中,置于co2培养箱,在温度为37℃和二氧化碳浓度5%的条件下培养;
10.步骤4:培养第三天向培养瓶中加入50ml复合培养基和4ml灭活后的血浆,放入co2培养箱继续培养。
11.步骤5:培养第五天向培养瓶中加入100ml复合培养基和8ml灭活后的血浆,放入co2培养箱继续培养。
12.步骤6:培养第七天,用移液枪将培养瓶中的细胞吹打均匀得到细胞悬液,将细胞悬液均匀分配到3个新的培养瓶中,并且分别在每个新的培养瓶中加入50ml复合培养基和4ml灭活后的血浆,继续放入co2培养箱进行扩大培养;
13.步骤7:培养第九天向扩大培养过程的3个培养瓶中分别加入80ml复合培养基,然后将剩余灭活后的血浆平均分配并加入各培养瓶中;
14.步骤8:第十一天收获细胞。
15.进一步地,复合培养基中包括基础培养基、gm-csf、tnf-α、il-4、il-2、ifn-γ、il-1α、pha-m和mdp。
16.进一步地,基础培养基为购买于宝日医公司,型号为gt-t551。
17.进一步地,gm-csf、tnf-α、il-4、il-2、ifn-γ和il-1α为抗体因子。
18.进一步地,pha-m和mdp为辅助培养因子。
19.进一步地,复合培养基中基础培养基、gm-csf、tnf-α、il-4、il-2、ifn-γ、il-1α、pha-m和mdp的用量比为500ml:1
×
105iu:5
×
104iu:5
×
103iu:3
×
104iu:1
×
105iu:1
×
104iu:5mg:0.01mg。
20.本发明的有益效果:
21.通过提取患者新鲜的外周血分离获得pbmc和血浆,然后扩增培养出nk细胞;在基础培养基中添加gm-csf、tnf-α、il-4、il-2、ifn-γ、il-1α等多种因子制备出复合培养基,用于nk细胞的培养,添加的多种因子对nk细胞的扩增影响较小,并且能够刺激nk细胞使其产生较长的时间记忆,使其对肿瘤细胞等靶细胞的杀伤活性更高,相较于普通培养的nk细胞拥有更好的使用效果。
附图说明
22.下面结合附图对本发明作进一步的说明。
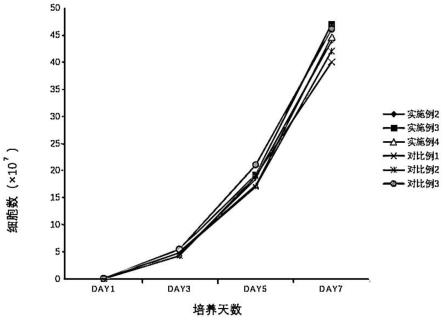
23.图1是本发明各组nk细胞培养过程中扩增情况的折线图;
24.图2是本发明检测对比nk细胞杀伤活性的柱状图。
具体实施方式
25.下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
26.实施例1
27.配制复合培养基,该复合培养基配方如表1所示:
28.表1
[0029][0030]
实施例2
[0031]
通过多因子培养免疫细胞,包括如下步骤:
[0032]
步骤1:采取新鲜外周血100ml,向外周血中加入60ml淋巴分离液并置于离心管中,在2000r/min的条件下离心15min,分离获得pbmc和血浆;
[0033]
步骤2:将血浆装入离心管并在56℃水浴的条件下灭活,然后离心去除杂质,备用;
[0034]
步骤3:使用实施例1中配制的复合培养基;将pbmc用生理盐水洗涤2次,然后将洗涤后的pbmc与50ml复合培养基混合并接种于培养瓶中,置于co2培养箱,在温度为37℃和二氧化碳浓度5%的条件下培养;培养第三天向培养瓶中加入50ml复合培养基和4ml灭活后的血浆,放入co2培养箱继续培养;培养第五天向培养瓶中加入100ml复合培养基和8ml灭活后的血浆,放入co2培养箱继续培养;
[0035]
步骤4:培养第七天,用移液枪将培养瓶中的细胞吹打均匀得到细胞悬液,将细胞悬液均匀分配到3个新的培养瓶中,并且分别在每个新的培养瓶中加入50ml复合培养基和4ml灭活后的血浆,继续放入co2培养箱进行扩大培养;培养第九天向扩大培养过程的3个培养瓶中分别加入80ml复合培养基,然后将剩余灭活后的血浆平均分配并加入各培养瓶中;第十一天收获细胞。
[0036]
实施例3
[0037]
通过多因子培养免疫细胞,包括如下步骤:
[0038]
步骤1:采取新鲜外周血100ml,向外周血中加入60ml淋巴分离液并置于离心管中,在2000r/min的条件下离心20min,分离获得pbmc和血浆;
[0039]
步骤2:将血浆装入离心管并在56℃水浴的条件下灭活,然后离心去除杂质,备用;
[0040]
步骤3:使用实施例1中配制的复合培养基;将pbmc用生理盐水洗涤2次,然后将洗涤后的pbmc与50ml复合培养基混合并接种于培养瓶中,置于co2培养箱,在温度为37℃和二氧化碳浓度5%的条件下培养;培养第三天向培养瓶中加入50ml复合培养基和4ml灭活后的血浆,放入co2培养箱继续培养;培养第五天向培养瓶中加入100ml复合培养基和8ml灭活后的血浆,放入co2培养箱继续培养;
[0041]
步骤4:培养第七天,用移液枪将培养瓶中的细胞吹打均匀得到细胞悬液,将细胞悬液均匀分配到3个新的培养瓶中,并且分别在每个新的培养瓶中加入50ml复合培养基和4ml灭活后的血浆,继续放入co2培养箱进行扩大培养;培养第九天向扩大培养过程的3个培养瓶中分别加入80ml复合培养基,然后将剩余灭活后的血浆平均分配并加入各培养瓶中;第十一天收获细胞。
[0042]
实施例4
[0043]
通过多因子培养免疫细胞,包括如下步骤:
[0044]
步骤1:采取新鲜外周血100ml,向外周血中加入60ml淋巴分离液并置于离心管中,在2000r/min的条件下离心30min,分离获得pbmc和血浆;
[0045]
步骤2:将血浆装入离心管并在56℃水浴的条件下灭活,然后离心去除杂质,备用;
[0046]
步骤3:使用实施例1中配制的复合培养基;将pbmc用生理盐水洗涤3次,然后将洗涤后的pbmc与50ml复合培养基混合并接种于培养瓶中,置于co2培养箱,在温度为37℃和二氧化碳浓度5%的条件下培养;培养第三天向培养瓶中加入50ml复合培养基和4ml灭活后的血浆,放入co2培养箱继续培养;培养第五天向培养瓶中加入100ml复合培养基和8ml灭活后的血浆,放入co2培养箱继续培养;
[0047]
步骤4:培养第七天,用移液枪将培养瓶中的细胞吹打均匀得到细胞悬液,将细胞
悬液均匀分配到3个新的培养瓶中,并且分别在每个新的培养瓶中加入50ml复合培养基和4ml灭活后的血浆,继续放入co2培养箱进行扩大培养;培养第九天向扩大培养过程的3个培养瓶中分别加入80ml复合培养基,然后将剩余灭活后的血浆平均分配并加入各培养瓶中;第十一天收获细胞。
[0048]
对比例1
[0049]
与实施例1相比,不添加抗体因子配制出复合培养基,然后按照实施例2中的步骤进行细胞培养。
[0050]
对比例2
[0051]
与实施例1相比,不添加辅助培养因子配制出复合培养基,然后按照实施例2中的步骤进行细胞培养。
[0052]
对比例3
[0053]
在实施例2步骤的基础上,不使用复合培养基,直接使用基础培养基进行细胞培养。
[0054]
在实施例2-实施例4和对比例1-对比例3中细胞培养的过程中,每次添加复合培养基时取2ml培养瓶中细胞并用细胞计数仪进行计数,记录数据。请参阅图1。由图1可知,培养过程中各组的细胞数相差较小,抗体因子和辅助培养因子对nk细胞的扩增影响较小。
[0055]
乳酸脱氢酶释放法检测nk细胞对肿瘤细胞的杀伤活性:
[0056]
试验材料:实施例2培养的nk细胞、对比例1培养的nk细胞、对比例2培养的nk细胞、对比例3培养的nk细胞、k562细胞株、10%fbs完全培养基、1%tritonx100、重组人白介素2、胰蛋白酶、dna蛋白酶、3h-tdr;
[0057]
试验方法:培养k562细胞株,取适量对数生长期的k562细胞并重悬,调节细胞浓度为2
×
105个/ml,使用96孔的平地培养板,每孔加入100μlk562细胞,分成4组每组24孔(分别标记为试验组1和试验组2、试验组3和对照组)。
[0058]
向试验组1的每孔加入100μl实施例2培养的nk细胞和100μl 10%pbs完全培养基:向试验组2的每孔加入100μl对比例1培养的nk细胞和100μl 10%pbs完全培养基;向试验组3的每孔加入100μl对比例2培养的nk细胞和100μl 10%pbs完全培养基;向对照组每孔加入100μl 10%pbs完全培养基;用co2培养箱在温度为37℃和二氧化碳浓度为5%的条件下培养6h,取出后在200g的重力条件下离心10min,每孔吸出150μl上清液并对应加入96孔酶联检测板中,并且向96孔酶联检测板的每孔中依次加入20μl0.4mol/l乳酸溶液、20μl 4mmol/l 2-(对碘苯基)-3-(对硝基苯)-5-苯基氯化四唑、20μl反应液(含0.03%bsa,2.7u/ml硫辛酰胺脱氢酶,4.5mmol/l氢化型辅酶i(nad+),1.2%蔗糖的pbs),在室温下放置20min。
[0059]
使用酶联检测仪器测定各孔的od值,检测波长492nm,参考波长650nm。
[0060]
记录数据并根据公式计算杀伤活性:
[0061][0062]
结果请参阅图2,由图2可知,试验组1的nk细胞杀伤活性更高。
[0063]
需要说明的是,在本文中,诸如术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要
素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
[0064]
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1