促进作物氮素利用的复合微生物菌剂、制备方法及应用与流程
1.本发明涉及微生物菌剂技术领域领域,特别是涉及促进作物氮素利用的复合微生物菌剂、制备方法及应用。
背景技术:
2.作物栽培过程中,氮素是影响生长发育和产量、品质的最重要元素。目前生产过程中往往通过大量施加氮肥以满足作物生长过程中对氮素的需求。但是作物对氮肥的利用效率仅仅只有10%-15%,其余大量的氮素随地下水流失或者转化为氮气回到大气中。
3.氮素再利用对于植物新生组织的发育尤为重要,在生殖生长期,超过50%的氮素来源于氮素的重新利用。提高作物的氮素利用效率以保障低氮肥投入下的作物生产和环境安全是未来可持续农业发展中的重要课题。
4.微生物在土壤中通过硝化作用和反硝化作用参与到氮素循环过程中。目前国内的复合微生物菌剂所选用的菌种单一,氮的转化效率低。
技术实现要素:
5.基于此,有必要针对传统的复合微生物菌剂所选用的菌种单一,功能缺乏多样性,转化效率低的问题,提供一种促进作物氮素利用的复合微生物菌剂、制备方法及应用。
6.本技术第一方面,提供一种促进作物氮素利用的复合微生物菌剂。促进作物氮素利用的复合微生物菌剂包括按质量百分含量计的如下组分:亚硝化螺菌发酵物20-30%、乳杆菌发酵物20-30%、酵母菌发酵物20-30%、黑曲霉发酵物10-20%和里氏木霉发酵物10-20%,其中,各所述发酵物包括相应的菌以及相应的所述菌产生的代谢物,各所述代谢物中均包括酶。
7.可选的,促进作物氮素利用的复合微生物菌剂包括按质量百分含量计的如下组分:亚硝化螺菌发酵物20%、乳杆菌发酵物30%、酵母菌发酵物30%、黑曲霉发酵物10%和里氏木霉发酵物10%。
8.本技术第二方面,提供一种上述的复合微生物菌剂的制备方法,包括以下步骤:
9.将活化的各细菌的种子、活化的各真菌的种子分别接种到对应发酵罐中,进行发酵;所述细菌包括亚硝化螺菌和乳杆菌,所述真菌包括酵母菌、黑曲霉以及里氏木霉;
10.将各所述发酵液根据权利要求1或2中各发酵物的重量百分数混合得到所述复合微生物菌剂;或将活化的各细菌的种子同时接种到发酵罐中发酵后,再将活化的各真菌的种子同时接种到同一所述发酵罐中共同发酵,发酵液作为所述复合微生物菌剂;所述细菌包括亚硝化螺菌和乳杆菌,所述真菌包括酵母菌、黑曲霉以及里氏木霉。
11.可选的,所述细菌的种子以及所述真菌的种子分别在第一培养基中活化1~2次,所述第一培养基包括:葡萄糖0.3g/l,酵母膏粉0.2g/l,kh2po40.01g/l,mgso40.01g/l,所述第一培养基的ph为5.5-6.0。
12.可选的,所述将活化的各细菌的种子、活化的各真菌的种子分别接种到对应发酵
罐中,进行发酵的步骤包括:
13.将活化的各细菌的种子、活化的各真菌的种子以10%(v/v)的接种浓度分别接种到对应发酵罐中,在35℃、溶氧浓度在60~100%的条件下在第一培养基中进行发酵,接种量为10%(v/v),所述第一培养基包括:葡萄糖0.3g/l,酵母膏粉0.2g/l,kh2po40.01g/l,mgso40.01g/l,所述第一培养基的ph为5.5-6.0;
14.发酵24h后,在各所述发酵罐中补充葡萄糖溶液,保持所述第一培养基中葡萄糖浓度为5-10g/l,继续发酵;
15.当总发酵时长达到72h,总发酵量为对应发酵罐容积的3/5时,停止发酵,得到相应菌的发酵液。
16.可选的,将各所述发酵液混合的步骤前还包括:
17.将各所述发酵液用水稀释至最终细胞密度为1
×
108cfu/ml。
18.可选的,所述将活化的各细菌的种子同时接种到发酵罐中发酵后,再将活化的各真菌的种子同时接种到同一所述发酵罐中共同发酵的步骤包括:
19.将活化的各细菌的种子以10%(v/v)的接种浓度接种到发酵罐中,在35℃、溶氧浓度在60~100%的条件下在第一培养基中进行发酵,所述第一培养基包括:葡萄糖0.3g/l,酵母膏粉0.2g/l,kh2po40.01g/l,mgso40.01g/l,所述第一培养基的ph为5.5-6.0;
20.发酵24h后,在所述发酵罐中补充葡萄糖溶液,保持所述第一培养基中葡萄糖浓度为5-10g/l,以0.5%(v/v)的接种浓度接种活化的各真菌的种子继续发酵;
21.当总发酵时长达到72h,总发酵量为发酵罐容积的3/5时,停止发酵,得到发酵液。
22.可选的,在所述活化的各细菌中,所述亚硝化螺菌和所述乳杆菌的接种比例为1~3:5~7;
23.在所述活化的各真菌中,所述酵母菌、黑曲霉和里氏木霉中的接种比例为1~3:1~5:1~5。
24.可选的,将曝气速率调整为1.0vvm(气体积/液体积/min),搅拌速率设置为50~150rpm,使得所述溶氧浓度在60~100%。
25.本技术第三方面,提供一种上述的复合微生物菌剂或上述的制备方法制得的复合微生物菌剂在作物栽培中的应用。
26.上述复合微生物菌剂中,含有包括细菌和真菌等多种微生物及其代谢产物和酶。亚硝化螺菌和乳杆菌为细菌,酵母菌、黑曲霉以及里氏木霉为真菌。细菌可以利用真菌分解纤维素后产生的葡萄糖生长,同时促进氮素转化并产生植物活性物质促进植物生长,因此具有所需营养条件低的优点。每种菌都有各自的侧重点,可以作到优势互补,因而具有功能及代谢产物多样,不拮抗,不容易被抑制等优点;且能促进铵态氮转化成亚硝态氮以及活化土壤中的难溶磷和钙使之变为有效态,提高宿主的氮吸收与氮代谢水平,促进作物的生长以及对营养物质的吸收。
附图说明
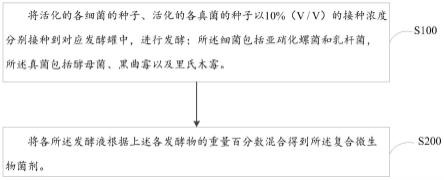
27.图1为本技术一实施方式的复合微生物菌剂的制备方法流程图。
具体实施方式
28.为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施的限制。
29.本技术第一方面,提供一种促进作物氮素利用的复合微生物菌剂,包括按质量百分含量计的如下组分:亚硝化螺菌发酵物20-30%、乳杆菌发酵物20-30%、酵母菌发酵物20-30%、黑曲霉发酵物10-20%和里氏木霉发酵物10-20%,其中,各所述发酵物包括相应的菌以及相应的所述菌产生的代谢物,各所述代谢物中均包括酶。
30.在原材料选用方面:乳杆菌是细菌中的一个常见种,广泛分布于世界各地的粮食、植物性产品和土壤中,是重要的发酵工业菌种,可分解氨气,生产淀粉酶、酸性蛋白酶、纤维素酶、果胶酶、葡萄糖氧化酶、柠檬酸和葡糖酸等。
31.酵母菌、里氏木霉和黑曲霉在生产过程中产酶的同时不产毒素,可以产生多种代谢产物,加速氮素转化,活化土壤,促进作物生产。亚硝化螺菌是土壤中的氨氧化细菌,是一类化能自养型微生物,对植物没有特异性,利用氨作为底物,在氨氧化酶和羟胺氧化还原酶的作用下将氨氧化为亚硝酸盐,并能够产生植物活性物质,促进作物生长。
32.在菌种搭配方面:由于土壤里的微生物相对复杂,使用单一菌容易被土壤某些微生物拮抗,导致菌剂效果不理想,因此本发明根据不同微生物的生长特性和功能特性,将黑曲霉,里氏木霉和酵母菌和氨氧化微生物进行合理搭配,菌种之间无拮抗,黑曲霉、里氏木霉和酵母菌同属于真菌,都可以产生纤维素酶、蛋白酶、淀粉酶及小分子有机酸等,降低被抑制的概率。且黑曲霉产酸能力较强,具有溶磷,溶钙的作用,可以更好的溶解土壤里的矿物养分,供作物和其它微生物使用。里氏木霉产纤维素酶能力明显优于其它真菌,可以为别的微生物提供好的碳源。细菌可以利用真菌分解纤维素后产生的葡萄糖生长,同时促进氮素转化并产生植物活性物质促进植物生长。每种菌都有各自的侧重点,可以作到优势互补。此外,本发明的复合微生物菌剂既包含菌也包含该菌产生的各种酶和其它代谢物(例如,有机酸),酶等代谢物可以进入土壤后可立即发挥作用,将土壤的有机大分子如纤维素等分解为小分子,促进菌体生长。
33.与现有技术相比,本发明具有以下有益效果:(1)本发明提供的复合微生物菌剂,含有包括细菌和真菌等多种微生物及其代谢产物和酶,具有所需营养条件低,功能及代谢产物多样,不拮抗,不容易被抑制等优点。且能促进铵态氮转化成亚硝态氮以及活化土壤中的难溶磷和钙使之变为有效态,提高宿主的氮吸收与氮代谢水平,促进作物的生长以及对营养物质的吸收。(2)本发明能有效提高土壤有益微生物群落的数量和种类,能在植物的根际周围形成保护层,防止病原微生物对植物的侵袭。(4)本发明提供的复合微生物菌剂产生的活性物质能够促进作物生长,达到增产提质的作用。
34.可选地,包括按质量百分含量计的如下组分:亚硝化螺菌发酵物20%、乳杆菌发酵物30%、酵母菌发酵物30%、黑曲霉发酵物10%和里氏木霉发酵物10%。。在该条件下,可以进一步提高宿主的氮吸收与氮代谢水平,促进作物的生长以及对营养物质的吸收。
35.本技术第二方面,提供一种复合微生物菌剂的制备方法。上述复合微生物菌剂可以通过各细菌、各真菌分别发酵,然后将发酵液混合的方式制备。在其中一些实施例中,参
见图1,该制备方法包括以下步骤:
36.s100:将活化的各细菌的种子、活化的各真菌的种子以10%(v/v)的接种浓度分别接种到对应发酵罐中,进行发酵;所述细菌包括亚硝化螺菌和乳杆菌,所述真菌包括酵母菌、黑曲霉以及里氏木霉。
37.s200:将各所述发酵液根据上述各发酵物的重量百分数混合得到所述复合微生物菌剂。
38.在该情形下,亚硝化螺菌和乳杆菌、酵母菌、黑曲霉以及里氏木霉分别培养得到相应的发酵液,然后将各发酵液按照质量百分数混合得到复合微生物菌剂。
39.上述实施例中复合微生物菌剂为分别培养的方法制备,也可以通过细菌、真菌共培养的体系制备,在另一些实施例中,该制备方法包括以下步骤:
40.将活化的各细菌的种子同时接种到发酵罐中发酵后,再将活化的各真菌的种子同时接种到同一发酵罐中共同发酵,发酵液作为所述复合微生物菌剂;所述细菌包括亚硝化螺菌和乳杆菌,所述真菌包括酵母菌、黑曲霉以及里氏木霉。
41.可选地,所述细菌的种子以及所述真菌的种子分别在第一培养基中活化1~2次,第一培养基包括:葡萄糖0.3g/l,酵母膏粉0.2g/l,kh2po40.01g/l,mgso40.01g/l,所述第一培养基的ph为5.5-6.0。
42.可将细菌和真菌的各菌种分别接种至第一培养基中,置于摇床(120rpm,35℃)中培养,从而进行活化。该培养基可使细菌或真菌的活力强,移种发酵后,能够迅速生长,从而缩短发酵时间、保证生产水平也有帮助。
43.可选地,所述将活化的各细菌的种子、活化的各真菌的种子分别接种到对应发酵罐中,进行发酵的步骤包括:
44.将活化的各细菌的种子、活化的各真菌的种子分别接种到对应发酵罐中,在35℃、溶氧浓度在60~100%的条件下在第一培养基中进行发酵,接种量为10%(v/v),第一培养基包括:葡萄糖0.3g/l,酵母膏粉0.2g/l,kh2po40.01g/l,mgso40.01g/l,所述第一培养基的ph为5.5-6.0;
45.发酵24h后,在各所述发酵罐中补充葡萄糖溶液,保持所述第一培养基中葡萄糖浓度为5-10g/l,继续发酵;
46.当总发酵时长达到72h,总发酵量为3l时,停止发酵,得到相应菌的发酵液。
47.在该制备方法中,活化的各细菌的种子、活化的各真菌的种子分别接种到各自的发酵罐中进行纯培养。例如分别接种到5l发酵罐中进行发酵,接种量为10%(v/v),发酵总时长为72h,总发酵量为3l。在35℃条件下,使溶氧(do)浓度保持在60~100%左右,发酵24h后,将高浓度无菌葡萄糖溶液(50%),通过蠕动泵送入发酵罐中进行补料,维持培养基中葡萄糖浓度为5-10g/l,发酵过程中没有调整发酵液ph值。具体地,可以通过发酵罐上的传感器测定ph值和do;每6h记录一次ph值、细胞密度和do值,用血球板计数法在显微镜下计算细胞密度。微生物细胞用石炭酸红染料染色2分钟后,在显微镜1000
×
下观察。
48.可选地,将各所述发酵液混合的步骤前还包括:
49.将各所述发酵液用水稀释至最终细胞密度为1
×
108cfu/ml。
50.发酵产物可用无菌去离子水稀释至最终细胞密度为1
×
108cfu/ml(菌落形成单位/ml)。
51.可选地,所述将活化的各细菌的种子同时接种到发酵罐中发酵后,再将活化的各真菌的种子同时接种到发酵罐中共同发酵的步骤包括:
52.将活化的各细菌的种子以10%(v/v)的接种浓度接种到发酵罐中,在35℃、溶氧浓度在60~100%的条件下在第一培养基中进行发酵,所述第一培养基包括:葡萄糖0.3g/l,酵母膏粉0.2g/l,kh2po40.01g/l,mgso40.01g/l,所述第一培养基的ph为5.5-6.0;
53.发酵24h后,在所述发酵罐中补充葡萄糖溶液,保持所述第一培养基中葡萄糖浓度为5-10g/l,以0.5%(v/v)的接种浓度接种活化的各真菌的种子继续发酵;
54.当总发酵时长达到72h,总发酵量为对应发酵罐容积的3/5时,停止发酵,得到发酵液。如,当发酵罐的容积为5l时,总发酵量为3l时,停止发酵。
55.在该制备方法中,活化的各细菌的种子、活化的各真菌的种子先后接种到同一发酵罐中进行共培养。先将所有细菌种子液接入发酵罐中发酵24h,然后按接种浓度为0.5%(v/v)接入真菌种子液到的细菌发酵系统中。
56.可选地,在所述活化的各细菌中,所述亚硝化螺菌和所述乳杆菌的接种比例为1~5:1~5;
57.在所述活化的各真菌中,所述酵母菌以及黑曲霉和里氏木霉中的一者的接种比例为1~5:1~5。
58.可选地,将曝气速率调整为1.0vvm(气体积/液体积/min),搅拌速率设置为50~150rpm,使得所述溶氧浓度在60~100%。
59.本技术第三方面,提供一种上述的复合微生物菌剂或上述的制备方法制得的复合微生物菌剂在作物栽培中的应用。例如,可应用于烤烟的栽培。
60.上述复合微生物菌剂中,含有包括细菌和真菌等多种微生物及其代谢产物和酶。亚硝化螺菌和乳杆菌为细菌,酵母菌、黑曲霉以及里氏木霉为真菌。细菌可以利用真菌分解纤维素后产生的葡萄糖生长,同时促进氮素转化并产生植物活性物质促进植物生长,因此具有所需营养条件低的优点。每种菌都有各自的侧重点,可以作到优势互补,因而具有功能及代谢产物多样,不拮抗,不容易被抑制等优点;且能促进铵态氮转化成亚硝态氮以及活化土壤中的难溶磷和钙使之变为有效态,提高宿主的氮吸收与氮代谢水平,促进作物的生长以及对营养物质的吸收。
61.以下结合具体实施例,对本技术的技术方案进行描述。
62.实施例1
63.将亚硝化螺菌、乳杆菌、酵母菌、黑曲霉以及里氏木霉分别接种至第一培养基中,置于摇床(120rpm,35℃)中培养,从而进行活化。第一培养基包括:葡萄糖0.3g/l,酵母膏粉0.2g/l,kh2po40.01g/l,mgso40.01g/l,所述第一培养基的ph为5.5-6.0。
64.将活化的各细菌的种子、活化的各真菌的种子分别接种到对应发酵罐中在第一培养基中进行纯培养,接种量为10%(v/v)。在35℃条件下,曝气速率调整为1.0vvm(气体积/液体积/min),搅拌速率为50~150rpm,使溶氧(do)浓度保持在60~100%左右,进行发酵。
65.发酵24h后,将高浓度无菌葡萄糖溶液(50%),通过蠕动泵送入发酵罐中进行补料,维持培养基中葡萄糖浓度为5-10g/l,继续发酵;
66.当总发酵时长达到72h,总发酵量为3l时,停止发酵,得到相应菌的发酵液。
67.将各发酵液发酵产物用无菌去离子水稀释至最终细胞密度为1
×
108cfu/ml。混合
得到促进作物氮素利用的复合微生物菌剂。该复合微生物菌剂包括按质量百分含量计的如下组分:亚硝化螺菌发酵物20%、乳杆菌发酵物30%、酵母菌发酵物30%、黑曲霉发酵物10%和里氏木霉发酵物10%。
68.实施例2
69.同实施例1不同之处在于,复合微生物菌剂包括按质量百分含量计的如下组分:亚硝化螺菌发酵物30%、乳杆菌发酵物20%、酵母菌发酵物20%、黑曲霉发酵物20%和里氏木霉发酵物20%。其余同实施例1。
70.实施例3
71.同实施例1不同之处在于,复合微生物菌剂包括按质量百分含量计的如下组分:亚硝化螺菌发酵物15%、乳杆菌发酵物25%、酵母菌发酵物25%、黑曲霉发酵物15%和里氏木霉发酵物20%。其余同实施例1。
72.实施例4
73.将亚硝化螺菌、乳杆菌、酵母菌、黑曲霉以及里氏木霉分别接种至第一培养基中,置于摇床(120rpm,35℃)中培养,从而进行活化。第一培养基包括:葡萄糖0.3g/l,酵母膏粉0.2g/l,kh2po40.01g/l,mgso40.01g/l,所述第一培养基的ph为5.5-6.0。
74.将活化的各细菌的种子、活化的各真菌的种子分别接种到对应发酵罐中在第一培养基中进行纯培养,接种量为10%(v/v)。在35℃条件下,曝气速率调整为1.0vvm(气体积/液体积/min),搅拌速率为50~150rpm,使溶氧(do)浓度保持在60~100%左右,进行发酵。
75.发酵24h后,将高浓度无菌葡萄糖溶液(50%),通过蠕动泵送入发酵罐中进行补料,维持培养基中葡萄糖浓度为5-10g/l,以0.5%(v/v)的接种浓度接种活化的各真菌的种子继续发酵。在所述活化的各真菌中,所述酵母菌、黑曲霉和里氏木霉中的接种比例为1~3:1~5:1~5。
76.当总发酵时长达到72h,总发酵量为发酵罐容积的3/5时,停止发酵,得到发酵液。将发酵液发酵产物用无菌去离子水稀释至最终细胞密度为1
×
108cfu/ml,得到促进作物氮素利用的复合微生物菌剂。经测得复合微生物菌剂包括按质量百分含量计的如下组分:亚硝化螺菌发酵物20%、乳杆菌发酵物30%、酵母菌发酵物30%、黑曲霉发酵物10%和里氏木霉发酵物10%。
77.应用实施例
78.试验地点为湖南农业大学耘园试验基地,供试品种为烟草k326。供试土壤类型为水稻土。试验于2021年3月-7月进行。烟草植株移栽时间为2021年3月28日。试验共设计2个处理(施加与不施加实施例1的复合微生物菌剂),每个处理30个盆。盆口上口径35cm,高35cm,每盆装土10kg。微生物功能菌剂施用方式为灌根。施用时期为伸根期。并保证施加与不施加菌剂处理间其他农艺措施相同且按照当地优质烟叶生产技术规范进行。施加菌剂处理中,烟草植株每株20ml菌剂稀释10倍后灌根。
79.测定项目:在菌剂施用后80d分别选取具有代表性烟株,测定6株烟农艺性状,包括株高、茎围、有效叶数、最大叶长与最大叶宽等。破坏性取样,测定烟株根系鲜重、活力与体积,烘干后测定根系干物质量,包括样品中硝态氮、铵态氮、总氮,以及有机氮的含量,包括氨基酸、叶绿素和烟碱的浓度。将整株烟拔出后先将块状土抖落,然后用细刷将根际土壤收集,土壤分为两份,一部分用于分子生物学实验,一部分用于测定土壤理化性质,包括ph、有
机质、土壤可溶性碳、有机碳、总碳、硝态氮、铵态氮、总氮的浓度,研究在不同施用时期喷施不同浓度菌剂对土壤氮素高效转化和对烟草氮素高效利用的影响。
80.实验结果:菌剂施用后,在烟草各项农艺性状方面,施加菌剂的实验组皆显著优于不施加菌剂的对照组:菌剂施用后,根重由对照的11.29
±
1.62g,增为12.13
±
4.03g;茎重由对照的36.63
±
5.11g,增为43.80
±
12.54g;叶重由对照的95.35
±
8.91g,增为97.92
±
11.88g;叶数由对照的16.40
±
1.14,增为17.8
±
2.77;叶长由对照的62.29
±
2.82cm,增为63.25
±
3.53cm;叶宽由对照的17.71
±
2.11cm,增为18.55
±
1.66cm;株高由对照的109.00
±
9.12cm,增为113.42
±
14.02cm;茎围由对照的5.68
±
0.13cm,增为6.04
±
0.30cm。土壤ph值无明显变化,土壤有机质含量由对照的24.11
±
0.61g/kg增为26.43
±
0.94g/kg,全氮含量由对照的1.34
±
0.05g/kg增为1.41
±
0.09g/kg,全磷含量由对照的0.50
±
0.05g/kg增为0.56
±
0.03g/kg,全钾含量由对照的14.00
±
0.55g/kg增为14.93
±
0.61g/kg,速效氮含量由对照的89.72
±
4.22mg/kg增为92.30
±
6.22mg/kg,速效磷含量由对照的45.75
±
7.04mg/kg增为50.43
±
4.26mg/kg,速效钾含量由对照的44.35
±
7.04mg/kg增为48.35
±
2.33mg/kg。
81.可见本技术的复合微生物菌剂具有促进氮素转化并产生植物活性物质促进植物生长,因此具有所需营养条件低的优点,并且且能促进铵态氮转化成亚硝态氮以及活化土壤中的难溶磷和钙使之变为有效态,提高宿主的氮吸收与氮代谢水平,促进作物的生长以及对营养物质的吸收。
82.以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1