基于CH3结构域的异二聚体分子、其制备方法及用途与流程
基于ch3结构域的异二聚体分子、其制备方法及用途
1.本技术是申请日2016年12月16日、申请号为201680073286.3、发明名称为“基于ch3结构域的异二聚体分子、其制备方法及用途”的中国专利申请的分案申请。
技术领域
2.本技术所述发明属于抗体工程领域,具体涉及基于ch3结构域的异二聚体分子、其制备方法及用途。
背景技术:
3.单克隆抗体药物在近十五年内增长迅速,成为制药行业的成长点。自1996年起,一共有30个左右单抗药物被批准上市,其中有九个单抗药物年销售额超过十亿美元。2010年单抗药物总销售额超过300亿美元,并且年增长率超过10%。由于单克隆抗体的靶标特异性强,因此只能抑制单一靶点。然而,在多种疾病中,包括肿瘤、自体免疫性疾病等,需要抑制多重信号通路来避免代偿效应。对于病毒感染疾病,由于病毒的高突变率,往往需要抑制多抗原位点来防止逃逸。另外,双功能抗体、蛋白被用于特异激活人体免疫系统(wolf,hofmeister et al.2005)。
4.众所周知,抗体的可结晶片段(fc)区形成同二聚体,同时fc对维持抗体和fc融合蛋白的体内稳定性起关键作用。通过改造fc使之形成异二聚体是产生多功能抗体、蛋白,并且维持其体内稳定性的有效方法。
5.异二聚体的一个典型应用的例子是双特异抗体,双特异抗体(bispecific antibody,bsabs)是含有两个不同配体结合位点的免疫球蛋白分子。双特异抗体至少可以对两个不同抗原具有活性(carter 2001),它取代了经典的抗体中fab两臂相同的形式,而是采用具有不同序列的fab两臂形式,因此y型两臂可以结合不同的抗原。双特异抗体在癌症治疗中的应用已经被多篇文献所综述(carter 2001;chames and baty 2009;chames and baty 2009)。
6.自然状态下不存在双特异性抗体,只能通过特殊方法进行制备。以往双特异抗体的制备方法有化学交联法,杂合f(ab')2分子法和鼠杂交瘤法等。化学交联法生产的双特异抗体的异源性,各批次间产品的不稳定性,以及抗体特异性易受某些修饰或不当连接而改变的特性,使得通过该方法生产的双特异抗体不适于体内使用。以巯基交联蛋白酶消化片段f(ab')生产的双特异杂交分子,成分虽较均一,但费时费力,且产量很低。杂交瘤法生产的双特异抗体,来源可靠,但由轻链、重链随机配对会产生多种可能的抗体形式,使得双特异抗体生产、纯化变得非常困难。
7.早在20世纪90年代,carter等人用“把手-孔洞”(knob into hole)模型改造抗体重链的部分氨基酸,比较成功地实现了双特异抗体的制备(ridgway,presta et al.1996;carter 2001)。“把手-孔洞”模型最初是由crick提出,并用来解决相邻的α-螺旋之间的氨基酸侧链折叠问题(crick 1952)。carter等在fc区第一条重链的ch3区域上通过将一个侧链小的氨基酸突变成一个侧链大的氨基酸而创造出了一个“把手”(如t366y),并将第二条
重链上的ch3上的某些氨基酸突变成了侧链小的氨基酸创造出了“孔洞”(y407t等)。“把手-孔洞”模型的原理是“把手-孔洞”的相互作用支持异二聚体的形成,而“把手-把手”模型及“孔洞-孔洞”模型阻碍同二聚体的形成。他们进一步在“把手-孔洞”突变的基础上引入了ch3区域内的二硫键来巩固异二聚体的结合能力。然而在他们的研究结果中,“把手-孔洞”模型对阻碍同二聚体的形成的能力仍然不够。之后该研究组尝试通过随机突变-噬菌体展示等方法一步提高异二聚体的含量,但仍没有解决根本问题。为了提高异二聚体的比例,还有研究通过分别制备两种抗体,在体外通过分子间二硫键还原-重新配对的方式形成异二聚体,但其制备工艺明显过于复杂。
8.因此,本领域仍需要寻找合适的突变以进一步增强异二聚体蛋白的形成而削弱同二聚体蛋白的形成。
技术实现要素:
9.本技术所述发明通过综合考虑界面氨基酸之间的各种相互作用,例如离子作用、疏水相互作用和空间作用等,筛选到有益的ch3突变序列,其更倾向于形成异二聚体,而不形成同二聚体,因而大大提高了异二聚体分子的产量。
10.一方面,本技术所述发明涉及异二聚体分子,其含有第一多肽链和第二多肽链,所述第一多肽链包含抗体重链恒定区第一ch3结构域,所述第二多肽链包含抗体重链恒定区第二ch3结构域,与相应的野生型人抗体重链恒定区ch3结构域相比,所述第一ch3结构域和第二ch3结构域含有选自如下(1)至(3)所示位置氨基酸的突变中的一种:
11.(1)第一ch3结构域的y349和t366发生突变,且第二ch3结构域的d356、t366、l368和y407发生突变,并且所述第一ch3结构域和/或第二ch3结构域还在选自f405、k409、k360、q347和l368中的1至3个氨基酸位置具有的突变;
12.(2)第一ch3结构域的t366和k409发生突变,且第二ch3结构域的t366、l368、y407和f405发生突变,并且任选地所述第一ch3结构域和/或第二ch3结构域还在选自k392、d399、y349、s354和e357中的1至2个氨基酸的位置具有突变;以及
13.(3)第一ch3结构域的t366和f405发生突变,且第二ch3结构域的t366、l368、y407和k409发生突变,并且任选地所述第一ch3结构域和/或第二ch3结构域还在选自k392、d399、y349、s354和e357中的1至2个氨基酸的位置具有突变;
14.以上所述的氨基酸位置根据抗体fc的kabat编号的eu索引确定。
15.在某些实施方式中,所述第一ch3结构域和第二ch3结构域含有上述第(2)项或第(3)项突变,并且不含有突变y349c和d356c。
16.在某些实施方式中,所述第一ch3结构域和/或第二ch3结构域还包含选自下列的突变中的一种:
17.1a)第二ch3结构域的f405发生突变;
18.1b)第一ch3结构域的f405发生突变;
19.1c)第一ch3结构域的k409发生突变,且第二ch3结构域的f405发生突变;
20.1d)第一ch3结构域的f405、k360和q347发生突变,且第二ch3结构域的q347发生突变;
21.1e)第一ch3结构域的f405和q347发生突变,且第二ch3结构域的k360和q347发生
突变;
22.1f)第一ch3结构域的k409、k360和q347发生突变,且第二ch3结构域的f405和q347发生突变;
23.1g)第一ch3结构域的k409和q347发生突变,且第二ch3结构域的f405、k360和q347发生突变;和
24.1h)第一ch3结构域的k409和l368发生突变,且第二ch3结构域的f405发生突变。
25.在某些实施方式中,所述第一ch3结构域和/或第二ch3结构域还任选地包含选自下列的突变中的一种:
26.2a)第一ch3结构域的k392发生突变,且第二ch3结构域的d399发生突变;
27.2b)第一ch3结构域的y349发生突变,且第二ch3结构域的e357发生突变;和
28.2c)第一ch3结构域的y349和s354发生突变,且第二ch3结构域的e357发生突变。
29.在某些实施方式中,所述第一ch3结构域和/或第二ch3结构域任选地还包含选自下列的突变中的一种:
30.3a)第一ch3结构域的d399发生突变,且第二ch3结构域的k392发生突变;
31.3b)第一ch3结构域的y349发生突变,且第二ch3结构域的e357发生突变;和
32.3c)第一ch3结构域的y349和s354d发生突变,且第二ch3结构域的e357发生突变。
33.在某些实施方式中,所述各突变各自独立地选自非带电氨基酸突变为带电氨基酸、带电氨基酸突变为非带电氨基酸和带电荷氨基酸突变为带相反电荷的氨基酸。
34.在某些实施方式中,所述第一ch3结构域和/或第二ch3结构域中的突变包含选自下述的一个或数个突变:y349c、y349d、d356c、t366w、t366s、l368a、l368e、l368g、f405k、y407v、y407a、k409e、k409a、k360e、q347e、q347r、k392d、d399s、e357a和s354d。例如,所述突变可以为选自下述的一个或数个突变:y349c、y349d、d356c、t366w、t366s、l368a、l368e、l368g、f405k、y407v、y407a、k409e、k409a、k360e、q347e、q347r、k392d、d399s、e357a和s354d。
35.在某些实施方式中,所述第一ch3结构域中包含选自下组的一处或多处(例如,至少1处、至少2处、至少3处、至少4处、至少5处、至少6处、至少7处或至少8处)的突变:y349、t366、f405、k409、l368、k392、s354和/或d399。
36.在某些实施方式中,所述第二ch3结构域中包含选自下组的一处或多处(例如,至少1处、至少2处、至少3处、至少4处、至少5处、至少6处、至少7处、至少8处或至少9处)的突变:d356、t366、l368、y407、f405、d399、e357、k409和/或k392。
37.在某些实施方式中,所述第一ch3结构域中包含选自下组的一处或多处(例如,至少1处、至少2处、至少3处、至少4处、至少5处、至少6处、至少7处或至少8处)的突变:y349、t366、f405、k409、l368、k392、s354和/或d399;且所述第二ch3结构域中包含选自下组的一处或多处(例如,至少1处、至少2处、至少3处、至少4处、至少5处、至少6处、至少7处、至少8处或至少9处)的突变:d356、t366、l368、y407、f405、d399、e357、k409和/或k392。
38.在某些实施方式中,所述第一ch3结构域中包含选自下组的一个或多个(例如,至少1个、至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个或者至少9个)突变:y349c、t366w、f405k、k409a、l368e、k392d、y349d、s354d和/或d399s。
39.在某些实施方式中,所述第二ch3结构域中包含选自下组的一个或多个(例如,至
少1个、至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个或者至少11个)突变:d356c、t366s、l368a、y407v、f405k、d399s、l368g、y407a、e357a、k409a和/或k392d。
40.在某些实施方式中,所述第一ch3结构域中包含选自下组的一个或多个(例如,至少1个、至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个或者至少9个)突变:y349c、t366w、f405k、k409a、l368e、k392d、y349d、s354d和/或d399s;且所述第二ch3结构域中包含选自下组的一个或多个(例如,至少1个、至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个或者至少11个)突变:d356c、t366s、l368a、y407v、f405k、d399s、l368g、y407a、e357a、k409a和/或k392d。
41.在某些实施方式中,所述的第一ch3结构域和第二ch3结构域含有选自以下一组的突变:
42.1)第一ch3结构域:y349c+t366w,第二ch3结构域:d356c+t366s+l368a+y407v+f405k;
43.2)第一ch3结构域:y349c+t366w+f405k,第二ch3结构域:d356c+t366s+l368a+y407v;
44.3)第一ch3结构域:y349c+t366w+k409e,第二ch3结构域:d356c+t366s+l368a+y407v+f405k;
45.4)第一ch3结构域:y349c+t366w+k409a,第二ch3结构域:d356c+t366s+l368a+y407v+f405k;
46.5)第一ch3结构域:y349c+t366w+f405k+k360e+q347e,第二ch3结构域:d356c+t366s+l368a+y407v+q347r;
47.6)第一ch3结构域:y349c+t366w+f405k+q347r,第二ch3结构域:d356c+t366s+l368a+y407v+k360e+q347e;
48.7)第一ch3结构域:y349c+t366w+k409a+k360e+q347e,第二ch3结构域:d356c+t366s+l368a+y407v+f405k+q347r;
49.8)第一ch3结构域:y349c+t366w+k409a+q347r,第二ch3结构域:d356c+t366s+l368a+y407v+f405k+k360e+q347e;
50.9)第一ch3结构域:y349c+t366w+k409a+l368e,第二ch3结构域:d356c+t366s+l368a+y407v+f405k;
51.10)第一ch3结构域:t366w+k409a+k392d,第二ch3结构域:t366s+l368a+y407v+d399s+f405k;
52.11)第一ch3结构域:t366w+k409a,第二ch3结构域:t366s+l368g+y407a+f405k;
53.12)第一ch3结构域:t366w+k409a+y349d,第二ch3结构域:t366s+l368a+y407v+f405k+e357a;
54.13)第一ch3结构域:t366w+k409a+y349d+s354d,第二ch3结构域:t366s+l368a+y407v+f405k+e357a;
55.14)第一ch3结构域:t366w+f405k,第二ch3结构域:t366s+l368a+y407v+k409a;
56.15)第一ch3结构域:t366w+f405k+d399s,第二ch3结构域:t366s+l368a+y407v+k409a+k392d;
57.16)第一ch3结构域:t366w+f405k,第二ch3结构域:t366s+l368g+y407a+k409a;
58.17)第一ch3结构域:t366w+f405k+y349d,第二ch3结构域:t366s+l368a+y407v+k409a+e357a;和
59.18)第一ch3结构域:t366w+f405k+y349d+s354d,第二ch3结构域:t366s+l368a+y407v+k409a+e357a。
60.在某些实施方式中,所述的第一ch3结构域和第二ch3结构域含有选自以下一组的突变:
61.2)第一ch3结构域:y349c+t366w+f405k,第二ch3结构域:d356c+t366s+l368a+y407v;
62.4)第一ch3结构域:y349c+t366w+k409a,第二ch3结构域:d356c+t366s+l368a+y407v+f405k;
63.9)第一ch3结构域:y349c+t366w+k409a+l368e,第二ch3结构域:d356c+t366s+l368a+y407v+f405k;
64.10)第一ch3结构域:t366w+k409a+k392d,第二ch3结构域:t366s+l368a+y407v+d399s+f405k;
65.11)第一ch3结构域:t366w+k409a,第二ch3结构域:t366s+l368g+y407a+f405k;
66.13)第一ch3结构域:t366w+k409a+y349d+s354d,第二ch3结构域:t366s+l368a+y407v+f405k+e357a;
67.15)第一ch3结构域:t366w+f405k+d399s,第二ch3结构域:t366s+l368a+y407v+k409a+k392d;
68.16)第一ch3结构域:t366w+f405k,第二ch3结构域:t366s+l368g+y407a+k409a;和
69.18)第一ch3结构域:t366w+f405k+y349d+s354d,第二ch3结构域:t366s+l368a+y407v+k409a+e357a。
70.在某些实施方式中,所述的第一多肽链和第二多肽链还分别含有抗体重链恒定区的ch2结构域。在某些实施方式中,所述ch2结构域位于ch3结构域的n端,其与ch3结构域的n端直接连接或通过连接肽连接。
71.在某些实施方式中,所述的第一多肽链和第二多肽链还分别含有抗体重链恒定区的铰链区或铰链区的一部分。在某些实施方式中,所述铰链区的一部分为d221-p230。
72.在某些实施方式中,所述铰链区或铰链区的一部分位于ch3结构域的n端,当存在ch2结构域时,所述铰链区或铰链区的一部分进一步位于ch2结构域的n端,其与ch2或ch3结构域直接连接或通过连接肽连接。
73.在某些实施方式中,所述野生型人抗体重链恒定区ch3结构域选自人igg(例如igg1、igg2、igg3或igg4)重链恒定区ch3结构域、人iga(例如iga1、iga2)重链恒定区ch3结构域、人igd重链恒定区ch3结构域、人ige重链恒定区ch3结构域和人igm重链恒定区ch3结构域。
74.在某些实施方式中,所述野生型人抗体重链恒定区ch3结构域为人igg1重链恒定区ch3结构域。
75.在某些实施方式中,所述第一和/或第二多肽链还含有分子结合区域,例如抗原结合区域、受体结合区域或酶结合区域。在某些实施方式中,所述抗原结合区域含有抗体可变
区。
76.在某些实施方式中,所述异二聚体分子为双特异性抗体、双特异性融合蛋白或抗体-融合蛋白嵌合体。
77.在另一方面,本技术涉及一种组合物(例如,药物组合物),其含有本技术所述的任一种异二聚体分子,以及任选的药学可接受的载体或赋形剂。
78.本技术还涉及核酸分子,其编码本技术所述异二聚体分子的第一多肽链或第二多肽链,或者编码本技术所述异二聚体分子的第一多肽链和第二多肽链。
79.本技术还涉及载体,其含有本技术所述的核酸分子。
80.本技术还涉及宿主细胞,其含有本技术所述的载体。
81.本技术还涉及所述异二聚体分子、组合物、核酸分子、载体或宿主细胞在制备双特异性抗体、双特异性融合蛋白和抗体-融合蛋白嵌合体中的用途。
82.本技术还涉及一种制备异二聚体分子的方法,其包括使用本技术所述的宿主细胞表达所述异二聚体分子的步骤。
83.在所述制备异二聚体分子的方法的某些实施方式中,所述宿主细胞同时含有编码所述异二聚体分子中第一多肽链和第二多肽链的载体,且所述方法包括使用该宿主细胞表达、回收并得到所述异二聚体分子。
84.在所述制备异二聚体分子的方法的某些实施方式中,所述宿主细胞包括第一组细胞和第二组细胞,所述第一组细胞和第二组细胞各自分别包含编码所述异二聚体分子的第一多肽链和第二多肽链的载体,所述方法包括:使所述第一多肽链和第二多肽链在所述第一组细胞和所述第二组细胞中分别表达后形成所述第一多肽链同二聚体和所述第二多肽链同二聚体,然后将所述第一多肽链同二聚体和所述第二多肽链同二聚体在合适的条件下混合并制备得到所述异二聚体分子。在某些实施方式中,所述方法还包括将所述第一多肽链同二聚体和所述第二多肽链同二聚体还原解离成单体,并混合、氧化,然后纯化制备得到所述异二聚体分子。在某些实施方式中,所述宿主细胞分别含有编码所述异二聚体分子中第一多肽链和第二多肽链的载体,第一多肽链和第二多肽链在两个宿主细胞中分别表达后形成第一多肽链同二聚体和第二多肽链同二聚体,然后将所述第一多肽链同二聚体和所述第二多肽链同二聚体在合适的条件下还原、混合、氧化,然后纯化制备得到所述异二聚体分子。
85.在所述制备异二聚体分子的方法的某些实施方式中,分别向所述第一组细胞和所述第二组细胞转染包含所述第一多肽链或包含所述第二多肽链的构建体或载体。所述转染可以为瞬时转染。在转染中,包含所述第一多肽链的构建体或载体与包含所述第二多肽链的构建体或载体的摩尔比可以为1:4至4:1,例如1:2至2:1,例如约1:1。
86.本领域技术人员能够从下文的详细描述中容易地洞察到本公开的其它方面和优势。下文的详细描述中仅显示和描述了本公开的示例性实施方式。如本领域技术人员将认识到的,本公开的内容使得本领域技术人员能够对所公开的具体实施方式进行改动而不脱离本技术所涉及发明的精神和范围。相应地,本技术的附图和说明书中的描述仅仅是示例性的,而非为限制性的。
附图说明
87.图1显示瞬时表达scfv-fc/fc异二聚体的电泳分析结果。使用了4%至12%sds-page蛋白凝胶电泳。泳道自1至7依次为:蛋白分子量标准,突变组合kh,突变组合1,突变组合2,突变组合3,突变组合4,野生型阴性对照组合。每组产物中所包含的同二聚体和异二聚体因为分子量差异而在凝胶电泳中的迁移距离不同。不同的同二聚体或异二聚体蛋白所处的位置在图中被标注出。
88.图2显示了瞬时表达scfv-fc/fc异二聚体的电泳分析结果。使用了12%sds-page蛋白凝胶电泳。泳道自1至9依次为:突变组合9,突变组合8,突变组合7,突变组合4,突变组合6,突变组合5,突变组合2,空白对照(细胞上清)及蛋白分子量标准。每组产物中所包含的同二聚体和异二聚体因为分子量差异而在凝胶电泳中迁移的距离不同。与图1相似,自上而下分别为scfv-fc/scfv-fc同二聚体,scfv-fc/fc异二聚体,和fc/fc同二聚体。
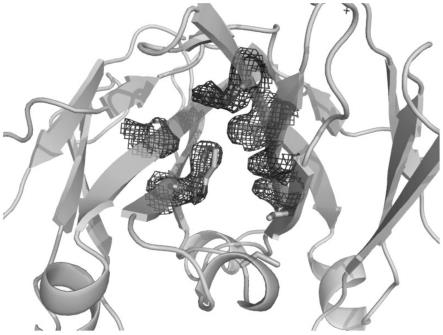
89.图3显示了突变组合4中的异二聚体fc上ch3-ch3界面的晶体结构局部图。突变的氨基酸残基用短棍表示,具体包含的相互接触的突变氨基酸残基对有如下:t366w/a链-t366s,l368a,y407v/b链,k409a/a链-f405k/b链,s354c/a链-y349c/b链。a链(左测颜色稍浅的链)用绿色表示,b链(右侧颜色稍深的链)用浅蓝色表示。
90.图4显示了在f405k-k409a这一对突变氨基酸残基对附近引入d399s-k392d这一对新突变,能进一步增强异二聚体之间的相互吸引,同时加大同二聚体之间的相互排斥之力。图4a显示了引入新突变时,f405k-k409a这一突变对附近的界面氨基酸相互作用。图4b显示了引入新突变后带来的相互作用的改变。
具体实施方式
91.以下由特定的具体实例说明本发明的实施方式,本领域技术人员可通过本说明书所公开的内容了解本发明的其他优点及功效。
92.在本技术中,所述第一多肽链和第二多肽链都含有抗体fc片段的ch3区域,两条多肽链之间通过ch3区域或者含有ch3区域的fc片段发生相互作用,形成二聚体,特别是异二聚体。异二聚体的两条多肽链可以是不同的组合,例如第一多肽链为抗体,第二多肽链为融合蛋白,或者两条多肽链均为融合蛋白,或者两条多肽链均为抗体(例如,靶向不同的抗原或抗原表位的抗体)。当融合蛋白包含抗体的fc段与细胞粘附分子的胞膜外区时也称为免疫粘附素。所述细胞粘附分子主要指能识别特异性配体细胞表面受体的分子,例如包括钙粘素、选择素、免疫球蛋白超家族、整合素及透明质酸粘素。
93.在本技术中,所述ch3区域来源于抗体fc片段,例如来源于人的抗体fc片段(例如,人抗体重链恒定区fc片段)。在某些实施方式中,所述ch3区域来源于人免疫球蛋白(ig)重链恒定区的fc片段,例如,来源于igm、igg(例如igg1、igg2、igg3、igg4)、iga(例如iga1、iga2)、ige和/或igd的重链恒定区fc片段。在某些实施方式中,本技术所述的ch3区域(如,所述野生型人抗体重链恒定区ch3结构域)源自野生型人igg1,例如,源自野生型人igg1的抗体重链恒定区ch3结构域。在一般情况下,所述人抗体fc片段的ch3区域来源于相应的野生型人抗体fc片段。野生型的人抗体fc片段是指自然人类群体中的抗体fc片段,例如,未经人工诱变或人工修饰的人抗体fc片段。在某些实施方式中,本技术所述的人抗体fc片段也包括对于相应野生型人抗体fc序列的个别氨基酸的改变,例如包括某些在糖基化位点突变
的氨基酸,或者其它无义的突变,也包括根据“把手-孔洞”模型突变的个别氨基酸的改变。例如,对于ch3以及ch2结构域,除了本技术中提到的突变外,还可能含有其它不影响抗体(特别是fc段)功能的突变。
94.在本技术中,当第一多肽链和/或第二多肽链中含有铰链区时,该铰链区作为柔性片段连接在两段多肽之间,以保证各段多肽链的功能;本领域技术人员可以根据需要选择铰链区的长度,例如可选择全长序列或其中的部分序列。
95.在本技术中,所述fc或其ch2、ch3结构域或铰链区中氨基酸位置的编号均根据kabat eu编号索引的位置确定。本领域技术人员知晓,即使上述区域中由于氨基酸的插入或缺失或其它突变导致氨基酸序列的改变,根据kabat eu编号索引确定的与标准序列对应的各氨基酸的位置编号仍然不变。
96.在本技术中,人的抗体重链恒定区可包括重链ch1、ch2、ch3、ch4中的两个或更多结构域与抗体的铰链区的组合。在某些实施方式中,所述人的抗体fc片段包括至少一个抗体铰链区、一个ch2结构域和一个ch3结构域。在某些实施方式中,所述ch2结构域为人igg1重链恒定区的ch2结构域,其对应于依照eu编号系统的氨基酸228-340。在某些实施方式中,所述ch2结构域对应于本技术中描述的任何其它抗体同种型的相应区域。在某些实施方式中,所述ch3结构域为人igg1重链恒定区的ch3结构域,其对应于依照eu编号系统的氨基酸341-447。在某些实施方式中,所述ch3结构域对应于本技术中描述的任何其它抗体同种型的相应区域。
97.在本技术中,所述带电氨基酸包括精氨酸、赖氨酸、天冬氨酸和谷氨酸。
98.在本技术中,异二聚体分子可以用标准的实验手段从宿主细胞中纯化。例如,当异二聚体蛋白包含抗体fc片段,可以用蛋白a来纯化。纯化方法包括但不限于色谱技术如体积排阻法、离子交换法、亲和色谱法及超滤法,或者上述各种方法的适当组合。
99.在本技术中,所述eu索引例如描述于kabat等,sequences of proteins of immunological interest,第5版public health service,national institutes of health,bethesda,md.(1991)。
100.本技术所述发明通过综合考虑界面氨基酸之间的各种相互作用,例如离子作用、疏水相互作用和空间作用等,筛选到了优选的ch3突变序列,其更倾向于形成异二聚体,而不形成同二聚体,因而大大提高了异二聚体分子的产量。同时,在本技术的一些实施方式中,制备了含有fc片段的异二聚体蛋白晶体,通过对晶体结构的解析以及三维结构建模,更进一步了解了界面氨基酸之间直接的相互作用,同时摒弃了以往认为的y349c与d356c的两个半胱氨酸之间必然会形成稳定二硫键的观点,在此基础上进行的突变组合更有利于形成异二聚体,而更不利于形成同二聚体,在大大提高异二聚体所占比例的同时大大降低了同二聚体的比例。
101.下面将结合实施例对本技术所述发明的实施方式进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于示例性地说明本技术所述发明,而不应视为限定本技术所述发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
102.实施方案
103.1、异二聚体分子,其包含第一多肽链和第二多肽链,所述第一多肽链包含抗体重
链恒定区第一ch3结构域,所述第二多肽链包含抗体重链恒定区第二ch3结构域,与相应的野生型人抗体重链恒定区ch3结构域相比,所述第一ch3结构域和第二ch3结构域含有选自如下(1)至(3)所示位置氨基酸的突变中的一种:
104.(1)第一ch3结构域的y349和t366发生突变,且第二ch3结构域的d356、t366、l368和y407发生突变,并且所述第一ch3结构域和/或第二ch3结构域还在选自f405、k409、k360、q347和l368中的1至3个氨基酸的位置具有突变;
105.(2)第一ch3结构域的t366和k409发生突变,且第二ch3结构域的t366、l368、y407和f405发生突变,并且任选地所述第一ch3结构域和/或第二ch3结构域还在选自k392、d399、y349、s354和e357中的1至2个氨基酸的位置具有突变;以及
106.(3)第一ch3结构域的t366和f405发生突变,且第二ch3结构域的t366、l368、y407和k409发生突变,并且任选地所述第一ch3结构域和/或第二ch3结构域还在选自k392、d399、y349、s354和e357中的1至2个氨基酸的位置具有突变;
107.以上所述的氨基酸的位置根据抗体fc的kabat编号的eu索引确定。
108.2、根据实施方案1所述的异二聚体分子,其中所述第一ch3结构域和/或第二ch3结构域还包含选自下列的突变中的一种:
109.1a)第二ch3结构域的f405发生突变;
110.1b)第一ch3结构域的f405发生突变;
111.1c)第一ch3结构域的k409发生突变,且第二ch3结构域的f405发生突变;
112.1d)第一ch3结构域的f405、k360和q347发生突变,且第二ch3结构域的q347发生突变;
113.1e)第一ch3结构域的f405和q347发生突变,且第二ch3结构域的k360和q347发生突变;
114.1f)第一ch3结构域的k409、k360和q347发生突变,且第二ch3结构域的f405和q347发生突变;
115.1g)第一ch3结构域的k409和q347发生突变,且第二ch3结构域的f405、k360和q347发生突变;和
116.1h)第一ch3结构域的k409和l368发生突变,且第二ch3结构域的f405发生突变。
117.3、根据实施方案1-2中任一项所述的异二聚体分子,其中所述第一ch3结构域和/或第二ch3结构域还任选地包含选自下列的突变中的一种:
118.2a)第一ch3结构域的k392发生突变,且第二ch3结构域的d399发生突变;
119.2b)第一ch3结构域的y349发生突变,且第二ch3结构域的e357发生突变;和
120.2c)第一ch3结构域的y349和s354发生突变,且第二ch3结构域的e357发生突变。
121.4、根据实施方案1-3中任一项所述的异二聚体分子,其中所述第一ch3结构域和/或第二ch3结构域任选地还包含选自下列的突变中的一种:
122.3a)第一ch3结构域的d399发生突变,且第二ch3结构域的k392发生突变;
123.3b)第一ch3结构域的y349发生突变,且第二ch3结构域的e357发生突变;和
124.3c)第一ch3结构域的y349和s354d发生突变,且第二ch3结构域的e357发生突变。
125.5、根据实施方案1-4中任一项所述的异二聚体分子,其中所述的各突变各自独立地选自非带电氨基酸突变为带电氨基酸、带电氨基酸突变为非带电氨基酸或带电荷氨基酸
突变为带相反电荷的氨基酸。
126.6、根据实施方案1-5中任一项所述的异二聚体分子,其中所述第一ch3结构域和/或第二ch3结构域中的突变包含选自下述的一个或数个突变:y349c、y349d、d356c、t366w、t366s、l368a、l368e、l368g、f405k、y407v、y407a、k409e、k409a、k360e、q347e、q347r、k392d、d399s、e357a和s354d。
127.7、根据实施方案1-6中任一项所述的异二聚体分子,其中所述第一ch3结构域中包含选自下组的一处或多处的突变:y349、t366、f405、k409、l368、k392、s354和/或d399。
128.8、根据实施方案1-7中任一项所述的异二聚体分子,其中所述第二ch3结构域中包含选自下组的一处或多处的突变:d356、t366、l368、y407、f405、d399、e357、k409和/或k392。
129.9、根据实施方案1-8中任一项所述的异二聚体分子,其中所述第一ch3结构域中包含选自下组的一处或多处的突变:y349、t366、f405、k409、l368、k392、s354和/或d399;且所述第二ch3结构域中包含选自下组的一处或多处的突变:d356、t366、l368、y407、f405、d399、e357、k409和/或k392。
130.10、根据实施方案1-9中任一项所述的异二聚体分子,其中所述第一ch3结构域中包含选自下组的一个或多个突变:y349c、t366w、f405k、k409a、l368e、k392d、y349d、s354d和/或d399s。
131.11、根据实施方案1-10中任一项所述的异二聚体分子,其中所述第二ch3结构域中包含选自下组的一个或多个突变:d356c、t366s、l368a、y407v、f405k、d399s、l368g、y407a、e357a、k409a和/或k392d。
132.12、根据实施方案1-11中任一项所述的异二聚体分子,其中所述第一ch3结构域中包含选自下组的一个或多个突变:y349c、t366w、f405k、k409a、l368e、k392d、y349d、s354d和/或d399s;且所述第二ch3结构域中包含选自下组的一个或多个突变:d356c、t366s、l368a、y407v、f405k、d399s、l368g、y407a、e357a、k409a和/或k392d。
133.13、根据实施方案1-12中任一项所述的异二聚体分子,其中所述的第一ch3结构域和第二ch3结构域含有选自以下一组的突变:
134.1)第一ch3结构域:y349c+t366w,第二ch3结构域:d356c+t366s+l368a+y407v+f405k;
135.2)第一ch3结构域:y349c+t366w+f405k,第二ch3结构域:d356c+t366s+l368a+y407v;
136.3)第一ch3结构域:y349c+t366w+k409e,第二ch3结构域:d356c+t366s+l368a+y407v+f405k;
137.4)第一ch3结构域:y349c+t366w+k409a,第二ch3结构域:d356c+t366s+l368a+y407v+f405k;
138.5)第一ch3结构域:y349c+t366w+f405k+k360e+q347e,第二ch3结构域:d356c+t366s+l368a+y407v+q347r;
139.6)第一ch3结构域:y349c+t366w+f405k+q347r,第二ch3结构域:d356c+t366s+l368a+y407v+k360e+q347e;
140.7)第一ch3结构域:y349c+t366w+k409a+k360e+q347e,第二ch3结构域:d356c+
t366s+l368a+y407v+f405k+q347r;
141.8)第一ch3结构域:y349c+t366w+k409a+q347r,第二ch3结构域:d356c+t366s+l368a+y407v+f405k+k360e+q347e;
142.9)第一ch3结构域:y349c+t366w+k409a+l368e,第二ch3结构域:d356c+t366s+l368a+y407v+f405k;
143.10)第一ch3结构域:t366w+k409a+k392d,第二ch3结构域:t366s+l368a+y407v+d399s+f405k;
144.11)第一ch3结构域:t366w+k409a,第二ch3结构域:t366s+l368g+y407a+f405k;
145.12)第一ch3结构域:t366w+k409a+y349d,第二ch3结构域:t366s+l368a+y407v+f405k+e357a;
146.13)第一ch3结构域:t366w+k409a+y349d+s354d,第二ch3结构域:t366s+l368a+y407v+f405k+e357a;
147.14)第一ch3结构域:t366w+f405k,第二ch3结构域:t366s+l368a+y407v+k409a;
148.15)第一ch3结构域:t366w+f405k+d399s,第二ch3结构域:t366s+l368a+y407v+k409a+k392d;
149.16)第一ch3结构域:t366w+f405k,第二ch3结构域:t366s+l368g+y407a+k409a;
150.17)第一ch3结构域:t366w+f405k+y349d,第二ch3结构域:t366s+l368a+y407v+k409a+e357a;
151.和
152.18)第一ch3结构域:t366w+f405k+y349d+s354d,第二ch3结构域:t366s+l368a+y407v+k409a+e357a。
153.14、根据实施方案1-13中任一项所述的异二聚体分子,其中所述的第一ch3结构域和第二ch3结构域含有选自以下一组的突变:
154.2)第一ch3结构域:y349c+t366w+f405k,第二ch3结构域:d356c+t366s+l368a+y407v;
155.4)第一ch3结构域:y349c+t366w+k409a,第二ch3结构域:d356c+t366s+l368a+y407v+f405k;
156.9)第一ch3结构域:y349c+t366w+k409a+l368e,第二ch3结构域:d356c+t366s+l368a+y407v+f405k;
157.10)第一ch3结构域:t366w+k409a+k392d,第二ch3结构域:t366s+l368a+y407v+d399s+f405k;
158.11)第一ch3结构域:t366w+k409a,第二ch3结构域:t366s+l368g+y407a+f405k;
159.13)第一ch3结构域:t366w+k409a+y349d+s354d,第二ch3结构域:t366s+l368a+y407v+f405k+e357a;
160.15)第一ch3结构域:t366w+f405k+d399s,第二ch3结构域:t366s+l368a+y407v+k409a+k392d;
161.16)第一ch3结构域:t366w+f405k,第二ch3结构域:t366s+l368g+y407a+k409a;和
162.18)第一ch3结构域:t366w+f405k+y349d+s354d,第二ch3结构域:t366s+l368a+y407v+k409a+e357a。
163.15、根据实施方案1-14中任一项所述的异二聚体分子,其中所述第一多肽链和第二多肽链还分别含有抗体重链恒定区的ch2结构域。
164.16、根据实施方案1-15中任一项所述的异二聚体分子,其中所述第一多肽链和第二多肽链还分别含有抗体重链恒定区的铰链区或铰链区的一部分。
165.17、根据实施方案1-16中任一项所述的异二聚体分子,其中所述野生型人抗体重链恒定区ch3结构域选自人igg重链恒定区ch3结构域、人iga重链恒定区ch3结构域、人igd重链恒定区ch3结构域、人ige重链恒定区ch3结构域和人igm重链恒定区ch3结构域。
166.18、根据实施方案1-17中任一项所述的异二聚体分子,其中所述野生型人抗体重链恒定区ch3结构域为人igg1重链恒定区ch3结构域。
167.19、根据实施方案1-18中任一项所述的异二聚体分子,其中所述的第一和/或第二多肽链还含有分子结合区域,所述分子结合域选自抗原结合区域、受体结合区域和酶结合区域。
168.20、根据实施方案19所述的异二聚体分子,其中所述抗原结合区域含有抗体可变区。
169.21、根据实施方案1-20中任一项所述的异二聚体分子,其为双特异性抗体、双特异性融合蛋白或抗体-融合蛋白嵌合体。
170.22、组合物,其含有根据实施方案1-21中任一项所述的异二聚体分子,以及任选的药学可接受的载体或赋形剂。
171.23、核酸分子,其编码根据实施方案1-21中任一项所述的异二聚体分子的第一多肽链和/或第二多肽链。
172.24、载体,其含有根据实施方案23所述的核酸分子。
173.25、宿主细胞,其含有根据实施方案24所述的载体。
174.26、根据实施方案1-21中任一项所述的异二聚体分子、根据实施方案22所述的组合物、根据实施方案23所述的核酸分子、根据实施方案24所述的载体或根据实施方案25所述的宿主细胞在制备双特异性抗体、双特异性融合蛋白或抗体-融合蛋白嵌合体中的用途。
175.27、一种制备异二聚体分子的方法,其包括使用根据实施方案25所述的宿主细胞表达所述异二聚体分子的步骤。
176.28、根据实施方案27所述的方法,其中所述的宿主细胞同时含有编码所述异二聚体分子中的第一多肽链和第二多肽链的载体,且所述方法包括使用该宿主细胞表达、回收并得到所述异二聚体分子。
177.29、根据实施方案28所述的方法,其中所述宿主细胞包括第一组细胞和第二组细胞,所述第一组细胞和第二组细胞各自分别包含编码所述异二聚体分子的第一多肽链和第二多肽链的载体,所述方法包括:使所述第一多肽链和第二多肽链在所述第一组细胞和所述第二组细胞中分别表达后形成所述第一多肽链同二聚体和所述第二多肽链同二聚体,然后将所述第一多肽链同二聚体和所述第二多肽链同二聚体在合适的条件下混合并制备得到所述异二聚体分子。
178.实施例1:第一轮突变候选组合序列的获得
179.1、fc结构建模及界面氨基酸的获取
180.从蛋白质数据库(pdb,www.pdb.org)中共获得48个包含fc区域的人igg1抗体晶体
结构,通过结构相似性搜索算法(参考文献:yuzhen ye and adam godzik.fatcat:a web server for flexible structure comparison and structure similarity searching.nucleic acids res.,2004,32(web server issue):w582-585.),得出这48个抗体的fc段来自1dn2(pdb编号)。
181.用蛋白质接触氨基酸识别软件cma(网址为:http://ligin.weizmann.ac.il/cma/),根据氨基酸作用的距离筛选并识别抗体(pdb编号:1dn2)中ch3-ch3之间的氨基酸接触。根据氨基酸接触规则,界面氨基酸指侧链重原子与另外一条链的任何一个氨基酸的重原子之间的距离小于一个阈值的一些氨基酸。本实施例的阈值选择为也可以选择(如文献:b.erman,i.bahar and r.l.jernigan.equilibrium states of rigid bodies with multiple interaction sites.application to protein helices.j.chem.phys.1997,107:2046-2059.)。人和鼠igg亚型氨基酸接触界面的保守情况可以通过序列多重比对得到。表1为通过氨基酸接触筛选(即氨基酸距离小于)的抗体1dn2的34个界面氨基酸,其中,链a和链b分别代表抗体1dn2的第一链和第二链。以下氨基酸位置是根据抗体fc的kabat编号的eu索引所命名的。
182.表1.抗体1dn2的ch3-ch3界面氨基酸列表
183.[0184][0185]
2、突变氨基酸以造成离子作用的改变
[0186]
根据表1的结果,选择接触氨基酸对中包含带电荷氨基的氨基酸对,对其中一条链上的一个氨基进行突变(非带电氨基酸变为带电荷氨基酸,或是带电荷氨基酸变成非带电荷氨基酸,或者改变带电荷氨基酸所带的电荷性质),使得fc链a与fc链b之间的离子作用不平衡,并降低同二聚体形成的几率和/或提高异二聚体形成的几率。
[0187]
作为示例,如对链a的phe405进行突变,突变为phe405lys(也可写作f405k),同时保持链b不变。由于第405位氨基酸残基周围的位于链b上的接触氨基酸残基中含有两个lys,均为带正电荷的氨基酸,因此当链a与链a配对时,两条链上的f405k突变所带的正电荷会引入极大的斥力;而当链a与链b配对时,只有一条链(a)上有f405k突变引入的斥力,而另一条链(b)则保持phe405,没有引入斥力。在此情况下,aa之间两条链的相互排斥十分显著,远大于ab或是bb,因此能有效降低aa同二聚体的形成。
[0188]
如果在链a中引入f405k突变的同时,将链b上与链a的f405k突变残基对应的接触氨基酸残基lys409突变为k409e或k409a,则当链a与链a配对时,两条链a上的f405k突变所引入的正电荷会依然引入极大的斥力;而当链a与链b配对时,链a上有f405k突变,与链b上的k409e或k409a突变相作用,没有斥力,甚至还有引力(k409e);而当链b与链b配对的时候,既不引入斥力也不引入引力。在此情况下,aa之间两条链的相互排斥十分显著,ab之间斥力降低或是引入引力,因此能有效降低aa同二聚体的形成,并同时促进ab异二聚体的形成。
[0189]
以此类推,在本实施例中得到的突变组合如下表所示:
[0190]
表2:异二聚体突变组合列表
[0191][0192]
实施例2:制备并考察scfv-fc/fc异二聚体
[0193]
1、构建表达突变的人igg1的fc片段以及scfv-fc融合蛋白的重组载体
[0194]
根据蛋白数据库uniprot上人免疫球蛋白gamma1(igg1)的恒定区氨基酸序列(p01857),得到人igg1-fc区氨基酸序列(seq id no:1),通过逆转录pcr,从人pbmc总rna中获得编码人igg1-fc的核酸片段(seq id no:2,命名为fc基因),通过重叠pcr在其5’端加上小鼠kappaiii信号肽的编码序列(如seq id no:3所示),之后再亚克隆至载体pcdna4(invitrogen,cat v86220),得到用于哺乳动物细胞表达人igg1-fc(简称fc)蛋白的重组表达载体。
[0195]
人工合成获得如seq id no:5所示的scfv-fc融合蛋白编码基因(其中的scfv是指抗her2的单链抗体),该基因编码scfv-fc融合蛋白序列见seq id:4,之后亚克隆至哺乳动物细胞表达载体pcdna4(invitrogen,cat v86220)获得用于哺乳动物细胞表达scfv-fc融合蛋白的重组表达载体。
[0196]
根据实施例1的表2,利用重叠pcr法对scfv-fc及fc编码基因进行组合突变,其中针对a链的突变位于scfv-fc融合蛋白上,针对b链的突变位于fc蛋白上。将突变后的基因亚克隆到pcdna4(invitrogen,cat v86220),最终分别得到用于在哺乳动物细胞中表达突变的scfv-fc融合蛋白及突变的fc蛋白的重组表达载体。
[0197]
2、瞬时表达scfv-fc/fc异二聚体,并检测不同突变组合对异二聚体含量的影响
[0198]
将步骤1的4种突变组合,kh组合(作为参比组),外加一种野生型组合(即未突变的scfv-fc融合蛋白和fc蛋白,作为阴性对照组)相应的表达载体用pei转染至悬浮培养的293h细胞(atcc crl-1573),每一组突变组合都包括了其相对应的a链(指代scfv-fc融合蛋白链)和b链(指代fc蛋白链)的重组表达载体共同转染,且a链和b链的重组表达载体共转比例为1:1。培养5至6天后,收集瞬时表达培养上清液,通过protein a亲和层析法,得到初步纯化的4组突变组合、kh突变组合以及野生型阴性对照组的瞬转产物。这些瞬转产物中都包
含了不同比例的同二聚体蛋白(scfv-fc/scfv-fc,fc/fc)和异二聚体蛋白(scfv-fc/fc)。由于这三种蛋白(scfv-fc/scfv-fc,fc/fc,和scfv-fc/fc)的分子量大小有差异,可以通过非还原条件下sds-page电泳检测每组产物中同二聚体蛋白(scfv-fc/scfv-fc,fc/fc)和异二聚体蛋白(scfv-fc/fc)的组成情况,同时用biorad公司推出的imagelab专业图像分析软件进行同二聚体蛋白(scfv-fc/scfv-fc,fc/fc)和异二聚体蛋白(scfv-fc/fc)比例的分析,电泳检测结果如图1及表3所示。
[0199]
表3.各突变组合在瞬转产物中同二聚体和异二聚体的比例
[0200][0201]
相对于野生型阴性对照组合,4组候选突变组合,以及kh组合中异二聚体(scfv-fc/fc)的比例都大幅度上升。同时,在kh基础上,引入新的突变后,异二聚体的比例也发生了改变,有的显著增加(如组合2,4),有的则适当提高(如组合1,3)。这里值得注意的是,由于这几组新的突变组合中包含了对接触面侧链基团的空间作用以及离子作用两种主要相互作用的调整,因此,其对异二聚体含量的影响大小并不能简单的只考虑两种作用的叠加。比如,同样是引入了f405k这个突变造成同二聚体之间斥力增大,但是在突变组合2中对异二聚体增加的效果就远高于突变组合1中(突变组合2中异二聚体含量约为70%,而1约为58%)。另外,对于k409位点上引入的突变,位于突变组合4中的非带电突变带来的异二聚体含量的增加(77%),要远优于突变组合3中的相反电荷的突变(57%);而如果从理论上单纯考虑两种相互作用的叠加,这两种突变带来的效果应该相似。
[0202]
为了进一步考察a链和b链的重组表达载体共转比例对于同二聚体和异二聚体比例的影响,将较优的两种突变组合(2和4),以及kh组合所用的共转表达载体分别用4:1及1:4的比例用pei转染至悬浮培养的293h细胞(atcc crl-1573),培养5-6天后,收集细胞上清。通过protein a亲和层析法,得到各自的瞬转产物。通过非还原条件下sds-page电泳检测同二聚体蛋白(scfv-fc/scfv-fc,fc/fc)和异二聚体蛋白(scfv-fc/fc)的组成情况。具体结果见表4。从结果可以看出:重组表达载体共转比例对于产物中同二聚体和异二聚体比例的
会带来比较明显的影响。无论是4:1还是1:4的共转比例,其产物中异二聚体的含量都显著降低。该结果说明,这三种组合虽然在a链与b链表达相对平衡的情况下,能极大的增加产物中异二聚体比例,降低同二聚体的比例,但是当产物中a链与b链表达不平衡,造成a链或b链过量的时候,过量的那一种产物,其形成同二聚体的比例就会增加,而异二聚体含量则相对降低。其中kh组合中,无论哪条链过量,都会造成异二聚体含量大幅度降低;突变组合2中b链(fc)过量造成的影响较大;突变组合4中,a链(scfv-fc)过量造成的影响较大,但是,即使突变组合2或突变组合4中的b链或a链过量,其形成异二聚体的比例均仍显著高于对照kh组合。进一步分析该结果,可以看出,这三种突变组合中,虽然a链与b链之间的相互作用得到了大幅度的增强,但是a链与a链或是b链与b链之间的相互作用减弱的幅度尚有不足,这才进一步造成当其中一个组分表达过剩的时候,同二聚体及异二聚体形成的平衡被打破,产生更多的同二聚体。其中,新的突变组合2与4相比于kh组合,在阻止同二聚体形成方面都有较明显的优化。
[0203]
表4.不同共转比例对于同二聚体和异二聚体的比例的影响
[0204][0205]
实施例3:第二轮突变候选组合序列的获得
[0206]
在实施例1与2中提到的优选fc突变组合(突变组合2与突变组合4)的基础上,根据已经公开的野生型fc的三维晶体结构,进一步引入界面氨基酸突变,旨在进一步减少a链-a链及b链-b链之间的相互吸引,抑制同二聚体蛋白的形成。
[0207]
根据表1的结果,进一步选择靠近突变组合2与突变组合4中突变位点附近的接触氨基酸中包含带电荷氨基酸的配对氨基酸,对其中一条链上的一个氨基酸进行突变(非带电氨基酸变为带电荷氨基酸,或是带电荷氨基酸变成非带电荷氨基酸,或者改变带电荷氨基酸所带的电荷性质),进一步增加链a与链b之间的离子作用不平衡性,并降低同二聚体形成的几率或同时提高异二聚体形成的几率。
[0208]
如对链a的lys360与链b的gln347这一对接触氨基酸进行突变,改变其间的离子作用。其中一条链(比如链a)上将这两个氨基酸残基都突变为带负电荷的氨基酸残基,如引入k360e和q347e两个突变;而另一条链(如链b)上将其中不带电荷的氨基酸残基突变为带正电荷的氨基酸残基,如引入q347r的突变。这时候,当链a-链a相互作用时,360、347位上所带的负电荷会相互排斥;链b-链b相互作用时,则由这两个位点上的正电荷相互排斥;只有当链a与链b相互作用时,各自的正负电荷才会产生相互吸引作用。该突变预计将增加aa以及
bb之间两条链的相互排斥,同时增加ab两条链之间的相互吸引。
[0209]
同时考察leu368这一氨基酸残基。该残基周围有两个带电荷氨基酸残基,glu357以及lys409。考虑到之前的突变组合4中,我们曾引入k409a突变,在此情况下,在已经引入k409a突变的同一条fc链上(根据实施例2,这里指定为链a),我们进一步将leu368突变为带负电荷氨基酸残基(如368e)。此时,则当链a与链a配对时,两条链上的l368e所带的负电荷会与e357上的负电荷相互作用,引入斥力;而当链a与链b配对时,链a上的l368e所带的负电荷与链b上的e357上的负电荷相互排斥,但同时又与链b上的k409相互吸引,综合下来,并没有引入太多斥力或引力。该突变预计将增加aa之间两条链的相互排斥,但并不影响ab或bb两条链之间的相互作用。
[0210]
实施例1与2中提到的优选fc突变组合(突变组合2与突变组合4)为基础,加上新引入的突变组合,得到的突变组合如表5所示:
[0211]
表5:异二聚体突变组合列表-2
[0212][0213]
实施例4:制备并考察新一轮scfv-fc/fc异二聚体突变组合
[0214]
1、构建表达突变的人igg1的fc片段以及scfv-fc融合蛋白的重组载体
[0215]
以实施例2中构建好的野生型scfv-fc及fc蛋白表达重组载体为模板,根据实施例3的表5,利用重叠pcr法对scfv-fc及fc编码基因进行组合突变,其中针对a链的突变位于scfv-fc融合蛋白上,针对b链的突变位于fc蛋白上。将突变后的基因亚克隆到pcdna4(invitrogen,cat v86220),最终得到用于在哺乳动物细胞中表达新一轮突变的scfv-fc融合蛋白及突变的fc蛋白的重组表达载体。
[0216]
2、瞬时表达scfv-fc/fc异二聚体,并检测不同突变组合对异二聚体含量的影响
[0217]
按照实施例2-2中所述的方法,将新的5种突变组合(5至9),以及第一轮的优选突变组合(2和4)利用293h细胞(atcc crl-1573),进行瞬时表达。其中a链和b链的重组表达载体共转比例为1:1。培养5至6天后,收集瞬时表达培养上清液,通过protein a亲和层析法,得到初步纯化的5组新突变组合、2组第一轮优选组合的瞬转产物。这些瞬转产物中都包含
了不同比例的同二聚体蛋白(scfv-fc/scfv-fc,fc/fc)和异二聚体蛋白(scfv-fc/fc)。由于这三种蛋白(scfv-fc/scfv-fc,fc/fc,和scfv-fc/fc)的分子量大小有差异,可以通过非还原条件下sds-page电泳检测每组产物中同二聚体蛋白(scfv-fc/scfv-fc,fc/fc)和异二聚体蛋白(scfv-fc/fc)的组成情况,同时用biorad公司推出的imagelab专业图像分析软件进行同二聚体蛋白(scfv-fc/scfv-fc,fc/fc)和异二聚体蛋白(scfv-fc/fc)比例的分析,电泳检测结果如图2及表6所示。
[0218]
表6.各突变组合瞬转产物中同二聚体和异二聚体的比例-2
[0219][0220]
与第一轮突变的优选组合比较,新引入的突变有一些略微提高了异二聚体生成的比例,如组合5相较于组合2;有几组变化不大,如组合6相较于组合2,组合7、8相较于组合4;另外,组合9引入新的突变后,反而大大降低了异二聚体生成的比例,推测是由于链a新引入的l368e所带的负电荷与链b上的e357上的负电荷相互排斥超过了与链b上的k409相互吸引,使得异二聚体变得不稳定。总体说来,新引入的突变虽然有几组对异二聚体的形成有适当帮助,但是并未带来显著提高。
[0221]
为了进一步考察新引入的突变对a链-a链以及b链-b链同二聚体的影响,我们单独瞬时的表达a链蛋白或b链蛋白,通过在比较相同瞬转条件下的同二聚体蛋白的表达水平,考察其同二聚体形成的趋势。重组表达载体用pei分别转染至悬浮培养的293h细胞(atcc crl-1573),培养5-6天后,收集细胞上清。通过protein a亲和层析法,得到各自的瞬转产物,并利用od280检测其表达水平。结果见表7。从表达水平看,对组合4中的链a引入的部分突变(组合8,组合9)能降低其同二聚体形成的趋势;对组合2中的链b引入的部分突变(组合5)能降低其同二聚体形成趋势;其余新的突变对同二聚体的形成影响不大。同时从该结果中还可以看出,组合2以及组合2衍生出的突变组合(5、6)相对组合4以及组合4衍生出的突
变组合(7、8、9),其链a形成同二聚体的趋势更小;而后者的链b形成同二聚体的趋势相对前者更小。该结果与实施例2中的得到的结果相一致,也进一步证明了通过该方法初步考察同二聚体形成趋势的可行性。另外,从表达水平来看,所有的链b都远低于链a。我们又做了野生型链a以及野生型链b的单独瞬时表达,发现未引入任何突变的情况下,野生型b链同二聚体的表达水平低于野生型链a的表达水平(前者约是后者的一半)。由此推断,链a中fc序列的n端融合了scfv序列,有助于提高其表达水平;而链a与链b之间的表达水平差异,并不能直接反映链a与链b各自同二聚体形成趋势的差异。
[0222]
表7.各突变组合中链a或链b单独瞬转,同二聚体表达水平比较
[0223][0224]
实施例5:第三轮突变候选组合序列的获得
[0225]
根据突变组合4的晶体结构,配合结构建模,找出新的接触界面氨基酸突变候选序列,以期在原有突变组合(如突变组合2或4)基础上,进一步抑制同二聚体蛋白的形成或促进异二聚体蛋白的形成。
[0226]
突变组合4异二聚体蛋白的晶体结构解析
[0227]
选择突变组合4,于293h细胞(atcc crl-1573)中瞬时表达并纯化得到突变组合4的异二聚体蛋白,进行晶体结构解析。此处,我们利用分子克隆在突变组合4链b的c端插入一段his-tag序列,从而可以在protein a亲和层析之后,利用imac的方法得到较纯的链a-链b异二聚体蛋白用于结晶。
[0228]
晶体结构解析过程如下:
[0229]
异二聚体fc晶体于下述条件下形成:2μl结晶缓冲液(15%的peg3350,1m的licl,0.1m的mes,ph6.0)于2μl蛋白溶液(10mg/ml目标蛋白,10mm tris,150mm nacl,ph 7.4)混合,于22℃在静置液滴中结晶。大约3天后长出晶体。之后将晶体置于下述溶液中:17%peg3350,1m licl,0.1m mes,ph6.0以及20%甘油;随后快速浸润并冷冻于液态氮中。x衍射数据通过ssrf bl17u收集。以野生型fc的结构(pdb登陆号:3ave)作为框架进行分子替换结
构解析。
[0230]
晶体结构显示,突变后的fc异二聚体其整体结构与野生型fc类似,但是在引入突变的ch3界面上由于不同的侧链基团相互作用而有所改变。ch3界面的具体晶体结构见图3。
[0231]
2、新突变候选组合的获得
[0232]
根据突变组合4晶体结构的结果进一步筛选新的候选突变。
[0233]
首先,我们通过晶体三维结构发现,链a上的y349c与链b上的d356c由于两个cys侧链基团的方向问题,并不能形成二硫键,而是成为了一对游离巯基。根据这一结果,我们将在第三轮突变中取消这一对突变,使其还原为突变前野生型氨基酸序列。
[0234]
第二,通过三维结构建模比较,在f405k-k409a这一对突变氨基酸残基对附近,进一步引入突变,改变离子键以及氢键。假设k409a位于a链上,f405k位于链b上。则于链a上引入k392d突变、链b上引入d399s突变。如图4所示,对于链a与链b之间的相互作用,新引入的突变对加入了k392d-f405k这一对离子键,以及k392d-d399s这一对氢键,预计能有效提高异二聚体的形成趋势。而a链-a链相互作用中,则引入了k329d-d399之间的静电斥力,抑制a链同二聚体形成。在链b-链b相互作用中,原有的k409-d399之间的离子键则由于d399s突变的引入而消失,降低了b链同二聚体形成的趋势。
[0235]
第三,将突变组合4的晶体结构与野生型fc蛋白晶体结构比较,发现突变组合4中的链a有外移(即远离链b),推测可能是由于链a中t366w突变中,变大的侧链基团带来了一定的空间位阻。在此基础上我们进一步将链b上与链a中t366w残基相接触的氨基酸残基突变为带有更小侧链基团的氨基酸残基,如在链b上,将原有的y407v和l368a突变替换为y407a和l386g两个突变,为t366w突变留出足够的空间,这样有可能进一步稳固异二聚体结构。
[0236]
第四,在f405k-k409a这一对突变氨基酸残基对外围,对其他接触界面氨基酸对进行突变,改变界面静电作用。此处考察y349与e357这一对接触氨基酸。链a引入突变y349d,链b引入e357a。则a-a之间y349d与e357a之间引入的静电斥力会抑制a-a同二聚体形成;a-b之间以及b-b之间并未引入新的作用力。在此基础上,a链进一步引入s354d突变,加强其与e357a之间的静电斥力,进一步抑制a-a同二聚体的形成。
[0237]
先以突变组合4为基础,引入上述突变,得到的突变组合如表8所示:
[0238]
表8:异二聚体突变组合列表-3
[0239][0240]
随后以突变组合2为基础引入上述突变同时参考突变组合4,得到的突变组合如表9所示:
[0241]
表9:异二聚体突变组合列表-4
[0242][0243]
实施例6:制备并考察第三轮scfv-fc/vhh-fc异二聚体突变组合
[0244]
1、构建表达突变的人igg1的fc片段以及scfv-fc融合蛋白的重组载体
[0245]
考虑到单纯的fc片段表达水平较scfv-fc低,为了能更好的掌握两条链的表达比例,我们在原来的b链(单纯的fc链)的n端融合了一段骆驼单域抗体的可变区序列(标记为vhh)。人工合成获得如seq id no:36所示的vhh-fc融合蛋白编码基因,该基因编码vhh-fc融合蛋白序列见seq id:35,之后亚克隆至哺乳动物细胞表达载体pcdna4(invitrogen,cat v86220)获得用于哺乳动物细胞表达vhh-fc融合蛋白的重组表达载体。
[0246]
以实施例2中构建好的野生型scfv-fc蛋白表达重组载体以及上述vhh-fc融合蛋白的重组表达载体为模板,根据实施例5的表8,利用重叠pcr法对scfv-fc及vhh-fc编码基
因(seq id no:5及seq id no:36)进行组合突变,其中针对a链的突变位于scfv-fc融合蛋白上,针对b链的突变位于vhh-fc蛋白上。将突变后的基因亚克隆到pcdna4(invitrogen,cat v86220),最终得到用于在哺乳动物细胞中表达第三轮突变的scfv-fc融合蛋白及突变的vhh-fc蛋白(seq id no:4到seq id no:35)的重组表达载体。
[0247]
2、瞬时表达scfv-fc/vhh-fc异二聚体,并检测不同突变组合对异二聚体含量的影响
[0248]
按照实施例2-2中所述的方法,将表8中的4种突变组合(10至13),以及突变组合4利用293h细胞(atcc crl-1573),进行瞬时表达。其中a链和b链的重组表达载体共转比例为4:1,1:1以及1:4。培养5至6天后,收集瞬时表达培养上清液,通过protein a亲和层析法,得到初步纯化的4组新突变组合、以及突变组合4的瞬转产物。这些瞬转产物中都包含了不同比例的同二聚体蛋白(scfv-fc/scfv-fc,vhh-fc/vhh-fc)和异二聚体蛋白(scfv-fc/vhh-fc)。由于这三种蛋白(scfv-fc/scfv-fc,vhh-fc/vhh-fc,和scfv-fc/vhh-fc)的分子量大小有差异,可以通过非还原条件下sds-page电泳检测每组产物中同二聚体蛋白(scfv-fc/scfv-fc,vhh-fc/vhh-fc)和异二聚体蛋白(scfv-fc/vhh-fc)的组成情况,同时用biorad公司推出的imagelab专业图像分析软件进行同二聚体蛋白(scfv-fc/scfv-fc,vhh-fc/vhh-fc)和异二聚体蛋白(scfv-fc/vhh-fc)比例的分析,电泳检测结果如表10所示。
[0249]
表10.各突变组合瞬转产物中同二聚体和异二聚体的比例-3
[0250][0251]
为了进一步考察新引入的突变对a链-a链以及b链-b链同二聚体的影响,我们单独
瞬时的表达a链蛋白或b链蛋白,通过在比较相同瞬转条件下的同二聚体蛋白的表达水平,考察其同二聚体形成的趋势。重组表达载体用pei分别转染至悬浮培养的293h细胞(atcc crl-1573),培养5-6天后,收集细胞上清。通过protein a亲和层析法,得到各自的瞬转产物,并利用od280检测其表达水平。结果见表11。
[0252]
表11.各突变组合中链a或链b同二聚体表达水平比较-2
[0253][0254]
综合上述结果,可以看出。对突变组合4引入第三轮突变后,虽然并未在抑制链a同二聚体形成过程中展示出显著效果,但是却都显著抑制了链b的同二聚体形成、并有效促进了异二聚体形成。在两条链表达接近平衡(1:1)的时候,几组新突变组合中异二聚体含量都能达到80%以上,比突变组合4有较明显的提高。其中突变组合11中,针对链b的新突变基本已可以完全抑制链b同二聚体的形成。可以看到即使在1:4(a:b)的瞬转比例下,仍然观察不到链b同二聚体,且异二聚体含量达到了89%。
[0255]
根据组合10至13的结果,我们进一步选择突变组合15,16,18,通过瞬时表达,考察其促进异二聚体形成的效果。
[0256]
按照实施例2-2中所述的方法,将表9中的3种突变组合(15,16,18),以及突变组合2利用293h细胞(atcc crl-1573),进行瞬时表达。其中a链和b链的重组表达载体共转比例为4:1,1:1以及1:4。培养5至6天后,收集瞬时表达培养上清液,通过protein a亲和层析法,得到初步纯化的3组新突变组合、以及突变组合2的瞬转产物。这些瞬转产物中都包含了不同比例的同二聚体蛋白(scfv-fc/scfv-fc,vhh-fc/vhh-fc)和异二聚体蛋白(scfv-fc/vhh-fc)。由于这三种蛋白(scfv-fc/scfv-fc,vhh-fc/vhh-fc,和scfv-fc/vhh-fc)的分子量大小有差异,可以通过非还原条件下sds-page电泳检测每组产物中同二聚体蛋白(scfv-fc/scfv-fc,vhh-fc/vhh-fc)和异二聚体蛋白(scfv-fc/vhh-fc)的组成情况,同时用biorad公司推出的imagelab专业图像分析软件进行同二聚体蛋白(scfv-fc/scfv-fc,vhh-fc/vhh-fc)和异二聚体蛋白(scfv-fc/vhh-fc)比例的分析,电泳检测结果如表12所示。可以看出。对突变组合2引入第三轮突变后,同样是在抑制链b的同二聚体形成上展示出了更显著的效果,并有效促进了异二聚体形成。在两条链表达接近平衡(1:1)的时候,几组新突变组合中异二聚体含量都能达到80%以上,比突变组合4有较明显的提高。其中突变组合16与18在适当改变瞬转载体比例的情况下(链b质粒过量或两个质粒平衡),其异二聚体的比例仍然达到了80%以上。
[0257]
表12.各突变组合瞬转产物中同二聚体和异二聚体的比例-4
[0258][0259]
实施例7:异二聚体的其他指标考核
[0260]
1、异二聚体的加速稳定性检测
[0261]
我们选择了突变组合4,11及16的异二聚体进行了加速稳定性的实验,实验周期31天,温度45℃,buffer为pbs。于第0天,第8天,第18天和第31天进行非还原ce-sds的检测,并与相应的野生型fc蛋白进行比较。31天加速稳定性sds-page结果表明,三个突变样品及野生型对照样品,直到第31天,其主峰含量的下降均不超过2%。可以认为异二聚体具有和野生型相同的热稳定性。
[0262]
尽管本技术所述发明的具体实施方式已经得到详细的描述,本领域技术人员将会理解。根据已经公开的所有教导,可以对那些细节进行各种修改和替换,这些改变均在本技术所述发明的保护范围之内。本技术所述发明的全部范围由所附权利要求及其任何等同物给出。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1