蓄热材料的制作方法
本发明涉及蓄热材料、尤其是化学蓄热材料,具体地说,涉及在低温下进行水蒸气(水)的吸附和解离、并且蓄热量大的化学蓄热材料。
背景技术:
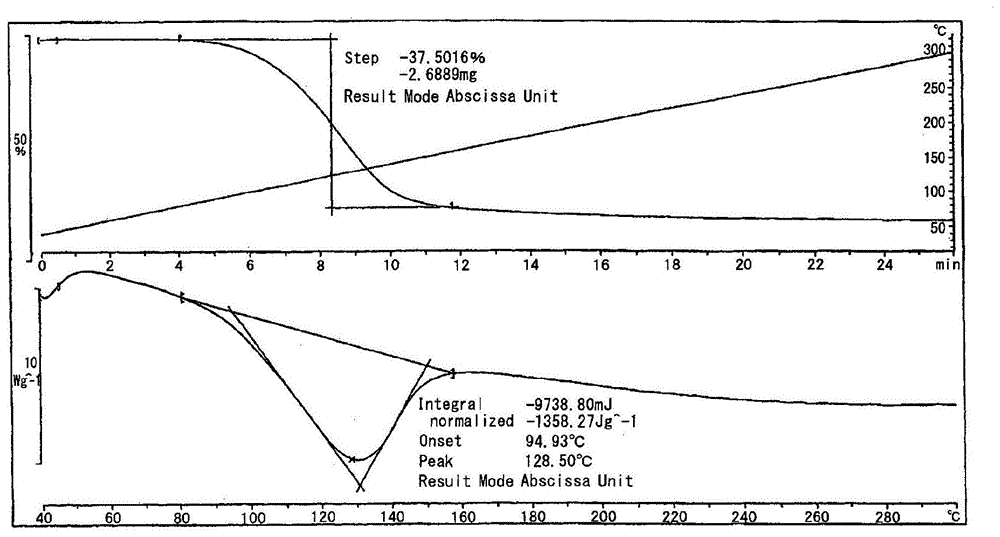
:蓄热材料是能够储藏热能的材料的总称,能够进行热的吸收、释的蓄热材料也是大家知道的。作为这样的蓄热材料有:利用材料的热容量而赋予温度差、从而蓄积热能的显热蓄热材料,利用材料发生相变之际热能的出入来蓄热的潜热蓄热材料,利用反应介质和蓄热材料接触之际产生的化学反应热来进行蓄热的化学蓄热材料。其中,化学蓄热材料具有以下优点:蓄热容量大,能够在一定温度下取出热,进而如果将反应物质分离,能够在常温下储藏。作为所述化学蓄热材料的代表例,可以列举出氧化钙,已知其伴随着水和·脱水反应而进行热的释放和吸收。此外,作为其他的化学蓄热材料,已经提出了含有由金属元素和有机配体构成的配位高分子的蓄热材料(专利文献1)。专利文献1中公开了通过使由硝酸铜(ii)3水和物、异烟酸和水形成的混合物反应而得到化合物,对该化合物通过差示扫描热量测定装置进行测定,显示出水的解离温度为63.5℃、吸热量(蓄热量)为309j/g。现有技术文献专利文献专利文献1:日本特开2005-097530号公报技术实现要素:发明要解决的课题在使用前述氧化钙作为化学蓄热材料的场合,水和反应产生的发热在30℃以下的低温下也进行,热的放出良好,但为了使水和反应生成的氢氧化钙进行脱水反应(蓄热),需要400℃以上的高温,因而实用上存在问题。此外,专利文献1中记载的,在使用由金属元素和有机配体构成的配位高分子作为化学蓄热材料的场合,尽管能够利用的温度可以是200℃以下,但存在以下问题:与所述氧化钙的体系相比,蓄热量小,作为蓄热材料的性能不充分。因此,本发明的课题是解决前述问题,即、提供能够低温下进行水蒸气(水)的吸附·解离,也就是在低温下能够利用、并且蓄热量大的化学蓄热材料。解决课题的手段本发明人为了解决前述课题而进行了反复深入的研究,结果发现如果使用碳原子数2~10的脂肪族多元羧酸金属盐,则能够在低温进行水蒸气(水)的吸附·解离、并且蓄热量大,由此得到显示良好性能的化学蓄热材料,从而完成本发明。即、本发明作为观点1,涉及一种化学蓄热材料,含有碳原子数2~10的脂肪族多元羧酸金属盐,通过水蒸气即水的吸附或解离显示发热性或吸热性。作为观点2,涉及观点1所述的化学蓄热材料,所述脂肪族多元羧酸是选自二羧酸、三羧酸和四羧酸中的至少一种。作为观点3,涉及观点2所述的化学蓄热材料,所述脂肪族多元羧酸是二羧酸。作为观点4,涉及观点1~3的任一项所述的化学蓄热材料,所述脂肪族多元羧酸是碳原子数2~4的多元羧酸。作为观点5,涉及观点1所述的化学蓄热材料,所述脂肪族多元羧酸是选自草酸、丙二酸和富马酸中的至少一种。作为观点6,涉及观点1所述的化学蓄热材料,所述脂肪族多元羧酸是富马酸。作为观点7,涉及观点1~6的任一项所述的化学蓄热材料,所述金属盐的金属种类是选自锂、钠、钾、镁、钙、锶、钡、铝、锰、铁、钴、铜、镍、锌、银和锡中的至少一种。作为观点8,涉及观点7所述的化学蓄热材料,所述金属盐的金属种类是碱土金属。作为观点9,涉及观点7所述的化学蓄热材料,所述金属盐的金属种类是选自镁和钙中的至少一种。作为观点10,涉及观点1~9的任一项所述的化学蓄热材料,通过水蒸气即水的吸附产生的发热量、或通过水蒸气即水的解离产生的吸热量为0.5mj/kg以上。作为观点11,涉及观点1~10的任一项所述的化学蓄热材料,水蒸气即水的解离温度为200℃以下。作为观点12,涉及一种热交换器,含有观点1~11中的任一项所述的化学蓄热材料。作为观点13,涉及观点12所述的热交换器,被用于利用车辆排出的热进行水蒸气即水的解离并蓄热、通过水蒸气即水的吸附进行发热的系统。作为观点14,涉及观点12所述的热交换器,被用于利用从工厂排出的热进行水蒸气即水的解离并蓄热、通过水蒸气即水的吸附进行发热的系统。作为观点15,涉及观点12所述的热交换器,被用于利用从机器装置排出的热进行水蒸气即水的解离并蓄热、通过水蒸气即水的吸附进行发热的系统。作为观点16,涉及观点一种系统,含有观点1~11中的任一项所述的化学蓄热材料,利用从车辆排出的热进行水蒸气即水的解离并蓄热、通过水蒸气即水的吸附进行发热。作为观点17,涉及观点一种系统,含有观点1~11中的任一项所述的化学蓄热材料,利用从工厂排出的热进行水蒸气即水的解离并蓄热、通过水蒸气即水的吸附进行发热。作为观点18,涉及观点一种系统,含有观点1~11中的任一项所述的化学蓄热材料,利用从机器装置排出的热进行水蒸气即水的解离并蓄热、通过水蒸气即水的吸附进行发热。发明效果本发明的蓄热材料,例如能够在200℃以下的低温下进行水蒸气(水)的吸附·解离,蓄热量大,所以能够用于例如便携型保温用具(暖宝)、食品干燥剂、饭盒的加热装置中的发热材料、酒的加热装置中的发热材料、吸附热泵用吸附剂、干燥剂空调装置用吸附剂、汽车用除湿干燥剂、住宅用除湿干燥剂等的各种产品。此外,本发明的蓄热材料可以是在需要吸收的热量时能够加以利用的高效的蓄热材料,可以作为例如车载用废热回收再利用系统等的蓄热材料使用。附图说明图1是试验前的tga-dsc曲线图。图2是脱水工序后的tga-dsc曲线图。图3是试验前的xrd图案。图4是脱水工序后的xrd图案。具体实施方式下面对本发明予以具体说明。本发明的化学蓄热材料,其特征在于,含有碳原子数2~10的脂肪族多元羧酸金属盐,通过水蒸气即水的吸附或解离显示发热性或吸热性。<化学蓄热材料>本发明中的化学蓄热材料是指,利用在反应介质和蓄热材料接触时产生的化学反应热进行热的吸收、释放的蓄热材料,尤其是指通过水蒸气(水)的吸附或解离而显示出发热性或吸热性的蓄热材料。对于上述所指的化学蓄热材料中的发热或吸热的机理,以氧化钙为例予以说明。氧化钙中的发热如下述(式1)所示,是在氧化钙通过水和反应(水蒸气(水)的吸附)转变为氢氧化钙时发生,而且氧化钙中的吸热如下述(式2)所示,在氢氧化钙通过脱水反应而变为氧化钙之际发生。(式1)cao+h2o→ca(oh)2+1.46mj/kg(式2)ca(oh)2+1.46mj/kg→cao+h2o由上述(式1)和(式2)可知,1.46mj/kg的热量在水和反应或脱水反应之际被发热或吸热,该发热和吸热的量可以被看作是被蓄积在化学蓄热材料(氧化钙)中。<碳原子数2~10的脂肪族多元羧酸金属盐>[碳原子数2~10的脂肪族多元羧酸]作为用于构成可以在本发明中使用的碳原子数2~10的脂肪族多元羧酸金属盐的碳原子数2~10的脂肪族多元羧酸,只要是包括羧基的碳原子在内碳原子数为2~10、并且具有2个以上羧基的脂肪族化合物,就没有特殊限定,此外也可以是兼有羟基的羟基羧酸。作为这些脂肪族多元羧酸,可以列举出例如草酸、丙二酸、琥珀酸、富马酸、马来酸、丁炔二酸、苹果酸、酒石酸、戊二酸、己二酸、庚二酸、辛二酸等二羧酸;乌头酸、柠檬酸、环己烷-1,2,4-三羧酸等的三羧酸;丁烷-1,2,3,4-四羧酸、环丁烷-1,2,3,4-四羧酸、环己烷-1,2,4,5-四羧酸等的四羧酸;苹果酸、酒石酸、柠檬酸等的羟基羧酸等。作为碳原子数为2~10的脂肪族多元羧酸,优选列举出选自二羧酸、三羧酸和四羧酸中的至少一种,更优选列举出二羧酸。此外,作为碳原子数为2~10的脂肪族多元羧酸,优选列举出碳原子数为2~4的多元羧酸,此外,优选列举出选自草酸、丙二酸和富马酸中的至少一种,更优选列举出富马酸。这些脂肪族多元羧酸既可以单独使用,也可以二种以上混合使用。优选单独使用。[金属种类]作为用于构成可以在本发明中使用的碳原子数2~10的脂肪族多元羧酸金属盐的金属,可以使用1价、2价和3价的金属。作为所述金属,优选列举出选自锂、钠、钾、镁、钙、锶、钡、铝、锰、铁、钴、铜、镍、锌、银和锡中的至少一种。作为所述金属,更优选列举出碱土金属,进而优选列举出选自镁和钙中的至少一种。这些金属既可以单独使用,也可以二种以上混合使用。[脂肪族多元羧酸金属盐的制造]对于脂肪族多元羧酸金属盐的制造方法,没有特殊限定,可以通过将所述脂肪族多元羧酸、和所述金属的氯化物、硫酸盐或硝酸盐、与氢氧化钠等碱在水中混合发生反应,使脂肪族多元羧酸的金属盐析出、过滤、干燥,而作为结晶性粉末得到。此外,还可以通过将所述脂肪族多元羧酸与所述金属的氧化物、氢氧化物或碳酸盐在水中混合、发生反应,使脂肪族多元羧酸的金属盐析出、过滤、干燥而得到。得到的粉末的形态,通常是粒状结晶、板状结晶、长条状结晶、棒状结晶、针状结晶等,进而也可以是这些结晶层叠而成的形态。这些化合物(结晶性粉末),在有市售的情况可以使用市售品。蓄热量的评价,可以通过差示扫描热量测定得到的热收支(吸热或放热量)进行,作为本发明的化学蓄热材料的蓄热量,优选为0.5mj/kg以上、更优选为0.7mj/kg以上、尤其优选为1.0mj/kg以上。因此,本发明的化学蓄热材料优选具有这样的热收支。该热收支的上限没有特殊限定,越高越优选,但通常是10mj/kg以下。本发明的化学蓄热材料可以发生水蒸气(水)的吸附·解离的温度优选为200℃以下、例如为-30~200℃、更优选为30~180℃、尤其优选为50~100℃。如果在该温度范围具有热收支,则可以利用吸热、发热这两者作为化学蓄热材料。例如在吸热的场合,可以用于排热回收、热岛(heatisland)现象的缓和等,此外,在发热的场合可以用于暖气、汽车发动机的暖风等。因此,本发明的化学蓄热材料优选在差示扫描热量测定中-30~200℃、尤其30~180℃、尤其是50~100℃的温度范围具有热收支。本发明此外涉及含有上述化学蓄热材料的热交换器。本发明此外还涉及在利用车辆、工厂、机器装置等排出的热进行水蒸气(水)的解离并蓄热,通过水蒸气(水)的吸附进行发热的系统中使用的所述热交换器。本发明此外还涉及含有上述化学蓄热材料、利用从车辆、工厂、机器装置等排出的热进行水蒸气(水)的解离并蓄热,通过水蒸气(水)的吸附进行发热的系统。在所述系统的一个方案中,该系统由反应器、蒸发器、冷凝器、切换流路的阀等构成,反应器中具有被填充了上述化学蓄热材料、进而用于快速进行加热、冷却的热交换器。于是,在蓄热时从车辆、工厂、机器装置等排出的高温的排热被导入到反应器中,从化学蓄热材料解离出水蒸气(水),生成的水蒸气(水)在冷凝器中液化,而且在放热时将水蒸气(水)从蒸发器送向化学蓄热材料(水蒸气(水)解离后的),使其吸附·发热,将该热经由热交换器快速取出体系并利用。例如从车辆释放的排热,通过所述系统可以有效被用于空调、发动机、atf、排气催化剂等的暖气。产业可利用性通过本发明,能够在低温下蓄积大量的热,实现未利用废热的有效利用。实施例下面列举出实施例来对本发明进行更具体的说明,但本发明不受下述实施例限定。再者,实施例中试样的调制和物性的分析中使用的装置和条件如下。(1)热重量/差示扫描热量测定(tga-dsc)装置:mettler-toledo社制tga/dsc1测定温度(实施例1~10):40~300℃测定温度(比较例1):40~500℃加热速度:10℃/分氮气流:50ml/分样品盘:铝盘(2)粉末x射线解析(xrd)装置:(株)リガク制デスクトップx射线衍射装置miniflex(注册商标)600测定角度(2θ):3~40度扫描速度:15度/分[制造例1]草酸镁(oxa-mg)的制造将草酸二水和物[纯正化学(株)制]6.48g(51.4mmol)、氢氧化镁[纯正化学(株)制]3.00g(51.4mmol)和水50g混合,在90℃下搅拌5小时。将反应混合物冷却到室温(约23℃),将析出的固体过滤。将该固体在减压下、50℃干燥1小时而得到草酸镁(水和物)7.01g。[制造例2]草酸钙(oxa-ca)的制造将草酸二水和物5.10g(40.5mmol)、氢氧化钙[纯正化学(株)制]3.00g(40.5mmol)和水50g混合,在90℃下搅拌5小时。将反应混合物冷却到室温(约23℃),将析出的固体过滤。将该固体在减压下、50℃干燥1小时而得到草酸钙(水和物)5.57g。[制造例3]草酸锰(oxa-mn)的制造将草酸二水和物3.29g(26.1mmol)、碳酸锰[纯正化学(株)制]3.00g(26.1mmol)和水30g混合,在90℃搅拌4小时。将反应混合物冷却到室温(约23℃),将析出的固体过滤。将该固体在减压下、50℃干燥1小时而得到草酸锰(水和物)4.20g。[制造例4]草酸锌(oxa-zn)的制造将草酸二水和物3.81g(30.2mmol)、氢氧化锌[纯正化学(株)制]3.00g(30.2mmol)和水30g混合,在90℃下搅拌4小时。将反应混合物冷到室温(约23℃),将析出的固体过滤。将该固体在减压下50℃干燥1小时而得到草酸锌(水和物)5.29g。[制造例5]丙二酸镁(maa-mg)的制造将丙二酸[东京化成工业(株)制]5.35g(51.4mmol)、氢氧化镁3.00g(51.4mmol)和水31g混合,在90℃搅拌3小时。将反应混合物冷却到室温(约23℃),将析出的固体过滤。将该固体在减压下50℃干燥1小时而得到丙二酸镁(水和物)7.25g。[制造例6]富马酸镁(fua-mg)的制造将富马酸[纯正化学(株)制]5.97g(51.4mmol)、氢氧化镁3.00g(51.4mmol)和水33g混合,在90℃搅拌3小时。将反应混合物冷却到室温(约23℃),将析出的固体过滤。将该固体在减压下、50℃干燥1小时而得到富马酸镁(水和物)5.64g。[制造例7]富马酸钙(fua-ca)的制造将富马酸4.70g(40.5mmol)、氢氧化钙3.00g(40.5mmol)和水30g混合,在90℃搅拌2.5小时。将反应混合物冷却到室温(约23℃),将析出的固体过滤。将该固体在减压下、50℃干燥1小时而得到富马酸钙(水和物)6.50g。[制造例8]酒石酸镁(taa-mg)的制造将l-酒石酸[纯正化学(株)制]5.15g(34.3mmol)、氢氧化镁2.00g(34.3mmol)和水33g混合,在90℃搅拌5小时。将反应混合物冷却到室温(约23℃),将析出的固体过滤。将该固体在减压下、50℃干燥1小时而得到酒石酸镁(水和物)6.40g。[制造例9]柠檬酸镁(cia-mg)的制造将柠檬酸[纯正化学(株)制]6.59g(34.3mmol)、氢氧化镁3.00g(51.4mmol)和水30g混合,在90℃搅拌5小时。将反应混合物冷却到室温(约23℃),将析出的固体过滤。将该固体在减压下、50℃干燥1小时而得到柠檬酸镁(水和物)9.65g。[制造例10]环丁烷-1,2,3,4-四羧酸镁(cbta-mg)的制造将环丁烷-1,2,3,4-四羧酸[aldrich社制]1.00g(4.29mmol)、氢氧化镁0.50g(8.57mmol)和水5g混合,在90℃搅拌3小时。将反应混合物冷却到室温(约23℃),将析出的固体过滤。将该固体在减压下、50℃干燥1小时而得到环丁烷-1,2,3,4-四羧酸镁(水和物)1.41g。[实施例1~10、比较例1]对制造例1~10得到的脂肪族羧酸金属盐和氢氧化钙[纯正化学(株)制]进行热重量/差示扫描热量测定,评价通过水的解离产生的吸热量(蓄热量)和吸热开始温度(水的解离温度)。将结果一并示于表1。表1化合物蓄热量[mj/kg]解离温度[℃]实施例1oxa-mg0.90167实施例2oxa-ca0.53130实施例3oxa-mn0.71121实施例4oxa-zn0.66118实施例5maa-mg0.94181实施例6fua-mg1.3080实施例7fua-ca0.6686实施例8taa-mg0.61101实施例9cia-mg0.84125实施例10cbta-mg0.83161比较例1ca(oh)21.34427如表1所示,本发明的蓄热材料的蓄热量大,为0.5mj/kg以上,此外确认蓄热开始温度(水的解离温度)为200℃以下。尤其是由富马酸镁形成的蓄热材料(实施例6),蓄热量大于1mj/kg,蓄热开始温度为100℃以下,可以确认,其作为蓄热材料显示出了非常优异的性能。另一方面,作为公知蓄热材料的氢氧化钙,尽管蓄热量大,但蓄热开始温度非常高,是400℃以上,确认不实用。[实施例11]反复特性评价将fua-mg5.00g放入表面皿中,反复进行以下操作5次。(1)脱水工序:在减压下、90℃静置4小时,(2)水蒸气吸附工序:在室温(约23℃)、相对湿度100%下静置18小时针对各工序后的试样进行热重量/差示扫描热量测定和粉末x射线解析,评价由水的解离产生的吸热量(蓄热量)、吸热开始温度(水的解离温度)、热重量减少和xrd图案。将结果示于表2。此外,将试验前的tga-dsc曲线示于图1,将第一次脱水工序后的tga-dsc曲线示于图2,将试验前的xrd图案示于图3,将第一次脱水工序后的xrd图案示于图4。表2如表2所示,本发明的蓄热材料,即使反复进行水的解离(脱水)/吸附,蓄热量、解离温度之类的蓄热性能也几乎没有变化,确认具有优异的反复特性。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1