一种双酚A适配体亲和柱及其制备方法和用途与流程
本发明涉及一种双酚A的适配体亲和柱及其制备方法和用途。属食品安全检测领域。
背景技术:
双酚A 是2,2-双(4-羟基苯基)丙烷的俗称,又称二酚基丙烷, 由2 分子苯酚和1 分子丙酮在酸性介质中催化缩合而成的酚类物质。它是生产聚碳酸酯(Polycarbonate,PC) 及环氧树脂(epoxyResin,EP)的主要原料,又可用作酚醛树脂、可塑性聚酯、抗氧剂及聚氯乙烯(PVC)稳定剂等。在食品包装方面, 添加BPA 的塑料具有无色透明、耐用、轻便以及抗摔等特性,在食品包装材料、容器内壁涂料等方面有着重要的用途,尤以婴儿奶瓶,金属罐容器的内涂层最为普遍存在。
双酚A 可通过食品包装和塑料薄膜迁移到食品或是饮料中,被人体吸收,进而逐步危害人体健康,可使人类和野生动物的内分泌系统、免疫系统、神经系统出现异常,还会严重干扰人类和动物的生殖遗传功能。研究报道,双酚A 具有雌性激素的特性,对肝脏、肾脏、乳腺有一定的损伤; 同时双酚A 也与肥胖症、糖尿病以及男性不孕有关,研究证实,低剂量的双酚A( 10 -7 mol /L) 即能引起支持细胞和精子细胞死亡。双酚A 的危害已引起诸多研究者及世界卫生组织的广泛关注,很多国家已经颁布了相关法律,禁止在食品包装材料中添加含双酚A 的物质,尤其是婴儿用品。2014 年,欧洲食品安全局提议将目前双酚A 每日最大摄入量由0.05 mg /( kg·d) 降低到0.005 mg /( kg·d) 。1994 年,我国公布的卫生标准中对双酚A 用量规定为每升蒸馏水中所含的双酚A 要小于0.05 mg。尽管目前对双酚A 的限量在不断降低,但由于管理不够规范,人们在日常生活中经常食用的食品常常使用以双酚A 作为添加剂的材料包装。有研究表明,在某些食品、纸杯、人体血液、人体尿液、人体唾液、自然界中的水、奶瓶等样品中均可检测出双酚A。由于双酚A 危害极大,因此建立检出限低、准确、快速的双酚A 检测方法尤为重要。
双酚A的检测方法包括荧光法、酶联免疫吸附法、紫外分光光度法、气相色谱发及高效液相色谱法等。
紫外分光光度法利用双酚A在278nm波长是具有吸收峰来检测,其优点是操作简单便捷。但此方法受到环境影响及溶剂影响很大,准确度不高,并且变异较大。
酶联免疫吸附技术法利用抗原抗体特异性结合的特点来检测,具有特异性高,灵敏性强,且检测成本低的优点。BPA 是一种小分子,不能直接用于免疫动物, 但可以与抗体发生特异性结合反应。竞争型酶联免疫吸附分析法(ELISA)就是利用这种特性。石春红[食品工业科技,2011(01),290-292]等建立了间接竞争ELISA检测双酚A的方法,检测限为1 ng/mL, 对PC 材质的桶装水做回收试验, 回收率为92.5%~107.7%。但是由于双酚A是小分子,免疫原性弱,难以获得高亲和力的抗体。从而限制了此方法的开发。
原子荧光光谱法是以原子在辐射能激发下发射的荧光强度进行定量分析的发射光谱分析法.唐舒雅等[工业水处理,2006,26(3):74-76]利用在pH=1的酸性介质中,β-环糊精对BPA荧光强度有增强作用的特点,建立了荧光测定法.该方法的线性范围为0.4-300ug/L,相对标准偏差为1.3%,检出限为0.02ug/L。
高效液相色谱法( HPLC)具有准确度高、灵敏性强、可微量测定等优点,是目前常用于食品中小分子检测的方法。尤其是高效液相色谱-质谱联用技术在双酚A的检测中广泛应用。但因其此方法对样品中小分子纯度的要求较高,导致检测成本高、周期长,无法满足大批量样品快速筛选的需要,所以使用受到限制。今年来发展起来的固相萃取柱-高效液相色谱(SPE-HPLC))将固相萃取技术与高效液相色谱相结合。使HPLC的使用更加广泛。固相萃取作为一种新的净化技术,在食品安全分析检测中应用越来越广泛。它是将疏水性固相载体上填充柱管制备而成。当样品提取液通过柱子时,由于样本中物质的极性的不同而分离开来。分步洗脱就能得到纯度较高的目的物。
但是由于样本中成分复杂,很多物质都具有相似的极性,导致固相萃取得到的洗脱产物常常组分较多。导致固相萃取得到的双酚A杂质较多,影响随后的HPLC检测。因而,需要一种特异性的双酚A纯化方法。
免疫亲和柱是替代固相萃取柱常用的净化手段,利用抗原抗体特异性的亲和作用来分离目标物。是替代固相萃取柱的理想选择。免疫亲和柱-高效液相色谱联用(IAC-HPLC)也是目前食品安全检测常用的检测技术。免疫亲和柱具有操作简单,特异性高的优点。但是由于抗体获得困难,免疫亲和柱通常比较昂贵。并且由于抗体本身是一种蛋白质,其活性受到周围环境的影响。保存不当或者操作不当很容易造成抗体失活从而影响免疫亲和柱的效率。由于双酚A是小分子物质,免疫原性差,用于制备抗体难度很大。导致无法得到有效的双酚A抗体用于制备免疫亲和柱。
适配体是一段核酸序列,通常为DNA或者RNA序列。 单链的核酸序列可以形成二级结构,从而能与靶点特异性结合。通过多次的富集和筛选,能够筛选到与靶点有高亲和力的特异性适配体。Herman等描述了核酸适配体的结合特异性,[Science 287,820-825].核酸适配体相对于抗体来说更稳定,不易受到环境的影响,并且核酸适配体可以化学合成,保证序列的准确性。[Song. Trends Analy. Chem 2008.27(2)]。
核酸适配体被应用于小分子的检测,在专利CN105505940A中,描述了一种黄曲霉毒素B1的适配体DNA传感器。通过黄曲霉毒素B1的适配体,及多条互补探针序列制备DNA传感器,通过酶底物反应,实现黄曲霉毒素B1的检测。在专利CN104399283中,描述了一种黄曲霉毒素B1的适配体亲和柱。该专利利用环氧基活化的琼脂糖微球,将黄曲霉毒素B1的适配体偶联,制备成亲和柱。实现黄曲霉毒素B1的分离。
技术实现要素:
本发明的目的在于提供一种双酚A适配体亲和柱及其制备方法和用途
在本发明中,我们利用SELEX系统,从适配体文库中筛选出来一组高特异性、高亲和力的的新的双酚A的单链DNA适配体。适配体修饰后与N-羟基琥珀酰亚胺活化的载体通过共价键进行偶联。经过洗涤和封闭得到双酚A的特异性载体。载体装柱后就形成了高亲和力的双酚A适配体亲和柱
该亲和柱操作简便,纯化双酚A效率高。能耐受有机溶剂,并且可以重复使用。样本经过简单的处理后就可以进行纯化,得到纯度很高的双酚A。用于高效液相色谱检测和质谱检测。
具体操作如下:
本发明最大的优势就是利用了核酸适配体的特性,通过多轮的富集、洗涤、扩增等步骤,筛选出针对双酚A的特异性适配体。通过序列测定得到适配体的序列
核酸适配体相对于抗体来说,具有适应环境广泛,能够耐受高温、能耐受有机溶剂并且操作方便等优点。最主要的,适配体在制备过程中不需要经过动物体内的过程,而是通过化学合成来获得。因此,生产周期短,并且可以通过合成条件保证序列的准确性
以核酸适配体为基础制备的亲和柱具有特异性好,双酚A结合量大,纯化效率高的特点
双酚A适配体亲和柱及其制备方法说明如下
1.选择N-羟基琥珀酰亚胺(NHS)修饰的琼脂糖载体sepharose4B,进行活化
取1gN-羟基琥珀酰亚胺修饰的琼脂糖,加入用50ml 1mM的HCl,溶胀30min后,凝胶用100ml 1mM HCl洗涤6次,再用100ml超纯水洗涤
2.将活化好的琼脂糖凝胶sepharose4B用偶联缓冲液(0.1M的NaHCO3,0.8M NaCl,PH8.2)洗涤3次。加入20mol/L的氨基修饰的双酚A适配体,室温偶联8小时
3.将偶联好的双酚A适配体-琼脂糖载体用20mM,PH7.4的磷酸缓冲液PBS洗涤3次
4.封闭
将偶联好的双酚A适配体-琼脂糖载体中加入100mmol/L的Tris.Cl PH8.0 ,室温反应2小时
5.将封闭好的双酚A适配体-琼脂糖载体用20mM,PH7.4的磷酸缓冲液PBS洗涤3次
6.装柱
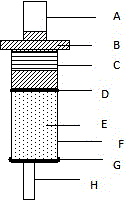
将双酚A—琼脂糖载体根据需要装入层析柱中,可根据需要制备不同容量的双酚A亲和柱。层析柱的结构如附图1所示:
与现有技术相比,本发明具有如下优点:
1.本发明充分的利用了核酸适配体的优点,通过多轮的筛选和富集。得到了高特异性高亲和力的双酚A核酸适配体。该适配体能够特异性的结合样本中的双酚A,有效去除了固相萃取柱常见的杂质较多,组分复杂的缺点。降低了抗体亲和柱经常遇到的交叉反应性。亲和柱效率大幅度提高
核酸适配体不受操作环境和有机溶剂的影响,尤其适合真菌毒素类的脂溶性物质的纯化。相比较,具有同样结合特异性的免疫亲和柱,因为其中的抗体不耐有机溶剂,有机溶剂常常会造成抗体的失活而使亲和柱效率降低
此外,由于有机溶剂导致抗体失活,因此免疫亲和柱通常为一次性使用。而核酸适配体亲和柱可以耐受有机溶剂,可以重复使用多次,大幅度降低了使用成本
2.本发明使用的核酸适配体可以通过化学合成法获得,可以保证序列的正确性。大幅度降低了不同批次间的变异。而相对来说,不同批次的抗体来自于不同的小鼠或者兔子,导致抗体间质量变异较大,使亲和柱质量存在差别
3.使用本发明纯化双酚A操作简便,几步就可以得到纯度较高的双酚A。更方便操作者使用
4.使用本发明的产品得到的双酚A纯度很高,后续不用再做别的纯化处理就可以直接用于高效液相色谱检测或者荧光检测。节省了操作者的时间和费用。
附图说明
图1:双酚A适配体亲和柱结构组份示意图
A:进样口塞;B:活塞适配器;C:稳定箍;D:上筛板;E:柱体;F:载体填料;G:下筛板;H:出样口堵头
图2:双酚A适配体亲和柱外观结构图
A:进样口塞;B:活塞适配器;C:稳定箍;D:上筛板;E:柱体;F:载体填料; G:下筛板;H:出样口堵头
图3:水中双酚A检测的质谱检测图
图4:奶粉样本中双酚A检测的质谱检测图。
具体实施方式
实施例1:利用氨基修饰的双酚A适配体制备亲和柱
本发明制备双酚A适配体亲和柱的一个优选的实施方案如下:
1.载体活化
选择N-羟基琥珀酰亚胺(NHS)修饰的琼脂糖载体sepharose4B,进行活化
取1gN-羟基琥珀酰亚胺修饰的琼脂糖,加入用50ml 1mM的HCl,溶胀30min后,凝胶用100ml 1mM HCl洗涤6次,再用100ml超纯水洗涤
2.将活化好的琼脂糖凝胶sepharose4B用偶联缓冲液(0.1M的NaHCO3,0.8M NaCl,PH8.2)洗涤3次。加入20mol/L的氨基修饰的双酚A适配体,室温偶联8小时
3.将偶联好的双酚A适配体-琼脂糖载体用20mM,PH7.4的磷酸缓冲液PBS洗涤3次
4.封闭
将偶联好的双酚A适配体-琼脂糖载体中加入100mmol/L的Tris.Cl PH8.0 ,室温反应2小时
5.将封闭好的双酚A适配体-琼脂糖载体用20mM,PH7.4的磷酸缓冲液PBS洗涤3次
6.装柱
将交联后的双酚A-琼脂糖凝胶用10毫升20mM PBS PH7.4重悬,然后装入空的亲和纯化柱柱体中
1) 取空的柱体,加入下方筛板,加入1mlPBS,使其自然流干
2)加下方出样口堵头,在柱体中加入1ml上述处理后的双酚A适配体-琼脂糖凝胶载体,静止5分钟,使载体自然沉降
3)加入上方筛板,按压筛板,使其到达载体上方
4)加入活塞适配器,适配器有一个压紧作用,使上方筛板紧贴载体
5)从下方将稳定箍套在柱体上,使其紧贴进样口
6)拔掉出样口堵头,用注射器取5mlPBS,将注射器接在进样口上,缓慢的将PBS注入亲和柱中,使出液速度保持在1-2滴/秒。直至全部液体注入亲和柱
7)套上出样口堵头,套上进样口塞,将制备好的双酚A适配体亲和柱放入4℃保存。
实施例2:利用生物素修饰的双酚A适配体制备亲和柱
本发明制备双酚A适配体亲和柱的一个优选的实施方案如下:
1.取1ml链霉亲和素(SA)修饰的琼脂糖凝胶sepharose4B,用10ml超纯水洗涤3次
2.将(SA)修饰的琼脂糖凝胶sepharose4B用偶联缓冲液(0.02M的PBS,0.8M NaCl,PH7.4)洗涤3次。加入20mol/L的生物素修饰的双酚A适配体,室温偶联4小时
3.将偶联好的双酚A适配体-琼脂糖载体用20mM,PH7.4的磷酸缓冲液PBS洗涤3次
4.装柱
将双酚A—琼脂糖载体根据需要装入层析柱中,可根据需要制备不同容量的双酚A亲和纯化柱
1)取空的柱体,加入下方筛板,加入1mlPBS,使其自然流干
2)加下方出样口堵头,在柱体中加入1ml上述处理后的双酚A适配体-琼脂糖凝胶载体,静止5分钟,使载体自然沉降
3)加入上方筛板,按压筛板,使其到达载体上方
4)加入活塞适配器,适配器一个压紧作用,使上方筛板紧贴载体
5)从下方将稳定箍套在柱体上,使其紧贴进样口
6)拔掉出样口堵头,用注射器取5mlPBS,将注射器接在进样口上,缓慢的将PBS注入亲和柱中,使出液速度保持在1-2滴/秒。直至全部液体注入亲和柱
7)套上出样口堵头,套上进样口塞,将制备好的双酚A适配体亲和柱放入4℃保存。
实施例3:利用双酚A适配体亲和柱纯化和水中的双酚A
本实施例利用正常的纯化水样本中加入双酚A的标准品,然后用双酚A适配体亲和柱进行纯化,纯化后用高效液相色谱检测。测定回收率
1.样品处理
按照每毫升水样品10ng的标准,在水中添加双酚A标准品;
w将免疫亲和柱连接于10.0 ml一次性注射器下
w准确移取10ml加入双酚A标准品后的水样,注入一次性注射器中,将空气压力泵与玻璃注射器连接调节开关,使液体以1~2滴/秒的速度流出
w待液体排干后,首先用0.1%Tween-20水溶液洗涤10mL,再用蒸馏水或去离子水洗涤10mL,流速2~3滴/秒
w待液体排干后,更换新针筒,上样2ml乙腈,用刻度试管接洗脱液,流速1滴/秒;
w 洗脱后液体用氮气在 30℃条件下吹至近干
w 用10%乙腈水溶液溶解并定容到1ml
w 洗脱液用0.22μm微孔滤器过滤后转移至样品瓶用于HPLC分析
2.洗脱产物用高效液相色谱HPLC检测
高效液相色谱检测结果显示,从检测结果可以看出,在10毫升的水中加入100ng的双酚A,用本发明的适配体亲和柱可以回受到92.4ng,回收率为92.4%
质谱图见附图3。
实施例4:利用双酚A适配体亲和柱纯化和检测奶粉样品中的双酚A
1.前处理
按照每克奶粉样品100ng的标准,在奶粉样品中添加双酚A标准品
w取1g奶粉样本,加入100ng双酚A标准品,加入10ml 10mmolPBSPH7.4缓冲液,充分震荡混匀
w用快速定性滤纸过滤,收集滤液
w 全部滤液作为上样液过亲和柱净化
2. 净化
w 将亲和柱连接于10.0 ml一次性注射器下。按照前处理要求,准确移取相应体积的样品提取液注入一次性注射器中,将空气压力泵与玻璃注射器连接调节开关,使液体以1~2滴/秒的速度流出
w 待液体排干后,用蒸馏水或去离子水洗涤2次,每次10mL
w 待液体排干后,上样1mL甲醇,流速1滴/秒,收集洗脱液并定容至1mL
w 洗脱液用0.22μm微孔滤器过滤后转移至样品瓶用于HPLC分析
检测结果显示,在1g奶粉中加入100ng双酚A标准品,回收89.8ng,回收率89.8%
质谱图见附图4。
实施例5:双酚A适配体亲和柱重复使用柱容量的变化
本实施例利用定量的双酚A的标准品,然后用双酚A适配体亲和柱进行纯化。亲和柱上的双酚A用有机溶剂洗脱后,用高效液相色谱检测其浓度。亲和柱重新平衡后重复上样和洗脱,测定洗脱的双酚A浓度。主要目的是测试双酚A适配体亲和柱的重复使用性
1. 配制1ug/ml的双酚A标准品
2.取出双酚A适配体亲和柱,打开进样口塞,进样口与注射器针筒连接,注射器接入到气控操作架上
3.打开出样口塞,用10mmol/L PBS PH7.4洗涤亲和柱3次,每次10毫升,调节气孔操作架气泵压力,使液体以3滴/秒的流速流出
4.取100ul上述配制的双酚A标准品,总量100ng,加入亲和柱柱中,调节流量至1-2滴/秒。直至样品全部流出亲和柱
5.用蒸馏水洗涤纯化柱3次,每次5毫升
6.加入1ml甲醇,收集洗脱产物
7.洗脱产物用高效液相色谱HPLC检测
8.亲和柱用超纯水洗涤3次,每次10ml,然后用10mmol/L PBS PH7.4洗涤亲和柱3次,每次10毫升
9.再次上样100ul双酚A标准品,总量100ng
10. 按照上述操作洗涤及洗脱,洗脱产物用高效液相色谱检测其浓度
11. 再重复步骤8.9.10三次。检测洗脱产物的浓度
12. 计算总共5次的双酚A适配体亲和柱纯化的回收率
高效液相色谱检测结果见表4:
从上述结果可以看出,双酚A适配体亲和柱重复使用5次后,其结合能力没有明显的降低。
双酚A适配体序列1:
5'-CCGGTGGGTGGTCAGGTGGGATAGCGTTCCGCGTATGGCCCAGCGCATCACGGGTTCGCACCA-3'
双酚A适配体序列2:
5'-CCGCCGTTGGTGTGGTGGGCCTAGGGCCGGCGGCGCACAGCTGTTATAGACGTCTCCAGC-3'
双酚A适配体序列3:
5'-CCGCCGTTGGTGTGGTGGGCCTAGGGCCGGCGGCGCACAGCTGTTATAGACGCCTCCAGC-3'
- 还没有人留言评论。精彩留言会获得点赞!