一种快速导流和物质输运的纸芯片及其制法和用途的制作方法
本发明涉及微流控芯片,特别是利用纸和塑料透明胶带的复合构建具有毛细管道微流控芯片。
背景技术:
纸芯片(paperanalyticaldevices(upads))自2007年由马丁内斯(martinez)等人引入微流控领域以来,在芯片使用材料、芯片制作技术、芯片操作方式等方面都获得了极大的发展。传统的纸芯片由纸制成,纸不仅廉价易得,还容易裁剪、渗透、印染,从而适用于各种图案化操作,包括喷墨印刷、雕版印刷、乃至于手写。这些成熟技术为纸芯片的发展奠定了基础。除此之外,纸的多孔结构将纸芯片从根本上与传统的芯片区别开来,这个特点带来了两大优势:第一,由于纸张较大的比表面积,试剂更容易在纸中吸附从而固定在纸中,从而简化了芯片制作的过程;第二,由于纸纤维的毛细作用,液体在纸中可以自行流动,这使得纸芯片摆脱了对外部流体注射装置的依赖,结构更为简单、将更适用非专业领域和普通人群的使用。因此纸芯片在过去的十年间经历了迅猛发展,并被公认为商用化前景最好的一种微流控芯片。
然而,尽管发展迅速,纸芯片与传统微流控系统相比仍然存在一些不足。在这些不足中,系统的液流控制问题最为突出。这一控制包括两个方面:对液流流速的控制和输送范围的控制。在传统的单层纸芯片中,液体的流动所需时间和流动距离的平方成正比,所以随着距离的增加,液体流经整个管道系统的时间也将明显增加。这将导致明显的样品蒸发损耗。故而传统纸芯片一般限制在一个较小的结构单元上(管道总长度一般小于4cm),不能用于大规模的多样品分析。在传统纸芯片上,可以运输的目标物一般只限于小分子和离子,大分子在纸芯片上会出现吸附、层析,从而出现严重的分配不均匀、堵塞在局部区域等问题。除此以外,传统纸芯片还面临着操纵多路流体困难、难以定量研究、传输过程吸附、样品重现性差的问题。
对于以上的困境,已经有几种初步的解决方法。其中一种是多层结构。jahanshahi-anbuhi将蜡图案化得到的纸芯片管道夹在两层塑料薄膜之间(s.jahanshahi-anbuhi,p.chavan,c.sicard,v.leung,s.m.z.hossain,r.pelton,j.d.brennanandc.d.m.filipe,labchip,2012,12,5079–5085.issn:1473-0197);dasilvaetal.使用摩擦生电的聚乙烯对苯二酸酯薄片去封装纸基管道(eversont.s.g.dasilva,murilosanthiago,fabrícior.desouza,wendellk.t.coltroandlaurot.kubota,labchip,2015,15,1651.issn:1473-0197)。martinezetal.直接将两层蜡图案化纸芯片堆叠成一个双层芯片(a.w.martinez,s.t.phillips,g.m.whitesidesande.carrilho,anal.chem.,2010,82,3–10.issn:0003-2700)。这种方案会使每层芯片之间形成缝隙,明显加速液体的流动。另外一种解决思路是采用中空管道,renaultetal.首倡这种方案,并利用两层除去管道内纸纤维的蜡图案化纸芯片堆叠,构建出这种中空管道芯片。液体可以在这种中空管道中因为毛细现象以较高的速度定向流动,有较高的使用价值(c.renault,x.li,s.e.fosdickandr.m.crooks,anal.chem.,2013,85,7976–7979.issn:0003-2700和c.renault,m.j.andersonandr.m.crooks,j.am.chem.soc.,2014,136,4616–4623.issn0002-7863)。但是这类蜡基芯片不可弯折,层叠间不牢固,容易漏液,并且不能制备复杂的结构。基于上述认识,本发明着手开发全新的思路,以制作液体流速更快、更少吸附、具有定量分析大分子能力的纸芯片。
技术实现要素:
本发明的目的是提供一种用于纸芯片快速物质输运的新型纸毛细管快速导流结构及其制备方法,以满足大分子定量分析等应用的需求。
本发明的技术方案如下:
一种纸基-透明塑料胶带复合微流控芯片,它是以物理方法或化学方法在基材纸上构建微流道,从而使待分析流体按照设定的亲水通道流动,其特征是:它是基材纸上主微流道位置形成宽0.2–1mm和深0.1–1mm的凹槽,凹槽上贴合透明塑料胶带,构成毛细管的纸芯片。
上述的纸基-透明塑料胶带复合微流控芯片,所述的基材纸可以是纤维结构的片状材料,包括各类纸张、塑料滤膜或电纺丝膜。
上述的纸基-透明塑料胶带复合微流控芯片,所述的物理方法可以是喷蜡打印、激光切割、印刷、绘图、喷墨打印或印章压印等方法。
上述的纸基-透明塑料胶带复合微流控芯片,所述的化学方法可以是光刻、紫外固化或等离子刻蚀等方法。
一种上述的纸基-透明塑料胶带复合微流控芯片的制法,它包括下列步骤:
步骤1.使用物理方法或化学方法制造具有树枝状检测区域的纸基材;
步骤2.在纸的中央到检测区域的主微流道位置刻划或压印,使之形成若干道均匀、明显的宽0.2–1mm和深0.1–1mm的凹槽;
步骤3.在步骤2所制好的基材纸上的凹槽上贴合透明胶带,使胶带和凹槽组成毛细管,剪去多余的胶带,即得纸基-透明塑料胶带复合微流控芯片。
上述的纸基-透明塑料胶带复合微流控芯片的制法,所述的在主微流道位置压印出凹槽可以用模具压印。
上述的纸基-透明塑料胶带复合微流控芯片在分离、分析和/或鉴定有机分子、无机金属离子、高分子或生物大分子中的应用。
本发明的纸基-透明塑料胶带复合微流控芯片上用胶带和基材纸共同组成毛细管,物质在芯片中的运输主要以毛细管本身的毛细作用,而不借助纸纤维的毛细作用,从而加快运输速度且减少了纸的吸附。
本发明的具体效果如下:
通过将纸和塑料胶带结合,既保留了纸具有较好毛细能力的优势,又通过塑料胶带构建大毛细管道,加快了液体的传输速度,增加了液体的有效传输距离,减少了液体样品的吸附损失,基于以上优势,该芯片在对生命大分子的定量检测应用中具有重要意义。
于现有的纸芯片中空毛细管制造方法,该方法具有巨大的成本优势,能够满足大批量生产、一次性使用的要求。
附图说明
图1.纸基-透明塑料胶带复合微流控芯片示意图。其中a.毛细芯片基本结构示意图,基材纸贴合的透明胶带。其中4.透明胶带面;3.基材纸。透明胶带与基材纸有凹槽的一面紧密贴合,共同形成纸面上的小毛细管,提升了液体运输的效率;b.纸基-透明塑料胶带复合微流控芯片的基本结构示意图,其中1.压印出的主微流道毛细管道;2.负载检测试剂的圆形纸基检测区域。被检测样品从底端通过主微流道(1)的毛细作用被运载到芯片上,并沿着图中箭头方向扩散到圆形检测区域,实现样品的检测。
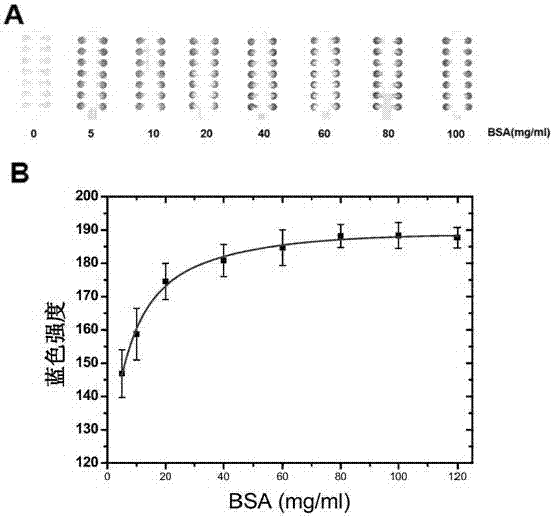
图2.实施例3中不同浓度下的牛血清白蛋白(bsa)在芯片上的显色情况。其中a.不同bsa浓度时显色情况;b.经过色度分析的不同bsa浓度时的显色曲线
图3.实施例3中不同浓度下的谷草转氨酶(ast)在芯片上的显色情况。其中a.不同ast浓度时显色情况;b.经过色度分析的不同ast浓度时的显色曲线。图2和图3说明了这种芯片在检测生物大分子方面的可行性
图4.实施例2中不同浓度下的铁离子溶液在芯片上的显色情况。其中a.不同铁离子浓度时显色情况;b.经过色度分析的不同铁离子浓度时的显色曲线。
图5.实施例2中不同浓度下的镍离子在芯片上的显色情况。其中a.不同镍离子浓度时显色情况;b.经过色度分析的不同镍离子浓度时的显色曲线。
图6.实施例2中不同浓度下的铬离子在芯片上的显色情况。其中a.不同铬离子浓度时显色情况;b.经过色度分析的不同铬离子浓度时的显色曲线。
图7.实施例2中不同浓度下的铜离子在芯片上的显色情况。其中a.不同铜离子浓度时显色情况;b.经过色度分析的不同铜离子浓度时的显色曲线。图4至图7说明了这种芯片在检测普通离子溶液方面的可行性
图8.实施例4中不同浓度下的大肠杆菌在芯片上的显色情况。其中a.不同大肠杆菌浓度时显色情况;b.经过色度分析的不同大肠杆菌浓度时的显色图像。
图9.实施例4中不同浓度下的沙门氏菌在芯片上的显色情况。其中a.不同沙门氏菌浓度时显色情况;b.经过色度分析的不同沙门氏菌浓度时的显色图像。图8和图9说明了这种芯片在检测微生物方面的可行性。
图10.实施例3中50mg/mlbsa和500u/last混合溶液的显色图案。上侧一行圆形检测区为ast检测区域,下侧一行圆形检测区为bsa检测区域。图中检测区域已经全部显色,证明了芯片对生物大分子混合液的检测能力。
图11.实施例2中100mg/l铁、镍、铬、铜混合离子溶液的显色图案。检测剂排列顺序为从左到右铁、镍、铬、铜循环三次。图中检测区域已经全部显色,证明芯片对普通金属离子混合液的检测能力。
图12.实施例4中菌落浓度为104cfu/ml的大肠杆菌和108cfu/ml的沙门氏菌混合液的显色图案。检测剂排列顺序为从左到右沙门氏菌、大肠杆菌循环六次。图中检测区域已经全部显色,证明了芯片对微生物混合液的检测能力。
具体实施方式:
下面结合附图对本发明作进一步说明。此处所说明的附图用来提供对本发明的进一步理解,构成本申请的一部分,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
实施例1:纸基-透明塑料胶带复合微流控芯片的制造
步骤1.使用激光雕刻滤纸制造纸芯片(whatman中速定量滤纸)作为纸基,如图1所示;
步骤2.用激光雕刻机雕刻出带有宽0.5mm和深0.5mm凹槽聚对苯二甲酸乙二醇酯(pet)板模具;
步骤3.将步骤1中得到的纸芯片中间主微流道区域置于模具的凹槽上,压印出凹槽并用塑料胶带黏贴封住整个凹槽;
步骤4.用剪刀剪去胶带多余的部分,即得到纸基-透明塑料胶带复合微流控芯片。
实施例2:纸基-透明塑料胶带复合微流控芯片用于多种离子同时分析
步骤1.制作实施例1中具有四阶检测区域的纸芯片;
步骤2.配制各浓度分别为0.1g/l的氯化铁、硝酸镍、重铬酸铵、硫酸铜混合标准液;
步骤3.配制ph4.5的3m醋酸铵的缓冲液;
步骤4.用步骤3中的溶液配制0.1g/ml的羟胺溶液和8mg/ml的1,10-邻菲罗啉溶液;
步骤5.配制0.7mg/ml的聚丙烯酸溶液;
步骤6.配制0.5m的naf溶液;
步骤7.配制ph4.5的3m醋酸钠的缓冲液;
步骤8.配制质量分数为1%的丁二酮肟甲醇溶液;
步骤9.配制0.03m的氨水溶液;
步骤10.配制0.35mm硝酸铈铵溶液;
步骤11.配制质量分数5%的聚乙二烯丙基二甲基氯化铵溶液;
步骤12.分别取15mg1,5-二苯基碳酰二肼和40mg邻苯二甲酸酸酐溶于1ml丙酮;
步骤13.配制0.01mph4.5醋酸钠缓冲液;
步骤14.分别取50mg浴铜灵和10mgpeg-400溶于1ml氯仿;
步骤15.在纸基-透明塑料胶带复合微流控芯片的第一级显色区域先后滴加1μl步骤4和步骤5中配制的三种溶液,滴加间隔为3min;
步骤16.在纸基-透明塑料胶带复合微流控芯片的第二级显色区域先后滴加1μl步骤6、7、8、9中配制的四种溶液,滴加间隔为3min;
步骤17.在纸基-透明塑料胶带复合微流控芯片的第三级显色区域先后滴加1μl步骤10、11、12中配制的三种溶液,滴加间隔为3min;
步骤18.在纸基-透明塑料胶带复合微流控芯片的第四级显色区域先后滴加1μl步骤13和步骤14中配制的两种溶液,滴加间隔为3min;
步骤19.将纸基-透明塑料胶带复合微流控芯片一段浸入标准混合液,待溶液在毛细作用下走完芯片全程,检测区域完全变色后拿出,用扫描仪(brother,dcp-1618w)扫描并用imagej分析色度,结果见图11。
实施例3:纸基-透明塑料胶带复合微流控芯片用于多种生物大分子蛋白同时分析
步骤1.制作实施例1中具有七阶检测区域的芯片;
步骤2.配制10mg/ml、20mg/ml、40mg/ml、60mg/ml、80mg/ml、100mg/ml、120mg/ml的牛血清白蛋白(bsa)磷酸缓冲(pbs)溶液;
步骤3.配制10u/l、20u/l、40u/l、60u/l、80u/l、100u/l、200u/l、300u/l、500u/l的谷草转氨酶(ast)磷酸缓冲(pbs)溶液;
步骤4.配制ph1.8的250mm柠檬酸缓冲液50ml(含一滴聚乙二醇辛基苯基醚(tritonx-100));
步骤5.配制6mm四溴酚蓝的95%乙醇溶液;
步骤6.配制10%海藻糖水溶液;
步骤7.306mg半胱亚磺酸、34mgα-酮戊二酸、1.6mg乙二胺四乙酸(edta)溶于1ml400mmtris溶液;
步骤8.在25ml水中依次溶解:250mg聚乙烯醇、100mg甲基绿、50mg罗丹明b、2.75mgzncl2、一滴聚乙二醇辛基苯基醚(tritonx-100);
步骤9.在25ml水中依次溶解:250mg聚乙烯醇、25mg甲基绿、25mg罗丹明b、2.75mgzncl2、一滴聚乙二醇辛基苯基醚(tritonx-100);
步骤10.在芯片一侧圆形检测区各滴加步骤4中的溶液1.2μl;
步骤11.步骤10完成3min后,在滴加步骤4中溶液的区域各滴加0.8μl步骤5中的溶液;
步骤12.在步骤10滴加区域的另一侧各滴加1μl步骤6中的溶液;
步骤13.步骤12完成5min后,在滴加步骤6溶液的区域各滴加1μl步骤7中的溶液;
步骤14.步骤13完成5min后,在滴加步骤7溶液的区域各滴加1μl步骤8中的溶液;
步骤15.步骤14完成5min后,在滴加步骤8溶液的区域各滴加1μl步骤9中的溶液;
步骤16.步骤15完成5min后,将各个芯片一头浸入不同浓度的bsa和ast溶液中,待溶液在毛细作用下走完芯片全程,检测区域开始变色后拿出,用扫描仪(brother,dcp-1618w)扫描并用imagej分析色度,结果见图2。
在实验中可以发现,随着bsa和ast浓度的增加,芯片检测区域显色剂颜色开始出现明显的变化,显色结果可以用曲线拟合,从而可以证明这种芯片在运输和负载大分子物质进行反应的能力。
实施例4:纸基-透明塑料胶带复合微流控芯片用于多种微生物同时检测
步骤1.制作实施例1中具有三级检测区域的芯片;
步骤2.配制1mg/ml的cprg(氯苯酚红,英文全称chlorophenolred-β-d-galactopyranoside)水溶液;
步骤3.配制5mg/ml的mc(5-溴-6氯-3-吲哚-辛酸酯,英文全称5-bromo-6-chloro-3-indolylcaprylate)水溶液;
步骤4.配制质量分数1%的聚乙二醇辛基苯基醚(tritonx-100)磷酸缓冲(pbs)溶液;
步骤5.用接种环采集少量大肠杆菌和沙门氏菌,并将细菌分别分散在2ml步骤4配制的溶液中。
步骤6.从步骤5中制取的菌液中各取100μl,逐级稀释,平板培养用于确定菌液的菌落浓度。
步骤7.将剩余的菌液放入超声清洗仪(舒美牌kq218超声清洗仪)冰水浴超声震荡15min,然后按照体积比1:5的比例逐级稀释三级后等体积混合。
步骤8.在芯片一侧圆形检测区各滴加步骤2中的溶液1.2μl,室温条件下干燥5min;
步骤9.在芯片的另一侧圆形检测区各滴加步骤3中的溶液1μl,室温条件下干燥5min后在原滴加区域再各滴加步骤3中的溶液1μl;
步骤10.将各个芯片一头浸入不同浓度的大肠杆菌和沙门氏菌溶液中,待溶液在毛细作用下走完芯片全程后,将芯片置于密封的培养皿内37℃下孵育2h,待变色后用扫描仪(brother,dcp-1618w)扫描并用imagej分析色度,结果见图12。
在实验中可以发现,随着bsa和ast浓度的增加,芯片检测区域显色剂颜色开始出现明显的变化,从而可以证明这种芯片在运输和负载大分子物质进行反应的能力。
- 还没有人留言评论。精彩留言会获得点赞!