用于从细胞培养流体分离微载体的容器的制作方法
本申请要求2016年11月2日提交的美国临时申请序列号62/416,309的优先权,其公开内容通过引用并入本文。
背景技术:
微载体典型地用于粘附或贴壁依赖性细胞的培养并且被广泛用在用于粘附或贴壁依赖性细胞的培养的制药工业中。微载体可用于培养用于某些生物制剂或疫苗的制造的粘附细胞;或用于培养某些类型的细胞(例如,干细胞),在这种情况下干细胞本身是预期产物。
微载体典型地窝藏允许或促进细胞到微载体上的附着的表面特性或化学性质。生物反应器被用于涉及微载体的粘附细胞的培养。一旦细胞达到某个密度或细胞培养过程完成,则细胞培养流体需要与微载体分离用于细胞培养流体本身(例如,在分泌的治疗性蛋白质的情况下,例如,单克隆抗体)或带有附着到其的细胞的微载体(例如,在干细胞的情况下)的进一步处理。此外,通常期望将微载体从细胞培养流体分离使得微载体可以在灭菌后重复使用。
总体上,已描述了若干从微载体移除细胞的方法,例如,通过微载体用胰蛋白酶、edta或类似试剂的处理以从微载体释放细胞。还已描述了若干用于从细胞培养流体分离微载体的方法。例如,对于大体积的批量处理,传统的分离方法一直是让微载体沉淀在例如堆叠表面的倾斜沉淀台上或浅容器中。一旦细胞已沉淀,就有可能通过倾析收获大部分上清液并且可通过重复沉淀步骤来加强产物的回收。然而,对于这种方法要求的时间可能对于高效回收来说太长并且产物可能变质。
可替代地,已描述了过滤器来从细胞培养溶液分离微载体。例如,一种常规系统包括结合到一次性接收袋中的过滤筛网,由此含有微载体的溶液经由馈送到接收袋中的回路通过横切接收袋壁的配件被转移到接收袋中。将微载体悬浮液跨越柔性接收袋的壁转移的入口配件借助于平面网格片材被分成两个腔室,使得通过入口配件馈送的第一腔室是微载体积聚的地方并且第二腔室接收不含微载体的液体溶液。
另一种常规系统包括用于从流体介质分离微载体的过滤器组件,该过滤器组件包括:围绕适于保持流体的无菌隔室的可折叠容器;流体通过其流入隔室中的入口端口;流体通过其流出隔室的出口端口;以及设置在隔室内的过滤器,该过滤器将隔室分成与入口端口流体联接的入口腔室和与出口端口流体联接的出口腔室,并且该过滤器允许介质穿过过滤器同时防止微载体穿过。
通过使溶液穿过具有跨越刚性容器延伸的水平筛网的刚性容器,可以实现微载体从包含脱离的细胞的培养溶液的分离。筛网是刚性网格,其允许培养流体穿过但是阻止微载体穿过。然而,当微载体在筛网上积聚时,它们开始堵塞筛网并阻止流体从筛网穿过。一旦筛网被堵塞,该过程就停止直到筛网畅通为止。此外,一旦完成该过程,刚性容器和相关的筛网就必须在其可以被重新使用之前被清洁和消毒。这些过程步骤可能是昂贵且耗时的。
贴壁依赖性细胞具有在基质上“扩散”的趋势或需求并且从而相对于细胞数量占据相对大的表面积。这极大地使得用于贴壁依赖性细胞产物的生产的方法复杂。例如,75cm2培养表面可能产生基本上可忽略的1×105-6个细胞、几微克的总湿细胞重量,并且远少于任何有用的药物产品的总湿细胞重量。从而,尽管多年来试图克服平面表面附着的限制,但是在平坦表面上生长贴壁依赖性细胞用于生产一直是高度不切实际的。
因此,本领域中需要的是可以减轻以上问题中的一个或多个的方法和/或系统。
技术实现要素:
本文中描述的各实施例涉及用于从细胞培养流体分离微载体的容器。相对于本领域中描述的系统,本文中描述的容器提供含有微载体的细胞培养流体的更大的过滤效率。例如,在现有技术的过滤系统(例如,如上描述的过滤系统)的情况下,一旦袋填充有微载体,则微载体的越来越小百分比的表面积与过滤容器(例如,袋或囊)接触,由此减慢或阻碍过滤过程并降低整体过滤效率。本文中描述的容器具有高表面积,导致过滤效率的增加。
在一些实施例中,提供了一种用于从细胞培养流体分离微载体的容器,该容器包括:可包括无菌可折叠袋的第一隔室;提供进入第一隔室的流体路径的入口端口和提供离开第一隔室的流体路径的出口端口;以及完全封闭的第二隔室,该第二隔室与第一隔室的入口端口流体连接并且包括部分或完全多孔的边界壁,并且该边界壁具有足以将微载体保留在第二隔室内侧同时允许细胞培养流体穿过第二隔室进入第一隔室的出口端口中的孔隙率,在该第一隔室处可收集细胞培养流体。
在某些实施例中,完全封闭的第二隔室具有限定出多个独立或离散的微载体接收区域的多个边界壁。所述区域是独立或离散的,因为一个独立或离散的区域中的微载体不直接与另一个独立区域中的微载体相互作用并且不与另一个独立区域中的微载体接触。在一些实施例中,每个微载体接收区域是囊。
在某些实施例中,存在多个完全封闭的隔室,每个完全封闭的隔室与第一隔室的入口端口流体连接并且包括部分或完全多孔的边界壁,并且该边界壁具有足以将微载体保留在第二隔室内侧同时允许细胞培养流体穿过第二隔室进入第一隔室的出口端口的孔隙率,在该第一隔室处可收集细胞培养流体。
在一些实施例中,提供了一种用于从细胞培养流体分离微载体的方法,该方法包括:
(a)提供包括微载体的细胞培养流体;
(b)提供容器,其包括:第一隔室和设置在第一隔室内侧的完全封闭的第二隔室,其中第一隔室包括无菌可折叠袋;提供进入第一隔室的流体路径的入口端口;以及提供离开第一隔室的流体路径的出口端口;并且第二隔室与第一隔室的入口端口流体连接并且包括部分或完全多孔的边界壁,并且该边界壁具有足以将微载体保留在第二隔室内侧同时允许流体穿过第二隔室进入出口端口的孔隙率;边界壁限定出独立或离散的微载体接收区域;以及
(c)使包括微载体的细胞培养流体流过第一隔室的入口端口,使得微载体流入完全封闭的第二隔室中,在第二隔室中微载体被捕获并积聚在该第二隔室内侧,并且剩余的细胞培养流体通过第一容器的出口端口流出第二隔室,
由此从细胞培养流体分离微载体。
在一些实施例中,第二隔室包括多个独立或离散的微载体接收区域,每个微载体接收区域包括为含有微载体的细胞培养流体进入微载体接收区域提供流体路径的顶部、侧壁以及足够多孔以允许细胞培养流体穿过同时将微载体保留在微载体接收区域中的底部。
在一些实施例中,第二隔室的多个微载体接收区域被连接到气室(plenum)以形成歧管。气室可由诸如例如聚砜、丙烯酸或聚碳酸酯聚合物的刚性材料构成。可替代地,气室可由诸如例如乙烯基或聚氯乙烯聚合物的柔性材料构成。在一些实施例中,气室将含有微载体的细胞培养流体分布到所述多个微载体接收区域中的每一个。
附图说明
图1是根据某些实施例的用于分离微载体的容器的示意图;
图2是根据另一个实施例的用于分离微载体的容器的示意图;
图3是根据某些实施例的用于分离微载体的容器的示意图;以及
图4是根据某些实施例的用于分离微载体的容器的另一个示意图。
具体实施方式
通过参考附图可获得对本文中公开的部件、方法和装置的更完整理解。各图仅是基于方便性和易于展示本公开的示意性表示,并且因此并不旨在指示各装置或其部件的相对大小和尺寸和/或限定或限制各示例性实施例的范围。
尽管为了清楚起见在以下描述中使用了特定术语,但是这些术语旨在仅指为了各附图中的说明所选择的各实施例的具体结构,并且不旨在限定或限制本公开的范围。在下面的附图和以下描述中,应理解,相似的附图标记指的是具有相似功能的部件。
除非上下文另有明确规定,否则单数形式“一”、“一个”和“该”包括复数个指示物。
如本说明书中所使用的,各种装置和部分可以被描述为“包括”其它部件。如本文中所使用的,术语“包括”、“包含”、“具有”、“有”,“可以”、“容纳”及其变型旨在为开放式的过渡短语、术语或单词,其不排除另外的部件的可能性。
贴壁依赖性细胞(包括许多基因修饰的动物细胞)通过包括静电/疏水相互作用、自身附着基体的产生或者附着到聚氨基酸(例如聚赖氨酸)或各种“支架(scaffolding)”蛋白质(包括胶原蛋白、层粘连蛋白、纤连蛋白及其它“rgd”肽)的方法而附着到表面。这些在自然环境中固定细胞的仿细胞附着基质,贴壁依赖性是必要的要求,因为附着过程本身向细胞中提供控制遗传和合成过程并且特别是期望产物的产生的信号。
分批方法
分批模式微载体细胞培养简单地涉及以支持细胞健康的方式在容器中提供细胞涂覆的微载体与营养介质的组合:气体、缓冲液、合成代谢碳源和生长因子被提供并优化以实现期望产物的最大产量。一旦达到优化的产物浓度,就以某些方式将悬浮液与微载体分离并且然后经受下游处理。
补料分批模式类似于分批模式,因为产物仅在运行的结束时被移除,但是不同之处在于在该过程期间以多个间隔添加营养物,其目的是提高产物的回收。
灌注(连续流动)模式
在灌注模式中,新鲜营养介质的连续流动通过微珠的悬浮液。由于微载体被选择为比介质的密度稍微致密,因此介质典型地非常缓慢地通过培养容器灌注。从而,微载体重量抵消否则会将微载体从培养容器排出的流动向量(移动介质的“提升”因子)。如果期望的产物被排到营养介质中,则该产物从流出物流被回收。如果产物仍与附着到微载体珠的细胞相关联,或者在产物通过化学或酶促手段(典型地胰蛋白酶或“edta”(乙二胺四乙酸))从微载体脱落后被包含在细胞中,则在发生进一步处理之前细胞从微载体的分离是必需的。
从而,在连续或灌注模式中,在整个培养周期收获产物。在分批和补料分批模式中,仅在过程运行结束时移除产物。
基于微载体的培养物的处理
鉴于网格过滤介质的尺寸相对于微载体的浓度较大,这些当前方法都将提供微载体的良好捕获。然而,在微载体捕获腔室开始填充有微载体时,一部分网格被阻塞,因此过滤的效率下降并且流体流的处理必须必要地降低。从而,仍然存在对于一种用于从培养基分离微载体珠或细胞以及用于在收获时回收微载体珠或细胞的更快、更有效的手段的装置和方法的持续需求。对于这种装置和方法在其中营养物被连续地添加到系统并且产物在整个培养周期被收获的细胞培养的连续或灌注模式中的使用的需求特别明显。
为了克服迄今已知的捕获装置中过滤介质的耗尽,有必要增加捕获介质的可用表面积。当被部署在接收袋中时本文中公开的各实施例显著增加过滤介质的表面积而不会增加总体装置的体积。
本文中公开的各实施例提供以特别有效的方式从细胞培养溶液或处理溶液过滤微载体或其它聚集体的装置和方法,使得微载体悬浮介质的滤液有效地与微载体本身分离。该装置的设计极大地减少了本领域中已知装置所预期的过滤器堵塞和流动阻塞,同时提供由应用任何类型的无菌一次性或可重复使用的可消毒生物反应器的类似装置所预期的所有优点。更特别地,本文中公开的各实施例涉及一种用于细胞微载体的改进的一次性过滤装置并且涉及将过滤器单元结合到用于细胞和细胞产物从微载体细胞培养物的回收的处理回路中。总体上,一次性过滤装置和滤液回收装置可包括任何大小的无孔一次性袋。一个实施例被称为“枕形”袋并且包括面向彼此设置并沿着周边密封或粘合在一起的两片或更多片聚合物或层压聚合物。可替代地,存在一次性的三维一次性袋,也就是说,制造成具有三个、四个、五个或更多柔性一体或层压无孔聚合物材料的壁的袋。
某些实施例的目的是增加过滤的效率。在某些实施例中,通过增加隔室的壁的数量以产生多个独立或离散的微载体接收区域来增加多孔过滤隔室的表面积。在不减少所使用的微载体的实际数量的情况下,减少了在微载体区域中积聚的微载体床的有效密度。因此,对于相同数量的微载体,更多的微载体表面积暴露于样品或细胞培养溶液。
在一些实施例中,歧管或气室可用于将处理流体引导到第二隔室或多个隔室中。
在某些实施例中,装置的第一隔室可以是袋。该袋可以携带可变数量的配件,例如无菌端口、管道连接和管道回路的布置。在一个实施例中,袋是无孔的并且包括柔性聚乙烯材料或薄膜,并且可以具有附接到该袋的配件。本文中使用的术语“配件”是指被焊接(例如,热焊接)到无孔袋薄膜以便将其附接的分离的物体。因此,配件通常包括可以与包括无孔袋的壁的聚合物材料相同或相似的聚合物材料。配件通常是比无孔袋的壁更致密的材料,并且可以被添加到袋以实现功能。配件的一个非限制性示例是形成端口的配件。在某些实施例中,如下描述的端口被添加到无孔袋的壁以便从无孔袋的内部抽出细胞培养基或其它流体。这种袋可以在被容纳在金属罐或箱中的同时使用以减轻来自较大流体载荷的应力。
在某些实施例中,第二隔室被容纳在第一隔室内,该第一隔室收集来自第二隔室过滤器的滤液。第二隔室(过滤器)可以沿着隔室的顶部边缘被密封到第一隔室的壁,例如,诸如通过粘合剂或热密封。第二隔室包括多个独立或离散的微载体接收区域。
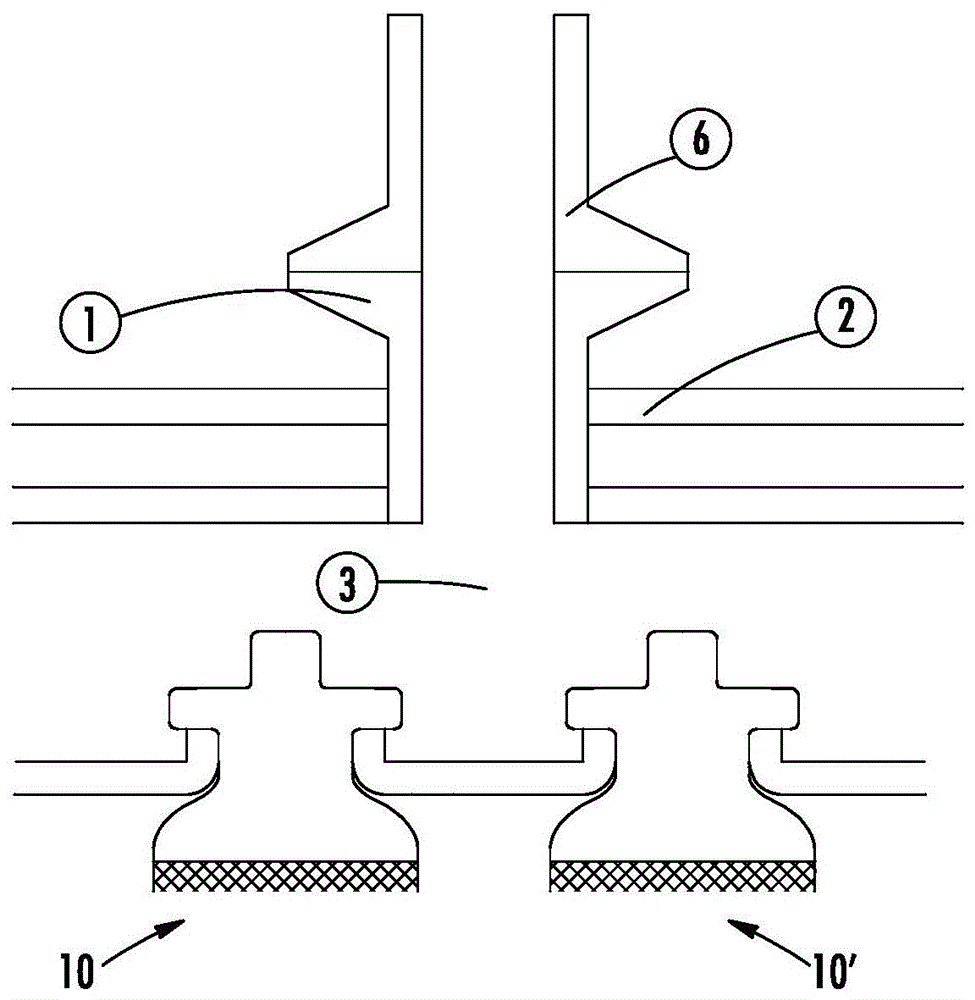
现在转到图1,示出了配件1,其从流体和珠(未示出)的外部源联接到外部馈送管,并提供通入容器中和通入与多个独立或离散的微载体接收区域10、10'(部分示出)流体连通的气室3中的路径。在所示实施例中,存在两个这样的微载体接收区域10、10',其中每个都是网格过滤袋。微载体接收区域10、10'中的每一个被构造为在其内部容积中容纳彼此独立的多个微载体;隔室10中的多个微载体与隔室10'中的多个微载体独立且不同。在一些实施例中,每个微载体接收区域10、10'中的多个微载体被捕获并积聚以形成微载体床。每个微载体接收区域10、10'可以是相同的(例如,相同的容积和构造)但并不必需是相同的。
图2示出了一个实施例,其中第一容器2围绕包括气室3和多个独立或离散的微载体接收区域10、10'、10”及10”'的第二容器5。在某些实施例中,每个区域10、10'、10”和10”'是多孔网格过滤袋。含有珠的流体通过配件1并进入气室3,在气室3处该含有珠的流体分布到各网格袋,在悬浮流体穿过网格并进入第一容器2时所述网格袋捕获珠。在该实施例中,入口端口1位于容器2的侧壁上。网格袋具有足以允许处理流体穿过同时将微载体保留在网格袋内的孔隙率。用于微载体接收区域的合适孔隙率包括50-100μm网格。
图3示出了与图2类似的实施例,除了提供进入第二容器的气室3的配件1位于设备的顶部上。例如,如果配件1与钩或槽支撑件接合,则该配件1可以为设备提供支撑。
图4示出了一个实施例,其中第二容器包括多个离散的过滤囊100。每个过滤囊可以被附接到歧管并且与到第一容器(例如无孔聚乙烯袋)的入口流体连通。附接可以是机械的,或者如果第二容器(或其相关部分)和歧管都是相同的材料(例如,pe),则它们可以被热密封。
在某些实施例中,每个囊100是网格囊或其它多孔材料,其被构造为容纳多个微载体同时允许流体穿过。
在一些实施例中,第二容器可以预装载有微载体,并且设备可用于用处理液洗涤微载体,例如以洗涤粘附细胞脱离微载体,或者将处理液中的细胞粘附到微载体。
一种假设的微载体接收区域可以通过以下示例表示。带有尺寸10×10×10的立方体具有10×10×5的侧壁表面,由于排除顶壁,所以存在五个10×10单位=500平方单位的壁。如果这由10×1单位的囊作为微载体接收区域来代替,则总的侧壁和底壁表面会是10×10(2个每个大侧壁×1单位)加上10×1×3(对于每个囊2个短侧壁加上1个底壁)或2300平方单位的过滤面积,在大约相同的空间中增加460%。
在使用中,在某些实施例中,所描述的过滤装置被附接到端口。该端口又通过管道被附接到从细胞培养容器排出悬浮液的泵或重力流动回路。该流动被引导到微载体接收区域,例如过滤网格。通过直接附接到端口或通过来自端口的进入第一容器的延伸管(图2)进入微载体接收区域。微载体溶液通入第二隔室的充当气室的上部中,并且微载体溶液被分布到各微载体接收区域,例如囊、袋或者网格过滤织物或多孔片材的褶皱袋(图3)。因为与仅具有一个微载体接收区域的标准过滤器单元相比,由微载体接收区域的侧壁提供的额外表面积指数地倍增用于过滤的表面积,所以该设备也比现有技术过滤器指数地更高效。
合适的微载体包括从ge可获得的cytodex微载体;从pall可获得的solohill微载体,以及从corning可获得的cellbind微载体。
示例
过滤装置具有例如塑料或聚乙烯袋的第一容器,以及包括气室和五个网格过滤袋的第二容器,其中对于每个独立的袋260cm2的总面积,每个过滤袋具有2cm×10cm×10cm的过滤网格织物尺寸。100升cho细胞培养流体中的cytodex3微载体珠(141-211微米直径)被泵送到所描述的具有80微米的网格大小的珠过滤装置中。对于每100升珠悬浮液500毫升的最终填充珠体积,溶胀的cytodex3珠的体积为每升被泵送的珠溶液50毫升(ml)。珠过滤器的第二容器具有附接到容器的气室的五个网格袋。当处理100升含有珠的流体时,五个袋将捕获500ml珠。对于各袋不必恰好均匀地填充,然而,它们将倾向于这样做。如果一个袋比另一个袋显著较满,则较满的袋将具有稍高的压降,并且到来的液体将朝向较不满/较低压降的袋偏置。此时,这在积聚的珠之上留下600cm2尚未阻塞的过滤介质。这与现有技术的第二容器相比较,该现有技术的第二容器仅由相同外尺寸(即,10cm×10cm×10cm)的一个袋构成,其中没有被捕获的珠覆盖的未阻塞的过滤介质的量仅为200cm2,这是在该示例中由权利要求1的发明提供的过滤面积的三分之一。从而,在该示例中,所要求保护的发明在可用过滤介质的一半消耗时的未阻塞流动速率将是现有技术装置在可用过滤介质的一半消耗时的未阻塞流动速率的三倍。
- 还没有人留言评论。精彩留言会获得点赞!