三齿邻菲罗啉锰催化剂及其在合成有机硅/硼化合物中的应用的制作方法
[0001]
本发明属于化学有机合成领域,具体涉及一种三齿邻菲罗啉锰催化剂及其在合成有机硅/硼化合物中的应用。
背景技术:
[0002]
有机硅/硼化合物是一类非常有价值的化合物,在合成化学、药物化学和材料化学等领域具有重要的用途。有机硅/硼化合物一般由有机镁试剂与硅源或硼源的反应合成,但是这些反应条件苛刻、对环境污染大、且官能团耐受性和原子经济性都较差。采用过渡金属来催化烯烃硅氢化和烯烃硼氢化反应,可以克服这些缺点,在制备有机硅或有机硼化合物领域具有明显优势。长期以来,该领域主要采用贵金属催化剂如铂、铑和铱等;但是,贵金属储量稀少,价格高昂,且毒性大,无法满足可持续性绿色化学的要求。
[0003]
锰是仅次于铁和钛在地壳中储量第三的过渡金属元素,其储量是钴的38倍,是镍的12倍。另外,锰具有生物兼容性好,价态多样和硬的路易斯酸等优点,逐渐被开发用于各种催化反应,并表现出优越的特性。但是,目前只有极少数的锰催化剂应用于烯烃的硅氢化和硼氢化反应;而且,这些锰催化剂的反应条件严苛、底物适用性差、活性低,无法满足合成有机硅/硼化合物反应的工业化生产要求。因此,发展一种新型催化剂用于合成有机硅/硼化合物是十分必要的。
技术实现要素:
[0004]
本发明的目的在于克服现有技术中存在的缺点,提供一种成本低、合成简单、底物适用性广、活性高的三齿邻菲罗啉锰催化剂及其制备方法。
[0005]
本发明的另一目的在于提供上述三齿邻菲罗啉锰催化剂在合成有机硅/硼化合物中的应用,可以在较温和的条件下以烯烃为原料进行催化硅氢化或硼氢化反应,合成有机硅化合物或有机硼化合物。
[0006]
本发明的目的通过下述技术方案实现:
[0007]
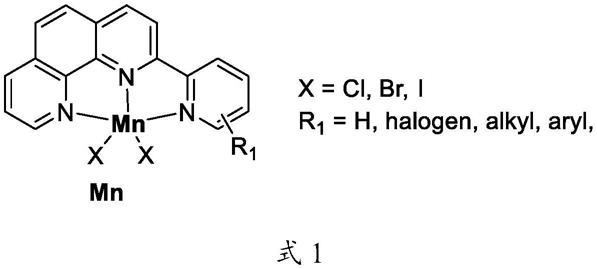
一种三齿邻菲罗啉锰催化剂,结构式如式1所示:
[0008][0009]
其中,x为氯、溴或碘;r1为h、卤素、烷基或芳基。所述卤素优选氟、氯、溴或碘;所述烷基优选甲基、甲氧基、乙基、异丙基、丁基或环己基;所述芳基优选苯基、2,6-二甲基苯基、
2,6-二异丙基苯基或均三甲基苯基。
[0010]
上述三齿邻菲罗啉锰催化剂的制备方法,是将mnx2·
4h2o和三齿邻菲罗啉配体3加入到甲醇/丙酮溶液中,在25~80℃条件下反应10~24h;反应完毕,过滤、清洗、干燥,得到三齿邻菲罗啉锰催化剂。其中,三齿邻菲罗啉配体3的合成,是将2-溴-1,10-菲罗啉和相应的取代-2-三丁锡基吡啶按照1:(1.5~3.0)的摩尔用量比加入到甲苯溶剂中,在80~120℃下反应3~6d后,冷却至室温;然后用乙酸乙酯稀释,过滤,旋干,用石油醚/乙酸乙酯(4:1~0:1)过柱,得到黄色固体即三齿邻菲罗啉配体3。
[0011]
所述清洗,是先用甲醇/丙酮清洗过滤得到的固体,再用乙醚清洗。
[0012]
所述干燥为真空干燥。
[0013]
mnx2·
4h2o和三齿邻菲罗啉配体的摩尔用量比为(2.0~7.0):1.0。
[0014]
所述甲醇/丙酮溶液的体积比为1.0:(2.0-6.0)。
[0015]
所述三齿邻菲罗啉锰催化剂的制备过程如式2所示:
[0016][0017]
所述三齿邻菲罗啉锰催化剂的应用,是作为金属催化剂催化烯烃的硅氢化或硼氢化反应,制备得到有机硅化合物或有机硼化合物。其中,硅氢化得到的是反马氏选择性产物,而硼氢化得到的是马氏选择性产物。
[0018]
所述有机硅化合物和有机硼化合物的通式为:
[0019][0020]
所述烯烃的通式为:
[0021]
其中,取代基r为芳香取代基或脂肪烯烃。所述芳香取代基可以为苯环;或苯环上含有供电子取代基如甲基、叔丁基、甲氧基等;或苯环上含有吸电子取代基如卤素、三氟甲基等;或苯环上含有一些官能化基团如氨基、不饱和烯/炔基团等;或芳香环为杂环如噻吩、吡啶等。所述脂肪烯烃可以为简单脂肪烯烃,如正己基、正戊基或环己基等;或为含有官能团的复杂烯烃,官能团可以是卤素、烷氧基、酯基、烯烃等。
[0022]
所述三齿邻菲罗啉锰催化剂在合成有机硅化合物中的应用,是将所述三齿邻菲罗啉锰催化剂、叔丁醇钠、烯烃和二苯基硅烷按顺序加入到溶剂中,惰性气体保护下在25~80℃反应2h~12h;反应完毕,降至室温,加水淬灭,用乙酸乙酯萃取,浓缩、纯化、干燥,得到有机硅化合物,其选择性是反马氏。
[0023]
所述三齿邻菲罗啉锰催化剂、叔丁醇钠、烯烃和二苯基硅烷的摩尔比为(0.005~0.03):(0.01~0.1):1.0:(1.0~1.2);所述的溶剂为四氢呋喃、乙醚或无溶剂。
[0024]
有机硅化合物的合成步骤如式3所示:
[0025][0026]
所述三齿邻菲罗啉锰催化剂在合成有机硼化合物中的应用,是将所述三齿邻菲罗啉锰催化剂、叔丁醇钠、烯烃和频那醇硼烷按顺序加入到溶剂中,惰性气体保护下在25~80℃反应2h~12h;反应完毕,降至室温,加水淬灭,用乙酸乙酯萃取,浓缩、纯化、干燥,得到有机硼化合物,其选择性是马氏。
[0027]
所述三齿邻菲罗啉锰催化剂、叔丁醇钠、烯烃和频那醇硼烷的摩尔比为(0.005~0.03):(0.01~0.1):1.0:(3.0~5.0);所述的溶剂为四氢呋喃、乙醚或无溶剂。
[0028]
有机硼化合物的合成步骤如式4所示:
[0029][0030]
本发明与现有技术相比具有如下优点和效果:
[0031]
(1)本发明的三齿邻菲罗啉锰催化剂的合成原料简单易得,成本低,而且对空气稳定和环境友好。
[0032]
(2)本发明的催化剂对底物的适应范围广,能够在较温和的条件下,催化烯烃转化为丰富多样的有机硅化合物和有机硼化合物,还可以用于药物活性分子如维生素e衍生物的硅氢化转化。
[0033]
(3)本发明的催化剂在烯烃氢官能化反应方面,表现出了独特的区域选择性:在烯烃硅氢化反应中表现出了反马氏选择性,而在烯烃硼氢化反应中表现出了马氏选择性,极大的丰富了产物的多样性。
[0034]
(4)本发明的催化剂还可以实现烯烃衍生物的克规模级别的硅氢化反应,其活性和选择性仍然保持不变;而且可以用于“一锅法”实现烯烃转化各种有价值化合物,在环境友好和经济上有较大的优势。
具体实施方式
[0035]
为了便于理解本发明,下面将结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但是,不以任何形式限制本发明。应该指出的是,对本领域的技术人员来说,在不脱离本发明构思的前提下,本发明还可以做出若干变形和改进,这些都属于本发明的保护范围。
[0036]
为了在实施例中简明清楚地表述配体和配合物,说明如下:
[0037]
配体3a为式5所示的三齿邻菲罗啉配体,其中r1为h;
[0038]
配体3b为式5所示的三齿邻菲罗啉配体,其中r1为甲基;
[0039]
配体3c为式5所示的三齿邻菲罗啉配体,其中r1为溴;
[0040][0041]
锰催化剂mn1为式6所示的三齿邻菲罗啉锰催化剂,其中r1为h;
[0042]
锰催化剂mn2为式6所示的三齿邻菲罗啉锰催化剂,其中r1为甲基;
[0043]
锰催化剂mn3为式6所示的三齿邻菲罗啉锰催化剂,其中r1为溴;
[0044][0045]
三齿邻菲罗啉配体的合成:
[0046]
三齿邻菲罗啉配体的合成根据文献报道(rsc adv.,2016,6,100532)的方法合成,以2-溴-1,10-邻菲罗啉1为初始原料,与6-取代-2-三正丁基锡基-吡啶衍生物2反应得到相应的三齿邻菲罗啉配体3。
[0047]
实施例1
[0048]
合成三齿邻菲罗啉配体3a,具体按照以下步骤进行:
[0049]
向150ml的封管中,称取2-溴-1,10-菲罗啉中间体1(5mmol,1.30g),2-三正丁基锡基-吡啶2a(15mmol,5.52g),和pd(pph3)4(10mol%,0.578g),在60ml甲苯溶液中,110℃下反应4d。将混合物冷却至室温,旋干,过柱(sio2),以正己烷-乙酸乙酯(1:4)-乙酸乙酯为洗脱剂,纯化干燥得到1.22g黄白色产物3a,产率74%。
[0050]1h nmr(400mhz,chloroform-d)δ9.21(d,j=4.3hz,1h),8.97(d,j=8.0hz,1h),8.78(d,j=8.4hz,1h),8.71(d,j=4.7hz,1h),8.32(d,j=8.4hz,1h),8.20(d,j=8.0hz,1h),7.88(t,j=7.7hz,1h),7.75(q,j=8.8hz,2h),7.60(dd,j=8.0,4.4hz,1h),7.35
–
7.31(m,1h)。
[0051]
13
c nmr(101mhz,chloroform-d)δ156.30,156.20,150.47,149.09,146.43,145.74,137.06,137.02,136.22,129.07,128.83,126.80,126.59,124.21,122.96,122.84,120.88。
[0052]
实施例2
[0053]
合成三齿邻菲罗啉配体3b,具体按照以下步骤进行:
[0054]
按照实施例1中配体3a的合成方法,用2-溴-1,10-菲罗啉中间体1(5mmol,1.30g),6-甲基-2-三正丁基锡基-吡啶2b(7.5mmol,2.87g)代替2a,90℃下反应3d,其他操作条件同
实施例3a,纯化干燥得到0.95g黄白色产物3b,产率70%。
[0055]1h nmr(400mhz,chloroform-d)δ9.23(dd,j=4.3,1.5hz,1h),8.83(dd,j=8.4,2.3hz,1h),8.77(d,j=7.8hz,1h),8.33(d,j=8.4hz,1h),8.23(dd,j=8.0,1.6hz,1h),7.85
–
7.73(m,3h),7.62(dd,j=8.0,4.4hz,1h),7.21(d,j=7.6hz,1h),2.67(s,4h)。
[0056]
13
c nmr(101mhz,chloroform-d)δ157.84,156.69,155.59,150.49,146.53,145.80,137.26,136.94,136.25,129.10,128.80,126.68,123.83,122.95,121.05,119.91,24.79。
[0057]
实施例3
[0058]
合成三齿邻菲罗啉配体3c,具体按照以下步骤进行:
[0059]
按照实施例1中配体3a的合成方法,用2-溴-1,10-菲罗啉中间体1(2.5mmol,0.65g),6-溴-2-三正丁基锡基-吡啶衍生物2c(5mmol,2.28g)代替2a,120℃下反应5d,其他操作条件同实施例3a,纯化干燥得到0.57g黄白色产物3c,产率68%。
[0060]1h nmr(400mhz,chloroform-d)δ9.24(dd,j=4.3,1.7hz,1h),8.99(d,j=7.7hz,1h),8.81(d,j=8.4hz,1h),8.38(d,j=8.4hz,1h),8.28(dd,j=8.1,1.7hz,1h),7.87
–
7.81(m,2h),7.77(t,j=7.8hz,1h),7.67(dd,j=8.1,4.4hz,1h),7.56(d,j=7.8hz,1h)。
[0061]
13
c nmr(101mhz,chloroform-d)δ157.44,154.72,150.65,146.47,145.85,141.56,139.49,137.26,136.41,129.26,128.60,127.29,126.69,123.21,121.60,121.20。
[0062]
三齿邻菲罗啉锰催化剂的合成:
[0063]
实施例4
[0064]
合成三齿邻菲罗啉锰催化剂mn1,具体按照以下步骤进行:
[0065]
向100ml的三口瓶中,加入配体3a(0.5mmol,0.136g)和丙酮(20ml),加热至50℃。之后,加入mncl2.4h2o(2.5mmol,0.495g)的甲醇(5ml)溶液,反应液中立即就出现黄色固体。50℃反应24h,冷却至室温,沉淀过滤,用甲醇-丙酮溶液(1:4)洗涤,再用大量乙醚洗涤。真空干燥,得到0.365g微黄色固体mn1,产率92%。
[0066]
元素分析:anal.calcd for:c
17
h
11
cl2mnn3.0.35meoh elemental analysis:c,52.84;h,3.17;n,10.66;found:c,52.58;h,3.26;n,10.16。
[0067]
hrms(maldi,m/z):[m
–
cl]
+
347.008.
[0068]
实施例5
[0069]
合成三齿邻菲罗啉锰催化剂mn2,具体按照以下步骤进行:
[0070]
按照实施例4中催化剂mn1的合成方法,用3b(0.5mmol,0.143g)代替3a,70℃反应16h,其他操作条件同实施例4,纯化干燥得到0.370g微黄色产物mn2,产率90%。
[0071]
元素分析:anal.calcd for:c
18
h
13
cl2mnn
3 elemental analysis:c,54.44;h,3.30;n,10.58;found:c,54.18;h,3.43;n,10.16。
[0072]
hrms(maldi,m/z):[m
–
cl]
+
361.016.
[0073]
实施例6
[0074]
合成三齿邻菲罗啉锰催化剂mn3,具体按照以下步骤进行:
[0075]
按照实施例4中催化剂mn1的合成方法,用3c(0.5mmol,0.175g)代替3a,80℃反应12h,其他操作条件同实施例4,纯化干燥得到0.404g微黄色产物mn3,产率85%。
[0076]
元素分析:anal.calcd for:c
17
h
10
brcl2mnn3.1.3h2o elemental analysis:c,
42.06;h,2.62;n,8.66;found:c,42.26;h,3.00;n,8.16。
[0077]
hrms(maldi,m/z):[m
–
cl]
+
424.906.
[0078]
三齿邻菲罗啉锰催化剂在催化烯烃硅氢化反应合成有机硅化合物的应用,其选择性是反马氏,反应通式如下:
[0079][0080]
实施例7
[0081]
合成苯乙基二苯基硅烷7a,具体按照以下步骤进行:
[0082]
向带有搅拌子的10ml schlenk管中,称取3.8mg(0.01mmol)三齿邻菲罗啉锰催化剂mn1和3.0mg(0.03mmol)叔丁醇钠,氩气保护下加入114μl(1mmol)苯乙烯和186μl(1mmol)二苯基硅烷,室温反应3h。反应完全后,乙酸乙酯萃取,旋干,过柱,得到271mg无色油状物,即7a,其产率为94%。
[0083]1h nmr(400mhz,chloroform-d)δ7.58
–
7.56(m,4h),7.42
–
7.34(m,6h),7.28
–
7.23(m,2h),7.18
–
7.14(m,3h),4.89(t,j=3.7hz,1h),2.78
–
2.74(m,2h),1.54
–
1.48(m,2h)。
[0084]
13
c nmr(101mhz,chloroform-d)δ144.49,135.29,134.22,129.79,128.48,128.19,127.98,125.86,30.58,14.41。
[0085]
实施例8
[0086]
合成(4-甲氧基苯乙基)二苯基硅烷7b,具体按照以下步骤进行:
[0087]
按照实施例7中苯乙基二苯基硅烷7a的合成方法,用三齿邻菲罗啉锰催化剂mn2,134mg(1mmol)4-甲氧基苯乙烯代替苯乙烯,溶剂为thf,50℃反应5h,其他操作条件同实施例7,反应结束后得到258mg无色油状物,即7b,其产率为81%。
[0088]1h nmr(400mhz,chloroform-d)δ7.59(d,j=7.2hz,4h),7.45
–
7.37(m,6h),7.12(d,j=8.4hz,2h),6.83(d,j=8.5hz,2h),4.91(t,j=3.6hz,1h),3.80(s,3h),2.76
–
2.72(m,2h),1.54
–
1.49(m,2h)。
[0089]
13
c nmr(101mhz,chloroform-d)δ157.83,136.59,135.29,134.30,129.75,128.87,128.16,113.88,55.41,29.67,14.66。
[0090]
实施例9
[0091]
合成(4-叔丁基苯乙基)二苯基硅烷7c,具体按照以下步骤进行:
[0092]
按照实施例7中苯乙基二苯基硅烷7a的合成方法,用三齿邻菲罗啉锰催化剂mn3,160mg(1mmol)4-叔丁基苯乙烯代替苯乙烯,80℃反应12h,其他操作条件同实施例7,反应结束后得到275mg无色油状物,即7c,其产率为80%。
[0093]1h nmr(400mhz,chloroform-d)δ7.61(d,j=6.6hz,4h),7.45
–
7.38(m,6h),7.33(d,j=8.0hz,2h),7.16(d,j=7.9hz,2h),4.95(t,j=3.3hz,1h),2.81
–
2.77(m,2h),1.58
–
1.53(m,2h),1.35(s,9h)。
[0094]
13
c nmr(101mhz,chloroform-d)δ148.66,141.41,135.30,134.33,129.75,128.16,127.62,125.35,34.48,31.57,29.99,14.27。
[0095]
实施例10
[0096]
合成(4-氟苯乙基)二苯基硅烷7d,具体按照以下步骤进行:
[0097]
按照实施例7中苯乙基二苯基硅烷7a的合成方法,用三齿邻菲罗啉锰催化剂mn1,122mg(1mmol)4-氟苯乙烯代替苯乙烯,溶剂为正己烷,室温反应3h,其他操作条件同实施例7,反应结束后得到254mg无色油状物,即7d,其产率为83%。
[0098]1h nmr(400mhz,chloroform-d)δ7.58
–
7.56(m,4h),7.44
–
7.36(m,6h),7.14
–
7.10(m,2h),6.97
–
6.91(m,2h),4.89(t,j=3.7hz,1h),2.76
–
2.72(m,2h),1.52
–
1.46(m,2h)。
[0099]
13
c nmr(101mhz,chloroform-d)δ161.18(d,j
c-f
=244hz),139.86(d,j
c-f
=3.0hz),135.13,133.96,129.70,129.17(d,j
c-f
=8.1hz),128.07,115.00(d,j
c-f
=20.2hz),29.70,14.48。
[0100]
实施例11
[0101]
合成(4-氯苯乙基)二苯基硅烷7e,具体按照以下步骤进行:
[0102]
按照实施例7中苯乙基二苯基硅烷7a的合成方法,用三齿邻菲罗啉锰催化剂mn2,138mg(1mmol)4-氯苯乙烯代替苯乙烯,溶剂为thf,室温反应5h,其他操作条件同实施例7,反应结束后得到277mg无色油状物,即7e,其产率为86%。
[0103]1h nmr(400mhz,chloroform-d)δ7.60
–
7.58(m,4h),7.47
–
7.36(m,6h),7.28
–
7.20(m,2h),7.11(d,j=8.4hz,2h),4.91(t,j=3.7hz,1h),2.83
–
2.68(m,2h),1.56
–
1.45(m,2h)。
[0104]
13
c nmr(101mhz,chloroform-d)δ142.82,135.25,133.99,131.52,129.86,129.36,128.52,128.22,30.01,14.40。
[0105]
实施例12
[0106]
合成(4-溴苯乙基)二苯基硅烷7f,具体按照以下步骤进行:
[0107]
按照实施例7中苯乙基二苯基硅烷7a的合成方法,用三齿邻菲罗啉锰催化剂mn3,182mg(1mmol)4-溴苯乙烯代替苯乙烯,溶剂为乙醚,室温反应7h,其他操作条件同实施例7,反应结束后得到322mg无色油状物,即7f,其产率为88%。
[0108]1h nmr(400mhz,chloroform-d)δ7.59(d,j=7.5hz,4h),7.46
–
7.38(m,8h),7.06(d,j=8.2hz,2h),4.92(t,j=3.6hz,1h),2.76
–
2.72(m,2h),1.54
–
1.48(m,2h)。
[0109]
13
c nmr(101mhz,chloroform-d)δ143.34,135.25,133.96,131.47,129.86,129.78,128.22,119.53,30.08,14.34。
[0110]
实施例13
[0111]
合成(4-三氟甲基苯乙基)二苯基硅烷7g,具体按照以下步骤进行:
[0112]
按照实施例7中苯乙基二苯基硅烷7a的合成方法,用三齿邻菲罗啉锰催化剂mn1,172mg(1mmol)4-三氟甲基苯乙烯代替苯乙烯,80℃反应12h,其他操作条件同实施例7,反应结束后得到185mg无色油状物,即7g,其产率为52%。
[0113]1h nmr(400mhz,chloroform-d)δ7.62
–
7.60(m,4h),7.54(d,j=8.1hz,2h),7.48
–
7.40(m,6h),7.30(d,j=8.0hz,2h),4.96(t,j=3.6hz,1h),2.88
–
2.84(m,2h),1.58
–
1.53(m,2h)。
[0114]
13
c nmr(101mhz,chloroform-d)δ148.46,135.25,134.64,133.85,129.93,128.33,128.27,125.88,125.45,125.41,125.38,125.34,123.18,30.55,14.25。
[0115]
实施例14
[0116]
合成(3-甲基苯乙基)二苯基硅烷7h,具体按照以下步骤进行:
[0117]
按照实施例7中苯乙基二苯基硅烷7a的合成方法,用三齿邻菲罗啉锰催化剂mn2,118mg(1mmol)3-甲基苯乙烯代替苯乙烯,溶剂为thf,50℃反应6h,其他操作条件同实施例7,反应结束后得到272mg无色油状物,即7h,其产率为90%。
[0118]1h nmr(400mhz,chloroform-d)δ7.63
–
7.61(m,4h),7.47
–
7.39(m,6h),7.22
–
7.18(m,1h),7.02(d,j=7.5hz,3h),4.94(t,j=3.7hz,1h),2.80
–
2.75(m,2h),2.35(s,3h),1.57
–
1.52(m,3h)。
[0119]
13
c nmr(101mhz,chloroform-d)δ144.45,138.01,135.29,134.29,129.76,128.81,128.39,128.17,126.59,124.98,30.49,21.54,14.44。
[0120]
实施例15
[0121]
合成(3-溴苯乙基)二苯基硅烷7i,具体按照以下步骤进行:
[0122]
按照实施例7中苯乙基二苯基硅烷7a的合成方法,用三齿邻菲罗啉锰催化剂mn3,182mg(1mmol)3-溴苯乙烯代替苯乙烯,溶剂为正己烷,60℃反应6h,其他操作条件同实施例7,反应结束后得到307mg无色油状物,即7i,其产率为84%。
[0123]1h nmr(400mhz,chloroform-d)δ7.60
–
7.58(m,4h),7.46
–
7.38(m,6h),7.34(s,1h),7.31(dt,j=7.2,1.8hz,1h),7.15
–
7.10(m,2h),4.92(t,j=3.7hz,1h),2.77
–
2.73(m,2h),1.53
–
1.48(m,2h)。
[0124]
13
c nmr(101mhz,chloroform-d)δ146.77,135.25,133.91,131.08,130.02,129.89,128.97,128.24,126.68,122.55,30.33,14.27。
[0125]
实施例16
[0126]
合成(3-氟苯乙基)二苯基硅烷7j,具体按照以下步骤进行:
[0127]
按照实施例7中苯乙基二苯基硅烷7a的合成方法,用三齿邻菲罗啉锰催化剂mn1,122mg(1mmol)3-氟苯乙烯代替苯乙烯,溶剂为thf,30℃反应6h,其他操作条件同实施例7,反应结束后得到269mg无色油状物,即7j,其产率为88%。
[0128]1h nmr(400mhz,chloroform-d)δ7.61
–
7.59(m,4h),7.46
–
7.38(m,7h),7.25
–
7.20(m,1h),6.96(d,j=7.7hz,1h),6.92
–
6.85(m,2h),4.92(t,j=3.7hz,1h),2.82
–
2.76(m,2h),1.55
–
1.49(m,2h)。
[0129]
13
c nmr(101mhz,chloroform-d)δ163.09(d,j=245.4hz),147.03(d,j=7.1hz),135.26,133.98,129.88,129.79,128.23,123.63(d,j=2.0hz),114.83(d,j=21.2hz),112.70(d,j=21.2hz),30.39,14.18。
[0130]
实施例17
[0131]
合成(2-氯苯乙基)二苯基硅烷7k,具体按照以下步骤进行:
[0132]
按照实施例7中苯乙基二苯基硅烷7a的合成方法,用三齿邻菲罗啉锰催化剂mn2,138mg(1mmol)2-氯苯乙烯代替苯乙烯,溶剂为乙醚,室温反应12h,其他操作条件同实施例7,反应结束后得到274mg无色油状物,即7k,其产率为85%。
[0133]1h nmr(400mhz,chloroform-d)δ7.61(d,j=6.7hz,4h),7.44
–
7.37(m,6h),7.33(d,j=7.7hz,1h),7.20(t,j=6.7hz,1h),7.17
–
7.10(m,2h),4.95(t,j=3.3hz,1h),2.90
–
2.85(m,2h),1.55
–
1.50(m,2h)。
[0134]
13
c nmr(101mhz,chloroform-d)δ142.07,135.29,134.10,133.72,129.89,
129.82,129.60,128.19,127.34,126.96,28.78,12.90。
[0135]
实施例18
[0136]
合成(2-(1-萘基)乙基)二苯基硅烷二苯基硅烷7l,具体按照以下步骤进行:按照实施例7中苯乙基二苯基硅烷7a的合成方法,用三齿邻菲罗啉锰催化剂mn3,154mg(1mmol)1-乙烯基萘代替苯乙烯,50℃反应12h,其他操作条件同实施例7,反应结束后得到237mg无色油状物,即7l,其产率为70%。
[0137]1h nmr(400mhz,chloroform-d)δ7.96
–
7.92(m,1h),7.89
–
7.85(m,1h),7.72(d,j=8.0hz,1h),7.65
–
7.64(m,4h),7.50
–
7.46(m,2h),7.45
–
7.38(m,7h),7.34(d,j=6.7hz,1h),5.02(t,j=3.7hz,1h),3.28
–
3.22(m,2h),1.69
–
1.64(m,2h)。
[0138]
13
c nmr(101mhz,chloroform-d)δ140.62,135.31,134.21,134.06,131.59,129.85,128.92,128.22,126.68,125.86,125.74,125.54,125.21,123.78,27.75,13.98。
[0139]
实施例19
[0140]
合成(2-(2-萘基)乙基)二苯基硅烷7m,具体按照以下步骤进行:
[0141]
按照实施例7中苯乙基二苯基硅烷7a的合成方法,用三齿邻菲罗啉锰催化剂mn1,154mg(1mmol)2-乙烯基萘代替苯乙烯,60℃反应9h,其他操作条件同实施例7,反应结束后得到284mg无色油状物,即7m,其产率为84%。
[0142]1h nmr(400mhz,chloroform-d)δ7.82(d,j=7.5hz,1h),7.78(d,j=8.4hz,2h),7.64
–
7.62(m,5h),7.48
–
7.35(m,9h),4.97(t,j=3.6hz,1h),2.98
–
2.94(m,2h),1.66
–
1.61(m,2h)。
[0143]
13
c nmr(101mhz,chloroform-d)δ141.94,135.31,134.21,133.79,132.12,129.81,128.20,128.03,127.72,127.58,127.11,125.99,125.76,125.21,30.78,14.32。
[0144]
实施例20
[0145]
合成辛基二苯基硅烷7n,具体按照以下步骤进行:
[0146]
按照实施例7中苯乙基二苯基硅烷7a的合成方法,用三齿邻菲罗啉锰催化剂mn2,112mg(1mmol)辛-1-烯代替苯乙烯,80℃反应12h,其他操作条件同实施例7,反应结束后得到260mg无色油状物,即7n,其产率为88%。
[0147]1h nmr(400mhz,chloroform-d)δ7.58(d,j=7.0hz,4h),7.42
–
7.36(m,6h),4.88(t,j=3.2hz,1h),1.48(q,j=7.8hz,2h),1.40
–
1.35(m,2h),1.33
–
1.26(m,8h),1.19
–
1.14(m,2h),0.89(t,j=6.5hz,3h)。
[0148]
13
c nmr(101mhz,chloroform-d)δ135.14,134.76,129.44,127.93,33.17,31.89,29.20,29.19,24.41,22.66,14.09,12.17。
[0149]
实施例21
[0150]
合成(4-苯基丁基)二苯基硅烷7o,具体按照以下步骤进行:
[0151]
按照实施例7中苯乙基二苯基硅烷7a的合成方法,用三齿邻菲罗啉锰催化剂mn3,132mg(1mmol)4-苯基丁烯代替苯乙烯,溶剂为thf,60℃反应10h,其他操作条件同实施例7,反应结束后得到253mg无色油状物,即7o,其产率为80%。
[0152]1h nmr(400mhz,chloroform-d)δ7.55
–
7.53(m,4h),7.40
–
7.32(m,6h),7.23(q,j=6.4,5.5hz,2h),7.17
–
7.11(m,3h),4.85(t,j=3.6hz,1h),2.58(t,j=7.6hz,2h),1.73
–
1.65(m,2h),1.56
–
1.48(m,2h),1.20
–
1.13(m,2h)。
[0153]
13
c nmr(101mhz,chloroform-d)δ142.74,135.27,134.67,129.65,128.51,128.37,128.11,125.72,35.65,34.99,24.26,12.16。
[0154]
实施例22
[0155]
合成(3-苯基丙基)二苯基硅烷7p,具体按照以下步骤进行:按照实施例7中苯乙基二苯基硅烷7a的合成方法,用三齿邻菲罗啉锰催化剂mn1,118mg(1mmol)烯丙苯代替苯乙烯,溶剂为正己烷,50℃反应12h,其他操作条件同实施例7,反应结束后得到220mg无色油状物,即7p,其产率为73%。
[0156]1h nmr(400mhz,chloroform-d)δ7.60(d,j=6.8hz,4h),7.45
–
7.39(m,6h),7.31(q,j=6.7,6.0hz,2h),7.25
–
7.18(m,3h),4.94(t,j=4.0hz,1h),2.74(t,j=7.5hz,2h),1.86(p,j=7.8hz,2h),1.28
–
1.23(m,2h)。
[0157]
13
c nmr(101mhz,chloroform-d)δ142.29,135.27,134.52,129.68,128.67,128.38,128.12,125.86,39.38,26.45,12.00。
[0158]
实施例23
[0159]
合成(2-环己基)二苯基硅烷7q,具体按照以下步骤进行:
[0160]
按照实施例7中苯乙基二苯基硅烷7a的合成方法,用三齿邻菲罗啉锰催化剂mn2,110mg(1mmol)乙烯基环已烷代替苯乙烯,80℃反应12h,其他操作条件同实施例7,反应结束后得到206mg无色油状物,即7q,其产率为70%。
[0161]1h nmr(400mhz,chloroform-d)δ7.58(dd,j=7.5,1.7hz,4h),7.43
–
7.35(m,6h),4.86(t,j=3.6hz,1h),1.77
–
1.64(m,5h),1.39
–
1.34(m,2h),1.26
–
1.12(m,6h),0.91
–
0.82(m,2h)。
[0162]
13
c nmr(101mhz,chloroform-d)δ135.27,134.87,129.59,128.08,40.62,33.06,31.98,26.90,26.54,9.34。
[0163]
实施例24
[0164]
合成(2-(环己-3-烯-1-基)乙基)二苯基硅烷7r,具体按照以下步骤进行:
[0165]
按照实施例7中苯乙基二苯基硅烷7a的合成方法,用三齿邻菲罗啉锰催化剂mn3,108mg(1mmol)4-乙烯基环己-1-烯代替苯乙烯,溶剂为thf,50℃反应12h,其他操作条件同实施例7,反应结束后得到219mg无色油状物,即7r,其产率为75%。
[0166]1h nmr(400mhz,chloroform-d)δ7.59
–
7.57(m,4h),7.44
–
7.36(m,6h),5.67(s,2h),4.88(t,j=3.6hz,1h),2.17
–
2.12(m,1h),2.05
–
2.02(m,2h),1.81
–
1.76(m,1h),1.68
–
1.61(m,1h),1.58
–
1.53(m,1h),1.48
–
1.43(m,2h),1.24
–
1.16(m,3h)。
[0167]
13
c nmr(101mhz,chloroform-d)δ135.26,134.73,129.64,128.11,127.20,126.70,36.49,31.70,31.24,28.58,25.46,9.39。
[0168]
实施例25
[0169]
合成(2-丁氧基-乙基)二苯基硅烷7s,具体按照以下步骤进行:
[0170]
按照实施例7中苯乙基二苯基硅烷7a的合成方法,用三齿邻菲罗啉锰催化剂mn1,100mg(1mmol)1-(乙烯氧基)丁烷代替苯乙烯,溶剂为thf,60℃反应9h,其他操作条件同实施例7,反应结束后得到233mg无色油状物,即7s,其产率为82%。
[0171]1h nmr(400mhz,chloroform-d)δ7.59(d,j=7.1hz,4h),7.43
–
7.36(m,6h),4.93(s,1h),3.60(t,j=7.8hz,2h),3.37(t,j=6.5hz,2h),1.62
–
1.58(m,2h),1.53(q,j=
7.0hz,2h),1.40
–
1.31(m,2h),0.92(t,j=7.3hz,3h)。
[0172]
13
c nmr(101mhz,chloroform-d)δ135.28,134.05,129.75,128.12,70.43,67.52,32.00,19.52,14.38,14.07。
[0173]
实施例26
[0174]
合成(6-氯-己基)二苯基硅烷7t,具体按照以下步骤进行:
[0175]
按照实施例7中苯乙基二苯基硅烷7a的合成方法,用三齿邻菲罗啉锰催化剂mn2,118mg(1mmol)4-甲氧基苯乙烯代替苯乙烯,80℃反应12h,其他操作条件同实施例7,反应结束后得到227mg无色油状物,即7t,其产率为75%。
[0176]1h nmr(400mhz,chloroform-d)δ7.59(d,j=6.6hz,4h),7.44
–
7.37(m,6h),4.89(t,j=2.4hz,1h),3.51(t,j=6.7hz,2h),1.78
–
1.71(m,2h),1.57
–
1.49(m,2h),1.43
–
1.38(m,4h),1.21
–
1.16(m,2h)。
[0177]
13
c nmr(101mhz,chloroform-d)δ135.24,134.66,129.66,128.11,45.22,32.63,32.44,26.59,24.39,12.21。
[0178]
实施例27
[0179]
合成维生素衍生物-二苯基硅烷7x,具体按照以下步骤进行:
[0180]
按照实施例7中苯乙基二苯基硅烷7a的合成方法,用三齿邻菲罗啉锰催化剂mn3,532mg(1mmol)维生素e-衍生物-苯乙烯代替苯乙烯,80℃反应12h,其他操作条件同实施例7,反应结束后得到574mg微黄色油状物,即7x,其产率为80%。
[0181]1h nmr(400mhz,chloroform-d)δ7.58(dd,j=7.6,1.6hz,4h),7.42
–
7.35(m,6h),7.05(d,j=8.5hz,2h),6.65(d,j=8.5hz,2h),4.90(t,j=3.6hz,1h),2.75
–
2.70(m,2h),2.62(t,j=6.7hz,2h),2.14(s,3h),2.03(s,3h),1.98(s,3h),1.90
–
1.77(m,2h),1.66
–
1.55(m,3h),1.52
–
1.48(m,2h),1.45(s,3h),1.33
–
1.23(m,12h),1.19
–
1.07(m,6h),0.90
–
0.86(m,12h)。
[0182]
13
c nmr(101mhz,chloroform-d)δ156.98,148.63,143.59,136.50,135.17,134.22,129.61,128.74,128.31,128.03,126.36,123.18,117.81,114.50,75.00,40.05,39.42,37.51,37.45,37.34,32.84,32.74,31.37,29.56,28.02,26.96,24.84,24.49,23.89,22.76,22.67,21.07,20.66,19.80,19.72,14.33,12.95,12.07,11.84。
[0183]
三齿邻菲罗啉锰催化剂在催化烯烃硼氢化反应合成有机硼化合物的应用,其选择性是马氏,主要得到产物8,反应通式如下:
[0184][0185]
实施例28
[0186]
合成4,4,5,5-四甲基-2-(1-苯乙基)-1,3,2-二氧杂环戊烷8a,具体按照以下步骤进行:
[0187]
向带有搅拌子的10ml schlenk管中,称取3.8mg(0.01mmol)三齿邻菲罗啉锰催化剂mn1和3.0mg(0.03mmol)叔丁醇钠,氩气保护下加入114μl(1mmol)苯乙烯和558μl(4mmol)频那醇硼烷,室温反应2h。反应完全后,乙酸乙酯萃取,旋干,过柱即得174mg无色油状物,即
8a:9a(95:5),其产率为75%。
[0188]1h nmr(400mhz,chloroform-d)δ7.29
–
7.22(m,4h),7.16
–
7.12(m,1h),2.44(q,j=7.4hz,1h),1.34(d,j=7.5hz,3h),1.22(s,6h),1.21(s,6h)。
[0189]
13
c nmr(101mhz,chloroform-d)δ145.11,128.42,127.91,125.20,83.42,24.95,24.76,24.72,17.17。
[0190]
实施例29
[0191]
合成2-(1-(4-甲氧基苯基)乙基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊烷8b,具体按照以下步骤进行:
[0192]
按照实施例28中8a的合成方法,用三齿邻菲罗啉锰催化剂mn2,134mg(1mmol)4-甲氧基苯乙烯代替苯乙烯,溶剂为thf,50℃反应9h,其他操作条件同实施例28,反应结束后得到183mg无色油状物,即8b:9b(91:9),其产率为70%。
[0193]1h nmr(400mhz,chloroform-d)δ7.14(d,j=8.3hz,2h),6.82(d,j=8.3hz,2h),3.78(s,3h),2.37(q,j=7.2hz,1h),1.30(d,j=8.0hz,3h),1.21(s,6h),1.20(s,6h)。
[0194]
13
c nmr(101mhz,chloroform-d)δ157.39,137.16,128.75,113.91,83.36,55.33,24.95,24.77,24.73,17.49。
[0195]
实施例30
[0196]
合成2-(1-(4-叔丁基苯基)乙基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊烷8c,具体按照以下步骤进行:
[0197]
按照实施例28中8a的合成方法,用三齿邻菲罗啉锰催化剂mn3,160mg(1mmol)4-叔丁基苯乙烯代替苯乙烯,溶剂为正己烷,60℃反应9h,其他操作条件同实施例28,反应结束后得到239mg无色油状物,即8c:9c(100:0),其产率为83%。
[0198]1h nmr(400mhz,chloroform-d)δ7.27(d,j=7.9hz,2h),7.14(d,j=7.9hz,2h),2.43
–
2.37(m,1h),1.32(s,3h),1.30(s,9h),1.22(s,6h),1.21(s,6h)。
[0199]
13
c nmr(101mhz,chloroform-d)δ147.76,141.85,127.52,125.32,83.37,34.40,31.58,24.79,24.77,17.35。
[0200]
实施例31
[0201]
合成2-(1-(4-氟苯基)乙基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊烷8d,具体按照以下步骤进行:
[0202]
按照实施例28中8a的合成方法,用三齿邻菲罗啉锰催化剂mn1,122mg(1mmol)4-氟苯乙烯代替苯乙烯,溶剂为乙醚,30℃反应9h,其他操作条件同实施例28,反应结束后得到188mg无色油状物,即8d:9d(95:5),其产率为75%。
[0203]1h nmr(400mhz,chloroform-d)δ7.18
–
7.15(m,2h),6.94(t,j=8.6hz,2h),2.41(q,j=7.1hz,1h),1.31(d,j=8.0hz,3h),1.21(s,6h),1.20(s,6h)。
[0204]
13
c nmr(101mhz,chloroform-d)δ161.02(d,j=243hz),140.65(d,j=3.0hz),129.13(d,j=8.1hz),115.10(d,j=21.2hz),115.20,114.99,83.51,24.94,24.76,24.72,17.34。
[0205]
实施例32
[0206]
合成2-(1-(4-氯苯基)乙基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊烷8e,具体按照以下步骤进行:
[0207]
按照实施例28中8a的合成方法,用三齿邻菲罗啉锰催化剂mn2,138mg(1mmol)4-氯苯乙烯代替苯乙烯,溶剂为thf,室温反应12h,其他操作条件同实施例28,反应结束后得到181mg无色油状物,即8e:9e(93:7),其产率为68%。
[0208]1h nmr(400mhz,chloroform-d)δ7.22(d,j=7.9hz,2h),7.14(d,j=8.0hz,2h),2.40(q,j=6.8hz,1h),1.31(d,j=7.4hz,3h),1.20(s,6h),1.20(s,6h)。
[0209]
13
c nmr(101mhz,chloroform-d)δ143.62,130.87,129.23,128.48,83.57,24.95,24.75,24.72,17.05。
[0210]
实施例33
[0211]
合成2-(1-(4-溴苯基)乙基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊烷8f,具体按照以下步骤进行:
[0212]
按照实施例28中8a的合成方法,用三齿邻菲罗啉锰催化剂mn3,182mg(1mmol)4-溴苯乙烯代替苯乙烯,溶剂为thf,60℃反应6h,其他操作条件同实施例28,反应结束后得到229mg无色油状物,即8f:9f(76:24),其产率为74%。
[0213]1h nmr(400mhz,chloroform-d)δ7.38
–
7.36(m,3h),7.10
–
7.08(m,3h),2.70(t,j=7.8hz,0.66h),2.39(q,j=7.1hz,1h),1.30(d,j=7.5hz,4h),1.25
–
1.14(m,17h)。
[0214]
13
c nmr(101mhz,chloroform-d)δ144.02,143.35,131.28,131.18,129.82,129.54,119.18,118.76,83.44,83.19,29.39,24.81,24.61,24.58,16.84。
[0215]
实施例34
[0216]
合成2-(1-(4-三氟甲基苯基)乙基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊烷8g,具体按照以下步骤进行:
[0217]
按照实施例28中8a的合成方法,用三齿邻菲罗啉锰催化剂mn1,172mg(1mmol)4-三氟甲基苯乙烯代替苯乙烯,80℃反应12h,其他操作条件同实施例28,反应结束后得到210mg无色油状物,即8g:9g(90:10),其产率为70%。
[0218]1h nmr(400mhz,chloroform-d)δ7.51(d,j=7.9hz,2h),7.32(d,j=7.9hz,2h),2.51(q,j=7.2hz,1h),1.35(d,j=7.4hz,3h),1.21(s,6h),1.20(s,6h)。
[0219]
13
c nmr(101mhz,chloroform-d)δ149.44,128.13,127.54(q,j=31.3hz),125.31(q,j=4.0hz),124.67(q,j=272.7hz),83.71,24.93,24.75,24.71,16.84。
[0220]
实施例35
[0221]
合成2-(1-(3-甲基苯基)乙基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊烷8h,具体按照以下步骤进行:
[0222]
按照实施例28中8a的合成方法,用三齿邻菲罗啉锰催化剂mn2,118mg(1mmol)3-甲基苯乙烯代替苯乙烯,溶剂为thf,50℃反应9h,其他操作条件同实施例28,反应结束后得到185mg无色油状物,即8h:9h(94:6),其产率为75%。
[0223]1h nmr(400mhz,chloroform-d)δ7.16(t,j=7.5hz,1h),7.03(d,j=7.6hz,2h),6.96(d,j=7.3hz,1h),2.40(q,j=7.5hz,1h),2.33(s,3h),1.33(d,j=7.5hz,3h),1.23(s,6h),1.21(s,6h)。
[0224]
13
c nmr(101mhz,chloroform-d)δ145.01,137.85,128.76,128.30,126.00,124.93,83.39,24.94,24.74,24.72,21.60,17.25。
[0225]
实施例36
[0226]
合成2-(1-(3-氟苯基)乙基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊烷8i,具体按照以下步骤进行:
[0227]
按照实施例28中8a的合成方法,用三齿邻菲罗啉锰催化剂mn3,122mg(1mmol)3-氟苯乙烯代替苯乙烯,溶剂为正己烷,60℃反应9h,其他操作条件同实施例28,反应结束后得到185mg无色油状物,即8i:9i(94:6),其产率为70%。
[0228]1h nmr(400mhz,chloroform-d)δ7.20(q,j=7.8hz,1h),6.96(dd,j=19.5,9.1hz,2h),6.82(td,j=8.5,2.3hz,1h),2.44(q,j=7.4hz,1h),1.32(d,j=7.5hz,3h),1.21(s,6h),1.20(s,6h)。
[0229]
13
c nmr(101mhz,chloroform-d)δ163.12(d,j=245.4hz),147.80(d,j=7.1hz),129.64(d,j=8.1hz),123.76(d,j=2.0hz),114.66(d,j=21.2hz),112.04(d,j=21.2hz),83.59,24.93,24.74,24.70,16.87。
[0230]
实施例37
[0231]
合成2-(1-(3-溴苯基)乙基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊烷8j,具体按照以下步骤进行:
[0232]
按照实施例28中8a的合成方法,用三齿邻菲罗啉锰催化剂mn1,182mg(1mmol)3-溴苯乙烯代替苯乙烯,溶剂为thf,70℃反应4h,其他操作条件同实施例28,反应结束后得到248mg无色油状物,即8j:9j(94:6),其产率为80%。
[0233]1h nmr(400mhz,chloroform-d)δ7.36(s,1h),7.27
–
7.25(m,1h),7.13
–
7.10(m,2h),2.40(q,j=7.1hz,1h),1.31(d,j=7.4hz,3h),1.21(s,6h),1.20(s,6h)。
[0234]
13
c nmr(101mhz,chloroform-d)δ147.57,130.92,129.91,128.33,126.63,122.54,83.64,24.95,24.74,24.71,16.94。
[0235]
实施例38
[0236]
合成2-(1-(2-氯苯基)乙基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊烷8k,具体按照以下步骤进行:
[0237]
按照实施例28中8a的合成方法,用三齿邻菲罗啉锰催化剂mn2,138mg(1mmol)2-氯苯乙烯代替苯乙烯,80℃反应12h,其他操作条件同实施例28,反应结束后得到200mg无色油状物,即8k:9k(92:8),其产率为75%。
[0238]1h nmr(400mhz,chloroform-d)δ7.34(d,j=8.6hz,1h),7.30
–
7.28(m,1h),7.22(t,j=7.4hz,1h),7.11(td,j=7.7,1.5hz,1h),2.79(q,j=7.5hz,1h),1.37(d,j=7.5hz,3h),1.26(s,12h)。
[0239]
13
c nmr(101mhz,chloroform-d)δ142.98,133.97,129.31,128.98,126.99,126.55,83.59,24.96,24.81,24.80,15.54。
[0240]
实施例39
[0241]
合成2-(6-氯己烷-2-基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊烷8l,具体按照以下步骤进行:
[0242]
按照实施例28中8a的合成方法,用三齿邻菲罗啉锰催化剂mn3,118mg(1mmol)6-氯己-1-烯代替苯乙烯,溶剂为thf,60℃反应9h,其他操作条件同实施例28,反应结束后得到177mg无色油状物,即8l:9l(88:12),其产率为72%。
[0243]1h nmr(400mhz,chloroform-d)δ3.52(t,j=6.8hz,2h),1.75(p,j=6.9hz,2h),
1.49
–
1.39(m,3h),1.32
–
1.23(m,13h),1.07
–
0.95(m,4h)。
[0244]
13
c nmr(101mhz,chloroform-d)δ83.03,45.30,32.99,32.53,26.34,24.96,24.91,24.86,15.57。
[0245]
实施例40
[0246]
合成4,4,5,5-四甲基-2-(1-苯基丙烷-2-基)-1,3,2-二氧杂环戊烷8m,具体按照以下步骤进行:
[0247]
按照实施例28中8a的合成方法,用三齿邻菲罗啉锰催化剂mn1,118mg(1mmol)烯丙苯代替苯乙烯,溶剂为正己烷,70℃反应10h,其他操作条件同实施例28,反应结束后得到172mg无色油状物,即8m:9m(86:14),其产率为70%。
[0248]1h nmr(400mhz,chloroform-d)δ7.29
–
7.26(m,2h),7.24
–
7.21(m,2h),7.20
–
7.15(m,1h),2.84(dd,j=13.6,7.5hz,1h),2.57(dd,j=13.6,8.3hz,1h),1.43
–
1.38(m,1h),1.22(s,6h),1.21(s,6h),1.00(d,j=7.4hz,3h)。
[0249]
13
c nmr(101mhz,chloroform-d)δ142.45,129.03,128.13,125.67,83.12,39.11,24.97,24.84,24.83,15.33。
[0250]
实施例41
[0251]
合成4,4,5,5-四甲基-2-(4-苯基丁烷-2-基)-1,3,2-二氧杂环戊烷8n,具体按照以下步骤进行:
[0252]
按照实施例28中8a的合成方法,用三齿邻菲罗啉锰催化剂mn2,132mg(1mmol)4-苯基-1-丁烯代替苯乙烯,80℃反应9h,其他操作条件同实施例28,反应结束后得到190mg无色油状物,即8b:9b(81:19),其产率为73%。
[0253]1h nmr(400mhz,chloroform-d)δ7.24
–
7.22(m,2h),7.17
–
7.12(m,3h),2.62
–
2.57(m,2h),1.81
–
1.73(m,1h),1.59
–
1.54(m,1h),1.22(s,12h),1.09
–
1.04(m,1h),1.01
–
0.99(m,3h)。
[0254]
13
c nmr(101mhz,chloroform-d)δ143.22,128.57,128.33,125.63,83.03,35.45,35.42,24.94,24.88,15.55。
[0255]
实施例42
[0256]
克规模合成苯乙基二苯基硅烷7a,具体按照以下步骤进行:
[0257]
向带有搅拌子的100ml schlenk管中,称取38mg(0.1mmol)三齿邻菲罗啉锰催化剂mn1和30.0mg(0.3mmol)叔丁醇钠,氩气保护下加入1140μl(10mmol)苯乙烯和1860μl(10mmol)二苯基硅烷,室温反应12h。反应完全后,乙酸乙酯萃取,旋干,过柱即得2650mg无色油状物,即苯乙基二苯基硅烷7a,其产率为92%。
[0258]
实施例43
[0259]“一锅法
”-
连续硅氢化-氧化合成2-苯乙醇10a:具体按照以下步骤进行:
[0260]
向带有搅拌子的100ml schlenk管中,称取3.8mg(0.01mmol)三齿邻菲罗啉锰催化剂mn1和3.0mg(0.03mmol)叔丁醇钾,氩气保护下加入114μl(1mmol)苯乙烯和186μl(1mmol)二苯基硅烷,室温反应12h。然后,加入232mg(4mmol)kf,1000mg(10mmol)khco3,3.3ml(30%,30mmol)h2o2,4ml thf和4ml meoh,60℃反应24h。反应完全后,乙醚萃取,旋干,过柱即得122mg无色油状物,即10a,其产率为85%。
[0261]1h nmr(400mhz,chloroform-d)δ7.27
–
7.33(m,3h),7.28
–
7.25(m,2h),3.88(t,j
=6.9hz,2h),2.90(t,j=6.9hz,2h),1.75(s,1h)。
[0262]
13
c nmr(101mhz,chloroform-d)δ138.61,129.15,128.69,126.58,63.77,39.31。
[0263]
实施例44
[0264]“一锅法
”-
连续硅氢化-氧化合成苯乙基二苯基硅醇10b:具体按照以下步骤进行:
[0265]
向带有搅拌子的10ml schlenk管中,称取3.9mg(0.01mmol)三齿邻菲罗啉锰催化剂mn2和3.0mg(0.03mmol)叔丁醇钾,氩气保护下加入114μl(1mmol)苯乙烯和186μl(1mmol)二苯基硅烷,室温反应12h。然后,加入106mg(1.0mmol)pd/c(10%),0.4ml h2o和4ml et2o,室温反应过夜。反应完全后,乙醚萃取,旋干,过柱即得122mg无色油状物,即10b,其产率为75%。
[0266]1h nmr(400mhz,chloroform-d)δ7.64(d,j=6.7hz,4h),7.46
–
7.39(m,6h),7.30
–
7.26(m,2h),7.20
–
7.16(m,3h),2.82
–
2.78(m,2h),2.27(s,1h),1.56
–
1.52(m,2h)。
[0267]
13
c nmr(101mhz,chloroform-d)δ144.58,136.09,134.30,130.11,128.55,128.12,127.96,125.90,29.20,17.25。
[0268]
实施例45
[0269]“一锅法
”-
连续硅氢化-环化合成1,1-二苯基-2,3-二氢-1h-苯并[b]硅氧烷10c:具体按照以下步骤进行:
[0270]
向带有搅拌子的10ml schlenk管中,称取3.9mg(0.01mmol)三齿邻菲罗啉锰催化剂mn3和3.0mg(0.03mmol)叔丁醇钾,氩气保护下加入114μl(1mmol)苯乙烯和186μl(1mmol)二苯基硅烷,室温反应12h。然后,加入,13.2mg(0.02mmol)ir(ome)(cod)2,11mg(0.04mmol)4,4'-二叔丁基联吡啶,101mg(1.02mmol)降冰片烯和4ml thf,80℃反应过夜。反应完全后,乙醚萃取,旋干,过柱即得229mg无色油状物,即10c,其产率为80%。
[0271]1h nmr(400mhz,chloroform-d)δ7.68(d,j=7.2hz,1h),7.59
–
7.56(m,4h),7.40
–
7.30(m,8h),7.25
–
7.21(m,1h),3.31
–
3.13(t,j=7.3hz,2h),1.53
–
1.50(m,2h)。
[0272]
13
c nmr(101mhz,chloroform-d)δ154.49,136.49,135.43,135.25,133.44,130.01,129.72,128.07,126.18,126.02,32.01,10.72。
[0273]
以上所述仅为本发明的实施例,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1