一种新型冠状病毒核酸纯化试剂及纯化方法与流程
本发明属于核酸纯化
技术领域:
,具体涉及一种新型冠状病毒核酸纯化试剂及纯化方法。
背景技术:
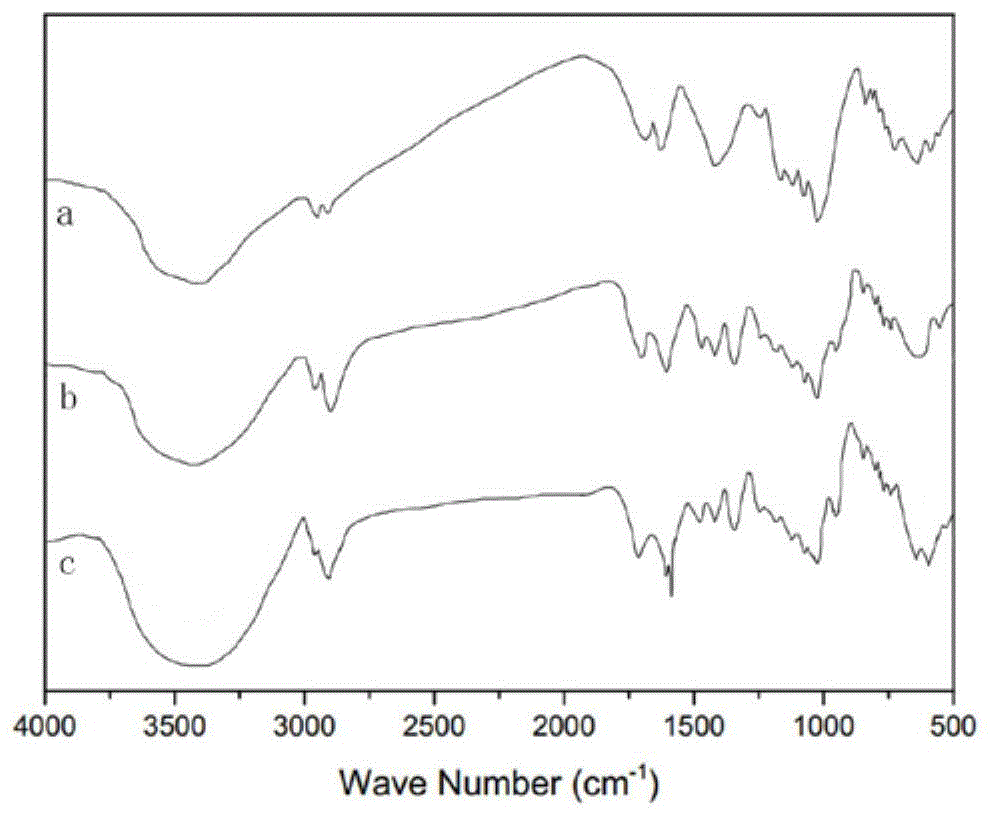
:新型冠状病毒肺炎(2019-ncov)是指由新型冠状病毒感染导致的病毒性呼吸道疾病,由rna核酸和蛋白等组成,rna很容易降解,蛋白衣壳将rna包裹在其中,加上一层由脂质和糖蛋白组成的包膜,从而使其rna得到保护。2019-ncov通过细胞表面的血管紧张素转换酶2(angiotensinconvertingenzymeⅱ,ace2)受体入侵细胞造成感染,并且利用宿主细胞进行复制增殖。因此可以通过采集人的特定部位细胞标本,检测其中是否含有病毒rna核酸,来确认机体是否受到感染。我国科学家从sars-cov-2感染者的支气管、肺泡灌洗液标本中检测出泛β-冠状病毒核酸阳性,并利用il-lumina二代测序和nanopore三代测序技术获得了病毒的全基因序列。随后,国内各种核酸检测试剂盒相继面世,主要包括实时荧光定量pcr(rt-qpcr)、恒温扩增技术及快速卡式荧光pcr技术等。然而,近期的新冠病毒核酸检测出现了阳性率低、检测结果与临床表现不吻合等问题,据推测,病原学因素、样本因素、人员因素、仪器设备因素、试剂因素等都有可能影响检测而造成假阴性结果。其中,有效的核酸纯化是核酸检测的一个关键前提条件,而核酸的分离纯化主要是指将核酸与蛋白质、多糖、脂肪等生物大分子物质分开,主要的方法有磁珠法、离心柱法和一步裂解释放法。现有技术中,申请公布号为cn111235145a的发明专利申请公开一种核酸纯化试剂及纯化方法,所述的试剂包括:磁珠、dna结合液、洗涤液和洗脱液;所述的磁珠为硅羟基修饰的磁珠;所述的dna结合液为盐酸胍、醋酸钠、tritonx-100;所述的洗涤液包括:试剂1:盐酸胍、醋酸钠、tritonx-100;试剂2:乙醇、醋酸钠、柠檬酸钠;所述的洗脱液为tris-hcl,实施过程中在dna结合液中加入浓度比为1:1-5的椰油酰基谷氨酸钠和月桂酰基谷氨酸钠可明显提高纯化效果,各试剂相互作用明显提高核酸的纯化效率并且纯度高,使分离纯化得率可达98.76%,明显高于现有技术。申请公布号为cn103820431a的发明专利申请一种基于纳米磁珠的核酸提取纯化方法,步骤包括:将生物样品和裂解缓冲液混合,使裂解缓冲液中的纳米磁珠与游离到裂解缓冲液中的核酸dna/rna形成磁珠-核酸复合物,在磁场作用下转移至洗涤缓冲液液,洗涤去除磁珠-核酸复合物上的杂质,在磁场作用下再转移至洗脱缓冲液中洗脱回收核酸。该申请使用的纳米磁珠颗粒大小均匀,表面光滑,表面积比值大,磁响应速度快,能长期与裂解缓冲液共同室温保存,对核酸吸附力强,分离迅速;提取出的核酸dna/rna纯度高、完整,可直接用于后续检测,核酸提取时间较一般磁珠法核酸提取试剂需要时间更短,更适合自动化,实现了高通量核酸dna/rna的提取。技术实现要素:本发明的其中一个目的在于提供一种硒代赖氨酸改性壳聚糖在包覆四氧化三铁纳米颗粒制备纳米磁珠中的用途。经硒代赖氨酸改性壳聚糖包覆制得纳米磁珠,具有粒径分散性均匀、比表面积大、磁场感应性好、核酸亲和力和吸附力强的优点,是纯化核酸优良的载体,可实现核酸的高效、快速提取。本发明的其中一个目的在于提供一种粒径分散性均匀、比表面积大、磁场感应性好、核酸亲和力和吸附力强的纳米磁珠,可以纯化血液、组织、培养细胞等不同样本中的核酸。本发明为实现上述目的所采取的技术方案为:一种纳米磁珠,包括核区和壳层,壳层包覆核区;组成核区的材料为四氧化三铁纳米颗粒;组成壳层的材料为经硒代赖氨酸改性壳聚糖。本发明纳米磁珠在四氧化三铁纳米颗粒表面包覆有硒代赖氨酸改性壳聚糖,粒径分散性均匀、比表面积大、磁场感应性好、核酸亲和力和吸附力强,能够吸附更多的核酸,对其他的生化组分如蛋白质、多糖、脂类则既不亲和也不吸附,可以纯化血液、组织、培养细胞等不同样本中的核酸,纯化过程快速、结果准确、精密度高,提高核酸纯化的产量、纯度、重复性和稳定性,满足后续试验要求。进一步地,纳米磁珠的粒径为100-200nm。进一步地,纳米磁珠的饱和磁化强度>54emu/g。本发明还公开了上述纳米磁珠的制备方法,包括:a1,将壳聚糖和硒代赖氨酸在edc和nhs存在下反应,获得硒代赖氨酸改性壳聚糖;a2,铁前驱体溶液在碱性条件下反应,获得四氧化三铁颗粒;a3,采用凝聚沉淀方法将四氧化三铁颗粒与硒代赖氨酸改性壳聚糖溶液混合,获得纳米磁珠。进一步地,一种纳米磁珠的制备方法,包括:a1,按重量份计,将4-6份壳聚糖分散于500-1000份mes/hcl缓冲液中,加入4-6份硒代赖氨酸、1.5-2.8份edc和1-1.6份nhs,混合均匀,调节ph值至4.0-6.0,反应10-15h后调节ph值至8.0-9.0,然后将产物装入透析袋中透析5-7d,期间每隔5-8h更换一次蒸馏水,将产物冷冻干燥,获得硒代赖氨酸改性壳聚糖;a2,按重量份计,将95-110份3-5mnaoh溶液升温至50-70℃,通氮气除氧后加入18-24份0.4-0.6m氯化亚铁和28-40份0.4-0.6m氯化铁,反应30-60min后升温至80-90℃,继续反应45-90min后自然冷却,离心分离提取沉淀物,再用乙醇及蒸馏水洗涤沉淀物,冷冻干燥后获得四氧化三铁颗粒;a3,按重量份计,将0.8-2份硒代赖氨酸改性壳聚糖溶于100份15-25m乙酸溶液中,加入0.8-2份四氧化三铁颗粒,混合均匀后超声分散20-60min,然后升温至30-50℃,通氮气除氧后加入硫酸钠溶液凝聚沉淀反应3-6h,离心分离提取沉淀物,将沉淀物用乙醇及蒸馏水洗涤,冷冻干燥后获得壳聚糖纳米氧化铁磁珠。更进一步地,mes/hcl缓冲液中mes浓度为20-30m,mes/hcl缓冲液的ph为4.0-6.0。本发明还公开了上述纳米磁珠在核酸纯化中的用途。进一步地,核酸为天然来源的核酸或合成的核酸。更进一步,天然来源的核酸为从任何类型的细胞提取的核酸,如细胞培养物、组织样品、血液样品等。更进一步,合成的核酸为rna转录产物产生的cdna、pcr产物、质粒dna。进一步地,纳米磁珠在新型冠状病毒核酸纯化中的用途。本发明还公开了一种新型冠状病毒核酸纯化试剂,包括上述纳米磁珠。进一步地,核酸纯化试剂还包括:洗涤i液、洗涤ii液和洗脱液。更进一步地,洗涤i液包括:tris-hcl6-12mm、乙酸钠0.5-1.0m、0.1-0.2m氯化锂、tween-201.2-1.6wt%、乙醇50-60%(v/v),其ph为6.0-7.0;洗涤ii液包括:tris-hcl6-12mm、氯化钠15-25mm、乙醇50-60%(v/v),其ph为6.0-7.0;洗脱液包括:tris-hcl6-12mm,其ph为7.5-8.5。进一步地,核酸纯化试剂还包括结合液。更进一步地,结合液包括:氯化钠1-3mm、peg-40006-10%。更进一步地,结合液包括:氯化钠1-3mm、硒代赖氨酸改性壳聚糖3-5%、peg-40006-10%。结合液的加入能够提高核酸纯化效果,这是因为结合液能够使磁珠处于悬浮状态,从而增加磁珠和核酸的接触几率,最终达到提高核酸纯化效果的目的,而硒代赖氨酸改性壳聚糖的加入使得核酸的得率更高。更进一步地,洗涤ii液还包括3-5mm甘氨酸乙酯盐酸盐,洗脱液中甘氨酸乙酯盐酸盐的存在有利于盐离子、核苷酸和氨基酸等小分子杂质的去除,进一步提高a260/a230,此外还能进一步提高核酸纯化效果。本发明还公开了一种纯化过程快速、结果准确、精密度高的新型冠状病毒核酸的纯化方法,取上述核酸纯化试剂与待纯化样本混合,得到纯化的核酸。该纯化方法能够提高核酸纯化的产量、纯度、重复性和稳定性。进一步地,纯化方法包括:b1,将待纯化样本、磁珠和结合液加入离心管中,混匀,磁分离,弃上清;b2,将离心管中加入洗涤i液,磁分离,吸净管盖及管底的残液;b3,将离心管中加入洗涤ii液,磁分离,吸净管盖及管底的残液;b4,将离心管中加入洗脱液,60-70℃下放置10-15min,每隔1-2min轻摇混匀,磁分离,小心吸取上清液至新的离心管中,放入-20℃冰箱保存。更进一步地,待纯化样本为新型冠状病毒核酸裂解液。于本发明中,新型冠状病毒核酸裂解液通过如下方法获得:将2019新型冠状病毒核酸样本中加入裂解液,混匀,在60-70℃、400-600r/min下振荡处理20-40min,获得新型冠状病毒核酸裂解液。于本发明中,裂解缓冲液包括:盐酸胍2-3m、tween-201.2-1.6wt%、0.4-0.6m氯化钠、乙醇50-60%(v/v),其ph为6.0-7.0。本发明由于采用了在四氧化三铁纳米颗粒表面包覆有硒代赖氨酸改性壳聚糖的壳聚糖基纳米磁珠,因而具有如下有益效果:本发明新型冠状病毒核酸纯化试剂具有较好的核酸纯化效果,比如纯化过程快速、结果准确、精密度高,核酸的产量高、纯度高、重复性和稳定性佳。因此,本发明提供一种纯化效果佳的新型冠状病毒核酸纯化试剂。附图说明图1为硒代赖氨酸改性壳聚糖和纳米磁珠的ftir图;图2为纳米磁珠的tem图;图3为纳米磁珠的室温磁滞回线;图4为实施例1-7纯化方法纯化效果比较;图5为实施例1-7纯化方法的稳定性;图6为实施例1-7纯化方法对不同浓度的核酸样本的纯化效果。具体实施方式下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本
技术领域:
普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。实施例1:1.一种纳米磁珠的制备方法,包括:a1,按重量份计,将5份壳聚糖分散于750份mes/hcl缓冲液(mes浓度为25m,mes/hcl缓冲液的ph为5.0)中,加入5份硒代赖氨酸、2.2份edc和1.15份nhs,混合均匀,调节ph值至5.0,反应12h后调节ph值至8.5,然后将产物装入透析袋中透析7d,期间每隔6h更换一次蒸馏水,将产物冷冻干燥,获得硒代赖氨酸改性壳聚糖;a2,按重量份计,将100份4mnaoh溶液升温至60℃,通氮气除氧后加入20份0.5m氯化亚铁和35份0.5m氯化铁,反应45min后升温至85℃,继续反应60min后自然冷却,离心分离提取沉淀物,再用乙醇及蒸馏水洗涤沉淀物,冷冻干燥后获得四氧化三铁颗粒;a3,按重量份计,将1.2份硒代赖氨酸改性壳聚糖溶于100份20m乙酸溶液中,加入1.2份四氧化三铁颗粒,混合均匀后超声分散30min,然后升温至45℃,通氮气除氧后加入硫酸钠溶液凝聚沉淀反应5h,离心分离提取沉淀物,将沉淀物用乙醇及蒸馏水洗涤,冷冻干燥后获得壳聚糖纳米氧化铁磁珠。2.一种新型冠状病毒核酸纯化试剂,包括上述纳米磁珠、结合液、洗涤i液、洗涤ii液和洗脱液,具体为:结合液包括:氯化钠2mm、peg-40008%;洗涤i液包括:tris-hcl10mm、乙酸钠0.8m、0.15m氯化锂、tween-201.5wt%、乙醇55%(v/v),其ph为6.5;洗涤ii液包括:tris-hcl10mm、氯化钠20mm、乙醇55%(v/v),其ph为6.5;洗脱液包括:tris-hcl10mm,其ph为8.0。3.一种新型冠状病毒核酸的纯化方法,包括:b1,将150μl新型冠状病毒待纯化样本、30μg磁珠和300μl结合液加入离心管中,ph调节至5.0,上下颠倒混匀30s,室温孵育20min,期间5min上下颠倒混匀10s,使磁珠与核酸充分结合,然后磁分离,弃上清;b2,将离心管中加入500μl洗涤i液,上下颠倒混匀使磁珠充分悬浮,磁分离,吸净管盖及管底的残液;b3,将离心管中加入500μl洗涤ii液,上下颠倒混匀使磁珠充分悬浮,磁分离,吸净管盖及管底的残液;b4,将离心管中加入50μl洗脱液,65℃下放置15min,每隔2min轻摇混匀,磁分离,小心吸取上清液至新的离心管中,放入-20℃冰箱保存。实施例2:一种纳米磁珠的制备方法,包括:a1,按重量份计,将4份壳聚糖分散于600份mes/hcl缓冲液(mes浓度为25m,mes/hcl缓冲液的ph为5.0)中,加入6份硒代赖氨酸、2.0份edc和1.5份nhs,混合均匀,调节ph值至5.0,反应10h后调节ph值至9.0,然后将产物装入透析袋中透析5d,期间每隔8h更换一次蒸馏水,将产物冷冻干燥,获得硒代赖氨酸改性壳聚糖;a2,同实施例1;a3,按重量份计,将0.8份硒代赖氨酸改性壳聚糖溶于100份25m乙酸溶液中,加入2份四氧化三铁颗粒,混合均匀后超声分散25min,然后升温至35℃,通氮气除氧后加入硫酸钠溶液凝聚沉淀反应6h,离心分离提取沉淀物,将沉淀物用乙醇及蒸馏水洗涤,冷冻干燥后获得壳聚糖纳米氧化铁磁珠。2.一种新型冠状病毒核酸纯化试剂,同实施例1。3.一种新型冠状病毒核酸的纯化方法,同实施例1。实施例3:一种纳米磁珠的制备方法,包括:a1,按重量份计,将6份壳聚糖分散于1000份mes/hcl缓冲液(mes浓度为25m,mes/hcl缓冲液的ph为5.0)中,加入4份硒代赖氨酸、2.8份edc和1.6份nhs,混合均匀,调节ph值至5.0,反应15h后调节ph值至9.0,然后将产物装入透析袋中透析6d,期间每隔6h更换一次蒸馏水,将产物冷冻干燥,获得硒代赖氨酸改性壳聚糖;a2,同实施例1;a3,按重量份计,将2份硒代赖氨酸改性壳聚糖溶于100份15m乙酸溶液中,加入1份四氧化三铁颗粒,混合均匀后超声分散30min,然后升温至40℃,通氮气除氧后加入硫酸钠溶液凝聚沉淀反应6h,离心分离提取沉淀物,将沉淀物用乙醇及蒸馏水洗涤,冷冻干燥后获得壳聚糖纳米氧化铁磁珠。2.一种新型冠状病毒核酸纯化试剂,同实施例1。3.一种新型冠状病毒核酸的纯化方法,同实施例1。实施例4:一种纳米磁珠的制备方法,包括:a1,按重量份计,将100份4mnaoh溶液升温至60℃,通氮气除氧后加入20份0.5m氯化亚铁和35份0.5m氯化铁,反应45min后升温至85℃,继续反应60min后自然冷却,离心分离提取沉淀物,再用乙醇及蒸馏水洗涤沉淀物,冷冻干燥后获得四氧化三铁颗粒;a2,按重量份计,将1.2份壳聚糖溶于100份20m乙酸溶液中,加入1.2份四氧化三铁颗粒,混合均匀后超声分散30min,然后升温至45℃,通氮气除氧后加入硫酸钠溶液凝聚沉淀反应5h,离心分离提取沉淀物,将沉淀物用乙醇及蒸馏水洗涤,冷冻干燥后获得壳聚糖纳米氧化铁磁珠。2.一种新型冠状病毒核酸纯化试剂,同实施例1。3.一种新型冠状病毒核酸的纯化方法,同实施例1。实施例5:1.一种纳米磁珠的制备方法,同实施例1。2.一种新型冠状病毒核酸纯化试剂,包括上述纳米磁珠、结合液、洗涤i液、洗涤ii液和洗脱液,具体为:结合液包括:氯化钠2mm、peg-40008%、硒代赖氨酸改性壳聚糖4%;洗涤i液包括:tris-hcl10mm、乙酸钠0.8m、0.15m氯化锂、tween-201.5wt%、乙醇55%(v/v),其ph为6.5;洗涤ii液包括:tris-hcl10mm、氯化钠20mm、乙醇55%(v/v),其ph为6.5;洗脱液包括:tris-hcl10mm,其ph为8.0。3.一种新型冠状病毒核酸的纯化方法,同实施例1。实施例6:1.一种纳米磁珠的制备方法,同实施例1。2.一种新型冠状病毒核酸纯化试剂,包括上述纳米磁珠、结合液、洗涤i液、洗涤ii液和洗脱液,具体为:结合液包括:氯化钠2mm、peg-40008%4%;洗涤i液包括:tris-hcl10mm、乙酸钠0.8m、0.15m氯化锂、tween-201.5wt%、乙醇55%(v/v),其ph为6.5;洗涤ii液包括:tris-hcl10mm、氯化钠20mm、甘氨酸乙酯盐酸盐3.5mm、乙醇55%(v/v),其ph为6.5;洗脱液包括:tris-hcl10mm,其ph为8.0。3.一种新型冠状病毒核酸的纯化方法,同实施例1。实施例7:1.一种纳米磁珠的制备方法,同实施例1。2.一种新型冠状病毒核酸纯化试剂,包括上述纳米磁珠、结合液、洗涤i液、洗涤ii液和洗脱液,具体为:结合液包括:氯化钠2mm、peg-40008%、硒代赖氨酸改性壳聚糖4%;洗涤i液包括:tris-hcl10mm、乙酸钠0.8m、0.15m氯化锂、tween-201.5wt%、乙醇55%(v/v),其ph为6.5;洗涤ii液包括:tris-hcl10mm、氯化钠20mm、甘氨酸乙酯盐酸盐3.5mm、乙醇55%(v/v),其ph为6.5;洗脱液包括:tris-hcl10mm,其ph为8.0。3.一种新型冠状病毒核酸的纯化方法,同实施例1。试验例1:1.红外光谱分析采用kbr压片法,在傅立叶变换红外光谱仪上对实施例1得硒代赖氨酸改性壳聚糖和纳米磁珠样品进行ftir表征,扫描波数范围为4000-400cm-1,分辨率4cm-1,扫描次数32次。硒代赖氨酸改性壳聚糖和纳米磁珠的ftir图见图1,图中a为壳聚糖,b为实施例1得硒代赖氨酸改性壳聚糖,c为实施例1得纳米磁珠。可以看出,硒代赖氨酸改性壳聚糖和壳聚糖的红外光谱存在不同之处,比如,在1610cm-1和1465cm-1附近出现新的吸收峰,这是羧基中的不对称伸缩振动和对称伸缩振动引起的;在740cm-1附近出现新的吸收峰,这是c-se中的不对称伸缩振动和对称伸缩振动引起的;在2900-2960cm-1附近处的吸收峰增强,以上说明硒代赖氨酸改性壳聚糖制备成功。同理,从纳米磁珠的红外光谱可以看出,纳米磁珠的表面含有硒代赖氨酸改性壳聚糖。2.透射电子显微镜分析利用透射电子显微镜观察纳米磁珠的物理形态、分散状态及粒径参数。将实施例1得纳米磁珠在乙醇中利用超声波使之均匀分散,将一滴分散液滴加到碳膜铜网上,自然干燥后放入透射电子显微镜中观察粒子的平均粒径及形貌。图2为纳米磁珠的tem图,可以看出,四种磁性微粒的成球性好,包裹性好,粒径100-200nm,具有较大的比表面积。3.磁强计分析取5.0mg纳米磁珠干燥样品,在室温下采用振动样品磁强计在-15k至+15koe量程中度数,记录产物的磁滞回线进而得出其饱和磁化强度。图3为纳米磁珠的室温磁滞回线,图中a为实施例1得纳米磁珠,b为实施例2得纳米磁珠,c为实施例3得纳米磁珠,d为实施例4得纳米磁珠。表1为纳米磁珠的饱和磁化强度,可以看出。从图3和表1可以看出,实施例1-3得纳米磁珠的饱和磁化强度>54emu/g,这说明实施例1-3得纳米磁珠的磁场感应性好。表1纳米磁珠的饱和磁化强度组别饱和磁化强度(emu/g)实施例157.11实施例258.42实施例355.27实施例448.164.核酸的得率和纯度测定取200μl含20copies/ml新型冠状病毒核酸样品,加入400μl裂解液,混匀,在65℃、500r/min下振荡处理25min,获得新型冠状病毒核酸裂解液,即新型冠状病毒待纯化样本。裂解缓冲液包括:盐酸胍2.5m、tween-201.5wt%、0.5m氯化钠、乙醇55%(v/v),其ph为6.5。按照实施例1-7方法对新型冠状病毒待纯化样本进行纯化,用超微量核酸检测仪测定纯化后产物中核酸浓度、a260、a280及a230,计算得率和纯度(a260/a280、a260/a230)。表2核酸浓度和纯度组别核酸浓度(ng/μl)a260/a280a260/a230实施例1106.242.0642.086实施例2105.772.0552.067实施例3105.432.0682.079实施例487.341.8781.952实施例5119.222.0242.139实施例6117.532.0112.123实施例7123.862.0152.125核酸浓度和纯度见表2,实施例1-3核酸的得率大于90%,且实施例1核酸的浓度大于实施例4,这说明纳米磁珠在四氧化三铁纳米颗粒表面包覆有氨基改性二氧化硅,可以提高核酸纯化的产量;从表2中还能得出,利用本发明实施例1-3纳米磁珠对核酸进行分离纯化,能够提高核酸的纯度;结合液中硒代赖氨酸改性壳聚糖的存在能够提高核酸的得率和纯度;洗涤ii液中甘氨酸乙酯盐酸盐的存在能够提高核酸的得率和纯度。5.核酸的纯化效果测定取200μl含102copies/ml新型冠状病毒核酸样品,加入400μl裂解液,混匀,在65℃、500r/min下振荡处理25min,获得新型冠状病毒核酸裂解液,即新型冠状病毒待纯化样本。裂解缓冲液包括:盐酸胍2.5m、tween-201.5wt%、0.5m氯化钠、乙醇55%(v/v),其ph为6.5。按照实施例1-7方法对新型冠状病毒待纯化样本进行纯化,使用荧光定量pcr仪对纯化产物进行荧光扩增,参照核酸检测试剂盒检测说明书设置反应程序(上海捷诺生物科技有限公司,批号:gztr2020005,国械注准20203400058),结果以ct值表示。同时,为了评价纯化方法的稳定性,将纯化产物于-20℃放置24h后进行荧光扩增。此外,为了评价纯化方法的精密度,不同浓度的新型冠状病毒核酸样品进行如上试验。图4为实施例1-7纯化方法纯化效果比较,图中ct值为2019-ncovorf1ab基因ct值,可以看出实施例1-3的ct值低于实施例4,实施例5-7的ct值低于实施例1,以上结果说明实施例1对核酸的纯化效果优于实施例4,实施例5-7对核酸的纯化效果优于实施例1。这说明利用本发明实施例1-3纳米磁珠对核酸进行分离纯化,结合液中加入硒代赖氨酸改性壳聚糖,洗涤ii液加入甘氨酸乙酯盐酸盐,均能够提高核酸的纯度效果。图5为实施例1-7纯化方法的稳定性,图中ct值为2019-ncovorf1ab基因ct值,可以看出实施例1-3和实施例5-7的ct值在室温和-20℃下无明显差别,这说明实施例1-3和实施例5-7纯化方法具有较好的稳定性,而实施例1纯化方法的稳定性优于实施例4。图6为实施例1-7纯化方法对不同浓度的核酸样本的纯化效果,图6a中ct值为2019-ncovorf1ab基因ct值,图6b中ct值为n基因ct值;其中,高浓度为含104copies/ml新型冠状病毒核酸样品,中浓度为含102copies/ml新型冠状病毒核酸样品,低浓度为含10copies/ml新型冠状病毒核酸样品,可以看出实施例1-3纯化方法对不同浓度新型冠状病毒核酸样品均具有较好的纯化效果,在相同浓度下,实施例1-3的ct值低于实施例4,实施例5-7的ct值低于实施例1,以上结果说明实施例1纯化方法的精密度高优于实施例4,实施例5-7纯化方法的精密度高优于实施例1。这说明利用本发明实施例1-3纳米磁珠对核酸进行分离纯化,结合液中加入硒代赖氨酸改性壳聚糖,洗涤ii液加入甘氨酸乙酯盐酸盐,均能够提高核酸的纯度效果。本发明的操作步骤中的常规操作为本领域技术人员所熟知,在此不进行赘述。以上所述的实施例对本发明的技术方案进行了详细说明,应理解的是以上所述仅为本发明的具体实施例,并不用于限制本发明,凡在本发明的原则范围内所做的任何修改、补充或类似方式替代等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1