用于分辨光信号检测器中不同调制频率的光信号的系统和方法与流程
用于分辨光信号检测器中不同调制频率的光信号的系统和方法发明背景相关专利申请的交叉引用本专利申请根据35U.S.C.§119(e)要求于2011年2月24日提交的美国临时申请No.61/446,280的权益,该临时申请的公开内容据此全文以引用方式并入本文。技术领域本发明涉及用于同时进行多个诊断测定的系统和方法,更具体地讲涉及用于根据产生测量发射信号的对应激发信号的调制频率来分辨不同的测量发射信号的系统和方法。
背景技术:
本文描述或涉及的任何参考文献均不认为是受权利要求书保护的本发明的现有技术。诊断测定广泛用于临床诊断和健康科学研究,以检测或量化生物体或生物样品中生物抗原、细胞或遗传异常、疾病状态和疾病相关病原体或基因突变的存在或含量。如果诊断测定使得能够实现定量化,则专业人员能够更好地计算感染或疾病的程度,并确定疾病随时间推移的状态。诊断测定在很多情况下集中于检测所关注的化学物质、蛋白质或多糖抗原、核酸、生物聚合物、细胞或组织。多种测定可用于检测这些诊断指示物。具体地讲,基于核酸的测定通常包括通向样品中一个或多个靶标核酸序列的检测或量化的多个步骤。靶标核酸序列通常针对蛋白质、细胞、组织、生物体或病毒的可识别群组具有特异性,其中所述群组由至少一个核酸共有序列限定,该序列为群组成员所共有,并且在待测定样品中针对该群组具有特异性。多种基于核酸的检测方法在Kohne的美国专利No.4,851,330和Hogan的美国专利No.5,541,308中有充分描述。靶标核酸序列的检测在很多情况下需要使用具有核苷酸碱基序列的核酸分子,所述核苷酸碱基序列基本上与靶标序列或其扩增子的至少一部分互补。在选择性测定法条件下,探针将以允许专业人员检测样品中是否存在靶标序列的方式杂交到靶标序列或其扩增子。有效探针制备的技术是本领域已知的。然而,通常将有效探针设计为防止与其自身或与将干扰针对是否存在靶标序列的检测的任何核酸分子存在非特异性杂交。探针可包括例如能够检测的标记物,其中标记物例如是放射标记物、荧光团或荧光染料、生物素、酶、化学发光化合物或本领域已知的另一类型的可检测信号。因为探针以允许检测指示在样品中存在靶标序列的信号的方式杂交到靶标序列或其扩增子,所以信号的强度与存在的靶标序列或其扩增子的量成比例。因此,通过在扩增过程期间周期性地测量指示扩增子存在的信号,可检测扩增子随时间推移的增长。根据在该“实时”监测扩增过程期间收集的数据,可确定样品中最初的靶标核酸的量。用于实时检测和用于处理实时数据以确定核酸水平的系统和方法例如在Lair等人的美国专利No.7,932,081“Signalmeasuringsystemforconductingreal-timeamplificationassays”(用于进行实时扩增测定法的信号测量系统)中有所描述,该专利的公开内容据此以引用方式并入。为了在单次测定中检测所关注的不同核酸,可使用被配置为杂交到不同核酸的不同探针,其中每个探针可提供可检测的不同信号。例如,被配置为杂交到不同靶标的不同探针可以用荧光团配制,所述荧光团当暴露于指定激发波长的激发光时以预定的波长发荧光。用于检测不同靶标核酸的测定可通过将样品材料交替地暴露于不同激发波长,并在实时监测过程期间检测与每个靶标核酸的探针相对应的所关注波长的荧光水平而并行完成。并行处理可通过使用被构造和布置为在扩增过程期间周期性地测量信号发射的不同信号检测设备,并且不同信号检测设备被配置为产生不同波长的激发信号且测量不同波长的发射信号来进行。然而,一个荧光团的激发和发射波长偶尔会与另一个荧光团的激发和发射波长重叠。在这种情况下,确保测量信号完全是由于被预期激发信号激发的所关注荧光团的发射所致成为了一种挑战。这种“光学串扰”可采取多种形式。对于被配置为测量来自容纳在毗邻反应容器内的样品的发射的信号检测设备,串扰可能在一个通道检测到来自(相同或不同信号检测器的)另一个通道的激发光时发生,或在一个信号检测设备获得来自容器的由不同信号检测设备激发的发射光时发生。此外,串扰可能在用于特定染料颜色的激发信号激发该信号检测器所不期望的颜色染料时发生。此外,串扰可能在用于特定染料颜色的发射信号激发该信号检测器所不期望的颜色染料时发生。同步检测是减少某些形式的串扰、以及由于例如环境光而产生的光学噪声的方法。同步检测形成窄带宽滤波器,其对发射信号中以激发信号调制频率为中心的窄范围的频率敏感。来自信号检测设备的激发信号在调制频率被解调,并且荧光检测电路被配置为检测所测量的发射信号的频率,并拒绝频率与激发频率不一致的信号部分。这种基于电路的“模拟解调器”例如在Lair等人的美国专利No.7,932,081中有所描述。
技术实现要素:
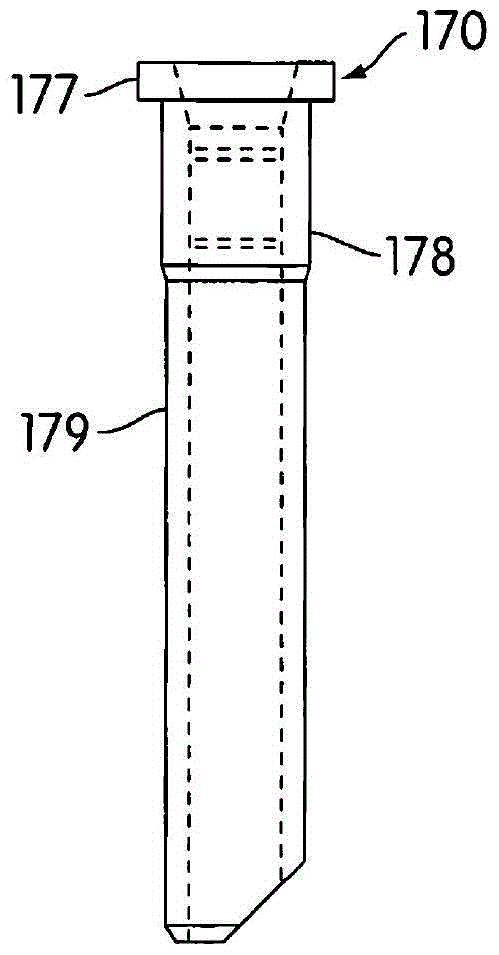
本发明的系统和方法提供了用于进行同步检测的改良程序,以及利用同步检测来限制或避免串扰的改良程序和机制。因此,本发明的方面体现在一种用于检测由两个或更多个容器中每一个的内容物发射的多个不同光信号的方法,每一个不同的光信号指示所关注的不同分析物或其扩增产物的存在。该方法包括在每个容器中形成所关注的分析物的扩增产物,且在形成扩增产物的同时将激发信号导向每个容器。激发信号具有激发发射部分的预定激发波长,所述发射部分发射与激发波长相关的发射信号并具有预定的发射波长,并且每个激发信号具有预定的激发频率。使用信号检测设备检测包括从每个容器发射的发射信号在内的光信号,并由检测到的信号生成检测数据。通过计算机实施的算法使检测数据数字化。预定激发频率的检测数据的幅度由计算机实施的算法根据数字化的数据来确定,从而确定检测到的信号的对应于相关发射信号的部分。对于待检测的多个不同光信号中的每一个,重复导向激发信号、检测光信号、将检测数据数字化以及检测预定激发频率的检测数据的幅度的步骤。针对与一个发射部分的发射信号相关的激发信号的预定激发频率不同于针对容器中至少一个其他发射部分的预定激发频率。本发明的另外方面体现在用于检测多个不同光信号的方法,其中检测光信号包括在多个离散时间中每一个时间处测量光信号的强度,并且其中在每一个离散时间处测得的光信号强度包括在包括该离散时间的时间范围内测得的平均强度。本发明的另外方面体现在用于检测多个不同光信号的方法,其中从容器中每一个检测三个或更多个不同的光信号。本发明的另外方面体现在用于检测多个不同光信号的方法,其中对于两个或更多个、但不是全部的待检测光信号,激发频率是相同的。本发明的另外方面体现在用于检测多个不同光信号的方法,其中发射信号为荧光发射。本发明的另外方面体现在用于检测多个不同光信号的方法,其中发射部分包括荧光染料,并且每个不同的光信号由容纳在容器中的不同荧光染料产生。本发明的另外方面体现在用于检测多个不同光信号的方法,其中至少一个光信号包括第一、第二和第三光信号。第一光信号具有第一范围的光波长,第二光信号具有第二范围的光波长,并且第三光信号具有第三范围的光波长。第一和第二范围光波长的光谱至少部分地彼此重叠,第二和第三范围光波长的光谱至少部分地彼此重叠,但第一和第三范围光波长的光谱彼此不重叠。与第一和第三光信号相关的激发信号的激发频率是相同的,并且与第二光信号相关的激发信号的激发频率不同于与第一和第三光信号相关的激发信号的激发频率。本发明的另外方面体现在用于检测多个不同光信号的方法,其中两个或更多个容器以线性的并列布置方式排列,其中相邻容器的预定激发频率是不同的。在一些实施例中,交替容器的预定激发频率是相同的。本发明的另外方面体现在用于检测多个不同光信号的方法,其中检测预定激发频率的检测数据的幅度包括执行戈泽尔信号处理技术。本发明的另外方面体现在用于检测多个不同光信号的方法,其还包括执行用于根据与检测信号的对应于相关发射信号的部分相关联的数据确定存在于每个容器中的分析物的量的计算机实施算法的步骤。本发明的另外方面体现在用于检测多个不同光信号的方法,其中检测数据以至少为相关激发信号的激发频率的两倍的频率被数字化。本发明的另外方面体现在用于检测多个不同光信号的方法,其中激发频率在200Hz–350Hz的范围内,并且数字化频率为约4kHz。本发明的另外方面体现在用于检测多个不同光信号的方法,其中激发频率在100Hz–1kHz的范围内,并且数字化频率在2kHz–8kHz的范围内。本发明的另外方面体现在用于检测多个不同光信号的方法,其中激发频率在10Hz–5kHz的范围内,并且数字化频率在1kHz–1GHz的范围内。本发明的另外方面体现在用于检测多个不同光信号的方法,其还包括形成对照分析物的扩增产物的步骤,以及对于对照分析物执行导向激发信号、检测光信号、将检测数据数字化以及检测预定激发频率的检测数据的幅度的步骤。本发明的另外方面体现在用于检测多个不同光信号的方法,其中对照分析物包括与所关注的分析物无关的已知分析物。本发明的另外方面体现在用于检测多个不同光信号的方法,其还包括将对于对照分析物具有特异性的对照探针加入每个容器,其中对照探针包括发出发射信号的发射部分,所述发射信号的发射波长不同于所关注分析物的发射部分的发射波长。本发明的另外方面体现在用于检测多个不同光信号的方法,其还包括执行用于根据与检测到的信号的对应于相关发射信号的部分相关联的数据确定对照分析物的量的计算机实施算法。本发明的另外方面体现在用于检测多个不同光信号的方法,其还包括使容器的内容物交替地暴露于不同激发波长的光能,以及检测是否存在具有对照探针发射部分的发射波长的信号,作为扩增产物成功形成的指示。本发明的另外方面体现在用于检测多个不同光信号的方法,其中每个容器以能脱开的方式固定在并列结构中。本发明的方面还体现在一种用于检测由容器发射的光信号的系统。该系统包括激发设备和信号检测设备。激发设备被构造和布置为产生激发信号。激发信号具有预定的激发波长和预定的激发频率,并且激发发射部分,所述发射部分发射与激发波长相关的发射信号并具有预定的发射波长。激发设备还被构造和布置为使激发信号导向到容器。信号检测设备被构造和布置为检测光信号(包括从容器发射的发射信号),并将与检测到的信号相关的检测数据存储在计算机可读介质上。该系统还包括用于执行将所存储的检测数据数字化的算法的处理器,以及用于执行根据数字化的检测数据确定预定激发频率的发射信号的幅度从而确定检测信号的对应于相关发射信号的部分的算法的处理器。本发明的另外方面体现在用于检测从容器发射的光信号的系统,其还包括用于执行基于与检测到的信号的对应于相关发射信号的部分相关的数据确定存在于容器中的分析物的量的算法的处理器。本发明的另外方面体现在用于检测从容器发射的光信号的系统,其还包括相对于彼此处于固定位置的多个激发设备和相对于彼此处于固定位置的多个信号检测设备。每个激发设备被构造和布置为(a)产生具有预定激发波长和预定激发频率的激发信号,该激发信号激发发射部分,该发射部分发射具有预定发射波长的相关发射信号,以及(b)将激发信号导向到不同容器。每个信号检测设备被构造和布置为检测从容器发射的发射信号,并将与检测到的信号相关的检测数据存储在计算机可读介质上。每个激发设备对应于相关检测设备,使得每个相关激发和检测设备产生的激发信号和检测到的发射信号被导向相关的容器并从相关容器发射。处理器被配置为将所存储的与每个信号检测设备相关的检测数据数字化,并且处理器被配置为根据与每个信号检测设备相关的数字化检测数据确定相关预定激发频率的发射信号的幅度,以及确定相关检测信号的对应于相关发射信号的部分。本发明的另外方面体现在用于检测从容器发射的光信号的系统,其中不同的相关容器包括多个以线性的并列布置方式排列的容器,并且其中相邻容器的相关预定激发频率是不同的。本发明的另外方面体现在用于检测从容器发射的光信号的系统,其中交替容器的相关预定激发频率是相同的。本发明的另外方面体现在用于检测从容器发射的光信号的系统,其还包括被构造和布置为相对于多个激发和检测设备移动不同的相关容器的容器移动装置。本发明的另外方面体现在用于检测从容器发射的光信号的系统,其包括两组或更多组的多个激发和相关检测设备,其中每组与系统中的每个其他组在空间上彼此不同。本发明的另外方面体现在用于检测从容器发射的光信号的系统,其包括三至六组多个激发和相关检测设备。本发明的另外方面体现在用于检测从容器发射的光信号的系统,其中每组多个激发和相关检测设备围绕中心轴径向排列。本发明的另外方面体现在用于检测从容器发射的光信号的系统,其中每个容器以能脱开的方式固定在并列排列中。本发明的方面还体现为一种用于在存在来源于相同容器或不同容器的多个不同光信号的情况下检测从容器的内容物发射的光信号的方法。该方法包括在容器中形成所关注的分析物的扩增产物,且在形成扩增产物的同时将激发信号导向到容器。激发信号具有激发发射部分的预定激发波长,所述发射部分发射与激发波长相关的发射信号,并且具有预定的发射波长,并且激发信号具有预定的激发频率。使用信号检测设备检测光信号(包括从容器发射的发射信号),并由检测到的信号产生检测数据。使用计算机实施的算法使检测数据数字化。预定激发频率的检测数据的幅度由计算机实施的算法根据数字化的检测数据来确定,从而确定检测到信号的对应于相关发射信号的部分。本发明的另外方面体现在用于检测从容器的内容物发射的光信号的方法,其还包括检测从容器的内容物发射的第二光信号。在形成扩增产物时,将第二激发信号导向容器,所述第二激发信号具有激发发射部分的第二预定激发波长,该发射部分发射与第二激发波长相关并具有预定的第二发射波长的第二发射信号,其中第二激发信号具有预定的第二激发频率。使用相同或不同的信号检测设备检测包括从容器发射的发射信号在内的光信号,并由检测到的信号产生第二检测数据。通过计算机实施的算法使第二检测数据数字化。预定第二激发频率的第二检测数据的幅度由计算机实施的算法根据数字化的第二检测数据确定,从而确定检测到的信号的对应于相关第二发射信号的部分。本发明的另外方面体现在用于检测从容器的内容物发射的光信号的方法,其中激发频率对于至少两个待检测的光信号是不同的。本发明的另外方面体现在用于检测从容器的内容物发射的光信号的方法,其中发射信号为荧光发射。本发明的另外方面体现在用于检测从容器的内容物发射的光信号的方法,其中发射部分包含荧光染料。本发明的另外方面体现在用于检测从容器的内容物发射的光信号的方法,其中从容器检测第一、第二和第三光信号。第一光信号具有第一范围的光波长,第二光信号具有第二范围的光波长,并且第三光信号具有第三范围的光波长。第一和第二范围光波长的光谱至少部分地彼此重叠,第二和第三范围光波长的光谱至少部分地彼此重叠,但第一和第三范围光波长的光谱彼此不重叠。与第一和第三光信号相关的激发信号的激发频率是相同的,并且与第二光信号相关的激发信号的激发频率不同于与第一和第三光信号相关的激发信号的激发频率。本发明的另外方面体现在用于检测从容器的内容物发射的光信号的方法,其中确定预定频率的检测数据的幅度包括执行戈泽尔信号处理技术。本发明的另外方面体现在用于检测从容器的内容物发射的光信号的方法,其还包括执行计算机实施的算法,用于根据与检测到的信号的对应于相关发射信号的部分相关联的数据确定存在于容器中的分析物的量。本发明的另外方面体现在用于检测从容器的内容物发射的光信号的方法,其中检测数据以至少为相关激发信号的激发频率两倍的频率被数字化。本发明的另外方面体现在用于检测从容器的内容物发射的光信号的方法,其中激发频率在200Hz–350Hz的范围内,并且数字化频率为约4kHz。本发明的另外方面体现在用于检测从容器的内容物发射的光信号的方法,其中激发频率在100Hz–1kHz的范围内,并且数字化频率在2kHz–8kHz的范围内。本发明的另外方面体现在用于检测从容器的内容物发射的光信号的方法,其中激发频率在10Hz–5kHz的范围内,并且数字化频率在1kHz–1GHz的范围内。本发明的这些和其他特征、方面和优点在考虑到以下详细说明、所附权利要求书和附图后对本领域的技术人员将显而易见。附图说明图1是一种反应容器的透视图,该反应容器为结合实现本发明方面的装置使用的多容器设备单元的形式。图2是结合用于执行磁分离过程的器械使用并且在图1中示出的多容器设备上运行的接触限制移液管尖头的侧正视图。图3是从图1中箭头“60”的方向观察的多容器设备的一部分的放大仰视图。图4是温箱的分解透视图,其被配置为保持多个容器,同时使反应容器经受指定温度条件,并且包括用于在温育过程期间检测反应容器的内容物发射的信号的信号检测器。图5是温箱的容器载体圆盘传送带的仰视平面图。图6是温箱的容器载体圆盘传送带的装配组件和用于在温箱中生成气流的循环风扇的透视图。图7是温箱壳体的底壁、容器载体的一部分和容器载体传动组件的透视图。图8是容器载体的容器分隔器的透视图。图9是从分隔器的相对侧查看的容器分隔器透视图。图10是温箱的容器载体组件的局部透视图,这些组件包括用于检测容器载体上反应容器存在与否的容器存在性传感器。图11是温箱和适于将反应容器置于温箱中及将反应容器从温箱移除的容器传送机构的局部透视图。图12是温箱的一部分的局部透视图,其包括温箱底部、设置在温箱底部之下的信号检测器,以及相对于信号检测器设置于信号检测位置的反应容器。图13是结合本发明使用的信号检测器的透视图。图14是信号检测器的仰视平面图。图15是沿图14中直线15-15截取的信号检测器的侧面剖视图。图16是信号检测器的分解透视图。图17是显示出优选的扩增检测染料的激发光谱的曲线图。图18是显示出优选的扩增检测染料的发射光谱的曲线图。图19是显示出根据本发明方面的一种优选实时扩增测定法的方案的流程图。图20是显示出分析物定量过程的流程图。图21是实时荧光计数据的时间曲线图;图22是显示出将曲线拟合至实时荧光计数据及使用拟合来确定阈值时间的方法的图线。图23是示出用于执行来自反应容器的内容物的发射信号的相位同步检测的算法的流程图,以检测源于正确激发信号的发射信号的频率分量。图24是示意性地示出激发和检测架构的框图。图25是示意性地示出实现本发明方面的检测电路的布置方式的框图。图26A和26B是电路图的两个部分,示出了实现本发明方面的荧光计检测电路。图27是示意性地示出实现本发明方面的激发电路的布置方式的框图。图28是示出实现本发明方面的荧光计激发电路的电路图。图29是显示出反应容器的移动、来自反应容器的发射信号的测量以及处理从反应容器测量的信号的计划示意图。图30示出了在检测不同荧光染料的光信号检测器中使用的激发和发射滤波器的带宽。图31是显示出FAM、HEX和ROX染料的激发和发射荧光光谱的曲线图。具体实施方式多容器设备参见图1,多容器设备(“MRD”)160形式的反应容器包括多个单独的容器管或反应管162,优选地为五个。容器管162优选地为具有开放顶端和封闭底端的圆柱形管的形式,容器管162通过连接肋结构164彼此连接,所述连接肋结构限定了面向下的肩部,所述肩部沿着MRD160的任一侧纵向延伸。MRD160优选地由注模聚丙烯,例如特拉华州威尔明顿的蒙特尔聚烯烃公司(MontellPolyolefins(Wilmington,Delaware))(产品编号PD701NW)或亨斯迈公司(Huntsman)(产品编号P5M6K-048)销售的那些注模聚丙烯形成。在一种可供选择的实施例中,MRD的容器管162通过诸如例如样品管架这样的装置相对于彼此以能脱开的方式固定。弓形罩结构169设置在MRD160的一端。MRD操纵结构166从罩结构169延伸出。操纵结构适于与传送机构接合,以便在诊断分析仪的不同组件之间移动MRD160。与MRD160相配的一种示例性传送机构在美国专利No.6,335,166中有所描述,该专利的公开内容据此以引用方式并入。MRD操纵结构166包括从罩结构169延伸的侧向延伸板168,其中板168的相对末端上具有垂直延伸件167。角撑板壁165在罩结构169和垂直件167之间从侧向板168向下延伸。如图3中所示,罩结构169和垂直件167具有互相面向的凸表面。可通过使接合构件侧向(方向“A”)移动到罩结构169和垂直件167之间的空间,而使MRD160与传送机构和其他组件接合。罩结构169和垂直件167的凸表面为进行侧向相对运动进入该空间的接合构件提供了更宽的进入点。具有平坦标签容纳表面175的标签容纳结构174设置在与罩结构169和MRD操纵结构166相对的MRD160末端上。人和/或机器可读标签(例如可扫描条形码)可置于表面175上,以在MRD160上提供识别和指示信息。MRD160优选地包括与每个相应容器管162开口相邻的尖头固定结构176。每个尖头固定结构176提供圆柱形孔,其中容纳适于被置于抽吸管末端上的导管,例如接触限制尖头170。尖头170的示例性构造和功能如下所述。每个保持结构176被构造和布置成以如下方式摩擦地容纳尖头170:当MRD160倒置时,防止尖头170脱出保持结构176,但当与移液管接合时,允许尖头170从保持结构176移除。参见图2,尖头170包括大致圆柱形结构,该结构具有周边轮缘177和直径大致大于尖头170下部179的上卡圈178。尖头170优选地由导电聚丙烯形成。当尖头170插入保持结构176的孔中时,法兰177接触结构176的顶部,并且卡圈178提供尖头170和保持结构176之间贴合但能脱开的过盈配合。或者,每个保持结构176可被配置为松散地容纳尖头170,使得当与移液管接合时,尖头更容易地从保持结构移除。有关MRD160的更多详情可见于美国专利No.6,086,827,该专利的公开内容据此以引用方式并入。虽然MRD160的特定配置已有所示例,但本领域的技术人员将认识到,可根据本发明使用单或多容器设备的多种配置。样本制备程序在一示例性实施例中,通过将一定量的靶标捕获试剂,优选为磁珠寡核苷酸纯化(mag-oligo)试剂,例如由自动机械移液装置分配到MRD160的每个容器管162中,来制备用于磁分离过程的样品。靶标捕获试剂包括能够结合到靶标分析物并使之固定的载体材料。载体材料优选地包括磁响应粒子。分配到每个容器管162中的量通常为100-500μl。接下来,将一定量的样品材料分配到包含靶标捕获试剂的MRD160的每个容器管162中。可将不同样品分配到五个容器管162的每个中,或者可将相同样品分配到两个或更多个容器管162中。磁分离过程包括如下步骤:将容器管的内容物暴露于磁场以将磁响应粒子吸引到容器管一侧并离开悬浮液,取出容器管的液体内容物(例如通过真空抽吸)同时保持磁响应粒子在悬浮液之外,移除磁场,以及将洗涤溶液添加到容器管中以重悬磁响应粒子。这些步骤可以重复一或多次。合适的磁分离洗涤过程在Lair等人的美国专利No.8,008,066中有所描述,该专利的公开内容据此以引用方式并入。实时扩增测定实时扩增测定可用于确定样品中靶标核酸(举例来说,来源于病原生物体或病毒)的存在和量。通过确定样品中靶标核酸的数量,从业人员可估算样品中生物体或病毒的量或载量。在一个应用中,实时扩增测定可用于筛选预期用于输血的血液或血液制品的血源性病原体,例如丙型肝炎病毒(HCV)和人类免疫缺陷病毒(HIV)。在另一个应用中,实时测定可用于监测治疗方案在受病原生物体或病毒感染的患者或者患有以异常或突变基因表达为特征的疾病或疑似患有此类疾病的患者中的功效。实时扩增测定还可用于诊断目的以及用于基因表达测定。在以上讨论的本发明的一优选应用中,通过使用探针来确定所关注的生物体、病毒或基因的存在性,所述探针在特定使用条件下在样品中表现出对来源于所关注的生物体、病毒或基因的靶标核酸序列(即,包含于来自所关注的生物体、病毒或基因的靶标核酸或者其扩增产物之内)具有特异性。为了表现出特异性,探针通常具有与靶标或其互补序列的至少一部分基本上互补的核苷酸碱基序列,使得在选择性测定条件下,探针会可检测地杂交到靶标序列或其互补序列上,但不会杂交到可存在于样品中的任何非靶标核酸上。本发明的方面涉及用于执行有别于“终点”扩增测定的“实时”扩增测定的系统和方法。在“终点”扩增测定中,在扩增程序结束时确定含有靶标序列或其互补序列的扩增产物的存在性。该测定可在检测工位进行,检测工位可位于发生扩增反应的温箱外部。相比之下,在“实时”扩增测定中,在扩增程序过程中测定含有靶标序列或其互补序列的扩增产物的量。在实时扩增测定中,可采用如下方法测定靶标核酸的浓度:通过定期测量信号(其为样品中含有靶标序列或其互补序列的扩增产物的量的函数)获得数据,并根据所获得的数据计算靶标序列被扩增的比率。对于实时扩增测定,探针优选地为单分子自杂交探针,其具有一对相互作用的标签,它们相互作用后会发射不同的信号,具体取决于探针是处于自杂交状态还是杂交到靶序列或其互补序列。参见例如Diamond等人的名称为“DisplacementPolynucleotideAssayMethodandPolynucleotideComplexReagentTherefor”(置换多核苷酸测定方法及其用到的多核苷酸复合试剂)的美国专利No.4,766,062;Tyagi等人的名称为“DetectablyLabeledDualConformationOligonucleotideProbes,AssaysandKits”(带有可检测标签的双重构象寡核苷酸探针、测定法和试剂盒)的美国专利No.5,925,517;Tyagi等人的名称为“NucleicAcidDetectionProbesHavingNon-FRETFluorescenceQuenchingandKitsandAssaysIncludingSuchProbes”(具有非FRET荧光淬灭的核酸检测探针以及包括此类探针的试剂盒和测定法)的美国专利No.6,150,097;以及Becker等人的名称为“MolecularTorches”(分子炬)的美国专利No.6,361,945。可设想用于本发明的其他探针,包括互补的双分子探针、用插入染料标记的探针,插入染料的使用是为了辨别单链和双链核酸。参见例如Morrison的名称为“CompetitiveHomogenousAssay”(竞争性均相测定法)的美国专利No.5,928,862;Higuchi的名称为“HomogenousMethodsforNucleicAcidAmplificationandDetection”(核酸扩增和检测的均相方法)的美国专利No.5,994,056;以及Yokoyama等人的名称为“MethodforAssayingNucleicAcid”(测定核酸的方法)的美国专利No.6,541,205。相互作用的标签的例子包括酶/底物、酶/辅因子、发光/淬灭剂、发光/加合物、染料二聚体和福斯特能量转移对。用于将相互作用的标签连接到探针以实现最佳信号区分的方法和材料在以上引用的参考文献中有所描述。在一优选的实时扩增测定中,相互作用的标签包括荧光部分或其他发射部分和淬灭剂部分,例如4-(4-二甲基氨基苯基偶氮)苯甲酸(DABCYL)。荧光部分在受到适当激发波长的光能激发时发射特定发射波长的光能(即,发荧光)。当荧光部分和淬灭剂部分保持在十分接近的位置时,荧光部分发射的光能被淬灭剂部分吸收。但是当探针杂交到存在于样品中的核酸时,荧光和淬灭剂部分彼此分离,并且荧光部分发射的光能可以被检测到。可将以不同且可分辨的波长激发和发射的荧光部分与不同探针组合。可将不同探针添加到样品中,并且可通过将样品交替地暴露于不同激发波长的光能,并在与不同荧光部分相对应的不同波长测定样品的光发射,来测定与每个探针相关联的靶标核酸的存在性和量。在多重实时扩增测定的一个例子中,可在开始扩增反应之前将以下物质添加到样品中:第一探针,其5′和3′端连接有淬灭剂部分和第一荧光染料(具有激发波长λex1和发射波长λem1)并且第一探针对来源于HCV的核酸序列具有特异性;第二探针,其5′和3′端连接有淬灭剂部分和第二荧光染料(具有激发波长λex2和发射波长λem2)并且第二探针对来源于HIV1型(HIV-1)的核酸序列具有特异性;以及第三探针,其5′和3′端连接有淬灭剂部分和第三荧光染料(具有激发波长λex3和发射波长λem3)并且第三探针对来源于西尼罗河病毒(WNV)的核酸序列具有特异性。在将样品中的探针与扩增试剂混合后,可将样品周期性且交替地暴露于波长λex1、λex2和λex3的激发光,然后针对波长λem1、λem2和λem3的发射光进行测量,从而检测这单个样品中所有三种病毒的存在(或不存在)和量。扩增试剂的组分将取决于要进行的测定,但通常将包含合适缓冲液中的至少一种扩增寡核苷酸(例如引物、启动子-引物和/或启动子寡核苷酸)、三磷酸核苷和辅因子(例如镁离子)。当扩增过程用于在可进行检测之前增加存在于样品中的靶标序列或其互补序列的量时,通常期望包括“对照”以确保扩增已经发生,从而避免假阴性。此类对照可为与所关注的序列不相关的已知核酸序列、或另一序列。将对于对照序列具有特异性并且具有独特荧光染料(即,对照染料)和淬灭剂组合的探针(即,对照探针),连同扩增对照序列所需的一种或多种扩增试剂以及靶标序列一起添加到样品中。在将样品暴露于适当扩增条件下后,将样品交替地暴露于不同激发波长(包括对照染料的激发波长)的光能,并检测发射光。检测到与对照染料相对应的波长的发射光就证实已经成功进行了扩增(即,的确扩增了对照序列),因此检测与靶标序列的探针相对应的发射光的任何失败不可能归因于扩增失败。反之,检测对照染料的发射光失败可能表明扩增失败,因此使该测定得出的任何结果均不可信。用于进行实时扩增测定的系统和方法在Lair等人的名称为“Systemforperformingmulti-formattedassays”(用于进行多种格式测定法的系统)的美国专利No.8,008,066中有所描述,该专利的公开内容据此以引用方式并入。根据本发明的方面,实时扩增测定在温箱,例如温箱200中进行,所述温箱的结构在图4-12中示出。温箱200是以下意义上的旋转温箱:MRD160承载于具有受控温度内部的壳体内的旋转载体结构(如,圆盘传送带)上。温箱200包括连接到其上的信号检测器或信号检测器模块400以便以实时方式检测温箱中承载的MRD160的反应管162内进行的扩增,例如通过在用与每种染料相对应的激发光照射MRD160时测定MRD160的每个反应管162内的一种或多种染料发射的荧光来进行检测。温箱200可被集成到自动化诊断分析仪(未示出)中,自动化诊断分析仪可包括用于将MRD160放置到温箱200中及将MRD160从温箱200移除的一个或多个容器传送机构。适合与本发明结合使用的温育工位或温箱200的结构在图4-12中示出。图4示出了温箱200的分解透视图。温箱200包括具有外壁202、底壁206和顶壁(未示出)(它们均由隔热护罩或罩212覆盖)的壳体。侧壁、底壁和顶壁优选由铝形成,并且隔热罩优选由合适的隔热材料,例如聚氨酯泡沫制成。容器载体242优选为可旋转地安装在壳体内的圆盘传送带的形式,并且容器载体242被配置为承载多个反应容器。容器例如MRD160可通过形成在侧壁202中的容器开口204插入到容器载体242中以及从容器载体242移除。容器开口204被门组件214的滑动门216覆盖(将在下文更详细描述)。一个或多个信号检测器400设置在温箱壳体的底壁206下方并且被配置为检测温箱200内容器载体242上承载的反应MRD160的内容物所发射的信号。信号检测器400将在下文更详细描述。热量可以任何合适方式在温箱200内生成。在一个实施例中,电阻加热元件设置在温箱壳体的侧壁202上。其他合适的加热元件可包括例如珀尔帖热电加热元件。加热元件可受微处理器控制以保持恒定的所需温度,并且温箱200还可包括一个或多个温度感测元件以将温度水平信号提供给微处理器控制器。循环风扇226可设置在温箱壳体内,例如容器载体242顶部。在一个实施例中,风扇226为轴流风扇,如图所示,其被配置为产生穿过容器载体242且在温箱200内的气流。有关容器载体242构造的更多细节在图5和6中示出。图5为其上承载多个MRD160的容器载体242的仰视平面图。图6为容器载体242一部分的透视图,图中示出了安装在载体242顶部的风扇226。载体242包括上部圆盘244和相同的下部圆盘256。如图5和6所示,下部圆盘包括内环258、外环260以及以同心方式设置在内环258与外环260之间的中间环262。内部径向辐条266在内环248与中间环262之间延伸。外部辐条264在中间环262与外环260之间延伸,并且在该实施例中被配置为相对于关于中间环262和外环260中心的实际径向取向倾斜。上部圆盘244具有类似构造,但图6中仅外环248和外部辐条252可见。上部圆盘244还包括内环、中间环和内部辐条,它们在图6中均被风扇226遮挡视线。上部圆盘244和下部圆盘256通过设置在围绕上部圆盘244和下部圆盘256周长的角间隔处的多个间隔柱268,相对于彼此以平行相间隔的取向固定。可通过合适的紧固件(例如螺钉)延伸穿过上部圆盘244或下部圆盘256中的孔进入每个间隔柱268的每端中形成的开口(例如螺纹开口),将每个间隔柱268固定到位。容器载体242还包括多个容器分隔器274,其在下部圆盘256的每个外部辐条264与上部圆盘244的对应外部辐条252之间延伸。相邻设置的容器分隔器274之间的空间限定容器工位240,每个容器工位被配置为容纳单个反应MRD160。如图5所示,该图为温箱的容器载体圆盘传送带的仰视平面图,每个MRD160以大致垂直的取向被承载,其中每个容器管162的下端设置在容器载体242的底部并且每个MRD160的容器操纵结构166径向延伸超过容器载体242的外周边。容器分隔器的细节在图7-9中示出。如所指出的,每个容器分隔器274附接到下部圆盘256的外部辐条264之一,如图7中所示。容器分隔器274包括当分隔器274被安装在上部圆盘244与下部圆盘256之间时大致垂直取向的分隔壁276。分隔壁276包括下部定位柱278和上部定位柱280,所述下部定位柱被配置为被插入到下部圆盘256中形成的配合开口(未示出)中,并且所述上部定位柱被配置为被插入到上部圆盘244中形成的配合开口(未示出)中。磁体282可沿着分隔壁276的下端被安装。磁体282从分隔壁276的一个边缘延伸到相对的边缘。温箱200中承载的反应容器可在其中包含磁响应粒子以进行磁分离过程,从而隔离所关注的分析物,反应容器的内容物内存在此类粒子可能使信号检测器400要检测的内容物发射的任何信号变模糊。因此,安装到分隔壁276上的磁体282使磁粒子的至少一部分聚集到容器管162的一侧,从而从悬浮液移除这些粒子,这些粒子在悬浮液中可使信号变模糊。更具体地讲,用于在本发明一实施例中靶标捕获的磁粒子可影响扩增产物的实时检测。已鉴定出两个特定的干扰效应。首先,磁粒子可通过吸附寡核苷酸(如,扩增寡核苷酸和探针)和酶试剂(如,核酸聚合酶)而抑制扩增。此外,存在磁粒子(沉淀的或悬浮液中的)可导致荧光耗损,从而阻挡或部分阻挡到达检测染料的激发光的量和从MRD160的反应管162发射的光的量。这称为黑云效应(blackcloudeffect)。因此,为了最大程度减小该效应,温箱200的分隔器274包括如图8所示的磁体282。每个分隔器274包括将覆盖容器管162的开放上端的容器封盖法兰284以及防止反应MRD160被插入到容器工位240中超过期望位置的容器阻挡壁286。每个分隔器274还包括位于其一侧上的容器悬挂器法兰288和容器导向翼292,并且分隔壁276的相对侧包括容器支承凸缘290。容器悬挂器法兰288的斜角形状限定一个分隔器274的悬挂器法兰288的边缘与相邻分隔器274的容器支承凸缘290之间的恒定间距,以便在MRD160被插入到容器工位240中时提供用于支承MRD160的连接肋结构164的平行边缘。分隔器274还包括容器压紧弹簧294,其被配置为具有自由端296的弹性悬臂式突起,其中自由端296略微弯曲以在MRD160被插入到容器工位240中时使容器管162适形于径向最内端。压紧弹簧294借助其自身弹性以能脱开的方式将MRD160固定在容器工位240中。每个分隔器274还包括位于分隔壁276下缘的传动带支承元件298。每个传动带支承件298可包括凸肋299。在本发明的一优选实施例中,温箱200一次保持18个MRD160,每个绕圆盘传送带以20°的增量间隔开。容器载体242的传动组件300包括导向轮304和306、传动带308、以及安装在温箱壳体的底壁206的马达安装部分208上的马达302。传动带308固定在马达302的传动轴(未示出)周围、导向轮304和306周围、并且还在安装在上部圆盘244与下部圆盘256之间的多个分隔器274的带传动支承件298之上。如所指出的,每个传动带支承件298可包括垂直肋299,用于接合传动带308的齿状物(未示出)。如图7所示,该图示出了温箱壳体的底壁、容器载体的一部分和容器载体传动组件的透视图,温箱壳体的底壁206包括多个细长开口210,其优选地关于与容器载体242的旋转轴相对应的点以相等角间隔形成。开口210以每个MRD160在承载于容器载体242上时将取向的相同角度取向,并且每个开口210被配置为容纳信号检测器400的上端,该信号检测器延伸进入温箱200以在温育过程中检测MRD160的内容物发射的信号。马达302优选地为受微处理器控制的步进马达。“原位”位置传感器(未示出)指示容器载体242何时处于指定旋转位置,并且马达302设有编码器。因此,容器载体242的移动可以被控制,例如通过微处理器从连接到马达302的编码器和原位传感器接收信号来控制和监测载体242的角运动和定位,以将容器载体242上的每个MRD160顺序放置到开口210上方的信号检测位置。如图10所示,该图示出了温箱的容器载体的组件的局部透视图,容器载体242还包括在下部圆盘256的内环258与上部圆盘244(未在图10中示出)的内环之间延伸的中心柱270。容器存在性传感器272安装在中心柱270上并且被配置为检测插入到容器载体242的容器工位240中的MRD160的存在。控制和监测容器载体242的角位置的微处理器控制也监测每个特定MRD(160)的位置,MRD(160)可用例如标签(诸如机器可读条形码或RFID标签)进行标识。也就是说,当通过其标签或其他方式标识的MRD160被移动到温箱200中时,对该MRD160被插入到的容器工位240的角位置进行测定和跟踪,以在MRD位于温箱200内时始终监测MRD160的位置。在一个实施例中,中心柱270和容器存在性传感器272相对于容器载体242固定。可通过在容器存在性传感器272前方旋转容器工位240,来确定容器载体242的任何容器工位240中是否存在MRD。门组件214的细节在图4和11中示出。门组件214包括门216,其可滑动地设置在相对于与容器开口204相邻的侧壁202的一部分固定的框架224中。在图11中,省略了开口204上方的框架224和侧壁202的一部分,以便不遮挡MRD160的视线。如所指出的那样,门216可滑动地设置在框架224内并且可包括沿着其顶部和/或底部边缘的槽或脊,所述槽或脊接合沿着门216被设置在其中的框架224的开口的边缘的脊或槽。大致水平的导向杆222跨越框架224中形成的开口并延伸穿过门216的下部。可以提供弹簧机构(未示出)例如卷簧,以便将门216偏置到相对于开口204的关闭位置中。可以包括传感器(未示出)例如光学传感器,以便将信号提供给器械控制器,从而指示门为关闭和/或打开位置。图11还示出了容器传送机构320的一部分,其具有被配置为接合MRD160的操纵结构166的操纵钩322。容器传送机构320包括壳体324,容器传送机构320在壳体324内将MRD160承载到和自温箱200和/或包括温箱200的器械的任何其他工位。合适的容器传送机构的细节在如下文献中更详细描述:Ammann等人的名称为“AutomatedProcessForIsolatingandAmplifyingaTargetNucleicAcidSequence”(分离和扩增靶标核酸序列的自动化方法)的美国专利No.6,335,166或Hoerger等人的名称为“MethodandApparatusforEffectingTransferofReactionReceptaclesinanInstrumentforMulti-StepAnalyticalProcedures”(适用于多步骤分析程序的实现器械中反应容器的传送的方法和装置)的国际专利公布No.WO2010/132885,这些文献的内容据此以引用方式并入。门组件214包括从滑动门216延伸的致动柱220,并且容器传送机构320的接触元件(未示出)接合致动柱220以将滑动门216推至打开位置,使得操纵钩322可延伸穿过容器开口204而将MRD160插入到容器载体242中或从容器载体242取回MRD160。信号检测器400为实时测量例如未淬灭荧光染料分子的浓度的系统的一部分。在每个MRD160的每个容器管162内进行的测定可以优选地设计为使得随着靶标浓度经扩增增加,荧光信号增强。信号检测器400用于通过监测荧光信号的出现来监测扩增过程。温箱200的一示例性实施例可包括三和六个之间的信号检测器400,其中每个检测器被设计为测量特定荧光染料(即,颜色)。每个信号检测器400内置例如五个单独检测器,其可包括荧光计。五个单独荧光计(本文也称为“通道”)的间距与每个MRD160的容器管162的间距相同。信号检测器400可设置有额外的或更少的单独检测器,但是检测器的数量通常对应于每个MTU160中容器管的数量。信号检测器400以一定取向被安装到扩增温箱200,使得当容器载体242以与信号检测器400的角位置相对应的预设角增量停止时,它们中每一个可检测MRD160的每个容器管162发射的信号。因此,载体242每旋转一次,每个MRD160可被每个信号检测器400扫描一次。如图12所示,该图为温箱的一部分的局部透视图,在一个实施例中,六个信号检测器400被构造和布置为检测温箱200的壳体内承载的六个不同MRD160的五个容器管162中每一个的内容物发射的信号。也就是说,每个信号检测器400被配置为检测MRD160的五个容器管162中每一个发射的信号,MRD160通过载体242可操作地相对于信号检测器400定位。信号检测器400可具有大致相同的构造,但是每个可适于检测以不同的可测量或可检测值为特征的信号。例如,每个信号检测器400可被配置为检测不同波长的荧光,从而每个均可以被配置或调整为检测容器管162的内容物内的不同荧光染料。每个信号检测器400还可被配置为发射预定波长或一定波长范围内的光。很多情况下,信号检测器400发射的光的波长对应于容器管162的内容物内荧光染料的激发波长窗口。驱动容器载体242的马达302受微处理器控制,微处理器可从连接到载体242的原位传感器、定时器和连接到马达302的编码器接收信号,以便控制载体242的移动和角定位。载体242被控制以(a)将MRD160移动到相对于信号检测器400的操作性感测位置,(b)停顿足够长时间,从而允许信号检测器从相对于其可操作地定位的MRD读取和处理信号读数,以及(c)对载体242进行分度以将下一个MRD160定位到相对于信号检测器400的操作性位置。附接到温箱200的用于实时荧光检测的信号检测器400被称为光学检测模块(一种类型的信号检测器或信号测量设备),如即将描述的。结合本发明使用的信号检测器400的细节在图13-16中示出。如图13所示,该图为信号检测器的透视图,检测器400包括壳体,所述壳体包括检测器壳体418和激发壳体402,这两者相对于彼此成直角连接到透镜和滤波器或光学器件壳体434。界面盖456附接到光学器件壳体438。壳体组件402、418和434中的每一个可由加工的铝制成并且通过合适的紧固件(例如螺钉)彼此固定,并且优选经过阳极化处理。界面盖456优选由非导热材料例如加工而成,以便使温箱200与检测器400之间的热传导最小化。激发印刷电路板(“PCB”)406连接到激发壳体402的末端,并且检测器PCB422连接到检测器壳体418的末端。分别设置在激发PCB406和检测器PCB422上的激发和检测器电路在以下描述。柔性电缆454将激发PCB406与检测器PCB422连接。界面盖456包括围绕盖456周边的轮缘460和轮缘460上突出的穹顶部分458。如例如图12所示,界面盖456的穹顶458延伸进入温箱200的底壁206中形成的检测器开口210,并且轮缘460邻接围绕检测器开口210的底壁206的底部,以便在界面盖456和底壁206之间提供不透光密封。垫圈材料可设置在轮缘460和底壁206之间以进一步增强不透光密封。五个检测开口462设置在界面盖456中。如图15和16所示,这两个图分别示出了信号检测器的侧剖视图和分解透视图,激发壳体402包括五个激发通道404。激发源405(诸如连接到激发PCB406的发光二极管(“LED”))位于每个激发通道404的末端。相似地,检测器壳体418包括五个发射通道420,并且检测器元件423(例如光电二极管)设置在每个发射通道420中并连接到检测器PCB422。螺柱406安装在激发壳体402和检测器PCB422之间离检测器壳体418一定距离处,以为检测器PCB422提供额外稳定性。在每个检测器400的每个单独荧光计或通道内,具有两个光路,这两个光路由分别至少部分地设置在激发和发射通道内的激发光学器件和发射光学器件限定。如下文更详细描述的,激发光路从作为光源的LED开始,其光被激发透镜准直,然后通过激发滤波器过滤。过滤后的光向上穿过分束器并通过容器管162和分束器之间的物镜聚焦于容器管162上。发射光路源自容器管162的内容物发射的光,该光在朝分束器通过时被物镜准直并且被分束器反射向发射通道。在发射通道内,通过发射滤波器过滤后,光被发射透镜聚焦于检测器元件423,例如光电检测器上。检测器400的多种光学元件位于光学器件壳体434中。对于激发壳体402的每个激发通道404而言,光学器件壳体434容纳激发光学器件408,对于检测器壳体418的每个发射通道420而言,光学器件壳体434容纳发射光学器件424,而对于界面盖456的每个检测器开口462而言,光学器件壳体434容纳输入/输出光学器件444。激发光学器件408、发射光学器件424、和输入/输出光学器件444设置在光学器件壳体434内形成的光学器件通道436内。激发光学器件包括激发透镜412、透镜座414和激发滤波器416。O形环410在激发壳体402和光学器件壳体434之间提供不透光密封。对激发滤波器416进行选择,以使具有所期望激发特性(如,波长)的激发光从光源405行进到激发通道404内。发射光学器件包括发射透镜428、透镜座430和发射滤波器432。O形环426在检测器壳体418和光学器件壳体434之间提供不透光密封。对发射滤波器432进行选择,以使仅反应容器的内容物发射的信号的具有所期望信号特性(如,波长)的那部分透射到发射通道420内的检测器423。输入/输出光学器件444包括第一物镜450和第二物镜448,其间设置有间隔环446。O形环452在界面盖456和光学器件壳体434之间提供不透光密封。检测器400还包括二向色性分束器,其包括保持在分束器框架442内的二向色性分束器元件440,分束器框架442被插入到光学器件壳体434的分束器开口438中。为每个激发通道404和对应的发射通道420提供分束器440。对分束器440进行选择,以使具有指定激发波长的激发光以直线光路从激发通道404通过,并使来自容器162的内容物的具有指定检测波长的发射光偏转朝向检测通道420。不同荧光染料以不同波长被激发。在本发明的一个多重应用中,合适的染料包括罗丹明染料四甲基-6-罗丹明(“TAMRA”)和四丙醇-6-羧基罗丹明(“ROX”),以及荧光素染料6-羧基荧光素(“FAM”),并且它们各自均与DABCYL淬灭剂组合。另外的合适荧光染料包括6-羧基-1,4-二氯-2’,7’-二氯-荧光素(“TET”)、6-羧基-4’,5’-二氯-2’,7’-二甲氧基-荧光素(“JOE”)、NED、CALFLUORRed610、CALFLUOROrange560、Cy5、QUASAR670、德克萨斯红等等。另一种合适的染料包括5’-六氯荧光素亚磷酰胺(“HEX”)。多种另外的荧光染料是本领域已知的并且可易于应用于本发明的方法和系统。优选染料的激发光谱在图17中示出。因为优选染料以不同波长被激发,所以每个检测器400优选地在光学检测模块所针对的特定染料的所期望激发波长(即,颜色)处或附近发射激发光。因此,光学系统的组件选择在多种情况下将取决于检测器400所针对的特定染料。例如,对于光源405而言,特定LED选择将取决于检测器所针对的染料。检测器400在设计和组件方面经常相同,不同的是组件是特定于染料的。特定于染料的组件包括例如光源405、激发滤波器416、发射滤波器432和分束器440。下表提供了不同类型示例性染料的不同滤波器的规格:滤波器规格表1说明中心波长(nm)带宽(nm)尺寸(mm)厚度FAM激发滤波器460608.9×8.9正方形2FAM发射滤波器525308.9×8.9正方形2FAM短波通二向色滤波器10×14.8矩形1.05HEX激发滤波器535228.9×8.9正方形2HEX发射滤波器567158.9×8.9正方形2HEX短波通二向色滤波器10×14.8矩形1.05ROX激发滤波器585298.9×8.9正方形2ROX发射滤波器632228.9×8.9正方形2ROX短波通二向色滤波器10×14.8矩形1.05下表提供与不同类型染料相对应的不同透镜的规格:透镜和O形环规格表2下表示出了LED对于不同颜色优选的特性:LED规格表3特性蓝色绿色琥珀色芯片尺寸24mil11mil25mil主波长462nm533nm590nm辐射光通量4mW2mW1.2mW最大直流正向电流200mA50mA150mA应注意,在所示实施例中,分束器440使激发光通过并反射发射光。由于激发通道长于发射通道,该布置方式为信号检测器400的壳体提供窄外形,从而使可以角间隔设置在温箱200之下的检测器400的数量最大,如图12所示。在设计激发和发射通道(它们可从图12所示格式互换)中可考虑空间限制和参数选择。在此类实施例中,可以使用反射激发光并使发射光通过的分束器。根据本发明方面进行的实时扩增测定程序1900的流程步骤在图20中以流程图方式示出。程序1900由诊断分析仪执行,其中一个或多个温箱例如温箱200为诊断分析仪的组件,并且诊断分析仪受运行软件的计算机(微处理器)控制,所述软件包括计算机可读介质上编码或存储的实现程序1900的算法。图19中所示的流程类似于Lair等人的美国专利No.8,008,066中详细描述的类似流程。所述步骤仅代表示例性TAA程序。普通技术人员将认识到可以改变或省略下面描述的步骤或者可以根据现在已知或尚未开发的其他实时扩增测定程序添加或替代其他步骤。用于执行大量扩增程序的试剂配方是本领域熟知的,并且可用于本发明中或易于调整来用于本发明。参见如Kacian等人的美国专利No.5,399,491;Becker等人的美国专利No.7,374,885;Linnen等人的名称为“CompositionsandMethodsforDetectingWestNileVirus”(用于检测西尼罗河病毒的组合物和方法)的美国专利No.7,115,374;Weisburg等人的名称为“Compositions,MethodsandKitsforDeterminingthePresenceofTrichomonasVaginalisinaTestSample”(用于测定试样中阴道毛滴虫存在性的组合物、方法和试剂盒)的美国专利No.7,381,811;以及Kacian的名称为“MethodsforDeterminingthePresenceofSARSCoronavirusinaSample”(用于测定样品中SARS冠状病毒存在性的方法)的美国专利申请公布No.2010-0279276A1,所述专利文献各自的公开内容以引用方式被并入。一种示例性实时TAA扩增测定的流程步骤从步骤1902开始,在该步骤中将容器例如MRD160移动到样品转移工位(未示出)中的移液位置。在步骤1904中,样品移液管组件(未示出)将包括磁响应粒子的100μL靶标捕获试剂(“TCR”)分配到容器中,例如分配到MRD160的每个容器管162中。靶标捕获试剂包括捕获探针、含洗涤剂的裂解剂(例如十二烷基硫酸锂,用于裂解细胞并抑制样品材料中存在的RNA酶的活性)和约40μgSera-MagTM(MG-CM)羧酸盐改性类(印第安纳州印第安纳波利斯的Seradyn公司(Seradyn,Inc.,Indianapolis,IN);目录号24152105-050250)1微米、具有共价键合聚(dT)14的超顺磁性粒子。捕获探针包括5′靶标结合区和3′区,3′区具有聚(dA)30尾,用于与键合到磁粒子的聚(dT)14结合。捕获探针的靶标结合区被设计为结合到靶标核酸的与引物和检测探针靶向的区域不同的区域。在步骤1906中,将400μL样品分配到容器中。在步骤1908中,将容器如MRD160移动到混合机(未示出),并且在步骤1909中,优选以16Hz混合样品和TCR60秒。应注意,图19中给出的时间及其说明是所期望的时间,并且实际时间在实施过程中可能与给出的所期望时间有差别。在一个实施例中,诊断分析仪包括维持在三个不同温度的三个温箱:第一温箱维持在64℃,用于靶标捕获和引物退火,第二温箱维持在43.7℃,用于预热容器、AT结合和引物结合,并且第三温箱维持在42.7℃,用于扩增。第一、第二和第三温箱可以被配置为与上述温箱200相同,但第一和第二温箱可以省略信号检测器400。在步骤1910中,将容器移动到第二温箱以在43.7℃的温度预热容器及其内容物276秒。在其他实施例中,可将容器放置在用于预热步骤的温升工位(即温度控制盒,其被配置为容纳和保持一个或多个容器(未示出))。在步骤1912中,将容器移动到第一温箱(即,靶标捕获(“TC”)温箱),其在此处保持在64℃达1701秒,以使捕获探针杂交到从样品提取的靶标核酸(尽管不希望受任何具体理论的束缚,但在该温度下,捕获探针与固定聚(dT)14寡核苷酸的杂交不明显。)在步骤1914中,将容器从TC温箱移动到用于AT结合的第二温箱,其在此处保持在43.7℃达313秒,以允许与磁粒子相关联的固定寡核苷酸结合到捕获探针。在步骤1916中,将容器移动到冷却器(即温度控制盒,其被配置为容纳和保持一个或多个容器(未示出)),容器在此处保持在18℃达481秒。在步骤1918中,将容器移动到磁停放工位(未示出),该工位为以下结构,即该结构被配置为将一个或多个容器保持在接近一个或多个磁体的位置,使得每个容器管162的内容物暴露于磁场,以将靶标捕获试剂的磁响应粒子吸引到与磁体相邻的容器的一部分并离开悬浮液。合适的磁停放工位在Davis等人的美国专利申请公布No.2010/0294047“MethodandSystemforPerformingaMagneticSeparationProcedure”(用于进行磁力分离程序的方法和系统)中有所描述,该专利文献的公开内容以引用方式并入。在步骤1920中,将容器移动到磁分离工位(未示出)进行磁分离洗涤程序,例如Lair等人的美国专利No.8,008,066中所述。在磁分离工位内,磁体(其选择性地紧靠反应管放置)用于将磁响应粒子吸引并保持到管的一部分。一旦磁响应粒子和键合于其上的任何靶标核酸由此固定,就可通过从反应管抽吸流体来使杂交的核酸与未杂交的核酸分离开。在从管中初始抽吸流体内容物后,在步骤1922中将1mL洗涤溶液添加到容器中。步骤1924包括第二磁力洗涤,其包括在抽吸容器的流体内容物后,在步骤1926中将1mL洗涤溶液添加到容器中,并在步骤1928中将100μL油(如,硅油)或其他表面处理试剂添加到容器中。在步骤1930中进行最终的磁力洗涤程序(在其他实施例中,可进行更多或更少的磁力洗涤程序),然后在步骤1932中最终分配100μL油(如,硅油)或其他表面处理试剂。在步骤1928中将表面处理试剂例如硅油添加到样品溶液中的优点是,其减少了在磁分离洗涤程序的冲洗和抽吸步骤过程中粘附到反应管162内表面的材料量,从而有利于更有效的磁分离洗涤程序。尽管MRD160优选由疏水材料例如聚丙烯制成,在磁分离洗涤程序的抽吸步骤过程中在MRD容器管162的内表面上仍然可能形成材料例如洗涤溶液的小液滴。如果在磁分离洗涤程序过程中未从容器管162充分去除,该残余材料(其可能含有核酸扩增抑制剂)可能影响测定结果。在替代方法中,可以将表面处理试剂添加到容器管162并在添加TCR和样品之前去除,或者可以在从反应管中吸出TCR和样品之后,将表面处理试剂(可能与洗涤溶液一起)添加到反应管中,然后在将扩增和酶试剂添加到反应管中之前去除。目的是为容器管162的内表面提供表面处理剂的覆盖层。扩增反应的抑制剂是本领域已知的并且取决于所使用的样品来源和扩增程序。可能的扩增抑制剂包括下列物质:来自血液样品的血红蛋白;来自尿液样品的血红蛋白、硝酸盐、晶体和/或β-人绒毛膜促性腺激素;核酸酶;蛋白酶;阴离子洗涤剂,例如十二烷基硫酸钠(SDS)和十二烷基硫酸锂(LLS);以及EDTA,其为某些样本的抗凝剂和固定剂,能够结合二价阳离子如镁,镁为如上所指出的是用于基于核酸的扩增反应中的辅因子。例如参见以下文献:Mahonyetal.,J.Clin.Microbiol.,36(11):3122-2126(1998)(Mahony等人,《临床微生物学杂志》,第36卷,第11期,第3122-2126页,1998年);Al-Soud,J.Clin.Microbiol.,39(2):485-493(2001)(Al-Soud,临床微生物学杂志》,第39卷,第2期,第485-493页,2001年);和Kacian等人的名称为“MethodforSuppressingInhibitionofEnzyme-MediatedReactionsByIonicDetergentsUsingHighConcentrationofNon-IonicDetergent”(使用高浓度的非离子洗涤剂限制离子洗涤剂对酶介导的反应的抑制的方法)的美国专利No.5,846,701,所述文献各自的公开内容以引用方式并入。在步骤1932中将硅油添加到MRD160的每个反应管162中,以防止在随后的操纵过程中流体内容物蒸发和溅落。在步骤1934中,将保存在冷却环境中的扩增试剂添加到每个容器中,同时在扩增装载工位(未示出)将容器保持在45℃。在步骤1936中,将75μL扩增试剂分配到设置在装载工位内的容器中,然后通过安装在装载工位中的混合机将容器以16Hz混合25秒。对于示例性TAA反应,扩增试剂包含具有3′靶标结合区和RNA聚合酶识别的5′启动子序列的反义启动子-引物、结合到启动子-引物形成的延伸产物的正义引物、三磷酸核苷(例如,dATP、dCTP、dGTP、dTTP、ATP、CTP、GTP和UTP,包括修饰的核苷酸或核苷酸类似物)和辅因子,足以进行TAA反应。对于实时TAA扩增测定,扩增试剂还包含链置换分子炬探针,其具有相互作用的标签对(例如,通过常规方法连接到其5′和3′端的相互作用的荧光和淬灭剂部分)和靶标特异性区域,靶标特异性区域能够在发生扩增时可检测地杂交到扩增产物并且优选地不杂交到可能存在于容器中的任何非靶标核酸。参见Kacian等人的美国专利No.5,399,491;Becker等人的名称为“Single-PrimerNucleicAcidAmplification”(单引物核酸扩增)的美国专利No.7,374,885(公开了替代的基于TAA的扩增测定法,其中采用3′端封端的反义引物和正义启动子寡核苷酸,以最大程度减少副产物形成);以及Becker等人的美国专利No.6,361,945,所述专利文献各自的公开内容以引用方式并入。在步骤1938中,将容器移动到第二温箱并在43.7℃预热286秒。在步骤1940中,将容器移动到第一温箱并在64℃温育636秒,使引物退火。在步骤1942中,将容器移动到第二温箱并在43.7℃温育405秒,使启动子-引物结合到靶标核酸。在该特定TAA例子中优选的启动子-引物具有T7RNA聚合酶所识别的启动子序列。在步骤1944中,将容器移动到装载工位,以在45℃进行酶试剂添加。在步骤1946中,添加25μL酶并将MRD以10Hz混合15秒。在步骤1948中,将容器移动到第三温箱(扩增温箱),在此处将容器内容物在42.7℃温育3569秒进行扩增。在扩增过程中,在步骤1950中进行实时荧光测量。该例的酶试剂包含用于进行TAA的逆转录酶和T7RNA聚合酶。在基于核酸的测定完成后,并且为了避免后续扩增反应的可能污染,可用灭活剂处理反应混合物,该灭活剂破坏反应管中的核酸和相关扩增产物。在此类例子中,在扩增和实时测量之后,在步骤1952中,将容器移动到灭活队列或模块(未示出),并在步骤1954中,向每个容器提供2mL基于漂白剂的试剂以灭活存在于容器中的核酸(即,改变核酸使之不能扩增)。此类灭活剂可包括氧化剂、还原剂和反应性化学品等等,其改变核酸的一级化学结构。这些试剂的工作方式是使核酸对扩增反应呈惰性,无论核酸是RNA还是DNA。此类化学试剂的例子包括次氯酸钠的溶液(漂白剂)、高锰酸钾、甲酸、肼、硫酸二甲酯和类似化合物的溶液。灭活方案的更多细节可见于如Dattagupta等人的美国专利No.5,612,200和Nelson等人的美国专利申请公布No.US2005-0202491A1,所述专利文献各自的公开内容据此以引用方式并入。如上所指出的,温箱200包括多个信号检测器400,它们被配置为以实时方式测量位于MRD160中的未淬灭荧光染料分子的浓度。如上所讨论的,该测定法被设计为使得随着靶标浓度经扩增增加,荧光信号增强。因此,检测器400可用于通过监测荧光信号的出现来监测扩增过程。另外如上所指出的,温箱200可包括3与6个之间的检测器400。每个检测器400自身可具有多个荧光计。例如,根据本发明的一些实施例,每个检测器400包括五个荧光计或通道。优选地,荧光计的数量与MRD160中容器162的数量一样多。每个荧光计或通道包括两个光路:激发光路和发射光路。单个信号检测器400的相邻通道之间和/或相邻信号检测器400之间的光学串扰可呈多种形式。当一个通道检测到来自(相同或不同信号检测器400的)另一个通道的激发光时或当一个荧光计获得来自容器162的由不同荧光计激发的发射光时,可发生串扰。此外,串扰可能在特定染料颜色的激发信号激发该荧光计所不针对的颜色染料时发生。例如,如图17所示,该图示出了几种不同荧光染料的激发强度与波长的关系图,FAM和JOE、JOE和TAMRA、以及TAMRA和ROX的激发波长有一定程度重叠。数据采集系统和方法可结合图24高层地描述。通常,系统和方法包括三个组成部分:激发406、检测422和控制506。在激发分支406中,电源从电压控制的电流源产生交流电(“AC”)波形(例如,方形或正弦),并将该波形发送到光源(如,LED),以产生以与AC波形相对应的方式调制的激发光信号。检测分支422包括光检测器(如,光电二极管),其将入射到检测器上的光的光子转换为电流。检测分支422还包括组件例如互阻抗放大器,其将来自光检测器的电流转换为具有作为入射到光检测器上的光子的模拟的波形的电压。除其他组件外,控制分支或控制器506还包括模拟数字(A/D)转换器和解调器。A/D转换器将模拟电压转换为数字数据,并且解调器通过数字信号处理(“DSP”)技术(例如下文所述的那些技术)识别数字数据的频率分量,具体地讲识别具有与用于驱动激发信号的AC波形的频率相对应的频率的数字数据的分量。同步检测是减少某些形式的串扰的一种方法。减少串扰的其他方法包括使用窄带宽光谱滤波器进行激发和发射光的调节,使用聚焦元件(如,透镜或窄孔径)提供空间密集的激发和/或发射光束,以及使用隔离元件使信号检测器彼此光学隔离。同步检测形成窄带宽频率滤波器,其只对发射信号中以激发信号调制频率为中心的窄范围的频率敏感。在该过程中,每个光电检测器423连接至检测器PCB422上的互阻抗放大器,并且每个LED光源405连接至激发PCB406上的DAC控制的电流源。对LED电流进行调制。以LED的调制频率解调来自互阻抗放大器输出处光电二极管的信号,形成能拒绝串扰信号和环境光的同步检测系统。除串扰之外,同步检测还大大降低由其他来源(如环境光)产生的噪声,从而允许使用并非不透光的温箱(即,允许一定量的环境光进入温箱内部)。通过使用同步检测,系统对激发信号调制频率的信号敏感,并且对非激发调制频率的信号不敏感。环境光通常不在系统的调制频率,所以它被拒绝或不被测量。例如,太阳光不被调制;它是DC,因此它的强度与频率不相关。另外,室内光通常以50、60、100或120Hz被调制。因此,通过将激发信号的调制频率设置为远离环境光将会产生的典型频率,系统就变得对环境光不敏感。因为信号检测器400的发射通道420和激发通道404被布置为彼此接近,例如作为布置在一行中的紧密相邻的通道,所以可能发生MRD160的相邻容器162的发射信号之间的串扰。使用两种方法减少这种类型的串扰。例如,将光学器件设计为具有宽度为2mm的窄激发和检测点。信号检测器400的发射光路接受这个小点内窄角度范围内的光。这减少了MRD160的相邻容器162之间可泄漏的光量。除光学装置之外,还使用同步检测系统来减少这种类型的串扰。信号检测器400的五个激发通道404中每一个的激发信号的调制频率被设置在两个频率之一处,这两个频率例如在相邻通道之间交替。例如,将与第一容器162相对应的第一通道的激发信号的调制频率设置为频率A,将与第二容器162相对应的第二通道的激发信号的调制频率设置为频率B,将与第三容器162相对应的第三通道的激发信号的调制频率设置为频率A,将与第四容器162相对应的第四通道的激发信号的调制频率设置为频率B,并将与第五容器162相对应的第五通道的激发信号的调制频率设置为频率A,其中将频率A和频率B设置为间隔足够远从而使得每个通道对其相邻通道不敏感。具体地讲,对于FAM信号检测器而言,将第一、第三和第五容器162的调制频率设置为200Hz,将第二和第四容器162的调制频率设置为250Hz。一种颜色的检测与另一种颜色的激发之间也可能发生串扰。例如,FAM发射滤波器与HEX激发滤波器重叠,使得FAM荧光计能够检测到HEX的激发光。对于HEX检测器和FAM激发而言不是这种情况,因为这两种滤波器不重叠。用两种方法减少相邻颜色的检测与激发之间的串扰。一种是在可能的情况下将滤波器的带通布置为不重叠。当滤波器带宽加宽时,更宽光谱的光穿过滤波器,并且可以获得更多的信号,但串扰量也通常会增加。因此,可以调节滤波器带宽来提供串扰与信号强度之间的平衡,从而允许检测清晰的发射信号。如图30所示,该图示出了ROX、HEX和FAM染料的激发和发射滤波器的带宽(对于每种染料而言,激发带宽在发射带宽的左侧),FAM和ROX滤波器的光谱带宽优选不重叠。如图31所示,该图示出了归一化的激发和发射荧光与FAM、HEX和ROX染料的波长的关系图,HEX激发波长带与FAM发射波长带部分重叠,ROX激发波长带与HEX发射波长带部分重叠。还参见上面的表1。对于可接受的性能,优选的是FAM发射和HEX激发滤波器重叠,因为它们间隔非常近。通常在接近的颜色之间滤波器具有重叠,所以在颜色从FAM前进至HEX再前进至ROX时,FAM发射与HEX激发之间具有重叠,HEX发射与ROX激发之间具有重叠,但FAM(激发或发射)与ROX(激发和发射)之间没有重叠。如下所述用同步检测减少相邻颜色之间的串扰。已经描述了两种调制频率的交替来消除相邻容器162之间的串扰。在这种情况下,使用相同的方法;为HEX信号检测器选择与FAM信号检测器所用调制频率不同的两种调制频率,使这两种调制频率在容器162之间交替,然后将FAM调制频率用于ROX信号检测器。该布置方式列于下表4中:表4染料容器1容器2容器3容器4容器4FAM200Hz250Hz200Hz250Hz200HzHEX300Hz350Hz300Hz350Hz300HzROX200Hz250Hz200Hz250Hz200Hz图25示出了根据本发明实施例的检测电路422的一种布置方式的逻辑框图。检测器PCB422上的检测电路可以包括检测器电路502a–502e,它们被配置为检测荧光并将检测到的光转换成可被控制器506处理的电压信号。可将检测器电路502a–502e的输出直接或通过多路复用器504连接至控制器506,如图25所示。图27示出了根据本发明实施例的激发电路的一种布置方式的逻辑框图。如图27所示,该图为框图,示意性地示出了体现本发明方面的激发电路的一种布置方式,激发电路可包括控制器506和数字模拟转换器(DAC)510。激发PCB406上的激发电路包括用于驱动每个激发通道404的每个激发源405的激发电路512a-512e。激发电路512a-512e由数字模拟转换器(DAC)控制的电流源驱动。电流源为控制流过激发源405的电流的电压到电流放大器。可将监视器516连接至激发电路512a-512e,以有利于激发电压的过程控制。检查LED两端的电压和通过LED的电流来提供LED是否正常工作的良好指示。这是可以多种方式使用的诊断能力。例如,可以在自我检测期间在电源开着时检查LED,所以当荧光计通电时,它可以使已知的电流通过LED,如果LED的正向电压在预期范围内,那么系统将通过自我检测。也可以在监视LED正常运行的测定期间检查这些值。根据本发明的实施例,电路512a-512e中的每个LED(与激发源405相对应)可被数字模拟转换器控制的电流源驱动,如图28所示,该图为示出荧光计激发电路的电路图。该电流源可以是控制流过LED(与激发源405相对应)的电流的电压到电流放大器。除执行驱动计算机控制的电流波形通过LED的功能之外,图28所示的电流源还允许根据LED电流和电压进行过程控制。由U3形成的电路输出为LED两端电压的监视器,并且可由监视器516使用A/D转换器将其数字化。相似地,可以用R22的输出(远离晶体管Q3的一侧)来监视通过LED的电流,并相似地被位于监视器516中的A/D转换器数字化。监视通过LED的电流用于诊断目的,如上所述。荧光计电路502a–502e可如图26A和26B所示进行配置。每个检测器电路502包括前置放大器电路(其包括U11)和由U10(表示为U10B)的引脚5-7形成的放大器。前置放大器电路接收来自光电二极管D(与检测器元件423相对应)的电流并将其转换成放大的电压。如图所示,包括U10(表示为U10A)的引脚1-3的放大器提供偏置电流,以补偿由入射在光电二极管D上的未调制的环境光引起的从光电二极管D流出的电流。与电路1790一样,这是为了防止环境光使前置放大器的输出饱和。放大器U11和U10B形成来自光电二极管D(423)的电流信号(与发射信号相对应)的放大的前两个阶段。C54、C44和C58为放大器提供电源旁路/滤波。C12、D12、R55、R57和R61形成使光电二极管D的正极偏压的滤波电源。反馈电阻器R31和R32将来自光电二极管D的电流转换成电压,而C48为更高频率信号提供滤波。由R43和R45形成的分压器在下一个前置放大状态中提供为10的电压增益,而电容器C56提供另外的低通滤波。检测器电路502a-502e被配置为使用由U7A形成的电平位移器。尽管不希望受到理论的约束,但电平位移器的目的是使前置放大器的零电平移动至单极模拟数字转换器的中间范围。这允许使用某些微控制器所用的A/D转换器,使得不需要另外的A/D转换器。图26A和26B所示的电路配置不需要解调器电路。相反,检测器PCB422的检测电路可以使用控制器板上的五个相同的前置放大器电路。然后可以将每个前置放大器电路的输出直接连接至控制器506的A/D转换器输入。这允许由DSP使用微控制器506中执行的算法来完成同步检测,而不是像同步检测电路一样使用模拟解调器和滤波器电路。根据一些实施例,以至少为激发源405的调制频率的两倍,优选为调制频率的基本上两倍以上的速率将来自每个检测器电路502a–502e的信号数字化。例如,在一个实施方式中,调制频率为大约250Hz,数字化速率为4kHz。根据一些实施例,微控制器506通过执行如下所述修改的戈泽尔算法来识别发射信号的频率分量。然后可以计算与激发调制频率匹配的频率分量的大小,从而识别由于预期激发信号而产生的发射信号并数字地“过滤”出由于串扰和环境光而产生的信号分量。然而,在其他实施例中,用多种用于识别特定频率分量大小的不同算法中任何一种来处理数字化信号,包括离散傅立叶变换(DFT)、快速傅立叶变换(FFT)或数字锁相检测。使用的戈泽尔算法为GeraldGoertzel博士于1958年公布的用于识别信号频率分量的数字信号处理技术。一般的快速傅立叶变换算法对整个输入信号带宽平均地进行运算,而戈泽尔算法检测单个频带中的频率并且比FFT更高效。修改的戈泽尔算法用最后2项滤波器计算频率分量并归一化独立于样品数量的输出。在使用修改的戈泽尔算法的本发明实施例中,可以根据图24中所示的方法550计算某个频率的信号的功率,这可以借助于保存在计算机可读介质上并由微处理器(即,编程计算机),如控制器506执行的软件来实现。根据方法550,在步骤552将若干变量初始化。将Fs被初始化为对信号进行取样的频率(即,数字化频率)。将Ts设置为取样周期,或1/Fs。将Fc设置为单位为Hz的滤波器的中心频率(即,正被检测的具体染料的激发的调制频率)。将Ti初始化为积分时间。优选地,选择的中心频率Fc为取样周期Ts的整数倍,选择的积分时间Ti为中心频率Fc的整数倍,因为已经发现选择此类中心频率和积分时间能使数字处理噪声降至最低。最后,将戈泽尔项Q0、Q1和Q2被设置为0。在步骤554,用以下公式计算滤波器系数K:K=2cos(2πFc/FS)滤波器系数K计算后,在步骤556,可以通过用积分周期Ti除以取样周期Ts来计算积分周期中的测量数量N,并可以在步骤558将“计数”变量设置为0。步骤560暂停该过程,直到下一个取样时间已经过。在下一个取样时间,在步骤562将来自检测器电路502的模拟输出转换为数字输入Vin。在步骤564,按以下顺序重新计算戈泽尔项:Q0=KQ1-Q2+VinQ2=Q1Q1=Q0即,首先计算Q0,然后将Q2设置为Q1的当前值,然后将Q1重新设置为新计算出的Q0值。由于基本戈泽尔算法本质上是产生与所关注的单个频率相关的项数列的离散傅立叶变换(“DFT”),因此在当前的实施方式中用以下步骤“修改”该算法:计数器在步骤566递增,并在步骤568确定是否已经进行了N次测量。如果还未进行N次测量,那么方法返回步骤560。如果已进行了N次测量,则可以在步骤570在取样周期结束时根据以下公式用最后2项(Q1和Q2)计算信号的功率P:这时,可以在步骤572通过用P除以进行的测量次数来将功率输出的计算值归一化。如下所述,信号的处理取决于实际线性功率的测量。如果没有这些修改,输出就不是线性的,并且还取决于样品数量。样品数量是可配置参数,并且对于所有信号检测器中的所有通道而言,样品数量不相同。图29为载体242使MRD160移动以及MRD与每个检测器400交互作用的时序图580。如图所示,每个检测器400的总MRD移动时间582(如,2秒)被分成若干分量。参见584处所示的计时块,根据一些实施例,指定用于移动容器载体242以将MRD160置于相对于信号检测器400的工作位置的周期(如,0.8秒(800毫秒)),指定晃动周期(如,0.8秒(800毫秒)),并指定测量周期(如,400毫秒)。提供晃动时间延迟,以允许容器162内的流体停止晃动(在容器载体242开始和停止之后),并允许任何机械振动在进行发射信号测量之前逐渐减弱。将测量周期分成持续时间为250微秒的测量时隙586,将每个时隙再分成50微秒的时隙588,用于与MRD160的五个容器162相对应的信号检测器400的五个通道的每一个。这样,在400毫秒测量周期期间每250微秒对每个通道进行取样,获得1600个样品(0.400/0.00025)。取这1600个样品的平均值,来提供用于400毫秒测量周期的单个数据点。时间是可配置的。例如,可以使用700毫秒晃动周期和200毫秒测量周期。对于250微秒测量时隙,200毫秒测量周期将产生800个样品,取这800个样品的平均值来提供用于200毫秒测量周期的测量数据点。将用于每个通道N的每个50微秒时隙590分成不同的任务。在初始时间周期591(如,1微秒)期间,检测器400读取模拟数字转换器(“ADC”)缓冲区,以获得前一A/D转换的结果。更具体地讲,在每个50微秒时隙590期间,对不同的通道取样:在一个50微秒时隙590期间对通道1(即,第一容器管162,参见图1)进行取样,然后在下一个50微秒时隙590期间对通道2进行取样,然后在下一个50微秒时隙590期间对通道3进行取样,然后在下一个50微秒时隙590期间对通道4进行取样,然后在下一个50微秒时隙590期间对通道5进行取样。在每个50微秒时隙中,对通道之一进行取样,并对通道之一进行处理。所以,例如,当对通道2取样时,处理通道1,当对通道3取样时,处理通道2,然后是通道4和3,然后是通道5和4,然后是通道1和5,等等。如上所述,对于每个通道而言,信号检测器将光子转换成模拟电压,并且该电压被A/D转换器数字化。数字化的电压被暂时保存在ADC缓冲区中。当信号检测器开始进行测量光信号(并将该信号转换成数字数据)的过程时,从缓冲区读取保存在ADC缓冲区中的前一通道的数字值,并且来自前一通道的值将在ADC缓冲区中被下一通道取得的值取代。这种平行取样和处理能节约时间。读取先前为前一个通道转换的数据,然后开始对当前测量的下一个通道的数据进行转换。当在当前通道上继续进行与检测到的光信号相对应的电压模拟的A/D转换时,从ADC缓冲区读取的来自前一转换和前一通道的数据被DSP处理,以识别具有正确激发频率的分量。因此,处理和测量是重叠的。转向图29,在读取ADC缓冲区之后的后续时间周期592(如,1微秒)期间,正确的通道N被多路复用或激活,并且对该通道开始进行A/D循环。有一种模拟多路复用器能够选择要路由至A/D转换器输入的N个模拟信号之一。该步骤选择信号检测器400中的五个通道之一(因为每个颜色的MRD160的每个容器162具有一个通道)并在该通道上开始模拟数字转换。用两步法测量信号。在取样时间期间,即块593(如,6.2微秒)期间,模拟信号被多路复用器连接至取样与保持放大器。对取样与保持放大器而言,取样时间是解决模拟信号的准确表示所必需的。取样时间之后,即块594(如,2.8微秒),开始A/D转换。转换期间,模拟信号与取样与保持放大器断开,取样与保持放大器保存的电压被A/D转换器转换成数字位。这样,在取样时隙593期间所测得的信号在转换时隙594期间被转换成电压的数字测量值,并被保存在ADC缓冲寄存器中,从而取代先前保存的值,然后在下一个50微秒时隙开始时被读取。处理器计算表示LED电流波形中下一个电流数据点的数字值。平行于时间块593和594,在时间块595(如,9微秒)期间,可以使用例如用于产生通道N的激发信号点的串行外设接口(SPI)将AC波形中的下一个LED电流数据点发送至数字模拟转换器(“DAC”)。电流波形可以为正弦波、方波或其他波形。这是可配置的,并且正弦波和方波以类似的性能使用。在时间块596(如,15微秒)期间,(使用例如上文所述的修改的戈泽尔算法的)数字信号处理(“DSP”)被执行,以根据在时间块591期间从ADC缓冲区读取的数据计算功率。根据本发明的一些实施例,在每个通道的50微秒时隙期间可以不使用时间块597(如,24微秒),可以将其用于执行其他任务。一旦通过在规定的时间段内以规定的时间间隔测量来自每个容器的荧光发射已经收集到数据,就对所述数据进行处理,以确定样品中特定分析物(如,靶标核酸)的浓度。测得的数据(即测量信号)将以相对荧光单位(“RFU”)来表示,它是信号检测器400的检测PCB422根据聚焦到检测元件423上的发射荧光量而产生的信号。以给定时间间隔测得的每个数据点为RFU(t)。多个数据集的被称为“增长曲线”的RFU(t)图在图21中示出。一般来讲,每个RFU(t)图通常为S形,其特征在于初始的平坦部分(称为“静态水平”或“基线阶段”)在最低水平处或附近,然后是陡峭和相对急剧倾斜部分(称为“增长阶段”),最后是在最高水平处或附近的大致平坦部分(称为“平台阶段”)。如本文所用,“增长曲线”是指反应中的合成产物(如扩增子)的出现随时间或循环次数变化的特征图案。增长曲线被方便地表示为时间(x轴)与产物量的一些指标,如荧光测量值–RFU(y轴)的二维图。一些但不是全部增长曲线具有S形状。增长曲线的“基线阶段”是指曲线的初始阶段,其中产物(如扩增子)的量以基本上恒定的速率增加,该速率小于增长曲线的增长阶段特有的增加速率(其可以具有对数-线性外形)。增长曲线的基线阶段通常具有非常小的斜率,通常约为0。增长曲线的“增长阶段”是指可测量的产物随时间大幅增加的曲线部分。典型核酸扩增反应中从基线阶段向增长阶段的过渡用扩增子以随时间增大的速率出现来表征。增长曲线的增长阶段向平台阶段的过渡从拐点处开始,在该拐点,扩增子出现速率开始下降。“平台阶段”是指曲线的最后阶段。在平台阶段,可测量的产物形成的速率显著低于对数-线性增长阶段中的扩增子产生速率,并且甚至可以接近0。图20以流程图的形式示出了计算分析物浓度的方法。如框2100所示,输入来自信号检测器400的RFU(t)数据。检测器400例如用上文所述的戈泽尔算法来解调RFU(t)数据。在2104处开始用RFU(t)数据进行阈值时间确定。阈值时间或T-时间(也称为出现时间)是指如下所述归一化的数据RFU(t)达到预定阈值的时间。如下文所详述,使用校正曲线,可以将为具体样品确定的T-时间与分析物浓度关联起来,从而指示样品的分析物浓度。一般来讲,所关注的分析物浓度越高,达到T-时间越快。T-时间确定程序的第一步为背景调整和数据的归一化,如框2106所示。进行背景调整,以减去由于来自例如杂散电磁信号的背景“噪声”而产生的信号数据RFU(t)部分。也就是说,背景噪声包括由于除所关注分析物之外的来源而产生的RFU(t)信号部分。通过从数据RFU(t)中减去背景值“BG”来执行背景调整,以获得调整后的数据RFU*(t)。即,RFU*(t)=RFU(t)-BG。可以多种方式确定背景BG。根据用于确定背景噪声的一种方法,第一步是确定数据点之间的时间间隔。通过用循环时间(即,连续数据测量之间的时间)乘以数据点(即,第0个数据点,第1个数据点,第2个数据点,...,第n个数据点)并除以60秒,来确定时间间隔。例如,假设循环时间为30秒,第15个数据点的时间间隔为(15×30秒)/60秒=7.5。下一步是通过将最小信号数据点与最大信号数据点相加并除以2,来找出信号数据的中点。即:(RFUmax+RFUmin)/2从与中点值相对应的时间开始并逆向运算,计算每对数据点的斜率:(RFU(t)-RFU(t-1))/Δt(t→t-1)。然后,通过找出小于静态斜率值(即,RFU(t)曲线开始向上倾斜之前的值)的第一斜率值来确定RFU(t)斜率变平的位置。代表性的静态斜率值也称为“Δ值”,其包括0.0001。找出该斜率之后,寻找斜率不为负值或例如大于负Δ值(即,-0.0001)的下一个循环;该值为Hindex。然后,取从第一数据点开始的整个RFU(t)值范围的平均值,并转成对应于Hindex值的RFU值。可对该范围的数据使用ExcelTRIMMEAN函数,以静态截尾值(staticbacktrim)为0.15(即,不包括指定范围内最低7.5%的RFU值和指定范围内最高7.5%的RFU值)来计算该数据的平均值。该平均值为背景BG。或者,可以根据上文所述的程序用不是0.0001的Δ值确定背景。另一种确定背景的替代方法去掉了Δ值标准,而是取从循环1至指定终点(如5.5分钟之前的第一循环)的RFU数据的TRIMMEAN平均值。对于这种替代方法而言,可以将静态截尾值调整为例如0.40(即,从背景计算中去除指定范围内的最低20%的RFU值和指定范围内最高20%的RFU值)。另一种确定背景的替代方法是对所有或一部分RFU数据进行曲线拟合,以导出基线值的估计值,这就是要减去的背景。可以使用适于对RFU数据进行曲线拟合的任何曲线拟合技术。一种示例性的曲线拟合技术是使用Weusten等人为与核酸扩增相关联的典型S形曲线的曲线拟合而导出的方程的一部分。参见Weustenetal.,NucleicAcidsResearch,30(6e26):1-7(2002)(Weusten等人,《核酸研究》,第30卷,第6e26期,第1-7页,2002年),其公开内容以引用方式并入。对于背景减除而言,只需确定基线水平。因此,也只需要对包括基线的RFU数据的第一部分进行曲线拟合,通常朝向曲线的开始部分。可以对从循环1至恰好在最大RFU的75%之前的循环的RFU(t)数据进行曲线拟合。用以下多项式方程(3)生成RFU数据的最佳拟合模型,如上所述,该方程为Weusten等人所导出方程的一部分:RFU(t)=Y0+a1a2[ea2(t-a3)/(1+ea2(t-a3))]ln(1+ea2(t-a3))(3)如下所述,将变量Y0、a1、a2和a3的初始估计值输入曲线拟合方程中,并例如使用微软(Microsoft)EXCEL的SOLVER函数进行使方程与RFU数据拟合的迭代求解,从而获得最终方程以及Y0、a1、a2和a3的最终值。Y0=为基线;初始值可以为RFU(1)。a1=与RFU(t)数据的陡峭部分(增长阶段)相关;0.05可以是a1的合适的初始估计值。a2=与RFU(t)数据的陡峭部分(增长阶段)相关;1.0可以是a2的合适的初始估计值。a3=与基线和倾斜部分之间的过渡相关;RFU(t)达到恰好在RFUmax的25%之前的值的时间或循环为a3的合适的初始估计值。当已经导出Y0、a1、a2和a3的最终值时,将Y0视为背景,并将其从进行曲线拟合的RFU(t)数据中减去。可以使用与上文所述不同的曲线拟合方程。例如,可以使用市售的TABLECURVE软件包(加利福尼亚州里士满的SYSTAT软件公司(SYSTATSoftwareInc.;Richmond,CA))来识别和选择描述示例性实时核酸扩增曲线的方程式。一个用于数学建模的此类示例性所得方程由方程(4)给出:RFU(t)=Y0+b(1-exp(-(t-d*ln(1-2^(-1/e))-c)/d))^e(4)另一个示例性所得方程由方程(5)给出:RFU(t)=Y0+b/(1+exp(-(t-d*ln(2^(1/e)-1)-c)/d))^e(5)在每种情况下,如上所述,例如可以使用微软(Microsoft)EXCEL的SOLVER函数解方程,从而获得最终方程以及Y0和其他参数的最终值,并且通过解方程获得Y0,Y0是要从RFU(t)数据中减去的背景。为了对数据进行归一化,用针对背景调整后的每个数据点除以也针对背景调整后的最大数据点。即:因此,RFUn(t)将为-1至1。在步骤2108中,通过用RFUn(max)减RFUn(min)来计算数据范围。如果计算的范围不符合或超过指定的最小范围(如,0.05),则数据被视为可疑并且可靠性值得怀疑,因此,不计算T-时间。最小范围是靠经验确定的,并且对于不同的荧光测量器械,该范围可以有所不同。理想的是,指定的最小范围被选择为确保数据值从最小到最大的变化超过系统的噪声。在步骤2110中,对归一化的背景调整的数据应用曲线拟合程序。尽管可以使用公知的任何曲线拟合方法,但在一优选实施例中,使用线性最小二乘(“LLS”)曲线拟合。只对预定下界与上界之间的数据部分进行曲线拟合。在找到拟合数据的曲线之后,最终目的是找到与曲线和预定阈值相交点处相对应的时间。在优选的实施例中,归一化数据的阈值为0.11。通过使曲线与多个对照数据集拟合并观察所述多条曲线与所选阈值相交点处的时间来凭经验确定上界和下界。上界和下界分别限定了数据范围的上端和下端,在该数据范围内,对于在曲线与给定阈值的相交点处的时间而言,曲线显示出最小变化。在优选的实施例中,下界为0.04,上界为0.36,参见图21。对从低于下界的第一数据点延伸至穿过上界的第一数据点的数据进行曲线拟合。在步骤2110,确定拟合的斜率是否具有统计意义上的显著性。例如,如果第一阶系数的p值小于0.05,那么拟合被视为具有显著性,则继续处理。如果不是,则停止处理。或者,可以用R2值确定数据的有效性。为拟合的曲线确定线性曲线y=mx+b的斜率m和截距b。使用该信息,可以在步骤2104如下所述地确定T-时间:图22用图示出了使用拟合曲线确定T-时间的技术。转向图20,在步骤2116,确定是否需要内部对照/校准调整。通常,测试程序将包括至少一个具有作为对照的已知浓度的核酸(不是所关注的核酸)的反应容器,或者可以将对照核酸序列添加到每个样品。已知的浓度可以只是用作对照,以确认反应容器中确实发生了反应。也就是说,如果已知浓度如预期那样被放大,则确认成功发生了反应,并推断与靶标分析物有关的阴性结果是由于样品中不存在靶标。另一方面,没有如预期那样放大已知浓度则表明反应失败,并忽略与靶标有关的任何结果。可以用已知浓度来校准靶标的浓度。为统计学上有效数量的数据集确定与一系列包含内部对照和靶标序列的标准相对应的T-时间。使用该数据,构建校正图,如下所述从该图内插测试样品的浓度。构建校正图的一种方法是将靶标分析物的已知浓度放在x-轴上,将靶标与对照T-时间的差值放在y-轴上。随后,从校正曲线拟合内插测试样品的浓度。构建校正图的另一种方法是将靶标分析物的已知浓度放在x-轴上,将比率(靶标T-时间/内部对照T-时间)放在y-轴上。随后,从校正曲线拟合内插测试样品的浓度。该方法的一个例子在Haaland等人的名称为“Methods,ApparatusandComputerProgramProductsforDeterminingQuantitiesofNucleicAcidSequencesinSamplesUsingStandardCurvesandAmplificationRatioEstimates”(用标准曲线和放大比率估计值确定样品中的核酸序列数量的方法、装置和计算机程序产品)的美国专利No.6,066,458中有所公开,所述专利各自的公开内容以引用方式并入。构建校正图的另一种替代方法是使用参数校正方法,如Carrick等人的名称为“ParametricCalibrationMethod”(参数校正方法)的美国专利No.7,831,417中所述的方法,该专利的公开内容以引用方式并入。有时候,数据集在初始静态基线(即,RFU(t)曲线的初始平坦部分,参见图21)之后紧接着以及恰好在数据开始向上倾斜之前显示具有倾角。为了识别和校正此类数据,在确定该数据的T-时间之前,应用以下算法。从Hindex开始,检查每个RFU(t)值,以确定它是否小于背景值BG。如果是,用BG减去RFU(t)(结果应为正数)。这将为CorValue。将CorValue与背景减去的值相加,这继而将使RFU(t)达到基线。对每个RFU(t)值前向地进行该分析,直到最新的CorValue小于前一CorValue。将该最大CorValue与每个剩余的背景减去的RFU(t)值相加。现在,可以对校正后的数据集进行归一化并如上所述确定T-时间。如果用曲线拟合方法导出背景水平,则可不必进行上文所述的倾角校正。还需要对数据集进行孤立点检测,以识别并(如果需要的话)丢弃与剩余数据点相比显示为异常值的数据点。可以使用任何公知的孤立点检测方法。定量程序2120是分析物浓度确定的第二部分。为已知条件的分析物的已知浓度确定T-时间。用该数据可以导出分析物浓度(通常表示为logcopy)与T-时间之间的关系。在为具体样品确定T-时间之后,可以用导出的关系(Logcopy=f(T-时间))来确定样品的分析物浓度。更具体地讲,在步骤2122和2124,已知浓度的对照分析物的校正/对照数据集通过例如孤立点分析和/或任何其他已知的数据验证方法进行验证。如果发现数据有效,则继续校正,否则,停止校正。确定对照数据集的T-时间,并为具体条件的所有样品(如,用特定批次的试剂处理的样品)绘制T-时间与Logcopy关系图。在步骤2126,对T-时间与Logcopy关系图的一部分进行曲线拟合,如线性最小二乘拟合,以找出与数据最佳拟合的直线的斜率m和截距b。如果可用的T-时间与Logcopy数据点(称为“校准器”)的数量不小于预定的校准器最小数量(在步骤2128确定),则如下所述在步骤2130去除最低校准器(如果有的话):在找到校准器数据点的最佳拟合线之后,还要测试第2阶和第3阶曲线拟合。如果这些拟合显著优于第1阶线性拟合,则丢弃距离线性曲线拟合最远的校准器数据点,找出第1、第2和第3拟合并再次与剩余的校准器进行比较。重复该过程–假设校准器的数量不小于校准器的最小可接受数量–直到第2和第3阶拟合不显著优于第1阶线性拟合。当已经导出线性T-时间与Logcopy方程时,在步骤2132通过将样品的T-时间插入到方程中来确定该样品的所关注分析物的浓度(作为Logcopy)。因此,在步骤2134获得测定法结果。RT温箱608的预期增强包括自我检查光学检测模块。在此类模块中,LED1732(或者,单独的专用LED)发出已知的标准激发信号,激发光被导向光电二极管1780(和/或单独的专用比较仪光电二极管),以确保印刷电路板1790的激发信号、发射信号和信号输出都正确。本文所提及的所有文献据此以引用方式并入本文中。然而,并不承认任何文献是要求保护的主题的现有技术。尽管已经结合目前被视为最实用的和优选的实施例对本发明进行了描述,但应当理解,本发明并不限于所公开的实施例,正相反,本发明旨在涵盖包含在所附权利要求的精神和范围内的多种修改方式和等同的布置方式。另外,所附权利要求中不包括35U.S.C.§112所允许的“用于执行指定功能的装置”格式的语言的那些权利要求并不旨在根据35U.S.C.§112被解释为限于本说明书及其等同物中所述的结构、材料或行为。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1