用于癌症转移的预后和治疗的方法与流程
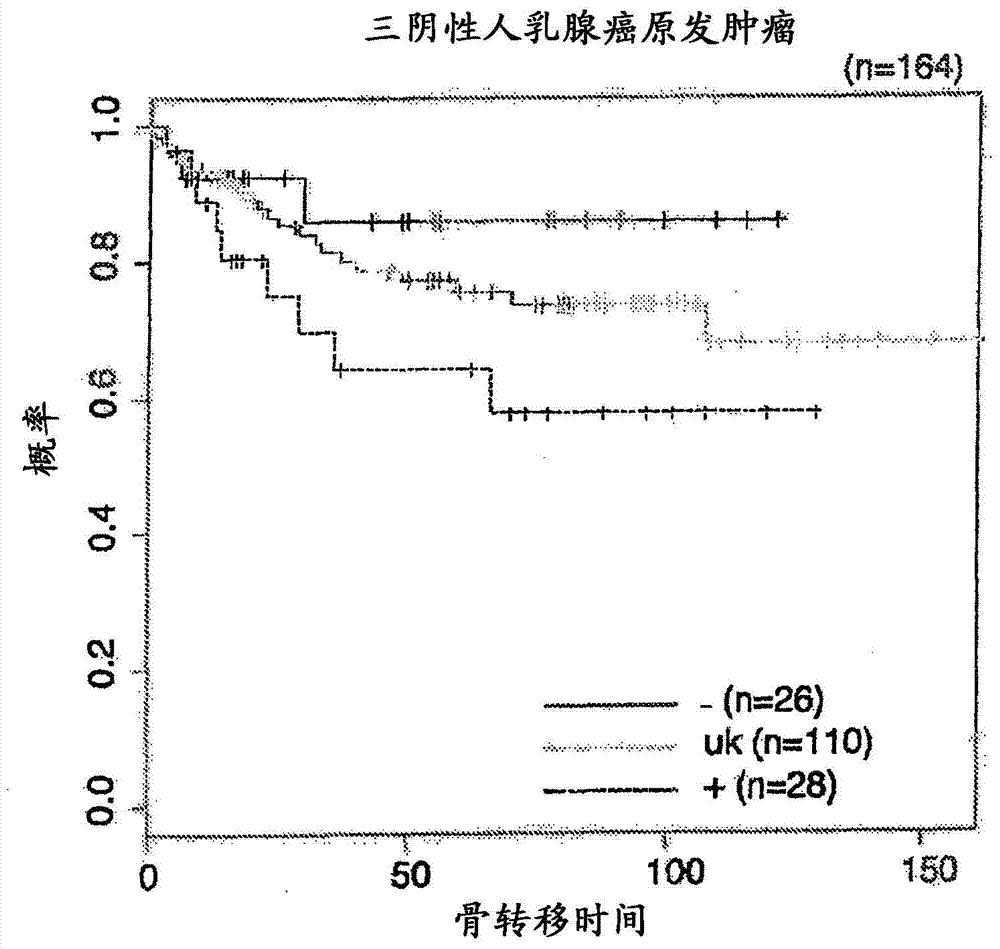
将与申请一起以电子方式提交的序列表("3190_001PC03_SEQIDListing_ascii.txt",48,269个字节,于2013年3月15日创建的)通过引用整体并入本文。发明背景发明领域本发明涉及基于测定原发性肿瘤样品中c-MAF基因的水平、16q23或16q22-24基因座的扩增或易位而对三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌(包括luminalA型和luminalB型)的骨转移预后。同样地,本发明还涉及用于设计具有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的受试者的个体化治疗(customizedtherapy)的方法,其包括测定c-MAF基因表达水平、16q23或16q22-24基因座扩增或易位。最后,本发明涉及c-MAF抑制剂用作治疗三阴性(包括基底样)乳腺癌转移或ER+乳腺癌转移,特别地骨转移的治疗剂的用途。背景领域乳腺癌是世界上第二大类癌症(10.4%,排在肺癌之后)和癌症致死的第五大病因(排在肺癌、胃癌、肝癌和结肠癌之后)。在妇女中,乳腺癌是癌症致死的最大病因。在2005年,乳腺癌世界上导致502,000例死亡(癌症导致的死亡的7%;所有死亡的大概1%)。自1970年代以来在世界范围内病例数目已显著增加,这是部分归因于西方世界现代生活方式的现象。按照TNM系统对乳腺癌进行分期。(参见美国癌症联合会.AJCCCancerStagingManual.第6版NewYork,NY:Springer,2002,将其通过引用整体并入本文)。预后与分期的结果密切相关,分期也用于在临床试验和医疗实践中对患者分配治疗法。关于分期的信息如下:TX:原发性肿瘤不能被评估。T0:无肿瘤证据存在。Tis:原位癌,无侵袭。T1:肿瘤为2cm或更小。T2:肿瘤超过2cm但小于5cm。T3:肿瘤超过5cm。T4:在乳腺或皮肤中生长的任何尺寸的肿瘤,或炎性乳腺癌。NX:附近的淋巴结不能被评估。N0:癌症未扩散至局部淋巴结。N1:癌症已扩散至1至3个腋淋巴结或一个乳房内淋巴结。N2:癌症已扩散至4至9个腋淋巴结或多个乳房内淋巴结。N3:下列情形之一:·癌症已扩散至10或更多个腋淋巴结,或癌症已扩散至锁骨下淋巴结,或癌症已扩散至锁骨上淋巴结或癌症影响腋淋巴结并且已扩散至乳房内淋巴结,或癌症影响4或更多个腋淋巴结并且最少量的癌症在乳房内淋巴结中或前哨淋巴结活检组织中。·MX:远端扩散(转移)的存在不能被评估。M0:不存在远端扩散。M1:已产生至远端器官(不包括锁骨上淋巴结)的扩散。大多数具有实体瘤癌症的患者在转移后死亡的事实意味着理解使得肿瘤能够转移的分子和细胞机制是至关重要。最近的出版物已显示转移是如何通过复杂然而知之甚少的机制引起的,以及不同的转移细胞类型如何具有朝向特定器官的向性。这些组织特异性转移细胞具有一系列允许它们定殖特定器官的获得性功能。所有细胞在其表面上、其细胞质中和细胞核中具有受体。某些化学信使例如激素结合所述受体,这引起细胞的变化。存在3种可影响乳腺癌细胞的重要受体:雌激素受体(ER)、孕激素受体(PR)和HER2/neu。为了命名具有这些受体的任何受体的细胞,当受体不存在时赋予其正号,如果受体不存在则赋予其负号:ER阳性(ER+)、ER阴性(ER-)、PR阳性(PR+)、PR阴性(PR-)、HER2阳性(HER2+)和HER2阴性(HER2-)。受体状态已成为所有乳腺癌的至关重要的评估,因为其决定使用特定治疗例如他莫昔芬或曲妥珠单抗的适合性。无监督基因表达阵列特征谱已通过内在亚型例如luminalA、luminalB、HER2+/ER-和基底样亚型的鉴定提供了乳腺癌的异质性的生物学证据。三阴性癌被定义为不表达雌激素受体(ER)、孕激素受体(PR)HER2的基因的肿瘤。该亚组占据所有类型的乳腺癌的15%,在绝经前非洲和非裔美洲妇女中出现的乳腺癌中占更大比例。三阴性乳腺癌具有与雌激素受体阳性乳腺癌极不相同的复发模式:前3-5年的复发风险要高得多,但之后急剧下降并且显著低于雌激素受体阳性乳腺癌的复发风险。基底样亚型的特征在于ER和HER2基因簇的低表达,因此在临床测试中通常是ER-阴性的、PR-阴性的和HER2-阴性的;为此,其通常被称为"三阴性"乳腺癌(BreastcancerResearch2007,9(Suppl1):S13)。基底样癌症表达通常见于正常乳腺的“基底”/肌上皮细胞的基因,包括高分子量细胞角蛋白(5/6,14和17),P-钙粘蛋白,窖蛋白1和2,巢蛋白,αB结晶体和表皮生长因子受体(Reis-FihoJ.等人,http://www.uscap.org/site~/98th/pdf/companion03h03.pdf)。鉴于没有国际上接受的基底样乳腺癌的定义,因此关于三阴性与基底样乳腺癌是否同义,一直存在许多混淆就不足为怪了。尽管几个组已互换使用这些术语,但应当指出的是,并非所有基底样癌症缺乏ER、PR和HER2,并且并非所有三阴性癌症都显示基底样表型。绝大部分三阴性癌具有基底样表型。同样地,绝大部分表达‘基底’标志物的肿瘤是三阴性的。然而,应当指出,有大量三阴性癌症不表达基底标志物,有少量、但仍显著量的基底样癌症亚组表达激素受体或HER2。Bertucci等人(IntJCancer.2008Jul1;123(1):236-40)已直接解决了该问题,并且确认,并非所有通过基因表达谱表征分析的三阴性肿瘤被分类为基底样癌症(即仅71%具有基底样表型)以及并非所有通过表达阵列分类的基底样乳腺癌都显示三阴性表型(即77%)。当利用可能的辅助激素疗法(利用他莫昔芬或芳香酶抑制剂)、疗法疗法和/或放射疗法使肿瘤局部化时,治疗乳腺癌的基础是手术。目前,用于手术后治疗(辅助疗法)的建议遵照一个模式。这一模式会发生改变,因为每两年会在St.Gallen,Switzerland举行世界会议来讨论世界多中心研究的实际结果。同样地,按照国立卫生研究院(NIH)的共同标准来评论所述模式。基于这些标准,超过85-90%的在淋巴结中不具有转移的患者为接受辅助全身性疗法的候选者。目前,PCR测定例如OncotypeDX或微阵列测定例如MammaPrint可基于特定基因的表达来预测乳腺癌复发的风险。2007年2月,MammaPrint测定成为从食品和药物管理局获得正式授权中的首个乳腺癌指标。专利申请EP1961825-A1描述了用于预测乳腺癌向骨、肺、肝或脑转移的发生的方法,所述方法包括测定肿瘤组织样品中一个或多个标志物(其中包括c-MAF)相对于它们在对照样品中的对应表达水平的表达水平。然而,该文献要求同时测定数个基因,以使得能够确定乳腺癌患者的存活,并且基因标签(genesignature)用于预测无骨转移的存活能力之间的关系在统计上是不显著的。专利申请US2011/0150979描述了用于预测基底样乳腺癌的预后的方法,其包括检测FOXC1的水平。专利申请US2010/0210738涉及用于预后具有三阴性乳腺癌的受试者的癌症的方法,包括检测一系列被随机上调或下调的基因在样品中的表达水平。专利申请US2011/0130296涉及可用于三阴性乳腺癌的诊断和预后的标志基因的鉴定。存在对鉴定允许预测患有三阴性乳腺癌的受试者发生转移的可能性的新型标志物的需要。新型预后因子的鉴定可用作选择最适当的治疗的指导方针。发明概述在一个方面,本发明涉及用于预测三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌(包括luminalA和B)在患有所述癌症的受试者中发生骨转移的体外方法,所述方法包括:i)测定所述受试者的样品中c-MAF基因的表达水平,和ii)将步骤i)中获得的表达水平与参照值相比较,其中所述基因的表达水平相对于所述参照值升高表明发生骨转移的风险增加。在另一个方面,本发明涉及用于预测患有骨转移性三阴性(包括基底样)乳腺癌或可选择地骨转移性ER+乳腺癌的患者的临床结果的体外方法,所述方法包括i)定量所述受试者的样品中c-MAF基因的表达水平,和ii)将步骤i)中获得的表达水平与参照值相比较,其中所述基因的表达水平相对于所述参照值升高表明不良临床结果。在另一个方面,本发明涉及用于对患有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的受试者设计个体化治疗的体外方法,所述方法包括:i)定量所述受试者的样品中c-MAF基因表达水平,和ii)将i)中获得的表达水平与参照值相比较,其中如果表达水平相对于所述参照值升高,则所述受试者适宜于接受目的在于预防、抑制和/或治疗骨转移的疗法。在本方法的具体方面,给受试者施用至少一种预防、抑制和/或治疗骨转移的治疗性药物。如果表达水平相对于所述参照值未升高,则所述受试者不适宜于接受目的在于预防、抑制和/或治疗骨转移的疗法。在该方法的具体方面,不给受试者施用至少一种预防、抑制和/或治疗骨转移的治疗性药物。在另一个方面,本发明涉及用于测定患有乳腺癌例如三阴性乳腺癌或ER+乳腺癌的受试者发生骨转移的风险的方法,所述方法包括测定所述受试者的样品中c-MAF基因的表达水平,其中所述基因的表达水平高于平均值+1个标准差表示增加的早期骨转移的风险。在该方法的一个具体方面,随后给受试者施用至少一种预防或抑制骨转移的治疗性药物。在另一个方面,本发明涉及用于为患有发生骨转移的三阴性(包括基底样)乳腺癌或ER+乳腺癌的受试者设计个体化治疗的体外方法,其包括:i)定量所述受试者的骨转移样品中c-MAF基因表达水平,和ii)将步骤(i)中获得的表达水平与参照值相比较,其中如果c-MAF基因表达水平相对于所述参照值升高,则所述受试者适宜于接受预防骨退化的疗法。在该方法的一个特定方面,则给受试者施用至少一种预防、抑制和/或治疗骨转移的治疗性药物。如果c-MAF基因表达水平相对于所述参照值未升高,则所述受试者不适宜于接受预防骨退化的疗法。在该方法的一个特定方面,则不给受试者施用至少一种预防、抑制和/或治疗骨转移的治疗性药物。在另一个方面,本发明涉及用于对患有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的受试者中预测所述癌症的骨转移的体外方法,所述方法包括确定c-MAF基因在所述受试者的样品中相对于参照基因拷贝数是否被扩增,其中c-MAF基因相对于所述参照基因拷贝数的扩增表明发生骨转移的风险增加。在该方法的一个具体方面,则给受试者施用至少一种预防或抑制骨转移的治疗性药物。在另一个方面,本发明涉及用于预测乳腺癌例如三阴性乳腺癌或ER+乳腺癌在患有所述癌症的受试者中的骨转移的体外方法,所述方法包括确定c-MAF基因在所述受试者的样品中是否已易位,其中c-MAF基因的易位表明增加的发生骨转移的风险。在该方法的一个具体方面,则给受试者施用至少一种预防或抑制骨转移的治疗性药物。在另一个方面,本发明涉及用于预测患有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的患者的临床结果的体外方法,所述方法包括确定c-MAF基因在所述受试者的样品中相对于参照基因拷贝数是否被扩增,其中c-MAF基因相对于所述参照基因拷贝数的扩增表示不良临床结果。在该方法的一个具体方面,则给受试者施用至少一种预防、抑制和/或治疗骨转移的治疗性药物。如果未观察到这样的扩增,则不给受试者施用至少一种预防、抑制和/或治疗骨转移的治疗性药物。在另一个实施方案中,本发明涉及用于预测患有乳腺癌的患者的临床结果的体外方法,所述方法包括确定c-MAF基因在所述受试者的样品中是否易位,其中c-MAF基因的易位(即t(14,16))表示不良临床结果。在一些实施方案中,本发明涉及设计用于具有c-MAF的扩增或易位的患者的个体化治疗。在一些实施方案中,个体化治疗是至少一种预防、抑制和/或治疗骨转移的治疗性药物。在另一个方面,本发明涉及用于预防三阴性(包括基底样)乳腺癌或ER+乳腺癌的骨转移的c-MAF抑制剂。在另一个方面,本发明涉及c-MAF抑制剂或能够避免或预防骨退化的试剂,所述抑制剂或试剂用于治疗患有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌,并且在转移性样品中相对于对照样品具有升高的c-MAF水平的受试者的骨转移。在另一个方面,本发明涉及用于预测乳腺癌在患有所述癌症的受试者中骨转移的试剂盒,所述试剂盒包含:a)用于定量所述受试者的样品中c-MAF表达水平的装置;和b)用于比较所述样品的c-MAF定量表达水平与参照c-MAF表达水平的装置。在另一个方面,本发明涉及用于预测乳腺癌在患有所述癌症的受试者中骨转移的试剂盒:a)用于测定所述受试者的样品中c-MAF基因易位的装置;和b)用于比较所述样品与参照c-MAF样品的c-MAF易位的装置。本发明还涉及这样的试剂盒用于预测乳腺癌在患有所述癌症的受试者中骨转移的用途。在一个实施方案中,则基于使用试剂盒的结果给受试者施用至少一种预防、抑制和/或治疗骨转移的治疗性药物或不施用所述至少一种所述药物。在另一个方面,本发明涉及用于预测乳腺癌在患有所述癌症的受试者中骨转移的试剂盒,所述试剂盒包含:a)用于定量所述受试者的样品中c-MAF基因的扩增、16q23或16q22-24基因座的扩增或易位的装置;和b)用于比较所述样品与参照样品的c-MAF基因扩增水平、16q23或16q22-24基因座扩增或易位的装置。在另一个方面,本发明涉及用于预测患有乳腺癌的骨转移的受试者的临床结果的试剂盒,所述试剂盒包含:a)用于定量所述受试者的样品中c-MAF表达水平的装置;和b)用于比较所述样品中c-MAF的定量表达水平与参照c-MAF表达水平的装置。本发明还涉及这样的试剂盒用于预测患有乳腺癌的骨转移的受试者的临床结果的用途。在一个实施方案中,则基于使用所述试剂盒的结果给受试者施用至少一种预防、抑制和/或治疗骨转移的治疗性药物或不施用至少一种所述药物。在另一个方面,本发明涉及用于确定用于患有乳腺癌的受试者的疗法的试剂盒,所述试剂盒包含:a)用于定量所述受试者的样品中c-MAF表达水平的装置;b)用于比较所述样品的定量c-MAF表达水平与参照c-MAF表达水平的装置;和c)用于基于定量的表达水平与参照表达水平的比较来确定用于预防和/或减少所述受试者的骨转移的疗法的装置。本发明还涉及这样的试剂盒用于为患有乳腺癌的受试者确定疗法的用途。在一个实施方案中,则基于使用试剂盒的结果给受试者施用至少一种预防、抑制和/或治疗骨转移的治疗性药物或不施用至少一种所述药物。在另一个方面,本发明涉及试剂盒,所述试剂盒包含:i)用于定量患有乳腺癌的受试者的样品中c-MAF表达水平的试剂,和ii)一个或多个已被预先确定来与骨转移的风险相关联的c-MAF表达水平指数。本发明还涉及这样的试剂盒用于预测乳腺癌在患有所述癌症的受试者中骨转移的用途。在一个实施方案中,则基于使用试剂盒的结果给受试者施用至少一种预防、抑制和/或治疗骨转移的治疗性药物或不施用至少一种所述药物。在另一个方面,本发明涉及用于对患有乳腺癌的受试者的样品进行分型的体外方法,所述方法包括:a)提供来自所述受试者的样品;b)定量所述样品的c-MAF表达水平;c)通过比较定量的c-MAF表达水平与预先确定的参照c-MAF表达水平来对所述样品分型;其中所述分型提供了与所述受试者的骨转移的风险相关的预后信息。在一个实施方案中,基于通过分型提供的预后信息给受试者施用至少一种治疗性试剂或不施用至少一种所述治疗性试剂。在另一个方面,本发明涉及用于预防或降低患有三阴性(包括基底样)乳腺癌的受试者的骨转移风险的方法,所述方法包括给所述试剂盒施用预防或减少骨转移的试剂,其中按照通过定量所述受试者的c-MAF表达水平确定的治疗方案施用所述试剂。在另一个方面,本发明涉及将患有乳腺癌的受试者分类至组群中的方法,包括:a)测定所述受试者的样品的c-MAF表达水平;b)比较所述样品的c-MAF表达水平与预先确定的参照c-MAF表达水平;和c)基于样品中所述c-MAF表达水平将所述受试者分类至组群中。在一个具体方面,组群用于进行临床试验。附图概述图1:每一个分数的密度图。ESR1、ERBB2、PGR、LUMINAL、PROLIFERATION。图2:具有三阴性(triplenegative)乳腺癌的患者发生骨转移的时间的Kaplan-Meier图(p-值=0.04)。每一个图的组通过c-MAF的水平来定义。(-)、(uk)和(+)以下列方式表示c-MAF表达水平:(-)(<平均值-SD),(uk)(≥平均值-SD并且≤平均值+SD)和(+)(>平均值+SD)。SD代表标准差。图3.c-MAF(mRNA)为ER+乳腺癌的乳腺癌骨转移的临床生物标志物。ER+原发性乳腺癌患者(GSE2603、GSE2034和GSE12276数据组或组群I)的无骨(左)、脑(右上)和肺(右下)转移存活的Kaplan-Meier曲线。低、中和高以下列方式表示c-MAF表达水平:低(<平均值-SD)、中(≥平均值-SD和≤平均值+SD)和高(>平均值+SD)。已从脑和肺转移分析中除去了具有骨转移的患者。图4.c-MAF(蛋白)是乳腺癌骨转移的临床生物标志物。a)原发性乳腺癌组织的代表性c-MAF免疫染色。病例1代表c-MAF阴性肿瘤(OD<1000)。病例2和病例3为MAF阳性肿瘤(分别地OD>1000和>25000)。b)曲线图描述了380个原发性乳腺癌肿瘤的组群(组群II)的c-MAF蛋白表达(OD)。按照BC亚型(ER+、HER2+和TN)分离肿瘤。底部的灰色记号描述具有骨转移的肿瘤。OD光密度基于c-MAF免疫染色。c,d)380个原发性乳腺癌肿瘤的组群(I、II和III期)的无病存活(c)和无骨转移存活(d)的Kaplan-Meier曲线。高c-MAF组(红线,OD>1000);低c-MAF组(绿线,OD<1000)。e)描述不同BC亚型(ER+、HER2+和TN)中c-MAF的骨转移诊断性能的表。CI(置信区间);Se-灵敏度;Sp-特异度;PPV(阳性预后值);NPV(阴性预后值)。图5:c-MAF对乳腺癌细胞骨转移的贡献。a)将具有或不具有c-MAF(短和长同种型)表达的亲代MCF7细胞注射入小鼠的左心室,通过体内生物发光成像来分析骨定殖。显示了无骨转移存活的Kaplan-Meier曲线。对应于代表性骨的总光子流量、HandE染色和CT扫描的图像示于终点。b)将具有或不具有c-MAF(短和长同种型)表达的亲代T47D细胞注射入小鼠的左心室,通过体内生物发光成像分析骨定殖。显示了无骨转移存活的Kaplan-Meier曲线。c)将耗尽或恢复了c-MAF(组合地或独立地短和长同种型)的表达的BoM2骨转移MCF7细胞衍生物注射入小鼠的左心室,通过体内生物发光成像分析骨定殖。显示了无骨转移存活的Kaplan-Meier曲线。对应于代表性骨的总光子流量、HandE染色和CT扫描的图像示于终点。d)通过小鼠的尾静脉注射具有或不具有c-MAF(短和长同种型)表达的亲代MCF7细胞,通过体内生物发光成像分析肺定殖。显示了无肺转移存活的Kaplan-Meier曲线。通过Wilcoxon符号秩检验(Wilcoxonsigned-ranktest)测定统计差异。图6.MCF7亲代和骨转移衍生物BoM2的MAF水平。a)用对照、c-MAF短同种型、c-MAF长同种型或c-MAF短同种型和长同种型表达构建体(左)转染的亲代细胞以及BoM2对照、shMAF或拯救细胞(Rescuecell)BoM2细胞(右)的MAF表达水平。使用TaqMan探针测定MAF长同种型表达水平,将其针对Bo2M水平进行标准化。使用SyberGreen反应,利用指定的引物测定MAF短同种型内源水平,将其针对β肌动蛋白水平进行标准化。使用PCR反应检测异位表达的c-MAF短同种型的存在。b)描述过表达亲代对照、MAF短同种型和MAF长同种型(同时地)的细胞以及BoM2对照、shMAF或拯救BoM2细胞的c-MAF蛋白水平的WB。α-微管蛋白用作上样对照。c)a)和b)中描述的MCF7、BoM2与MAF-耗尽的BoM2之间的直接c-MAFmRNA和蛋白质表达比较。d)用对照、c-MAF短同种型、c-MAF长同种型或c.MAF短同种型和长同种型表达载体瞬时转染的亲代细胞的C-MARE(c-MAF应答元件)报道基因质粒的海肾活性。将C-MARE启动子的活性针对对照条件进行标准化并以任意单位显示。数据为3个独立实验的平均值加sd。图7.MAF驱动实验性乳腺癌转移小鼠模型的骨转移。(左)无骨转移存活的Kaplan-Meier曲线。将亲代对照和c-MAF短同种型和c-MAF长同种型过表达细胞注射入左心室,通过生物发光测定转移。(右)第0天和终点第54天的代表性生物发光图像,显示了每一个组的小鼠后肢的代表性CT扫描和骨转移的H&E染色。比例尺,100um。溶骨区-黄色虚线。(右)在终点第54天测量离体后肢的总光子通量,将其针对第0天进行标准化。通过比较用对照与同时(左)或分别地(右)用c-MAF短同种型和c-MAF长同种型表达载体转染的亲代细胞来计算P值。图8.c-MAF是乳腺癌至骨的转移的原因介质。显示了骨转移发展的生物发光成像曲线。将值针对第0天进行标准化。将对照、shMAF或拯救BoM2细胞注射入裸鼠的左心室。计算统计数据,仅包括复发骨转移的动物。图9.c-MAF触发乳腺癌骨转移病变的破骨细胞分化。a)溶骨性病变(通过X-RAY测量的)占骨病变(通过发光测量的)总数的百分比。将亲代、c-MAF短同种型、c-MAF长同种型和c-MAF短同种型和长同种型表达亲代细胞和BoM2骨转移性MCF7细胞衍生物注射入小鼠的左心室,通过体内生物发光成像分析骨定殖。b)使用来源于MCF7亲代细胞或过表达c-MAF同种型的任何同种型(短-短同种型和长-长同种型)的细胞的条件培养基进行的破骨细胞从小鼠骨髓衍生前体细胞的分化的测定。破骨细胞的数目通过TRAP技术来测量(>3个多核细胞(Multinucleatedcell))。c和d)来自利用亲代、c-MAF短同种型、c-MAF长同种型以及c-MAF短同种型和长同种型表达亲代细胞和BoM2骨转移性MCF7细胞衍生物心内注射的小鼠的代表性骨转移病变的TRAP染色。在来自4个独立小鼠的至少4个不同视野中计数沿骨肿瘤界面的TRAP阳性破骨细胞(紫色),并将其结合SD值作图。比例尺为50μM。通过双尾wilcoxon检验评价组间统计差异。图10.c-MAF不支持乳腺癌增殖皮下注射的图示。(上图)来自亲代对照或c-MAF短同种型和c-MAF长同种型(同时地)过表达细胞的皮下肿瘤的生长曲线。值代表平均值±sd。(下图)来自对照或c-MAF短同种型和c-MAF长同种型(同时地)过表达细胞的皮下肿瘤的Ki67-阳性细胞的百分比。对于每一个肿瘤,计算最少10个随机视野的Ki67-阳性细胞。值为平均值±sd。(n=4)图11:c-MAF下游的PTHLH促成和介导乳腺癌骨转移a)针对B2M表达水平标准化的亲代、c-MAF短同种型、c-MAF长同种型以及c-MAF短同种型和长同种型表达亲代细胞和BoM2骨转移性MCF7细胞衍生物的PTHLH相对表达水平。*p-值<0.05。b)根据GSE14020数据集的人乳腺癌转移中MAF的标准化表达对PTHLH的标准化表达的点图。红点描述骨转移,而黑点描述其它软组织转移。虚线描述转移样品的平均MAF或PTHLH表达。c)利用50:50破骨细胞分化培养基和条件培养基(CM)亲代细胞、c-MAF短同种型和长同种型表达亲代细胞以及BoM2骨转移性MCF7细胞衍生物,或在无CM的情况下用人PTHLH拮抗肽(7-34)(5μg/ml)处理的骨髓细胞,通过TRAP技术测量破骨细胞的数目(破骨细胞>3个多核细胞,通过白色箭头突出显示)并将其针对对照进行标准化。d)将利用荧光素酶基因标记的亲代、c-MAF短同种型和长同种型表达亲代细胞注射入小鼠的左心室,通过体内生物发光成像分析骨定殖。在实验过程中每日2次用或不用PTHLH拮抗肽(7-34)(腹膜内接种(6μg/动物)的)处理用c-MAF短同种型和长同种型表达亲代细胞注射的小鼠。曲线代表实验终点上离体总光子通量,其反映每个病变的转移细胞数目(左图框)。描述了溶骨性骨转移病变(右图框)。e)每组代表性溶骨性病变的X-射线(CT-扫描)图像。描述了不同组的沿着骨肿瘤界面的TRAP阳性破骨细胞(黑色,通过白色箭头突出显示)。在来自每一个独立小鼠的至少4个不同视野中计数来自病变的沿着骨肿瘤界面的TRAP阳性破骨细胞(黑色),将其加以SD值作图。比例尺寸为50μM。通过双尾wilcoxon检验评价组间统计差异。图12.通过Cox回归模型,利用四次样条(包装phenoTest中的smoothCoxph函数)获得的c-MAF表达与骨转移风险比之间的关系的估计。曲线对应于指定的组:c-MAF预测其c-MAF表达水平高于平均值(命名为0)的肿瘤(GSE2603、GSE2034和GSE12276数据集的联合,组I)的骨转移的能力的HR比和p-值。表达水平上的1表示随后1个标准差。图13.c-MAF表达和骨转移风险的测定。我们在验证组群II中测定到何种程度,c-MAF越高则骨复发的风险越大。我们利用免疫组织化学(IHC),通过使用上述计算机化系统测定染色的光密度来定量c-MAF表达(图4a,b)。基于两种类型的c-MAF阳性乳腺癌肿瘤,我们可将它们分成两组,因为它们具有双峰行为(左图框)。基于这两个分类,我们确认了以下观察结果:c-MAF的染色越高,则骨转移的风险越高(HR(骨转移)=19.45;p-值<0.001),以及骨转移发生越早(右图框)。图14.显示用于测试不同时间点上c-MAF和骨转移(GSE2603、GSE2034和GSE12276数据集的联合,组群I)的独立性的Fisher's精确检验结果的图。列联表和Fisher’s检验p-值的比例示于每一个图框中。图15.c-MAF过表达可因拷贝数变化而发生。a)基于基因表达的拷贝数变化分析(ACE算法)。阴影面积描述了与ER+乳腺癌肿瘤(GSE2603、GSE2034和GSE12276数据集的联合,组群)的复发显著相关的DNA基因组扩增。b)描述基于MAF基因拷贝(16q23)与IGH(14q32)基因拷贝之间比率的具有MAF基因扩增的亲代和BoM2骨转移性细胞的百分比的图框。FISH染色的亲代和BoM2细胞的代表性图像。c)对于染色体16,黑点和灰色水平线分别代表标准化的log2强度比和区段。在MCF7亲代细胞中比较BoM2。在底部,16q22-24DNA基因组扩增以灰色突出显示。图16.16q22-24基因组DNA区域的扩增与乳腺癌骨转移相关a和b)I、II和III期BC人原代肿瘤组(n=334)(组群II)的无骨转移(a)或总体(bt)存活的Kaplan-Meier曲线。使用每肿瘤3个核心,基于平均每细胞2.5个16q23拷贝的截止值将患者分成16q23FISH阴性和16q23FISH阳性组。Se-敏感度;Sp-特异度;HR-风险比。c)I、II和III期BC人原代肿瘤组(分别地n=250和n=43)(来自组群II)中的ER-阳性(左)或三阴性(右)患者的无骨转移存活的Kaplan-Meier曲线。使用每肿瘤3个核心,基于平均每细胞2.5个16q23拷贝的截止值将患者分成16q23FISH阴性和16q23FISH阳性组。HR-风险比。d,e)16q23扩增在全部乳腺癌(d)和ER+乳腺癌(e)中的诊断性能的接受者作用特征(ReceiverOperatingCharacteristic,ROC)曲线。在ROC曲线中,将真阳性率(灵敏度)针对不同截止点作为假阳性率(100-特异度)的函数作图。ROC曲线上的每一个点代表对应于特定判定阈的灵敏度/特异度对。发明详述一般术语和表达的定义如本文中所用,“用于避免或防止骨退化的试剂”是指任何能够通过刺激成骨细胞增殖或抑制破骨细胞增殖或修复骨结构来预防、抑制、治疗、减少或终止骨退化的分子。如本文中所用,术语“基因的扩增”是指籍以在个别细胞或细胞系中形成各种拷贝的基因或基因片段的过程。基因的拷贝不一定位于相同染色体中。复制的区域通常称为“扩增子”。通常地,产生的mRNA的量,即基因表达水平与特定基因的拷贝数成正比地升高。如本文中所用,术语"基底样"、"基底样亚型"、"基底样亚型的乳腺癌"等,如本文中所用,是指特定亚型的乳腺癌,其特征在于两个阴性受体ER和HER2以及由CK5/6、CK14、CK17和EGFR组成的组中的至少一个阳性受体。因此,引用和提及三阴性乳腺癌(ER、HER-2、PgR)的本申请中的所有句子也可引用和提及其中ER和HER2为阴性和其中CK5/6、CK14、CK17和EGFR的至少一个为阳性的基底样乳腺癌。或者,"基底样"也提及乳腺癌,其特征在于基于下列10个基因的上调和/或下调的基因表达特征谱:(1)叉头框CI(FOXC1);(2)黑素瘤抑制活性(MIA);(3)NDC80同源物,着丝粒复合物组分(KNTC2);(4)中心体蛋白55kDa(CEP55);(5)Anillin,肌动蛋白结合蛋白(ANLN);(6)母体胚胎性亮氨酸拉链激酶(MELK);(7)G蛋白偶联受体160(GPR160);(8)跨膜蛋白45B(TMEM45B);(9)雌激素受体1(ESR1);(10)叉头框Al(FOXA1)。因为用于将乳腺癌肿瘤分类为基底样亚型的基因表达特征谱不包括雌激素受体、孕激素受体或Her2,因此三阴性和非三阴性乳腺癌都可被分类为基底样亚型。如本文中所用,"三阴性乳腺癌"是指这样的乳腺癌,其特征在于缺乏ER和PR的可检测表达(优选当通过由M.ElizabethH等人,JournalofClinicalOncology,28(16):2784-2795,2010公开的方法进行ER和PR表达的测量时),并且肿瘤细胞的表皮生长因子受体2型(HER2或ErbB2)(通常位于细胞表面上的一种受体)未被扩增。如果通过使用标准免疫组织化学技术少于5%的肿瘤细胞核的ER和PR表达被染色,则肿瘤细胞被认为对于ER和PR的表达是阴性的。如本文中所用,如果当用HercepTestTM试剂盒(CodeK5204,DakoNorthAmerica,Inc.,Carpinteria,CA)(使用多克隆抗-HER2一抗的半定量免疫组织化学测定)测定时它们产生0或1+或2+的测试结果分数,或如果它们是HER2FISH阴性,则肿瘤细胞被认为对于HER2过表达是阴性的。如本文中所用,“c-MAF基因”(v-maf肌腱膜纤维肉瘤癌基因同源物(禽类)也称为MAF或MGC71685)为含有亮氨酸拉链的转录因子,其如同源二聚体或异源二聚体一样起作用。取决于DNA结合位点,编码的蛋白质可以是转录激活因子或转录阻遏因子。编码c-MAF的DNA序列在登录号NG_016440(SEQIDNO:1(基因组))下于NCBI数据库中进行了描述。c-MAF的编码序列示于SEQIDNO:13中。本发明的方法可利用编码序列或基因组DNA序列。从所述DNA序列转录两个信使RNA,其每一个产生两种c-MAF蛋白同种型(α同种型和β同种型)之一。每一个同种型的互补DNA序列分别在登录号NM_005360.4(SEQIDNO:2)和NM_001031804.2(SEQIDNO:3)下于NCBI数据库中进行了描述。如本文中所用,“c-MAF抑制剂”是指任何能够通过阻止所述基因的表达产物产生(中断c-MAF基因转录和/或阻断来自c-MAF基因表达的mRNA的翻译)和通过直接抑制c-MAF蛋白活性来完全或部分地抑制c-MAF基因表达的分子。C-MAF基因表达抑制剂可使用下述方法来鉴定,所述方法基于所谓的抑制剂阻断c-MAF促进体外细胞增殖的能力的能力(例如如国际专利申请WO2005/046731(将其完整内容通过引用并入本文)中显示的)的方法来鉴定,基于所谓的抑制剂阻断在细胞周期蛋白D2启动子或包含c-MAF应答区(MARE或c-MAF应答元件)的启动子控制下的报道基因在表达c-MAF的细胞中的转录能力的能力(例如WO2008098351(将其完整内容通过引用并入本文)中描述的),或基于所谓的抑制剂阻断在响应利用PMA/离子霉素的刺激的IL-4启动子控制下的报道基因在表达NFATc2和c-MAF的细胞中的表达的能力(例如在US2009048117A(将其完整内容通过引用并入本文)中描述的)。如本文中所用,雷帕霉素(mTOR)或"mTor"的哺乳动物靶是指对应于EC2.7.11.1的蛋白质。mTor酶是丝氨酸/苏氨酸蛋白激酶并且调节细胞增殖、细胞运动性、细胞生长、细胞存活和转录。如本文中所用,“mTor抑制剂”是指任何能够通过阻止所述基因的表达产物产生(中断mTor基因转录和/或阻断来自mTor基因表达的mRNA翻译)和通过直接抑制mTor蛋白活性来完全或部分抑制mTor基因表达的分子。包括具有两个或更多个靶(其中具有mTor蛋白活性)的抑制剂。如本文中所用,"Src"是指对应于EC2.7.10.2的蛋白质。Src是非受体酪氨酸激酶和原癌基因。Src可在细胞生长和胚胎发育中起作用。如本文中所用,“Src抑制剂”是指任何能够通过阻止所述基因的表达产物产生(中断Src基因转录和/或阻断来自Src基因表达的mRNA的翻译)和通过直接抑制Src蛋白活性来完全或部分地抑制Src基因表达的分子。如本文中所用,"前列腺素内过氧化物合酶2"、"加氧酶-2"或"COX-2"是指对应于EC1.14.99.1的蛋白。COX-2负责将花生四烯酸转化成前列腺素内过氧化物H2。如本文中所用,“COX-2抑制剂”是指任何能够通过阻止所述基因的表达产物产生(中断COX-2基因转录和/或阻断来自COX-2基因表达的mRNA的翻译)和通过直接抑制COX-2蛋白活性来完全或部分地抑制COX-2基因表达的分子。如本文中所用,"结果"或"临床结果"是指所得的病程和/或疾病进展,可以例如通过复发、直至复发的时期、转移、直至转移的时期、转移的数目、转移部位的数目和/或因疾病而导致的死亡来表征。例如,良好的临床结果包括治愈、复发的预防、转移的预防和/或固定时期内的存活(无复发),不良临床结果包括疾病进展、转移和/或固定时期内的死亡。如本文中所用,“ER+乳腺癌”被理解为其肿瘤细胞表达雌激素受体(ER)的乳腺癌。这使所述肿瘤对雌激素敏感,从而意味着雌激素使癌性乳腺肿瘤生长。相反地,“ER-乳腺癌”被理解为其肿瘤细胞不表达雌激素受体(ER)的乳腺癌。其中ER+乳腺癌包括luminalA和B亚型。如本文中所用,术语基因的"表达水平",是指受试者的样品中由所述基因产生的基因产物的可测量的量,其中基因产物可以是转录产物或翻译产物。因此,表达水平可与核酸基因产物例如mRNA或cDNA或多肽基因产物相关。表达水平来源于受试者的样品和/或参照样品,并且可以例如从头检测或对应于先前的测定。表达水平可以例如使用微阵列法、PCR法(例如qPCR)和/或基于抗体的方法来测定或测量,这对于本领域普通技术人员来说是已知的。如本文中所用,术语“基因拷贝数”是指细胞中核酸分子的拷贝数。基因拷贝数包括细胞的基因组(染色体)DNA中的基因拷贝数。在正常细胞(非肿瘤细胞)中,基因拷贝数通常是两个拷贝(染色体对的每一个成员存在一个拷贝)。基因拷贝数有时包括获自细胞群体的样品的一半基因拷贝数。当提及c-MAF基因水平时,“升高的表达水平”被理解为高于参照样品或对照样品中的c-MAF基因表达水平。不排除其它机制,该升高的水平可能是由基因或16q23或16q22-24染色体基因座扩增或易位引起的。具体地,当从患者分离的样品中的表达水平为参照或对照的至少约1.1倍、1.5倍、5倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍或更多倍时,样品被认为具有高c-MAF表达水平。如本文中所用,"探针”是指与特定目标核酸序列互补的寡核苷酸序列。在一些实施方案中,探针可特异于已知经历易位的染色体的区域。在一些实施方案中,探针具有特定标记或标签。在一些实施方案中,标签为荧光基团。在一些实施方案中,探针为其标记基于铂对核酸和蛋白质的稳定配位结合的DNA原位杂交探针。在一些实施方案中,探针是如美国专利申请12/067532和美国专利申请12/181,399(将所述美国专利申请通过引用整体并入本文)和Swennenhuis等人"Constructionofrepeat-freefluorescenceinsituhybridizationprobes"NucleicAcidsResearch40(3):e20(2012)中描述的。如本文中所用,"标签"或“标记”是指任何直接或间接地与探针结合,从而使得探针或待探测的位置能够被看到、被标记或另外地被捕获的物理分子。如本文中所用,"易位"是指染色体物质在染色体之间的不等量或等量的交换。在一些情况下,易位存在于同一染色体上。在一些情况下,易位存在于不同的染色体之间。易位以高频率在许多类型的癌症包括乳腺癌和白血病中发生。易位可以是初次相互易位(primaryreciprocaltranslocation)或更复杂的二次易位。存在几种牵涉免疫球蛋白重链(IgH)基因座的初次易位,这样的初次易位据信构成了许多癌症的触发事件。(Eychène,A.,Rocques,N.和Puoponnot,C.,AnewMAFiaincancer.2008.NatureReviews:Cancer.8:683-693)。如本文中所用,"多倍体"或"多倍性"表示细胞包含超过2个拷贝的目标基因。在一些情况下,目标基因为MAF。在一些实施方案中,多倍性与目标基因表达的积累相关。在一些实施方案中,多倍性与基因组不稳定性相关。在一些实施方案中,基因组不稳定性可导致染色体易位。如本文中所用,"全基因组测序"是籍以在单一时间上对生物体的整个基因组进行测序的过程。参见,例如,Ng.,P.C.和Kirkness,E.F.,WholeGenomeSequencing.2010.MethodsinMolecularBiology.628:215-226。如本文中所用,"外显子测序"是籍以对生物体的DNA的完整编码区进行测序的过程。在外显子测序中,对mRNA进行测序。基因组的非翻译区不包括在外显子测序中。参见,例如,Choi,M.等人,GeneticdiagnosisbywholeexomecaptureandmassivelyparallelDNAsequencing.2009.PNAS.106(45):19096–19101。如本文中所用,“转移”被理解为癌症从其起始的器官至不同器官的传播。其通常通过血液或淋巴系统发生。当癌细胞扩散并形成新肿瘤时,后者称为继发性或转移性肿瘤。形成继发性肿瘤的癌细胞与原始肿瘤的细胞相同。如果乳腺癌例如扩散(转移)至肺,则继发性肿瘤由恶性乳腺癌细胞形成。肺中的该疾病是转移性乳腺癌而不是肺癌。在本发明方法的一个具体实施方案中,转移是三阴性乳腺癌,或可选择地是已扩散(转移)至骨的ER+乳腺癌(包括luminalA型和B型)。如本文中所用,“预测”是指确定患有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的受试者将发生至远端器官的转移的可能性。如本文中所用,"良好预后"表示预期(例如预测)受试者存活和/或在规定的时期内无复发或远端转移,或处于在规定的时期内发生复发或远端转移的低风险中。术语"低"是相对术语,在本说明的上下文中,是指关于临床结果(复发、远端转移等)的“低”表达组的风险。"低"风险可被当作比异质性癌症患者群体的平均风险更低的风险。在Paik等人(2004)的研究中,复发的总体"低"风险被认为低于15%。风险还可以时间的函数变化。时期可以为例如癌症初始诊断后或在进行预后的5年、10年、15年或甚至20年。如本文中所用,"不良预后"表示预期例如预测受试者在规定的时间内不能存活和/或发生复发或远端转移,或处于发生复发或远端转移的高风险中。术语"高"是相对术玉器,在本申请的上下文中,是指关于临床结果(复发、远端转移等)的"高"表达组的风险。"高"风险可被视为比异质性癌症患者群体的平均风险更高的风险。在Paik等人(2004)的研究中,复发的总体"高"风险被认为高于15%。风险也可作为时间的函数变化。时期可以为例如癌症初始诊断后或完成预后后5年、10年、15年或甚至20年。如本文中所用,“参照值”是指用作通过患者或从患者收集的样品的实验室检查获得的值/数据的参照的实验室值。参照值或参照水平可以是绝对值;相对值;具有上限和/或下限的值;值的范围;平均值;中位值、平均值或与特定对照或基线值相比较的值。参照值可基于个别样品值,例如,获自被测试的受试者样品的值(但在更早时间点上)。参照值可基于大量样品(例如来自一群时间年龄相仿的组的受试者),或基于包括或不排除待测试样品的样品混合物。如本文中所用,“受试者”或“患者”是指分类为哺乳动物的所有动物,包括但不限于家养动物和农场动物、灵长类动物和人,例如人类、非人灵长类动物、牛、马、猪、绵羊、山羊、狗、猫或啮齿类动物。优选,受试者为任何年龄或种族的男人或女人。如本文中所用,术语“治疗”是指任何类型的疗法,其目的在于终止、预防、改善或减小对本文中描述的临床结果的易感性。在优选实施方案中,术语治疗涉及本文中定义的障碍或病况的预防性治疗(即减小对临床病况的易感性的疗法)。因此,“治疗”、“医治”以及它们的等同术语是指获得期望的药理学或生理学效应,包括哺乳动物(包括人)的病理状态或病症的任何治疗。所述效应就完全或部分防止病症或其症状而言可以是预防性的,和/或就病症和/或可归因于病症的有害作用的部分或完全治愈而言可以是治疗性。即,“治疗”包括(1)预防受试者的病症发生或复发,(2)抑制病症,例如阻止其发展,(3)停止或终止障碍或至少与其相关的症状,以便宿主不再遭受障碍或其症状折磨,例如通过恢复或修复丢失、丧失或有缺陷的功能,或刺激无效过程而引起障碍或其症状的消退,或(4)缓解、减轻或改善障碍或与其相关的症状,其中改善以广义使用来指至少是参数例如炎症、疼痛或免疫缺陷的量值的减少。如本文中所用,"样品"或"生物样品"意指从受试者分离的生物材料。生物样品可包含任何适合用于测定c-MAF基因的表达水平的生物材料。可从任何适当的生物组织或流体例如肿瘤组织、血液、血浆、血清、尿或脑脊髓液(CSF)分离样品。“肿瘤组织样品”被理解为源自原发性三阴性(包括基底样)乳腺癌肿瘤,或可选择地源自ER+乳腺癌肿瘤的组织样品。所述样品可通过常规方法,例如活组织检查,使用相关医学
技术领域:
中的技术人员公知的方法来获得。“溶骨性骨转移”是指这样一种类型的转移,在该转移中骨吸收(骨密度的进行性丢失)在因肿瘤细胞对破骨细胞活性的刺激而引起的转移的附近产生,并且特征在于严重疼痛、病理性骨折、高钙血症、脊髓压迫症和因神经压迫而引起的其它综合症。用于基于c-MAF的表达水平预测三阴性(包括基底样)乳腺癌或ER+乳腺癌的骨转移的方法令人惊讶地发现三阴性(包括基底样)乳腺癌的样品和ER+乳腺癌的样品的c-MAF表达水平与患骨转移的风险相关。此外,三阴性(包括基底样)原发性肿瘤和ER+原代肿瘤中c-MAF的基因表达与骨转移复发显著相关,并且与无骨转移存活和存活负相关。此外,已发现c-MAF表达水平以剂量依赖性方式预测骨转移。在第一方面,本发明涉及用于预测三阴性(包括基底样)乳腺癌或ER+乳腺癌在患有所述癌症的受试者中的骨转移的体外方法(在下文中为本发明的第一方法),其包括:i)测定所述受试者的样品的c-MAF基因的表达水平,和ii)将步骤i)中获得的表达水平与参照值相比较,其中所述基因的表达水平相对于所述参照值升高表示增加的发生骨转移的风险。本发明的方法包括在第一步骤中测定受试者的样品中c-MAF基因表达水平。在一个优选实施方案中,样品为肿瘤组织样品。用于获得活检样品的方法包括将肿瘤分成大的碎片,或显微切割,或本领域已知的其它细胞分离法。肿瘤细胞可另外地通过细胞学法,通过用小规针抽吸来获得。为了简化样品保存和处理,可将样品在福尔马林中固定并浸渍在石蜡中,或首先冷冻,随后通过浸没在允许快速冷冻的高致冷介质中来浸渍在组织冷冻介质例如OCT化合物中。在一个优选实施方案中,本发明的第一方法包括仅定量c-MAF基因表达水平(作为单一标志),即该方法不包括测定任何另外的标志的表达水平。如本领域普通技术人员所理解的,基因表达水平可通过测量所述基因的信使RNA水平或由所述基因编码的蛋白质的水平,以及包含所述基因的基因组区域拷贝或易位的数目来进行定量。为此,可处理生物样品以物理地或机械地破碎组织或细胞结构,从而将细胞内组分释放至水溶液或有机溶液中以制备核酸。通过本领域普通技术人员已知的商购可得的方法(Sambrook,J.,等人,“Molecularcloning:aLaboratoryManual”,第3版,ColdSpringHarborLaboratoryPress,N.Y.,第1-3卷.)来提取核酸。因此,可从因所述基因的转录而产生的RNA(信使RNA或mRNA)或可选择地从所述基因的互补DNA(cDNA)定量c-MAF基因表达水平。因此,在本发明的一个具体实施方案中,c-MAF基因表达水平的定量包括c-MAF基因的信使RNA或所述mRNA的片段、c-MAF基因的互补DNA或所述cDNA的片段或其混合物的定量。实际上,任何常规方法可在本发明的范围内用于检测和定量由c-MAF基因编码的mRNA水平或其对应的cDNA水平。以非限定性实例为例,由所述基因编码的mRNA水平可使用常规方法,例如包括mRNA扩增和所述mRNA扩增产物的定量的方法,例如电泳和染色,或可选择地通过Southern印迹及使用适当的探针、Northern印迹及使用目标基因(c-MAF)的mRNA或其对应cDNA的特异性探针、S1核酸酶作图、RT-PCR、杂交、微阵列等,优选通过使用适当的标志的实时定量PCR来定量。同样地,对应于由c-MAF基因编码的所述mRNA的cDNA水平还可通过使用常规技术来定量;在该情况下,本发明的方法包括通过对应mRNA的逆转录(RT)合成对应cDNA,随后扩增和定量所述cDNA扩增产物的步骤。用于定量表达水平的常规方法可见于例如Sambrook等人,2001.(上文中引用的)。这些方法在本领域中是已知的,本领域普通技术人员熟悉每一个技术所必需的标准化。例如,使用多重PCR产生的表达测量应当通过将待测量的基因的表达与所谓的"管家"基因(所述管家基因的表达在所有样品中应当是恒定的,从而提供要比较的基线表达)或已知受癌症调节的其它对照基因相比较来进行标准化。在一个具体实施方案中,c-MAF基因表达水平通过定量聚合酶链式反应(PCR)或DNA/RNA阵列或核苷酸杂交技术来定量。此外,c-MAF基因表达水平还可通过扩增由所述基因编码的蛋白质即c-MAF蛋白(c-MAF)[NCBI,登录号O75444],或c-MAF蛋白的任何功能上等同的变体的表达水平来定量。存在两种c-MAF蛋白同种型,由403个氨基酸组成的α同种型(NCBI,NP_005351.2)(SEQIDNO:4)和由373个氨基酸组成的β同种型(NCBI,NP_001026974.1)(SEQIDNO:5)。c-MAF基因表达水平可通过定量任一c-MAF蛋白同种型的表达水平来定量。因此,在一个具体实施方案中,由c-MAF基因编码的蛋白质的水平的定量包括c-MAF蛋白的定量。在本发明的说明书中,“c-MAF蛋白的功能上等同的变体”被理解为(i)其中一个或多个氨基酸残基被保守或非保守氨基酸残基(优选地保守氨基酸残基)置换的c-MAF蛋白(SEQIDNO:4或SEQIDNO:5)的变体,其中这样的置换的氨基酸残基可以是或可以不是由遗传密码编码的氨基酸残基,或(ii)包含一个或多个氨基酸的插入或缺失并且具有与c-MAF蛋白相同的功能(即用作DNA结合转录因子)的变体。c-MAF蛋白的变体可使用如下方法来鉴定,所述方法基于c-MAF促进体外细胞增殖的能力(如国际专利申请WO2005/046731(将其通过引用整体并入本文)中显示的),基于所谓抑制剂阻断在细胞周期蛋白D2启动子或包含c-MAF应答区(MARE或c-MAF应答元件)的启动子的控制下的报道基因在表达c-MAF的细胞中的转录能力的能力(如WO2008098351(将其通过引用整体并入本文)中描述的),或基于所谓的抑制剂在表达NFATc2和c-MAF的细胞中阻断在响应利用PMA/离子霉素的刺激的IL-4启动子控制下的报道基因表达的能力(如US2009048117A(将其通过引用整体并入本文)中描述的)。根据本发明的变体优选与任一c-MAF蛋白同种型(SEQIDNO:4或SEQIDNO:5)的氨基酸序列具有至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%或至少约99%的序列相似性。变体与先前定义的特定c-MAF蛋白序列之间的相似性的程度使用本领域普通技术人员公知的算法和计算机处理来测定。两个氨基酸序列之间的相似性优选使用BLASTP算法[BLASTManual,Altschul,S.,等人,NCBINLMNIHBethesda,Md.20894,Altschul,S.,等人,J.Mol.Biol.215:403-410(1990)]来测定。c-MAF蛋白表达水平可通过任何常规方法来定量,所述方法允许检测和定量受试者的样品的所述蛋白。以非限定性实例为例,所述蛋白质水平可以例如通过使用具有c-MAF结合能力的抗体(或包含抗原决定簇的其片段)和随后定量形成的复合物来进行定量。用于这些测定的抗体可被标记或可不被标记。可使用的标志的说明性实例包括放射性同位素、酶、荧光基团、化学发光试剂、酶底物或辅因子、酶抑制剂、颗粒、染料等。存在广泛的可用于本发明的已知测定,所述测定使用未标记的抗体(一抗)和标记抗体(二抗);这些技术包括Western-blot或Western转移、ELISA(酶联免疫吸附测定)、RIA(放射免疫测定)、竞争性EIA(竞争性酶免疫测定)、DAS-ELISA(双抗体夹心ELISA)、免疫细胞化学和免疫组织化学技术、基于蛋白质微阵列或生物芯片(包含特定抗体)的使用的技术或基于形式例如试纸条(dipsticks)中胶体沉淀的测定。用于检测和定量所述c-MAF蛋白的其它方式包括亲和层析技术、配体结合测定等。当使用免疫法时,已知以高亲和力结合c-MAF蛋白的任何抗体或试剂可用于检测其量。然而,抗体例如多克隆血清、杂交瘤的上清液或单克隆抗体、抗体片段、Fv、Fab、Fab’和F(ab’)2、scFv、人源化双链抗体、三链价抗体、四链抗体、纳米抗体、alphabody、装订肽(stapledpeptide)、环肽和抗体的使用是优选的。市场上存在可用于在本发明说明书的商业化c-MAF蛋白抗体,例如抗体ab427、ab55502、ab55502、ab72584、ab76817、ab77071(Abcamplc,330SciencePark,CambridgeCB40FL,UnitedKingdom)、AbDSerotec的O75444单克隆抗体(MouseAnti-HumanMAFAzidefreeMonoclonalantibody,Unconjugated,Clone6b8)等。存在许多提供抗c-MAF抗体的商业公司,例如AbnovaCorporation,BethylLaboratories,SantaCruzBiotechnology,BioworldTechnology,GeneTex等。在一个具体实施方案中,通过western印迹、ELISA或蛋白质阵列定量c-MAF蛋白。在另一个具体实施方案中,从外体(exosome)或循环DNA定量c-MAF蛋白水平。外体为由大多数细胞类型在体内和体外分泌的40-100nm膜小囊泡。外体通过向内出芽至区室的腔中,在特定的一群称为多泡体(MVB)的内含体中形成。在MVB与质膜融合后,这些内部小囊泡被分泌。可通过几个本领域公知的方法(ThéryC.等人,CurrProtocCellBiol.2006Apr;Chapter3:Unit3.22)(将其完整内容通过引用并入本文)从不同的细胞系或体液分离外体。几种商业试剂盒可获得用于分离外体,例如ExoQuickTM或ExoTestTM。本发明的第一方法包括在第二步骤中将受试者的样品(例如,肿瘤样品)中获得的c-MAF基因表达水平与参照值相比较。在测量了具有乳腺癌例如三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的受试者的样品的c-MAF基因表达水平并将其与参照值相比较后,如果所述基因的表达水平相对于所述参照值升高,则可得出所述受试者具有更大的发生骨转移倾向的结论。必须使c-MAF基因表达水平的测定与参照值发生关联。在一个实施方案中,本文中预定的参照值可传达c-MAF的绝对量。在另一个实施方案中,可直接相对于参照值(例如,在增加或减少,或倍数增加或倍数减少方面)来测定被测试的受试者的样品中任一个或多个生物标志的量。有利地,这可允许将受试者的样品中任一个或多个生物标志的量与参照值相比较(换句话说测量受试者的样品的任一个或多个生物标志相对于参照值的相对量)而无需首先测定所述一个或多个生物标志的各自绝对量。在一个优选实施方案中,参照值为对照样品或参照样品的c-MAF基因表达水平。取决于待分析的肿瘤的类型,对照或参照样品的确切性质可变化。因此,如果要评价预后,则参照样品为来自具有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的受试者的样品,所述受试者的癌症未转移,或者对应于在具有未转移的三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的受试者的活检样品中肿瘤组织标本内测量的c-MAF基因表达水平的中位值。所述参照样品通常通过组合等量的受试者群体的样品来获得。通常地,典型参照样品获自在临床上被良好记录的并且其中转移的不存在被良好表征的受试者。在这样的样品中,可以例如通过提供整个参照群体的平均浓度来测定生物标志(c-MAF基因)的标准浓度(参照浓度)。当测定标志的参照浓度时考虑各种因素。这样的考虑包括患者的年龄、体重、性别、一般身体健康状况等。例如,将等量的一组至少约2个、至少约10个、至少约100至优选超过约1000个(优选根据前述考虑,例如根据不同年龄类型分类)的受试者用作参照组。参照水平所源自的样品集合优选由患有与研究的患者对象相同的类型的癌症的受试者形成。在一个具体实施方案中,c-MAF表达的“增加的”或“减少的”表达的参照值通过利用常规方法计算c-MAF表达水平的百分位数来测定,所述常规方法包括在一个或数个从其疾病通过上述任何方法良好记录的受试者分离的样品中进行测定。c-MAF的“降低的”水平则可优选被赋予这样的样品,在所述样品中c-MAF表达水平等于或低于正常群体的第50百分位数,包括例如等于或低于正常群体的第60百分位数,等于或低于正常群体的第70百分位数,等于或低于正常群体的第80百分位数,等于或低于正常群体的第90百分位数,等于或低于正常群体的第95百分位数的表达水平。“升高的”c-MAF基因表达水平则可优选被赋予这样的样品,在所述样品中c-MAF基因表达水平等于或高于正常群体的第50百分位数,包括例如等于或高于正常群体的第60百分位数,等于或高于正常群体的第70百分位数,等于或高于正常群体的第80百分位数,等于或高于正常群体的第90百分位数,等于或高于正常群体的第95百分位数的表达水平。本领域普通技术人员将理解预测原代乳腺肿瘤发生转移的倾向不需要针对所有待鉴定的受试者(即,针对100%的受试者)都是正确的。然而,该术语要求能够鉴定统计上显著部分的受试者(例如,组群研究中的组群)。一个部分是否是统计上显著的可由本领域普通技术人员使用各种公知的统计评价工具,例如置信区间的确定、p值的确定、Student'sT检验、Mann-Whitney检验等来以简单的方式确定。细节提供于Dowdy和Wearden,StatisticsforResearch,JohnWileyandSons,NewYork1983中。优选置信区间为至少90%、至少95%、至少97%、至少98%或至少99%。P值优选为0.1、0.05、0.01、0.005或0.0001。更优选,群体中至少60%、至少70%、至少80%或至少90%的受试者可适合通过本发明的方法来鉴定。在另一个实施方案中,至骨的转移为溶骨性骨转移。在另一个实施方案中,c-MAF的表达水平高于平均值表示增加的骨转移的风险,即所述风险与c-MAF表达水平呈正比。因此,患有乳腺癌的受试者的骨转移风险是剂量依赖性的。用于基于c-MAF的表达水平预测患有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌骨转移的患者的临床结果的方法在另一个方面,本发明涉及用于预测患有骨转移性三阴性(包括基底样)乳腺癌或可选择地骨转移性ER+骨癌的患者的临床结果的体外方法(在下文中为本发明的第二方法),其包括:i)定量所述受试者的样品中c-MAF基因的表达水平和ii)将步骤i)中获得的表达水平与参照值相比较,其中所述基因的表达水平相对于所述参数值升高表示不良临床结果。本发明的第二方法包括在第一步骤中定量患有三阴性(包括基底样)乳腺癌或或选择地ER+乳腺癌的受试者的样品中c-MAF基因表达水平。在一个优选实施方案中,样品为肿瘤组织样品。在优选实施方案中,本发明的第二方法包括仅定量作为单一标志的c-MAF基因表达水平,即,该方法不包括测定任何另外的标志的表达水平。在第二步骤中,将受试者的肿瘤样品中获得的c-MAF基因表达水平与参照值相比较。在一个优选实施方案中,参照值为所述基因在对照样品中的表达水平。必须使c-MAF基因表达水平的测定与对照样品或参照样品的值发生关联。取决于待分析的肿瘤的类型,对照样品的确切性质可变化。因此,在牵涉本发明的第二方法的情况下,参照样品为具有乳腺癌、但未发生骨转移的受试者的样品,或对应于在未患有转移的乳腺癌受试者的活检样品中肿瘤组织标本内测量的c-MAF基因表达水平的中位值。在测量样品的c-MAF基因表达水平并将其与对照样品相比较后,如果所述基因的表达水平相对于对照样品中的其表达水平升高,则这表明不良的临床结果。在一个具体实施方案,骨转移是溶骨性转移。在另一个特定实施方案中,c-MAF基因表达水平的定量包括定量所述基因的信使RNA(mRNA)或所述mRNA的片段、所述基因的互补DNA(cDNA)或所述cDNA的片段。在一个更优选实施方案中,表达水平通过定量聚合酶链式反应(PCR)或DNA或RNA阵列来定量。在另一个实施方案中,c-MAF基因表达水平的定量包括定量由所述基因编码的蛋白质或其变体的水平。在一个更优选实施方案中,通过Western印迹、免疫组织化学、ELISA或蛋白质阵列来测定蛋白质水平。在另一个实施方案中,参照样品为来自未患有转移的受试者的三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的肿瘤组织样品。被广泛地接受用于测定患者的临床结果的任何参数可用于本发明,包括但不限于:无病进展,如本文中所用,其描述在进行研究期间没有疾病复发、处于完全缓解的受试者的比例。无病存活(DFS),如同此使用的,被理解为疾病治疗后的时间长度,其间受试者无疾病体征地存活着。客观反应,如本发明中使用的,其描述在其中观察到完全或部分反应的被治疗的受试者的比例。肿瘤控制,如本发明中使用的,其指在其中观察到完全反应、部分反应、少量反应或≥6个月的稳定疾病的被治疗受试者的比例。无进展存活,如本文中所用,其被定义为从治疗开始至首次测量到癌症生长的时间。发生进展的时间(TTP),如本文中所用,其指疾病被治疗后直至疾病开始恶化的时间。术语“进展”先前已进行了定义。6个月无进展存活或“PFS6”率,如本文中所用,其指在治疗开始后前6个月中无进展的受试者的百分比,和存活期中位数,如本文中所用,其指一半参加研究的受试者仍然存活的时间。如本文中所用,术语“不良”或“良好”是指这样的临床结果,意指受试者将显示有利的或不利的结果。如本领域普通技术人员将理解的,这样的可能性的评估,可以不用针对100%的待诊断受试者是正确的,尽管这样是优选的。然而,该术语要求统计上显著部分的受试者可被鉴定为具有对于给定的结果的倾向。一个部分在统计上是否显著可由本领域普通技术人员使用各种公知的统计评价工具,例如置信区间的确定、p-值确定、Student'st-检验、Mann-Whitney检验等来容易地确定。细节见于Dowdy和Wearden,StatisticsforResearch,JohnWiley&Sons,NewYork1983中。优选置信区间为至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%。p-值优选为0.05、0.01、0.005或0.0001或更少。更优选地,受试者群体的至少约60%、至少约70%、至少约80%或至少约90%可通过本发明的方法来适当地鉴定。用于设计具有三阴性(包括基底样)乳腺肿瘤或可选择地ER+乳腺肿瘤或Src响应特征+或HER2+乳腺肿瘤的患者的个体化治疗的方法如在现有技术水平上是已知的,待给患有癌症的受试者施用的治疗取决于后者是否是恶性肿瘤,即其是否具有高的经历转移的可能性,或后者是否是良性肿瘤。在第一种假定中,选择的治疗是全身性治疗例如化学疗法,在第二种假定中,选择的治疗是局部治疗例如放射疗法。因此,如本申请中所描述的,鉴于c-MAF基因在三阴性(包括基底样)乳腺癌细胞或可选择地ER+乳腺癌细胞中的过表达与骨转移的存在相关,因此,c-MAF基因的表达水平可用于为患有所述癌症的受试者确定最适合疗法。因此,在另一个方面,本发明涉及用于设计用于患有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的受试者的个体化治疗的体外方法(在下文中为本发明的第三方法),所述方法包括:i)定量所述受试者的样品的c-MAF基因表达水平,和ii)将i)中获得的表达水平与参照值比较,其中如果表达水平相对于所述参照值升高,则所述受试者适宜于接受目标在于预防和/或治疗骨转移的疗法。如果表达水平相对于所述参照值未升高,则所述受试者不适宜于接受目标在于预防和/或治疗骨转移的疗法。在一个具体实施方案中,骨转移是溶骨性转移。本发明的第三方法包括在第一步骤中定量患有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的受试者的样品的c-MAF基因表达水平。在一个优选实施方案中,样品为肿瘤组织样品。在另一个具体实施方案中,本发明的第三方法包括仅定量作为单一标志的c-MAF基因表达水平,即,该方法不包括测定任何另外的标志的表达水平。在本发明的第三方法的情况下,样品可以是受试者的原发性肿瘤组织样品。在第二步骤中,将受试者的肿瘤样品中获得的c-MAF基因表达水平与参照值比较。在一个优选实施方案中,参照值为所述基因在对照样品中的c-MAF基因表达水平。必须使c-MAF基因表达水平的测定与对照样品或参照样品的值发生关联。取决于待分析的肿瘤的类型,对照样品的确切性质可变化。因此,优选地参照样品为具有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的、未发生转移的受试者的样品,或对应于在具有未转移的三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的受试者的活检样品中肿瘤组织标本内测量的c-MAF基因表达水平的中位值。在已测量样品的c-MAF基因表达水平并将其与参照值比较后,如果所述基因的表达水平相对于参照值升高,则可得出所述受试者适宜于接受目的在于预防(如果受试者还未经历转移的话)和/或治疗转移(如果受试者已经历转移的话)的疗法。当癌症已转移时,可使用全身性治疗,包括但不限于化学疗法、激素治疗、免疫疗法或其组合。此外,可使用放射疗法和/或手术。治疗的选择通常取决于原发性癌症的类型、尺寸、转移的位置、患者的年龄、一般健康状况和先前使用的治疗的类型。全身性治疗是到达整个身体的那些治疗,例如:化学疗法是使用药物破坏癌细胞。通常通过口服或静脉内途径施用药物。有时,将化学疗法与放射疗法一起使用。乳腺癌的适当化学疗法性治疗包括但不限于蒽环类(多柔比星、表柔比星、PEG化脂质体多柔比星)、紫杉烷类(紫杉醇、多西他赛、白蛋白纳米颗粒结合的紫杉醇)、5-氟尿嘧啶(连续输注5-FU、卡培他滨)、长春花生物碱类(长春瑞滨、长春碱)、吉西他滨、铂盐(顺铂、卡铂)、环磷酰胺、依托泊苷以及上述试剂的一种或多种的组合,例如环磷酰胺/蒽环类+/-5-氟尿嘧啶方案(例如多柔比星/环磷酰胺(AC)、表柔比星/环磷酰胺、(EC)环磷酰胺/表柔比星/5-氟尿嘧啶(CEF)、环磷酰胺/多柔比星/5-氟尿嘧啶(CAF)、5-氟尿嘧啶/表柔比星/环磷酰胺(FEC))、环磷酰胺/甲氨蝶呤/5-氟尿嘧啶(CMF)、蒽环类/紫杉烷类(例如多柔比星/紫杉醇或多柔比星/多西他赛)、多西他赛/卡培他滨、吉西他滨/紫杉醇、紫杉烷/铂方案(例如紫杉醇/卡铂或多西他赛/卡铂)。免疫疗法是帮助患者的免疫系统本身抵抗癌症的治疗。存在几个类型的用于治疗患者的转移的免疫疗法。这些免疫疗法包括但不限于细胞因子、单克隆抗体和抗肿瘤疫苗。在另一个方面,治疗是Alpharadin(二氯化镭223)。Alpharadin使用来自镭-223衰变的α辐射来杀死癌细胞。镭-223通过其作为钙模拟物的性质天然地自我靶向骨转移。α辐射具有2-10个细胞的极短的射程(当与基于β或γ辐射的目前放射疗法相比较时),从而引起更少的对周围健康组织(特别地骨髓)的损伤。由于与钙相似的性质,镭-223被吸至其中使用钙来在体内构建骨的地方,包括更快的异常骨生长(例如在具有晚期去势抵抗性前列腺癌的男人的骨转移中看到的)的部位。镭-223在注射后于血流中被运送至异常骨生长的部位。癌症在体内开始的地方称为原发性肿瘤。这些细胞的一些可脱离并且于血流中被运送至身体的另一个部位。随后癌细胞可定居在身体的该部分,形成新的肿瘤。如果这发生,其称为继发性癌症或转移。大多数晚期前列腺癌患者在他们的骨中遭受最大疾病负担。利用镭-223的目的是选择性靶向该继发性癌症。骨中未被吸收的任何镭-223快速经过肠并被排泄掉。在另一个方面,治疗为mTor抑制剂。在一些方面,mTor抑制剂是双重mTor/PI3激酶抑制剂。在一些方面,mTor抑制剂用于预防或抑制转移。在一些方面,mTor抑制剂选自:ABI009(西罗莫司)、雷帕霉素(西罗莫司)、Abraxane(紫杉醇)、Absorb(依维莫司)、Afinitor(依维莫司)、AfinitorwithGleevec、AS703026(pimasertib)、Axxess(佐他莫司)、AZD2014、BEZ235、Biofreedom(佐他莫司)、BioMatrix(佐他莫司)、BioMatrixflex(佐他莫司)、CC115、CC223、ComboBio-engineeredSirolimusElutingStentORBUSNEICH(西罗莫司)、CuraxinCBLC102(米帕林)、DE109(西罗莫司)、DS3078、EndeavorDES(唑罗莫司)、EndeavorResolute(唑罗莫司)、Femara(来曲唑)、Hocena(安卓奎诺尔)、INK128、Inspiron(西罗莫司)、IPI504(盐酸瑞螺旋霉素)、KRN951(tivozanib)、ME344、MGA031(替利珠单抗)、MiStentSES(西罗莫司)、MKC1、Nobori(佐他莫司)、OSI027、OVI123(蛹虫草菌素)、Palomid529、PF04691502、PromusElement(依维莫司)、PWT33597、Rapamune(西罗莫司)、ResoluteDES(唑罗莫司)、RG7422、SAR245409、SF1126、SGN75(vorsetuzumabmafodotin)、Synergy(依维莫司)、Taltorvic(地磷莫司)、Tarceva(埃罗替尼)、Torisel(坦西莫司)、XiencePrime(依维莫司)、XienceV(依维莫司)、Zomaxx(唑罗莫司)、Zortress(依维莫司)、ZotarolimusElutingPeripheralStentMEDTRONIC(唑罗莫司)、AP23841、AP24170、ARmTOR26、BN107、BN108、CanstatinGENZYME(canstatin)、CU906、EC0371、EC0565、KI1004、LOR220、NV128、雷帕霉素ONCOIMMUNE(西罗莫司)、SB2602、SirolimusPNPSAMYANGBIOPHARMACEUTICALS(西罗莫司)、TOP216、VLI27、VS5584、WYE125132、XL388、Advacan(依维莫司)、AZD8055、CypherSelectPlusSirolimuselutingCoronaryStent(西罗莫司)、CypherSirolimuselutingcoronarystent(西罗莫司)、DrugCoatedBalloon(西罗莫司)、E-MagicPlus(西罗莫司)、Emtor(西罗莫司)、Esprit(依维莫司)、Evertor(依维莫司)、HBF0079、LCP-Siro(西罗莫司)、LimusCLARIS(西罗莫司)、mTOR抑制剂CELLZOME、NevoSirolimuselutingCoronaryStent(西罗莫司)、nPT-mTOR、Rapacan(西罗莫司)、Renacept(西罗莫司)、ReZolve(西罗莫司),Rocas(西罗莫司)、SF1126、Sirolim(西罗莫司)、SirolimusNORTHCHINA(西罗莫司)、SirolimusRANBAXY(西罗莫司)、SirolimusWATSON(西罗莫司)Siropan(西罗莫司)、Sirova(西罗莫司)、Supralimus(西罗莫司)、Supralimus-Core(西罗莫司)、TacrolimusWATSON(他罗利姆)、TAFA93、TemsirolimusACCORD(坦西莫司)、TemsirolimusSANDOZ(坦西莫司)、TOP216、XiencePrime(依维莫司)、XienceV(依维莫司)。在具体方面,mTor抑制剂为Afinitor(依维莫司)(http://www.afinitor.com/index.jsp?usertrack.filter_applied=true&NovaId=4029462064338207963;最近访问的,11/28/2012)。在另一个方面,将依维莫司与芳香酶抑制剂组合。(参见,例如,Baselga,J.,等人,EverolimusinPostmenopausalHormone-ReceptorPositiveAdvancedBreastCancer.2012.N.Engl.J.Med.366(6):520-529,将其通过引用并入本文)。在另一个方面,mTor抑制剂可通过本领域已知的方法来鉴定。(参见,例如,Zhou,H.等人UpdatesofmTorinhibitors.2010.AnticancerAgentsMed.Chem.10(7):571-81,将其通过引用并入本文)。在一些方面,mTor抑制剂用于治疗或预防或抑制对于激素受体是阳性的患者的转移。(参见,例如,Baselga,J.,等人,EverolimusinPostmenopausalHormone-ReceptorPositiveAdvancedBreastCancer.2012.N.Engl.J.Med.366(6):520-529)。在一些实施方案中,患者为ER+。在一些方面,mTor抑制剂用于治疗或预防或抑制晚期乳腺癌患者的转移。在一些方面,将mTor抑制剂与第二治疗组合使用。在一些方面,第二治疗是本文中描述的任何治疗。在另一个方面,治疗为Src激酶抑制剂。在一些方面,Src抑制剂用于预防或抑制转移。在一些方面,Src激酶抑制剂选自:AZD0530(沙拉替尼)、Bosulif(波舒替尼)、ENMD981693、KD020、KX01、Sprycel(达沙替尼)、Yervoy(伊匹木单抗)、AP23464、AP23485、AP23588、AZD0424、c-Src激酶抑制剂KISSEI、CU201、KX2361、SKS927、SRN004、SUNK706、TG100435、TG100948、AP23451、达沙替尼HETERO(达沙替尼)、达沙替尼VALEANT(达沙替尼)、Fontrax(达沙替尼)、Src激酶抑制剂KINEX、VX680,(乳酸托泽色替)、XL228和SUNK706。在一些实施方案中,Src激酶抑制剂为达沙替尼。在另一个方面,Src激酶抑制剂可通过本领域已知的方法(参见,例如,Sen,B.和Johnson,F.M.RegulationofSrcFamilyKinasesinHumanCancers.2011.J.SignalTransduction.2011:14pages,将其通过引用并入本文)来鉴定。在一些方面,Src激酶抑制剂用于治疗或预防或抑制对于SRC-响应特征(SRS)是阳性的患者的转移。在一些方面,患者为SRS+和ER-。(参见,例如,Zhang,CH.-F,等人LatentBoneMetastasisTiedtoSrc-Dependentsurvivalsignals.2009.CancerCell.16:67-78,将其通过引用并入本文)。在一些方面,Src激酶抑制剂用于治疗或预防或抑制晚期乳腺癌患者的转移。在一些方面,将Src激酶抑制剂与第二治疗组合使用。在一些方面,第二治疗是本文中描述的任何治疗。在另一个方面,治疗为COX-2抑制剂。在一些方面,COX-2抑制剂用于预防或抑制转移。在一些方面,COX-2抑制剂选自:ABT963、醋氨酚ERJOHNSON(醋氨酚)、AcularX(酮咯酸氨丁三醇)、BAY1019036(阿司匹林)、BAY987111(苯海拉明、萘普生钠)、BAYl1902(吡罗昔康)、BCIBUCH001(布洛芬)、Capoxigem(阿利考昔)、CS502、CS670(培比洛芬)、DiclofenacHPBCD(双氯芬酸)、Diractin(酮洛芬)、GW406381、HCT1026(硝基氟吡洛芬)、Hyanalgese-D(双氯芬酸)、HydrocoDex(醋氨酚、右美沙芬、氢可酮)、IbuprofenSodiumPFIZER(布洛芬钠)、IbuprofenwithAcetaminophenPFIZER(醋氨酚、布洛芬)、Impracor(酮洛芬)、IP880(双氯芬酸)、IP940(吲哚美辛)、ISV205(双氯芬酸钠)、JNS013(醋氨酚、盐酸曲马多)、KetoprofenTDS(酮洛芬)、LTNS001(naproxenetemesil)、MesalamineSALIX(氨水杨酸)、MesalamineSOFAR(氨水杨酸)、Mesalazine(氨水杨酸)、ML3000(利考非隆)、MRX7EAT(依托度酸)、NaproxenIROKO(萘普生)、NCX4016(硝基阿司匹林)、NCX701(硝基醋氨酚)、NuprinSCOLR(布洛芬)、OMS103HP(盐酸阿米替林、酮洛芬、盐酸羟甲唑啉)、Oralease(双氯芬酸)、OxycoDex(右美沙芬、氧可酮)、P54、PercoDex(醋氨酚、右美沙芬、氧可酮)、PL3100(萘普生、磷酯酰胆碱)、PSD508、R-Ketoprofen(酮洛芬)、Remura(溴芬酸钠)、ROX828(酮咯酸氨丁三醇)、RP19583(酮洛芬赖氨酸)、RQ00317076、SDX101(R-依托度酸)、TDS943(双氯芬酸钠)、TDT070(酮洛芬)、TPR100、TQ1011(酮洛芬)、TT063(S-氟比洛芬)、UR8880(西米考昔)、V0498TA01A(布洛芬)、VT122(依托度酸、普萘洛尔)、XP20B(醋氨酚、右丙氧芬)、XP21B(双氯芬酸钾)、XP21L(双氯芬酸钾)、Zoenasa(乙酰半胱氨酸,美沙拉嗪)、Acephen、Actifed+、Actifed-P、Acular、AcularLS、AcularPF、AcularX、Acuvail、雅维、雅维抗窦抗过敏、雅维抗感冒和抗窦、雅维解除堵塞、雅维PM、雅维PM胶囊、空气撒隆巴斯、Airtal、无酒精NyQuil解除感冒&流感、Aleve、AleveABDIIBRAHIM、Aleve-D、Alka-Seltzer、Alka-SeltzerBAYER、超强Alka-Seltzer、Alka-Seltzer柠檬-酸橙、原始Alka-Seltzer、Alka-Seltzer+、Alka-Seltzer+抗感冒和抗咳嗽、Alka-Seltzer+抗感冒和抗咳嗽配方、Alka-Seltzer+日夜抗感冒配方、Alka-Seltzer+白天无昏睡抗感冒配方、Alka-Seltzer+抗流感配方、Alka-Seltzer+夜晚抗感冒配方、Alka-Seltzer+抗窦配方、Alka-Seltzer+闪闪发光的原始抗感冒配方、Alka-SeltzerPM、Alka-Seltzer唤醒、Anacin、Anaprox、AnaproxMINERVA、Ansaid、蜂毒素、Apranax、Apranaxabdi、Arcoxia、抗关节炎配方Bengay、Arthrotec、Asacol、AsacolHD、AsacolMEDUNAARZNEIMITTEL、AsacolORIFARM、阿司匹林BAYER、复合阿司匹林、阿司匹林Migran、AZD3582、Azulfidine、BaralganM、BAY1019036、BAY987111、BAYl1902、BCIBUCH001、苯海拉明抗过敏、日夜苯海拉明、Benylin4抗流感、Benylin抗感冒和抗流感、Benylin日夜抗感冒和抗流感、Benylin日夜抗感冒和抗窦日夜、Benylin抗感冒和抗窦+、Benylin日夜解除感冒和流感、Benylin1All-In-One、Brexin、BrexinANGELINI、Bromday、百服宁、Buscopan+、Caldolor、Calmatel、Cambia、Canasa、Capoxigem、Cataflam、西乐葆、西乐葆ORIFARM、儿童雅维抗窦抗过敏、儿童泰诺、儿童泰诺抗咳嗽和抗流涕、儿童泰诺+抗感冒、儿童泰诺+抗感冒和抗咳嗽、儿童泰诺+抗感冒和抗流涕、儿童泰诺+抗流感、儿童泰诺+抗感冒&抗过敏、儿童泰诺+抗咳嗽&抗流涕、儿童泰诺+抗咳嗽&抗咽喉痛、儿童泰诺+抗多症状感冒、Clinoril、Codral抗感冒和流感、Codral日夜日片、Codral日夜夜片、晚间Codral、Colazal、Combunox、康泰克抗感冒+抗流感、康泰克抗感冒+抗流感无昏睡、CoricidinD、CoricidinHBP抗感冒和抗流感、CoricidinHBP日夜抗多症状感冒、CoricidinHBP抗最强流感、CoricidinHBP晚间抗多症状感冒、CoricidinII超强抗感冒和抗流感、CS502、CS670、Daypro、DayproAlta、DDS06C、Demazin抗感冒和抗流感、Demazin抗咳嗽、抗感冒和抗流感、Demazin日/夜抗感冒和抗流感、DemazinPE抗感冒和抗流感、DemazinPE日/夜抗感冒和抗流感、双氯芬酸HPBCD、Dimetapp日解除、Dimetapp抗多症状感冒和流感、Dimetapp夜解除、Dimetapp解除疼痛和发烧、DimetappPE抗窦抗疼痛、DimetappPE抗窦抗疼痛+抗过敏、Dipentum、Diractin、Disprin抗感冒'n'抗发烧、DisprinExtra、DisprinForte、Disprin+、Dristan抗感冒、初级Dristan、Drixoral+、Duexis、Dynastat、Efferalgan、Efferalgan+维生素C、Efferalgan维生素C、ElixsureIB、Excedrin背部和身体、Excedrin抗偏头痛、ExcedrinPM、Excedrin抗窦抗头痛、Excedrin抗紧张性头痛、Falcol、Fansamac、Feldene、FeverAll、Fiorinal、具有可待因的Fiorinal、Flanax、FlectorPatch、Flucam、Fortagesic、Gerbin、Giazo、Gladio、Goody's抗背部和身体疼痛、Goody's酷橙、Goody's超强、Goody'sPM、无油脂的Bengay、GW406381、HCT1026、HeXingYi、Hyanalgese-D、HydrocoDex、布洛芬钠PFIZER、具有对乙酰氨基酚的布洛芬PFIZER、IcyHotSANOFIAVENTIS、Impracor、Indocin、吲哚美辛APPPHARMA、吲哚美辛MYLAN、婴幼儿泰诺、IP880、IP940、Iremod、ISV205、JNS013、小泰诺、Junifen、初级强度雅维、初级强度美林、酮洛芬TDS、LemsipMax、LemsipMaxAllinOne、夜LemsipMaxAll、LemsipMax抗感冒和抗流感、Lialda、李施德林漱口水、劳埃德霜、Lodine、LorfitP、Loxonin、LTNS001、Mersyndol、美沙拉嗪SALIX、美沙拉嗪SOFAR、美沙拉嗪、MesasalGLAXO、MesasalSANOFI、Mesulid、MetsalHeatRub、MidolComplete、Midol扩展解除、Midol液体凝胶、MidolPM、Midol青少年配方、Migranin包衣片、ML3000、Mobic、Mohrus、美林、美林抗感冒和抗窦抗疼痛、美林PM、MovalisASPEN、MRX7EAT、Nalfon、NalfonPEDINOL、Naprelan、萘普生、萘普生RPG生命科学、萘普生IROKO、NCX4016、NCX701、NeoProfenLUNDBECK、Nevanac、Nexcede、Niflan、NorgesicMEDICIS、安乃近、NuprinSCOLR、Nurofen、Nurofen抗感冒和抗流感、Nurofen最强抗偏头痛、Nurofen+、Nuromol、具有维生素C的NyQuil、Ocufen、OMS103HP、Oralease、OrudisABBOTTJAPAN、Oruvail、Osteluc、OxycoDex、P54、必理通、必理通Actifast、Paradine、Paramax、Parfenac、Pedea、Pennsaid、颇得斯安、颇得斯安ORIFARM、Peon、Percodan、Percodan-Demi、PercoDex、Percogesic、Perfalgan、PL2200、PL3100、Ponstel、Prexige、Prolensa、PSD508、R-酮洛芬、Rantudil、Relafen、Remura、Robaxisal、Rotec、Rowasa、ROX828、RP19583、RQ00317076、Rubor、Salofalk、Salonpas、Saridon、SDX101、Seltouch、sfRowasa、Shinbaro、Sinumax、Sinutab、Sinutab、sinus、Spalt、Sprix、Strefen、Sudafed抗感冒和抗咳嗽、Sudafed抗头感冒和抗窦、SudafedPE抗感冒+抗咳嗽、SudafedPE抗压+抗疼痛、SudafedPE、严重感冒、SudafedPE抗窦日+夜解除日片、SudafedPE抗窦日+夜解除夜片、SudafedPE抗窦+抗炎疼痛解除、Sudafed高级抗窦、Surgam、Synalgos-DC、Synflex、Tavist抗过敏/抗窦/抗头痛、TDS943、TDT070、Theraflu抗感冒和抗咽喉痛、Theraflu日间抗严重感冒和咳嗽、Theraflu日间变暖解除、Theraflu变暖解除片日间抗多症状感冒、Theraflu变暖解除抗感冒和抗胸闷、Thomapyrin、ThomapyrinC、ThomapyrinEffervescent、ThomapyrinMedium、Tilcotil、Tispol、Tolectin、Toradol、TPR100、TQ1011、Trauma-Salbe、Trauma-SalbeKwizda、Treo、Treximet、Trovex、TT063、泰诺、泰诺抗多症状过敏、泰诺抗背部疼痛、泰诺抗感冒&抗咳嗽日间、泰诺抗感冒&抗咳嗽晚间、泰诺抗感冒和抗窦日间、泰诺抗感冒和抗窦夜间、泰诺抗严重感冒头堵塞、泰诺抗多症状感冒日间、泰诺抗多症状感冒夜间液体、泰诺抗严重多症状感冒、泰诺抗感冒无昏睡配方、泰诺抗感冒严重堵塞日间、泰诺抗完全感冒、夜间抗咳嗽和流感、泰诺抗流感夜间、经期泰诺、泰诺PM、泰诺抗窦堵塞&抗疼痛日间、泰诺抗窦堵塞&抗疼痛晚间、泰诺抗窦堵塞&抗疼痛严重、泰诺抗窦严重堵塞日间、泰诺超级解除、具有咖啡因和磷酸可待因的泰诺、具有磷酸可待因的泰诺、超强Bengay霜、Ultracet、UR8880、V0498TA01A、VicksNyQuil解除感冒和流感、Vicoprofen、Vimovo、扶他林乳胶剂、扶他林凝胶、扶他林NOVARTISCONSUMERHEALTHGMBH、扶他林XR、VT122、Xefo、快速Xefo、Xefocam、Xibrom、XL3、Xodol、XP20B、XP21B、XP21L、Zipsor和Zoenasa。在另一个方面,COX-2抑制剂可通过本领域已知的方法来鉴定(参见,例如,Dannhardt,G.和Kiefer,W.Cyclooxygenaseinhibitors-currentstatusandfutureprospects.2001.Eur.J.Med.Chem.36:109-126,将其通过引用并入本文)。在一些方面,COX-2抑制剂用于治疗或预防或抑制晚期乳腺癌的转移。在一些方面,将COX-2抑制剂与第二治疗组合使用。在一些方面,第二治疗是本文中描述的任何治疗。在一些方面,将COX-2抑制剂与第二治疗组合使用,所述第二治疗选自:地舒单抗、Zometa(http://www.us.zometa.com/index.jsp?usertrack.filter_applied=true&NovaId=2935376934467633633;最近访问,12/2/2012)、Carbozantinib或卡博替尼、阻断PTHLH(甲状旁腺激素样激素)或PTHrP(甲状旁腺激素相关蛋白)的抗体或肽和依维莫司。在另一个方面,用于避免和/或预防骨退化的治疗剂包括但不限于:甲状旁腺激素(PTH)和甲状旁腺样激素(PTHLH)抑制剂(包括阻断性抗体)或其重组形式(对应于PTH的氨基酸7-34的特立帕肽)。该激素通过刺激破骨细胞和增强其活性起作用。雷奈酸锶:为替代口服治疗,形成称为"双作用骨剂"(DABA)的药物的组的部分,因为它们刺激成骨细胞增殖并抑制破骨细胞增殖。“雌激素受体调节剂”(SERM)是指干扰或抑制(无论什么机制)雌激素对受体的结合的化合物。雌激素受体调节剂的实例包括雌激素类,孕激素、雌二醇、屈洛昔芬、雷洛昔芬、拉索昔芬、TSE-424、他莫昔芬、艾多昔芬、LY353381、LY117081、托瑞米芬、fluvestrant、4-[7-(2,2-二甲基-1-氧丙氧基-4-甲基-2-[4-[2-(1-哌啶基)乙氧基]苯基]-2H-1-苯并吡喃-3-基]-苯基-2,2-二甲基丙酸4,4’二羟二苯甲酮-2,4-二硝基苯-腙和SH646等。降钙素:通过降钙素受体直接抑制破骨细胞活性。已在破骨细胞的表面上鉴定了降钙素受体。二磷酸盐类:为用于预防或治疗具有与乳腺癌和前列腺癌相关的骨吸收和再吸收的疾病例如骨质疏松症和具有骨转移的癌症(后者具有或不具有高钙血症)。可用于通过本发明的第五方法设计的疗法的二磷酸盐的实例包括但不限于含氮二磷酸盐(例如帕玛二磷酸盐、奈立膦酸盐、奥帕膦酸盐、阿屈膦酸盐、伊班膦酸盐、利塞膦酸盐、伊卡膦酸盐、唑来膦酸盐或唑来膦酸等)和非含氮二磷酸盐(例如羟乙磷酸盐、氯屈膦酸盐、替鲁膦酸盐等)。“组织蛋白酶K抑制剂”是指干扰组织蛋白酶K半胱氨酸蛋白酶活性的化合物。组织蛋白酶K抑制剂的非限定性实例包括4-氨基-嘧啶-2-腈衍生物(在NovartisPharmaGMBH的名称下于国际专利申请WO03/020278中描述的)、公开案WO03/020721(NovartisPharmaGMBH)和公开案WO04/000843(ASTRAZENECAAB)中描述的吡咯并-嘧啶以及AxysPharmaceuticals的公开案PCTWO00/55126、MerckFrosstCanada&Co.和AxysPharmaceuticals的WO01/49288中描述的抑制剂。“DKK-1(Dickkopf-1)抑制剂”,如本文中所用,是指能够降低DKK-1活性的任何化合物。DKK-1是主要在成人骨中表达的并且在具有溶骨性病变的骨髓瘤患者中被上调的可溶性Wnt途径拮抗剂。靶向DKK-1的试剂可在预防多发性骨髓瘤患者的溶骨性骨疾病中起作用。来自Novartis的BHQ880是一级完全人抗-DKK-1中和抗体。临床前研究支持如下假说:BHQ880促进骨形成,从而抑制肿瘤诱导的溶骨性疾病(EttenbergS.等人,AmericanAssociationforCancerResearchAnnualMeeting.April12–16,2008;SanDiego,Calif.Abstract)。“双重MET和VEGFR2抑制剂”,如本文中所用,是指作为被设计来阻断MET驱动的肿瘤逃逸的MET和VEGF途径的高效双重抑制剂的任何化合物。MET不仅在肿瘤细胞和内皮细胞中而且还在成骨细胞(骨形成细胞)和破骨细胞(骨去除细胞)中表达。HGF结合所有这些细胞类型上的MET,从而赋予MET途径在多个自分泌和旁分泌回路中的重要作用。肿瘤细胞中MET的活化在转移性骨病变的建立中似乎是非常重要的。同时,成骨细胞和破骨细胞中MET途径的活化可导致骨转移的病理特征,包括异常骨生长(即,增生性病变(blasticlesion))或破坏(即,溶解性病变)。因此,靶向MET途径可以是预防转移性骨病变的建立和进展的可行策略。卡博替尼(Exelixis,Inc),以前称为XL184(CAS849217-68-1),是被设计来阻断MET驱动的肿瘤逃逸的MET和VEGF途径高效双重抑制剂。在多个临床前研究中,已显示卡博替尼杀死肿瘤细胞、减少转移和抑制血管生成(支持肿瘤生长所必需的新血管的形成)。另一种适当的双重抑制剂为E7050(N-[2-氟-4-({2-[4-(4-甲基哌嗪-1-基)哌啶-1-基]羰基氨基吡啶-4-基}氧)苯基]-N′-(4-氟苯基)环丙烷-1,1-二甲酰胺(2R,3R)-酒石酸盐)(CAS928037-13-2)或Foretinib(也称为GSK1363089、XL880、CAS849217-64-7)。“RANKL抑制剂”,如本文中所用,是指能够降低RANK活性的任何化合物。RANKL发现于基质的成骨细胞膜和T淋巴细胞的表面上,这类T-淋巴细胞是唯一的已显示分泌其的能力的淋巴细胞。其主要功能是破骨细胞(参与骨吸收的细胞)的活化。RANKL抑制剂可通过阻断RANKL对其受体(RANK)的结合,阻断RANK-介导的信号转导或通过阻断RANKL的转录或翻译而减少RANKL的表达来起作用。适合用于本发明的RANKL拮抗剂或抑制剂包括但不限于:○适当的RANK蛋白,其能够结合RANKL并且包含RANK蛋白的整个细胞外结构域或所述结构域的片段。可溶性RANK可包含信号肽和鼠或人RANK多肽的细胞外结构域,或可选择地,可使用除去信号肽的蛋白质成熟形式。○骨保护素或具有RANKL结合能力的其变体。○RANKL-特异性反义分子○能够加工RANKL的转录产物的核酶○特异性抗-RANKL抗体。“抗-RANKL抗体或针对RANKL的抗体”在本文中理解为所有能够特异性结合核因子κB(RANKL)的受体的配体、从而抑制一个或多个RANKL功能的抗体。抗体可使用本领域普通技术人员已知的方法的任何方法来制备。因此,多克隆抗体通过用待抑制的蛋白免疫动物来制备。单克隆抗体使用Kohler,Milstein等人(Nature,1975,256:495)描述的方法来制备。适用于本发明的说明书的抗体包括包含可变抗原结合区和恒定区的完整抗体、片段“Fab”、“F(ab′)2”和“Fab`”、Fv、scFv、双链抗体和双特异性抗体。○特异性抗-RANKL纳米抗体(nanobody)。纳米抗体是包含天然存在的重链抗体的独特结构和功能性质的抗体衍生治疗性蛋白。纳米抗体技术最初是在发现骆驼科(骆驼和骆马)具有不存在轻链的全功能抗体后开发而来的。纳米抗体的一般结构为FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4其中FR1至FR4是构架区1至4。CDR1至CDR3是互补决定区1至3。这些重链抗体包含单个可变结构域(VHH)和两个恒定结构域(CH2和CH3)。重要地,克隆和分离的VHH结构域是优选地稳定的多肽,其具有原始重链抗体的整个抗原结合能力。这些新发现的具有独特结构和功能性质的VHH结构域形成了Ablynx称其为纳米抗体的新一代治疗性抗体的基础。在一个实施方案中,RANKL抑制剂选自RANKL特异性抗体、RANKL特异性纳米抗体和骨保护素。在一个具体实施方案中,抗-RANKL抗体是单克隆抗体。在更具体实施方案中,抗-RANKL抗体为地舒单抗(Pageau,StevenC.(2009)。mAbs1(3):210-215,CAS编号615258-40-7)(将其完整内容通过引用并入本文)。地舒单抗是结合RANKL并且阻止其激活(其不结合RANK受体)的完全人单克隆抗体。地舒单抗的各个方面由美国专利No.6,740,522;7,411,050;7,097,834;7,364,736(将所述美国专利的每一个的完整内容通过引用整体并入本文)涵盖。在另一个实施方案中,RANKL抑制剂为与地舒单抗结合相同表位的抗体、抗体片段或融合构建体。在一个优选实施方案中,抗-RANKL纳米抗体是WO2008142164(将其内容通过引用并入本申请)中描述的任何纳米抗体。在一个更优选实施方案中,抗-RANKL抗体为ALX-0141(Ablynx)。ALX-0141已被设计来抑制与绝经后骨质疏松、类风湿关节炎、癌症和某些药剂相关的骨丢失,和恢复健康骨代谢的平衡。在一个优选实施方案中,预防骨退化的试剂选自二磷酸盐、RANKL抑制剂、PTH和PTHLH抑制剂或PRG类似物、雷奈酸锶、DKK-1抑制剂、双重MET和VEGFR2抑制剂、雌激素受体调节剂、镭-223、降钙素和组织蛋白酶K抑制剂。在一个更优选实施方案中,预防骨退化的试剂为二磷酸盐。在一个更优选实施方案中,二磷酸盐为唑来膦酸。在一个实施方案中,CCR5拮抗剂被施用来预防或抑制原发性乳腺癌肿瘤至骨的转移。在一个实施方案中,CCR5拮抗剂为大分子。在另一个实施方案中,CCR5拮抗剂为小分子。在一些实施方案中,CCR5拮抗剂为马拉韦罗(Velasco-Veláquez,M.等人2012.CCR5AntagonistBlocksMetastasisofBasalBreastCancerCells.CancerResearch.72:3839-3850.)。在一些实施方案中,CCR5拮抗剂为维立韦罗(Velasco-Veláquez,M.等人2012.CCR5AntagonistBlocksMetastasisofBasalBreastCancerCells.CancerResearch.72:3839-3850.)。在一些方面,CCR5拮抗剂为阿拉韦罗(DemarestJ.F.等人2005.UpdateonAplaviroc:AnHIVEntryInhibitorTargetingCCR5.Retrovirology2(Suppl.1):S13)。在一些方面,CCR5拮抗剂为螺哌啶CCR5拮抗剂。(RotsteinD.M.等人2009.SpiropiperidineCCR5antagonists.Bioorganic&MedicinalChemistryLetters.19(18):5401-5406。在一些实施方案中,CCR5拮抗剂为INCB009471(Kuritzkes,D.R.2009.HIV-1entryInhibitor:anoverview.Curr.Opin.HIVAIDS.4(2):82-7)。在一个优选实施方案中,双重MET和VEGFR2抑制剂选自卡博替尼、Foretinib和E7050。在一个优选实施方案中,镭223疗法为alpharadin。或者,可进行联合治疗,其中将超过一种来自上述试剂的试剂组合以治疗和/或预防转移,或可将所述试剂与其它补充剂例如钙或维生素D或与激素治疗组合。用于预测乳腺癌患者的早期骨转移的方法在另一个方面,本发明涉及用于测定患有乳腺癌例如三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的受试者的骨转移风险的体外方法,其包括测定所述受试者的样品中c-MAF基因的表达水平,其中所述基因的表达水平高于平均值+一个标准差表示增加的发生早期骨转移的风险。在一个优选实施方案中,骨转移是极早期骨转移。在一个优选实施方案中,骨转移是溶骨性转移。“早期骨转移”,如本文中所用,涉及在乳腺癌患者手术后5年内出现的骨转移。“极早期骨转移”,如本文中所用,涉及在乳腺癌患者手术后3年内内出现的骨转移。本发明的第四方法包括在第一步骤中定量患有乳腺癌例如三阴性(基底样)乳腺癌或可选择地ER+乳腺癌的受试者的样品中c-MAF基因表达水平。在一个优选实施方案中,样品为肿瘤组织样品。在一个优选实施方案中,本发明的第四方法包括仅定量作为单一标志的c-MAF基因表达水平,即,该方法不包括测定任何另外的标志的表达水平。可如先前针对本发明的第一方法所公开的,对c-MAF基因表达水平进行定量。在一个优选实施方案中,乳腺癌为三阴性乳腺癌,包括基底样乳腺癌或可选择地ER+乳腺癌,包括luminalA和B。在第二步骤中,所述基因的表达水平高于平均值+一个标准差表示增加的发生早期骨转移的风险。“平均水平”,如本文中所用,涉及概括或代表一组不相等值的总体显著性的c-MAF表达水平单一值(作为平均值、模式或中位数)。在一个优选实施方案中,平均水平对应于从乳腺癌肿瘤的代表性组群获得的表达水平平均值。患者组群根据代表人们试图对其进行评价的个体患者的年龄来确定。“标准差”,如本文中所用,涉及一组数字的离散度的测量。例如,c-MAF的平均正常水平的标准差是一组在乳腺肿瘤样品中发现的c-MAF水平的离散度。数据离散得越开,离差越大。标准差可通过在频率分布中提取观察值与它们的平均值的离差平方的平均数的平方根来获得。在测量具有乳腺癌例如三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的受试者的样品的c-MAF基因表达水平并将其与平均水平相比较后,如果所述基因的表达水平相对于平均水平高于平均值+一个标准差,则可得出所述受试者具有更大的发生早期骨转移的倾向性。用于设计具有骨转移的三阴性(包括基底样)乳腺癌患者或可选择地ER+乳腺癌患者的个体化治疗的方法在另一个方面,本发明涉及用于设计具有骨转移的三阴性(包括基底样)乳腺癌或可选择地具有骨转移的ER+乳腺癌的受试者的个体化治疗的体外方法(在下文中为本发明的第五方法),其包括:i)定量所述受试者的骨转移性样品的c-MAF基因表达水平,和ii)比较步骤(i)中获得的表达水平与参照值,其中如果c-MAF基因表达水平相对于所述参照值升高,则所述受试者适宜于接受目的在于预防骨退化的疗法。在一个优选实施方案中,骨转移为溶骨性转移。本发明的第五方法包括在第一步骤中定量患有乳腺癌的受试者的样品中c-MAF基因表达水平(或c-MAF易位或扩增)。在本发明的第五方法的情况下,样品可以是来自骨转移的组织样品。在一个优选实施方案中,本发明的第五方法包括仅定量作为单一标志的c-MAF基因表达水平,即,该方法不包括测定任何另外的标志的表达水平。在第二步骤中,将受试者的肿瘤样品中获得的c-MAF基因表达水平(或c-MAF易位或扩增)与参照值相比较。在一个优选实施方案中,参照值为对照样品的c-MAF基因表达水平。取决于待分析的肿瘤的类型,对照样品的确切性质可变化。因此,在牵涉本发明的第五方法的情况下,参照样品则是未发生转移的乳腺癌受试者的样品,或对应于在未患有转移的乳腺癌受试者的活检样品中肿瘤组织标本内测量的c-MAF基因表达水平的中位值。在测量样品的c-MAF基因表达水平并将其与参照值(例如对照样品的c-MAF基因表达水平)相比较后,如果所述基因的表达水平相对于参照值升高,则这表示所述受试者适宜于接受目的在于避免或预防骨退化的疗法。用于避免和/或预防骨退化的试剂的举例说明性实例包括、但不限于:-甲状旁腺激素(PTH)和甲状旁腺样激素(PTHLH)抑制剂(包括阻断性抗体)或其重组形式(对应于PTH的氨基酸7-34的特立帕肽)。该激素通过刺激破骨细胞和增强其活性起作用。-雷奈酸锶:为替代口服治疗,形成称为"双作用骨剂"(DABA)的药物的组的部分,因为它们刺激成骨细胞增殖并抑制破骨细胞增殖。-“雌激素受体调节剂”(SERM)是指干扰或抑制(无论什么机制)雌激素对受体的结合的化合物。雌激素受体调节剂的实例包括雌激素类,孕激素、雌二醇、屈洛昔芬、雷洛昔芬、拉索昔芬、TSE-424、他莫昔芬、艾多昔芬、LY353381、LY117081、托瑞米芬、fluvestrant、4-[7-(2,2-二甲基-1-氧丙氧基-4-甲基-2-[4-[2-(1-哌啶基)乙氧基]苯基]-2H-1-苯并吡喃-3-基]-苯基-2,2-二甲基丙酸4,4’二羟二苯甲酮-2,4-二硝基苯-腙和SH646等。-降钙素:通过降钙素受体直接抑制破骨细胞活性。已在破骨细胞的表面上鉴定了降钙素受体。-二磷酸盐类:为用于预防或治疗具有与乳腺癌和前列腺癌相关的骨吸收和再吸收的疾病例如骨质疏松症和具有骨转移的癌症(后者具有或不具有高钙血症)。可用于通过本发明的第五方法设计的疗法的二磷酸盐的实例包括但不限于含氮二磷酸盐(例如帕玛二磷酸盐、奈立膦酸盐、奥帕膦酸盐、阿屈膦酸盐、伊班膦酸盐、利塞膦酸盐、伊卡膦酸盐、唑来膦酸盐或唑来膦酸等)和非含氮二磷酸盐(例如羟乙磷酸盐、氯屈膦酸盐、替鲁膦酸盐等)。-Alpharadin(二氯化镭-223)。Alpharadin使用来自镭-223衰变的α辐射来杀死癌细胞。镭-223通过其作为钙模拟物的性质天然地自我靶向骨转移。α辐射具有2-10个细胞的极短的射程(当与基于β或γ辐射的目前放射疗法相比较时),从而引起更少的对周围健康组织(特别地骨髓)的损伤。由于与钙相似的性质,镭-223被吸至其中使用钙来在体内构建骨的地方,包括更快的异常骨生长(例如在具有晚期去势抵抗性前列腺癌的男人的骨转移中看到的)的部位。镭-223在注射后于血流中被运送至异常骨生长的部位。癌症在体内开始的地方称为原发性肿瘤。这些细胞的一些可脱离并且于血流中被运送至身体的另一个部位。随后癌细胞可定居在身体的该部分,形成新的肿瘤。如果这发生,其称为继发性癌症或转移。大多数晚期前列腺癌患者在他们的骨中遭受最大疾病负担。利用镭-223的目的是选择性靶向该继发性癌症。骨中未被吸收的任何镭-223快速经过肠并被排泄掉。-“组织蛋白酶K抑制剂”是指干扰组织蛋白酶K半胱氨酸蛋白酶活性的化合物。组织蛋白酶K抑制剂的非限定性实例包括4-氨基-嘧啶-2-腈衍生物(在NovartisPharmaGMBH的名称下于国际专利申请WO03/020278中描述的)、公开案WO03/020721(NovartisPharmaGMBH)和公开案WO04/000843(ASTRAZENECAAB)中描述的吡咯并-嘧啶以及AxysPharmaceuticals的公开案PCTWO00/55126、MerckFrosstCanada&Co.和AxysPharmaceuticals的WO01/49288中描述的抑制剂。-“DKK-1(Dickkopf-1)抑制剂”,如本文中所用,是指能够降低DKK-1活性的任何化合物。DKK-1是主要在成人骨中表达的并且在具有溶骨性病变的骨髓瘤患者中被上调的可溶性Wnt途径拮抗剂。靶向DKK-1的试剂可在预防多发性骨髓瘤患者的溶骨性骨疾病中起作用。来自Novartis的BHQ880是一级完全人抗-DKK-1中和抗体。临床前研究支持如下假说:BHQ880促进骨形成,从而抑制肿瘤诱导的溶骨性疾病(EttenbergS.等人,AmericanAssociationforCancerResearchAnnualMeeting.April12–16,2008;SanDiego,Calif.Abstract)。-“双重MET和VEGFR2抑制剂”,如本文中所用,是指作为被设计来阻断MET驱动的肿瘤逃逸的MET和VEGF途径的高效双重抑制剂的任何化合物。MET不仅在肿瘤细胞和内皮细胞中而且还在成骨细胞(骨形成细胞)和破骨细胞(骨去除细胞)中表达。HGF结合所有这些细胞类型上的MET,从而赋予MET途径在多个自分泌和旁分泌回路中的重要作用。肿瘤细胞中MET的活化在转移性骨病变的建立中似乎是非常重要的。同时,成骨细胞和破骨细胞中MET途径的活化可导致骨转移的病理特征,包括异常骨生长(即,增生性病变(blasticlesion))或破坏(即,溶解性病变)。因此,靶向MET途径可以是预防转移性骨病变的建立和进展的可行策略。卡博替尼(Exelixis,Inc),以前称为XL184(CAS849217-68-1),是被设计来阻断MET驱动的肿瘤逃逸的MET和VEGF途径高效双重抑制剂。在多个临床前研究中,已显示卡博替尼杀死肿瘤细胞、减少转移和抑制血管生成(支持肿瘤生长所必需的新血管的形成)。另一种适当的双重抑制剂为E7050(N-[2-氟-4-({2-[4-(4-甲基哌嗪-1-基)哌啶-1-基]羰基氨基吡啶-4-基}氧)苯基]-N′-(4-氟苯基)环丙烷-1,1-二甲酰胺(2R,3R)-酒石酸盐)(CAS928037-13-2)或Foretinib(也称为GSK1363089、XL880、CAS849217-64-7)。-“RANKL抑制剂”,如本文中所用,是指能够降低RANK活性的任何化合物。RANKL发现于基质的成骨细胞膜和T淋巴细胞的表面上,这类T-淋巴细胞是唯一的已显示分泌其的能力的淋巴细胞。其主要功能是破骨细胞(参与骨吸收的细胞)的活化。RANKL抑制剂可通过阻断RANKL对其受体(RANK)的结合,阻断RANK-介导的信号转导或通过阻断RANKL的转录或翻译而减少RANKL的表达来起作用。适合用于本发明的RANKL拮抗剂或抑制剂包括但不限于:○适当的RANK蛋白,其能够结合RANKL并且包含RANK蛋白的整个细胞外结构域或所述结构域的片段。可溶性RANK可包含信号肽和鼠或人RANK多肽的细胞外结构域,或可选择地,可使用除去信号肽的蛋白质成熟形式。○骨保护素或具有RANKL结合能力的其变体。○RANKL-特异性反义分子○能够加工RANKL的转录产物的核酶○特异性抗-RANKL抗体。“抗-RANKL抗体或针对RANKL的抗体”在本文中理解为所有能够特异性结合核因子κB(RANKL)的受体的配体、从而抑制一个或多个RANKL功能的抗体。抗体可使用本领域普通技术人员已知的方法的任何方法来制备。因此,多克隆抗体通过用待抑制的蛋白免疫动物来制备。单克隆抗体使用Kohler,Milstein等人(Nature,1975,256:495)描述的方法来制备。适用于本发明的说明书的抗体包括包含可变抗原结合区和恒定区的完整抗体、片段“Fab”、“F(ab′)2”和“Fab`”、Fv、scFv、双链抗体和双特异性抗体。○特异性抗-RANKL纳米抗体。纳米抗体是包含天然存在的重链抗体的独特结构和功能性质的抗体衍生治疗性蛋白。纳米抗体技术最初是在发现骆驼科(骆驼和骆马)具有不存在轻链的全功能抗体后开发而来的。纳米抗体的一般结构为FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4其中FR1至FR4是构架区1至4。CDR1至CDR3是互补决定区1至3。这些重链抗体包含单个可变结构域(VHH)和两个恒定结构域(CH2和CH3)。重要地,克隆和分离的VHH结构域是优选地稳定的多肽,其具有原始重链抗体的整个抗原结合能力。这些新发现的具有独特结构和功能性质的VHH结构域形成了Ablynx称其为纳米抗体的新一代治疗性抗体的基础。在一个实施方案中,RANKL抑制剂选自RANKL特异性抗体、RANKL特异性纳米抗体和骨保护素。在一个具体实施方案中,抗-RANKL抗体是单克隆抗体。在更具体实施方案中,抗-RANKL抗体为地舒单抗(Pageau,StevenC.(2009)。mAbs1(3):210-215,CAS编号615258-40-7)(将其完整内容通过引用并入本文)。地舒单抗是结合RANKL并且阻止其激活(其不结合RANK受体)的完全人单克隆抗体。地舒单抗的各个方面由美国专利No.6,740,522;7,411,050;7,097,834;7,364,736(将所述美国专利的每一个的完整内容通过引用整体并入本文)涵盖。在另一个实施方案中,RANKL抑制剂为与地舒单抗结合相同表位的抗体、抗体片段或融合构建体。在一个优选实施方案中,抗-RANKL纳米抗体是WO2008142164(将其内容通过引用并入本申请)中描述的任何纳米抗体。在一个更优选实施方案中,抗-RANKL抗体为ALX-0141(Ablynx)。ALX-0141已被设计来抑制与绝经后骨质疏松、类风湿关节炎、癌症和某些药剂相关的骨丢失,和恢复健康骨代谢的平衡。在一个优选实施方案中,预防骨退化的试剂选自二磷酸盐、RANKL抑制剂、PTH和PTHLH抑制剂或PRG类似物、雷奈酸锶、DKK-1抑制剂、双重MET和VEGFR2抑制剂、雌激素受体调节剂、镭-223、降钙素和组织蛋白酶K抑制剂。在一个更优选实施方案中,预防骨退化的试剂为二磷酸盐。在一个更优选实施方案中,二磷酸盐为唑来膦酸。在一个实施方案中,CCR5拮抗剂被施用来预防或抑制原发性乳腺癌肿瘤至骨的转移。在一个实施方案中,CCR5拮抗剂为大分子。在另一个实施方案中,CCR5拮抗剂为小分子。在一些实施方案中,CCR5拮抗剂为马拉韦罗(Velasco-Veláquez,M.等人2012.CCR5AntagonistBlocksMetastasisofBasalBreastCancerCells.CancerResearch.72:3839-3850.)。在一些实施方案中,CCR5拮抗剂为维立韦罗(Velasco-Veláquez,M.等人2012.CCR5AntagonistBlocksMetastasisofBasalBreastCancerCells.CancerResearch.72:3839-3850.)。在一些方面,CCR5拮抗剂为阿拉韦罗(DemarestJ.F.等人2005.UpdateonAplaviroc:AnHIVEntryInhibitorTargetingCCR5.Retrovirology2(Suppl.1):S13)。在一些方面,CCR5拮抗剂为螺哌啶CCR5拮抗剂。(RotsteinD.M.等人2009.SpiropiperidineCCR5antagonists.Bioorganic&MedicinalChemistryLetters.19(18):5401-5406。在一些实施方案中,CCR5拮抗剂为INCB009471(Kuritzkes,D.R.2009.HIV-1entryInhibitor:anoverview.Curr.Opin.HIVAIDS.4(2):82-7)。在一个优选实施方案中,双重MET和VEGFR2抑制剂选自卡博替尼、Foretinib和E7050。在一个优选实施方案中,镭223疗法为alpharadin。或者,可进行联合治疗,其中将超过一种来自上述试剂的试剂组合以治疗和/或预防转移,或可将所述试剂与其它补充剂例如钙或维生素D或与激素治疗组合。基于c-MAF基因扩增的检测对三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的转移进行预后的方法在另一个方面,本发明涉及用于预测三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌在患有所述癌症的受试者中的骨转移的体外方法(在下文中为本发明的第六方法),其包括确定c-MAF基因在所述受试者的样品中相对于参照基因拷贝数是否被扩增,其中c-MAF基因相对于所述参照基因拷贝数的扩增表示增加的发生骨转移的风险。在一些实施方案中,扩增发生在16q23基因座的区域内。在一些实施方案中,扩增发生在大致Chr.16–约79,392,959bp至约79,663,806bp(从着丝粒至端粒)之间的染色体区域的任何部分内。在一些实施方案中,扩增发生在大致Chr.16-79,392,959bp至约79,663,806bp之间的基因组区域内,但不包括DNA重复元件。在一些实施方案中,使用特异于该区域的探针测量扩增。在一个具体实施方案中,c-MAF基因扩增的程度可通过测定包含所述基因的染色体区域的扩增来测定。优选地,其扩增表示c-MAF基因扩增的存在的染色体区域为包括c-MAF基因的基因座16q22-q24。基因座16q22-q24位于染色体16中,位于所述染色体的长臂中和条带22与条带24之间的范围内。该区域在NCBI数据库中对应于重叠群NT_010498.15和NT_010542.15。在另一个优选实施方案中,c-MAF基因扩增的程度可通过使用特异于所述基因的探针来测定。在另一个优选实施方案中,c-MAF基因的扩增通过使用VysisLSIIGH/MAF双色双融合探针来测定,所述探针包含针对14q32和16q23的探针。本发明的第六方法在第一步骤中包括确定c-MAF基因在受试者的样品中是否被扩增。在一个优选实施方案中,样品是肿瘤组织样品。为此目的,将肿瘤样品中c-MAF基因的扩增与对照样品相比较。在一个具体实施方案中,用于乳腺癌受试者中发生骨转移的倾向的预后的本发明第六方法包括测定所述受试者的样品中c-MAF基因拷贝数和将所述拷贝数与对照或参照样品的拷贝数相比较,其中如果c-MAF拷贝数大于对照样品的c-MAF拷贝数,则受试者具有更大的发生骨转移的倾向性。对照样品是指具有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的未发生转移的受试者的样品,或分别对应于在未患有转移的具有三阴性(包括基底样)乳腺癌或ER+乳腺癌的受试者的活检样品的肿瘤组织标本中测量的c-MAF基因拷贝数的中位值。所述参照样品通常通过将等量的受试者群体的样品组合来获得。如果c-MAF基因拷贝数相对于所述基因在对照样品中的拷贝数而言增加,则受试者具有更大的发生转移的倾向。在一个优选实施方案中,当c-MAF基因拷贝数高于参照样品或对照样品具有的拷贝数时,c-MAF基因相对于参照基因拷贝数被扩增。在一个实例中,如果测试样品中的c-MAF基因的基因组拷贝数相对于对照样品增加至少2倍(即,6个拷贝)、3倍(即,8个拷贝)、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、25倍、30倍、35倍、40倍、45倍或50倍,则c-MAF基因被认为被“扩增”。在另一个实例中,如果每细胞的c-MAF基因的基因组拷贝数为至少3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30等,则c-MAF基因被认为被“扩增”。在一个具体实施方案中,扩增或拷贝数通过原位杂交或PCR来测定。用于确定c-MAF基因或染色体区域16q22-q24是否被扩增的方法在本领域是公知的。所述方法包括但不限于原位杂交(ISH)(例如荧光原位杂交(FISH)、生色原位杂交(CISH)或银原位杂交(SISH))、基因组比较杂交或聚合酶链式反应(例如实时定量PCR)。对于任何ISH法,扩增或拷贝数可通过计数染色体或细胞核中的荧光点、有色点或具有银的点来测定。荧光原位杂交(FISH)是用于检测和定位染色体上特定DNA序列的存在或不存在的细胞遗传技术。FISH使用仅结合与它们显示高度序列相似性的染色体的一些部分的荧光探针。在一个典型的FISH法中,利用荧光分子或半抗原(通常以fluor-dUTP、地高辛-dUTP、生物素-dUTP或半抗原-dUTP的形式,通过使用酶促反应例如切口平移或PCR将所述形式掺入DNA)标记DNA探针。将包含遗传物质(染色体)的样品置于载玻片上,通过甲酰胺处理进行变性。随后将标记的探针与包含遗传物质的样品在适当的条件下杂交,所述条件可由本领域技术人员确定。杂交后,直接(在利用氟标记的探针的情况下)或间接(使用荧光标记抗体检测半抗原)观察样品。在CISH的情况下,用地高辛、生物素或荧光素标记探针,将其与包含遗传物质的样品在适当的条件下杂交。可结合DNA的任何标识或标记分子可用于标记用于本发明的第四方法的探针,从而允许检测核酸分子。用于标记的标记物的实例包括但不限于放射性同位素、酶底物、辅因子、配体、化学发光试剂、荧光基团、半抗原、酶及其组合。标记方法和为了不同目的选择适当的标记物的指导方针可见于例如Sambrook等人(MolecularCloning:ALaboratoryManual,ColdSpringHarbor,NewYork,1989)和Ausubel等人(InCurrentProtocolsinMolecularBiology,JohnWileyandSons,NewYork,1998)中。在确定扩增存在后,通过直接测定c-MAF基因的扩增、16q23基因座的扩增或通过测定基因座16q22-q24的扩增确定扩增存在,并且在与所述基因在对照样品中的扩增相比较后,如果检测到c-MAF基因的扩增,则表明受试者具有更大的发生骨转移的倾向。需要将c-MAF基因的扩增的测定与对照样品或参照样品的值发生关联,所述对照样品或参照样品的值对应于在未发生转移的乳腺癌受试者的样品中测量的c-MAF基因的扩增水平,或对应于在未患有转移的乳腺癌受试者的活检样品的肿瘤组织标本中测量的c-MAF基因扩增的中位值。所述参照样品通常通过组合等量的来自受试者群体的样品来获得。一般地,典型的参照样品获自临床上被良好记录的并且其中转移不存在被良好表征的受试者。参照水平所源自的样品标本优选由患有与研究的患者对象相同类型的癌症的受试者组成。在已建立该中位值后,可将患者的肿瘤组织的c-MAF扩增水平与该中位值相比较,从而,如果存在扩增,则受试者具有更大的发生转移的倾向。在一个优选实施方案中,骨转移是溶骨性骨转移。如本文中所用,表述“溶骨性骨转移”是指这样一种类型的转移,其中在因肿瘤细胞对破骨细胞活性的刺激而引起的转移的附近产生骨吸收(骨密度的进行性丢失),其特征在于严重疼痛、病理性骨折、高钙血症、脊髓压迫症和因神经压迫导致的其它综合征。基于c-MAF基因易位检测而对三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的转移进行预后的方法在另一个方面,本发明涉及预测患有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的患者的临床结果的体外方法,其包括确定c-MAF基因在所述受试者的样品中是否易位,其中c-MAF基因的易位表示不良临床结果。在另一个方面,本发明涉及预测患有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的患者的临床结果的体外方法,其包括确定c-MAF基因在所述受试者的样品中是否易位,其中c-MAF基因的易位表示不良临床结果。在一些实施方案中,易位的基因来自16q23基因座上的区域。在一些实施方案中,易位的基因来自大致Chr.16–约79,392,959bp与79,663,806bp(从着丝粒至端粒)之间的染色体区域的任何部分。在一些实施方案中,易位的基因来自大致Chr.16–约79,392,959bp与79,663,806bp之间的基因组区域,但不包括DNA重复元件。在一些实施方案中,使用特异于该区域的探针测量易位。在一个具体实施方案中,c-MAF基因的易位可通过测定包含所述基因的染色体区域的易位来测定。在一个实施方案中,易位为t(14,16)易位。在另一个实施方案中,被易位的染色体区域为从基因座16q22至q24。基因座16q22-q24位于染色体16中,位于所述染色体的长臂中,并且在条带22与条带24之间的范围内。该区域在NCBI数据库中对应于重叠群NT_010498.15和NT_010542.15。在一个优选实施方案中,c-MAF基因易位至染色体14的基因座14q32,从而导致易位t(14,16)(q32,q23)。该易位使MAF基因紧临IgH基因座中的强增强子,所述增强子在一些情况下导致MAF过表达。(Eychène,A.,Rocques,N.,andPuoponnot,C.,AnewMAFiaincancer.2008.NatureReviews:Cancer.8:683-693)。在一个优选实施方案中,c-MAF基因的易位可使用特异于所述易位的探针来测定。在一些实施方案中,易位使用双色探针来测量。在一些实施方案中,易位使用双融合探针来测量。在一些实施方案中,易位使用双色双融合探针来测量。在一些实施方案中,易位使用两个单独的探针来测量。在另一个优选实施方案中,c-MAF基因的易位使用VysisLSIIGH/MAF双色双融合探针(http://www.abbottmolecular.com/us/products/analyte-specific-reagent/fish/vysis-lsi-igh-maf-dual-color-dual-fusion-probe.html;最近访问,11/5/2012)来测定,所述探针包含针对14q32和16q23的探针。在另一个优选实施方案中,c-MAF基因的易位使用如下探针来测定:KreatechdiagnosticsMAF/IGHgt(14;16)融合探针(http://www.kreatech.com/products/repeat-freetm-poseidontm-fish-probes/hematology/maf-igh-gt1416-fusion-probe.html;最近访问,11/5/2012)、AbnovaMAFFISH探针(http://www.abnova.com/products/products_detail.asp?Catalog_id=FA0375;最近登录,11/5/2012)、CancerGeneticsItaliaIGH/MAF双色双融合易位探针(http://www.cancergeneticsitalia.com/dna-fish-probe/ighmaf/;最近访问,11/5/2012)、CreativeBioarrayIGH/MAF-t(14;16)(q32;q23)FISH探针(http://www.creative-bioarray.com/products.asp?cid=35&page=10;最近访问,11/5/2012)、ArupLaboratories多骨髓瘤板(通过FISH)(http://www.aruplab.com/files/technical-bulletins/Multiple%20Myeloma%20%28MM%29%20by%20FISH.pdf;最近访问,11/5/2012)、特异于16q23或14q32的Agilent探针(http://www.genomics.agilent.com/ProductSearch.aspx?chr=16&start=79483700&end=79754340;最近访问,11/5/2012;http://www.genomics.agilent.com/ProductSearch.aspx?Pageid=3000&ProductID=637;最近访问11/5/2012)、特异于16q23或14q32的Dako探针(http://www.dako.com/us/ar42/psg42806000/baseproducts_surefish.htm?setCountry=true&purl=ar42/psg42806000/baseproducts_surefish.htm?undefined&submit=Accept%20country;最近访问,11/5/2012)、CytocellIGH/MAFTranslocation双融合探针(http://www.zentech.be/uploads/docs/products_info/prenatalogy/cytocell%202012-2013%20catalogue%5B3%5D.pdf;最近访问,11/5/2012)、MetasystemsXLIGH/MAFTranslocation–双融合探针(http://www.metasystems-international.com/index.php?option=com_joodb&view=article&joobase=5&id=12%3Ad-5029-100-og&Itemid=272;最近访问,11/5/2012)、ZeissFISH探针XL,100μl,IGH/MAFB(https://www.micro-shop.zeiss.com/?s=440675675dedc6&l=en&p=uk&f=r&i=5000&o=&h=25&n=1&sd=000000-0528-231-uk;最近访问,11/5/2012)或GenycellBiotechIGH/MAF双融合探针(http://www.google.com/url?sa=t&rct=j&q=&esrc=s&source=web&cd=1&ved=0CCQQFjAA&url=http%3A%2F%2Fwww.genycell.es%2Fimages%2Fproductos%2Fbrochures%2Flphmie6__86.ppt&ei=MhGYUOi3GKWH0QGlt4DoDw&usg=AFQjCNEqQMbT8vQGjJbi9riEf3lVgoFTFQ&sig2=V5IS8juEMVHB18Mv2Xx_Ww;最近访问,11/5/2012)。在一些实施方案中,探针上的标记为荧光基团。在一些实施方案中,探针上的荧光基团为橙色。在一些实施方案中,探针上的荧光基团为绿色。在一些实施方案中,探针上的荧光基团为红色。在一些情况下,探针上的荧光基团为黄色。在一些实施方案中,用红色荧光基团标记一种探针,用绿色荧光基团标记另一种探针。在一些实施方案中,用绿色荧光基因标记一种探针,用橙色荧光基团标记另一种探针。在一些情况下,探针上的荧光团是黄色的。例如,如果用红色荧光基团标记MAF特异性探针,则用绿色荧光基团标记IGH-特异性探针,如果看见白色,则其表明信号重叠并且易位已发生。在一些实施方案中,荧光基团为SpectrumOrange。在一些实施方案中,荧光基团为SpectrumGreen。在一些实施方案中,荧光基团为DAPI。在一些实施方案中,荧光基团为PlatinumBright405。在一些实施方案中,荧光基团为PlatinumBright415。在一些实施方案中,荧光基团为PlatinumBright495。在一些实施方案中,荧光基团为PlatinumBright505。在一些实施方案中,荧光基团为PlatinumBright550。在一些实施方案中,荧光基团为PlatinumBright547。在一些实施方案中,荧光基团为PlatinumBright570。在一些实施方案中,荧光基团为PlatinumBright590。在一些实施方案中,荧光基团为PlatinumBright647。在一些实施方案中,荧光基团为PlatinumBright495/550。在一些实施方案中,荧光基团为PlatinumBright415/495/550。在一些实施方案中,荧光基团为DAPI/PlatinumBright495/550。在一些实施方案中,荧光基团为FITC。在一些实施方案中,荧光基团为德克萨斯红。在一些实施方案中,荧光基团为DEAC。在一些实施方案中,荧光基团为R6G。在一些实施方案中,荧光基团为Cy5。在一些实施方案中,荧光基团为FITC、德克萨斯红和DAPI。在一些实施方案中,DAPI复染剂用于使易位、扩增或拷贝数变化可视。本发明的一个实施方案包括这样的方法,在所述方法中,在第一步骤中确定c-MAF基因在受试者的样品中是否被易位。在一个优选实施方案中,样品为肿瘤组织样品。在一个具体实施方案中,用于对乳腺癌受试者发生骨转移的倾向进行预后的本发明的方法包括测定所述受试者(其中c-MAF基因被易位)的样品的c-MAF基因拷贝数,和将所述拷贝数与对照或参照样品的拷贝数相比较,其中如果c-MAF拷贝数大于对照样品的c-MAF拷贝数,则受试者具有更大的发生骨转移的倾向。用于确定c-MAF基因或染色体区16q22-q24是否被易位的方法在现有技术水平上是公知的,包括先前针对c-MAF的扩增所描述的那些方法。所述方法包括但不限于原位杂交(ISH)(例如荧光原位杂交(FISH)、生色原位杂交(CISH)或银原位杂交(SISH))、基因组比较杂交或聚合酶链式反应(例如实时定量PCR)。对于任何ISH法,扩增、拷贝数或易位可通过计数染色体或细胞核中的荧光点、有色点或具有银的点来测定。在其它实施方案中,拷贝数变化和易位的检测可通过使用全基因组测序、外体测序或通过使用任何PCR衍生技术来检测。例如,可对基因组DNA的样品进行PCR来检测易位。在一个实施方案中,使用定量PCR。在一个实施方案中,利用特异于c-MAF基因的引物和特异于IGH启动子区域的引物来进行PCR;如果产生产物,则易位已发生。在一些实施方案中,在测定c-MAF基因的易位后,测定c-MAF基因的扩增和拷贝数。在一些实施方案中,探针用于确定细胞对于c-MAF基因是否是多倍体。在一些实施方案中,通过确定是否存在超过2个来自目标基因的信号来进行多倍性的确定。在一些实施方案中,通过测量来自特异于目标基因的探针的信号并将其与着丝粒探针或其它探针相比较来确定多倍性。基于c-MAF基因扩增的检测而对三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的临床结果进行预后的方法在另一个方面,本发明涉及用于预测患有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的患者的临床结果的体外方法(在下文中为本发明的第七方法),其包括确定c-MAF基因在所述受试者的样品中相对于参照基因拷贝数是否被扩增,其中c-MAF基因相对于所述参照基因拷贝数的扩增表示不良临床结果。本发明的第七方法包括在第一步骤中确定c-MAF基因在受试者的样品中是否被扩增。基本上如本发明的第五方法中所描述的那样确定c-MAF的扩增。在一个优选实施方案中,样品为肿瘤组织样品。在一个优选实施方案中,c-MAF基因的扩增通过测定基因座16q23或16q22-q24的扩增来进行测定。在另一个优选实施方案中,c-MAF基因的扩增通过使用c-MAF基因-特异性探针来测定。在第二步骤中,本发明的第七方法包括将所述拷贝数与对照或参照样品的拷贝数相比较,其中如果c-MAF拷贝数大于对照样品的c-MAF拷贝数,则这表示不良临床结果。在一个优选实施方案中,当c-MAF基因拷贝数高于参照样品或对照样品具有的拷贝数时,则c-MAF基因相对于参照基因拷贝数被扩增。在一个实例中,如果测试样品中的c-MAF基因的基因组拷贝数相对于对照样品增加至少2倍(即,6个拷贝)、3倍(即,8个拷贝)、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、25倍、30倍、35倍、40倍、45倍或50倍,则c-MAF基因被认为被“扩增”。在另一个实例中,如果每细胞的c-MAF基因的基因组拷贝数为至少3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30等,则c-MAF基因被认为被“扩增”。在另一个实施方案中,参照基因拷贝数为来自未患有骨转移的受试者的三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌样品的基因拷贝数。在另一个实施方案中,通过原位杂交或PCR测定扩增。用于设计三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌或HER2+乳腺肿瘤患者的个体化疗法的方法如在现有技术水平上是已知的,待给患有癌症的受试者施用的治疗取决于后者是否是恶性肿瘤,即其是否具有高的经历转移的可能性,或后者是否是良性肿瘤。在第一种假定中,选择的治疗是全身性治疗例如化学疗法,在第二种假定中,选择的治疗是局部治疗例如放射疗法。因此,如本申请中所描述的,鉴于c-MAF基因在三阴性(包括基底样)乳腺癌细胞或可选择地ER+乳腺癌细胞中的c-MAF基因扩增或易位与骨转移的存在相关,因此,c-MAF基因扩增或易位可用于决定用于患有所述癌症的受试者的最适合疗法。在一个优选实施方案中,c-MAF基因的扩增通过测定基因座16q23或16q22-q24的扩增来测定。在另一个优选实施方案中,c-MAF基因扩增通过使用c-MAF基因-特异性探针来测定。因此,在另一个方面,本发明涉及用于设计用于患有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的受试者的个体化治疗的体外方法(在下文中为本发明的第三方法),所述方法包括:i)定量所述受试者的样品的c-MAF基因的扩增或易位,和ii)将i)中获得的基因扩增或易位与参照值比较,其中如果c-MAF基因扩增或易位相对于所述参照值增加,则所述受试者适宜于接受目标在于预防和/或治疗转移的疗法。如果c-MAF基因扩增或易位相对于所述参照值未增加,则所述受试者不适宜于接受目标在于预防和/或治疗骨转移的疗法。在一个优选实施方案中,c-MAF基因的扩增通过测定基因座16q23或16q22-q24的扩增来测定。在另一个优选实施方案中,c-MAF基因扩增通过使用c-MAF基因-特异性探针来测定。在一个具体实施方案中,骨转移是溶骨性转移。本发明的另一个方法包括定量患有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的受试者的样品中c-MAF基因扩增或易位。在一个优选实施方案中,样品为肿瘤组织样品。在另一个具体实施方案中,本发明的方法包括仅定量作为单一标志的c-MAF基因的扩增或易位,即,该方法不包括测定任何另外的标志的表达水平。在本发明的该特定方法的情况下,样品可以是受试者的原发肿瘤组织样品。在第二步骤中,将受试者的肿瘤样品中获得的c-MAF基因的扩增或易位与参照值比较。在一个优选实施方案中,参照值为所述基因在对照样品中的c-MAF基因的扩增或易位。必须使c-MAF基因的扩增或易位的测定与对照样品或参照样品的值发生关联。取决于待分析的肿瘤的类型,对照样品的确切性质可变化。因此,优选地参照样品为具有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的未发生转移的受试者的样品,或对应于在具有未转移的三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的受试者的活检样品的肿瘤组织标本中测量的c-MAF基因的扩增或易位。在已测量样品的c-MAF基因的扩增或易位并将其与参照值比较后,如果所述基因的基因扩增或易位相对于参照值增加,则可得出所述受试者适宜于接受目的在于预防(如果受试者还未经历转移的话)和/或治疗转移(如果受试者已经历转移的话)的疗法。当癌症已转移时,可使用全身性治疗,包括但不限于化学疗法、激素治疗、免疫疗法或其组合。此外,可使用放射疗法和/或手术。治疗的选择通常取决于原发性癌症的类型、尺寸、转移的位置、患者的年龄、一般健康状况和先前使用的治疗的类型。全身性治疗是到达整个身体的那些治疗,例如:-化学疗法是使用药物破坏癌细胞。通常通过口服或静脉内途径施用药物。有时,将化学疗法与放射治疗一起使用。乳腺癌的适当化学治疗性治疗包括但不限于蒽环类(多柔比星、表柔比星、PEG化脂质体多柔比星)、紫杉烷类(紫杉醇、多西他赛、白蛋白纳米颗粒结合的紫杉醇)、5-氟尿嘧啶(连续输注5-FU、卡培他滨)、长春花生物碱类(长春瑞滨、长春碱)、吉西他滨、铂盐(顺铂、卡铂)、环磷酰胺、依托泊苷以及上述试剂的一种或多种的组合,例如环磷酰胺/蒽环类+/-5-氟尿嘧啶方案(例如多柔比星/环磷酰胺(AC)、表柔比星/环磷酰胺、(EC)环磷酰胺/表柔比星/5-氟尿嘧啶(CEF)、环磷酰胺/多柔比星/5-氟尿嘧啶(CAF)、5-氟尿嘧啶/表柔比星/环磷酰胺(FEC))、环磷酰胺/甲氨蝶呤/5-氟尿嘧啶(CMF)、蒽环类/紫杉烷类(例如多柔比星/紫杉醇或多柔比星/多西他赛)、多西他赛/卡培他滨、吉西他滨/紫杉醇、紫杉烷/铂方案(例如紫杉醇/卡铂或多西他赛/卡铂)。免疫疗法是帮助患者的免疫系统本身抵抗癌症的治疗。存在几个类型的用于治疗患者的转移的免疫疗法。这些免疫疗法包括但不限于细胞因子、单克隆抗体和抗肿瘤疫苗。在另一个方面,治疗是Alpharadin(二氯化镭223)。Alpharadin使用来自镭-223衰变的α辐射来杀死癌细胞。镭-223通过其作为钙模拟物的性质天然地自我靶向骨转移。α辐射具有2-10个细胞的极短的射程(当与基于β或γ辐射的目前放射疗法相比较时),从而引起更少的对周围健康组织(特别地骨髓)的损伤。由于与钙相似的性质,镭-223被吸至其中使用钙来在体内构建骨的地方,包括更快的异常骨生长(例如在具有晚期去势抵抗性前列腺癌的男人的骨转移中看到的)的部位。镭-223在注射后于血流中被运送至异常骨生长的部位。癌症在体内开始的地方称为原发性肿瘤。这些细胞的一些可脱离并且于血流中被运送至身体的另一个部位。随后癌细胞可定居在身体的该部分,形成新的肿瘤。如果这发生,其称为继发性癌症或转移。大多数晚期前列腺癌患者在他们的骨中遭受最大疾病负担。利用镭-223的目的是选择性靶向该继发性癌症。骨中未被吸收的任何镭-223快速经过肠并被排泄掉。在另一个方面,治疗为mTor抑制剂。在一些方面,mTor抑制剂是双重mTor/PI3激酶抑制剂。在一些方面,mTor抑制剂用于预防或抑制转移。在一些方面,mTor抑制剂选自:ABI009(西罗莫司)、雷帕霉素(西罗莫司)、Abraxane(紫杉醇)、Absorb(依维莫司)、Afinitor(依维莫司)、AfinitorwithGleevec、AS703026(pimasertib)、Axxess(佐他莫司)、AZD2014、BEZ235、Biofreedom(佐他莫司)、BioMatrix(佐他莫司)、BioMatrixflex(佐他莫司)、CC115、CC223、ComboBio-engineeredSirolimusElutingStentORBUSNEICH(西罗莫司)、CuraxinCBLC102(米帕林)、DE109(西罗莫司)、DS3078、EndeavorDES(唑罗莫司)、EndeavorResolute(唑罗莫司)、Femara(来曲唑)、Hocena(安卓奎诺尔)、INK128、Inspiron(西罗莫司)、IPI504(盐酸瑞螺旋霉素)、KRN951(tivozanib)、ME344、MGA031(替利珠单抗)、MiStentSES(西罗莫司)、MKC1、Nobori(佐他莫司)、OSI027、OVI123(蛹虫草菌素)、Palomid529、PF04691502、PromusElement(依维莫司)、PWT33597、Rapamune(西罗莫司)、ResoluteDES(唑罗莫司)、RG7422、SAR245409、SF1126、SGN75(vorsetuzumabmafodotin)、Synergy(依维莫司)、Taltorvic(地磷莫司)、Tarceva(埃罗替尼)、Torisel(坦西莫司)、XiencePrime(依维莫司)、XienceV(依维莫司)、Zomaxx(唑罗莫司)、Zortress(依维莫司)、ZotarolimusElutingPeripheralStentMEDTRONIC(唑罗莫司)、AP23841、AP24170、ARmTOR26、BN107、BN108、CanstatinGENZYME(canstatin)、CU906、EC0371、EC0565、KI1004、LOR220、NV128、雷帕霉素ONCOIMMUNE(西罗莫司)、SB2602、SirolimusPNPSAMYANGBIOPHARMACEUTICALS(西罗莫司)、TOP216、VLI27、VS5584、WYE125132、XL388、Advacan(依维莫司)、AZD8055、CypherSelectPlusSirolimuselutingCoronaryStent(西罗莫司)、CypherSirolimuselutingcoronarystent(西罗莫司)、DrugCoatedBalloon(西罗莫司)、E-MagicPlus(西罗莫司)、Emtor(西罗莫司)、Esprit(依维莫司)、Evertor(依维莫司)、HBF0079、LCP-Siro(西罗莫司)、LimusCLARIS(西罗莫司)、mTOR抑制剂CELLZOME、NevoSirolimuselutingCoronaryStent(西罗莫司)、nPT-mTOR、Rapacan(西罗莫司)、Renacept(西罗莫司)、ReZolve(西罗莫司),Rocas(西罗莫司)、SF1126、Sirolim(西罗莫司)、SirolimusNORTHCHINA(西罗莫司)、SirolimusRANBAXY(西罗莫司)、SirolimusWATSON(西罗莫司)Siropan(西罗莫司)、Sirova(西罗莫司)、Supralimus(西罗莫司)、Supralimus-Core(西罗莫司)、TacrolimusWATSON(他罗利姆)、TAFA93、TemsirolimusACCORD(坦西莫司)、TemsirolimusSANDOZ(坦西莫司)、TOP216、XiencePrime(依维莫司)、XienceV(依维莫司)。在具体方面,mTor抑制剂为Afinitor(依维莫司)(http://www.afinitor.com/index.jsp?usertrack.filter_applied=true&NovaId=4029462064338207963;最近访问的,11/28/2012)。在另一个方面,将依维莫司与芳香酶抑制剂组合。(参见,例如,Baselga,J.,等人,EverolimusinPostmenopausalHormone-ReceptorPositiveAdvancedBreastCancer.2012.N.Engl.J.Med.366(6):520-529,将其通过引用并入本文)。在另一个方面,mTor抑制剂可通过本领域已知的方法来鉴定。(参见,例如,Zhou,H.等人UpdatesofmTorinhibitors.2010.AnticancerAgentsMed.Chem.10(7):571-81,将其通过引用并入本文)。在一些方面,mTor抑制剂用于治疗或预防或抑制对于激素受体是阳性的患者的转移。(参见,例如,Baselga,J.,等人,EverolimusinPostmenopausalHormone-ReceptorPositiveAdvancedBreastCancer.2012.N.Engl.J.Med.366(6):520-529)。在一些实施方案中,患者为ER+。在一些方面,mTor抑制剂用于治疗或预防或抑制晚期乳腺癌患者的转移。在一些方面,将mTor抑制剂与第二治疗组合使用。在一些方面,第二治疗是本文中描述的任何治疗。在另一个方面,治疗为Src激酶抑制剂。在一些方面,Src抑制剂用于预防或抑制转移。在一些方面,Src激酶抑制剂选自:AZD0530(沙拉替尼)、Bosulif(波舒替尼)、ENMD981693、KD020、KX01、Sprycel(达沙替尼)、Yervoy(伊匹木单抗)、AP23464、AP23485、AP23588、AZD0424、c-Src激酶抑制剂KISSEI、CU201、KX2361、SKS927、SRN004、SUNK706、TG100435、TG100948、AP23451、达沙替尼HETERO(达沙替尼)、达沙替尼VALEANT(达沙替尼)、Fontrax(达沙替尼)、Src激酶抑制剂KINEX、VX680,(乳酸托泽色替)、XL228和SUNK706。在一些实施方案中,Src激酶抑制剂为达沙替尼。在另一个方面,Src激酶抑制剂可通过本领域已知的方法(参见,例如,Sen,B.和Johnson,F.M.RegulationofSrcFamilyKinasesinHumanCancers.2011.J.SignalTransduction.2011:14pages,将其通过引用并入本文)来鉴定。在一些方面,Src激酶抑制剂用于治疗或预防或抑制对于SRC-响应特征(SRS)是阳性的患者的转移。在一些方面,患者为SRS+和ER-。(参见,例如,Zhang,CH.-F,等人LatentBoneMetastasisTiedtoSrc-Dependentsurvivalsignals.2009.CancerCell.16:67-78,将其通过引用并入本文)。在一些方面,Src激酶抑制剂用于治疗或预防或抑制晚期乳腺癌患者的转移。在一些方面,将Src激酶抑制剂与第二治疗组合使用。在一些方面,第二治疗是本文中描述的任何治疗。在另一个方面,治疗为COX-2抑制剂。在一些方面,COX-2抑制剂用于预防或抑制转移。在一些方面,COX-2抑制剂选自:ABT963、醋氨酚ERJOHNSON(醋氨酚)、AcularX(酮咯酸氨丁三醇)、BAY1019036(阿司匹林)、BAY987111(苯海拉明、萘普生钠)、BAYl1902(吡罗昔康)、BCIBUCH001(布洛芬)、Capoxigem(阿利考昔)、CS502、CS670(培比洛芬)、DiclofenacHPBCD(双氯芬酸)、Diractin(酮洛芬)、GW406381、HCT1026(硝基氟吡洛芬)、Hyanalgese-D(双氯芬酸)、HydrocoDex(醋氨酚、右美沙芬、氢可酮)、IbuprofenSodiumPFIZER(布洛芬钠)、IbuprofenwithAcetaminophenPFIZER(醋氨酚、布洛芬)、Impracor(酮洛芬)、IP880(双氯芬酸)、IP940(吲哚美辛)、ISV205(双氯芬酸钠)、JNS013(醋氨酚、盐酸曲马多)、KetoprofenTDS(酮洛芬)、LTNS001(naproxenetemesil)、MesalamineSALIX(氨水杨酸)、MesalamineSOFAR(氨水杨酸)、Mesalazine(氨水杨酸)、ML3000(利考非隆)、MRX7EAT(依托度酸)、NaproxenIROKO(萘普生)、NCX4016(硝基阿司匹林)、NCX701(硝基醋氨酚)、NuprinSCOLR(布洛芬)、OMS103HP(盐酸阿米替林、酮洛芬、盐酸羟甲唑啉)、Oralease(双氯芬酸)、OxycoDex(右美沙芬、氧可酮)、P54、PercoDex(醋氨酚、右美沙芬、氧可酮)、PL3100(萘普生、磷酯酰胆碱)、PSD508、R-Ketoprofen(酮洛芬)、Remura(溴芬酸钠)、ROX828(酮咯酸氨丁三醇)、RP19583(酮洛芬赖氨酸)、RQ00317076、SDX101(R-依托度酸)、TDS943(双氯芬酸钠)、TDT070(酮洛芬)、TPR100、TQ1011(酮洛芬)、TT063(S-氟比洛芬)、UR8880(西米考昔)、V0498TA01A(布洛芬)、VT122(依托度酸、普萘洛尔)、XP20B(醋氨酚、右丙氧芬)、XP21B(双氯芬酸钾)、XP21L(双氯芬酸钾)、Zoenasa(乙酰半胱氨酸,美沙拉嗪)、Acephen、Actifed+、Actifed-P、Acular、AcularLS、AcularPF、AcularX、Acuvail、雅维、雅维抗窦抗过敏、雅维抗感冒和抗窦、雅维解除堵塞、雅维PM、雅维PM胶囊、空气撒隆巴斯、Airtal、无酒精NyQuil解除感冒&流感、Aleve、AleveABDIIBRAHIM、Aleve-D、Alka-Seltzer、Alka-SeltzerBAYER、超强Alka-Seltzer、Alka-Seltzer柠檬-酸橙、原始Alka-Seltzer、Alka-Seltzer+、Alka-Seltzer+抗感冒和抗咳嗽、Alka-Seltzer+抗感冒和抗咳嗽配方、Alka-Seltzer+日夜抗感冒配方、Alka-Seltzer+白天无昏睡抗感冒配方、Alka-Seltzer+抗流感配方、Alka-Seltzer+夜晚抗感冒配方、Alka-Seltzer+抗窦配方、Alka-Seltzer+闪闪发光的原始抗感冒配方、Alka-SeltzerPM、Alka-Seltzer唤醒、Anacin、Anaprox、AnaproxMINERVA、Ansaid、蜂毒素、Apranax、Apranaxabdi、Arcoxia、抗关节炎配方Bengay、Arthrotec、Asacol、AsacolHD、AsacolMEDUNAARZNEIMITTEL、AsacolORIFARM、阿司匹林BAYER、复合阿司匹林、阿司匹林Migran、AZD3582、Azulfidine、BaralganM、BAY1019036、BAY987111、BAYl1902、BCIBUCH001、苯海拉明抗过敏、日夜苯海拉明、Benylin4抗流感、Benylin抗感冒和抗流感、Benylin日夜抗感冒和抗流感、Benylin日夜抗感冒和抗窦日夜、Benylin抗感冒和抗窦+、Benylin日夜解除感冒和流感、Benylin1All-In-One、Brexin、BrexinANGELINI、Bromday、百服宁、Buscopan+、Caldolor、Calmatel、Cambia、Canasa、Capoxigem、Cataflam、西乐葆、西乐葆ORIFARM、儿童雅维抗窦抗过敏、儿童泰诺、儿童泰诺抗咳嗽和抗流涕、儿童泰诺+抗感冒、儿童泰诺+抗感冒和抗咳嗽、儿童泰诺+抗感冒和抗流涕、儿童泰诺+抗流感、儿童泰诺+抗感冒&抗过敏、儿童泰诺+抗咳嗽&抗流涕、儿童泰诺+抗咳嗽&抗咽喉痛、儿童泰诺+抗多症状感冒、Clinoril、Codral抗感冒和流感、Codral日夜日片、Codral日夜夜片、晚间Codral、Colazal、Combunox、康泰克抗感冒+抗流感、康泰克抗感冒+抗流感无昏睡、CoricidinD、CoricidinHBP抗感冒和抗流感、CoricidinHBP日夜抗多症状感冒、CoricidinHBP抗最强流感、CoricidinHBP晚间抗多症状感冒、CoricidinII超强抗感冒和抗流感、CS502、CS670、Daypro、DayproAlta、DDS06C、Demazin抗感冒和抗流感、Demazin抗咳嗽、抗感冒和抗流感、Demazin日/夜抗感冒和抗流感、DemazinPE抗感冒和抗流感、DemazinPE日/夜抗感冒和抗流感、双氯芬酸HPBCD、Dimetapp日解除、Dimetapp抗多症状感冒和流感、Dimetapp夜解除、Dimetapp解除疼痛和发烧、DimetappPE抗窦抗疼痛、DimetappPE抗窦抗疼痛+抗过敏、Dipentum、Diractin、Disprin抗感冒'n'抗发烧、DisprinExtra、DisprinForte、Disprin+、Dristan抗感冒、初级Dristan、Drixoral+、Duexis、Dynastat、Efferalgan、Efferalgan+维生素C、Efferalgan维生素C、ElixsureIB、Excedrin背部和身体、Excedrin抗偏头痛、ExcedrinPM、Excedrin抗窦抗头痛、Excedrin抗紧张性头痛、Falcol、Fansamac、Feldene、FeverAll、Fiorinal、具有可待因的Fiorinal、Flanax、FlectorPatch、Flucam、Fortagesic、Gerbin、Giazo、Gladio、Goody's抗背部和身体疼痛、Goody's酷橙、Goody's超强、Goody'sPM、无油脂的Bengay、GW406381、HCT1026、HeXingYi、Hyanalgese-D、HydrocoDex、布洛芬钠PFIZER、具有对乙酰氨基酚的布洛芬PFIZER、IcyHotSANOFIAVENTIS、Impracor、Indocin、吲哚美辛APPPHARMA、吲哚美辛MYLAN、婴幼儿泰诺、IP880、IP940、Iremod、ISV205、JNS013、小泰诺、Junifen、初级强度雅维、初级强度美林、酮洛芬TDS、LemsipMax、LemsipMaxAllinOne、夜LemsipMaxAll、LemsipMax抗感冒和抗流感、Lialda、李施德林漱口水、劳埃德霜、Lodine、LorfitP、Loxonin、LTNS001、Mersyndol、美沙拉嗪SALIX、美沙拉嗪SOFAR、美沙拉嗪、MesasalGLAXO、MesasalSANOFI、Mesulid、MetsalHeatRub、MidolComplete、Midol扩展解除、Midol液体凝胶、MidolPM、Midol青少年配方、Migranin包衣片、ML3000、Mobic、Mohrus、美林、美林抗感冒和抗窦抗疼痛、美林PM、MovalisASPEN、MRX7EAT、Nalfon、NalfonPEDINOL、Naprelan、萘普生、萘普生RPG生命科学、萘普生IROKO、NCX4016、NCX701、NeoProfenLUNDBECK、Nevanac、Nexcede、Niflan、NorgesicMEDICIS、安乃近、NuprinSCOLR、Nurofen、Nurofen抗感冒和抗流感、Nurofen最强抗偏头痛、Nurofen+、Nuromol、具有维生素C的NyQuil、Ocufen、OMS103HP、Oralease、OrudisABBOTTJAPAN、Oruvail、Osteluc、OxycoDex、P54、必理通、必理通Actifast、Paradine、Paramax、Parfenac、Pedea、Pennsaid、颇得斯安、颇得斯安ORIFARM、Peon、Percodan、Percodan-Demi、PercoDex、Percogesic、Perfalgan、PL2200、PL3100、Ponstel、Prexige、Prolensa、PSD508、R-酮洛芬、Rantudil、Relafen、Remura、Robaxisal、Rotec、Rowasa、ROX828、RP19583、RQ00317076、Rubor、Salofalk、Salonpas、Saridon、SDX101、Seltouch、sfRowasa、Shinbaro、Sinumax、Sinutab、Sinutab、sinus、Spalt、Sprix、Strefen、Sudafed抗感冒和抗咳嗽、Sudafed抗头感冒和抗窦、SudafedPE抗感冒+抗咳嗽、SudafedPE抗压+抗疼痛、SudafedPE、严重感冒、SudafedPE抗窦日+夜解除日片、SudafedPE抗窦日+夜解除夜片、SudafedPE抗窦+抗炎疼痛解除、Sudafed高级抗窦、Surgam、Synalgos-DC、Synflex、Tavist抗过敏/抗窦/抗头痛、TDS943、TDT070、Theraflu抗感冒和抗咽喉痛、Theraflu日间抗严重感冒和咳嗽、Theraflu日间变暖解除、Theraflu变暖解除片日间抗多症状感冒、Theraflu变暖解除抗感冒和抗胸闷、Thomapyrin、ThomapyrinC、ThomapyrinEffervescent、ThomapyrinMedium、Tilcotil、Tispol、Tolectin、Toradol、TPR100、TQ1011、Trauma-Salbe、Trauma-SalbeKwizda、Treo、Treximet、Trovex、TT063、泰诺、泰诺抗多症状过敏、泰诺抗背部疼痛、泰诺抗感冒&抗咳嗽日间、泰诺抗感冒&抗咳嗽晚间、泰诺抗感冒和抗窦日间、泰诺抗感冒和抗窦夜间、泰诺抗严重感冒头堵塞、泰诺抗多症状感冒日间、泰诺抗多症状感冒夜间液体、泰诺抗严重多症状感冒、泰诺抗感冒无昏睡配方、泰诺抗感冒严重堵塞日间、泰诺抗完全感冒、夜间抗咳嗽和流感、泰诺抗流感夜间、经期泰诺、泰诺PM、泰诺抗窦堵塞&抗疼痛日间、泰诺抗窦堵塞&抗疼痛晚间、泰诺抗窦堵塞&抗疼痛严重、泰诺抗窦严重堵塞日间、泰诺超级解除、具有咖啡因和磷酸可待因的泰诺、具有磷酸可待因的泰诺、超强Bengay霜、Ultracet、UR8880、V0498TA01A、VicksNyQuil解除感冒和流感、Vicoprofen、Vimovo、扶他林乳胶剂、扶他林凝胶、扶他林NOVARTISCONSUMERHEALTHGMBH、扶他林XR、VT122、Xefo、快速Xefo、Xefocam、Xibrom、XL3、Xodol、XP20B、XP21B、XP21L、Zipsor和Zoenasa。在另一个方面,COX-2抑制剂可通过本领域已知的方法来鉴定(参见,例如,Dannhardt,G.和Kiefer,W.Cyclooxygenaseinhibitors-currentstatusandfutureprospects.2001.Eur.J.Med.Chem.36:109-126,将其通过引用并入本文)。在一些方面,COX-2抑制剂用于治疗或预防或抑制晚期乳腺癌的转移。在一些方面,将COX-2抑制剂与第二治疗组合使用。在一些方面,第二治疗是本文中描述的任何治疗。在一些方面,将COX-2抑制剂与第二治疗组合使用,所述第二治疗选自:地舒单抗、Zometa(http://www.us.zometa.com/index.jsp?usertrack.filter_applied=true&NovaId=2935376934467633633;最近访问,12/2/2012)、Carbozantinib或卡博替尼、阻断PTHLH(甲状旁腺激素样激素)或PTHrP(甲状旁腺激素相关蛋白)的抗体或肽和依维莫司。在另一个方面,用于避免和/或预防骨退化的治疗剂包括但不限于:-甲状旁腺激素(PTH)和甲状旁腺样激素(PTHLH)抑制剂(包括阻断性抗体)或其重组形式(对应于PTH的氨基酸7-34的特立帕肽)。该激素通过刺激破骨细胞和增强其活性起作用。-雷奈酸锶:为替代口服治疗,形成称为"双作用骨剂"(DABA)的药物的组的部分,因为它们刺激成骨细胞增殖并抑制破骨细胞增殖。-“雌激素受体调节剂”(SERM)是指干扰或抑制(无论什么机制)雌激素对受体的结合的化合物。雌激素受体调节剂的实例包括雌激素类、孕激素、雌二醇、屈洛昔芬、雷洛昔芬、拉索昔芬、TSE-424、他莫昔芬、艾多昔芬、LY353381、LY117081、托瑞米芬、fluvestrant、4-[7-(2,2-二甲基-1-氧丙氧基-4-甲基-2-[4-[2-(1-哌啶基)乙氧基]苯基]-2H-1-苯并吡喃-3-基]-苯基-2,2-二甲基丙酸4,4’二羟二苯甲酮-2,4-二硝基苯-腙和SH646等。-降钙素:通过降钙素受体直接抑制破骨细胞活性。已在破骨细胞的表面上鉴定了降钙素受体。-二磷酸盐类:为用于预防或治疗具有与乳腺癌和前列腺癌相关的骨吸收和再吸收的疾病例如骨质疏松症和具有骨转移的癌症(后者具有或不具有高钙血症)。可用于通过本发明的第五方法设计的疗法的二磷酸盐的实例包括但不限于含氮二磷酸盐(例如帕玛二磷酸盐、奈立膦酸盐、奥帕膦酸盐、阿屈膦酸盐、伊班膦酸盐、利塞膦酸盐、伊卡膦酸盐、唑来膦酸盐或唑来膦酸等)和非含氮二磷酸盐(例如羟乙磷酸盐、氯屈膦酸盐、替鲁膦酸盐等)。-“组织蛋白酶K抑制剂”是指干扰组织蛋白酶K半胱氨酸蛋白酶活性的化合物。组织蛋白酶K抑制剂的非限定性实例包括4-氨基-嘧啶-2-腈衍生物(在NovartisPharmaGMBH的名称下于国际专利申请WO03/020278中描述的)、公开案WO03/020721(NovartisPharmaGMBH)和公开案WO04/000843(ASTRAZENECAAB)中描述的吡咯并-嘧啶以及AxysPharmaceuticals的公开案PCTWO00/55126、MerckFrosstCanada&Co.和AxysPharmaceuticals的WO01/49288中描述的抑制剂。-“DKK-1(Dickkopf-1)抑制剂”,如本文中所用,是指能够降低DKK-1活性的任何化合物。DKK-1是主要在成人骨中表达的并且在具有溶骨性病变的骨髓瘤患者中被上调的可溶性Wnt途径拮抗剂。靶向DKK-1的试剂可在预防多发性骨髓瘤患者的溶骨性骨疾病中起作用。来自Novartis的BHQ880是一级完全人抗-DKK-1中和抗体。临床前研究支持如下假说:BHQ880促进骨形成,从而抑制肿瘤诱导的溶骨性疾病(EttenbergS.等人,AmericanAssociationforCancerResearchAnnualMeeting.April12–16,2008;SanDiego,Calif.Abstract)。-“双重MET和VEGFR2抑制剂”,如本文中所用,是指作为被设计来阻断MET驱动的肿瘤逃逸的MET和VEGF途径的高效双重抑制剂的任何化合物。MET不仅在肿瘤细胞和内皮细胞中而且还在成骨细胞(骨形成细胞)和破骨细胞(骨去除细胞)中表达。HGF结合所有这些细胞类型上的MET,从而赋予MET途径在多个自分泌和旁分泌回路中的重要作用。肿瘤细胞中MET的活化在转移性骨病变的建立中似乎是非常重要的。同时,成骨细胞和破骨细胞中MET途径的活化可导致骨转移的病理特征,包括异常骨生长(即,增生性病变)或破坏(即,溶解性病变)。因此,靶向MET途径可以是预防转移性骨病变的建立和进展的可行策略。卡博替尼(Exelixis,Inc),以前称为XL184(CAS849217-68-1),是被设计来阻断MET驱动的肿瘤逃逸的MET和VEGF途径高效双重抑制剂。在多个临床前研究中,已显示卡博替尼杀死肿瘤细胞、减少转移和抑制血管生成(支持肿瘤生长所必需的新血管的形成)。另一种适当的双重抑制剂为E7050(N-[2-氟-4-({2-[4-(4-甲基哌嗪-1-基)哌啶-1-基]羰基氨基吡啶-4-基}氧)苯基]-N′-(4-氟苯基)环丙烷-1,1-二甲酰胺(2R,3R)-酒石酸盐)(CAS928037-13-2)或Foretinib(也称为GSK1363089、XL880、CAS849217-64-7)。-“RANKL抑制剂”,如本文中所用,是指能够降低RANK活性的任何化合物。RANKL发现于基质的成骨细胞膜和T淋巴细胞的表面上,这类T-淋巴细胞是唯一的已显示分泌其的能力的淋巴细胞。其主要功能是破骨细胞(参与骨吸收的细胞)的活化。RANKL抑制剂可通过阻断RANKL对其受体(RANK)的结合,阻断RANK-介导的信号转导或通过阻断RANKL的转录或翻译而减少RANKL的表达来起作用。适合用于本发明的RANKL拮抗剂或抑制剂包括但不限于:○适当的RANK蛋白,其能够结合RANKL并且包含RANK蛋白的整个细胞外结构域或所述结构域的片段。可溶性RANK可包含信号肽和鼠或人RANK多肽的细胞外结构域,或可选择地,可使用除去信号肽的蛋白质成熟形式。○骨保护素或具有RANKL结合能力的其变体。○RANKL-特异性反义分子○能够加工RANKL的转录产物的核酶○特异性抗-RANKL纳米抗体。“抗-RANKL抗体或针对RANKL的抗体”在本文中理解为所有能够特异性结合核因子κB(RANKL)的受体的配体、从而抑制一个或多个RANKL功能的抗体。抗体可使用本领域普通技术人员已知的方法的任何方法来制备。因此,多克隆抗体通过用待抑制的蛋白免疫动物来制备。单克隆抗体使用Kohler,Milstein等人(Nature,1975,256:495)描述的方法来制备。适用于本发明的说明书的抗体包括包含可变抗原结合区和恒定区的完整抗体、片段“Fab”、“F(ab′)2”和“Fab`”、Fv、scFv、双链抗体和双特异性抗体。特异性抗-RANKL纳米抗体。纳米抗体是包含天然存在的重链抗体的独特结构和功能性质的抗体衍生治疗性蛋白。纳米抗体技术最初是在发现骆驼科(骆驼和骆马)具有不存在轻链的全功能抗体后开发而来的。纳米抗体的一般结构为FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4其中FR1至FR4是构架区1至4。CDR1至CDR3是互补决定区1至3。这些重链抗体包含单个可变结构域(VHH)和两个恒定结构域(CH2和CH3)。重要地,克隆和分离的VHH结构域是优选地稳定的多肽,其具有原始重链抗体的完全抗原结合能力。这些新发现的具有独特结构和功能性质的VHH结构域形成了Ablynx称其为纳米抗体的新一代治疗性抗体的基础。在一个实施方案中,RANKL抑制剂选自RANKL特异性抗体、RANKL特异性纳米抗体和骨保护素。在一个具体实施方案中,抗-RANKL抗体是单克隆抗体。在更具体实施方案中,抗-RANKL抗体为地舒单抗(Pageau,StevenC.(2009)。mAbs1(3):210-215,CAS编号615258-40-7)(将其完整内容通过引用并入本文)。地舒单抗是结合RANKL并且阻止其激活(其不结合RANK受体)的完全人单克隆抗体。地舒单抗的各个方面由美国专利No.6,740,522;7,411,050;7,097,834;7,364,736(将所述美国专利的每一个的完整内容通过引用整体并入本文)涵盖。在另一个实施方案中,RANKL抑制剂为与地舒单抗结合相同表位的抗体、抗体片段或融合构建体。在一个优选实施方案中,抗-RANKL纳米抗体是WO2008142164(将其内容通过引用并入本申请)中描述的任何纳米抗体。在一个更优选实施方案中,抗-RANKL抗体为ALX-0141(Ablynx)。ALX-0141已被设计来抑制与绝经后骨质疏松、类风湿关节炎、癌症和某些药剂相关的骨丢失,和恢复健康骨代谢的平衡。在一个优选实施方案中,预防骨退化的试剂选自二磷酸盐、RANKL抑制剂、PTH和PTHLH抑制剂或PRG类似物、雷奈酸锶、DKK-1抑制剂、双重MET和VEGFR2抑制剂、雌激素受体调节剂、镭-223、降钙素和组织蛋白酶K抑制剂。在一个更优选实施方案中,预防骨退化的试剂为二磷酸盐。在一个更优选实施方案中,二磷酸盐为唑来膦酸。在一个实施方案中,CCR5拮抗剂被施用来预防或抑制原发性乳腺癌肿瘤至骨的转移。在一个实施方案中,CCR5拮抗剂为大分子。在另一个实施方案中,CCR5拮抗剂为小分子。在一些实施方案中,CCR5拮抗剂为马拉韦罗(Velasco-Veláquez,M.等人2012.CCR5AntagonistBlocksMetastasisofBasalBreastCancerCells.CancerResearch.72:3839-3850.)。在一些实施方案中,CCR5拮抗剂为维立韦罗(Velasco-Veláquez,M.等人2012.CCR5AntagonistBlocksMetastasisofBasalBreastCancerCells.CancerResearch.72:3839-3850.)。在一些方面,CCR5拮抗剂为阿拉韦罗(DemarestJ.F.等人2005.UpdateonAplaviroc:AnHIVEntryInhibitorTargetingCCR5.Retrovirology2(Suppl.1):S13)。在一些方面,CCR5拮抗剂为螺哌啶CCR5拮抗剂。(RotsteinD.M.等人2009.SpiropiperidineCCR5antagonists.Bioorganic&MedicinalChemistryLetters.19(18):5401-5406。在一些实施方案中,CCR5拮抗剂为INCB009471(Kuritzkes,D.R.2009.HIV-1entryInhibitor:anoverview.Curr.Opin.HIVAIDS.4(2):82-7)。在一个优选实施方案中,双重MET和VEGFR2抑制剂选自卡博替尼、Foretinib和E7050。在一个优选实施方案中,镭223疗法为alpharadin。或者,可进行联合治疗,其中将超过一种来自上述试剂的试剂组合以治疗和/或预防转移,或可将所述试剂与其它补充剂例如钙或维生素D或与激素治疗组合。使用c-MAF抑制剂治疗三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的骨转移的方法在另一个方面,本发明涉及用于治疗或预防乳腺癌例如三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的骨转移的c-MAF抑制剂(在下文中,本发明的抑制剂)。在另一个方面,本发明涉及c-MAF抑制剂用于制造用于治疗或预防三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的骨转移的药剂的用途。在另一个方面,本发明涉及用于治疗或预防有此需要的受试者的三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的骨转移的方法,包括给所述受试者施用c-MAF抑制剂。在另一个方面,本发明涉及用于预防或降低患有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的受试者发生骨转移的风险的方法,所述方法包括给所述受试者施用预防或减少骨转移的试剂,其中按照通过定量所述受试者的c-MAF表达水平确定的治疗方案施用所述试剂。以非限定性示例为例,适用于本发明的c-MAF抑制剂包括反义寡核苷酸、干扰RNA(siRNA)、催化性RNA、特异性核酶、抑制性抗体或纳米抗体、显性阴性c-MAF变体或者来自表1或2的化合物。反义寡核苷酸本发明的另一个方面涉及分离的“反义”核酸用于抑制表达,例如用于抑制核酸的转录和/或翻译的用途,所述核酸编码其活性将被抑制的c-MAF。反义核酸可通过常规碱基互补性,或例如在结合双链DNA情况下通过双螺旋的大沟中的特异性相互作用,结合于药物的潜在靶。通常地,这些方法是指一系列本领域中通常使用的技术,它们包括基于对寡核苷酸序列的特异性结合的任何方法。可将本发明的反义构建体例如作为表达质粒来进行分配,所述表达质粒当在细胞中转录时产生与编码c-MAF的细胞mRNA的至少一个独特部分互补的RNA。或者,反义构建体是离体产生的寡核苷酸探针,所述探针当被引入细胞时通过与靶核酸的mRNA和/或基因序列杂交来抑制基因表达。这样的寡核苷酸探针优选为修饰的寡核苷酸,其抗内源核酸酶,例如外切核酸酶和/或内切核酸酶,从而在体内是稳定的。用作反义寡核苷酸的核酸分子的实例为氨基磷酸酯、硫代磷酸酯(phosphothionate)和甲基膦酸酯的DNA类似物(也参见美国专利No.5,176,996;5,264,564;和5,256,775)(将所述美国专利的每一个专利通过引用整体并入本文)。此外,已在例如VanderKrol等人,BioTechniques6:958-976,1988;和Stein等人,CancerRes48:2659-2668,1988中综述了用于构建可用于反义疗法的寡聚物的一般逼近法。关于反义寡核苷酸,来源于翻译起始位置的寡脱氧核糖核苷酸区域(例如靶基因的-10与+10之间)是优选的。反义逼近牵涉与编码靶多肽的mRNA互补的寡核苷酸设计(DNA或RNA)。反义寡核苷酸将结合于转录的mRNA并且翻译被阻止。与mRNA的5’末端互补的寡核苷酸,例如直达起始密码子AUG并包括起始密码子的5’非翻译序列肯定以最高效方式抑制翻译。然而,最近已显示与mRNA的3’非翻译序列互补的序列对于抑制mRNA翻译也是高效的(Wagner,Nature372:333,1994)。因此,互补寡核苷酸可在基因的5’或3’非翻译区(基因的非编码区)用于反义逼近以抑制该mRNA的翻译。与mRNA的5’非翻译区互补的寡核苷酸必须包括起始密码子AUG的互补序列。与mRNA的编码区互补的寡核苷酸是不太高效的翻译抑制剂,但也可根据本发明使用它们。如果它们被设计来与mRNA的5’区、3’区或编码区杂交,那么反义核酸必须具有至少6个核苷酸长并且优选具有少于约100,更优选少于约50、25、17或10个核苷酸长。优选地,首先进行体外研究来定量反义寡核苷酸抑制基因表达的能力。优选地这些研究使用区分寡核苷酸的反义基因抑制与非特异性生物效应的对照。还优选地,这些研究将靶RNA或蛋白质的水平与RNA或蛋白质的内部对照的水平相比较。可将使用反义寡核苷酸获得的结果与使用对照寡核苷酸获得的结果相比较。优选地,对照寡核苷酸与待测定的寡核苷酸具有大致相同的长度,并且寡核苷酸序列与反义序列的差异并不大于阻止对靶序列的特异性杂交所必要的程度。反义寡核苷酸可以是单链或双链DNA或RNA或其嵌合混合物或衍生物或修饰形式。可修饰寡核苷酸的碱基、糖基或磷酸骨架来例如增强分子的稳定性、其杂交能力等。寡核苷酸可包括其它结合的基团,例如肽(例如,用于将它们导向宿主细胞的受体)或用于帮助通过细胞膜的运输(参见,例如,Letsinger等人,Proc.Natl.Acad.Sci.U.S.A.86:6553-6556,1989;Lemaitre等人,Proc.Natl.Acad.Sci.84:648-652,1987;PCT公布No.WO88/09810)或血脑屏障(参见,例如,PCT公布No.WO89/10134)的试剂、嵌入剂(参见,例如,Zon,Pharm.Res.5:539-549,1988)。为此目的,可将寡核苷酸缀合于另一种分子,例如,肽、运输载体、杂交触发的切割剂等。反义寡核苷酸可包含至少一个基团的修饰碱基。反义寡核苷酸还可包含至少一个修饰糖基,其选自但不限于阿拉伯糖、2-氟阿拉伯糖、木酮糖和己糖。反义寡核苷酸还可包含与中性肽相似的骨架。这样的分子称为肽核酸(PNA)寡聚物并且描述于例如Perry-O’Keefe等人,Proc.Natl.Acad.Sci.U.S.A.93:14670,1996,和Eglom等人,Nature365:566,1993中。在另一个实施方案中,反义寡核苷酸包含至少一个被修饰的磷酸骨架。在另一个实施方案中,反义寡核苷酸为α-异头寡核苷酸。可使用与靶mRNA序列的编码区互补的反义寡核苷酸,还可使用与转录的非翻译区互补的那些反义寡核苷酸。在一些情况下,可能难以达到足够的细胞内浓度的反义寡核苷酸来抑制内源mRNA翻译。因此,优选的近似法使用其中反义寡核苷酸被置于强polIII或polII启动子控制下的重组DNA构建体。或者,可通过指导与基因调控区(即,启动子和/或增强子)互补的脱氧核糖核苷酸序形成三螺旋结构,从而阻止机体内靶细胞的基因转录来减少靶基因表达(总体参考Helene,AnticancerDrugDes.6(6):569-84,1991)。在某些实施方案中,反义寡核苷酸是反义吗啉类。siRNA小干扰RNA或siRNA为能够通过RNA干扰抑制靶基因表达的试剂。siRNA可通过化学方法合成,可通过体外转录获得或可在靶细胞中体内合成。通常地,siRNA由15至40个核苷酸长的双链RNA组成,可包含1至6个核苷酸的3’和/或5’突出区。突出区的长度不依赖于siRNA分子的总长度。siRNA通过在转录后降解或沉默靶信使来起作用。本发明的siRNA与c-MAF编码基因的mRNA或编码所述蛋白质的基因序列大体上同源。“大体上同源”应理解为具有与靶mRNA充分互补或相似的序列,以便siRNA能够通过RNA干扰降解后者。适合用于引起所述干扰的siRNA包括通过RNA形成的siRNA以及包含不同化学修饰的siRNA,例如:-其中核苷酸之间的键与自然界中出现的键不同(例如硫代磷酸酯键)的siRNA。-RNA链与功能试剂例如荧光基团的缀合物。-通过在2’位置具有不同羟基官能团的修饰对RNA链的末端,特别地3’末端的修饰。-在2’位置上具有例如O-烷化残基的被修饰糖如2’-O-甲基核糖或2’-O-氟代核糖的核苷酸。-具有修饰碱基例如卤代碱基(例如5-溴尿嘧啶和5-碘尿嘧啶)、烷化碱基(例如7-甲基鸟苷)的核苷酸。可以以具有上述特征的双链RNA的形式使用siRNA。或者,可能在适当的启动子控制下使用包含siRNA的有义和反义链序列的载体以在目标细胞中对其表达。适合用于表达siRNA的载体是这样的载体,在所述载体中编码siRNA的两条链的两个DNA区域串联排列在通过间隔区(所述间隔区在转录后形成环)分隔的同一条DNA链中,并且单个启动子指导DNA分子的转录从而产生shRNA。或者,可能使载体,其中从不同转录单位的转录形成每一条形成siRNA的链。这些载体从而被分成趋异(divergent)和趋同(convergent)转录载体。在异向转录载体中,编码每一条形成siRNA的DNA链的转录单位串联地存在于载体中,以便每一条DNA链的转录依赖于其自已的启动子,所述启动子可以相同或不同(Wang,J.等人,2003,Proc.Natl.Acad.Sci.USA.,100:5103-5106和Lee,N.S.,等人,2002,Nat.Biotechnol.,20:500-505)。在趋同转录载体中,产生siRNA的DNA区域形成侧翼连接两个反向启动子的DNA区域的有义和反义链。在有义和反义RNA链转录后,后者将形成用于形成功能性siRNA的杂交体。已描述了其中使用2个U6启动子(Tran,N.等人,2003,BMCBiotechnol.,3:21)、小鼠U6启动子和人H1启动子(Zheng,L.,等人,2004,Proc.Natl.Acad.Sci.USA.,135-140和WO2005026322)以及人U6启动子和小鼠H1启动子(Kaykas,A.和Moon,R.,2004,BMCCellBiol.,5:16)的具有反向启动子系统的载体。适合其在从趋同或趋异表达载体的表达中使用的启动子包括与将在其中表达siRNA的细胞相容的任何启动子或启动子对。因此,适合用于本发明的启动子包括但不限于组成型启动子例如来源于真核生物病毒例如多瘤病毒、腺病毒、SV40、CMV、禽肉瘤病毒、乙型肝炎病毒的基因组的启动子、金属硫蛋白基因启动子、单纯疱疹病毒的胸苷激酶基因启动子、逆转录病毒LTR区域、免疫球蛋白基因启动子、肌动蛋白基因启动子、EF-1α基因启动子,以及其中蛋白质表达依赖于分子或外源信号的添加的诱导型启动子例如四环素系统、NFkappaB/UV光系统、Cre/Lox系统和热激基因启动子、WO/2006/135436中描述的调控型RNA聚合酶II启动子以及组织特异性启动子(例如,WO2006012221中描述的PSA启动子)。在一个优选实施方案中,启动子为组成型地起作用的RNA聚合酶III启动子。RNA聚合酶III启动子发现于有限数目的基因例如5SRNA,tRNA,7SLRNA和U6snRNA中。与其它RNA聚合酶III启动子不同,III型启动子不需要任何基因内序列,但需要以5’方向在位置-34和-24包含TATA框、在-66与-47之间包含近端序列元件或PSE以及在一些情况下在-265与-149之间包含远端序列元件或DSE的序列。在一个优选实施方案中,III型RNA聚合酶III启动子为人或鼠H1和U6基因启动子。在另外一个更优选的实施方案中,启动子为2个人或鼠U6启动子、小鼠U6启动子和人H1启动子或人U6启动子和小鼠H1启动子。在本发明的说明书中,ERα基因启动子或细胞周期蛋白D1基因启动子特别适合,从而它们对于在乳腺肿瘤中,优选在三阴性(包括基底样)乳腺肿瘤中特异性表达目标基因是特别优选的。可从所谓的shRNA(短发夹RNA)细胞内地产生siRNA,所述shRNA的特征在于形成siRNA的反向平行链通过环或发夹区域连接。shRNA可由质粒或病毒,特别地递转录病毒编码,并且处于启动子的控制之下。适合用于表达shRNA的启动子是在上述段落中针对表达siRNA所述的那些启动子。适合表达siRNA和shRNA的载体包括原核生物表达载体例如pUC18、pUC19、Bluescript及其衍生物、mp18、mp19、pBR322、pMB9、CoIEl、pCRl、RP4、噬菌体以及穿梭载体例如pSA3和pAT28、酵母表达载体例如2-微米质粒类型载体、整合质粒、YEP载体、着丝粒质粒等、昆虫表达载体例如pAC系列载体和pVL系列载体、植物表达载体例如pIBI、pEarleyGate、pAVA、pCAMBIA、pGSA、pGWB、pMDC、pMY、pORE系列载体等,和基于病毒(腺病毒、腺病毒相关病毒以及逆转录病毒特别地慢病毒)的高等真核细胞表达载体或非病毒载体例如pcDNA3、pHCMV/Zeo、pCR3.1、pEFl/His、pIND/GS、pRc/HCMV2、pSV40/Zeo2、pTRACER-HCMV、pUB6/V5-His、pVAXl、pZeoSV2、pCI、pSVLandpKSV-10、pBPV-1、pML2d和pTDTl。在一个优选实施方案中,载体是慢病毒载体。本发明的siRNA和shRNA可使用一系列本领域普通技术人员已知的技术来获得。用作设计siRNA的基础的核苷酸序列的区域是无限制的,其可包含编码区(起始密码子与终止密码子之间)的序列,或其可以可选择地在相对于起始密码子的3’方向位置的任何位置中包含优选25至50个核苷酸长的非翻译5’或3’区的序列。设计siRNA的一个方法包括鉴定其中N可以是c-MAF基因序列中的任意核苷酸的AA(N19)TT基序,和选择具有高G/C含量的那些基序。如果未发现所述基序,可能鉴定其中N可以是任意核苷酸的NA(N21)基序。c-MAF特异性siRNA包括WO2005046731中描述的siRNA,所述siRNA的链之一为ACGGCUCGAGCAGCGACAA(SEQIDNO:6)。其它c-MAF特异性siRNA序列包括但不限于CUUACCAGUGUGUUCACAA(SEQIDNO:7)、UGGAAGACUACUACUGGAUG(SEQIDNO:8)、AUUUGCAGUCAUGGAGAACC(SEQIDNO:9)、CAAGGAGAAAUACGAGAAGU(SEQIDNO:10)、ACAAGGAGAAAUACGAGAAG(SEQIDNO:11)和ACCUGGAAGACUACUACUGG(SEQIDNO:12)。DNA酶在另一方面,本发明还涉及DNA酶用于抑制本发明的c-MAF基因的表达的用途。DNA酶整合了反义与核酶技术的一些机械性质。DNA酶被设计成识别与反义寡核苷酸相似的特定靶核酸序列,然而与核酶一样,它们具有催化性并且特异性切割靶核酸。核酶还可使用被设计来催化地切割靶mRNA的转录产物以阻止编码其活性将被抑制的c-MAF的mRNA翻译的核酶分子。核酶是能够催化特异性RNA切割的酶促RNA分子(关于综述,参见,Rossi,CurrentBiology4:469-471,1994)。核酶作用的机制牵涉核酶分子序列与互补靶RNA的特异性杂交和随后内切核苷酸切割事件。核酶分子的组成优选包括与靶mRNA互补的一个或多个序列和公知的负责切割mRNA的序列或功能等同的序列(参见,例如,美国专利No.5093246)。本发明中使用的核酶包括锤头核酶、内切核糖核酸酶RNA(在下文中称为“Cech型核酶”)(Zaug等人,Science224:574-578,1984)。核酶可由被修饰的寡核苷酸形成(例如以增强稳定性、靶向等),它们应当被分配至在体内表达靶基因的细胞。一种优选的分配方法包括使用在强组成型polIII或polII启动子控制下“编码”核酶的DNA构建体,以便转染的细胞可产生足够量的核酶来破坏内源靶信使和抑制翻译。由于核酶具有催化性,因此与其它反义分子不同,低细胞内浓度是其功效所需要的。抑制性抗体在本发明的说明书中,“抑制性抗体”被理解为能够特异性结合c-MAF蛋白并抑制所述蛋白的一个或多个功能(优选与转录相关的那些功能)的任何抗体。可使用本领域普通技术人员已知的任何方法来制备抗体,所述抗体中的一些已在上文中提及。因此,通过用待被抑制的蛋白质免疫动物来制备多克隆抗体。使用Kohler,Milstein等人(Nature,1975,256:495)描述的方法制备单克隆抗体。在本发明的说明书中,适当的抗体包括含有可变抗原结合区和恒定区的完整抗体、“Fab”、“F(ab′)2”和“Fab`”、Fv、scFv片段、双链抗体、双特异性抗体、alphabody、环肽和装订肽。在鉴定具有c-MAF蛋白结合能力的抗体后,使用抑制剂鉴定测定法选择能够抑制该蛋白的活性的抗体。抑制性肽如本文中所用,术语“抑制性肽”是指能够结合c-MAF蛋白并抑制其活性(如上文中已解释的),即阻止c-MAF激活基因转录的那些肽。负c-MAF显性子由于来自MAF家族的蛋白质能够同二聚化和与AP-1家族的其它成员例如Fos和Jun异二聚化,因此抑制c-MAF活性的一种方式是通过使用能够与c-MAF二聚化但缺乏激活转录的能力的负显性子(negativedominants)。因此,负c-MAF显性子可以是存在于细胞中并且缺乏2/3的包含反式激活结构域的氨基末端的任何小maf蛋白(例如,mafK、mafF、mafg和pi8)(Fujiwara等人(1993)Oncogene8,2371-2380;Igarashi等人(1995)J.Biol.Chem.270,7615-7624;Andrews等人(1993)Proc.Natl.Acad.Sci.USA90,11488-11492;Kataoka等人(1995)Mol.Cell.Biol.15,2180-2190)(Kataoka等人(1996)Oncogene12,53-62)。或者,负c-MAF显性子包括维持与其它蛋白的二聚化的能力但缺乏激活转录的能力的c-MAF变体。这些变体是例如缺乏位于蛋白的N末端的c-MAF反式激活结构域的变体。因此,负c-MAF显性子变体以举例说明的方式包括其中已除去至少氨基酸1-122、至少氨基酸1-187或至少氨基酸1至257(通过将考虑US6274338中描述的人c-MAF的编号)的变体。本发明涉及负c-MAF显性子变体和在适合在靶细胞中表达的启动子的有效控制下编码c-MAF的多核苷酸的用途。可用于调控本发明的多核苷酸转录的启动子可以是组成型启动子,即在基线水平上指导转录的启动子,或其中转录活性需要外部信号的诱导型启动子。适合用于调控转录的组成型启动子,除其它以外,为CMV启动子、SV40启动子、DHFR启动子、小鼠乳房肿瘤病毒(MMTV)启动子、1a延伸因子(EFla)启动子、白蛋白启动子、ApoA1启动子、角蛋白启动子、CD3启动子、免疫球蛋白重链或轻链启动子、神经丝启动子、神经元特异性烯醇酶启动子、L7启动子、CD2启动子、肌球蛋白轻链激酶启动子、HOX基因启动子、胸苷激酶启动子、RNA聚合酶II启动子、MyoD基因启动子、磷酸甘油酸激酶(PGK)基因启动子、低密度脂蛋白(LDL)启动子、肌动蛋白基因启动子。在一个优选实施方案中,调控反式激活因子的表达的启动子为PGK基因启动子。在一个优选实施方案中,调控本发明的多核苷酸转录的启动子为T7噬菌体的RNA聚合酶启动子。优选地,可用于本发明的背景的诱导型启动子是对诱导剂起反应(在诱导剂不存在的情况下显示为0或可忽略的基线表达),并且能够促进位于3’位置的基因的激活的启动子。取决于诱导剂的类型,诱导型启动子被分类为Tet开/关启动子(Gossen,M.andH.Bujard(1992)Proc.Natl.Acad.Sci.USA,89:5547-5551;Gossen,M.等人,1995,Science268:1766-1769;Rossi,F.M.V.andH.M.Blau,1998,Curr.Opin.Biotechnol.9:451-456);Pip开/关启动子(US6287813);抗孕酮依赖性启动子(US2004132086)、蜕皮激素依赖性启动子(Christopherson等人,1992,Proc.Natl.Acad.Sci.USA,89:6314-6318;No等人,1996,Proc.Natl.Acad.Sci.USA,93:3346-3351,Suhr等人,1998,Proc.Natl.Acad.Sci.USA,95:7999-8004andWO9738117)、金属硫蛋白依赖性启动子(WO8604920)和雷帕霉素依赖性启动子(Rivera等人,1996,Nat.Med.2:1028-32)。适合用于表达编码负c-MAF显性变体的多核苷酸的载体包括从原核表达载体衍生的载体例如pUC18、pUC19、Bluescript及其衍生物、mp18、mp19、pBR322、pMB9、ColEl、pCRl、RP4、噬菌体和穿梭载体例如pSA3和pAT28、酵母表达载体例如2-微米类型质粒载体、整合质粒、YEP载体、着丝粒质粒等,昆虫细胞表达载体例如pAC系列载体和pVL系列载体、植物表达载体例如pIBI、pEarleyGate、pAVA、pCAMBIA、pGSA、pGWB、pMDC、pMY、pORE系列载体等,以及基于病毒载体(腺病毒、腺病毒相关病毒以及逆转录病毒,特别地慢病毒)的高等真核细胞表达载体或非病毒载体例如pSilencer4.1-CMV(Ambion)、pcDNA3、pcDNA3.1/hygpHCMV/Zeo、pCR3.1、pEFl/His、pIND/GS、pRc/HCMV2、pSV40/Zeo2、pTRACER-HCMV、pUB6/V5-His、pVAXl、pZeoSV2、pCI、pSVL和pKSV-10、pBPV-1、pML2d和pTDTl。小分子适合用于本发明的其它c-MAF抑制性化合物包括:表1:具有c-MAF抑制能力的小分子其它c-MAF抑制剂描述于专利申请WO2005063252(将其通过引用整体并入本文),例如下表(表2)中显示的。表2:c-MAF抑制剂在一个优选实施方案中,骨转移是溶骨性转移。通常将c-MAF抑制剂与药学上可接受的载体组合施用。术语“载体”是指籍以施用活性成分的稀释剂或赋形剂。这样的药物载体可以是无菌液体例如水和油,包括石油、动物、植物或合成来源的油,例如花生油、大豆油、矿物油、芝麻油等。水或盐水溶液以及葡萄糖和甘油水溶液,特别地对于可注射溶液,优选用作载体。适当的药物载体描述于E.W.Martin,1995的“Remington'sPharmaceuticalSciences”中。优选地,本发明的载体通过州或联邦政府管理机构批准或列入美国药典或通常承认其在动物,更具体地人类中的用途的其它药典。用于生产本发明的药物组合物的期望的药物剂型所必需的载体和辅助物质,除其它因素外,将取决于选择的药物剂型。按照本领域普通技术人员已知的常规方法生产药物组合物的所述药物剂型。施用待使用的活性成分、赋形剂的不同方法和用于产生它们的过程的综述可见于“TratadodeFarmaciaGalénica”,C.FaulíiTrillo,Luzán5,S.A.1993年版。药物组合物的实例包括用于口服、局部或胃肠外施用的任何固体组合物(片剂、丸剂、胶囊剂、粒剂等)或液体组合物(溶液、悬浮液或乳剂)。此外,如认为有必要,药物组合物可包含稳定剂、混悬剂、防腐剂、表面活性剂等。对于在药剂的使用,c-MAF抑制剂可以以前药、盐、溶剂化物或包合物(clathrate)的形式(分离地或与另外的活性剂组合地)存在,并且可将其与药学上可接受的赋形剂一起配制。对于其在本发明中的用途是优选的赋形剂包括糖、淀粉、纤维素、像胶和蛋白质。在一个具体实施方案中,可以以固体药物剂型(例如片剂、胶囊剂、丸剂、粒剂、栓剂、可被重建以提供液体形式的无菌晶体或无定形固体等)、液体药物剂型(例如溶液、悬浮液、乳剂、酏剂、洗剂、软膏剂等)或半固体药物剂型(凝胶、软膏剂、乳膏剂等)配制本发明的药物组合物。本发明的药物组合物可通过任何途径来施用,包括但不限于口服途径、静脉内途径、肌内途径、动脉内途径、髓腔内(intramedularry)途径、鞘内途径、心室内途径、经皮途径、皮下途径、腹膜内途径、鼻内途径、经肠途径、局部途径、舌下途径或直肠途径。用于施用活性剂的不同方式、待使用的赋形剂以及其生产过程的综述可见于TratadodeFarmaciaGalénica,C.FaulíiTrillo,Luzán5,S.A.,1993年看到和Remington’sPharmaceuticalSciences(A.R.Gennaro,Ed.),第20版,Williams&WilkinsPA,USA(2000)中。药学上可接受的载体的实例在现有技术水平上是已知的,包括磷酸缓冲盐溶液、水、乳剂例如油/水乳剂、不同类型的湿润剂、无菌溶液等。包含所述载体的组合物可通过现有技术水平上已知的常规方法来配制。如果施用核酸(siRNA、编码siRNA或shRNA的多核苷酸或编码负c-MAF显性子的多核苷酸),则本发明涉及特别地制备用于施用所述核酸的药物组合物。药物组合物可包含所述裸核酸,即,缺乏保护核酸免受身体的核酸酶降解的化合物,其使得消除与用于转染的试剂相关的毒性的有利方面成为必需。适合用于裸露化合物的施用途径包括静脉内途径、瘤内途径、颅内途径、腹膜内途径、脾内途径、肌内途径、视网膜下途径、皮下途径、粘膜途径、局部途径和口服途径(Templeton,2002,DNACellBiol.,21:857-867)。或者,可通过形成缀合于胆固醇或缀合于能够促进通过细胞膜的转运的化合物的脂质体一部分来施用核酸,所述化合物为例如从HIV-1TAT蛋白衍生的Tat肽、黑腹果蝇触角足同源结构域蛋白的同源结构域的第三螺旋、单纯疱疹病毒VP22蛋白、精氨酸寡聚物和WO07069090(Lindgren,A.等人,2000,TrendsPharmacol.Sci,21:99-103,Schwarze,S.R.等人,2000,TrendsPharmacol.Sci.,21:45-48,Lundberg,M等人,2003,MolTherapy8:143-150以及Snyder,E.L.andDowdy,S.F.,2004,Pharm.Res.21:389-393)中描述的肽。或者,可通过形成质粒载体或病毒载体(优选基于腺病毒的载体)的一部分,将多核苷酸在腺病毒相关病毒或逆转录病毒(例如基于鼠白血病病毒(MLV)或慢病毒(HIV、FIV、EIAV)的病毒)中进行施用。可以以小于10mg/千克体重,优选小于5、2、1、0.5、0.1、0.05、0.01、0.005、0.001、0.0005、0.0001、0.00005或0.00001mg/kg体重的剂量施用c-MAF抑制剂或包含它们的药物组合物。可通过注射、吸入或局部施用来施用单位剂量。剂量取决于待治疗的病况的严重度和反应,其可在数天至数月之间变化或直至病况消退。可通过定期测量患者身体中的药剂浓度来确定最佳剂量。可从通过先前的体外测定或在动物模型中进行的体内测定获得的EC50值确定最佳剂量。可以以每日一次或少于每日一次,优选少于每2、4、8或30日一次的频率施用单位剂量。或者,可能施用起始剂量,随后施用1次或数次通常少于起始剂量的维持剂量。维持方案可包括利用范围在0.01μg与1.4mg/kg体重/日之间的剂量,例如10,1,0.1,0.01,0.001或0.00001mg/kg体重/日的剂量治疗患者。优选以每5、10或30天一次的频率施用维持剂量。治疗必须持续一段时间,该时间将根据患者所患障碍的类型、其严重度和患者的病况变化而变化。治疗后,必需监控患者的进展以确定应当增加剂量(如果疾病对治疗无反应的话)还是减少剂量(如果观察到疾病的改善或者观察到不想要的副作用)。c-MAF水平升高的骨转移乳腺癌患者的骨退化的治疗或预防在另一个方面,本发明涉及用于治疗受试者的骨转移的c-MAF抑制剂或能够避免或预防骨退化的试剂,所述受试者患有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌,并且在转移性样品中具有相对于对照样品而言升高的c-MAF水平。在另一个方面,本发明涉及c-MAF抑制剂或能够避免或预防骨退化的试剂用于生产药剂的用途,所述药剂用于治疗患有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌,并且在转移性样品中具有相对于对照样品而言升高的c-MAF水平的受试者的骨转移。或者,本发明涉及预防和/或治疗患有乳腺癌并且在转移性样品中具有相对于对照样品而言升高的c-MAF水平的受试者的退化的方法,所述方法包括给所述受试者施用c-MAF抑制剂或用于避免或预防骨退化的试剂。在一个具体实施方案中,骨转移为溶骨性转移。已在上文中在于个体化疗法的背景中详细地描述了适合用于本发明中描述的治疗法的c-MAF抑制剂和能够避免或预防骨退化的试剂。参照或对照样品是具有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的未发生转移的受试者,或对应于在未患转移的具有三阴性(包括基底样)乳腺癌的受试者的活检样品的肿瘤组织样本中测量的c-MAF基因表达水平的中位值。用于确定或定量c-MAF水平相对于对照样品是否升高的方法已结合本发明的第一方法进行了详细描述,并且同样地适用于用于避免或预防骨退化的试剂。或者,可进行联合治疗,其中将来自上述试剂的用于避免或预防骨退化的超过一种试剂组合以治疗和/或预防转移,或可将所述试剂与其它补充剂例如钙或维生素D或与激素组合。通过将用于避免或预防骨退化的试剂与药学上可接受的载体组合施用。上文中已定义了用于c-MAF抑制剂的术语“载体”和载体的类型,以及其中可施用它们的形式和剂量,这同样地可适用于用于避免或预防骨退化的试剂。下列实施例举例说明了本发明并且不限定其范围。本发明的试剂盒在另一个方面,本发明涉及用于预测三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌在患有所述癌症的受试者中骨转移的试剂盒,所述试剂盒包含:a)用于定量所述受试者的样品的c-MAF表达水平的装置;和b)用于将所述样品的定量c-MAF表达水平与参照c-MAF表达水平比较的装置。在另一个方面,本发明涉及用于预测患有基底样的三阴性乳腺癌或可选择地ER+乳腺癌的骨转移的受试者的临床结果的试剂盒,所述试剂盒包含:a)用于定量所述受试者的样品的c-MAF表达水平的装置;和b)用于将所述样品的c-MAF定量表达水平与参照c-MAF表达水平相比较的装置。在另一个方面,本发明涉及用于确定患有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的受试者的疗法的试剂盒,所述试剂盒包含:a)用于定量所述受试者的样品的c-MAF表达水平的装置;b)用于比较所述样品的定量c-MAF表达水平与参照c-MAF表达水平的装置;和c)用于基于定量的表达水平与参照表达水平的比较而确定用于预防和/或减少所述受试者的骨转移的疗法的装置。在另一个方面,本发明涉及试剂盒,其包含:i)用于定量患有三阴性(包括基底样)乳腺癌或可选择地ER+乳腺癌的受试者的样品中c-MAF表达水平的试剂,和ii)一个或多个已被预先测定来与骨转移的风险相关的c-MAF基因表达水平指数。先前已详细地描述了用于定量所述受试者的样品中c-MAF表达水平(包括16q23和16q22-24基因座的扩增和易位)的装置。在一个优选实施方案中,用于定量表达的装置包括一组特异性结合和/或扩增c-MAF基因的探针和/或引物。在一个具体实施方案中,乳腺癌为三阴性(包括基底样)或ER+(包括luminalA和B)乳腺癌。本发明的方法的所有具体实施方案适用于本发明的试剂盒及其用途。用于对患有乳腺癌的受试者的样品分型的方法在另一个方面,本发明涉及用于对患有乳腺癌的受试者的样品分型的体外方法,所述方法包括:a)提供来自所述受试者的样品;b)定量所述样品的c-MAF表达水平;c)通过将定量的c-MAF表达水平与c-MAF表达的预先确定参照水平相比较来对所述样品分进行分型;其中所述分型提供了与所述受试者的骨转移风险相关的预后信息。先前已详细地描述了用于定量所述受试者的样品中c-MAF表达水平(包括16q23和16q22-24基因座的扩增和易位)的装置。在一个具体实施方案中,乳腺癌为三阴性(包括基底样)或ER+(包括luminalA和B)乳腺癌。在一个优选实施方案中,样品为肿瘤组织样品。用于分类患有乳腺癌的受试者的方法。在另一个方面,本发明涉及用于将患有乳腺癌的受试者分类至组群的方法,包括:a)测定所述受试者的样品的c-MAF表达水平;b)将所述样品的c-MAF表达水平与c-MAF表达的预先确定参照水平相比较;和c)基于样品的所述c-MAF表达水平将所述受试者分类至组群。先前已详细地描述了用于定量所述受试者的样品中c-MAF表达水平(包括16q23和16q22-24基因座的扩增和易位)的装置。在一个具体实施方案中,乳腺癌为三阴性(包括基底样)或ER+(包括luminalA和B)乳腺癌。在一个优选实施方案中,样品为肿瘤组织样品。在一个优选实施方案中,所述组群包含已被测定为具有可与所述参照表达水平相当的c-MAF表达水平的至少一个其它个体。在另一个优选实施方案中,所述样品中所述c-MAF表达水平相对于所述预先确定参照值升高,并且其中组群的成员被分类为具有增加的骨转移风险。在另一个优选实施方案中,所述组群用于进行临床试验。在一个优选实施方案中,样品为肿瘤组织样品。实施例组群I.发现乳腺癌原发性肿瘤组群将人乳腺肿瘤患者分类至PAM50BreastCancerIntrinsicClassifier中描述的5个亚型,随后进行适当的统计分析以观察这些肿瘤的c-MAF(MAF)表达是否与一些给定的亚型的骨转移事件相关。PAM50具有称为基底样的亚型。替代地使用三阴性组。从GEO(T.Barrett,D.B.Troup,S.E.Wilhite,P.Ledoux,D.Rudnev,C.Evangelista,I.F.Kim,A.Soboleva,M.Tomashevsky和R.Edgar.NCBIGEO:miningtensofmillionsofexpressionprofiles–databaseandtoolsupdate.NucleicAcidsResearch,35,January2007.ISSN1362-4962))下载患者的信息。使用下列数据集:GSE2603、GSE2034和GSE12276的联合。该联合组群具有50个患者。为了除去系统偏性,在合并表达之前,将测量转化成所有基因的Z比分数(z-score)。使用Bioconductor(R.C.Gentleman,V.J.Carey,D.M.Bates,B.Bolstad,M.Dettling,oS.Du-doit,B.Ellis,L.Gautier,Y.Ge,J.Gentry,K.Hornik,T.Hothorn,W.Huber,S.Iacus,R.Irizarry,F.Leisch,C.Li,M.Maechler,A.J.Rossini,G.Sawitzki,C.Smith,G.Smyth,L.Tierney,J.Y.H.Yang和J.Zhang.Bioconductor:Opensoftwaredevelopmentforcomputa-tionalbiologyandbioinformatics.GenomeBiology,5:R80,2004.URLhttp://genomebiology.com/2004/5/10/R80)进行所有统计分析。组群II.验证乳腺癌原发肿瘤样品组群:第二人乳腺肿瘤组群用于验证利用上述患者肿瘤样品组群I发现的假说。独立验证组由超过380个来自具有I、II或III期BC和注释的随访(RojoF.,AnnOncol(2012)23(5):1156-1164)的患者的原发乳腺癌样本组成。按照标准方法处理组织微阵列。按照ER+、三阴性和HER2+将肿瘤分成3个亚型,随后进行适当的统计分析以观察这些肿瘤的c-MAF(MAF)表达和16q22-24扩增是否与一些给定的亚型中的骨转移事件相关。该第二组群的统计分析基于下列前提:i)基线特征的比较(表3和6)。利用FoldedF检验测试年龄的方差齐性(equalityofvariance)。取决于方差齐性,利用混合或Satterhwaitet-检验(ANOVA或Kruskal-Wallis用于多个类别的比较)检验年龄平均值的差异。适用时,利用卡方或Fisher检验比较分类变量。ii)诊断性能FISH和IHC–利用p<0.2的输入变量的p-值标准和在将p调整为<0.10后在模型中保留变量的标准,通过逐步选择进行多变量分析。诊断性能通过比较ROC曲线的AUC来进行评价。模型的拟合优良度利用Hosmer-Lemeshow检验来评价(如果显著,不进行进一步分析)。–基于最大预测变量(16q23FISH和MAFIHC)计算每一个分类类别的灵敏度(Se)、特异度(Sp)、阳性预测值(PPV)和阴性预测值(NPV)。为了克服数据过度拟合问题,将进行PPV和NPV的拔靴法(bootstrapping)。iii)预后作用–利用关系的“efron"管理,进行结果时间对骨转移的Cox回归建模。事件的数目将驱动被输入模型的变量的数目(每5-10个事件约1个变量)。–使用比例风险假设(如SAS9.3中应用的)的最小上界检验(supremumtest)检查比例风险假设。如果该假设被违反,则该检验产生显著的p-值。乳腺癌亚型的分类按照在PAM50基因标签中作为对照基因描述的基因对联合组群(发现组群I)的PAM50基因进行标准化。对于每一个患者,通过扣除该相同患者的对照基因的平均值标准化表达评估值。计算5个评分来分类患者:-ESR1状态:基因ESR1的分布显示双峰性(图1)。两个模式鉴定了低ESR1和高ESR1患者。包装“mclust”用于使正常分布的混合与2个组分拟合和获得每一个患者属于低ESR1和高ESR1组分的后验概率。如果属于该组的后验概率大于80%,则患者被认为是低ESR1。相同的标准用于高ESR1。当患者既不是高ESR1也不是低ESR1时,其被认为是中间ESR1。-Luminal状态:对于每一个患者,通过将luminal基因列表中的所有基因的表达求平均值来计算luminal分数。luminal分数的分布显示双峰性(图1),从而以与ESR1状态相同方式描述luminal状态。-增殖状态;对于每一个患者,通过将luminal基因列表中的所有基因的表达求平均值来计算增殖分数。增殖基因的平均值未显示双峰性(图1)。因此一半具有最低平均值的患者被认为是低增殖的。剩余的患者被认为是高增殖的。-PGR1状态:基因PGR1显示双峰性(图1),从而以与luminal状态相同的方式描述PGR1状态。-ERBB2状态:基因ERBB2未显示双峰性(图1)。当ERBB2表达值高于ERBB2平均值加1个ERBB2的标准差时,样品被描述为高ERBB2。否则,样品被认为是低ERBB2。两个luminal基因和一个增殖基因不存在于联合组群中。不使用它们。每一个患者被分配至根据PAM50的亚型。有58个患者不能被分配至根据PAM50’s分类的任何亚型。我们未发现属于超过1个亚型的患者。雌激素受体阳性(ER+)肿瘤被定义为高ESR1。三阴性肿瘤被定义为低ESR1、PGR1和ERBB2。对于验证组群II,患者分类基于常规病理学家按照诊断目的的评分。ER+肿瘤被定义为表达ESR1的肿瘤,三阴性乳腺癌肿瘤被定义为不表达ESR1、PR和HER2的肿瘤。HER2+肿瘤根据病理学家评分被定义为2+和3+HER2肿瘤。有6个患者不能被分配至任何上述亚型。我们未发现属于超过一个亚型的患者。c-MAF基因表达能力预测三阴性乳腺癌组群的转移、骨转移的分析当分析组群I的骨转移时,33个患者因同时具有骨转移和另一种转移然而一次仅报导一个事件而被排除。我们对第一转移感兴趣,并且鉴于无法知道哪个转移是第一转移,我们从分析中排除具有两个转移部位注释的患者。在我们鉴定目标亚型三阴性(其包括大比例的基底样乳腺癌)和选择患者后,我们调整Cox比例风险度模型(使用来自包装存活的R功能coxph),以看我们是否能够通过亚型和c-MAF表达(包括作为调整变量的组群)解释每一个表型(骨转移)。c-MAF具有统计上显著的与亚型的相互作用效应(p=0.043)。这告诉我们c-MAF与存活之间的关系根据患者亚型而显著不同。c-MAF在三阴性乳腺癌原发性肿瘤中的基因表达与骨转移显著相关。(表3和图2)。亚型n风险比95%的置信区间p-值三阴性1641.444[1.016-2.054]0.040表3.存活分析c-MAF可用于测定三阴性(其包括大比例的基底样乳腺癌)乳腺癌受试者发生转移的倾向的预后(表3和图2)。分析c-MAF基因表达能力以预测ER+乳腺癌肿瘤的转移、骨转移我们聚焦于ER+乳腺癌(其包括大比例的luminal(包括A和B亚型)乳腺癌)。我们调整Cox比例风险度模型(使用来自包装存活的R功能coxph)以看我们是否能够通过c-MAF表达解释每一个表型(骨转移、肺转移或脑转移)。ER+乳腺癌原发肿瘤中c-MAF的基因表达与骨转移显著相关。(表4和图3)。亚型n风险比95%的置信区间p-值雌激素受体阳性3491.22[1.014-1.473]0.032表4.存活分析c-MAF可用于测定ER+乳腺癌(其包括大比例的luminal(包括A和B亚型)乳腺癌)受试者发生转移的倾向的预后(表4和图3)。通过免疫组织化学验证c-MAF为组群II的乳腺癌骨转移的临床生物标志,特别地在ER+和TN中。在DakoLink平台中使用置于带正电荷的载玻片上的3μm人BC肿瘤组织切片进行c-MAF免疫染色。在脱蜡后,在pH6.1,0.01mol/L基于柠檬酸盐的缓冲液(Dako)中进行热抗原修复。淬灭内源过氧化物酶。以1:100的稀释度将兔多克隆抗-MAF抗体在室温下使用30分钟,随后用偶联有过氧化物酶的抗-兔Ig葡聚糖聚合物(Flex+,Dako)进行温育。随后用3,3’-二氨基联苯胺(DAB)使切片可视,用苏木素进行复染色。已在从1:10至1:1000的一系列一抗递增稀释中计算了c-MAF抗体灵敏度(1:100)。使用亲代以及c-MAF-过表达(+c-MAF长同种型/短同种型)MCF7和T47D人BC细胞测定特异度。如针对IHC所描述的,处理福尔马淋固定的细胞沉淀,通过来自全裂解物的western印迹确认结果。特异度在BALB-c裸小鼠异位MCF7和c-MAF-过表达MCF7外植体中均有显示。将来自用正常兔IgG2(IS600,Dako)而非一抗温育的相同样本的切片用作阴性对照。通过计算机化测量给MAF免疫染色评分。使用配备有NuanceFX多光谱成像系统(CRIInc)的DM2000Leica显微镜,在420与700nm之间以10-nm波长间隔获得每一个样本的9个代表性图像。在获得图像的光谱数据集之前,进行自动曝光程序,同时对载玻片的空白区域成像,以测定在每一个波长下使设备的孔充填大约90%来补偿源强度、滤器传输效率和摄相机灵敏度的变化所必需曝光时间。建立纯DAB和苏木素染料颜色的文库,通过使用Nuance1.6.4软件,将其用于使颜色纯粹。随后对每一个新的案例获得参照的立方体(在不同波长下获得的图像的堆叠),随后使用相同曝光时间对代表性组织区域进行光谱成像。在图像的去卷积后,将光谱数据平场以补偿照明的不均匀性,并过滤本底。通过使用Beer法则转换(Beerlawconversion)获得样品除以参照立方体的比率的负对数来将阳性信号从传输转化成光密度单位。设置计算机辅助阈值,这产生了突出显示所有阳性信号的伪彩色图像。分析从目标区域的平均强度产生了c-MAF的定量数据。仅上皮细胞(正常和恶性的)而非间质细胞或淋巴细胞的细胞核通过设置特定尺寸阈值被检测到,并且由病理学家确认。计算每一个案例的所有目标区域的信号强度的平均值以进行统计分析。计算机化测量的输出产生从56变化至70,367的c-MAF表达连续数据。显示了原发性乳腺癌组织的代表性c-MAF免疫染色(IHC)(图4a)。案例1代表c-MAF阴性肿瘤(OD<1000)。案例2和3为c-MAF阳性肿瘤(分别地OD>1000和>25000)(图4a)。随后,描述380个原发性乳腺癌肿瘤的组群的c-MAF蛋白表达(计算化测量和表达为光密度任意单位,OD)的曲线概述了所有肿瘤IHC信号定量。按照BC亚型(ER+、HER2+和TN)分离肿瘤(图4b)。基于上述IHC染色,画出按照c-MAF(阳性或阴性)分层的380个原发性乳腺癌肿瘤(I、II和III期)的组群的无疾病存活(图4c)和无骨转移存活(图4d)的Kaplan-Meier曲线。还计算c-MAF在不同BC亚型(ER+、HER2+和TN)中的诊断性能(图4e)。如上文中所定义的,进行基线表征和Cox多变量分析,以测定任何其它临床病理参数(表5和6)对作为原发性乳腺癌肿瘤的分层标准的c-MAF的影响。如所显示的,除具有超过9个淋巴结阳性外,不存在与任何其它参数的显著相关性。表5.根据c-MAFIHC表达的基线特征缩写:HER2,人表皮生长受体2表6.具有c-MAFIHC表达的患者的BDFS分析缩写:BDFS,无骨疾病存活;HR,风险比;CI,置信区间;HER2,人表皮生长因子受体2c-MAF在骨转移定殖测定中的功能验证已使用临床前实验性异种移植小鼠模型在骨转移定殖测定中功能性验证了c-MAF的致病贡献。使用ER+人乳腺细胞系,即用GFP/萤光素酶载体标记的MCF7和T47D,通过心室内或尾静脉注射将其接种入免疫缺陷小鼠。这些小鼠必须将携带雌激素丸剂以保证异种移植物模型中邻近的肿瘤细胞的激素供应。标准方法是功能的丧失和获得实验。在MCF7亲代、T47D或就高水平的c-MAF表达选择的高度骨转移性细胞衍生物(BoM2)中表达或沉默c-MAF以验证其在转移中的功能(图5和6)。使用心内接种在小鼠中的转移细胞的生物发光检测来体内测定c-MAF基因的骨转移功能。我们在BoM2细胞中产生shRNA-介导的c-MAF敲低,所述敲低使内源c-MAF的水平降低超过80%,并且可通过c-MAF外源过表达来恢复(图6)。此外,我们还产生了单个地或共同地表达每一个c-MAF同种型的细胞,并且在受体测定中测试其作为转录激活因子的功能性(图6)。将c-MAF(短同种型和长同种型)表达被耗尽或恢复的亲代MCF7细胞、具有或不具有c-MAF(共同地或单独地短同种型和长同种型)的亲代T47D细胞和BoM2骨转移性MCF7细胞衍生物注射入小鼠左心室,通过体内生物发光成像分析骨定殖。在所有情况下,接种对应的对照(图5、6、7和8)。在注射后第52天,相较于对照BoM2细胞(即表达c-MAF的)中的90%或恢复组中的50%(图5c和8),仅23%的用BoM2c-MAF敲低细胞接种的小鼠发生骨转移。c-MAF耗尽细胞的骨转移的减少伴随着后肢溶骨性病变程度的急剧下降(图5c)。相反地,MAF过表达(每一个亚型单个地或共同地)增强ER+乳腺癌细胞(MCF7和T47D)在心内注射后转移骨的能力和转移负担(图5a、b和7)。有趣地,MAF表达细胞导致比亲代MCF7细胞更多的溶骨性骨转移(图5a、6和9a),并且可在转移病灶周边检测到增加的耐酒石酸盐酸性磷酸酶(TRAP+)破骨细胞的数目(图9b,c,d)。当皮下植入时,MAF过表达不增加亲代MCF7细胞的固有增殖活性(图10)。高水平的MAF表达不支持肺定殖(图5d)。功能丧失和获得实验与乳腺癌原发性肿瘤的临床验证一起功能性验证了c-MAF作为雌激素受体阳性(包括luminalA和B分子亚型)和三阴性(包括基底样分子亚型)乳腺癌亚型的骨转移进程的预后及预测标志和致病靶基因。MAF通过破骨细胞分化的肿瘤细胞刺激,例如通过PTHLH细胞因子的转录控制而介导溶骨性骨转移c-MAF在给乳腺癌细胞提供骨转移功能中无直接活性,c-MAF可转而转录性地控制基因促进寻靶和骨重塑能力以定殖骨的活性。PTHLH表达处于c-MAF的控制之下。通过qPCR分析确认了这一观察(图11a)。此外,在骨中生长的患者乳腺癌转移(GSE14020)相较于其它地方的转移保持c-MAF表达(图11b)。此外,77%的表达高于平均值的MAF和PTHLH的转移为骨转移(图11b)。PTHLH被鉴定为负责恶性肿瘤的体液高钙血症的因子。此外,已显示其在部分因破骨细胞分化的刺激而引起的溶骨性骨转移中起着基本作用。事实上,来自表达c-MAF的细胞的条件培养基在体外增强破骨细胞分化的诱导,这一过程在用PTHLH拮抗剂肽(7-34Aa,PTHLH-AN)共温育后被阻止(图11c)。为了测试PTHLH是否介导乳腺癌细胞中c-MAF驱动的骨转移,我们心内注射表达c-MAF的MCF7乳腺癌细胞,并在47天的跨度中评价其在PTHLH-AN存在或不存在的情况下建立和生长骨转移的能力。为了阻断PTHLH的体内活性,每天2次给动物施用6μg的溶解于PBS中的(7-34Aa)PTHLH-AN。用PBS处理对照组。c-MAF表达细胞以相似的外显率产生骨转移,然而利用PTHLH-AN的处理引起后肢溶骨性病变的程度的显著下降(图11d,e)。该降低伴随着转移病灶周边的破骨细胞(TRAP+细胞)的数目的减少(图11d,e)。这些结果表明c-MAF驱动乳腺癌的溶骨性骨转移。此外,PTHLH表达是c-MAF驱动的溶骨性乳腺癌骨转移的必需因子。最后,破骨细胞分化过程的阻断阻止了c-MAF-驱动的乳腺癌骨转移。c-MAF预测向骨转移的能力是剂量依赖性的首先,我们评价c-MAF表达预测骨转移的能力是否是剂量依赖性的。已从GEO(Barrett等人(2007))下载了患者的信息。使用下列组的数据:GSE2603、GSE2034和GSE12276的联合。该联合组群具有560个患者。为了在合并前除去系统偏性,将所有基因的表达测量转换成z分数。使用Bioconductor(GentlemanRC等人GenomeBiology,5:R80,2004.URLhttp://genomebiology.com/2004/5/10/R80)进行所有统计分析。我们通过Cox回归模型,利用四次样条(包装phenoTest中的smoothCoxph函数)获得c-MAF表达与骨转移风险比之间的关系的光滑估计。包装phenoTest曲线和Cox比例风险的smoothCoxph函数通过基因表达水平平滑。因此,构建了显示危害在给定基因不同表达水平上如何表现的曲线。还提供了置信区间(用法:smoothCoxph(时间、事件、x、x轴范围(xlim)、y轴范围(ylim),其它......)。参数:时间)其中存储存活时间的变量;事件)其中存储存活事件的变量;x)包含给定基因的表达水平的数值;Xlim)曲线的x轴范围;Ylim)同线的y轴范围;其它...)被传递给曲线的其它参数)。通过Cox回归模型,利用利用四次样条获得的c-MAF表达与骨转移风险比之间的关系见于图12中。所有乳腺癌肿瘤存在于联合组群中,雌激素受体阳性乳腺癌肿瘤存在于联合组群中,三阴性肿瘤存在于联合组群中。进行分析,并且分析显示了c-MAF预测其c-MAF表达水平高于平均值(命名为0)的肿瘤的骨转移能力的风险比(HR)和p-值。表达水平上的1表示随后1个标准差。我们将“高c-MAF”表达的乳腺癌原发性肿瘤定义为一组表达高于乳腺癌原发性肿瘤的代表性组群的平均表达的c-MAF的肿瘤。我们将“低c-MAF”表达的乳腺癌原发性肿瘤定义为一组表达低于在乳腺癌原发性肿瘤的代表性组群中获得的平均值的c-MAF的肿瘤。在具有高c-MAF表达水平的乳腺癌肿瘤中,c-MAF表达以剂量依赖性方式预测骨转移的风险(图12)。类似地,在ER阳性(包括luminalA和B分子亚型)和三阴性(包括基底样分子亚型)乳腺癌亚型中,我们观察到相同的行为(图12)。综上所述,c-MAF表达水平越高,表达高于一组代表性乳腺癌肿瘤的平均值的c-MAF水平的ER+和TN乳腺癌肿瘤的骨转移的风险比越高。我们在验证组群II中测定在何种程度上,c-MAF的剂量越高,则骨复发的风险越大。为此,我们通过免疫组织化学(IHC),通过使用如上所述的计算机化系统测定染色的光密度来定量c-MAF表达(图4a,b)。c-MAF染色对于肿瘤细胞是特异性的(图4a)。基于染色,我们可观察到两种类型的c-MAF阳性乳腺癌肿瘤(案例2和3,图4a,b)。根据这两种类型的c-MAFIHC染色,在c-MAF阳性乳腺癌肿瘤中,我们可将它们分成两个组,因为它们具有双峰性行为(图13,左图框)。基于这两个分类,我们验证了如下观察:c-MAF染色越强,骨转移的风险越高(HR(骨转移)=19.45;p-值<0.001)并且骨转移发生越早(图13,右图框)。c-MAF预测早期骨转移的能力取决于原发性肿瘤检测和手术切除与远端复发的观察时间之间的跨度,乳腺癌肿瘤被分类为早期(<5年)和晚期(>5年)再发性肿瘤。事实上,在某些情况下,早期复发甚至限定于更短的早期。鉴于ER阳性和阴性肿瘤被描述为在早期骨复发方面表现不同,该分类具有临床重要性。详细地,ER阴性(包括三阴性和基底样)肿瘤在早期时间点复发,而ER阳性肿瘤在晚期和早期时间点具有相同的复发倾向(KnightWA,等人CancerResearch1997:37,4669-4671,GossPENatureRevCancer2010:10,871-877)。我们评价c-MAF表达是否可预测乳腺癌、ER阳性(包括luminalA和B)和三阴性(包括基底样)乳腺癌原发性肿瘤的早期骨转移。已从GEO下载患者的信息。使用下列组的数据:GSE2603、GSE2034和GSE12276的联合。该联合组具有560个患者。为了在合并前去除系统偏性,将所有基因的表达测量转换成z分数。使用Bioconductor进行所有统计分析。我们进行Fisher's精确检验以测试不同时间点上c-MAF和骨转移的独立性。列联表的比例和Fisher’s检验p-值可见于图14。我们将“极高c-MAF”表达的乳腺癌原发性肿瘤定义为一组表达高于平均值+1个标准差的c-MAF的肿瘤。我们将“低c-MAF”表达的乳腺癌原发性肿瘤定义为一组表达低于乳腺癌原发性肿瘤的代表性组群的平均值+1个标准差的c-MAF的肿瘤。在乳腺癌原发性肿瘤中,极高c-MAF水平(RNA或蛋白)预测乳腺癌原发性肿瘤手术后3和5年的早期骨转移(图14)。具体地,显示了在雌激素受体阳性(包括luminalA和B分子亚型)中,c-MAF水平(RNA或蛋白质)明显地确定了具有分别地手术后3和5年的早期骨转移(图14)的肿瘤的比例。综上所述,高水平的c-MAF表达可用于区分或预测处于高骨转移风险(包括早期乳腺癌骨转移)的乳腺癌原发性肿瘤。表7显示乳腺癌原发性肿瘤(GSE2603、GSE2034和GSE12276的联合)、雌激素受体阳性(包括luminalA和B分子亚型)乳腺癌原发性肿瘤和三阴性(包括基底样分子亚型)乳腺癌亚型的骨转移、早期骨转移和极早期骨转移的预测。三阴性乳腺癌原发性肿瘤(c-MAF>平均值,n=96)表7:HR(风险比),CI(置信区间)位于16q22-q24中的染色体区域(包括c-MAF)的扩增与骨转移相关我们通过改进ACE算法(通过表达数据进行的CNA分析)鉴定了原发性乳腺癌样本中的拷贝数变化(CNA)与转移的风险相关(图15a)。其中,位于染色体16q22-q24中的扩增区域与转移风险显著(p<0.05)相关,并且包括c-MAF(其增加的表达个别地和独立地与ER+人乳腺癌的骨转移风险相关(HR=1.22p=0.032,基于GSE2603、GSE2034和GSE12276的联合的乳腺癌原发性肿瘤数据集)的基因)。类似地,当通过FISH(16q23)和比较性基因组杂交(CGH)比较亲代MCF7(ER+)与骨转移性MCF7衍生物(BoM2)细胞时,我们确认了16q22-24染色体区域的获得(图15b,c)。一个亚组的亲代细胞(32.7%)具有该基因组扩增,而体内骨转移选择导致该残留群体有剩余部分(88.6%)。因此,我们显示16q22-q24在具有转移、特别地骨转移的风险的乳腺癌中被扩增,并且在体内支持选择的细胞的向骨转移的能力。在组群II中通过FISH测定验证16q22-24DNA基因组扩增预测骨转移的预后能力为了进一步验证16q22-24基因组扩增特异性预测骨转移风险的能力,我们通过FISH(我们使用测定16q23基因组区域的商购可得诊断探针,IGH/MAFAbbotVysis探针)在由334个来自具有I、II和III期BC和注释的随访(RojoF.,AnnOncol(2012)23(5):1156-1164)的患者的原发性乳腺癌样本组成的独立验证组中,分析16q22-24染色体区域的基因组获得。按照标准方法处理组织微阵列。用MAF(16q23)和IGH(14q32)探针混合物(Abbotvysis探针)温育载玻片。使用DAPI复染,利用适当的显微镜获得图像。测定I、II和III期BC人原发性肿瘤组(n=334)的无骨(图16a)转移存活或总体(图16b)存活的Kaplan-Meier曲线。使用每肿瘤3个核心,基于每细胞2.5个16q23拷贝的截止值作为平均值,按照16q23FISH阴性和16q23FISH阳性组将患者分层(图16a和b)。计算预测骨转移的标志的风险比(骨转移)、特异度和灵敏度。如上所述进行所有乳腺癌的数据集的基线特征和Cox多变量分析(表8和9)。还测定I、II和III期BC人原发性肿瘤组的ER-阳性(左)或三阴性(右)患者(分别地n=250和n=43)的无骨转移存活的Kaplan-Meier曲线(图16c)。使用每肿瘤3个核心,基于的每细胞2.5个16q23拷贝的截止值作为平均值,将患者分成16q23FISH阴性和16q23FISH阳性组。如上所述进行ER+乳腺癌的Cox多变量分析(表10)。表8.FISH>2.5个拷贝/细胞的16q23(MAF)的基线特征的比较。在每肿瘤3个核心中测量的。(*对在该变量上未失去值的患者计算的百分比)表9.I、II、III期乳腺癌至作为复发第一部位的骨转移的时间的Cox回归。16q23(MAF)FISH>2.5个拷贝/细胞。在每肿瘤3个核心中测量的表10.I、II、III期乳腺癌至作为复发第一部位的骨转移的时间的Cox回归。16q23(MAF)FISH>2.5个拷贝/细胞。在每肿瘤3个核心中测量的还计算16q23扩增在所有乳腺癌(图16d)和ER+乳腺癌(图16e)中的诊断性能的接受者作用特征(ROC)曲线以估计诊断性能。在ROC曲线中,对于不同的截止点,将真阳性率(灵敏度)针对假阳性率(100-特异度)的函数作图。ROC曲线上的每一个点代表对应于特定判定阈的灵敏度/特异度对。总的来说,本文中使用16q23FISH探针测量的16q22-24扩增明显地预测了乳腺癌原发性肿瘤,特别地TN和ER+乳腺癌亚型的骨转移的风险。基于c-MAF表达水平确定被诊断为具有三阴性乳腺癌的受试者的治疗方案肿瘤组织样品获自被诊断为患有三阴性乳腺癌的受试者。将样品切成组织薄片,然后包埋在石蜡中。将每一个石蜡切片安放在载玻片上。用抗-MAF抗体温育载玻片。为了显现和检测结合于MAF的抗体,使用缀合有荧光染料的抗体。通过给荧光染料提供激发光束来使载玻片可见。利用荧光显微镜拍摄荧光信号的图像。通过将肿瘤样品的荧光信号与参照样品的相比较来获得肿瘤样品的c-MAF相对表达水平。使肿瘤样品中的强度与参照样品中的强度发生关联,其中肿瘤样品相较于参照样品的更高强度与具有原发性乳腺癌的受试者转移于骨的风险增加相关。或者,使用原位杂交技术或类似技术测定16q22-24基因座、16q23基因座或c-MAF基因的扩增或易位。基因增加的骨转移风险的预后,给受试者施用抗-RANKL抗体地舒单抗作为骨转移的预防性治疗。将120mg地舒单抗每月1次给受试者皮下(SC)施用,进行6个月。每3个月一次皮下施用120mg地舒单抗,进行随后4年半。口服施用钙(至少500mg)和维生素D(至少400IU),进行5年。5年后,受试者无任何骨转移的证据。基于不增加骨转移的风险的预后,不给患者施用该抗-RANKL抗体。应理解,本文中描述的实例和实施方案仅用于举例说明目的,并且将被包括在本申请的精神和范围内。为了所有目的,将本文中引用的所有公开案、专利、专利申请、因特网网址和登录号/数据库序列(包括多核苷酸和多肽序列)通过引用整体并入本文,达到就如同每一个个别的公开案、专利、专利申请、因特网网址或登录号/数据库序列被具体且个别地这样通过引用并入的程度。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1