一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制作方法
本发明涉及生物技术领域,尤其涉及一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子。
背景技术:
结直肠癌(colorectalcancers,crc)是全球常见的恶性肿瘤,它的发病与遗传因素和环境因素相关,其发病分子机制主要有:遗传不稳定性增加、甲基化表型以及k-ras、b-raf等基因的突变。结直肠癌患者中40%-50%在确诊时已经有远处转移,即使接受了根治性手术切除的患者,最终仍然有50%以上出现复发性转移,因此转移性结直肠癌(mcrc)的药物治疗尤为重要。虽然伊立替康(irinotecan)、奥沙利铂(oxaliplatin)及氟尿嘧啶(fluorouracil)等针对crc的化疗药物虽然能提高mcrc的疗效,但患者的中位生存期仍不到2年。进入21世纪以来,靶向egfr的单克隆抗体西妥昔单抗(cetuximab)和帕尼单抗(panitumumab)成为mcrc治疗的一个突破。
西妥昔单抗是人-鼠嵌合的igg1单克隆抗体,而帕尼单抗则是完全人源化的igg2单克隆抗体。它们与egfr均有非常高的亲和力,可竞争性阻断egfr与其配体-表皮生长因子(epidermalgrowthfactor,egf)等的结合,从而阻断egfr下游的信号转导途径。egfr下游的主要信号通路为ras–raf–mek–erk–mapk和pi3k–akt–mtor,前者主要参与肿瘤细胞的增殖,后者则主要参与肿瘤细胞的存活、侵袭和转移。因此,西妥昔单抗和帕尼单抗可以抑制肿瘤细胞的生存、增殖、侵袭和转移。然而,无论是西妥昔单抗还是帕尼单抗,其价格都相当的昂贵,而且,西妥昔单抗和帕尼单抗单药治疗mcrc的效率并不理想,仅为8%-13%;即使与mcrc的主要化疗方案folfox、folfiri联合用药,有效率较常规的化疗方案也仅提高8%-16%。基于这两方面,提高或改善靶向egfr单克隆抗体的疗效成为了迫切需要解决的问题。而导致靶向egfr单克隆抗体治疗mcrc有效率不高的主要原因是存在极其严重的耐药问题,所以,探索靶向egfr单克隆抗体的耐药机制并找到解决方案成为提高其疗效的重中之重。
靶向egfr单克隆抗体的耐药分子机制极为复杂,包括原发性耐药分子机制和继发性耐药分子机制。关于靶向egfr单克隆抗体治疗mcrc原发性耐药分子机制的研究主要集中在egfr及其配体的分子改变和细胞内参与egfr信号转导的分子的改变。细胞内参与egfr信号转导的分子改变主要有k-ras、n-ras、braf、pi3k等的突变以及pten的缺失。临床上,即使是西妥昔单抗治疗有效的患者,其缓解期也最多持续12-18个月,几乎所有的患者最终都会出现肿瘤的进展,形成对西妥昔单抗的继发性耐药。目前对靶向egfr单克隆抗体继发性耐药分子机制的研究主要包括:西妥昔单抗作用下 引起的egfr的分子改变、amphiregulin和epiregulin表达下调、k-ras基因突变或扩增、pten基因不稳定性增加或缺失、skf(src家族激酶,非受体酪氨酸激酶c)高表达、肿瘤细胞发生表皮间充质转化(epithelial-mesenehymaltransition,emt)、hedgehog信号通路的gli1表达升高等。
prss1基因编码一种丝氨酸蛋白酶,这个酶主要由胰腺分泌,但其在肿瘤中也有表达。目前对该分子的研究仅局限于胰腺炎等炎症中。
技术实现要素:
本发明的一个目的是提供检测prss1表达量的物质的用途。
本发明提供的检测prss1表达量的物质在制备检测待测肿瘤细胞是否对prss1识别的单克隆抗体耐药产品中的应用;
或检测prss1表达量的物质在制备检测待测肿瘤患者是否对prss1识别的单克隆抗体耐药产品中的应用;
或检测prss1表达量的物质在制备预测待测肿瘤患者对prss1识别的单克隆抗体治疗效果产品中的应用;
或检测prss1表达量的物质在制备检测待测肿瘤患者对prss1识别的单克隆抗体原发耐药产品中的应用;
或检测prss1表达量的物质在制备检测prss1识别的单克隆抗体的药物疗效产品中的应用。
上述应用中,所述prss1识别的单克隆抗体为靶向egfr单克隆抗体;所述靶向egfr单克隆抗体具体为西妥昔单克隆抗体;所述肿瘤为结肠癌,所述肿瘤细胞为结肠癌细胞。
本发明的另一个目的是提供prss1蛋白的用途。
本发明提供的prss1蛋白在制备提高肿瘤细胞对prss1识别的单克隆抗体的耐药性的产品中的应用。
上述应用中,所述提高肿瘤细胞对靶向egfr单克隆抗体的耐药性体现在如下1)和/或2):
1)降低prss1识别的单克隆抗体对结肠癌细胞抑制效果;
2)降解prss1识别的单克隆抗体。
上述应用中,所述降低prss1识别的单克隆抗体对结肠癌细胞抑制效果体现在降低prss1识别的单克隆抗体对结肠癌细胞增值的抑制效果和/或降低prss1识别的单克隆抗体对结肠癌细胞中egfr信号通路相关蛋白的表达量;
所述egfr信号通路相关蛋白具体为p-egfr、p-akt和/或p-erk。
本发明的第三个目的是提供prss1蛋白。
本发明提供的prss1蛋白在制备具有如下1)-4)中至少一种功能的产品中的应用:
1)降低prss1识别的单克隆抗体对肿瘤细胞或肿瘤抑制效果;
2)降低prss1识别的单克隆抗体对肿瘤细胞增值的抑制效果;
3)降低prss1识别的单克隆抗体对肿瘤细胞中egfr信号通路相关蛋白的表达量;
4)降解prss1识别的单克隆抗体。
上述应用中,所述egfr信号通路相关蛋白具体为p-egfr、p-akt和/或p-erk。
上述应用中,所述prss1识别的单克隆抗体为靶向egfr单克隆抗体;所述靶向egfr单克隆抗体具体为西妥昔单克隆抗体;所述肿瘤为结肠癌,所述肿瘤细胞为结肠癌细胞。
prss1蛋白在降解单克隆抗体中的应用也是本发明保护的范围。
上述应用中,所述单克隆抗体具体为西妥昔单克隆抗体或贝伐珠单克隆抗体或曲妥珠单克隆抗体。
prss1抑制剂(如spink1)在制备促进prss1识别的单克隆抗体对肿瘤细胞或肿瘤抑制效果产品中的应用也是本发明保护的范围。
上述应用中,所述prss1识别的单克隆抗体为靶向egfr单克隆抗体;所述靶向egfr单克隆抗体具体为西妥昔单克隆抗体。
本发明的实验证明,prss1识别单克隆抗体的特异性位点并降解单克隆抗体,且prss1表达水平较高的肿瘤患者对单克隆抗体的疗效普遍较差,即prss1的高表达可导致肿瘤患者对prss1特异性识别的单克隆抗体药物产生耐药性。因此,prss1可作为一种辅助临床用药的疗效检测分子,即临床上通过监测患者体内prss1的表达水平,可预测患者对单克隆抗体的疗效,并及时更换有效的治疗方案,以提高患者的疗效、改善患者的生活质量。
附图说明
图1为prss1在对西妥昔单抗耐药的细胞株中的表达水平高于对西妥昔单抗敏感的细胞株。
图2为对西妥昔单抗耐药的结肠癌细胞株中prss1表达水平明显高于对西妥昔单抗敏感的结肠癌细胞株。
图3为导入外源prss1结肠癌细胞株中prss1表达检测。
图4为过表达prss1结肠癌细胞株对西妥昔单抗的敏感性分性。
图5为感染敲低prss1表达慢病毒的结肠癌细胞株中prss1表达检测,★★代表p﹤0.01。。
图6为敲低prss1结肠癌细胞株对西妥昔单抗的敏感性分析。
图7为过表达prss1结肠癌细胞株和感染敲低prss1表达慢病毒的结肠癌细胞株中egfr信号通路的明星分子p-egfr、p-akt以及p-erk受西妥昔单抗的抑制情况。
图8为过表达prss1结肠癌细胞株对西妥昔单抗的降解情况。
图9为敲低prss1结肠癌细胞株对西妥昔单抗的降解情况。
图10为重组丝氨酸蛋白酶对单克隆抗体的降解模式与细胞上清对单克隆抗体的降解模式。
图11为23例对单克隆抗体治疗原发耐药患者血清中prss1的水平明显高于29例对单克隆抗体治疗有效的患者。
图12为患者在使用单克隆抗体治疗过程中的血清中prss1的水平。
图13为prss1的抑制剂可抑制prss1降解单克隆抗体。
图14为prss1抑制剂与贝伐珠单抗联合用药更好的抑制裸鼠荷瘤的生长和增殖。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
prss1为丝氨酸蛋白酶,其氨基酸序列为序列表中序列2,其编码基因的核苷酸序列为序列表中序列1。
实施例1、prss1作为判断待测细胞是否耐西妥昔单抗的标识物
一、与耐药相关分子prss1的确定
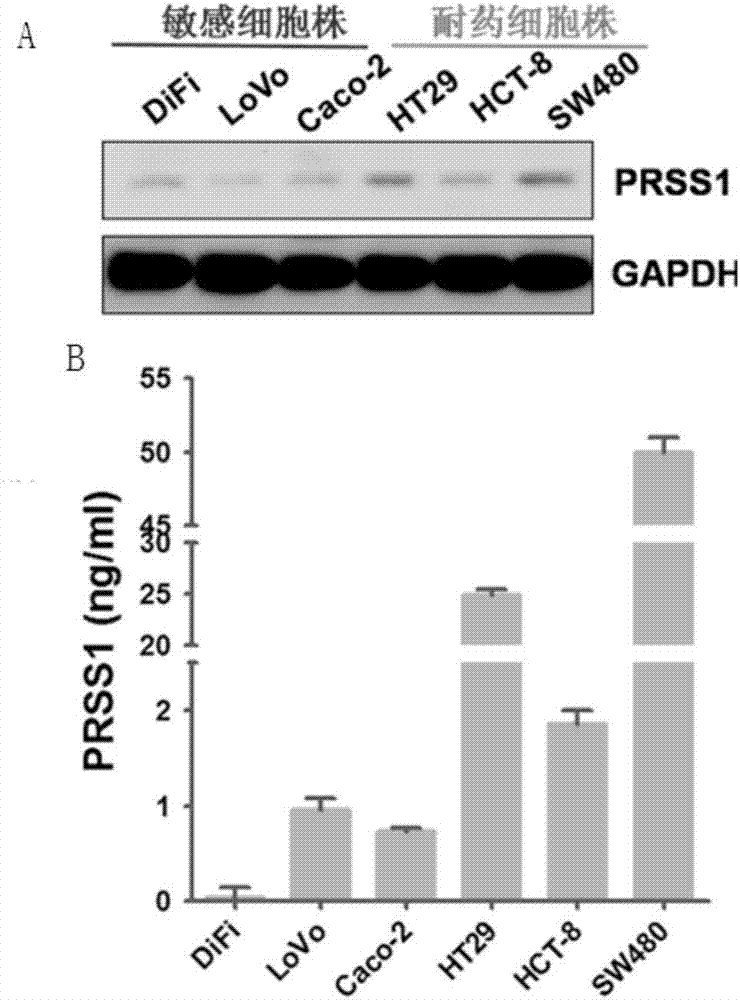
通过大量的文献调研,发现了一个关于798株细胞基因表达谱数据库(affymetrix133amicroarrays)。该数据库可在如下网址中的sangercelllineproject中找到:http://www.broadinstitute.org/cgi-bin/cancer/datasets.cgi。大量文献检索后发现,这个数据库中的798株细胞系中,有19株细胞系(egi-1、hcc70、、colo-205、hct116、ht-29、ls1034、ls174t、rko、sw620、pc-3、katoiii、mkn45、ags、sas、hucct1、a549、sw403、hct15、te-1)是文献报道的对西妥昔单抗耐药的细胞系,30株细胞系(mda-mb-468、lovo、sw48、huh-7、sw1573、te-5、kyse-150、22rv1、du-145、mkn1、mkn28、nci-n87、ca9-22、cal-33、hsc-2、hsc-3、fadu、cal-39、u251、ca-ski、dotc2-4510、me-180、omc-1、a498、achn、caki-1、snu-423、msto-211h、nci-h2052、a431)是对西妥昔单抗敏感的细胞系。对这个数据库中的数据进行生物信息学分析,发现:prss家族成员prss1、prss2以及prss3在对西妥昔单抗耐药细胞系中的表达显著的高于对西妥昔单抗敏感的细胞系(图1)。
二、prss1可以作为判断待测细胞是否耐西妥昔单抗的标识物
进一步检测六株结直肠癌细胞株中prss1的表达量,具体如下:
提取西妥昔单抗耐药的结肠癌细胞株ht-29、hct-8、sw480和对西妥昔单抗敏感 的细胞株difi、lovo、caco-2的rna,以fw5′-aggcacactctaccaccatga-3′和rv5′-atgttgtgctctcccagtctca-3′,进行rt-pcr。rt-pcr结果显示prss1在对西妥昔单抗耐药的结肠癌细胞株(ht-29、hct-8和sw480)中的mrna表达水平明显高于对西妥昔单抗敏感的细胞株(difi、lovo和caco-2);
无血清细胞培养液中培养西妥昔单抗耐药的结肠癌细胞株ht-29、hct-8、sw480和对西妥昔单抗敏感的细胞株difi、lovo、caco-2,分别收集上清液,提取蛋白,用westernblot(一抗是abcam公司的prss1抗体,二抗为中山金桥公司的辣根酶标记的山羊抗兔的二抗)和elisa检测转染(r&dsystemhumantrypsin(pan)elisa试剂盒)细胞胞质以及细胞上清中prss1表达水平。westernblot结果如图2a所示,实验显示对西妥昔单抗耐药的结肠癌细胞株(ht-29、hct-8和sw480)的胞质中prss1蛋白的表达水平显著高于对西妥昔单抗敏感的细胞(difi、lovo和caco-2);
elisa检测结果如图2b西妥昔单抗耐药的结肠癌细胞株(ht-29、hct-8和sw480)的细胞上清中prss1蛋白的表达水平明显高于对西妥昔单抗敏感的细胞(difi、lovo和caco-2)。
因此,prss1可以作为辅助判断待测细胞是否耐西妥昔单抗的标识物,分别检测待测细胞和西妥昔单抗敏感细胞(如difi或caco-2)中prss1表达量,若待测细胞中prss1表达量高于西妥昔单抗敏感细胞中prss1表达量,则待测细胞对西妥昔单抗具有或候选具有耐药性;若待测细胞中prss1表达量不高于西妥昔单抗敏感细胞中prss1表达量,则待测细胞对西妥昔单抗不具有或候选不具有耐药性。
那么究竟prss1和细胞耐西妥昔单抗是如何作用,进行下面实验。
实施例2、prss1提高结肠癌细胞对西妥昔单抗的耐药性
一、过表达prss1结肠癌细胞和干扰prss1表达的结肠癌细胞的获得
1、过表达prss1全长肽及成熟肽的结肠癌细胞的获得
1)过表达prss1的重组载体及转染细胞
pmscv-puro-prss1为将prss1全长肽的编码基因(序列1)插入pmscv-puro(clontech公司,目录号为pt3303-5,货号为catalog#k1062-1)的bglⅱ和salⅰ酶切位点得到的载体。
pmscv-puro-prss1’为将prss1成熟肽的编码基因(序列3)插入pmscv-puro的bglⅱ和salⅰ酶切位点得到的载体。
将pmscv-puro-prss1和pmscv-puro-prss1’、pmscv-puro分别转染lovo(购自美国atcc公司,bncc337953),得到转染pmscv-puro-prss1结肠癌细胞lovo、转染pmscv-puro-prss1’结肠癌细胞lovo、转染pmscv-puro空载体结肠癌细胞lovo。
2)rt-pcr和real-time验证
提取转染pmscv-puro-prss1的结肠癌细胞lovo(prss1(f))和转染pmscv-puro-prss1’的结肠癌细胞lovo(prss1(m))以及转染pmscv-puro空载体结肠癌细胞lovo(vector)的mrna,反转录成cdna,用rt-pcr和real-time方法进行检测。
针对prss1的引物为fw5′-aggcacactctaccaccatga-3′和rv5′-atgttgtgctctcccagtctca-3;针对gapdh的引物为fw5′-aggtcggtgtgaacggatttg-3′和rv5′-tgtagaccatgtagttgaggtca-3′。
rt-pcr检测结果如图3a,转染pmscv-puro-prss1的结肠癌细胞lovo和转染pmscv-puro-prss1’的结肠癌细胞lovo均得到约327bp的pcr产物,转染pmscv-puro空载体的结肠癌细胞lovo没有目的产物。
real-time检测结果如图3b,可以看出,转染pmscv-puro-prss1的结肠癌细胞lovo和转染pmscv-puro-prss1’的结肠癌细胞lovo中prss1的表达量大于转染pmscv-puro空载体的结肠癌细胞lovo。
3)westernblot检测
无血清细胞培养液中培养转染pmscv-puro-prss1的结肠癌细胞lovo(prss1(f))和转染pmscv-puro-prss1’的结肠癌细胞lovo(prss1(m))以及转染pmscv-puro空载体结肠癌细胞lovo(vector),分别收集上清液,提取蛋白,用westernblot(一抗是abcam公司的prss1抗体,二抗为中山金桥公司的辣根酶标记的山羊抗兔的二抗)和elisa检测转染(r&dsystemhumantrypsin(pan)elisa试剂盒)细胞胞质以及细胞上清中prss1表达水平。
westernblot检测结果如图3c所示,elisa检测结果如图3d所示,上述结果均表明转染pmscv-puro-prss1的lovo(prss1(f))和转染pmscv-puro-prss1’的结肠癌细胞lovo(prss1(m))中prss1表达水平均高于转染pmscv-puro空载体结肠癌细胞lovo,表明prss1在转染后的细胞中过表达。
2、转染prss1shrna的结肠癌细胞和转染controlshrna的结肠癌细胞的获得
1)prss1shrna干扰表达载体及转染细胞
prss1shrna干扰表达载体1为将shrna1的编码基因(ttgttcagagtcttcctgtcg)插入plko.1-trccontrol(clontech公司,编号为10879)载体的ecori和agei位点得到的载体。
prss1shrna干扰表达载体3为将shrna3的编码基因(ttgctggtaatctttccaggg)插入plko.1-trccontrol(10879)载体的ecori和agei位点得到的载体。
controlshrna干扰表达载体为plko.1-scrambleshrna(clontech公司,编号为1864)。
将上述prss1shrna干扰表达载体1、prss1shrna干扰表达载体3和controlshrna干扰表达载体转染293t细胞,包装得到表达prss1shrna1慢病毒液、表达prss1shrna3慢病毒液和表达controlshrna慢病毒液。
将表达prss1shrna1慢病毒液、表达prss1shrna3慢病毒液和表达controlshrna慢病毒液分别侵染结肠癌细胞lovo,得到转染prss1shrna1的结肠癌细胞lovo、转染prss1shrna3的结肠癌细胞lovo和转染controlshrna的结肠癌细胞lovo。
2)转染prss1shrna的结肠癌细胞
提取转染prss1shrna1的结肠癌细胞lovo(shrna-1)、转染prss1shrna3的结肠癌细胞lovo(shrna-3)和转染controlshrna的结肠癌细胞lovo(scramble)的mrna,反转成cdna后用rt-pcr和real-time方法进行检测。
针对prss1的引物为fw5′-aggcacactctaccaccatga-3′和rv5′-atgttgtgctctcccagtctca-3;针对gapdh的引物为fw5′-aggtcggtgtgaacggatttg-3′和rv5′-tgtagaccatgtagttgaggtca-3′。
rt-pcr结果如图5a所示,real-time结果如图5b所示,可以看出,相比于转染controlshrna的结肠癌细胞lovo,转染prss1shrna1的结肠癌细胞lovo和转染prss1shrna3的结肠癌细胞lovo在mrna的表达水平显著降低。
无血清细胞培养液中培养上述转染细胞,收集上清液,用elisa方法(r&dsystemhumantrypsin(pan)elisa试剂盒)检测感染细胞上清中prss1表达水平。以感染controlshrna的细胞为对照。结果如图5c所示,转染prss1shrna1的结肠癌细胞lovo和转染prss1shrna3的结肠癌细胞lovo中prss1表达水平低于转染controlshrna的结肠癌细胞lovo,表明,prss1在转染prss1shrna后受到抑制。
三、prss1与西妥昔单抗的作用关系
1、prss1使西妥昔单抗抑制结肠癌细胞增值的水平降低
mtt检测:
(1)将转染pmscv-puro-prss1的结肠癌细胞lovo(prss1(f))、转染pmscv-puro-prss1’的结肠癌细胞lovo(prss1(m))、转染pmscv-puro空载体结肠癌细胞lovo(vector)、转染controlshrna的结肠癌细胞lovo(control)、转染prss1shrna1的结肠癌细胞lovo(shrna-1)和转染prss1shrna3的结肠癌细胞lovo(shrna-3)分别用胰酶消化,用培养基制成5×104/ml细胞悬液。
(2)均匀铺于96孔板中,每空加入200μl细胞悬液,共设6个复孔,共铺8块96孔板。
(3)放置于37℃,5%co2培养箱内。
(4)用培养液将西妥昔单抗(德国默克公司s20110009)稀释成0μg/ml、 0.01μg/ml、0.1μg/ml、1μg/ml、5μg/ml、10μg/ml、20μg/ml、50μg/ml以及1000μg/ml的浓度梯度。
(5)待细胞贴壁(12小时后),每孔中加入100μl上述(4)制备的相应药物浓度的培养液,细胞培养箱内继续培养36小时,换液,继续培养36小时。
(6)西妥昔单抗处理细胞72小时后,每孔内加入20μl提前混合好的mtt溶液,微量震荡器震荡10min,使充分混合。细胞培养箱内培养2小时。
(7)以490nm波长用thermo酶标仪测量每孔的数据,记录结果。
(8)重复以上实验。
(9)绘制细胞生长曲线。
结果如图4和图6所示所示,可以看出,在西妥昔单抗处理下,转染pmscv-puro-prss1的结肠癌细胞lovo和转染pmscv-puro-prss1’的结肠癌细胞lovo的增值率大于转染pmscv-puro空载体结肠癌细胞lovo;在西妥昔单抗处理下,转染prss1shrna的结肠癌细胞lovo的增值率小于转染controlshrna的结肠癌细胞lovo。表明,prss1使西妥昔单抗抑制结肠癌细胞增值的水平降低,从而提高结肠癌细胞对西妥昔单抗的耐药性。
2、prss1使西妥昔单抗抑制结肠癌细胞中egfr信号通路中的p-egfr、p-akt和p-erk表达水平降低
提取将转染pmscv-puro-prss1的结肠癌细胞lovo(full)、转染pmscv-puro-prss1’的结肠癌细胞lovo(mature)、转染pmscv-puro空载体结肠癌细胞lovo(vector)、转染controlshrna的结肠癌细胞lovo(vector)、转染prss1shrna1的结肠癌细胞lovo(sh-1)和转染prss1shrna3的结肠癌细胞lovo(sh-3)的蛋白,用westernblot检测转染细胞中p-egfr(所用的一抗为美国abcam公司产品,所用的二抗为中山金桥公司的辣根酶标记的山羊抗兔的二抗)、p-akt(所用的一抗为美国cellsignalingtechnology公司产品,所用的二抗为中山金桥公司的辣根酶标记的山羊抗兔的二抗)和p-erk(美国cellsignalingtechnology公司产品,所用的二抗为中山金桥公司的辣根酶标记的山羊抗兔的二抗)表达水平。以结肠癌细胞lovo(mock)为对照。
结果如图7所示,左图显示了结肠癌细胞过表达prss1,右图显示抑制结肠癌细胞中prss1表达,可以看出,在西妥昔单抗处理下,转染pmscv-puro-prss1的结肠癌细胞lovo、转染pmscv-puro-prss1’的结肠癌细胞lovo中的p-egfr、p-akt和p-erk的表达水平高于转染pmscv-puro空载体结肠癌细胞lovo;在西妥昔单抗处理下,干扰prss1表达的转染prss1shrna1的结肠癌细胞lovo(sh-1)和转染prss1shrna3的结肠癌细胞lovo(sh-3)中的p-egfr、p-akt和p-erk的表达水平低于结肠癌细胞 lovo(mock)和转染controlshrna的结肠癌细胞lovo(vector)。表明,prss1使西妥昔单抗抑制结肠癌细胞中egfr信号通路中的p-egfr、p-akt和p-erk表达水平降低,从而提高结肠癌细胞对西妥昔单抗的耐药性。
3、细胞上清降解西妥昔单克隆抗体
1)、复苏转染pmscv-puro-prss1的结肠癌细胞lovo(prss1(f))、转染pmscv-puro-prss1’的结肠癌细胞lovo(prss1(m))、转染pmscv-puro空载体结肠癌细胞lovo(vector)、转染controlshrna的结肠癌细胞lovo(vector)、转染prss1shrna1的结肠癌细胞lovo(shprst1-1)和转染prss1shrna3的结肠癌细胞lovo(shprst1-3),传代;以结肠癌细胞lovo(mock)为对照。
2)、胰酶消化细胞,细胞计数,将7×105个细胞接种到25cm2平皿中,共接种6个6cm平皿,放置于37℃,5%co2培养箱内培养;
3)、待细胞长至75%左右时,弃去含血清的培养基,用pbs清洗2遍,将pbs吸去,向细胞中加入含有5μg/ml西妥昔单抗的无血清培养基4ml,将细胞置于37℃,5%co2培养箱内培养;
4)、分别于0小时、2小时、6小时、12小时、24小时、36小时以及48小时吸取细胞上清500μl,吸取的上清4℃,2000rpm离心5分钟,以清除死细胞。将细胞上清分装,冻存于-80℃冰箱内;
5)、分别取0小时、2小时、6小时、12小时、24小时、36小时以及48小时细胞上清10μl,加入2μl6×蛋白loadingbuffer,100℃变性5分钟;
6)、sds聚丙烯酰胺凝胶电泳。
7)、5%脱脂牛奶中室温封闭1小时后,将膜放入以1:1000稀释的辣根酶标记的山羊抗人的二抗中进行孵育,4℃摇床过夜。
8)、从4℃摇床上将膜取出,放置于室温30分钟,后用pbst洗膜3次,每次10分钟。
9)、显影,分析结果。
过表达prss1结果如图8所示,说明过表达prss1之后,细胞上清对西妥昔单抗的降解显著的增强;
干扰prss1结果如图9所示,敲低细胞中prss1的表达后,细胞上清对西妥昔单抗的降解则明显的减弱。
这一实验结果证明prss1可以降解西妥昔单抗。
实施例3、prss1降解其余单抗
分析prss是否可以降解贝伐珠单抗和曲妥珠单抗等其余商品化的单克隆抗体。
方法与实施例2的三的3基本一样,仅将西妥昔单抗替换为贝伐珠单抗(公司的名称是rochepharma(schweiz)ltd国内联系是上海罗氏制药有限公司,进口注册标 准:js20110006)或曲妥珠单抗(公司的名称是rochepharma(schweiz)ltd国内联系是上海罗氏制药有限公司,进口注册标准:js20110007以及js20110008),且结肠癌细胞为ht-29。
结果如图10所示,发现细胞上清中的prss1除了可以降解西妥昔单抗之外,还可以降解贝伐珠单抗和曲妥珠单抗。
实施例4、prss1用来判断待测患者是否耐西妥昔单抗
收集临床中使用西妥昔单抗治疗的52例结肠癌肿瘤患者的治疗前、治疗中以及治疗后的血清,elisa试剂盒检测血清中prss1的水平(详见humantrypsinpanspecificduosetelisakit;r&dsystem说明书)。这52例使用单克隆抗体进行治疗的患者中,有23例患者是对单克隆抗体原发耐药的患者,29例患者对单克隆抗体的治疗是有效的。
结果如图11所示,elisa检测这52例患者在用单克隆抗体进行治疗前血清中prss1的水平,对单克隆抗体治疗原发耐药的23例患者血清中prss1的表达水平明显高于对单克隆抗体治疗有效的29例患者血清中prss1的水平。
因此,prss1可以作为判断或辅助判断待测肿瘤患者是否对西妥昔单抗原发耐药。
另外,连续监测对单克隆抗体治疗有效的患者a、b和c血清中prss1的水平,发现,随着单克隆抗体的不断使用,患者血清中prss1的水平与患者对单克隆抗体的疗效存在着一定的相关性。当患者对单克隆抗体治疗的效果较好时,患者血清中prss1的水平则维持不变甚至降低,而当患者逐渐对单克隆抗体的治疗失去效果时,患者血清中prss1的水平则明显的有升高的趋势。也就是说通过监测患者血清中prss1的水平,可以预估患者对单抗隆抗体治疗是否有效,并且这种预估性相比于监测肿瘤标记物cea或ca19-9,具有更好的疗效预测性。即prss1可以作为判断单克隆抗体类药物疗效的一个预测分子。实验结果如图12所示。
总而言之,分别检测用药前待测肿瘤患者prss1表达量,若用药前待测肿瘤患者中prss1表达量高于有效病人中prss1表达量,则待测肿瘤患者对西妥昔单抗具有耐药性;若用药前待测肿瘤患者中prss1表达量不高于有效病人中prss1表达量,则待测肿瘤患者对西妥昔单抗不具有耐药性。并且,连续监测患者在用药过程中血清中prss1的表达量,可以预判患者什么时候会对单克隆抗体失去疗效,进而可以避免不必要的过度医疗,并及时更换有效的治疗方案。
实施例5、prss1的抑制剂可以增强单克隆抗体对肿瘤的疗效
一、prss1抑制剂spink1可以抑制prss1对单克隆抗体的降解
1、将人丝氨酸蛋白酶prss1(r&dsystem公司,货号为3848-se-010)用pbs稀释成400nm/l。
2、向400nm/l的人丝氨酸蛋白酶溶液中加入prss1单克隆抗体(r&dsystem公 司,货号为3848-se-010),使单克隆抗体的浓度为25ng/μl.
3、准备四个dp管,分别加入400μl上述含400nm/l人丝氨酸蛋白酶的25ng/μl的单克隆抗体溶液,标为a、b、c和d,向b中加入乌司他丁(医用胰蛋白酶抑制剂,广州天普生化医药股份有限公司,国药准字h19990134,产品批号031402113)使其浓度为1600u/ml,向c中加入购买的大豆胰蛋白酶抑制剂(sigma公司,货号为t6522)使其浓度为1mg/ml,向d中加入购买的重组人spink1蛋白(r&dsystem公司,货号为7496-pi,为prss1抑制剂),
4、再准备一个ep管,将其标记为e,仅向e中加入400μl浓度为25ng/μl的单克隆抗体稀释液,即没有加入人丝氨酸蛋白酶及其抑制剂。
5、将a、b、c、d和e五个ep管放在37℃烤箱6小时。
分别从四个ep管中取出5μl,westernblot实验检测,结果如图13所示,prss1抑制剂乌司他丁、大豆胰蛋白酶抑制剂以及重组人spink1蛋白均可抑制prss1对单克隆抗体的降解,其中spink1蛋白对人丝氨酸蛋白酶prss1的抑制是最强的。
二、prss1的抑制剂spink1与单克隆抗体的联合用药可以更好地抑制肿瘤的生长和增殖
重组人spink1蛋白(r&dsystem公司,货号为7496-pi,为prss1抑制剂)
将ht-29细胞(美国atcc公司,编号为bncc100164)制成3*107个/ml的单细胞悬液,每只balb/c雌性裸鼠注射100μl的单细胞悬液,共接种35只balb/c雌性裸鼠。
于接种后第5天开始每次用药前用游标卡尺测量瘤子的最长径和最短经,并按照公式体积=1/2×最长径×最短经2计算荷瘤的体积,将裸鼠分成生理盐水组、抑制剂组、单克隆抗体组以及抑制剂+单克隆抗体组共四个组,每组8只裸鼠。
分别按照如下每组的药液给药每组裸鼠:
生理盐水组:每只裸鼠注射生理盐水;
抑制剂组:每只裸鼠注射25μg的prss1抑制剂spink1;
单克隆抗体组:每只裸鼠注射100μg的贝伐珠单抗;
抑制剂+单克隆抗体组:每只裸鼠注射100μg的贝伐珠单抗和25μgprss1抑制剂spink1;
上述给药为使每只裸鼠的注射体积约225μl,每周给药两次.
测量并记录荷瘤的大小,约一个月后(从第二次给药记起)将裸鼠从动物房取出,将裸鼠处死后将瘤子剥出,对每组裸鼠的荷瘤大小进行分析。
结果如图14所示,prss1的抑制剂spink1与单克隆抗体的联合用药,可以更好的抑制肿瘤细胞的生长和增殖。
- 还没有人留言评论。精彩留言会获得点赞!