一种定量评价海洋环境变化的方法与流程
本发明属于环境生态学技术领域,涉及建立一种量化评价污染物类型及污染程度的海洋环境生物学监测方法。
背景技术:
目前国内外所使用的海洋环境监测方法主要是通过直接检测水体或沉积物中污染物的形态和含量,或是通过评价海洋生态系统的变化(如优势种的变化、种群丰度、密度的改变等)来实现的,它虽然能从宏观水平上反映特定时空条件下海域的污染状况,但却不能阐明(更不能预测)低浓度、长时间的污染胁迫对海洋环境和海洋环境生物的影响,对于海洋环境的健康程度以及海洋污染作用的生态效应本质更是难以说明。这主要是因为海洋生态系统是一个有等级划分的复杂系统,它在群落、种群、个体、细胞和分子等各个层次水平上均存在着代偿机制,以避免污染直接影响到生态系统的高级结构;换言之,某些污染作用可能不足以导致生态系统的高级结构在宏观上发生变化,但却能够在低等环境生物的细胞、分子水平上有所反映。这种反映和变化依靠传统的海洋环境监测手段并不能检出;而当通过传统的海洋环境监测方法监测到海洋环境中污染物浓度、或生态系统的结构发生变化时,污染已然发生并已经达到一定的程度。因此,目前这种海洋环境监测方法具有明显的间接性和后滞性,已经不能满足海洋环境可持续发展的需求。
技术实现要素:
针对现有技术中存在的问题,本方法的目的是在海洋双壳贝类中建立一种基于生物标志物系统的、定量评价海洋污染程度的生物检测与评价方法,从生物标志物系统组分的筛选与建立、主成分分析方法区分污染物类型、生物标志物指数的计算及其与环境污染程度之间的相关性分析等方面入手,将该生物评价方法的各项初始条件规范化,解决了现有研究体系的随意性与研究结果的不可比性。
本发明的技术方案如下:
一种定量评价海洋环境变化的方法,具体步骤如下:
1)目标生物的确定:目标生物选择在环境中移动性小,能有效富集环境污染物、或对环境变化响应敏感的生物;
2)目标生物靶器官的选择:靶器官的选择遵循高生物累积性或高敏感性的选择标准;
3)生物标志物的筛选及生物标志物系统的构建
研究不同浓度或不同胁迫条件下目标生物重要生理过程的影响,基于靶器官从不同生物组织层次中(分子水平、细胞水平、组织水平、个体水平、种群水平、群落水平)筛选出能灵敏响应胁迫变化的生物标志物,建立生物标志物系统;
4)将生物标志物系统中各组分有机融合成一个指数,命名为综合生物标志物指数(Integrated biological index,IBR);IBR计算方法如下,对生物标志物系统中的各组分:
①计算每个试验水平生物标志物的平均值X;
②计算生物标志物每一试验水平的标准值:Y=(X-m)/s,其中m和s是计算每一个生物标志物组分在所有试验水平下的总体平均值和标准偏差;
③Z是在上述标准数值基础上由Y推得的,在此生物标志物被激活的情况下Z=Y,在此生物标志物被抑制的情况下Z=﹣Y,激活或抑制要根据具体的酶进行判断;
④S值由S=Z+|min|推得,min是每一个生物标志物组分在所有试验水平下Z值的最小值;
⑤IBR={[(S1×S2)/2]+[(S2×S3)/2]+…+[(Sn-1×Sn)/2]+(Sn×S1)/2]}。
将生物标志物系统中各组分的计算结果相加,得到IBR;
5)利用pearson correlation analysis分析IBR与环境胁迫程度之间的相关性,确定IBR。
在上述方案的基础上,步骤1)中的目标生物选择底栖的双壳贝类生物。
在上述方案的基础上,步骤1)中靶器官选择鳃、肝胰腺和/或血液。
双壳贝类的生物标志物指标可以根据研究目标,从以下重要生理过程中选择1项或多项进行研究,具体见表1。
生物标志物的确定依据:生物标志物(biological marker,biomarker)广义上是指生物个体或群体接触外来化学污染物或其它非正常因素而造成的机体的各种变化,包括生理、生化、免疫、细胞和遗传等方面的改变。它不仅能反映污染物对生物体产生的作用,还能反映生物体对外源环境胁迫的敏感性,具有一定的剂量-效应关系。因此,只有在预检测中能灵敏响应外源环境的变化并具有一定剂量-效应关系的指标才能被确定为生物标志物。多个生物标志物组合在一起,构成生物标志物系统。
表1被纳入生物标志物系统构建的祖耀生理学组分
本发明以海洋环境中的底栖贝类为目标,从海洋低等生物的分子、细胞水平入手,将生物化学、细胞生物学、细胞遗传学和病理学等有关技术和方法引入到传统的海洋环境监测方法中,通过分析和评价海洋环境的岗哨生物在污染物胁迫初期一组指示生物体重要生理过程的生物标志物系统(biomarker system,BMS)的改变,建立相应的生物标志物指数(integrated biological index,IBR);分析IBR与环境变化之间的相关性判定海洋环境污染程度的渐变,建立基于IBR的生物环境评价新方法。该方法克服传统海洋环境监测方法的间接性、滞后性以及检测灵敏度低等缺点,具有更高的灵敏性与预警性,能够为海洋环境的早期污染评价提供一种有效的预警性监测手段。
附图说明
本发明有如下附图:
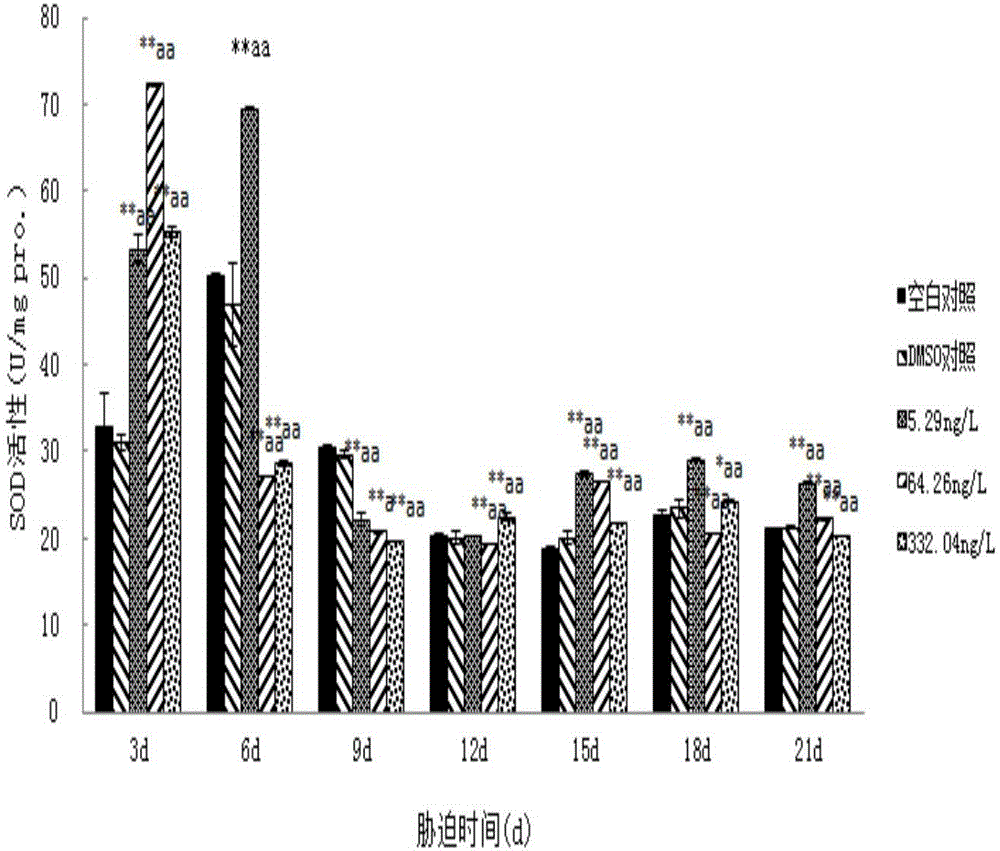
图1为实施例1中荧蒽胁迫对紫贻贝鳃中SOD活性的影响;
图2为实施例1中荧蒽胁迫对紫贻贝消化腺组织中SOD活性的影响;
图3为实施例1中荧蒽胁迫对紫贻贝鳃中CAT活性的影响;
图4为实施例1中荧蒽胁迫对紫贻贝消化腺组织中CAT活性的影响;
图5为实施例1中荧蒽胁迫对紫贻贝鳃中Gpx活性的影响;
图6为实施例1中荧蒽胁迫对紫贻贝消化腺组织中Gpx活性的影响;
图7为实施例1中不同胁迫时间、不同胁迫浓度条件下紫贻贝的IBR变化。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的保护范围。
若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
实施例1
以紫贻贝为例,研究持久性有机污染物荧蒽在不同浓度的条件下对其影响,使用本发明方法构建生物标志物系统,建立基于生物标志物指数的环境评价方法,定量评价环境污染条件的差异。
持久性有机污染物荧蒽为难溶于水的物质,能吸附在其它的水体颗粒中。对于这类污染物质通常选择鳃和消化腺作为靶器官。由于紫贻贝抗氧化系统对于污染胁迫响应灵敏,因此在这类污染物的胁迫-响应中通常可以直接选择分子水平(遗传与酶学)指标变化。
研究为亚急性毒性胁迫,时间周期选在在21d。每隔3天取样,进行生理生化分析。
如图1和图2所示,鳃和消化腺组织中SOD的活性变化对荧蒽的响应表象出类似的变化趋势,各浓度组的蒽胁迫均能明显诱导SOD活性变化,且响应时间高浓度组先于低浓度组。随着污染时间的延长,不同浓度组基本上都出现抑制。图1和图2中“*”:表示该组数据和对照组之间差异显著(ANOVA,P<0.05),“**”表明差异极显著(ANOVA,P<0.01);“a”表示相邻浓度组之间差异显著(P<0.05),“aa”表示差异极显著(P<0.01)。
如图3和图4所示,鳃和消化腺组织中,相同时间不同浓度的荧蒽作用下CAT活性变化比较明显不论是低浓度组还是高浓度组,均使CAT产生了诱导,且响应时间高浓度组先于低浓度组。随着污染时间的延长,不同浓度组基本上都出现抑制。图3和图4中“*”:表示该组数据和对照组之间差异显著(ANOVA,P<0.05),“**”表明差异极显著(ANOVA,P<0.01);“a”表示相邻浓度组之间差异显著(P<0.05),“aa”表示差异极显著(P<0.01)。
图5和图6为荧蒽胁迫对紫贻贝鳃和消化腺组织中Gpx活性的影响。结果显示:相同时间不同浓度的荧蒽对不同组织中Gpx活性均产生显著的影响。不论是低浓度组还是高浓度组,均使Gpx产生了诱导,且响应时间中浓度组先于低浓度组和高浓度组。随着污染时间的延长,不同浓度组基本上都出现抑制。图5和图6中:“*”:表示该组数据和对照组之间差异显著(ANOVA,P<0.05),“**”表明差异极显著(ANOVA,P<0.01);“a”表示相邻浓度组之间差异显著(P<0.05),“aa”表示差异极显著(P<0.01)。
以胁迫第6d和第18d的数据为例(表2),计算IBR:
表2不同处理组紫贻贝的抗氧化指标数值(均值+括号内的方差)
根据以上结果计算IBR,结果如下:
(1)胁迫6d
(2)胁迫18d
图7为不同胁迫时间、不同胁迫浓度条件下紫贻贝的IBR变化(图中,每个浓度组左侧的为6d,右侧为18d),从中可以看出,紫贻贝所受胁迫程度越轻,IBR指数越高;另外,在不同胁迫时间、不同胁迫浓度条件下,紫贻贝的IBR变化表现出良好的时间、浓度的一致性关系,即在同一浓度条件下,随着胁迫时间的延长IBR不断降低;在同一胁迫时间条件下,IBR随着浓度的增高而不断下降,二者之间存在明显的负相关性。
上述实施方案为本发明最佳的实施方案,但本发明的实施方案并不受上述实施方案的限制,其他的任何不违背本发明原理的条件下,可以通过改变参数的形式所产生的实施例,都包含于本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!