一种DNA甲基化实时检测方法及其应用与流程
本发明属于电化学检测技术领域,具体涉及一种基于溴原子稀释DNA长程电子转移原理的DNA甲基化实时检测方法及其应用。
背景技术:
DNA甲基化是指DNA在甲基转移酶(MTases)作用下,催化底物S-腺苷甲硫氨酸(SAM),转移一个甲基至胞嘧啶的C5位置,生成5-甲基胞嘧啶(5-mC)的过程。作为重要的表观遗传学修饰方式之一,DNA甲基化与胚胎发育、染色体结构、基因印记等密切相关。DNA甲基化是一个动态过程,异常的MTases表达通常引起异常甲基化修饰,并与人类各种疾病相关。因此,深入理解DNA甲基化过程及MTases功能在疾病诊断、药物筛选、细胞重编程、全能细胞研究等方面具有重要意义。
DNA甲基化研究方法分为基因组整体甲基化水平分析,特异位点甲基化分析,以及新甲基化位点寻找等。常规分析方法有甲基化特异性PCR(MS-PCR)、甲基化敏感的单核苷酸引物扩增(MS-SNuPE)、重亚硫酸氢钠联合限制性内切酶分析法(COBRA)、甲基化敏感性斑点分析(MS-DBA)、限制性标记基因组扫描(RLGS)、甲基化免疫沉淀(MIP)等。这些方法通常基于甲基化位点识别与信号放大。首先通过化学或生物方法区分DNA链中甲基化的胞嘧啶(mC)和非甲基化胞嘧啶(C),进一步利用凝胶电泳、荧光光谱、质谱、基因测序或电化学等技术检测甲基化的DNA。虽然这些方法已被广泛应用于临床和基础研究,但多数方法操作繁琐、耗时长、检测成本高或依赖复杂设备如分光光度计或荧光仪等。更重要的,这些方法只能提供静态的甲基化状态的“快照”。实现动态甲基化过程的实时检测,对于更加深入理解甲基化过程的机制,更加精确的研究甲基化转移酶活性、酶抑制剂、酶序列偏好性等基本问题,具有重要的意义。当前,尚无实时检测动态甲基化过程的有效方法,该难题仍然是甲基化研究面临的瓶颈问题之一。
实现跟踪动态DNA甲基化过程面临两个难点:(1)难以捕捉该修饰过程的微小变化。由于甲基是个很小的基团,常规的实时分析技术,如石英晶体微天平(QCM)或表面等离子体共振技术(SPR)难于在没有经过信号放大的情况下检测这一修饰过程。质谱技术可能有足够的灵敏度,但质谱分析通常是以离线的方式进行。(2)难于实现信号的同步放大。DNA甲基化需要高灵敏度的分析方法,因此通常依赖于多种信号放大策略,如聚合酶链反应(PCR)或生物亲和技术。PCR方法需要通过亚硫酸氢盐或限制性内切酶预处理待测DNA链。生物亲和策略通常使用mCpG抗体或甲基化位点结合蛋白(MBD)与甲基化位点结合,增加DNA甲基化后的信号变化。然而,该信号变化来源于DNA的甲基化修饰和生物亲和分子与甲基化位点结合的总反应过程,其主要反映的是决速步骤(反应速度最慢的步骤)的反应过程。
技术实现要素:
本发明基于DNA双链的长程电子转移特性,结合特异性化学衍生化反应,建立一种快速、简便的DNA甲基化动态过程实时电化学检测方法和电化学生物传感器,并应用于DNA甲基化过程的实时检测,酶抑制剂筛选,以及酶序列偏好性等研究。
本发明所采取的技术方案是:
一种电化学生物传感器,其包括电极,电极表面修饰有待测DNA双链,所述待测DNA双链含有甲基化位点,并标记有电活性物质。
电活性物质是指在电场作用下能发生氧化还原反应的物质,其在本发明技术方案中所起的作用是产生可被检测的电化学信号,以便后续的实验结果分析。电化学检测中,常用的电活性标记物包括二茂铁,铁氰化钾,亚甲基蓝,均可用于本发明的技术方案中。
所述电活性物质修饰在纳米载体上,再通过纳米载体固定到待测DNA双链上。纳米载体在此处所起的作用是:承载电活性物质(如二茂铁等),提高电活性物质的修饰量,增大电化学反应信号,改善测试灵敏度。因此,所述纳米载体具有导电性,粒径≤25nm,例如金纳米粒子。
所述电极为惰性金属电极或玻碳电极,包括金电极、银电极、铂电极或玻碳电极,均可用于本发明的技术方案中。
作为优选的,电活性物质可通过共价结合(例如金-硫共价结合)原理、亲和系统(例如生物素-亲和素系统,抗体-抗原亲和系统)、或先构建功能化导电聚合物膜的方法固定到纳米载体上;
作为优选的,负载电活性物质的纳米载体通过共价结合(例如金-硫共价结合)原理、亲和系统(例如生物素-亲和素系统,抗体-抗原亲和系统)、或先构建功能化导电聚合物膜的方法固定到待测DNA双链上;
作为优选的,待检DNA双链通过共价结合(例如金-硫共价结合)原理、亲和系统(例如生物素-亲和素系统,抗体-抗原亲和系统)、或先构建功能化导电聚合物膜的方法固定到电极上。
一种DNA甲基化实时检测试剂盒,其包括以上所述的电化学生物传感器,以及甲基转移酶、S-腺苷甲硫氨酸、溴原子供体、强氧化剂。
作为优选的,所述强氧化剂包括高碘酸钠、重铬酸钾、高锰酸钾中的至少一种,强氧化剂在此处的作用是通过特异性氧化反应,在甲基胞嘧啶的C4位置上键合一个溴原子;所述溴原子供体为溴化物,例如溴化锂。
一种DNA甲基化实时检测方法,包括如下步骤:
(1)制备电化学生物传感器;
(2)对电化学生物传感器上修饰的待检DNA双链进行从头甲基化反应;
(3)对步骤(2)甲基化反应生成的5-mC进行特异性化学衍生化反应,使其DNA双链
的电子转移效率明显下降,产生电化学信号差异;
(4)实时监测该电化学信号的变化,以跟踪DNA动态甲基化过程。
步骤(3)所述特异性化学衍生化反应为溴衍生化反应,在溴原子和强氧化剂存在的情况下发生。
该技术方案的具体原理如下:
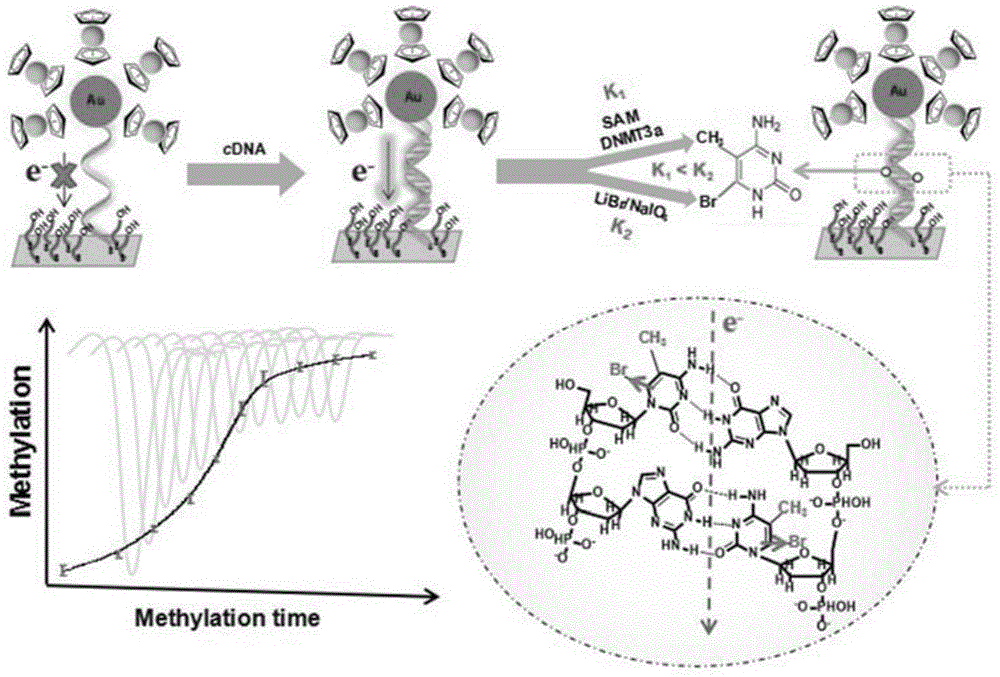
已知双螺旋DNA由于其磷酸骨架和碱基间的π电子云堆积,具有长程电子转移能力。该长程电子转移的效率依赖于DNA双链中的C:G碱基对,并极大地受C:G碱基对间π电子云堆积情况变化影响,如碱基修饰或错配、DNA熔链、大分子的结合或吸附等。由于DNA甲基化过程不仅是一个特定的碱基修饰过程,而且也可作为特异性化学反应的活性位点,本方法利用甲基化过程对DNA双链的长程电子传递特性的影响,结合特异性的溴衍生化反应进一步增加该影响,建立简便的DNA甲基化实时动态电化学检测方法。其具体步骤如图1所示:制备电化学生物传感器,传感器表面修饰含有甲基化位点的、标记有电活性物质的DNA双链,形成电子传递通路。在MTases/SAM存在下,待分析位点发生甲基化后,生成的5-mC迅速发生特异性溴衍生化反应,在甲基胞嘧啶的C4位置上键合一个溴原子,在溴原子和甲基基团的共同作用下,引起DNA双链的电子转移效率明显下降,产生电化学信号差异,高斯计算证实了该长程电子传递能力的降低来源于溴对所在区域的π电子云分布的影响。通过实时监测该电化学信号的变化,可跟踪DNA动态甲基化过程。
本发明的有益效果是:
该方法通过溴原子供体和强氧化剂对甲基化胞嘧啶的特异性氧化反应,在甲基胞嘧啶的C4位置上键合一个溴原子,在溴原子和甲基基团的共同作用下,双链DNA的长程电子传递能力明显降低,所产生的电化学信号明显减弱,且所减弱的电化学信号与目标碱基的甲基化程度成正比。该方法具有快速,灵敏,不受溶液浊度影响,操作方便,使用成本低,易于微型化和实现现场检测等特点,在DNA甲基化检测方面具有独特优势:
(1)衍生化反应速率快,可与DNA甲基化过程同步,实现了检测的即时性,适用于临床上在线快速检测;
(2)检测过程中无需二次标记或二次反应,简化了分析的操作步骤,缩短了分析时间,降低测定成本;
(3)方法无需使用限制性生物类或荧光类识别物,对特异位点的甲基化研究具有普适性;
(4)该方法表现出很好的重复性和稳定性,可发展成为试剂盒并向市场推广。
附图说明
图1:基于溴原子稀释DNA长程电子转移原理的DNA甲基化实时动态检测方法示意图;
图2:离线方法动态检测DNA甲基化过程;
图3:基于溴衍生化反应的DNA甲基化过程动态检测(离线);
图4:基于溴衍生化反应的DNA甲基化过程动态检测(在线);
图5:DNMT3a酶抑制剂地西他滨(A)与表没食子儿茶素没食子酸酯(B)的活性检测;
图6:DNMT3a酶对不同侧翼位碱基序列的偏好性检测。
具体实施方式
下面结合实施例对本发明作进一步的说明,但并不局限于此。
实施例1
含有甲基化位点的探针分子标记巯基二茂铁后,与巯基己醇共同修饰到金电极表面,并与互补DNA杂交形成长程电子传递通路。在DNMT3a催化下,探针DNA被甲基化后,立刻发生溴衍生化反应,在甲基胞嘧啶的C4位置上键合一个溴原子,在溴原子和甲基基团的共同作用下,使双链DNA的长程电子传递能力明显降低。高斯计算证实了该长程电子传递能力的降低来源于溴对所在区域的π电子云分布的影响。
1、制备电化学生物传感器
(1)金电极预处理
金电极在用体积比为3:7的过氧化氢/硫酸混合液浸泡后,洗净,用氧化铝粉末抛光。活化电极表面,利用循环伏安法检测电极抛光结果。
(2)DNA探针固定化
设计含有待分析甲基化位点的DNA探针,探针两端修饰巯基。根据探针序列,设计其互补DNA。修饰有巯基的DNA探针与互补DNA链杂交反应后,与含有巯基己醇的缓冲液混合,在金电极表面进行自组装反应。
(3)电活性探针的合成和标记
根据金-硫共价结合原理,将金纳米粒子溶液与巯基二茂铁进行混合反应,之后采用离心分离方法,将含金纳米粒子/巯基二茂铁聚合物的下层底液转入缓冲液中备用。
根据金-硫共价结合原理,将含有金纳米粒子/巯基二茂聚合物的缓冲液滴加在自组装有DNA双链的金电极表面进行共价修饰。
2、DNA甲基化动态过程检测
(1)DNA甲基化条件优化
用不同浓度的MTase对DNA进行从头甲基化反应,并检测反应后的电化学信号。酶量越大,DNA甲基化程度越高,电化学信号降低值越大。以电化学信号值最小的一组实验的DNMT3a用量为其最佳浓度。
用最佳浓度的DNMT3a对DNA进行不同温度和时间的从头甲基化反应,并检测反应后的电化学信号。以电化学信号值最小的一组实验所用的温度和时间为其最佳反应温度和时间。
用不同浓度的酶底物SAM进行从头甲基化反应,并检测反应后的电化学信号。酶底物浓度越大,DNA甲基化生成效率越高,所产生电信号越低。以电化学信号值最小的一组实验的SAM用量为其最佳浓度。
(2)溴衍生化条件优化
用不同浓度的溴化锂和高碘酸钠进行DNA甲基化的衍生化反应,并检测反应后的电化学信号。衍生产物生成量与所产生的电化学信号值成反比,根据结果,以电化学信号值最小的一组实验的溴化锂和高碘酸钠用量为其最佳浓度。用最佳浓度的溴化锂和高碘酸钠进行不同温度和时间下的衍生化反应,并检测反应后的电化学信号。根据结果,以电化学信号值最小的一组实验所用的温度和时间为其最佳反应温度和时间。
(3)电化学检测条件优化
在三电极体系(金工作电极、银/氯化银参比电极、铂丝辅助电极)中,二茂铁的出峰电位在0.30~0.35V之间,因此示差脉冲伏安法的电位扫描范围设定为-0.1~0.6V。根据电化学工作站提供的参考值,电位增量及振幅分别设为0.004V和0.05V,脉冲宽和周期分别设为0.05秒和0.2秒。
(4)目标DNA甲基化动态过程检测
待测DNA自组装于金电极表面并修饰金纳米粒子/巯基二茂铁后,在最佳示差脉冲伏安条件下进行电化学信号检测,确定初始信号值。对待测DNA进行甲基化和溴衍生化反应,按照反应所需的最佳浓度、温度及缓冲液pH值同时加入所需反应物。反应开始后,每隔10-15分钟进行一次电化学信号检测,记录所测电化学信号与初始信号的差异,分析甲基化变化过程。
实施例2
下面以DNA甲基化转移酶DNMT3a作用甲基化位点5’-CCGG-3’为例,对本发明的技术方案再做进一步的说明。
含有甲基化位点(5’-CCGG-3’)的探针分子标记巯基二茂铁后,与巯基己醇共同修饰到金电极表面,并与互补DNA杂交形成长程电子传递通路。在DNMT3a催化下,探针DNA被甲基化后,立刻发生溴衍生化反应,使双链DNA的长程电子传递能力明显降低。高斯计算证实了该长程电子传递能力的降低来源于溴对所在区域的π电子云分布的影响。
1.制备电化学传感器
(1)金电极预处理
金电极(Φ=3mm)用体积比为3:7的过氧化氢/硫酸混合液浸泡30分钟后,在去离子水中超声洗净5分钟。分别用粒径为1、0.3、0.05μm的氧化铝粉末抛光,并在体积比为1:1的乙醇:水溶液中超声洗净5分钟。该电极在0.5M的稀硫酸中,在–0.2~1.6V循环扫描80圈。用去离子水洗净电极,备用。
(2)DNA探针固定化
设计DNA探针(p-ODN)及其互补DNA链(c-ODN)。序列如下:
p-ODN:5’-SH-C6-CCATGTACCGGACTAGTC-C6-SH-3’(SEQ ID NO.1);
c-ODN:5’-GACTAGTCCGGTACATGG-3’(SEQ ID NO.2)。
60μL TNE缓冲液中(10mM Tris-HCl,1mM EDTA,0.1M NaCl,pH=7.4)含有1μM p-ODN和1μM c-ODN,在37℃潮湿环境下杂交反应1小时。杂交反应液与40μL 0.1mM的MCH及100μL的TE缓冲液(10mM Tris-HCl,1mM EDTA,pH=7.4)混合,滴加于已抛光的金电极表面,在4℃潮湿环境下静置反应12小时。
(3)电活性探针的合成和标记
将0.5mL金纳米粒子溶液与0.5mL 5mM的巯基二茂铁(SH-Fc)正己烷溶液在常温下混合反应12小时。以8000转/分钟的速度离心6分钟,移去上层清液。用1mL体积比为1:1的正己烷/磷酸盐缓冲液将离心管中的剩余样液转移出并滴加到修饰有DNA双链的金电极表面。在常温下静置反应2小时。用去离子水冲洗电极表面去除非特异性结合物。
2.DNA甲基化动态变化过程检测
(1)示差脉冲伏安法检测电化学信号
示差脉冲伏安法电位扫描范围设置为–0.1~0.6V,其他条件根据电化学工作站的固有参考值进行设置。以制备好的金电极为工作电极,Ag/AgCl为参比电极,铂丝电极为辅助电极,在浓度为0.5M的磷酸盐缓冲液(pH=7.4)中检测电活性物(Fc)的电化学信号值,记录为初始电化学信号值(I0)。
(2)DNA甲基化过程动态检测(离线)
将100μL的1×NEBuffer2反应储备液(含50mM NaCl,10mM Tris-HCl,10mM MgCl2,1mM DTT,120μM SAM和90nM DNMT3a)滴加在制备好的金电极表面,在37℃的潮湿环境下进行甲基化反应。每隔10~15分钟在0.5M的磷酸盐缓冲液(pH=7.4)中进行一次电化学检测,记录电化学信号值(I1,I2,I3...)。计算每次测得的电化学信号值与初始电化学信号值差异的百分比(1–Ix/I0)×100%,绘制信号变化曲线(图2)。
(3)溴增强DNA甲基化过程动态检测(离线)
将100μL的1×NEBuffer2反应储备液(含50mM NaCl,10mM Tris-HCl,10mM MgCl2,1mM DTT,120μM SAM,90nM DNMT3a,20mM NaIO4和50mM LiBr)滴加在制备好的金电极表面,在37℃的潮湿环境下进行甲基化反应。每隔10~15分钟在0.5M的磷酸盐缓冲液(pH=7.4)中进行一次电化学检测,记录电化学信号值(I1',I2',I3'...)。计算每次测得的电化学信号值与初始电化学信号值差异的百分比(1–Ix’/I0)×100%,绘制信号变化曲线。根据图3所示,溴衍生化反应不仅增强了信号差异,而且反应速率与甲基化速率基本同步。
(4)溴增强DNA甲基化过程动态检测(在线)
在10mL反应槽中加入5mL的1×NEBuffer2反应储备液(含50mM NaCl,10mM Tris-HCl,10mM MgCl2,1mM DTT,120μM SAM,90nM DNMT3a,20mM NaIO4和50mM LiBr),同时放入一个1cm长的搅拌子。将电极伸入反应储备液中,反应每隔10-15分钟后,用搅拌子以800转/分钟的速度搅拌溶液1分钟以脱去非特异性结合物,静置5秒后,直接进行电化学检测,记录电化学信号值(I10″,I20″,I30″...)。计算每次测得的电化学信号值与初始电化学信号值差异的百分比,绘制信号变化曲线。根据图4所示,电化学信号的变化趋势与离线时所测的信号趋势相符,证明此分析方法可以进行DNA甲基化动态在线检测。
(5)溴增强DNA甲基化过程动态检测方法应用于DNMT3a酶抑制剂筛选研究
在10mL反应槽中加入5mL的1×NEBuffer2反应储备液(含50mM NaCl,10mM Tris-HCl,10mM MgCl2,1mM DTT,120μM SAM,90nM DNMT3a,20mM NaIO4和50mM LiBr),同时放入一个1cm长的搅拌子。将电极伸入反应储备液中,反应100分钟后,用搅拌子以800转/分钟的速度搅拌溶液1分钟以脱去非特异性结合物,静置5秒后,直接进行电化学检测,记录电化学信号值I0″'作为参比信号值。在相同反应体系中,分别依次加入不同溶度(0.5,0.8,1.0,1.2,1.5,2.0,2.5,3.0,5.0μM)的DNMT3a酶抑制剂地西他滨和表没食子儿茶素没食子酸酯。将电极伸入反应储备液中,反应100分钟后,用搅拌子以800转/分钟的速度搅拌溶液1分钟以脱去非特异性结合物,静置5秒后,直接进行电化学检测,记录电化学信号值(I1″',I2″',I3″'...)。计算每次测得的电化学信号值与参比信号值差异的百分比,采用“归一法”绘制信号变化曲线。根据图5所示,地西他滨与表没食子儿茶素没食子酸酯的IC50值分别为1.27μM和2.05μM。
(6)溴增强DNA甲基化过程动态检测方法应用于DNMT3a酶序列偏好性研究
在10mL反应槽中加入5mL的1×NEBuffer2反应储备液(含50mM NaCl,10mM Tris-HCl,10mM MgCl2,1mM DTT,120μM SAM,90nM DNMT3a,20mM NaIO4和50mM LiBr),同时放入一个1cm长的搅拌子。将含不同侧翼位碱基序列(CCGG,GCGC,ACGC)的DNA修饰于电极表面,依次将电极伸入反应储备液中,反应100分钟后,用搅拌子以800转/分钟的速度搅拌溶液1分钟以脱去非特异性结合物,静置5秒后,直接进行电化学检测,记录电化学信号值(I1″″,I2″″,I3″″......)。计算每次测得的电化学信号值与初始电化学信号值差异的百分比,绘制信号变化柱状图。根据图6所示,依照电化学信号差异的百分比,可以判断DNMT3a酶序列偏好性为:ACGC>GCGC>CCGG。
以上实施例表明,本发明方法具有快速,灵敏,不受溶液浊度影响,操作方便,使用成本低,易于微型化和实现现场检测等特点,可用于DNA甲基化过程的实时检测,酶抑制剂筛选,以及酶序列偏好性等研究。
以上实施例仅为介绍本发明的优选案例,对于本领域技术人员来说,在不背离本发明精神的范围内所进行的任何显而易见的变化和改进,都应被视为本发明的一部分。
SEQUENCE LISTING
<110> 中山大学
<120> 一种DNA甲基化实时检测方法及其应用
<130>
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 18
<212> DNA
<213> 人工序列
<400> 1
ccatgtaccg gactagtc 18
<210> 2
<211> 18
<212> DNA
<213> 人工序列
<400> 2
gactagtccg gtacatgg 18
- 还没有人留言评论。精彩留言会获得点赞!