一种用于分析水溶液中蛋白质二级结构的傅里叶变换红外光谱样品准备方法与流程
本发明属于生物大分子分析技术领域,具体涉及—种简单高效的样品准备方法,特别是一种用于分析水溶液中蛋白质二级结构的傅里叶变换红外光谱样品准备方法。
背景技术:
红外光谱是最早用于测定多肽及蛋白质二级结构的手段之一。红外光谱技术
应用于多肽及蛋白质二级结构分析大致经历了定性、半定量和定量研究三个发展阶段。
早期的研究指出在蛋白质的红外谱带中都有氢键化的NH基团的3300cm-1特征吸收带以及1700-1500cm-1范围的酰胺I带和II带;其余吸收带则主要由组成蛋白质的氨基酸残基的性质决定。随着后来研究的不断深入,到1956年己知多肽和蛋白质在红外区的特征吸收带有9个之多,即酰胺I带,酰胺II带,酰胺III带,酰胺IV带,酰胺V带,酰胺VI带,酰胺VIII带,酰胺A带和酰胺B带。其中酰胺I带对蛋白质的结构研究最有价值,酰胺A带和II带也用于多肽和蛋白质的构象研究。由于偏振辐射技术的发展以及模型多肽制备方法和蛋白质纯化方法的改进,红外研究在定性估计蛋白质二级结构的主要成分方面取得了重要进展。
70年代中期,发展了若干半定量计算蛋白质构象的方法。但是这些方法的也有其局限性,因为它要求许多参数,给实际工作造成了困难。并且由于仪器等条件的限制,以往仅限于定性和半定量研究。80年代傅里叶变换红外光谱和计算机辅助程序的发展,使蛋白质二级结构的研究的定量分析提供可能。通过二阶导数和去卷积的应用,使得红外测定蛋白质二级结构含量组成更加精准。
由于水在酰胺I带有一定的红外吸收,直到90年代,实验中一般采用重水体系进行测定。然而,重水与水毕竟有差别,且重水体系的操作也比较复杂。
90年代,蛋白红外光谱超薄样品池垫片(6-7μm),以及蛋白质红外光谱的专门分析软件投入应用,使得检测、分析水溶液环境中蛋白质二级结构成为可能。1990年,Dong等实验室用十多种己知X射线衍射数据的蛋白进行红外光谱分析,对水溶液中酰胺I带频率进行了指认,建立了红外光谱定量分析蛋白质在水环境中二级结构的方法,并以此来研究蛋白质的构象变化。该方法的建立在蛋白质二级结构的测定以及动力学的测定方面起到了重要的作用。原有的上样方法利用的是Biocell 氟化钙样品池,上样池包括垫片,氟化钙晶片(两片晶片,有孔和无孔),超薄样品膜。样品膜被裁剪成特定的形状,放在两个晶片之间,中间的空隙用于上样。无孔垫片,无孔晶片,样品膜,有孔晶片,有孔垫片,按顺序叠加,形成三明治的形状,放置在固定装置中。使用1ml 注射器将样品通过小孔注入到样品膜和晶片的空隙中。该方法使用了超薄的样品膜,能有效定量地扣除水分,具备其他技术所不具备的优势。当然,该方法也有不足之处,由于要消除水分对于蛋白样品的影响,其上样所需的样品池的膜是很薄的,而且需要在上样的过程中要求没有气泡产生,这就导致进样困难,需要一定的经验才能成功上样,而且不能完全消除水分的影响,需要软件的协助。其次,该技术对于蛋白样品的浓度是有要求的,要想得到蛋白质的信号,蛋白溶液需要高浓度(>3 mg/ml),而有些蛋白在浓度较高时会发生聚集,这也就导致了其应用有一定的局限性。
技术实现要素:
为了克服现有技术的不足,本发明的目的在于提供一种操作简单的用于分析水溶液中蛋白质二级结构的傅里叶变换红外光谱样品准备方法,其效率更高,质量更好。
本发明将蛋白样品滴在氟化钙晶片的表面,待溶剂自然蒸发后,晶片表面形成固态薄膜状,用于谱图收集。该方法操作简单,不会有气泡产生。期间水分不断蒸发,减少了水分的影响,而且对蛋白浓度的要求也较传统方法低很多(>0.5 mg/ml)。从实验结果来看,该方法实用可行。
本发明使用的技术方案利用的原理在其他红外技术中也有应用。现有其他技术中是将样品溶液滴在适当的载体上,挥发掉溶剂,将膜取下,制得样品膜,或者是在盐窗上成膜,虽可直接用于测定,但盐窗价格昂贵,稍微使用不当就容易破裂,且盐窗对水溶液不稳定,主要是用于高聚物的测定。本发明涉及的技术方案所使用的是氟化钙晶片,低溶解度,耐酸碱,主要用于测定水溶液中的蛋白质样品,其应用领域完全不同。本发明中所用的傅里叶红外分析仪配有专用于蛋白分析的软件,专门用于检测水溶液状态的蛋白质二级结构组成。
本发明的技术方案具体介绍如下。
本发明提供一种用于分析水溶液中蛋白质二级结构的傅里叶变换红外光谱
样品准备方法,其特征在于,其采用可拆卸的氟化钙样品池进样,通过将蛋白质水溶液直接涂布在氟化钙晶片上,待溶剂室温自然挥发后完成制样,从而进行傅里叶变换红外数据采集;其中:蛋白质水溶液的浓度为0.5mg/ml~20mg/ml,涂布的厚度为2-50μm。
本发明中,蛋白质水溶液涂布前,先进行预处理,除去冷冻保存的蛋白质中
的甘油等其他化学物质,并将蛋白质水溶液用低盐缓冲液透析,除去高盐。
本发明中,蛋白质水溶液是由蛋白质和水组成的溶液,或者是由蛋白质和缓
冲液组成的溶液。
本发明中,蛋白质水溶液的浓度为3-15mg/ ml。涂布的厚度为10-30μm。
本发明中,可拆卸的氟化钙样品池包括一片氟化钙晶片、两片垫片和固定装置,垫片、氟化钙晶片和垫片按顺序叠加,置于固定装置中固定。
本发明提供的用于分析水溶液中蛋白质二级结构的傅里叶变换红外光谱
样品准备方法的具体步骤如下:
(1)氟化钙晶片用溶剂擦洗干净;
(2)将蛋白质水溶液均匀地涂布于氟化钙晶片的表面,并在室温下自然挥发;
(3)缓冲液会不断蒸发,蛋白溶液在氟化钙晶体表面形成透明的薄层固体膜;
(4)将氟化钙晶片固定好,进行红外数据采集。
本发明制样后,进行红外数据采集,得到二阶导数谱图,进而可分析出蛋白
质二级结构的组成。
和现有技术相比,本发明具有的有益效果在于:
1.实验条件相对现有的技术相对宽松;
2.利用原有的实验装置,操作步骤更简单,而且在很大程度减少了水分对图谱质量的影响,操作条件及参数和原有方法相同,无需改进;
3.可用于检测低浓度的蛋白,扩大了蛋白的使用范围;
4.得到的图谱更加光滑,精度更高,所测的蛋白质浓度下限更低(>0.5mg/ml,传统方法浓度>3mg/ml;
5.蛋白的固化和疾病相关,该方法提供了一种蛋白固化二级结构组成含量测定方法;
总之,本发明在原有进样的技术的基础上进行了改进,简化了操作步骤,直接将蛋白固定在氟化钙晶片,提高了实验的成功率,同时可以作为一种对比技术,检测特殊蛋白在固化的过程中二级结构组成含量的变化,这对于某些疾病的产生机理或具有重要的意义。
附图说明
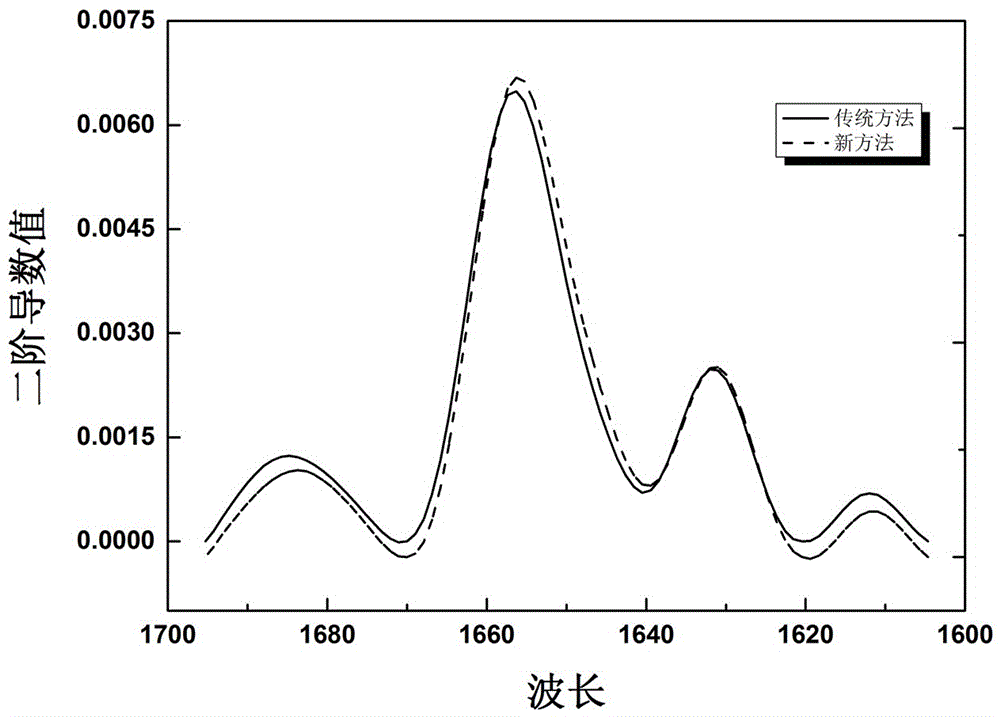
图1是本发明实施例1和传统方法的实验结果比较示意图。
图2 是本发明实施例2和传统方法的实验结果比较示意图。
图3是本发明实施例子3低浓度蛋白测定结果示意图。
具体实施方式
下面结合附图和实施例对本发明的技术方案进行详细说明。
实施例中,红外实验部分所用到的光谱仪为美国Bio tools公司的PR0TA-2X系列Prota蛋白分析仪,主要组件包括:ABB BomemMB3000傅立叶变换红外光谱仪,薄膜型氟化钙可拆卸液体氟化钙样品池(ABB Bo men Inc.),气体干燥吹扫装置和配套的集成谱图收集、数据处理软件Grams/Al以及基于此软件的PROTA软件。
实施例1 水溶液中环磷酸腺苷受体蛋白二级结构测定
1. 实验室纯化重组的环磷酸腺苷受体蛋白,蛋白浓度为3-4 mg/ml,缓冲液为20-30 mmol/L的磷酸盐缓冲溶液。空白为只含20-30 mmol/L的磷酸盐蛋白缓冲液。
2. 将环磷酸腺苷受体蛋白样品和空白样品涂在氟化钙晶片上,涂布的厚度为10μm,室温下自然挥发,待用。在传统方法中,用到厚度为6-10μm的聚丙烯薄膜,裁剪成晶片的形状,中间掏空,将薄膜放到两个晶片之间,固定好后,则在两个晶片之间形成了6-10μm的空隙用于上样。使用1ml 注射器将样品通过小孔注入到样品膜和晶片的空隙中,用于检测。
3. 傅里叶红外变换光谱在傅里叶变换红外光谱仪上测定,使用相应检测器,并不断用干燥空气吹扫。
4. 待吹扫完成后,收集空气峰。
5. 将空白样品放入样品池,收集红外谱图。
6. 将蛋白样品放入样品池,收集红外谱图。
7. 依次扣除空气和空白样品峰,在2000到1750cm-1内基线平直说明已经成功将水扣除。二阶导数图谱通过萨维斯—高莱求导而得。蛋白质中各二级结构组成含量通过倒转的二级衍生谱中1600-1700cm-1酰胺I带由曲线拟合得到。
图1 是实施例1实验结果示意图,并和传统注射上样法相比较,二者区别在误差范围内。
实施例2水溶液中细胞色素C二级结构测定
1. 公司购得纯度在99.9%以上的细胞色素C,将其溶在水中,终浓度为10-20mg/ml,离心待用。
2. 将细胞色素C样品和空白样品涂在氟化钙晶片上,涂布的厚度为40μm,室温下自然挥发,待用。在传统方法中,用到厚度为6-10μm的聚丙烯薄膜,裁剪成晶片的形状,中间掏空,将薄膜放到两个晶片之间,固定好后,则在两个晶片之间形成了6-10μm的空隙用于上样。使用1ml 注射器将样品通过小孔注入到样品膜和晶片的空隙中,用于检测。
3. 傅里叶红外变换光谱在傅里叶变换红外光谱仪上测定,使用相应检测器,并不断用干燥空气吹扫。
4. 待吹扫完成后,收集空气峰。
5. 将空白样品放入样品池,收集红外谱图。
6. 将蛋白样品放入样品池,收集红外谱图。
7. 依次扣除空气和空白样品峰,在2000到1750cm-1内基线平直说明已经成功将水扣除。二阶导数图谱通过萨维斯—高莱求导而得。蛋白质中各二级结构组成含量通过倒转的二级衍生谱中1600-1700cm-1酰胺I带由曲线拟合得到。
图2 是实施例2实验结果示意图,并和传统注射上样法相比较,二者区别在误差范围内。
实施例3水溶液中低浓度牛血清蛋白二级结构测定
1. 从公司购得纯度在99.9%以上的牛血清白蛋白,将其溶在水中,终浓度为0.5-1mg/ml,离心待用。
2. 将牛血清白蛋白样品和空白样品涂在氟化钙晶片上,涂布的厚度为25μm,室温下自然挥发,待用。
3. 傅里叶红外变换光谱在傅里叶变换红外光谱仪上测定,使用相应检测器,并不断用干燥空气吹扫。
4. 待吹扫完成后,收集空气峰。
5. 将空白样品放入样品池,收集红外谱图。
6. 将蛋白样品放入样品池,收集红外谱图。
7. 依次扣除空气和空白样品峰,在2000到1750cm-1内基线平直说明已经成功将水扣除。二阶导数图谱通过萨维斯—高莱求导而得。蛋白质中各二级结构组成含量通过倒转的二级衍生谱中1600-1700cm-1酰胺I带由曲线拟合得到。
图3 是实施例3实验结果示意图,0.5 mg牛血清白蛋白结构测定图。
- 还没有人留言评论。精彩留言会获得点赞!