一种用于肌氨酸的电化学检测方法与流程
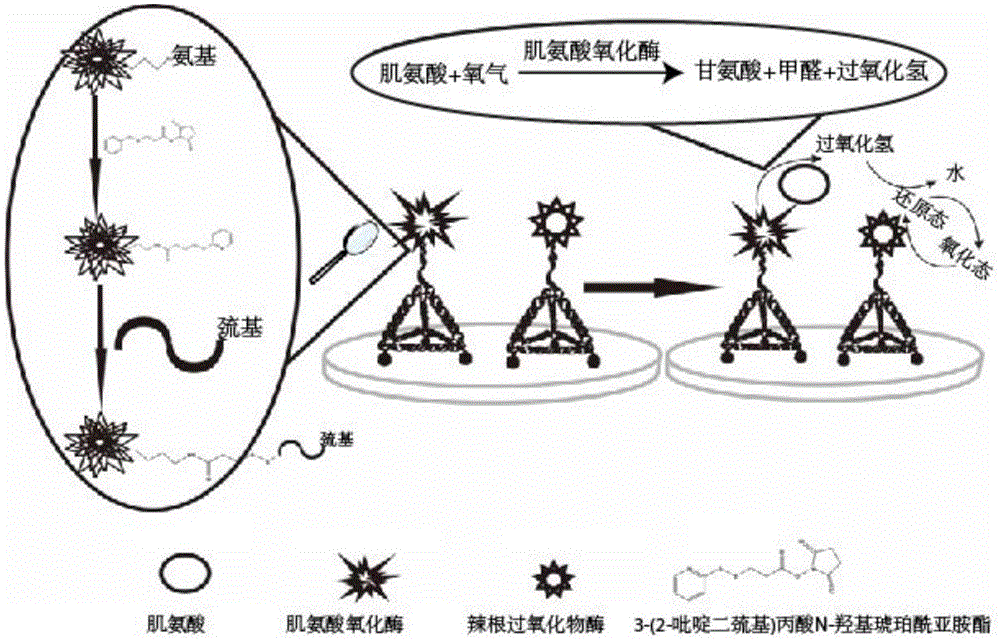
本发明涉及基因杂交和酶反应检测领域,更具体地涉及一种用于肌氨酸的电化学检测方法。
背景技术:
肌氨酸普遍存在于生物材料中,比如蛋黄、火鸡、火腿、蔬菜、豆制品等。肌氨酸味道偏甜、易溶于水,可以用来作为生物可降解的表面活性剂被用来生产肥皂、牙膏、洗发水、化妆品等,肌氨酸盐也可以抑制某些酶或者细菌的侵蚀,同样被广泛应用到表面修饰或者化妆品的合成中。诸如像化妆品等快销产品,产品配方中每种成分的含量配比等都会影响到产品的性能,因而对产品的所有成分含量的精准控制变得非常重要。肌氨酸作为该类产品中重要的组成部分,对其的精准检测也变得非常重要,有越来越多的化妆品专利被保护起来,这也就使得开发一种简单快速有效的检测手段变得非常有意义。
核酸作为一种天然的生物大分子,在纳米尺度上构建功能结构方面具有得天独厚的优势。首先,Watson-Crick碱基配对原则使得核酸序列之间的杂交可以预测;其次,核酸双螺旋结构特性明确,例如:B型DNA的直径和螺旋重复单位分别为大约2纳米和3.4纳米(大约10.5个碱基对)这使得即便是对于最为复杂的DNA纳米结构,构建模型也很简单;第三,核酸结构刚柔兼具。例如:双链DNA的刚性长度大约为50nm,通过双链DNA与相对柔性的单链DNA连接,我们就能得到特定设计的几何结构,并且不影响其稳定性;第四,现代有机化学和分子生物学的发展,允许我们对任意核酸序列进行合成、修饰和复制等;最后,核酸是一种生物相容性很好的材料,可以用与其他生物材料一起构建多组分纳米结构。
基于核酸的电化学生物传感器以其快速、灵敏、低成本及易微型化等优点在临床医药、食品检验、环境检测以及反恐等各个领域有着巨大的潜在用途。生物分子检测的灵敏度不仅仅和生物分子的亲和力有关还和传感器的界面性质有关(T.M.Squires,R.J.Messinger,S.R.Manalis,Nat.Biotechnol.2008,26,417-426)。决定电化学生物传感器性能的一个重要的方面就是分子识别界面。核酸纳米结构可以很好地吸附在电极表面,而每一个探针只和一个纳米结构连接,探针之间的空间和相互作用可以通过核酸纳米结构的大小来控制(M.H.Lin,J.J.Wang,G.B.Zhou,J.B.Wang,N.Wu,J.X.Lu,J.M.Gao,X.Q.Chen,J.Y.Shi,X.L.Zuo,C.H.Fan,Angew.Chem.Int.Ed.Engl,2015,54,2151-2155)。同时能够可控地将酶固定在电极表面,提高生物传感器的性能,最大程度地保持酶的活性使之更好地排列在电极的表面(Pei,H.,N.Lu,Y.L.Wen,S.P.Song,Y.Liu,H.Yan,and C.H.Fan,AdvancedMaterials,2010.22(42):4754-4758)。DNA折纸技术同样可以实现不同DNA结构,并且可以控制不同位置伸出DNA序列调控酶在DNA结构上的距离,更好地提高生物传感器的性能。
技术实现要素:
本发明旨在提供一种用于肌氨酸的电化学检测方法,结合酶反应的特异性和电化学检测的高灵敏度、低检测限,构建一种新型的利用酶级联反应和核酸纳米结构的电化学技术来检测前列腺癌靶标小分子肌氨酸的传感器。
本发明所述的用于肌氨酸的电化学检测方法,包括如下步骤:S1,利用物理吸附或者化学偶联的方法将肌氨酸氧化酶SOX和第一核酸序列连接,得到第一核酸序列修饰酶;将过氧化物酶Peroxidase和第二核酸序列连接,得到第二核酸序列修饰酶;S2,提供第一核酸纳米结构,其上伸出第一识别序列;提供第二核酸纳米结构,其上伸出第二识别序列;S3,第一核酸序列修饰酶与第一识别序列杂交,得到肌氨酸氧化酶SOX和核酸纳米结构的第一复合体,第二核酸序列修饰酶与第二识别序列杂交,得到过氧化物酶Peroxidase和核酸纳米结构的第二复合体;S4,将第一复合体和第二复合体组装到电化学装置的工作电极表面,利用第一复合体中的肌氨酸氧化酶SOX催化肌氨酸生成双氧水,利用第二复合体中的过氧化物酶Peroxidase催化酶催化底物TMB和双氧水的电化学反应,产生电流信号进行电化学检测。
所述步骤S1包括:S11,将3-(2-吡啶二巯基)丙酸N-羟基琥珀酰亚胺酯SPDP和肌氨酸氧化酶SOX、过氧化物酶Peroxidase进行连接,得到SPDP活化酶;S12,将SPDP活化酶和巯基核酸序列进行反应,得到核酸序列修饰酶,其中,巯基核酸序列是利用巯基对序列为SEQ ID NO:6或SEQ ID NO:7的核酸进行修饰的DNA链。
所述步骤S11中的SPDP活化酶通过超滤进行纯化,并通过紫外进行定量。
所述步骤S12中的SPDP活化酶和巯基核酸序列的摩尔比为1:1-1:50。
所述步骤S12中核酸序列修饰酶通过超滤进行纯化,并通过紫外进行定量。
所述步骤S2中的核酸纳米结构为一维、二维或三维的DNA纳米结构。
所述第一核酸纳米结构为四面体DNA纳米结构,其通过序列为SEQ ID NO:1、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5的四条单链DNA自组装形成;所述第二核酸纳米结构为四面体DNA纳米结构,其通过序列为SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5的四条单链DNA自组装形成。
所述步骤S4中的第一复合体和第二复合体的摩尔比为0.5:1-20:1。
所述步骤S4中的电化学装置的工作电极是由碳电极和金电极组成的平板电极,或由印刷碳电极和印刷金电极组成的薄膜印刷电极。
所述步骤S4中的电化学装置的电解槽中加入不含双氧水的酶催化底物TMB和待测肌氨酸样本。
根据本发明的电化学检测方法将结构核酸纳米技术、酶催化反应和电化学生物传感器相结合,实现了对肌氨酸小分子的定量检测。相对于现有的技术,本发明具有如下优点:检测采用的是酶级联反应和电化学结合的方法,检测的特异性高;检测线性范围宽,可以达到0.05uM-10mM;检测限低;采用多通道电化学仪进行检测,检测快速、通量大。
附图说明
图1是根据本发明的实施例1的电化学检测方法的原理图;
图2是根据本发明的实施例1的SPDP-HRP和巯基DNA L2(linker2)反应不同时间的紫外定量结果,从而说明反应时间对活化的酶和巯基DNA的连接效率有一定的影响;
图3是根据本发明的实施例1的SPDP-SOX和巯基DNA L1(linker1)反应不同时间的紫外定量结果,从而说明反应时间长可以在一定程度上改善连接效率,但是,无限制地通过延长反应时间来追求连接效率的提高会造成酶活性的下降;
图4是根据本发明的实施例1的巯基DNA L1和SPDP-SOX反应不同比例对两者连接效率的紫外定量表征;
图5是根据本发明的实施例1的巯基DNA L2和SPDP-HRP反应不同比例对两者连接效率的紫外定量表征;
图6示出根据本发明的实施例1,将连接好的L1-SOX和L2-HRP和DNA纳米结构以一定比例混合反应,AFM表征其连接效率,A)为巯基DNA连接的酶和DNA纳米结构(此处为DNA折纸)比例为1:1反应,B)为两者的比例为100:1进行反应的表征;
图7是根据本发明的实施例1的将两种酶连接四面体以1:1进行混合,然后取混合好的酶连四面体不同浓度组装到电极表面,检测5uM的肌氨酸所得到的电流值;
图8是根据本发明的实施例1的不同比例的SOX-DN1和Peroxidase-DN2所得到电化学信号的柱状图;
图9是根据本发明的实施例1的使用金棒电极检测不同浓度肌氨酸溶液的标准曲线,示出肌氨酸浓度与电化学电流信号的对应关系,其中,待测肌氨酸浓度依次分别为用pH7.4的PB配制的标准溶液,浓度为1μM、10μM、100μM、1mM的肌氨酸溶液;
图10是根据本发明的实施例2的使用Genfludics十六通道电化学装置检测不同肌氨酸溶液的标准曲线,示出肌氨酸浓度与电化学电流信号的对应关系,其中,待测肌氨酸浓度依次分别为用pH7.4的PB配制的标准溶液,浓度为0.05μM、0.1μM、0.5μM、1μM、5μM、10μM、100μM、1mM、10mM的肌氨酸溶液。
具体实施方式
下面结合附图,给出本发明的较佳实施例,并予以详细描述。
实施例1
试剂包括:
4条用于组装形成四面体DNA纳米结构探针的单链DNA:Tetra-A1(87bp,ssDNA)、Tetra-A2(85bp,ssDNA)、Tetra-B(55bp,5’端修饰巯基ssDNA)、Tetra-C(55bp,5’端修饰巯基ssDNA)、Tetra-D(55bp,5’端修饰巯基ssDNA),均购于上海生工生物工程有限公司。
Tetra-A1(SEQ ID NO:1):
5’-ACATTCCTAAGTCTGAAACATTACAGCTTGCTACACGAGAAGAGCCGCCATAGTAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAAA-3’
Tetra-A2(SEQ ID NO:2):
5’-ACATTCCTAAGTCTGAAACATTACAGCTTGCTACACGAGAAGAGCCGCCATAGTAAAAAAAAAAAAACCACCACCACCACCACCA-3’
Tetra-B(SEQ ID NO:3):
5'-HS-C6-TATCACCAGGCAGTTGACAGTGTAGCAAGCTGTAATAGATGCGAGGGTCCAATAC-3
Tetra-C(SEQ ID NO:4):
5'-HS-C6-TCAACTGCCTGGTGATAAAACGACACTACGTGGGAATCTACTATGGCGGCTCTTC-3'
Tetra-D(SEQ ID NO:5):
5'-HS-C6-TTCAGACTTAGGAATGTGCTTCCCACGTAGTGTCGTTTGTATTGGACCCTCGCAT-3
其中,
Tetra-A1链上22bp的识别序列:
5’-AAAAAAAAAAAAAAAAAAAAAA-3’
Tetra-A2链上20bp的识别序列:
5’-AACCACCACCACCACCACCA-3’
肌氨酸氧化酶SOX和过氧化物酶Peroxidase均购自sigma公司。
用于修饰酶的核酸序列:
Linker1序列(SEQ ID NO:6):
5’-TTTTTTTTTTTTTTTTTTTTTT-3’(22bp,ssDNA)
Linker2序列(SEQ ID NO:7):
5’-TTGGTGGTGGTGGTGGTGGT-3’(20bp,ssDNA)
四甲基联苯胺TMB采用是Thermo scientific的用于ELISA的不含有双氧水的TMB溶液。将肌氨酸配成不同的浓度,用于检测。肌氨酸购买于sigma公司。
根据本发明的电化学检测方法包括如下步骤:
S1,将3-(2-吡啶二巯基)丙酸N-羟基琥珀酰亚胺酯SPDP和酶进行连接,得到SPDP活化酶。
分别取20μL的200μM的肌氨酸氧化酶SOX和辣根过氧化物酶HRP,20μL的4mM的SPDP溶液溶于二甲基亚砜DMSO中,5*(5*意为5乘,可以从试剂公司直接购买,使用的时候一般均为1*。)PBS 20μL,H2O 40μL放于eppendorf的震荡仪上25℃、300rpm反应2h。将反应后的酶加入200μL的1*PBS于30kD的超滤管中6000rpm超滤15分钟,并用1*PBS重悬于30kD的超滤管中6000rpm超滤15分钟,重复该操作2次。再将超滤管倒置3000rpm超滤10分钟,回收,紫外定量。
S2,将SPDP活化酶(SPDP-酶)和巯基核酸序列(SH-DNA)进行反应,得到核酸序列修饰酶(SPDP-酶-DNA-SH)。
将用于修饰酶的核酸序列linker1,linker2进行巯基修饰得到巯基核酸序列linker1,linker2。紫外定量好的SPDP活化酶(SPDP-SOX或SPDP-HRP)中加入10倍的巯基核酸序列linker1(或巯基核酸序列linker2),得到SPDP-SOX-DNA linker1-SH(简写为SOX-linker1),或者SPDP-HRP-DNA-linker2-SH(简写为HRP-linker2)。反应前测一下其在343nm处的紫外吸收,放置于eppendorf的震荡仪25℃、300rpm反应0.5h-32h,见图2和图3。巯基核酸序列和SPDP活化酶反应的比例分别从1:1到50:1,不同比例对SPDP活化酶和巯基核酸序列的连接效率的关系见图4和图5。测一下343nm的紫外吸收,利用反应前后的343nm处吸光度的差值计算每个酶分子上连接的巯基核酸序列的数量。再将反应后的酶溶液采用步骤S1同样的方法超滤、纯化、定量。
S3,合成四面体DNA(TDN)纳米结构。
取等量的Tetra-A1(或Tetra-A2)、B、C、D四条单链DNA,用TM buffer(20mMTris,50mMMgCl2,pH8.0)稀释,使其终浓度为1uM,体积50μL,得到四面体DNA(TDN1或TDN2)。95℃10min后,再于4℃放置待用。
S4,合成酶和四面体DNA纳米结构的复合体。
取合成好的TDN1(S3的产物),和TDN2(S3的产物),分别和定量好的SOX-linker1(S2的产物)、HRP-linker2(S2的产物)杂交,加入SOX-linker1和HRP-linker2的量是TDN1和TDN2的3倍。反应之后就可以成功的将SOX和HRP连接到TDN1、TDN2上并将其固定在工作电极上,具体参考示意图1。
当然也可以采用其他的DNA纳米结构和酶巯基DNA连接物进行连接,如图6,探索了不同比例的酶巯基DNA连接物和DNA折纸不同比例的连接效率。图中DNA折纸上相距50nm的距离处伸出可以和酶连接的巯基DNA进行杂交的DNA单链,通过控制加入的酶巯基DNA的复合物和DNA折纸的比例从1:1到100:1,可以看出,加入的酶DNA复合物的量越多,连接效率越高。当然此处是以DNA折纸为实施例,通过原子力显微镜更加直观的表征了不同比例对DNA纳米结构和酶连接效率的影响。该比例会随着设计的DNA纳米结构的不同而有所改变。
S5,清洗打磨电极并组装。
取直径为2mm的金电极,先用0.3μm和0.05μm的氧化铝粉依次打磨,然后用乙醇和水各超声2min,在0.5M硫酸中测定其伏安曲线,最后用超纯水冲洗然后用氮气吹干,备用。
实验中调节加入两种酶的比例,探究其对检测的影响。见图8,从两种酶比例和相应检测电流值可以看出,当两种酶的比例为1:1时,检测电流最大,对检测最有利,故选择两种酶的比例为1:1作为最优化的配比。将两种酶四面体复合物按照1:1的比例混合,DNA纳米结构和酶复合物的终浓度从0.5uM到10uM不等,见图7。不同的浓度对检测效果有一定的影响,对于DNA四面体结构而言,1uM基本达到饱和,故而经常采用1uM作为最终的组合组装浓度。取3μL混合好的溶液滴加在电极上,室温下组装过夜(12h)。
S6,检测。
检测体系中加入800μL的TMB、100μL的pH7.4PB buffer、100μL的待测肌氨酸的溶液,该检测体系的上述配比对实验结果非常重要,因为TMB在中性或碱性中溶解度小,过碱容易析出,过酸对两种酶的活性不利。检测采用三电极系统,金电极为工作电极,铂电极为对电极,银/氯化银电极为参比电极。使用CHI电化学分析仪(CHI630b)检测。扫描循环伏安图和时间电流曲线,其中循环伏安法,起始电压0V,最高电压+0.7V,最低电压0V,扫速0.1V/s。时间电流曲线,电压+0.15V,时间100s。图9示出利用上海辰华仪器使用金棒电极检测不同浓度肌氨酸溶液的标准曲线,利用此曲线,根据本发明的基于四面体DNA纳米探针利用酶级联反应的实验可实现对溶液中肌氨酸的定量分析。
实施例2
步骤S1-S4与实施例1相同。
S5,清洗十六通道的金芯片电极。
十六通道的金芯片电极购买于Genfludics,放入到有异丙醇的烧杯中浸泡1分钟,然后用二次去离子水冲洗,并超声10秒。然后吹干,将围栏固定在金芯片电极上,待用。
S6,检测。
三个电极为一组,取124.8μL的TMB、15.6μL的待测肌氨酸溶于pH7.4的PB缓冲液,混合均匀,每个电极上滴加50μL的检测液。检测使用的是Genfludics的十六通道电化学装置进行检测,其中,循环伏安法采用的电位是负电位-250mV,正电位是+400mV。时间电流曲线,电压为-200mV,时间为60秒。如图10所示,为体系中肌氨酸的标准曲线的建立,检测限可以达到0.05uM,线性范围是0.05uM-10mM。
该体系不仅仅可以应用于上海辰华的三电极体系(工作电极为金电极),还可以应用于十六通道芯片电极的检测,实现高通量、低样本量、快速灵敏的检测。
以上所述的,仅为本发明的较佳实施例,并非用以限定本发明的范围,本发明的上述实施例还可以做出各种变化。即凡是依据本发明申请的权利要求书及说明书内容所作的简单、等效变化与修饰,皆落入本发明专利的权利要求保护范围。本发明未详尽描述的均为常规技术内容。
序列表
<110> 中国科学院上海应用物理研究所
<120> 一种用于肌氨酸的电化学检测方法
<160> 7
<210> 1
<211> 87
<212> DNA
<213> 未知
<220>
<223> 购自大连Takara生物有限公司
<400> 1
acattcctaa gtctgaaaca ttacagcttg ctacacgaga agagccgcca tagtaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaa 87
<210> 2
<211> 85
<212> DNA
<213> 未知
<220>
<223> 购自大连Takara生物有限公司
<400> 2
acattcctaa gtctgaaaca ttacagcttg ctacacgaga agagccgcca tagtaaaaaa 60
aaaaaaacca ccaccaccac cacca 85
<210> 3
<211> 55
<212> DNA
<213> 未知
<220>
<221> misc_binding
<222> (1)
<223> 5’端修饰巯基,购自大连Takara生物有限公司
<400> 3
tatcaccagg cagttgacag tgtagcaagc tgtaatagat gcgagggtcc aatac 55
<210> 4
<211> 55
<212> DNA
<213> 未知
<220>
<221> misc_binding
<222> (1)
<223> 5’端修饰巯基,购自大连Takara生物有限公司
<400> 4
tcaactgcct ggtgataaaa cgacactacg tgggaatcta ctatggcggc tcttc 55
<210> 5
<211> 55
<212> DNA
<213> 未知
<220>
<221> misc_binding
<222> (1)
<223> 5’端修饰巯基,购自大连Takara生物有限公司
<400> 5
ttcagactta ggaatgtgct tcccacgtag tgtcgtttgt attggaccct cgcat 55
<210> 6
<211> 22
<212> DNA
<213> 未知
<220>
<223> 购自大连Takara生物有限公司
<400> 6
tttttttttt tttttttttt tt 22
<210> 7
<211> 20
<212> DNA
<213> 未知
<220>
<223> 购自大连Takara生物有限公司
<400> 7
ttggtggtgg tggtggtggt 22
- 还没有人留言评论。精彩留言会获得点赞!