SUSD2在制备高级别浆液性卵巢癌诊断和/或预后判断的试剂盒中的应用的制作方法
本发明涉及生物医学技术领域,具体涉及SUSD2在制备高级别浆液性卵巢癌诊断和/或预后判断的试剂盒中的应用。
背景技术:
卵巢癌是妇科常见恶性肿瘤,病死率位居妇科恶性肿瘤之首,是妇产科临床面临的最大挑战。虽然肿瘤细胞减灭术和铂类紫杉类联合化疗使患者5年生存率有所改善,但半个世纪以来卵巢癌临床诊治并无实质性进展。这主要由于缺乏临床实用的早期诊断手段和疗效持久的治疗方案,其根本原因在于对卵巢癌的早期诊断、发生发展、预后等的分子机制认识不清。
高级别浆液性卵巢癌(HGSOC)是卵巢癌患者死亡的主要原因,所占比例较大,且死亡率居高不下。HGSOC预后很差,长期存活率低于20%。复发和远处转移是术后治疗失败的主要原因。目前临床实践中,临床病理分期是最重要、最可靠的预后指标,但是仍然需要更精确的标志物进一步将术后病人划分为高风险和低风险,进而采取更有效的治疗方法。
肿瘤的发生是多因素、多基因异常所致的复杂过程,在病灶发生形态学变化之前,可能已经存在着许多分子生物学的改变。用分子水平异常作为卵巢癌的肿瘤标志物能更恰当地反映肿瘤生物学行为的异质性,进而为卵巢癌的早期诊断和预后判断提供更有价值的指导。
目前发现的卵巢癌重要改变的分子标志物主要集中在核酸与蛋白方面,前者包括细胞遗传学改变、基因的扩增、缺失、突变、断裂与融合、mRNA及miRNA等,后者表现为蛋白表达水平、大小、亚细胞定位及蛋白翻译后修饰等改变。由于蛋白质是基因表达的最终产物,也是基因功能的执行者,蛋白质间的相互作用、相互协调是细胞进行一切代谢活动的基础,因此关注卵巢癌发生发展中蛋白水平的改变,寻找对卵巢癌进行早期诊断和预后判断的分子标志物显得尤为重要。
SUSD2是单通道1型膜蛋白,常表达于骨髓间充质干细胞,血管周围平滑肌细胞,以及许多肿瘤细胞系。之前的研究表明,在许多肿瘤中(例如,肝癌,肺癌等),SUSD2表达低,过表达SUSD2可抑制肿瘤细胞的转移和增殖。但在乳腺癌中,SUSD2相比于乳腺良性肿瘤表达增加,并且过表达后可促进乳腺癌细胞的转移,诱导T细胞凋亡。由此可见,在不同的肿瘤组织中,SUSD2的表达与肿瘤发生及进展的相关性是存在较大差异的。因此,研究SUSD2在卵巢癌发生、发展过程中表达量的变化,对于卵巢癌的早期诊断和预后判断具有十分重要的意义。
技术实现要素:
针对上述现有技术,本发明的目的在于研究SUSD2在高级别浆液性卵巢癌中的表达情况,并分析其与高级别浆液性卵巢癌临床病理参数和生物学行为的关系,进而发现SUSD2在高级别浆液性卵巢癌发生、发展、转移过程中所起的作用。
为实现上述目的,本发明采用如下技术方案:
本发明首先比较了SUSD2在输卵管伞和高级别浆液性卵巢癌中的表达,发现SUSD2在输卵管伞中低表达,在高级别浆液性卵巢癌中高表达,差异具有统计学意义。
本发明还比较了高级别浆液性卵巢癌患者的无进展生存期、总生存期、淋巴结转移、腹膜转移情况,结果发现SUSD2高表达患者的预后越差。
综合上述研究结果,本发明的第一方面,提供SUSD2作为高级别浆液性卵巢癌诊断和/或预后判断的标志物的应用。
通过测定上述标志物的表达量,可以进行高级别浆液性卵巢癌诊断和/或预后判断,包括:高级别浆液性卵巢癌或卵巢癌组织转移的鉴别诊断和/或易感性分析,高级别浆液性卵巢癌治疗药物、治疗方法、治疗疗效及预后的评估,相关人群高级别浆液性卵巢癌或卵巢癌组织转移患病风险的评估等。
测定上述标志物的表达量需要使用检测试剂、试剂盒或检测芯片等,因此,本发明进一步研究了上述标志物的检测试剂、试剂盒和检测芯片,以用于高级别浆液性卵巢癌诊断和/或预后。
检测蛋白表达的方法有多种,包括但不限于酶联免疫吸附测定(ELISA),例如竞争性ELISA、双抗夹心ELISA、免疫印迹、ELISA和免疫印迹的组合等。根据上述检测方法,能够检测SUSD2的试剂都可以制成卵巢癌诊断和预后判断的试剂盒。本发明的第二方面,提供一种SUSD2的检测方法,步骤如下:
将输卵管伞和高级别浆液性卵巢癌的蜡块制作成组织芯片(TMA),进行免疫组织化学染色、显微镜和成像设备扫描为电子图片,阅片并进行统计分析。
具体检测方法如下:
将TMA组织切片经脱蜡至水、抗原修复、灭活内源性过氧化物酶和山羊血清封闭后,分别与一抗SUSD2在保湿盒内4℃孵育过夜,随后经PBS洗后分别与二抗(生物素标记的羊抗鼠/兔IgG)、辣根过氧化酶酶标签孵育,DAB显色,苏木素复染;最后经酒精脱水和二甲苯透明后用中性树胶封片,利用显微镜和成像设备扫描为数码照片,并对每张免疫组化染色切片进行评分。
对每张TMA的评分包括两部分,染色强度和染色面积,染色强度从低到高依次未为阴性(-),弱阳性(+),阳性(++),强阳性(+++),染色面积用百分率表示,即0%-100%。染色面积0%-10%记为0,11%-20%记为1,21%-50%记为2,51%-100%记为3,最终每个点的免疫组化得分为染色强度*染色面积。
SUSD2的免疫组化评分以6为cut-off值,小于6为阴性或弱阳性,大于等于6为阳性或强阳性。
预后判断或风险预测的判断方法为,SUSD2蛋白表达阳性,则卵巢癌患者生存期短;SUSD2蛋白表达阴性,则卵巢癌患者生存期长。
本发明的第三方面,提供检测SUSD2的试剂在制备高级别浆液性卵巢癌诊断和/或预后判断的试剂盒中的应用。
优选的,所述检测SUSD2的试剂为SUSD2抗体。
进一步的,所述试剂中还包含:山羊血清、0.01M柠檬酸盐抗原修复液、3%H2O2、DAB显色试剂和PBS溶液。
本发明的第四方面,提供抑制SUSD2蛋白表达的试剂在制备改善高级别浆液性卵巢癌预后的药物中的用途。
本发明的有益效果:
本发明首次研究发现SUSD2在输卵管伞中表达是下调的,但在高级别浆液性卵巢癌中的表达是上调的,且SUSD2的表达与卵巢癌患者的预后紧密相关。本发明以SUSD2作为标志物,通过免疫组织化学的方法诊断高级别浆液性卵巢癌,并判断高级别浆液性卵巢癌的预后。SUSD2高级别浆液性卵巢癌中高表达,而在正常输卵管伞中低表达。SUSD2在高级别浆液性卵巢癌中的表达水平和病人的存活率有关,SUSD2表达高的患者预后不好,存活率低。根据SUSD2的表达情况与高级别浆液性卵巢癌预后之间的关系,可以对卵巢癌进行诊断和预后的判断,以及开发能够改善高级别浆液性卵巢癌的药物,具有十分广泛的应用前景。
附图说明
图1:SUSD2表达情况与卵巢高级别浆乳癌生存曲线(无进展生存期);
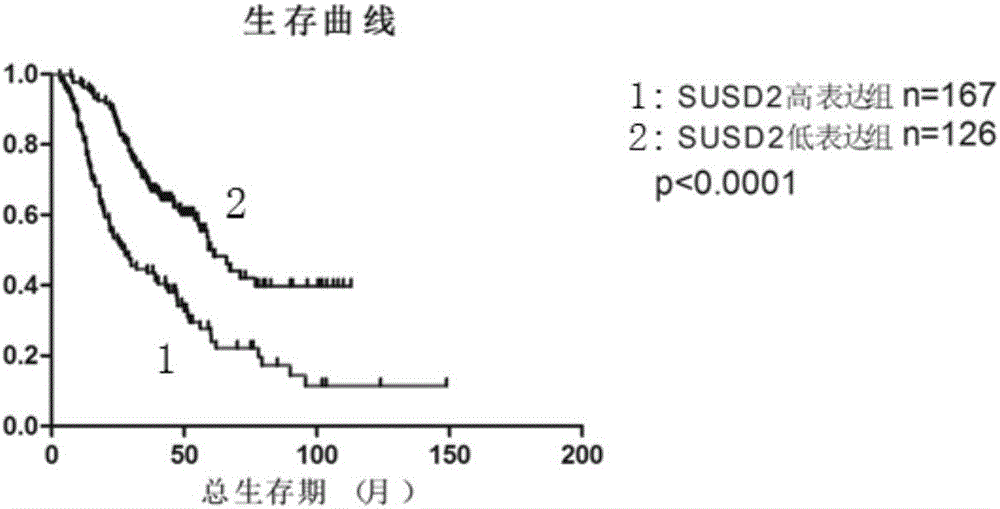
图2:SUSD2表达情况与卵巢高级别浆乳癌生存曲线(总生存期);
图3:在淋巴结转移阳性恶性肿瘤检测结果;
图4:在淋巴结转移阴性肿瘤检测结果。
具体实施方式
结合实施例对本发明作进一步的说明,应该说明的是,下述实施例说明仅是为了解释本发明,并不对其内容进行限定。本发明实施例中未注明具体条件的实验方法,均为常规的试验方法。
实施例1:
1.试验方法:
我们收集了2007-2013年55例输卵管伞和306例高级别浆液性卵巢癌患者的手术标本存档蜡块。利用半自动组织芯片打孔机制作成3个TMA组织芯片,保证免疫组织化学大样本、高通量、标准化。每个蜡块均包含输卵管伞和高级别浆液性卵巢癌。
组织芯片(TMA)技术是将数十至数百个甚至更多的组织样本整齐的排列在一张载玻片上而制成的缩微阵列组织片。通过免疫组化、原位杂交显色等,在组织切片上实现了高通量获取基于形态学的基因组学和蛋白质组学的表达信息。组织芯片技术已经在肿瘤研究中广泛应用,用于研究肿瘤不同发展阶段的基因及蛋白质变化情况、预后的评价及分子标志物的评价、信号通路研究等。组织芯片具有大样本、高通量、标准化等优点,是实现蛋白质分子网络与临床信息的集成的关键技术。本实施例采用的是TMA组织芯片,每张芯片上面有将近200个点,可以同时进行免疫组化检测其表达情况。
标本经连续切片、二甲苯脱蜡、梯度酒精水化后,用超敏型二步法检测目的蛋白的表达,具体方法如下:
(1)TMA切片经过65℃烤片,二甲脱蜡、梯度酒精水化;其中,脱蜡、水化的具体步骤为:
①组织切片置于二甲苯I中浸泡10分钟,②组织切片置于二甲苯II浸泡10分钟,③组织切片置于无水乙醇中I浸泡10分钟,④组织切片置于无水乙醇II浸泡10分钟,⑤组织切片置于95%乙醇中浸泡10分钟,⑥组织切片置于80%乙醇中浸泡10分钟,⑦组织切片置于75%乙醇中浸泡10分钟,⑧组织切片置于蒸馏水中浸泡5分钟。
(2)切片经0.01M柠檬酸盐抗原修复液(Citrate Buffer(pH 6.0))抗原修复、3%H2O2灭活内源性过氧化物酶、封闭。具体步骤为:
将0.01M柠檬酸盐抗原修复液通过微波炉加热5分钟,放入组织切片高火加热15秒,冷却30,反复加热-冷却15个循环,在室温下冷却;
用1*PBS洗处理过的组织切片3次,每次五分钟。
将3%双氧水溶液滴加在载玻片上,37度静置15分钟,甩去多余液体。
用1*PBS洗3次,各五分钟。
滴加封闭液(正常山羊血清,5%BSA溶液),在37度孵育30分钟,甩去多余液体。
(3)滴加SUSD2一抗(1∶100)50μL,室温静置2小时。
(4)1*PBS缓冲液洗3次,每次5分钟。
(5)滴加二抗(生物素标记的羊抗鼠/兔IgG)(1∶100)50μL,室温静置20分钟。
(6)1*PBS缓冲液洗3次,每次5分钟。
(7)滴加辣根过氧化物酶50μL,室温静置15分钟。
(8)1*PBS缓冲液洗4次,每次5分钟。
(9)DAB显色,在显微镜下掌握染色程度,在达到满意效果后放入清水中终止染色,后用自来水冲洗10分钟。
(10)苏木精复染5分钟,自来水冲洗10分钟。
(11)5%盐酸酒精脱色5秒,氨水反蓝15秒,自来水冲洗10分钟。
(12)脱水、透明,具体步骤如下:①组织切片置于80%乙醇中浸泡3分钟,②95%乙醇中浸泡3分钟,③无水乙醇中II浸泡5分钟,④无水乙醇I浸泡5分钟,⑤二甲苯II中浸泡10分钟,⑥二甲苯I浸泡10分钟。
(13)树脂封片、镜检。
所有的免疫染色切片经2位病理医师采用盲法独立评分。肿瘤细胞浆中出现棕黄色颗粒被认为是阳性信号。染色强度分4级:0,阴性;1,弱阳性;2,阳性;3,强阳性;阳性细胞百分数分4个等级:0,0~10%;1,11~20%;2:21~50%;3,51-100%。每个标本的总分数是由肿瘤细胞染色强度和肿瘤细胞阳性百分数两部分的乘积得出的,范围是0~9。为了方便统计,我们把免疫组织化学染色分为低表达(即标本的组化染色总分数小于3)和高表达(即标本的组化染色总分数大于或等于3)2个组。
2.试验结果:
(1)SUSD2在输卵管伞和高级别浆液性卵巢癌中的表达情况:
结果见表1。
表1:SUSD2在输卵管伞和高级别浆液性卵巢癌中的表达情况
对照组VS肿瘤组(χ2=22.725,p<0.001)。
结果表明卵巢高级别浆乳癌,SUSD2表达量明显增强。
(2)SUSD2在高级别浆液性卵巢癌中的表达与临床特征的关系
结果见表2。
表2:SUSD2在高级别浆液性卵巢癌中的表达与临床特征的关系
无进展生存期,大于两年VS小于等于两年(χ2=15.045,p<0.001);总生存期,大于两年VS小于两年(χ2=33.457,p<0.001));淋巴结转移,转移组VS未转移组(χ2=4.546,p<0.05);腹膜转移,转移组VS为转移组(χ2=10.973,p<0.005)。
结果表明,在高级别浆液性卵巢癌中,SUSD2高表达组预后差。
(3)SUSD2表达情况与高级别浆液性卵巢癌生存曲线分析
结果分别见图1和图2。由图可以看出:SUSD2在高级别浆液性卵巢癌中的表达情况与卵巢癌患者的无进展生存期和总生存期相关;高表达组中(中位无进展生存期15个月,中位总生存期27.55个月);低表达组(中位无进展生存期28.08个月,中位总生存期61个月)。
综上,SUSD2可以用来作为高级别浆液性卵巢癌的诊断和预后评价指标,尤其能评价患者术后的存活情况,为临床医师的治疗提供建议和参考。
实施例2:
采用本发明实施例1的方法对蜡块标本组织进行检测,镜检结果分别如图3和图4所示。其中,图3所示的组织切块中SUSD2的表达程度较高,细胞膜上有明显棕黄色颗粒,为SUSD2检测阳性结果,后经病理检测结果为高级别浆液性卵巢癌。
图4所示的组织切片中SUSD2的表达程度较低,无明显棕黄色颗粒,为SUSD2检测阴性结果,后经病理检测结果为淋巴结转移阴性。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!