用于高正电荷蛋白的免疫测定法的制作方法
本发明涉及用于评估抗体对fgf-18蛋白的亲和性以及用于确定人滑液样本中fgf-18蛋白的量的免疫测定法。
背景技术:
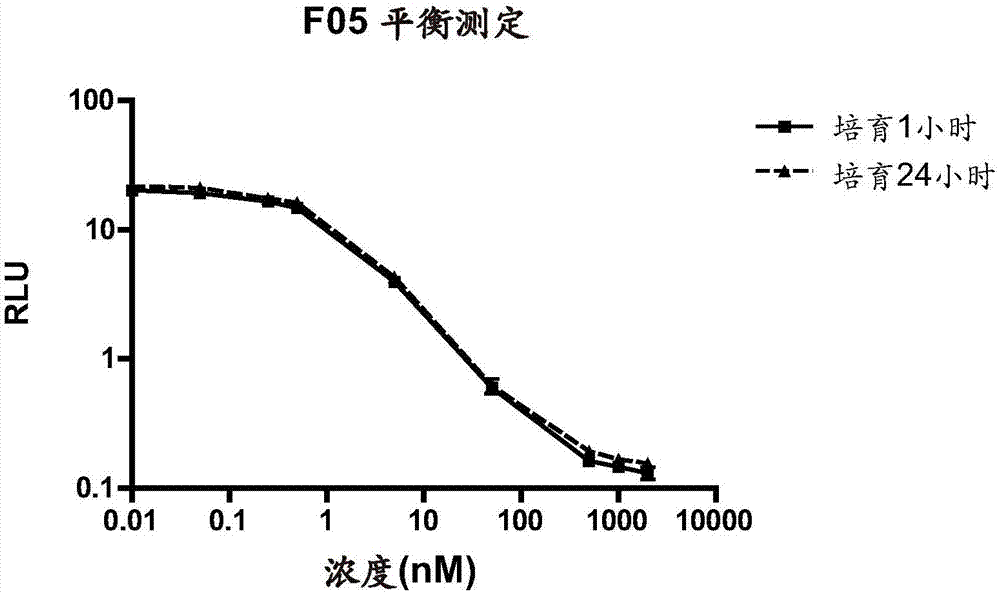
:免疫测定法是利用抗体在复合混合物(例如生物基质)中特异性结合分子的能力的生化测试。该能力可用于检测或定量所识别的分子,即所谓的分析物,或反之亦然,即抗原可用于捕获并允许定量特异性抗体。结合事件与可测量信号的产生相关联,所述可测量信号通常与已知浓度的参考样本产生的信号进行比较。最早的免疫测定法均基于用放射性碘来标记抗体(radioimmunoassays,ria)。在60年代首次进行了基于酶的免疫测定法(enzymeimmunoassayseia或enzymelinkedimmunosorbentassay,elisa)的实验,在这些年中,这种免疫测定法已经成为最常用的免疫测定法。现在有几种可以使用的标记,从酶到荧光探针、dna等。此外,还可以使用未标记的试剂。目前有不同的免疫测定技术可供使用,例如alphalisa技术、gyrolab技术和imperacer技术。gyrolab免疫测定平台是一种基于微流体的自动化系统,由液体处理系统、荧光检测系统和光盘(cd)微实验室组成。免疫测定在嵌入在微结构中的亲和捕获柱上进行。有不同类型的cd,其允许处理不同的分析物体积,以便在动态范围、灵敏度和测定类型方面具有不同的性能。在一片cd中有12到14个区段,每个区段由8个微结构组成。每个微结构包含纳米流体的复杂系统,其允许试剂、洗涤缓冲液和分析物通过,其末端是预先用链霉亲和素珠填充的亲和柱。通过使用cd旋转产生的离心力进行免疫测定:公用试剂由液体处理系统分配在公用通道中(每个区段一个),而样本从独立入口注入,以避免交叉污染。cd的慢速旋转允许通过使用溢出通道除去额外体积来进行体积限定:疏水屏障防止流体流向所述柱。在体积限定之后,cd的快速旋转使得疏水屏障破裂,从而液体可以流过所述柱。第一试剂必须用生物素标记,以便与链霉亲和素珠结合。在免疫测定的尾声(例如,夹心免疫测定中的第二抗体),加入用荧光探针标记的试剂。工作站内的激光能够激发荧光团,然后读取荧光响应。在添加试剂的不同步骤之间有几个洗涤步骤,以提高免疫测定的特异性。仪器具有预先确定的方案,但是许多参数(洗涤缓冲液的组成、洗涤步骤的数量、cd旋转的时间)是可以改变的,以优化方法以获得最佳结果。可以设置不同的免疫测定方式(夹心、直接、间接、竞争和桥接)。唯一的要求是提供生物素化的试剂和荧光探针标记的试剂。技术实现要素:本发明的一个方面提供一种预处理用于免疫测定的人滑液样本的方法,包括:-向所述人滑液样本添加透明质酸酶溶液,-在室温(rt)下培育所述样本,-离心所述人滑液样本。本发明的另一个方面提供一种用于确定人滑液样本中的高正电荷蛋白的量的方法,包括以下步骤:a)预处理所述人滑液样本,所述预处理步骤包括:-向所述人滑液样本添加透明质酸酶溶液,-在室温(rt)下培育所述样本,-离心所述人滑液样本,b)用缓冲液稀释已预处理的所述人滑液样本,c)将针对所述高正电荷蛋白的生物素化抗体固定到柱上,d)用标准洗涤缓冲液洗涤所述柱以除去未结合的抗体,e)在所述柱中,在所述抗体与所述高正电荷蛋白特异结合的条件下,使已预处理及已稀释的所述人滑液样本与已固定的所述生物素化抗体接触,以产生抗体-蛋白复合物,f)用标准洗涤缓冲液洗涤所述柱复合物,g)向所述柱中的所述抗体-蛋白复合物添加带有荧光染料标记的对所述高正电荷蛋白特异的抗体,以产生可测量的响应,并用标准洗涤缓冲液洗涤所述柱,h)测量所产生的响应,i)通过比较所述样本产生的响应与校准标准产生的响应来确定所述样本中高正电荷蛋白的量。本发明的另一个方面提供一种用于自动化地确定人滑液样本中的高正电荷蛋白的量的方法,包括以下步骤:a)预处理所述人滑液样本,所述预处理步骤包括:-向所述人滑液样本添加透明质酸酶溶液,-在室温(rt)下培育所述样本,-离心所述人滑液样本,b)用缓冲液稀释已预处理的所述人滑液样本,c)将针对所述高正电荷蛋白的生物素化抗体固定到柱上,d)用标准洗涤缓冲液洗涤所述柱以除去未结合的抗体,e)提供注射装置,所述注射装置用于将已预处理及已稀释的所述人滑液样本自动化地转移到所述柱中,f)在将已预处理及已稀释的所述人滑液样本转移到所述柱中之前,用高离子力缓冲液洗涤所述注射装置,g)将已预处理及已稀释的所述人滑液样本转移到所述柱中,从而在所述抗体与所述高正电荷蛋白特异结合的条件下,使已预处理及已稀释的所述人滑液样本与已固定的所述生物素化抗体接触,以产生抗体-蛋白复合物,h)在步骤g)之后,用高离子力缓冲液洗涤所述注射装置,i)用标准洗涤缓冲液洗涤所述柱,j)向所述柱中的所述抗体-蛋白复合物添加带有荧光染料标记的对所述高正电荷蛋白特异的抗体,以产生可测量的响应,并用标准洗涤缓冲液洗涤所述柱,k)测量所产生的响应,l)通过比较所述样本产生的响应与校准标准产生的响应来确定所述样本中所述高正电荷蛋白的量。附图说明图1示出了磺基-nhs-lc-生物素与伯胺的反应。注意nhs是反应中的离去基团(副产物)。离去基团和任何未反应的生物素试剂在脱盐步骤中除去。图2示出了分析物的对数浓度对与alexa-647标记的f05一起培育后获得的rlu的曲线图。三次重复的平均结果,误差棒显示sem。图3示出了分析物的对数浓度对与alexa-647标记的f44一起培育后获得的rlu的曲线图。三次重复的平均结果,误差棒显示sem。图4示出了4次独立实验中分析物的对数浓度对与alexa-647标记的mabf05一起培育后获得的平均rlu的曲线图。三次重复的平均结果。图5示出了4次独立实验中分析物的对数浓度对与alexa-647标记的f44一起培育后获得的平均rlu的曲线图。三次重复的平均结果。图6示出了f44和f05之间的结合差异的分析。(a)clips不连续矩阵数据集中所有~4000个肽的散点图。对于每个肽,将f05和f44获得的elisa值绘制为xy散点。红线:45°参考。绿线:loess仿样拟合。一个数据点被着色为品红色,以在图a-c中对其进行跟踪。(b)图中所得并进行了loess归一化的数据。(c)图b的ma-图。对高于或低于0.5和-0.5的数据点进行评分和着色。(d)图c中评分的肽的频率表。蓝线表示与f44的结合较强。黄线表示与f05的结合较强。图7可视化地示出了同系蛋白质的结构上的结合区域。21-27为绿色。7-21为黄色。153-164为蓝色。图8示出了分析物的对数浓度对与平均rlu的曲线图。三次重复的平均结果,误差棒显示sem。图9示出的直方图表示各种mrd的加料样本(ss)和滑液空白样品(sf)的bcc的结果。3次重复的平均结果,误差棒表示sem。图10示出的直方图表示在rexxiphn中配制的三个浓度水平(qc-低=30微克/毫升,qc-媒介=500皮克/毫升,qc-高=15000皮克/毫升)的qc样本进行(处理)或未进行(未处理)透明质酸酶消化的平均rlu的结果。3次重复的平均结果,误差棒表示sem。具体实施方式本文提及的所有出版物、专利申请、专利和其它参考文献通过引用整体并入本文。提供本文所讨论的出版物和申请的原因仅仅是它们在本申请的申请日之前已公开。本文中的任何内容都不得解释为承认本发明不具有通过在先发明而获得的优先权。另外,材料、方法和实施例仅是说明性的,而不是限制性的。在冲突的情况下,以本说明书(包括定义)为准。除非另有定义,本文使用的所有技术和科学术语具有与本文主题所属
技术领域:
的技术人员通常理解的含义相同的含义。如本文所使用的,提供以下定义以便于理解本发明。“包括”一词通常表示包含,也就是说允许存在一个或多个特征或组分。本说明书和权利要求书中所使用的单数形式“一”,“一个”和“该”包括复数,除非上下文另有明确说明。本文所用的术语“fgf-18化合物”、“fgf-18蛋白”或“fgf-18”是指保持人fgf-18蛋白的至少一种生物活性的蛋白。fgf-18可以是天然的、其成熟形式、重组形式或截短形式。人fgf-18蛋白的生物活性主要包括软骨细胞或成骨细胞增殖的增加(参见wo98/16644)或软骨形成(参见wo2008/023063)的增加。天然或野生型人fgf-18是由关节软骨的软骨细胞表达的蛋白。人fgf-18最初被命名为zfgf-5,在wo98/16644中有完整描述。seqidno:1对应于天然人fgf-18的氨基酸序列,其具有由氨基酸残基1(met)至27(ala)组成的信号肽。人fgf-18的成熟形式对应于seqidno:1的残基28(glu)至残基207(ala)的氨基酸序列(180个氨基酸)。本发明中的fgf-18可以通过重组方法制备,例如由申请wo2006/063362教导的方法。根据表达系统和条件,本发明中的fgf-18在重组宿主细胞中表达,并具有起始甲硫氨酸(met)残基或具有分泌信号序列。当在原核宿主中表达时(例如在大肠杆菌中),fgf-18在其序列的n末端含有额外的met残基。例如,当在大肠杆菌中表达时,人fgf-18的氨基酸序列以n-末端(位置1)的met残基开始,随后是seqidno:1的残基28(glu)至残基207(ala)。本文中使用的术语fgf-18的“截短形式”是指包含或由seqidno:1的残基28(glu)至196(lys)组成的蛋白质。优选地,截短形式的fgf-18蛋白是称为“trfgf-18”的多肽(170个氨基酸,也称为rhfgf18或sprifermin),其以met残基(n-末端)开始,随后是野生型人fgf-18的氨基酸残基28(glu)-196(lys)。trfgf-18的氨基酸序列示于seqidno:2(seqidno:2的氨基酸残基2~170对应于seqidno:1的氨基酸残基28~196)。trfgf-18是在大肠杆菌中产生的重组截短形式的人fgf-18(参见wo2006/063362)。已经证实trfgf-18具有与成熟人fgf-18类似的活性,例如增加软骨细胞增殖和软骨沉积,从而修复和重建多种软骨组织(参见wo2008/023063)。术语“带正电荷”是指蛋白质含有的带正电荷的碱性氨基酸(例如赖氨酸,精氨酸和组氨酸)比带负电荷的酸性氨基酸多,以及/或者蛋白质被折叠,使得带正电荷的氨基酸暴露在其表面,以及/或者在介质的ph下表现出总体正电荷(当所述介质的ph低于pi、即等电点时)。这些蛋白通常是碱性的(pi通常高于7)。术语“高正电荷蛋白”是指非常碱性的蛋白,即具有高pi,优选为约9.5或更高。例如,溶菌酶、fgf-2和fgf-18是高正电荷碱性蛋白。该术语为本领域技术人员所熟知。术语“室温”是指通常在约15至25℃范围内的温度,例如约15℃、18℃、20℃、22℃或25℃。根据项目阶段,需要不同类型的方法,例如在早期阶段,只需要进行快速和粗略的评估,或者只需要定性方法。glp和临床研究中的方法需要经过验证。此外,并不是在每种情况下都需要评估免疫原性。生物基质中的药物浓度(pk)和抗药物抗体(ada)的测量是药物开发的重要方面。毒代动力学、药代动力学和生物等效性研究的结果用于制定支持药物的安全性和有效性的关键决定。因此,所使用的应用生物分析方法必须以令人满意的标准充分表征、充分验证并完整记录,以获得可靠的结果。上市批准申请中提交的非临床(药物-毒理学)研究必须符合良好实验室规范(goodlaboratorypractice)。用于非glp临床前研究的方法应符合条件,但不一定在glp设施中开发并充分验证。人类生物分析研究不属于directive2004/10/ec所规定的glp的范围,但应当遵循良好临床实践(goodclinicalpractice,gcp)的原则。监管机构(fda,ema)发布官方指南,说明必须遵循的pk和ada测定的验证,以确保使用验证方法产生的数据的可靠性。此外,由科学界撰写的白皮书涵盖在不同版本的官方指南之间出现的本领域的新课题。一种测定法的生命周期可以大致分为3个阶段:方法开发、研究前验证和研究中验证。在方法开发期间,评估测定法的原理,该原理在研究前验证阶段得到确认,并在研究中验证阶段应用。研究前确认阶段在方法优化结束且测定法被认为是有效的之后进行:这意味着已经确定并生产(如果需要的话)了关键测定试剂。基于可用的试剂选择最合适的技术,确定测定形式和批次大小。选择最小要求稀释(minimumrequireddilution,mrd)以最小化基质效应,并确定方法范围及确认灵敏度。方法开发过程中应建立标准曲线浓度和用于将曲线拟合到校准数据的回归模型。在开始实验阶段之前必须制定验证计划。文件记录应包括对方法的预期用途的描述和要验证的性能参数的总结、所提出的实验的总结以及评估的每个性能参数的目标接受标准。验证工作完成后,必须制定综合报告。该报告总结测定法的性能结果、以及与所述测定法的符合接受标准的使用条件相关的任何其他相关信息。确保生物分析方法的性能的可接受性和分析结果的可靠性的主要特征是:选择性、定量下限、方法范围、响应函数(校准曲线性能)、准确度、精度、基质效应、分析物在整个周期的储存和加工条件下在生物基质、库存和工作溶液中的稳定性。用于定量药物或抗药物抗体的免疫测定严重依赖于所用抗体的质量。这意味着虽然可以使用不同的技术和形式,但前提始终是要有一对良好的抗体。抗体在免疫测定中的作用通常包括用于pk测定的捕获和检测试剂、以及用于免疫原性测定的阳性对照。当为同一个应用考虑几种类型的测定形式和试剂时,建议同步启动产生不同类型的试剂,以增加获得具有适当预先指定特性的最佳试剂的可能性。进行适当的风险评估提供了充分平衡资源和时间表的机会。最好的策略是考虑有关研究的目标、药物开发计划的阶段、可能的测定形式、待测试样本的起源种类和基质类型、所需的测定灵敏度和特异性、以及潜在的对多种分析物的试剂反应性的需要。要收集的有用信息的例子包括:(a)对敏感性以及试剂与目标分析物之间的特异性和选择性相互作用的要求;(b)对减少与其他测定组分的潜在非特异性相互作用的需要,例如异嗜性抗体及其在pk测定中的相互作用;(c)对降低目标样本群体(例如类风湿因子)中潜在的交叉反应性的需要;(d)区分分析物同工型及其蛋白水解副产物的需要;(e)检测游离分析物与较大复合物中的分析物的要求;以及(f)在用酸处理或不处理样本的情况下检测与治疗剂结合的抗药物抗体。每个测定需要不同的抗体类型:例如在早期mab治疗剂开发计划期间,可以使用通用的抗igg试剂,这种试剂在后期可能会由于靶特异性试剂的产生而变得不太可取。无论使用什么技术,没有良好的原始材料,特别是抗体,测定的品质便可能受到影响。为此,为了更好地选择感兴趣的抗体,研究了使用gyrolab的亲和力测定和使用clips技术的表位作图。在进行新技术的评估时将项目的阶段考虑在内,以尝试根据具体需要(例如所需的灵敏度、灵活性、易于转移)建立良好的使用平台。选择gyrolab开发pk方法以定量人滑液中的高正电荷药物,例如fgf-18蛋白,优选sprifermin。在方法开发过程中遇到两个困难:分析物(药物)的高等电点和基质(样本)的高粘度。挑战在于找到一种方法(用于稀释分析物的缓冲液类型、洗涤程序等),以帮助减少与分子疾病有关的问题,以及一种能够使基质流化而不损害分析物稳定性的样本预处理方法。抗体亲和力的测定对于更好地理解可使用的最佳形式或了解新的免疫测定的开发中可能存在的缺陷可以有很大的价值。在生物相互作用,有两个参与者:具有较低分子量的一个通常称为配体(l),而大分子结合配对物则被称为受体(r)。在免疫复合物中,抗体被认为是受体,而分析物被认为是配体。在溶液中,受体的总浓度由自由受体部分和配体结合部分构成(假定受体具有单个配体结合位点,从而任何受体分子要么是游离的,要么与配体结合)。同样,任何配体分子必须是游离的或者与受体分子结合。这导致了以下质量守恒方程:[r]=[rl]+[r]f[l]=[rl]+[l]f其中,[r]和[l]分别是受体与配体的总浓度,[r]f和[l]f是两种分子的游离浓度,而[rl]是受体-配体复合物的浓度。在该系统中,分子不断地从自由状态转变为结合状态。其中kon为复合物形成的的二级速率常数,koff为复合物解离的一级速率常数。当复合物的形成和解离速率相等时,达到平衡。这个平衡的位置可用解离常数kd来量化地表示:不同的受体-配体复合物的相对亲和力与其kd值成反比,因此可以使用kd值来比较不同的结合配对物与相同分子的结合强度。结合常数(ka)为kd的倒数。在大多数情况下,受体和配体之间的亲和力使得需要大量过量的配体来实现与受体的显著结合;因此,在大多数实验条件下,二元复合物的形成在游离配体的浓度几乎没有变化的情况下进行。因此,结合反应以准一级动力学进行:[rl]t=[rl]eq[1-exp(-kobst)其中[rl]t是二元复合物rl在时间t的浓度,[rl]eq是平衡时该二元复合物的浓度,而kobs是趋近于平衡的准一级速率常数的实验确定值。对于可逆结合,kobs的值与配体的浓度成正比:kobs=koff+kon[l]f因此,可以确定kobs在不同配体浓度下的值。通过绘制kobs作为配体浓度的函数,可以获得线性拟合,其斜率等于kon,而其截距等于koff。研究受体-配体相互作用的最常见和简单的方法是在等待平衡建立,因为该动力学过程通常发生在非常短的时间内。在平衡时,rl复合物的浓度是恒定的,并且复合物形成和解离的速率相等。kon[r]f[l]f=koff[rl],考虑到kon/koff等同于结合常数ka:[rl]=ka[r]f[l]f目前有多种用于亲和测量的技术;文献中最常用的是等温滴定量热法(itc)、表面等离子体共振(spr)和kinexa。gyrolab技术用于评估抗体对其抗原的亲和力。该技术基于固定化的抗原与平衡时数量增加的游离抗原之间结合目标抗体的竞争。只有未结合溶液中的游离抗原的抗体才能被固定化的抗原捕获,从而可以用检测荧光团(即荧光染料)测定其浓度。根据已开发的方法,测定亲和力所需的步骤如下:·抗原的生物素化和用荧光染料标记抗体,例如alexa-647,·对捕获条件进行测试,·确定固定ab浓度,·测定结合平衡时间,·确认所得的kd:重复实验以及ab浓度的变化由于试剂的标记是关键的步骤,捕获试剂(sprifermin)用不同比例的生物素标记,并用于捕获抗体且与未标记的抗原比较。sprifermin是高正电荷蛋白,因此分析物与柱(例如gyrolab技术的cd柱)发生严重的非特异性结合。为了降低这种效应,成功地采用了包括更严格的洗涤步骤的改良方法。选择的捕获试剂是以1:2至1:20比例的生物素(例如1:2,1:10或1:20)、优选1:5至1:15比例的生物素、更优选1:10比例的生物素标记的sprifermin。在确定了捕获试剂(优选以1:10标记的sprifermin)后,就将其用于测定固定抗体(ab)的浓度:在不与游离抗原进行预混合的情况下,分析两种待评估的抗体的标准曲线。最佳浓度的选择基于两个因素:所选择的浓度必须在曲线的线性部分上,并且响应必须足够高,以在预混合物中抗原浓度增加时有足够的信号降低空间。使用了两种针对fgf-18的抗体:f05和f44。在用荧光染料标记后,两种标记的抗体以0.1pm至100nm的浓度使用,例如0.1或0.5pm,0.001,0.005,0.01,0.05,0.1,0.5,1,5,10,50或100nm。优选地,浓度范围为0.05至1nm。结果表明,更优选的浓度为或约为0.1nm。将所选浓度的两种mab与不同量的抗原(0.5pm至2μm)一起培育1小时(1h)或24小时(24h)。培育1小时和24小时后获得的响应非常接近,因此可以比较两种mab的计算kd。在认为此时已经达成了平衡的前提下,以下所有实验都是以1小时的预混合进行的,这对于加快整个开发进程是有利的条件。这些初步数据也可用于初步kd估计。结果表明,f05mab的kd为约1nm,而mabf44似乎具有更高的亲和力,其估计kd为约200pm。为了更好地计算kd,进行了kd对照实验,该实验须满足的条件是:固定mab浓度和所计算的kd之间的比率应小于或等于1。两种抗体都满足这个要求:f05的比率约为0.09,而f44的比率约为0.2,远低于1。通过使用开发的程序重复4次评估同时改变固定mab的浓度来确认以上实验结果。f05给出了稳健的结果,响应稳定,以kd对照方式进行的所有实验中保持约1nm的估计亲和常数。f44显示出比f05更高的亲和力,约为300pm,但结果可重复性较低,表明这种表现可能是由于使用的试剂:具有较高亲和力的抗体的测定较为困难。评估抗体质量的第二个方面是表位作图。由于这些抗体用于夹心免疫测定法中,识别的表位可能是一种有用的信息,不仅可以选择最佳的抗体对,而且可用于数据解读。通过了解抗体识别的确切表位,可以评估该测定法特异性识别完整药物或消化产物的能力,这对药物开发过程中pk数据的解读是非常有用的信息。根据pepscanpresto(theneederland)进行表位作图。选择该技术是因为它不仅能够作为最常规的技术识别线性表位,而且能够在短时间内识别构型和非连续表位。将抗原(sprifermin)在大约4000个重叠肽的文库中转化,这些重叠肽本身进行测试,并且以单一残基诱变进行测试。此外,使用clips技术使这些重叠肽成环(conformedinloops):重叠肽本身,诱变的重叠肽,最后与来自所有蛋白质长度的序列并置。所有这些肽组在基于pepscan且针对所用抗体的结合特性优化的elisa中测试。数据分析是困难的,因为两种抗体具有非常相似的结合模式,但是由于它们用于夹心elisa,所以两个表位必然存在差异。因此,通过突出差异结合肽比较分析结合模式。发现了一个公用结合区(seqidno.2的氨基酸残基21-27)。此外,两种mab都发现了第二结合区(f05是seqidno.2的氨基酸残基7-21,f44是seqidno.2的氨基酸残基153-164)。这些区域分别位于蛋白质一级序列的n末端和c末端区域,并且,根据与sprifermin具有高度同源性的一个蛋白质的三级结构,这些区域应该在seqidno.2的氨基酸残基21-27的区域附近。使用两种抗体f05和f44来开发用于确定人滑液中的sprifermin的量的pk测定法。由于基质造成非常严重的干扰,且从患者收集的样本的体积可能非常有限,因此选择gyrolab,其相对于已经验证可在人血清中定量相同药物的夹心elisa是更为优选的技术。两种抗体均以捕获和检测两种组合进行测试,结果表明,f44可用作捕获试剂,而f05可用作检测试剂。该结果证实了f44所测得的更高的亲和力:实际上亲和力最高的ab通常用于捕获复杂基质中的分析物。发明人必须考虑的一个重要的方面是分析物。sprifermin是一个约20kda的重组蛋白,其特征是等电点为10.4。这意味着,在中性ph下该蛋白带正电。因此,它是粘性的,并具有结合到玻璃和塑料表面的倾向。因此,对用于稀释样本的缓冲液进行了优化,以避免样本处理过程中分析物的损失。测试了不同的缓冲液:rexxiphn、rexxiphnmax、稀释缓冲液1和稀释缓冲液10。在这些缓冲液中,具有最佳性能的是rexxiphn(一种针对带正电荷的分析物开发的缓冲液)。与此方法的开发相关的第二个问题是基质的复杂性。使用不同mrd稀释未加料滑液以及加入了所述分析物的滑液,以找到最佳稀释度。在寻找最佳mrd的实验期间,发明人发现滑液的粘度很高,难以处理。此外,在测定中的响应方面有一个奇怪的现象:稀释度越低,cv%和%bias的结果越好。由于这些原因,决定通过增加预处理步骤来改善滑液的处理。由于滑液主要由透明质酸构成,因此评估了用透明质酸酶进行消化。采用了温和的温度和持续时间条件,以减少该处理步骤对分析物稳定性的影响。经过多次试验,发明人认识到仅用透明质酸酶消化滑液不足以降低样本粘度;在不同透明质酸酶浓度和培育时间的许多实验中都出现了针头凝结、其他样本污染、差%cv和差%bias。因此,为了提高该方法的性能,测试了离心步骤与透明质酸酶消化的组合,在%bias和%cv方面得到了良好的结果,而不影响分析物的稳定性。确定了最终的样本预处理程序(以13'000rpm离心两次,每次5分钟,并在室温下与20μg/ml透明质酸酶摇瓶培育30'),改善了样本的处理,增加了基质的流动性,并避免了针头凝结现象。在确定稀释缓冲液液、mrd和样本预处理之后,进行了针头残留评估,以确保分析物没有结合到仪器上。正如所料,即使使用了rexxiphn,sprifermin仍严重结合gyrolab针(由于其高正电荷),影响低浓度加料样本(ss)。因此,在添加分析物的步骤之前增加额外的用高盐溶液洗涤的步骤,以改进该方法。因此,该方法包括至少2个洗涤步骤:一个在添加分析物的步骤之前,一个在添加分析物的步骤之后。本发明的一个方面提供一种预处理用于免疫测定的人滑液样本的方法,包括:-向所述人滑液样本添加透明质酸酶溶液,-在室温(rt)下培育所述样本,-离心所述人滑液样本。透明质酸酶的浓度范围为0.1至30μg/ml,例如0.1,1,5,10,15,20,25或30μg/ml。优选地,其范围为5至20μg/ml。更优选为20μg/ml或约20μg/ml。人滑液与透明质酸酶一起培育的时间是至少20分钟,优选至少25分钟,更优选至少30分钟。更优选地,人滑液与透明质酸酶一起培育的时间为30分钟或1小时。人滑液样本的离心根据标准方法进行。例如,可进行10000~15000rpm的离心,例如以13,000rpm或约13,000rpm离心5~15分钟,优选10分钟。本发明的另一个方面提供一种用于确定人滑液样本中的高正电荷蛋白的量的方法,包括以下步骤:a)预处理所述人滑液样本,所述预处理步骤包括:-向所述人滑液样本添加透明质酸酶溶液,-在室温(rt)下培育所述样本,-离心所述人滑液样本,b)用缓冲液稀释已预处理的所述人滑液样本,c)将针对所述高正电荷蛋白的生物素化抗体固定到柱上,d)用标准洗涤缓冲液洗涤所述柱以除去未结合的抗体,e)在所述柱中,在所述抗体与所述高正电荷蛋白特异结合的条件下,使已预处理及已稀释的所述人滑液样本与已固定的所述生物素化抗体接触,以产生抗体-蛋白复合物,f)用标准洗涤缓冲液洗涤所述柱复合物,g)向所述柱中的所述抗体-蛋白复合物添加带有荧光染料标记的对所述高正电荷蛋白特异的抗体,以产生可测量的响应,并用标准洗涤缓冲液洗涤所述柱,h)测量所产生的响应,i)通过比较所述样本产生的响应与校准标准产生的响应来确定所述样本中高正电荷蛋白的量。本发明的另一个方面提供一种用于自动化地确定人滑液样本中的高正电荷蛋白的量的方法,包括以下步骤:a)预处理所述人滑液样本,所述预处理步骤包括:-向所述人滑液样本添加透明质酸酶溶液,-在室温(rt)下培育所述样本,-离心所述人滑液样本,b)用缓冲液稀释已预处理的所述人滑液样本,c)将针对所述高正电荷蛋白的生物素化抗体固定到柱上,d)用标准洗涤缓冲液洗涤所述柱以除去未结合的抗体,e)提供注射装置,所述注射装置用于将已预处理及已稀释的所述人滑液样本自动化地转移到所述柱中,f)在将已预处理及已稀释的所述人滑液样本转移到所述柱中之前,用高离子力缓冲液洗涤所述注射装置,g)将已预处理及已稀释的所述人滑液样本转移到所述柱中,从而在所述抗体与所述高正电荷蛋白特异结合的条件下,使已预处理及已稀释的所述人滑液样本与已固定的所述生物素化抗体接触,以产生抗体-蛋白复合物,h)在步骤g)之后,用高离子力缓冲液洗涤所述注射装置,i)用标准洗涤缓冲液洗涤所述柱,j)向所述柱中的所述抗体-蛋白复合物添加带有荧光染料标记的对所述高正电荷蛋白特异的抗体,以产生可测量的响应,并用标准洗涤缓冲液洗涤所述柱,k)测量所产生的响应,l)通过比较所述样本产生的响应与校准标准产生的响应来确定所述样本中所述高正电荷蛋白的量。根据本发明,术语“带正电荷蛋白”是指蛋白质含有的带正电荷的碱性氨基酸(例如赖氨酸,精氨酸和组氨酸)比带负电荷的酸性氨基酸多,以及/或者蛋白质被折叠,使得带正电荷的氨基酸暴露在其表面,以及/或者在介质的ph下表现出总体正电荷。优选地,所述高正电荷蛋白是fgf-18蛋白。更优选地,所述fgf-18蛋白选自以下组:1)包含或由人fgf-18的成熟形式构成的多肽,对应于包含或由seqidno:1的残基28(glu)至残基207(ala)构成的序列,2)包含或由人fgf-18的截断形式构成的多肽,所述人fgf-18的截断形式包含或由seqidno:1的残基28(glu)至残基196(lys)构成,以及3)包含或由seqidno:2构成的多肽。更优选地,fgf-18是sprifermin。在另一个实施例中,所述预处理的人滑液样本用rexxiphn缓冲液以1:2至1:10、优选以1:5或约1:5稀释(上述步骤b))。在另一个实施例中,所述高离子力缓冲液是含有高浓度的盐(例如nacl)的缓冲液,所述盐优选地溶解在乙醇中。优选地,所述盐的浓度至少为1m。例如,所述高离子力缓冲液是20%乙醇中的1.5mnacl。人滑液样本的离心(步骤a))根据标准方法进行。例如,可进行10000~15000rpm的离心,例如以13,000rpm或约13,000rpm离心5~15分钟,优选10分钟。人滑液与透明质酸酶一起培育(步骤a))的时间是至少20分钟,优选至少25分钟,更优选至少30分钟。更优选地,人滑液与透明质酸酶一起培育的时间为30分钟或1小时。透明质酸酶的浓度范围为0.1至30μg/ml,例如0.1,1,5,10,15,20,25或30μg/ml。优选地,其范围为5至20μg/ml。更优选为20μg/ml或约20μg/ml。在一个实施例中,所述标准洗涤缓冲液可以是任何已知的标准缓冲液。例如tween缓冲液,例如pbs中的0.05%tween20。针对高正电荷蛋白的抗体,例如针对fgf-18蛋白的抗体(即特异性结合例如fgf-18蛋白的抗体)可通过本领域中已知的任何标准方法获得。在本发明的方法中使用的柱是本领域已知的基于高度特异性的相互作用(例如抗原和抗体之间)分离生化混合物的任何合适的柱。优选地,所述柱是亲和捕获柱。更优选地,所述柱是链霉亲和素珠柱。每次都进行柱的洗涤步骤,以除去未结合的试剂(抗体、混合物或蛋白质)。每次都进行注射装置的洗涤步骤,以除去粘性高正电荷蛋白,例如fgf-18蛋白,当需要定量多个样本时,这种蛋白可能会导致残留(carryover)。在本发明的方法中使用的注射装置是用于将液体样本从一个容器转移到另一个容器的任何合适的注射装置,例如用于将已预处理和稀释的人滑液样本从稀释容器转移到柱中。注射装置可以是一次性的或非一次性的。例如,合适的注射装置可以是带有一次性枪头的移液系统或适于本发明的方法的针。具体地说这种针可以是gyrolab工作站(gyrolab免疫测定平台)中使用的针。在自动定量时,可以同时或接近同时定量一组样本。在这种情况下,需要一组柱,每个待分析的人滑液样本需要一个柱,并且该方法的各步骤将被重复。通常,可使用同一个注射装置来转移样本上柱,只要小心地进行所有洗涤步骤,以避免样本之间的残留。如果使用一次性注射装置,则步骤f)和h)的洗涤步骤不是必需的。本发明所用的荧光染料是能够吸收紫外线辐射或可见光、并几乎没有时间延迟地发射波长更长的光(荧光)的有机着色剂。本发明的范围之内的荧光染料包括染料分子和较大的分子单元的发色组分(荧光染料),例如结合到抗体或其它生物分子上的发色团。这样的荧光染料例如吖啶染料,花青染料,荧光酮染料,恶嗪染料,菲啶染料,若丹明染料,其例如用于荧光分析,或用作免疫学特异性标记的荧光探针。常见的荧光染料及其应用领域的较好的综述例如thehandbookoffluorescentprobesandresearchchemicals,richardp.haugland,molecularprobes。在一个优选实施例中,使用的alexa-647荧光染料。该荧光染料属于alexafluor荧光染料家族,由molecularprobes公司生产。alexafluor系列的激发和发射光谱覆盖可见光谱并延伸到红外。该家族的各成员大致上根据它们的激发光最大值(以nm为单位)编号。alexafluor染料通过香豆素、若丹明、呫吨(例如荧光素)、和花青染料的磺化合成。磺化使得alexafluor染料带负电荷和亲水性。alexafluor染料通常比具有相近的激发光和发射光的普通染料(例如荧光素,罗丹明)(并在一定程度上比新的花青系列)更稳定、更亮而对ph较不敏感。在本发明的上下文中,可测量的响应是由荧光标记的化合物(抗体或蛋白质)发射、并由本领域中已知的任何荧光或荧光分光光度计方法测定的荧光。当使用gyrolab技术时,发射的荧光信号由gyrolab工作站测量,该工作站能够执行柱表面的扫描,并给出相对荧光单位的数字响应、以及柱中的荧光峰值图像作为结果。本领域技术人员将理解,除了具体描述的实施例,本文描述的发明还可有其他变化和修改。应当理解,本发明包括所有这样的变化和修改,而不脱离其精神或实质特征。本发明还包括在本说明书中所提及的所有个别步骤、特征、组合物和化合物或其组合,以及任意两个或更多个所述步骤或特征的任意和所有组合。本说明书因此应被认为在所有方面均是示例性的而不是限制性的,本发明的范围由所附权利要求书限定,并且所有等价含义和范围内的改变都包含在其中。参考以下实施例可更充分地理解以上描述。然而,这些实施例仅用于举例说明实施本发明的方法,而不能理解为限制本发明的范围。序列说明:seqidno.1:天然人fgf-18的氨基酸序列。seqidno.2:重组截短fgf-18(trfgf-18)的氨基酸序列。实施例在以下实施例中,如果实际样本浓度低于该方法的定量下限(150pg/ml),将被报告为低于定量下限(bql)。1.使用gyrolab技术的亲和力测量1.1.1分析方法在亲和力测定中,使用直接抗体测定法。biotin标记的抗原sprifermin被附着到cd柱上,alexa647标记的mab由固定化的抗原捕获。需要在cd外、在微板孔中进行抗原和抗体的预混合步骤。在预定的时间后,将混合物装载,只有游离抗体被固定化抗原捕获。分析的抗体是zymogenetics生产的针对sprifermin的单克隆抗体(igg),其用于临床前和临床pk测定。所述抗体命名为f5a2(在本文中称为mabf05)和f44a2(在本文中称为mabf44)。1.1.2sprifermin的生物素化使用pierce试剂盒“ez-linkmicrosulfo-nhs-lc-biotinylation:无重量生物素”(cat.21327)来进行生物素化。生物素化产物使用pierce“zeba脱盐离心柱”(cat.89849)纯化,而标记程度使用pierce“生物素定量试剂盒”(cat.25008)进行检查。生物素的n-羟基琥珀酰亚胺(nhs)酯是最流行的一类生物素化试剂。nhs活化的生物素与ph7-9的缓冲液中的伯氨基(-nh2)高效地反应,形成稳定的酰胺键。蛋白质通常具有许多可用于标记的位点(参见图1),包括赖氨酸(k)残基的侧链中的伯胺和每个多肽的n末端。有生物素的几种不同的nhs酯,其具有不同的性质和间隔臂长度。该试剂盒中的磺基-nhs酯试剂是水溶性的,从而使反应可在不存在有机溶剂的情况下进行。因为生物素较小(244da),因此可以结合到许多蛋白质上而不改变其生物学活性。按照以下步骤进行生物素化:1.200μl冷milli-q水添加到1mg生物素,以获得9mm的浓度;2.配制浓度为0.1mm的sprifermin(相当于2mg/ml:分子量19830)。使用比分析物过量2/10/20倍摩尔的生物素。因此,2.7/13.5/27微升的9mm生物素被添加到120微升sprifermin;3.将混合物在摇动条件下培育1个小时;4.过量的生物素用pierce的zeba脱盐离心柱除去。该柱能够交换溶解了蛋白质的缓冲液,并保留≥95%的盐和小分子,同时提供大于7000da的蛋白质的恢复。首先将所述柱在1500×g下离心1分钟。除去过量的液体,并加载120微升样本。将所述柱在1500×g下离心2分钟。流出液中含有标记的蛋白质而不含游离生物素。5.通过光谱法使用nanodropnd-1000在280nm处读取测量样本浓度。使用pbs作为参考。在生物素化之后,通过使用pierce生物素定量试剂盒检查标记程度。haba(4'-羟基偶氮-2-羧酸)是一种用于快速估计生物素与蛋白质的摩尔对摩尔比的试剂。所述试剂盒含有haba与抗生物素蛋白和生物素化辣根过氧化物酶(hrp)阳性对照的预混物:haba/抗生物素蛋白。将含有生物素化蛋白的溶液中加入到haba与抗生物素蛋白的混合物。由于生物素对抗生物素蛋白的亲和力更高,它将置换haba,从而使500nm处的吸光度成比例地下降。通过这种方法,溶液中未知的生物素的量可以在一个微板孔中通过测量添加含有生物素的样本之前和之后haba-抗生物素蛋白溶液的吸光度来进行定量。吸光度的变化通过haba-抗生物素蛋白复合物的消光系数与样本中生物素的量相关。进行以下步骤:1.无重量haba/抗生物素蛋白预混物在室温下平衡,并溶解在100μlmilliq水中;2.对每个样本以及一个阳性对照,将160μlpbs移液到微板孔中;3.将20μlhaba/抗生物素蛋白预混物溶液加入到每个孔中的pbs中。将微板放置在定轨摇床上混合2分钟;4.测量孔中的溶液在500nm处的吸光度,并将该值记录为a500haba/抗生物素蛋白;5.20微升生物素化样本/生物素化hrp(生物素化率已知的阳性对照)加入到含有haba/抗生物素蛋白反应混合物的孔中,并如上所述混合;6.测量孔中的溶液在500nm处的吸光度,并在该值保持恒定至少15秒后,将该值记录为a500haba/抗生物素蛋白/生物素样本;7.最后根据以下公式计算每毫摩尔的蛋白(在原始样本中)中的生物素的毫摩尔数:δa500=(a500h\a)-(a500h\a\b)=calc#21.1.3以alexa-fluor647标记抗体使用molecularprobes试剂盒“647单克隆抗体标记试剂盒”(cat.a20186)标记和纯化产物。使用nanodrop1000来检查标记程度。复合物的吸收和荧光最大值分别为约650纳米和668纳米。alexafluor647活性染料具有琥珀酰亚胺基酯部分,可与蛋白质的伯胺有效地反应以形成稳定的染料-蛋白质复合物。按照以下程序进行标记:1.将抗体稀释到1mg/ml的浓度,然后加入十分之一体积的碳酸氢钠缓冲液(ph8.3)。(加入ph~8.3的碳酸氢盐是为了提高反应混合物的ph值,因为琥珀酰亚胺酯在ph7.5-8.5有效地反应;2.将(步骤1所得的)100μl蛋白质溶液转移至含有活性染料的小瓶中,并轻轻地倒置以充分溶解该染料;3.将溶液在22℃的摇床中培育1小时;4.为了将标记的抗体与未反应的产物分离,使用ph为7.2的磷酸盐缓冲盐水(pbs)及2mm的叠氮化钠中的30,000mw尺寸排阻树脂来除去过量染料。将旋转柱置于5ml管中并搅拌纯化树脂。将1ml悬浮液加入到柱中,并使其沉降。然后再加入500μl。悬浮液总体积为1.5ml。利用重力使柱缓冲液从柱中排出。开始时可能需要一定的压力,以使缓冲液的最初几滴流出。5.将旋转柱置于一个收集管中,并使用吊桶式转头在1100×g下离心3分钟。将缓冲液弃掉。旋转柱便可用于纯化标记抗体;6.将步骤3的产物(标记混合物)逐滴加入到所述旋转柱的中心并使其吸收到凝胶床中;7.将旋转柱置于空收集管中,在1100×g下离心5分钟;8.离心之后,收集约100μlph为7.2的pbs及2mm的叠氮化钠中的标记蛋白。游离的染料留在柱床中。为了确定标记率,使用nanodrop仪器测量复合物溶液在280nm和650nm的吸光度。样本中蛋白质的浓度根据下列公式计算:其中203'000是典型的igg在280nm的摩尔消光系数(ε),单位为cm-1m-1,0.03是荧光团对280nm的吸光度的贡献的校正因子。标记程度根据下列公式计算:其中239'000cm-1m-1是alexafluor647染料在650nm的近似摩尔消光系数。对于igg,最佳的标记程度是每摩尔抗体标记3至7摩尔的alexafluor647染料。1.1.4.捕获试剂测试为了确定捕获试剂(生物素化sprifermin)的最佳实验条件,在2步gyrolab测定中测试了不同的条件。生物素化的捕获试剂与珠结合,以制备分析物特异性捕获柱。在测定过程中,alexa-647标记的抗体通过所述柱,其中所述抗体被特异性地捕获。使用了以下捕获试剂:·未标记的sprifermin;·未标记的sprifermin+生物素化的牛血清白蛋白(bio-bsa,sigma,a8549),比例为1:3;·未标记的sprifermin+生物bsa,比例为1:9;·sprifermin,生物素化标记1:2;·sprifermin,生物素化标记1:10;·sprifermin,生物素化标记1:20;所有的捕获试剂以pbs-t(磷酸盐缓冲盐水中的0.01%tween20)或rexxiphn缓冲液(gyros,p0004996)稀释至0.1mg/ml的浓度。检测试剂(alexa-647标记的mab抗sprifermin)以rexxipf缓冲液(gyros,p0004825)稀释至5、10和50nm的浓度进行测试。使用gyrolab方法“bioaffy10002stepc-adwiz-v1”进行的第一个实验。使用gyrolab方法“bioaffy1000wash×2c-adwiz-v1”进行第二个实验,并增加额外的使用washsolution2(ws2:20%乙醇中的1.5mnacl)进行洗涤的步骤。结果进行第一个实验以评估最佳捕获条件,比较三种不同生物素化程度的sprifermin(比例为sprifermin:生物素1:2、1:10、1:20),并以未标记的sprifermin作为阴性对照。被评估的检测单克隆抗体以三种不同浓度制备。不同捕获条件的组合的结果表明,非特异性信号很高,这是由于药物与链霉亲和素捕获柱的结合造成的(见表1,未标记sprifermin)。表1:捕获试剂测试的结果。第一个实验。avgrlu:三个重复实验的平均响应。为了获得特异性,对gyrolab方法进行了改良。增加用高离子力缓冲液(ws2)洗涤的步骤,以减少非特异性结合。此外,测试未标记的sprifermin与bio-bsa的组合,以封闭柱上的自由结合位点。第二个实验的结果示于表2中。表2:捕获试剂测试的结果。第二个实验。avgrlu:三个重复实验的平均响应。在使用包括ws2洗涤步骤的新方法的情况下,由于bio-sprifermin与所述柱结合而产生的信号高于未标记药物的信号(在alexa标记的mab浓度为50nm时,第一种方法中标记程度为1:2的sprifermin与未标记sprifermin之间的比率约为5。在第二个实验中该比率约为50)。未标记药物的响应从实验1到实验2显著地下降,而标记药物的响应保持不变。加入bio-bsa似乎并不能显著帮助非特异性信号的抑制。通过分析不同条件下的峰值,可以发现使用标记和未标记sprifermin产生的信号之间有明显的差异。在峰形和信号饱和度方面最佳的条件似乎是sprifermin生物素化程度1:10。1.1.5固定抗体(ab)浓度的确定为了选择用于kd实验的alexa-647标记mab的固定浓度,在不进行与抗原的预培育的情况下制作了跨越alexa-647标记mab的不同浓度的标准曲线。不同的抗体浓度以两步骤gyrolab测定法“bioaffy1000wash×2c-adwiz-v1”进行了测试。捕获试剂,标记程度1:10的bio-sprifermin,以rexxiphn稀释至0.1mg/ml使用。将alexa标记的mabf05以rexxipf稀释至50,1,0.1,0.01,0.005,0.001nm,0.5和0.1pm,以制作标准曲线。alexa标记的mabf44以rexxipf稀释至50,10,1,0.01,0.005,0.001nm以及0.5和0.1pm。结果为了确定用于kd实验的固定mab浓度,在不进行与药物的预培育的情况下制备了不同浓度的两种抗体。在进行了几次实验以确定s形曲线的线性部分后,发现两种抗体在低于0.01nm时的反应似乎都不稳定,且两种抗体的表现接近(见表3)。0.01nm以下的%cv非常高。两种抗体所选择的浓度均为0.1nm。表3:f05和f44固定抗体浓度确定实验的结果。avgrlu:三次重复实验的平均响应,cv%:三次重复实验的变化系数%。红色:超出接受标准(±20%)的%cv。1.1.6平衡时间的确定及比率[ab]/kd的评估为了选择kd实验的正确培育时间,制作了跨越未标记sprifermin的不同浓度的标准曲线,然后与固定的alexa-647标记mab培育1h或24h,并进行测试。标准曲线以两步骤gyrolab测定法“bioaffy1000wash×2c-adwiz-v1”进行了测试。捕获试剂,标记程度1:10的bio-sprifermin,以rexxiphn稀释至0.1mg/ml使用。将未标记sprifermin稀释至0.0005,0.01,0.05,0.25,0.5,5,50,500,1000和2000nm的最终浓度,以制作标准曲线。将0.1nm的alexa标记的mabf05用rexxipf以1:20进行稀释。将0.1或0.05nm的alexa标记的mabf44用rexxipf稀释。将这些混合物在黑暗中的22℃的摇床中保持1小时或24小时。结果将所选择的mab浓度0.1nm与不同浓度的sprifermin一起预培育,以便选择kd确定实验中优选的培育时间。进行1小时或24小时的预培育,然后进行测试,以便评估较短的培育时间是否能够使反应达到平衡(参见图2的mabf05的结果)。对于mabf44稳定结果难以获得,因此决定将固定mab浓度由0.1降低至0.05nm。%bias方面的结果不是最佳的,但通过多次实验证实。由于培育1或24小时后所得的计算kd接近,因此决定维持培育时间为1小时(参照图3mabf44)。两种抗体的比率[ab]/kd均远低于1,因此所进行的实验可称为kd控制的,从而可精确地测定kd。1.1.7.kd的验证为了验证所得到的数据,按照与1.1.6中所述相同的步骤,对每个抗体将测定kd的实验重复4次。结果将每个抗体的kd实验重复4次以验证结果。mabf05参见图4,mabf44参见图5。f05给出了稳健的结果,计算kd在所有实验中保持一致,响应稳定。计算kd的结果为约1nm。f44的结果的可重复性较差,原因可能与使用的试剂的低浓度有关。但mabf44对sprifermin的亲和力比mabf05高,因为计算kd约为300pm,仪器的响应变化较大可以归因于一个事实,即这种高亲和力可能是这种技术的一个挑战。1.1.8在不同抗体固定浓度下测定kd为了确定计算kd的准确性,将未标记sprifermin与不同mab浓度培育。制作了跨越未标记sprifermin的不同浓度的标准曲线,然后与4种固定的alexa-647标记mab培育1h。标准曲线以两步骤gyrolab测定法“bioaffy1000wash×2c-adwiz-v1”进行了测试。捕获试剂,标记程度1:10的bio-sprifermin,以rexxiphn稀释至0.1mg/ml使用。将未标记sprifermin稀释至0.0005,0.01,0.05,0.25,0.5,5,50,500,1000和2000nm的最终浓度,以制作标准曲线。将0.01,0.1,1和10nm的alexa标记的mabf05用rexxipf以1:20进行稀释。将5,50pm,0.5和5nm的alexa标记的mabf44用rexxipf稀释。将这些稀释溶液在黑暗中的22℃的摇床中保持1小时。结果为了确认所计算出的kd的可靠性,将四种不同浓度的所述两种mab与未标记的sprifermin一起培育(如之前的实验)。这个实验是为了排除所得到的kd只对所有先前的实验中所选用的抗体浓度有效的可能性。对于mabf05来说,浓度的变化对所计算出的kd的影响很低。只有最高测试浓度:10nm的(比所选的0.1nm高100倍)显示出了不同的结果,但由于[ab]/kd是1.6,因此该测定结果不能被认为与其他结果一样准确(数据未示出)。mabf44也有同样的情况(数据未显示)。但结果显示kd比在先前实验中获得的更高,从而证实了该抗体对其抗原具有更高亲和力是对gyrolab技术的挑战的假设。2.使用pepscanclips技术进行表位作图使用pepscanclips技术来表征用于pk免疫测定以定量血清和滑液中的sprifermin的两种mab(f44和f05)。将目标药物在包括约4000个重叠肽构建体、并使用组合矩阵设计的文库中转化。clips技术允许将肽构建为单、双或三环。在本实验中,以单、双环进行了测试。通过将clips模板耦合到所述肽的半胱氨酸残基上来进行合成。抗体与每种肽的结合使用基于pepscan的elisa进行测试。所述肽阵列在4℃下用初级抗体溶液培育过夜。洗涤后,所述肽阵列在25℃下用抗体过氧化物酶复合物(sba,cat.2010-05)的1:1000稀释溶液培育1小时。洗涤后,加入过氧化物酶底物2,2'-连氮基-二-3-乙基苯(abts)和2μl/ml的3%h2o2。1小时后测量显色,并用ccd相机和成像处理系统进行定量。合成了六组不同的肽:第1组:单残基的诱变扫描:用19种天然氨基酸中的任一种系统性置换基础序列中的单个位置;第2组:clips构型环:单环构型clips肽,具有19个重叠残基的整组20mers(大约150个肽);第3组:具有错配中断的clips构型环:与第2组相同,但中间位置的2个氨基酸取代为ala(约150个肽);对比第2组和第3组的结果可以揭示突变位置的相关性。第4组:线性:具有19个重叠残基的线性20mers(约150个肽);第5组:具有错配中断的线性:与第4组相同,但中间位置的2个氨基酸取代为ala(约150个肽);第6组:clips不连续矩阵:26×154的17mers矩阵,具有16个重叠残基。在t3clips支架上建模(约4000个肽);为了优化结合条件,以不同浓度的抗体、稀释缓冲液的组成和阵列预处理进行实验设计。结果为了突出结合得最好的肽,一种可以使用的统计工具是箱线图方法。结果的分布显示了一个共同的背景水平,并且能够确定统计异常值:在噪点中具有统计学相关的更强的结合的肽,就可能是可以用于结合的肽。使用箱线图分析的结果发现,具有突出的特异性结合的最佳条件是封闭缓冲液中的抗体浓度为5μg/ml以及1%的竞争性蛋白。线性和clips肽的分析表明,这两种抗体具有相似的结合模式,在n-和c-末端的结合较强。不连续clips矩阵的分析表明揭示了2种抗体的特异性结合模式。下列氨基酸编号基于seqidno.2。对于f05和f44,观察到的优势结合区域均为21-27和36-45。在区域121-129,141-151和153-163中也观察到了f44的结合。这两个区域与f05也有某种程度上的结合,但结合程度比f44低得多。f05也结合n-末端1-21。为了阐明这两种抗体的结合之间的差异,对该数据组中的值进行了比较:每个响应值均以成对散点图的方式作图。如果一个抗体与一个肽的结合高于另一个抗体,该点云(pointcloud)便不会以1:1线为中心。由于f44的整体结合比f05高,因此实际上点云不以1:1线为中心(参见图6a)。为根据整体结合进行调整并集中在两个样本之间的特异性差异上,使用loess曲线拟合使点云归一化(参见图6b)。归一化后,点云以1:1线为中心。为了识别差异性结合的肽,图6b中的数据被重新拟合为ma-图(这种曲线类型将两个样本的平均值显示在x轴上,而将差异的log2显示在y轴上)。在该图中,差异性结合的肽具有高y值。为去除噪声,可以对平均值和差异性结合进行截断。余下的差异性结合肽在图6c中以蓝色(与f44结合较强)和黄色(与f05结合较强)显示。所识别的218种肽(总数为4000)根据在靶蛋白上的序列位置评分(图6d)。f44与覆盖区域153-164的肽的结合明显较强。对于f05,具有相对较强的结合的区域主要是7-21。两种抗体的结合最强的区域均为21-27,这表明该区域可能是f05和f44的表位。但是,补充证据表明,这两种抗体具有不同的表位,因为它们可以在一个“三明治-elisa”实验同时使用。f05和f44之间的差异分析表明f05特异性结合n-末端结构域,而f44结合c-末端结构域。这两个结构域均在优势结合区域的附近。以上结果通过使用与sprifermin属于同一家族的蛋白质显示在图7中。因此,f05和f44的推定表位为:f05:21-27连同7-21f44:21-27连同153-1643.基于gyrolab测定分析物和基质的pk(药理动力学)的的测定法的开发3.1寻找最佳抗体组合为了确定最佳抗体组合,以3步gyrolab测定法:“bioaffy1000wizv1mod洗涤”并加入洗涤溶液2(ws2:20%乙醇中的1.5mnacl)测试两种不同的条件。以rexxiphn缓冲液(gyros,p0004996)将分析物sprifermin独立稀释至50,10,2ng/ml,400,80,16,3.2pg/ml,以制备其标准曲线。加入空白样本溶液(标准0,“std0”,只有rexxiphn)。捕获试剂(生物素标记f44和f05抗体)以0.1mg/ml的浓度使用。检测试剂(alexa-647标记的f44和f05)以在rexxipf缓冲液(gyros,p0004825)稀释至25nm的浓度使用。结果为了决定该pk测定的最佳抗体组合,两种mab的组合(f05作为捕获试剂/f44作为检测试剂,以及f44作为捕获试剂/f05作为检测试剂)使用3步骤gyrolab方法“bioaffy1000wizv1modwash”并加入洗涤溶液2进行了测试(见图8)。重复该实验3次,并改变检测抗体的浓度(数据未显示)。结果发现,最好的组合是f44作为捕获试剂而f05作为检测试剂:这种组合产生的峰具有较尖锐的形状,并且在曲线的下部也具有较好的线性(数据未示出)。3.2缓冲液的选择用于稀释分析物的缓冲液的选择对于免疫测定的性能是至关重要的。使用四种不同的缓冲液来进行sprifermin的标准曲线的制备,并按照alphalisa技术步骤进行分析:·rexxiphn缓冲液(gyros,p0004996);·rexxiphnmax缓冲液(gyros,p0004997);·稀释缓冲液1(0.1%牛血清白蛋白(sigma,目录号a7906),0.05%的lutrol(basfcat.s30101),溶解于7mm的磷酸氢二钠、1mm的kh2po4、2.7mm的氯化钾中,ph7.3);·稀释缓冲液10(1%牛血清白蛋白(sigma,目录号a7906),0.5%的lutrol(basfcat.s30101)在溶解于7mm的磷酸氢二钠、1mm的kh2po4、2.7mm的氯化钾中,ph7.3)。以20,5,1ng/ml,200,50,25,10pg/ml(孔中的最终浓度)制备std曲线。加入空白样本溶液(std0,只有缓冲液)。捕获试剂,生物素标记的f44,以0.1mg/ml的浓度使用。检测试剂,alexa-647标记的f05,以rexxipf缓冲液(gyros,p0004825)稀释至25nm的浓度使用。结果结果表明,最好的缓冲液是rexxiphn,这种商业试剂含有中和嗜异性抗体的试剂,并具有较高的离子强度,适合于带正电荷的分析物,例如sprifermin。与其他曲线相比,以rexxiphn制备的标准曲线具有较好的准确度(见表5)和精度(见表4)。表4:缓冲液选择实验的结果。avgrlu:三次重复实验的平均响应,cv%:三次重复实验的精度。下划线:超出接受标准(±20%)的%cv。表5:缓冲液选择实验的结果。avgbcc:三次重复实验的平均反算浓度,%bias:bcc的准确度。使用xlfit(idbs)logisticautoestimate加权1/y2获得标准曲线回归。公式201。下划线:超出接受标准(±20%)的%bias。3.3最小所需稀释度(mrd)在缓冲液中优化了所述方法后,将其转用到基质中。为了这个目的,在gyrolab技术步骤后进行了一个实验。使用在rexxiphn中制作的标准曲线来定量在合并人滑液(seralaboratoriesinternational)中制备的分析物,所述分析物的浓度为:0.5,1,2,5和10ng/ml,并分别按以下比例稀释:1:5,1:10,1:20,1:50,1:100。同时,以同样的方式处理空白基质,然后进行测试。结果为了确定样本测试将应用的mrd,对照在rexxiphn中制作的标准曲线对在合并人滑液中制备的样本进行分析。在使用滑液的第一个实验中发现,基质非常粘稠并且难以移液。另外,由于高粘度也可能会导致针头凝结。由于这些原因,确定mrd的实验的结果在准确度和精度方面并不令人满意:1:10稀释液的%cv很高(见表6和图9),低mrd(1:5和1:10)的%bias是可接受的,但高度稀释液的%bias则不是。由于这个原因,决定在mrd之前增加预处理基质的步骤,以改善滑液的处理。加料滑液池(最终浓度100pg/ml)(接受标准:%bias±20%)mrd1:5mrd1:10mrd1:20mrd1:50mrd1:100avgbccpg/ml112.0115.9128.7123.7127.7%bias12.015.928.723.727.7%cv5.425.62.51.27.1空白滑液池,接受标准:全部bqlmrd1:5mrd1:10mrd1:20mrd1:50mrd1:100复制品1bccpg/mlbql13.444.8bql11复制品2bccpg/ml1010.830.1bqlbql复制品3bccpg/mlbql11.634.5bqlbql表6:mrd实验的结果。avgbcc:三次重复实验的平均反算浓度,%bias:bcc的准确度。cv%:三次重复实验的精度。bql=低于定量下限。使用xlfit(idbs)logisticautoestimate加权1/y2获得标准曲线回归。公式201。下划线:超出接受标准(±20%)的结果。3.4.基质预处理为了降低基质的粘度,设定了离心步骤和透明质酸酶消化步骤。3.4.1.透明质酸酶消化透明质酸酶(牛睾丸型透明质酸酶,sigma,h3506)的储备液在含有0.01%bsa的pbs中稀释到200和2μg/ml。将这些溶液加入到三个样本中:1)空白滑液,2)加入1000pg/ml分析物的滑液(最终浓度100pg/ml),3)加入200pg/ml分析物的滑液(最终浓度40pg/ml)。在室温下摇床培养这些样本30分钟。培养结束时,将样本在rexxiphn中以1:5或1:10稀释,并按照3.1段中所述的步骤进行分析。结果如表7所示,用透明质酸酶消化滑液后,空白和加料样本都仅在1:5的稀释液中获得了改善的结果。在所测试的两种浓度的透明质酸酶中,效果最好的是10μg/ml的。该处理步骤所得的加料样本的%bias非常低,但真正的改进是空白样本的结果,与上一个实验的结果(见表6)不同,几乎所有经处理的样本的结果都是bql。表7:滑液消化实验的结果。0.01%bsa=没有用透明质酸酶处理的样本,透明质酸酶0.1μg/ml=用低浓度透明质酸酶处理的样本,透明质酸酶10μg/ml=用高浓度透明质酸酶处理的样本。avgbcc:三次重复实验的平均反算浓度,%bias:bcc的准确度。bql=低于定量下限。使用xlfit(idbs)logisticautoestimate加权1/y2获得标准曲线回归。公式201。下划线:超出接受标准(±20%)的结果。3.4.2.离心使用合并人滑液制备了三种含有分析物的加料样本,浓度为75,2.5和0.15ng/ml(孔中最终浓度分别为15000,500和30pg/ml),在13000rpm下离心两次,每次5分钟。离心之后,在rexxiphn中以1:5稀释样本,并使用在rexxiphn缓冲液(gyros,p0004996)中以20,10,5,1ng/ml,200,50,20pg/ml(孔中的最终浓度)制作的标准曲线进行分析。加入空白样本(std0,仅rexxiphn)。以相同的方式处理空白基质。按照alphalisa技术步骤进行实验。结果如表8所示,离心步骤没有改善所选择的mrd1:5后分析的加料样本的%bias。所有的样本都被高估,但是,与只用透明质酸酶处理的样本相比,离心后的样本较容易处理。因此,决定将两个预处理步骤相结合。空白滑液ss30pg/mlss500pg/mlss15000pg/mlbql34.1748alq复制品1bccpg/mlbql53.4723alq复制品2bccpg/mlbql44.3931alq复制品3bccpg/mln.a.43.9800.7n.a.avgbccpg/mln.a.46.460.1n.a.%bias表8:滑液离心实验的结果。avgbcc:三次重复实验的平均反算浓度,%bias:bcc的准确度。bql=低于定量下限。alq=高于定量上限。使用xlfit(idbs)logisticautoestimate加权1/y2获得标准曲线回归。公式201。3.4.3.透明质酸酶消化+离心使用合并人滑液制备了浓度为75,2.5和0.15ng/ml(孔中最终浓度分别为15000,500和30pg/ml)的三种加料样本以及一个空白样本,并在13000rpm下离心两次,每次5分钟。将溶于含有0.01%bsa的pbs中的200μg/ml透明质酸酶溶液用所述加料样本以1:20稀释,并在室温下摇床培育30分钟。培养结束时,在rexxiphn中以1:5稀释样本,并使用在rexxiphn缓冲液(gyros,p0004996)中以20,10,5,1ng/ml,200,50,20pg/ml(孔中的最终浓度)制作的标准曲线进行分析。加入空白样本(std0,仅rexxiphn)。以相同的方式处理空白基质。按照alphalisa技术步骤进行实验。结果离心加酶消化的组合在所测试的所有浓度下都得到了较好的结果,除了无法定量的低ss(低于20pg/ml,这是标准曲线中最低的点;见表9)。因此,所选的预处理步骤如下:-将样本在13000rpm下离心两次,每次5分钟;-透明质酸酶消化:以10μg/ml透明质酸酶在室温下摇床培养30分钟-在rexxiphn中mrd1:5空白滑液ss30pg/mlss500pg/mlss15000pg/mlbqlbql58518100复制品1bccpg/mlbqlbql60213500复制品2bccpg/mlbqlbql56116500复制品3bccpg/mln.a.n.a.58316033avgbccpg/mln.a.n.a.16.56.9%bias表9:滑液双重处理实验的结果。avgbcc:三次重复实验的平均反算浓度,%bias:bcc的准确度。bql=低于定量下限。使用xlfit(idbs)logisticautoestimate加权1/y2获得标准曲线回归。公式201。3.4.4.预处理对分析物的影响以150,1500和75,000皮克/ml(最终浓度分别为30,300,15,000pg/ml)的浓度在缓冲液中配制三个质量对照。将所配制的溶液的一半在rexxiphn中以1:5稀释,而另一半在22℃下与10μg/ml的透明质酸酶培育30分钟。结果为了验证样本预处理会否损害sprifermin,对三个质量对照在进行或不进行样本预处理的情况下进行了分析。结果表明,透明质酸酶消化不影响分析物,进行和未进行预处理的qc具有类似的rlu。(见表10和图10)表10:实验结果。在rexxiphn中制备的三种浓度水平的质量对照样本进行(经处理)或未进行(未处理)透明质酸酶消化的rlu(qc-低=30μg/ml,qc-中=500pg/ml,qc-高=15000μg/ml)。3.4.5基质预处理:优化和选择性评价评估方法的选择性的实验使用9个个体人滑液样本进行。在pbs0.01%bsa中制备浓度为400μg/ml的透明质酸酶的储备液,并加入(1:20稀释)到所述9个个体滑液样本中。将样本在室温下摇床培育30分钟,然后在13000rpm下离心两次,每次5分钟。基质预处理后,将浓度为100pg/ml(lloq)的sprifermin加入到所述9个样本中的每一个中,并按照alphalisa技术步骤在rexxiphn中以1:5稀释。结果在测试了一些个体人滑液样本后,决定将透明质酸酶的浓度提高到20μg/ml,并推迟离心步骤。这样做是因为,并不是所有来自不同个体的滑液都变得清澈(数据未显示)。如表11所示,10个样本中有9个的平均%bias在±25%以内。选择性的接受标准是:以lloq浓度加料的个体样本中至少80%必须具有±25%的%bias。因此实验结果满足接受标准。表11:实验结果。bcc=以lloq浓度(100pg/ml,最终浓度20pg/ml)加料的个体滑液样本的三次重复实验的平均反算浓度。%bias:bcc的准确度。%cv:bcc的精度。红色:超出接受标准(±20%)的%cv或%bias。3.5.残留评估及gyrolab方法优化为了评估残留效应的存在,使用定制方法“bioaffy1000v1modwash”并加入洗涤溶液2(ws2:20%乙醇中的1.5mnacl)进行定制实验。制备以下试剂:1)将sprifermin用rexxiphn稀释至以下浓度以制备标准曲线:20,10,5,1ng/ml,200,50,20pg/ml;2)rexxiphn中的浓度为20ng/ml的qc;3)仅用rexxiphn制备的空白样本。实验设定为8个针中的每一个装载:1.空白样本;2.一个标准曲线点;3.20ng/ml的qc样本;4.最后加入空白样本。捕获和检测试剂按已设定的浓度使用。结果由于gyrolab是机器人系统,其中,样本是使用一组固定的针处理的,因此,必须进行一个特定的评估,以排除残留效应的可能性。为此目的,设定了一个实验,将每个针装载空白样本、然后装载高浓度的std、然后再次装载空白样本。装载高浓度qc之前和之后的所有空白样本都给出了低于定量下限的结果(见表12),但在装载高浓度qc之前和之后的平均响应有所增加,表明可能存在残留效应,虽然该效应程度轻微。表12:残留评估的结果。报告了每个针中的前空白样本、高浓度qc和后空白样本的rlu。表中列出每个样本的平均数据。定量下限的std.1rlu为0.655。下划线:超出接受标准。3.5.1.对lloq样本的影响为了评估上一个实验中观察到的轻微残留会否影响lloq浓度的样本,将空白样本替换为lloq浓度(100pg/ml,孔中最终浓度20pg/ml)的合并滑液加料样本,进行同样的评估。实验设定为8个针中的每一个装载:1.首先装载lloq样本;2.一个标准曲线点;3.20ng/ml的qc样本;4.最后加入lloq样本。使用与上一个实验中相同的方法测试装载高浓度样本之前和之后的lloq样本,并评估稍微改变了针洗涤步骤的改良方法。在加入分析物的步骤之前及之后,加入用ws2溶液洗针的额外步骤。此外,在加入分析物的步骤中,增加额外的洗涤步骤,该改良方法命名为“bioaffy1000washstation2v2beta1”。结果为了更好地理解残留效应对样本的影响,将空白样本替换为含有lloq浓度的分析物的样本,重复同样的评估。实验结果发现对浓度较低的样本有实际影响,见表13,表明确实有可能存在残留效应。表13:残留评估的结果。报告了每个针中的前lloq和后lloq的反算浓度(pg/ml)。表中列出每个样本的平均数据。浓度的接受标准是75至125pg/ml。下划线:超出接受标准(100±25%)的浓度。表14:残留评估的结果。报告了每个针中的前lloq和后lloq的反算浓度(pg/ml)。表中列出每个样本的平均数据。浓度的接受标准是75至125pg/ml。下划线:超出接受标准(100±25%)的浓度。相反,在改进了针洗涤过程后,对低浓度样本的影响是非常有限的(见表14),证实了优化的方法能够准确地量化浓度非常低的真实滑液样本。3.6.最终的方法3.6.1.概述针对sprifermin的生物素化的小鼠单克隆抗体用作捕获试剂(f44),针对sprifermin的alexafluor-647标记的单克隆抗体用作检测试剂(f05)。在rexxiphn中制备校准标准和质量对照。未知样本在rexxiphn中以1:5最小稀释度预处理后进行分析。方法范围是从150pg/ml至50'000pg/ml,并且进一步延伸至9.6μg/ml,使用rexxiphn稀释。校准曲线点:10'000,5'000,1000,200,100,50,30,0pg/ml。质量对照:qc-h:7'000pg/ml,qc-m:500pg/ml,qc-l:90pg/ml。3.6.2.未知样本的预处理:用20μg/ml的透明质酸酶溶液处理未知样本。将透明质酸酶加入到未知样本中(例如,将2μl的400μg/ml透明质酸酶加入到38μl未知样本中),振荡,并在22℃下摇床培育30分钟。使用minispin离心机将未知样本以13000rpm离心10分钟。用rexxiphn以1:5稀释已处理的未知样本,然后进行分析(例如4μl未知样本+16μlrexxiphn)。3.6.3.抗体的制备在使用前,包被抗体必须在pbs-t中稀释至0.1mg/ml的。检测抗体必须在rexxipf中稀释至20nm并保持避光。3.6.4.步骤1.在进行分析之前,使所有试剂处于室温下。2.将gyrolab设定为待机模式,关闭gyrolab控制软件和仪器,并用milliq水对内部洗涤台进行清洗。3.开启仪器和gyrolab控制软件,按照用户指南中的描述,初始化和并用pbs-t准备系统。4.按照用户指南中的描述,每周一次使用ws2进行针脱附。5.将ws2溶液连接到洗涤台2,并按照用户指南中的描述准备系统。6.使用3步向导方法“bioaffy1000pbtm-087_pmt5”创建一个新的运行。校准标准和质量对照必须重复测定三次,而样本则只测定一次。7.根据gyrolab对照装载清单,将校准标准、质量对照、未知样本、捕获和检测抗体以及洗涤缓冲液加入到微板中。用微板盖上盖避光。8.根据仪器辅助装载程序的要求装载微板和cd,并开始运行。使用每个std溶液的三次重复。回归分析不包括std-0。使用每个校准标准的每个重复测定的仪器响应,用logistic方程(自动估计,加权因子1/y2)拟合标准曲线。如果有证据表明,某些未知样本的浓度高于定量上限(50,000皮克/ml),可以在分析前稀释这些样本。使用rexxiphn以最小稀释(1:5)对初始样本进行稀释。但应当对稀释过程进行记录。如果实际样本浓度低于该方法的定量下限(150pg/ml),将被报告为低于定量下限(bql)。序列表<110>阿雷斯贸易股份有限公司<120>用于高正电荷蛋白的免疫测定法<130>p15/008<150>ep15153117.5<151>29.01.2015<160>2<170>patentinversion3.5<210>1<211>207<212>prt<213>智人(homosapiens)<220><223>人fgf-18<400>1mettyrseralaproseralacysthrcysleucysleuhispheleu151015leuleucyspheglnvalglnvalleuvalalaglugluasnvalasp202530pheargilehisvalgluasnglnthrargalaargaspaspvalser354045arglysglnleuargleutyrglnleutyrserargthrserglylys505560hisileglnvalleuglyargargileseralaargglygluaspgly65707580asplystyralaglnleuleuvalgluthraspthrpheglysergln859095valargilelysglylysgluthrgluphetyrleucysmetasnarg100105110lysglylysleuvalglylysproaspglythrserlysglucysval115120125pheileglulysvalleugluasnasntyrthralaleumetserala130135140lystyrserglytrptyrvalglyphethrlyslysglyargproarg145150155160lysglyprolysthrarggluasnglnglnaspvalhisphemetlys165170175argtyrprolysglyglnprogluleuglnlysprophelystyrthr180185190thrvalthrlysargserargargileargprothrhisproala195200205<210>2<211>170<212>prt<213>人工序列<220><223>重组截短fgf-18(sprifermin)<400>2metglugluasnvalasppheargilehisvalgluasnglnthrarg151015alaargaspaspvalserarglysglnleuargleutyrglnleutyr202530serargthrserglylyshisileglnvalleuglyargargileser354045alaargglygluaspglyasplystyralaglnleuleuvalgluthr505560aspthrpheglyserglnvalargilelysglylysgluthrgluphe65707580tyrleucysmetasnarglysglylysleuvalglylysproaspgly859095thrserlysglucysvalpheileglulysvalleugluasnasntyr100105110thralaleumetseralalystyrserglytrptyrvalglyphethr115120125lyslysglyargproarglysglyprolysthrarggluasnglngln130135140aspvalhisphemetlysargtyrprolysglyglnprogluleugln145150155160lysprophelystyrthrthrvalthrlys165170当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1