利用表面选择性非线性光学技术确定蛋白质结构的方法与流程
交叉引用
本申请要求2015年4月2日提交的美国临时申请号62/142,314的权益,也要求2015年4月16日提交的美国临时申请号62/148,649的权益,两份申请均通过全文引用而并入本文。
背景技术:
二次谐波发生(secondharmonicgeneration,shg)是一种非线性光学过程,其可以被配置为能够利用附接至靶分子的二次谐波活性标签来检测蛋白质和其他生物靶标的结合相互作用和构象变化的表面选择性检测技术(参见,例如美国专利号6,953,694和8,497,073)。迄今为止,这些方法已经用于检测多种系统中配体诱导的构象变化,并通过它们在结合时诱导的构象的类型来区分配体(salafsky,j.s.(2001),“’shg-labels’fordetectionofmoleculesbysecondharmonicgeneration”,chemicalphysicsletters342,485-491;salafsky,j.s.(2003),“second-harmonicgenerationasaprobeofconformationalchangeinmolecules”,chemicalphysicsletters381,705-709;salafsky,j.s.(2006),“detectionofproteinconformationalchangebyopticalsecond-harmonicgeneration”,journalofchemicalphysics125;moree,b.等人(2015),“smallmoleculesdetectedbysecondharmonicgenerationmodulatetheconformationofmonomericα-synucleinandreuceitsaggregationincells”,j.boil.chem.290(46);27582-27593;moree等人(2015),“proteinconformationalchangesaredetectedandresolvedsitespecificallybysecond-harmonicgeneration”,biophys.j.109:806-815)。实例包括区分i型与ii型激酶抑制剂,如伊马替尼和达沙替尼,它们分别与蛋白质结合以诱导失活和活性构象。
shg和相关的技术和频发生(sum-frequencygeneration,sfg)在过去已经被用于研究染料分子在界面处的取向(heinzt.等人(1983),“determinationofmolecularorientationofmonolayeradsorbatesbyopticalsecond-harmonicgeneration”,physicalreviewa28(3):1883-1885;heinz,t,(1991)second-ordernonlinearopticaleffectsatsurfacesandinterfaces”,nonlinearsurfaceelectromagneticphenomena(stegeman,h.p.a.g.ed.),elsevier,amsterdam,pp353-416)。在这些测量中,使用偏振光来确定经标记界面的非线性极化率(χ(2))的分量。然后可以使用χ(2)的实验测定值和关于界面平面内染料分子的取向程度的假设、分子参照系中染料分子的超极化率(α(2))的分量的相对值等来推断界面处染料分子的分子取向分布的细节。
蛋白质和生物分子结构测定领域非常成熟,但仍需要实时地与在溶液中对构象变化和结构进行灵敏地和快速地测量。关于蛋白质结构和动力学的大多数信息主要来自于x-射线晶体学和nmr研究,但是这些技术相当耗费人力及物力,速度慢,或仅提供蛋白质结构的静态快照。
本发明所公开的利用表面选择性非线性光学技术测定蛋白质结构的方法、装置和系统解决了这些未满足的需求。在一些实施方式中,通过使用针对用于递送激发光的光学系统的新颖装置设计和机制以快速、精确且可互换地定位基底(包含待分析的拴系或固定的生物靶标)能够实现高通量形式的蛋白质结构测定,其同时确保激发光与基底表面之间保持有效的光耦合。用于生物样品的高通量光学探查的一种优选形式为玻璃底微孔板。本文公开的系统和方法提供了以与高通量分析系统要求相一致的方式通过全内反射,将shg和其他非线性光学技术所需的高强度激发光耦合到基底(例如,玻璃底微孔板中的玻璃基底)的机制。
技术实现要素:
本文公开了用于确定溶液中的蛋白质结构的方法,该方法包括:(a)在第一组实验条件下将蛋白质分子拴系至(tetheringto)表面,其中所述蛋白质分子在一个或多个已知位置用一个或多个非线性活性标签予以标记;(b)用至少一个基频的激发光照射步骤(a)中拴系的蛋白质分子,其中所述激发光由至少一个光源提供;(c)检测由于步骤(b)中的照射而由所述一个或多个非线性活性标签所产生的光的第一物理性质;(d)在至少第二组实验条件下将该蛋白质分子拴系在表面上;(e)用至少一个基频的激发光照射步骤(d)中拴系的蛋白质分子;(f)检测由于步骤(e)中的照射而由所述一个或多个非线性活性标签产生的光的至少第二物理性质;以及(g)将步骤(f)中所检测的光的所述至少第二物理性质与步骤(c)中所检测的光的所述第一物理性质进行比较,以确定拴系的蛋白质分子中所述一个或多个非线性活性标签的相对取向。
在一些实施方式中,所述方法进一步包括将关于所述一个或多个非线性活性标签的相对取向的数据全面地拟合至所述蛋白质分子的结构模型,其中所述结构模型基于所述一个或多个非线性活性标签在该蛋白质分子内的已知位置。
在一些实施方式中,所述方法进一步包括针对至少两个不同的非线性活性标签-蛋白质缀合物(conjugate)重复步骤(a)至(f),其中所述非线性活性标签与该蛋白质分子上至少两个不同的位点附接。在一些实施方式中,所述至少两个非线性活性标签-蛋白质缀合物各自包含单位点半胱氨酸。在一些实施方式中,所述非线性活性标签是非线性活性非天然氨基酸。在一些实施方式中,光的所述至少第二物理性质不同于光的所述第一物理性质。在一些实施方式中,光的所述第一物理性质和所述至少第二物理性质具有相同的偏振,但具有不同的大小或强度。在一些实施方式中,光的所述第一物理性质和所述至少第二物理性质具有不同的偏振。在一些实施方式中,所述非线性活性非天然氨基酸是萘的衍生物或aladan。在一些实施方式中,所述方法进一步包括将关于所述蛋白质的x射线晶体学数据(crystallographicdata)并入到该蛋白质分子的结构模型中。在一些实施方式中,所述蛋白质分子在两个或更多个已知位置处被标记。在一些实施方式中,所述蛋白质分子在三个或更多个已知位置处被标记。
在一些实施方式中,针对至少第三组实验条件重复步骤(d)至(f)。在一些实施方式中,针对至少第四组实验条件重复步骤(d)至(f)。在一些实施方式中,所述第一组实验条件包括将第一电场强度的第一电场施加到所述拴系的蛋白质分子上,并且所述至少第二组实验条件包括将至少第二电场强度的至少第二电场施加到所述拴系的蛋白质分子上。在一些实施方式中,所述第一电场和所述至少第二电场是直流(dc)场。在一些实施方式中,所述第一电场和所述至少第二电场是交流(ac)场。在一些实施方式中,所述第一电场是直流(dc)场,并且所述至少第二电场是交流(ac)场。在一些实施方式中,所述第一电场是交流(ac)场,并且所述至少第二电场是直流(dc)场。在一些实施方式中,利用在表面上装配的电极阵列来施加所述第一电场和所述至少第二电场。在一些实施方式中,所述电极阵列是如图9所示的圆形阵列。
在一些实施方式中,所述第一组实验条件包括使用与n-端附接的his标记物来拴系所述蛋白质分子,并且所述至少第二组实验条件包括使用与c-端附接的his标记物来拴系所述蛋白质分子。在一些实施方式中,所述第一组实验条件包括使用选自2xhis、4xhis、6xhis、8xhis、10xhis、12xhis和14xhis的第一his标记物来拴系所述蛋白质分子,并且所述至少第二组实验条件包括使用与所述第一his标记物长度不同的至少第二his标记物来拴系所述蛋白质分子。
在一些实施方式中,所述第一组实验条件包括使用第一测定缓冲液来拴系所述蛋白质分子,并且所述至少第二组实验条件包括使用与所述第一测定缓冲液不同的至少第二测定缓冲液来拴系所述蛋白质分子。在一些实施方式中,所述第一测定缓冲液与所述至少第二测定缓冲液之间的差异选自离子强度、ph、去污剂浓度、钙离子(ca2+)浓度、镁离子(mg2+)浓度、聚乙二醇浓度及其任何组合。
在一些实施方式中,所述第一组实验条件与所述至少第二组实验条件之间的差异包括将所述拴系的蛋白质分子与已知结合所述蛋白质分子并诱导其构象变化的至少第一配体相接触。
在一些实施方式中,位于所述一个或多个已知位置的所述一个或多个非线性活性标签是相同的。在一些实施方式中,位于所述一个或多个已知位置的所述一个或多个非线性活性标签是不同的。在一些实施方式中,所述一个或多个非线性活性标签是二次谐波(sh)活性标签。在一些实施方式中,所述一个或多个非线性活性标签是和频(sf)活性标签。在一些实施方式中,所述一个或多个非线性活性标签是差频(df)活性标签。
在一些实施方式中,所述照射步骤包括调节至少一个基频的激发光的偏振。在一些实施方式中,步骤(c)和(e)中的检测包括调节由所述一个或多个非线性活性标签产生的、到达检测器的光的偏振。在一些实施方式中,光的所述第一物理性质和至少第二物理性质是强度或偏振。
本文还公开了用于确定与拴系的蛋白质附接的非线性活性标签的绝对取向的方法,所述方法包括:(a)检测由于用至少一个基频的激发光照射而由非线性活性表面产生的光的物理性质,其中使用所述激发光的两种不同的偏振状态来进行检测;(b)检测以定向方式拴系在未经标记表面的非线性活性标记的蛋白质所产生的光的物理性质,其中所述光是由于用至少一个基频的激发光照射而产生的,并且其中使用所述激发光的两种不同的偏振状态来进行检测;(c)检测以定向方式拴系在非线性活性标记表面的非线性活性标记蛋白质所产生的光的物理性质,其中所述光是由于用至少一个基频的激发光照射而产生的,并且其中使用所述激发光的两种不同的偏振状态来进行检测;以及(d)通过将步骤(a)中所述光的物理性质、步骤(b)中所检测的光的物理性质与步骤(c)中所检测的光的物理性质进行比较,来确定附接至所述拴系的蛋白质的非线性活性标签的绝对取向。
在一些实施方式中,所述激发光以其从所述表面全内反射的方式被引导至该表面。在一些实施方式中,所述激发光的第一偏振状态包含相对于其入射平面的p-偏振,并且所述激发光的第二偏振状态包含相对于其入射平面的s-偏振。在一些实施方式中,所述方法进一步包括使用多于两种不同偏振状态的激发光来检测步骤(a)、(b)和(c)中产生的光的物理性质。
在一些实施方式中,所述非线性活性标记的表面是使用羧化非线性活性标签与氨基硅烷官能化的玻璃基底表面的共价碳二亚胺偶合来制备的。在一些实施方式中,所述非线性活性标记的表面包含受支承脂双层,并且其中所述受支承脂双层进一步包含与非线性活性标签共价偶合的含有胺或硫醇的脂质。
在一些实施方式中,使用所述蛋白质的c-端与氨基硅烷官能化的玻璃基底表面的共价碳二亚胺偶合来将所述非线性活性标记的蛋白质以定向方式拴系在所述未标记的或非线性活性标记的表面上。在一些实施方式中,将所述非线性活性标记的蛋白质以定向方式拴系在包含受支承脂双层的未标记的或非线性活性标记的表面上,并且其中所述非线性活性标记的蛋白质插入到所述受支承脂双层中或附接至插入到所述受支承脂双层的锚分子上。
在一些实施方式中,所述非线性活性标签为二次谐波(sh)活性标签。在一些实施方式中,所述非线性活性标签为和频(sf)活性标签。在一些实施方式中,所述非线性活性标签为差频(df)活性标签。
本文公开了装置,其包括:(a)基底,其包含第一表面,所述第一表面进一步包含多个非连续区域,其中每个非连续区域进一步包含受支承脂双层和图案化的电极阵列;和(b)与所述基底的第一表面结合或集成的孔形成组件,使得每个非连续区域均包含在单个孔内。
在一些实施方式中,多个受支承脂双层进一步包含非线性活性标记的蛋白质。在一些实施方式中,所述多个受支承脂双层进一步包含每个均相同的非线性活性蛋白质。在一些实施方式中,所述多个受支承脂双层进一步包含受支承脂双层的两个或更多个子集,并且其中受支承脂双层的每个子集均包含不同的非线性活性蛋白质。在一些实施方式中,所述基底由选自玻璃、熔融石英、聚合物或其任何组合的光学透明材料制成。在一些实施方式中,所述图案化的电极阵列包含围绕所述受支承脂双层、在所述基底表面上图案化的两个或更多个电极的阵列。在一些实施方式中,所述图案化的电极阵列包含在所述孔形成单元的每个孔的壁上图案化的两个或更多个电极的阵列。在一些实施方式中,所述图案化的电极阵列包含在密封每个孔的盖上图案化的至少一个电极。在一些实施方式中,所述孔形成单元包含96个孔。在一些实施方式中,所述孔形成单元包含384个孔。在一些实施方式中,所述孔形成单元包含1,536个孔。在一些实施方式中,所述装置进一步包含棱镜阵列,该棱镜阵列与所述基底的第二表面集成且被配置用于将激发光递送至所述基底的第一表面,使得其从所述第一表面全内反射。
援引并入
本说明书中提到的所有出版物、专利及专利申请均通过引用以其全文并入本文,其程度如同特别地且单独地指出每个单独的出版物、专利或专利申请均通过引用以其全文而并入。如果本文的术语与并入的参考文献中的术语之间存在冲突,则以本文的术语为准。
附图说明
本发明的新颖特征在所附的权利要求书中具体阐述。通过参考以下对其中利用了本发明原理的说明性实施方式加以阐述的详细描述以及附图,将获得对本发明的特征和优点的更好的理解,在附图中:
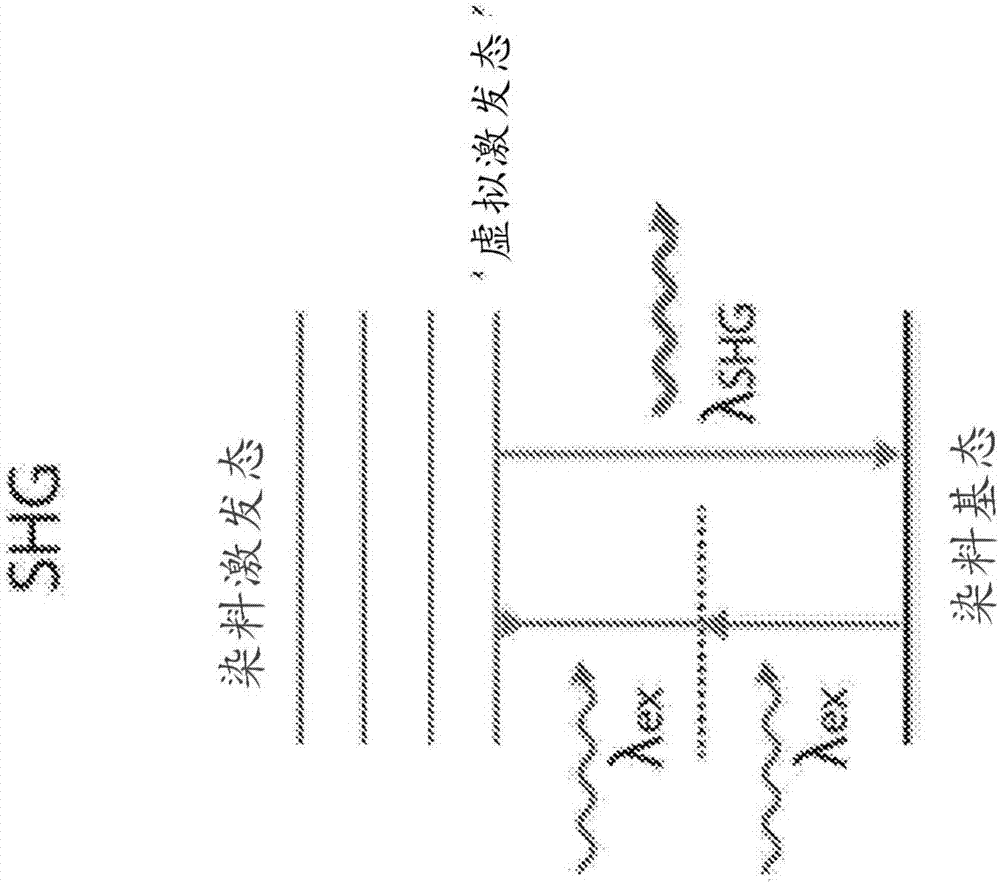
图1a提供了荧光(吸收/发射过程)的能级图的示意图示。
图1b提供了二次谐波发生(双光子散射过程)的能级图的示意图示。
图2提供了由配体的结合诱导的蛋白质(用非线性活性部分标记)的构象变化的示意图示,以及该构象变化对非线性活性标签相对于该蛋白质所附接到的光学界面(z轴)的取向的影响。
图3图示了实验室参照系(由x、y和z轴定义)与分子参照系(由x’、y’和z’轴定义)之间的关系。对于一些非线性活性分子,超极化率张量(α(2))可以由分子参照系中的单分量来控制,即α(2)=α(2)z’z’z’。
图4图示了用于根据非线性光学检测来测定生物分子(例如蛋白质或其他生物实体)的结构或构象变化的高通量分析系统的系统架构的一个非限制性示例。
图5示出了用于利用非线性光学检测对生物分子的结构或构象变化进行分析的光学设置的一个非限制性示例的示意图。
图6示出了描绘利用棱镜来以适当的入射角引导激发光从而使激发光在基底的顶表面经历全内反射的示意图示。向棱镜右侧的两条虚线指示出反射的激发光的光路以及当非线性活性物质拴系到基底表面时在该基底表面生成的非线性光信号。基底可选地连接到x-y平移台的致动器,以便在测量之间重新定位。棱镜的顶表面与基底的底表面之间的曲线指示出用于确保棱镜与基底之间的高光耦合效率的折射率匹配流体薄层(未按比例绘制)的存在。
图7示出了描绘利用附接到或邻近于透明基底(在本实例中配置成微孔板形式)的下表面的折射率匹配弹性体材料层来确保棱镜与基底上表面之间的高光耦合效率的示意图示。在该方法的一些实施方式中,棱镜的上表面呈略微圆拱,以便在使微孔板与棱镜相接触时集中压力,从而减少或消除棱镜与弹性体材料之间的气隙形成。
图8提供了用于使用表面选择性非线性光学技术来进行高通量结构确定的装置的一个非限制性示例的示意图,其中与玻璃底微板形式的基底结合或集成的半球形棱镜阵列用于提供激发光与基底顶表面的良好光耦合。
图9提供了包含围绕用于形成受支承脂双层的基底表面区域的图案化电极阵列的装置的一个非限制性示例的示意图。
图10a-图10b图示了具有用于提供激发光与基底顶表面的良好光耦合的集成式棱镜阵列的微孔板。这样的装置对进行蛋白质和其他生物分子的高通量结构确定可能是有用的。图10a:顶轴侧视图。图10b:底轴侧视图。
图11a-图11b示出了图10a-图10b中所示的微孔板装置的分解图。图11a:顶轴侧视图。图11b:底轴侧视图。
图12图示了利用图10a-图10b中图示的设计概念经由全内反射而将激发光耦合到基底表面的入射光路和出射光路。
图13a-图13b示出了针对拴系到光学界面的蛋白质分子(二氢叶酸还原酶(dhfr))的半胱氨酸标记的突变体所观察到的shg信号强度的数据示例。图13a:针对通过n-端his-标记物拴系到ni/nta掺杂的受支承脂双层的半胱氨酸标记的dhfr突变体的数据。图13b:针对通过c-端his-标记物拴系到ni/nta掺杂的受支承脂双层的半胱氨酸标记的dhfr突变体的数据。
图14a-图14b示出了针对在添加已知配体(甲氧苄氨嘧啶(tmp))后,拴系到光学界面的蛋白质分子(二氢叶酸还原酶(dhfr))的半胱氨酸标记的突变体所观察到的shg信号强度的百分比变化的数据示例。图14a:针对通过n-端his-标记物拴系到ni/nta掺杂的受支承脂双层的半胱氨酸标记的dhfr突变体的数据。图14b:通过c-端his-标记物拴系到ni/nta掺杂的受支承脂双层的半胱氨酸标记的dhfr突变体的数据。
图15图示了经配置用于控制本文公开的系统的操作的计算机系统。
图16是图示可结合本发明示例实施方式使用的计算机系统的第一示例架构的框图。
图17是示出一个具有多个计算机系统、多个蜂窝电话和个人数字助理以及网络附加存储(nas)的网络实施方式的视图。
图18是根据示例实施方式,利用共享虚拟地址存储器空间的多处理器计算机系统的框图。
具体实施方式
本文公开的系统和方法涉及生物分子结构和动力学测定领域。本文描述了用于确定附接至蛋白质或其他生物分子的二次谐波活性标签(或其他非线性活性标签,例如和频活性或差频活性标签)的相对和/或绝对取向,以及由其确定分子结构的方法。此外,描述了适用于分子取向或分子结构高通量分析的装置和系统。在本公开内容的一些方面,描述了响应于使生物实体与一种或多种测试实体相接触而确定该生物实体的取向、构象、结构或者取向变化、构象变化或结构变化的方法和系统。如本文所用,确定取向、构象、结构或其变化可涉及与非线性活性标签或标记物的平均取向相关和/或与之成比例的非线性光信号测量。如本文所用,“高通量”是指针对可选地与一种或多种测试实体相接触的多个生物实体进行分子取向、构象、结构或其变化的快速分析能力,或者是指针对可选地与大量测试实体相接触的一种或多种生物实体进行分子取向、构象、结构或其变化的快速分析能力,或者是指这两种模式的任意组合。
通常,所公开的方法、装置和系统依赖于使用二次谐波发生(secondharmonicgeneration,shg)或者相关的和频发生(sumfrequencygeneration,shg)或差频发生(differencefrequencygeneration,dfg)的非线性光学技术,用于确定分子取向、构象、结构或其变化。在这些方法中,偏振依赖性测量用于确定在表面或界面处定向并且根据本领域技术人员已知的方法用可超极化部分在一个或多个特定位点进行标记的蛋白质分子(或其他生物分子)的非线性极化率χ(2)的分量。进而,χ(2)的分量与整个模型的每个标记位点处的分子取向分布相关。通过在两组或更多不同组的实验条件(定义如下)下使用放置在蛋白质中的一个或多个不同位点的标签测量χ(2)的至少两个不同的分量,可以使用所得到的关于标签的相对取向的信息来开发蛋白质结构的模型,并使用shg或相关非线性光学技术检测其变化。
采用二次谐波发生的取向、构象和结构检测
与更广泛使用的基于荧光的技术(图1a)相比,二次谐波发生是一种非线性光学过程,其中同一激发波长或频率的两个光子与非线性材料相互作用,并作为具有激发光子的两倍能量(即,其两倍的频率和一半的波长)的单个光子进行重新发射(图1b)。二次谐波发生仅发生在缺乏反演对称性的非线性材料中(即,非中心对称材料中),并且需要高强度激发光源。这是和频发生的一种特殊情况,并且与诸如差频发生等其他非线性光学现象相关。在本公开内容通篇中,如本领域技术人员所理解的,术语shg、sfg和dfg可互换使用。
二次谐波发生和其他非线性光学技术可因其对非线性活性物质取向的依赖性而配置成表面选择性检测技术。例如,非线性活性物质向表面的拴系可以产生在分子能在溶液中经历自由扩散时所缺少的净平均取向度。常用于模拟非线性活性物质在界面处的取向依赖性的公式为:
χ(2)=ns<α(2)>
其中χ(2)是非线性极化率,ns是界面处每单位面积上非线性活性分子的总数,而<α(2)>是这些分子的非线性超极化率(α(2))的平均取向。shg的强度与非线性极化率的平方成比例,并且因此依赖于界面处定向的非线性活性物质的数目和其取向分布;其取向分布的变化,无论是空间的还是时间的,都会改变shg强度。
可以通过使用全内反射作为向非线性活性物质拴系或固定于其上的光学界面(或表面)递送激发光的模式来额外使得二次谐波发生和其他非线性光学技术成为表面选择性的。入射激发光的全内反射在界面处创造出“迅衰波”,其可以用于选择性地仅激发紧密靠近表面(即,迅衰波的空间衰减距离内,其通常为几十纳米级别)的非线性活性标签。全内反射还可以用于以表面选择性的方式来激发荧光,例如,激发附接到光学界面的荧光供体,该荧光供体继而经由荧光共振能量转移(fret)机制将能量转移到适宜的受体分子中。在本公开内容中,借助于激发光的全内反射生成的迅衰波优先用于激发非线性活性标签或分子。在本文描述的非线性活性过程中,对非线性活性物质的激发效率强烈依赖于其相对于表面的平均取向。例如,如果不存在非线性活性物质的净平均取向,则shg信号将不存在。
可以利用shg和其他非线性光学技术(例如,和频发生和差频发生)的这种表面选择性质来检测拴系于界面的生物分子的取向、构象、结构和其变化。例如,由于配体的结合而造成的受体分子的构象变化可采用非线性活性标签或部分来检测,其中该标签附接到或关联于所述受体,以便使构象变化引起相对于界面的取向的变化(图2),并从而导致非线性光信号的物理性质的变化(例如,信号强度或偏振的变化)。过去,由于相对较少的生物样品本身为非线性活性的,因此对表面选择性非线性光学技术的使用还主要局限于物理和化学应用上。最近,已经介绍了对二次谐波活性标签(“因此对标签”)的使用,从而事实上使得几乎任何分子或粒子均具有高非线性活性。这方面的第一个实例由使用噁唑染料标记蛋白细胞色素c并利用二次谐波发生来检测空气-水界面处的蛋白缀合物所证实(salafsky,j.,“`shg-labels'fordetectionofmoleculesbysecondharmonicgeneration”,chem.phys.lett.342(5-6):485-491(2001))。
表面选择性非线性光学技术也为相干技术,这意味着基本光束和非线性光束具有以明确定义的空间关系和相位关系通过空间传播的波前。采用表面选择性非线性光学检测技术分析生物分子或其他生物实体的结构和构象相比于其他光学方法具有许多固有优势,包括:i)非线性信号对非线性活性物质的取向的灵敏且直接的依赖性,从而赋予其对取向和构象变化的敏感性;(ii)比基于荧光的检测更高的信噪比(较低的背景),原因在于非线性光信号仅在形成非中心对称系统的表面处生成,即,该技术本身具有非常窄的“景深”;(iii)作为窄“景深”的结果,该技术在必须在含有游离(即未拴系至表面上)非线性活性物质的覆盖溶液的存在下进行测量时(例如,在结合过程可能被分离或冲洗步骤所消除或扰乱的情况下)有用。该技术的这一方面对于进行需要存在大块物体的平衡结合测量或者在限定时间段内进行测量的动力学测量可能特别有用;(iv)该技术表现出比荧光中发生的光漂白和加热效应更低的光漂白和加热效应,原因在于对于给定分子,双光子吸收截面通常远小于单光子吸收截面,并且shg(以及和频发生或差频发生)涉及散射而非吸收;(v)需要最少的收集光学器件并且预期信噪比较高,原因在于基本光束和非线性光束(例如,二次谐波光)相对于界面具有明确定义的传入和传出方向;这与基于荧光的检测相比特别有利,因为荧光发射是各向同性的,并且对于由焦平面外荧光物质产生的所检测信号可能还存在较大的荧光背景成分;(vi)由shg、sfg或dfg产生的信号提供了研究分子结构、构象或其变化(如发生,例如配体结合时)的即时、实时手段。在所公开的实时获得经历结构改变的蛋白质的实时“影片”作为其功能一部分的方法中,这种性质可能是非常有用的。
蛋白质结构的测定及动力学
偏振测量:可以使用至少一个基频的偏振激发光在实验室参照系中测量χ(2)的分量。一些光源,例如一些激光器,产生基本上偏振的基频光。在一些实施方式中,可以使用一个或多个光偏振器、波片等来进一步限定并且/或者调整激发光的偏振。通常,偏振光的入射面(即,由激发光的传播方向和垂直于基底平面或反射表面的矢量所定义的平面)将为图3所示的实验室坐标系的x-z平面。具有平行于入射平面的电场矢量的偏振光被称为p-偏振光。具有垂直于入射面的电场矢量的偏振光被称为s-偏振光。在一些实施方式中,还可以使用一个或多个光偏振器、波片等来限定和/或调整由非线性活性部分的激发所产生的已检测到的二次谐波光的偏振。如以上所概述的,通过在两组或更多不同组的实验条件下使用放置在以定向方式拴系或固定在光学界面(即,图3的表面平面)上的蛋白质中的一个或多个不同位点的标签测量χ(2)的至少两个不同的分量,可以使用所得到的关于标签的相对取向的信息来开发蛋白质结构的模型,并使用shg或相关的非线性光学技术来检测其变化。
用非线性活性部分标记的蛋白质:非线性活性标签与蛋白质的附接可以通过本领域技术人员公知的多种技术中的任何一种来完成。合适的标签附接技术的具体非限制性示例将在下面详细描述。
在一些实施方式中,一个或多个非线性活性标签可以附接至在同一单个蛋白质分子内的一个或多个不同的位置。在一些实施方式中,所述一个或多个非线性活性标签可以附接至在同一蛋白质的不同分子中的一个或多个不同的位置(例如位点),即形成包含不同版本的标记蛋白质的蛋白质家族。在一些实施方式中,蛋白质(或蛋白质家族)被标记的标记位点的数目可以是至少1个位点、至少2个位点、至少3个位点、至少4个位点、至少5个位点、至少6个位点、至少7个位点、至少8个位点、至少9个位点、至少10个位点或更多个位点。在其他实施方式中,所述非线性活性标签可以与相同蛋白质的不同单位点半胱氨酸突变体或变体附接,或者非线性活性的非天然氨基酸(例如,其他萘衍生物或aladan)可以与突变体或变体家族在一个或多个位点附接。这样的蛋白质可以是工程改造的、天然存在的、利用体外翻译方法制备的、在体内表达的以及通常通过本领域技术人员已知的各种方法中的任何一种创建的。
在一些实施方式中,所述shg测量可以包括使用由单个非线性活性标签标记的蛋白质分子。在一些实施方式中,所述shg测量可以包括使用由至少2个不同的非线性活性标签、至少3个不同的非线性活性标签、至少4个不同的非线性活性标签、至少5个不同的非线性活性标签、至少6个不同的非线性活性标签、至少7个不同的非线性活性标签、至少8个不同的非线性活性标签、至少9个不同的非线性活性标签或至少10个不同的非线性活性标签标记的蛋白质分子。
实验条件:如本文所定义的,“实验条件”是指测量shg或其他非线性光学信号的任何一组实验参数,其中由于潜在的分子取向分布的变化,这组实验条件中的一个或多个实验参数的变化会导致χ(2)测量值的变化。换句话说,不同组的实验条件产生不同的基线shg信号强度、不同的偏振依赖性、对相同配体结合事件的不同响应,或者前述的任何项或全部。例如,将电场施加到附接至受支承脂双层的蛋白质可改变分子潜在的取向分布,并因此可改变χ(2)测量值。可以用于定义实验条件组的实验参数的其他示例包括但不限于缓冲液条件如ph、离子强度、去污剂含量和浓度、拴系附接位点(例如,通过使用n-端或c-端his标记物)等。具体而言,在不同的和独立的实验条件组下所测量的χ(2)独立值允许人们在实验室参照系中获得潜在的分子取向分布(图3)。通过将这些不同的实验室系测量值彼此关联,可以确定位于蛋白质参照系中的两个或更多个不同标签位点处的非线性活性标签之间角度的相对差异,以及取向分布的其他参数,如用于模拟分子取向分布的高斯分布宽度。
在一些实施方式中,使用拴系标记的蛋白质的表面的一种或多种组成可以用于定义不同组的实验条件。例如,如果使用受支承脂双层拴系且定向标记的蛋白质,则可以使用所述双层(例如,具有不同的静电电荷密度或不同的摩尔脂质掺杂密度)的两种或更多种不同的脂质组成来创建相同蛋白质的两个或更多个不同的取向分布。例如,可以使用带有不同净电荷的头基的脂质(例如,两性离子的、正电荷的和负电荷的脂质头基)。在一些实施方式中,通过改变例如不同脂质组分的数目和/或其相对浓度来改变受支承脂双层的脂质组成可能是有利的。可以用于形成受支承脂双层或可以作为受支承脂双层的主要或次要组分插入的脂质分子的实例包括但不限于二酰基甘油、磷脂酸(pa)、磷脂酰乙醇胺(pe)、磷脂酰胆碱(pc)、磷脂酰丝氨酸(ps)、磷脂酰肌醇(pi)、磷脂酰肌醇磷酸(pip)、磷酸氢磷脂酰肌醇(pip2)、磷脂酰肌醇三磷酸(pip3)、神经酰胺磷酰胆碱(鞘磷脂:sph)、神经酰胺磷酰乙醇胺(鞘磷脂:cer-pe)、神经酰胺磷酰基脂质(phosphoryllipid)或其任何组合。在一些实施方式中,包含镍-次氨基三乙酸螯合物(ni-nta)部分的脂质分子可以用于借助于his标记物来拴系蛋白质。例如,所述双层可以以各种摩尔浓度掺入1,2-二油酰基-sn-甘油基-3[(n-(5-氨基-1-羧基戊基)亚氨基二乙酸)琥珀酰基](镍盐)。
在一些实施方式中,所述脂双层的不同脂质组分的数目可以在1-10或更大的范围内。在一些实施方式中,不同脂质组分的数目可以是至少1种、至少2种、至少3种、至少4种、至少5种、至少6种、至少7种、至少8种、至少9种或至少10种。在一些实施方式中,不同脂质组分的数目可以是至多10种、至多9种、至多8种、至多7种、至多6种、至多5种、至多4种、至多3种、至多2种或至多1种。
在一些实施方式中,所述脂双层的给定脂质组分的相对百分比可以在约0.1%至约100%的范围内。在一些实施方式中,给定脂质组分的相对百分比可以是至少约0.1%、至少约0.2%、至少约0.3%、至少约0.4%、至少约0.5%、至少约1%、至少约5%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%或至少约100%。在一些实施方式中,给定脂质组分的相对百分比可以是至多约100%、至多约90%、至多约80%、至多约70%、至多约60%、至多约50%、至多约40%、至多约30%、至多约20%、至多约10%、至多约5%、至多约1%、至多约0.5%、至多约0.4%、至多约0.3%、至多约0.2%或至多约0.1%。本领域技术人员将认识到所述脂双层中的给定脂质组分的相对百分比可以具有该范围内的任何值,例如,约12.5%。
如果标记物如his标记物用于拴系蛋白质,则his标记物的不同长度(即,6x、8x、10x、12x等)可以产生不同的取向分布,因此可以用于定义不同组的实验条件。而且,n-端与c-端his标记物通常产生不同的取向分布,并且因此可以用于定义产生不同χ(2)测量值的不同组的实验条件。
在一些实施方式中,用于将标记的蛋白质拴系到包含附接有ni-nta部分的脂质的受支承脂双层的his标记物的长度可以在约1个his残基至约20个his残基或更多个his残基的范围内。在一些实施方式中,his标记物的长度可以是至少1个his残基、至少2个his残基、至少3个his残基、至少4个his残基、至少5个his残基、至少6个his残基、至少7个his残基、至少8个his残基、至少9个his残基、至少10个his残基、至少11个his残基、至少12个his残基、至少13个his残基、至少14个his残基、至少15个his残基、至少16个his残基、至少17个his残基、至少18个his残基、至少19个his残基或至少20个his残基。在一些实施方式中,his标记物的长度可以是至多20个his残基、至多19个his残基、至多18个his残基、至多17个his残基、至多16个his残基、至多15个his残基、至多14个his残基、至多13个his残基、至多12个his残基、至多11个his残基、至多10个his残基、至多9个his残基、至多8个his残基、至多7个his残基、至多6个his残基、至多5个his残基、至多4个his残基、至多3个his残基、至多2个his残基或至多1个his残基。
此外,不同的缓冲液条件,如相同缓冲液中的不同盐浓度或不同的缓冲液,也可以改变分子的取向分布,并因此改变χ(2)测量值。在一些实施方式中,用于定义不同组实验条件的缓冲液的离子强度可以包括使用单价盐(例如nacl、kcl等)、二价盐(例如cacl2、mgcl2等)、三价盐(例如alcl3)或其任何组合。在一些实施方式中,用于定义不同组实验条件的缓冲液的离子强度可以在约0.0m至约1m或更高的范围内。在一些实施方式中,所述缓冲液的离子强度可以是至少0.0m、至少0.1m、至少0.2m、至少0.3m、至少0.4m、至少0.5m、至少0.6m、至少0.7m、至少0.8m、至少0.9m或至少1.0m。在一些实施方式中,所述缓冲液的离子强度可以是至多1.0m、至多0.9m、至多0.8m、至多0.7m、至多0.6m、至多0.5m、至多0.4m、至多0.3m、至多0.2m或至多0.1m。本领域技术人员将认识到所述缓冲液的离子强度可以具有该范围内的任何值,例如,约0.15m。
在一些实施方式中,还可以使用与界面区域相关联并且根据其浓度产生蛋白质的不同取向分布的缓冲液添加剂,如peg400、乙二醇等。
在一些实施方式中,用于shg偏振测量的不同组实验条件的数目可以增加,以便增加待取样的独立分子取向分布的数目和可以进行的独立偏振测量的数目,从而提高角度测量和由此衍生的蛋白质结构模型的准确性。在一些实施方式中,所使用的不同组实验条件的数目可以是至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少15个、至少20个、至少30个、至少40个、至少50个、至少60个、至少70个、至少80个、至少90个或至少100个。
χ(2)的测量和与蛋白质结构的关系:由于不同的潜在取向分布而导致不同组χ(2)测量值的每组实验条件允许独立测量将通过shg测定的角度θ。通过组合两个或更多个这样的测量,可以进行更准确的蛋白质结构测定,其包括以多个构象状态的平衡存在的蛋白质的结构。通过采用本领域技术人员已知的标准分子建模技术,以及在一些实施方式中,通过选择适当的简化假设,可以使用χ(2)分量的测量值和θ值的测定来开发结构模型。为简化分析和开发蛋白质结构模型而可以作出的假设的一个非限制性实例是,尽管在实验室参照系(即,相对于与表面平面垂直的轴)中蛋白质表面上的不同位点处两个或更多个标签的取向从一个实验条件变化到另一个实验条件,但是两者之间的相对取向,即蛋白质参照系中的角度在不同的实验条件下保持不变。实际上,在这个假设下,人们以不干扰蛋白质的功能和构象景象的方式改变表面上蛋白质的取向分布。每个实验条件产生至少一个独立的方程,将在不同偏振下测量的shg的强度与分子取向分布相关联。适宜的对照如配体诱导的构象变化、配体竞争实验、配体结合动力学、剂量-响应测量等可以在各个实验条件下运行,以确保蛋白质仍然是功能性的,并因此是天然样的。平均角度测量值(例如)与蛋白质中的标签或超极化部分的取向分布的其他参数一起,可以用作根据本领域技术人员已知的方法进行从头构建或集成结构模型构建中的约束。在一些实施方式中,例如,蛋白质的apox-射线晶体结构可以被包括在该模型中,并且用由shg测量所提供的结构数据覆盖以提高模型的准确性。
为了简化shg结构数据的分析,在所公开的方法的一些实施方式中可以作出的假设的非限制性实例包括:(i)α(2)的单个分量(例如αzzz(2))主导标签的超极化率;(ii)所述标签的超极化率不会随着实验条件的改变而改变;(iii)蛋白质中两个或更多个标签的位置(即,它们所附接的氨基酸残基的身份)是已知的;(iv)拴系或固定的蛋白质分子的取向在x-y平面上是各向同性的(即,它们在基底表面的平面上或受支承脂双层的平面上随机取向);(v)两个或更多个标签的取向变化并非由于蛋白质构象的内在变化或蛋白质解折叠;(vi)标签在每个标签位点处的取向分布构成δ函数(即,在标签位点处没有取向角度的分散),或其任何这样的组合。在一些实施方式中,所述shg结构数据可以与来自蛋白质晶体学研究、nmr研究、uv-vis和荧光光谱研究、圆二色性研究、交联实验、小角x射线散射研究等的结构数据重叠或组合。
在一些实施方式中,可以利用标准共价缀合化学,例如利用与胺基团、羧基基团、硫醇基团等反应的非线性活性部分进行非线性活性标签与蛋白质分子的附接。在一些实施方式中,可任选地希望对经标记蛋白质进行质谱分析,以严格鉴别蛋白质内经标记氨基酸残基的位置。
在优选的实施方式中,通过本领域技术人员公知的遗传工程或定点诱变技术确定标签的附接位点(参见,例如edelheit等人(2009),“simpleandefficientsite-directedmutagenesisusingtwosingle-primerreactionsinparalleltogeneratemutantsforproteinstructure-functionstudies”,bmcbiotechnology9:61)。利用这种方法,例如,包含胺基团或硫醇基团的氨基酸残基可以在用非线性活性标记物标记之前置于蛋白质内的精确位置。然后可使用本领域技术人员已知的多种测定中的任一种来测试突变蛋白质的天然样的功能性,例如,使用蛋白质的已知配体进行结合测定。
在另外优选的实施方式中,利用本领域技术人员已知的多种技术中的任一种,可以使用遗传工程技术将非线性活性非天然氨基酸并入蛋白质内的特定位点。参见,例如cohen等人(2002),“probingproteinelectrostaticswithasyntheticfuorescenceaminoacid”,science296:1700-1703和美国专利号9,182,406。
在所公开的方法的一个实例中,蛋白质在单个位点——具体改造的半胱氨酸残基——处用具有超极化率的shg活性标签加以标记,该蛋白质进而具有响应α(2)=α(2)z’z’z’的单一优势元素。经标记蛋白质经由his标记物与含有附接至脂质头基的ni-nta部分的受支承脂双层膜附接。如本领域技术人员所公知的,以这种方式产生基线shg信号,并且给出了χ(2)的非零分量(salafsky,j.s.(2001),“’shg-labels’fordetectionofmoleculesbysecondharmonicgeneration”,chemicalphysicsletters342,485-491;salafsky,j.s.(2003),“second-harmonicgenerationasaprobeofconformationalchangeinmolecules”,chemicalphysicsletters381,705-709;salafsky,j.s.(2006),“detectionofproteinconformationalchangebyopticalsecond-harmonicgeneration”,journalofchemicalphysics125):
χzzz(2)=ns<cos3θ>αz′z′z′(2)
其中ns和αz’z’z’(2)分别是表面密度和分子超极化率。然后可以由两个不同的偏振依赖性测量值(izzz和izxx,或等同地,ippp和ipss)来确定χ(2)的分量。在这种情况下,可以通过使用p-偏振基本激发光测量p-偏振shg信号来确定χzzz(2)。例如,如果使用800nm的基本激发光(例如,来自ti:蓝宝石锁模激光器),则在400nm处检测到二次谐波信号。一般来说,在p-偏振激发和p-偏振shg检测下观察到的shg信号强度ippp,由非线性极化率的若干个分量所决定。然而,通过使用二氧化硅棱镜测量在全反射几何中的临界入射角处的shg信号来实现在该测量中仅分离χzzz(2)的简化的方法。在全内反射(tir)几何中,由于χ(2)的离轴张量分量消失,仅留下了确定所测量的ipppshg信号强度的χzzz(2)(是指基本光束/shg光束的偏振),因此所测量的shg强度由棱镜和表面拴系的蛋白质泡在其中的缓冲液的折射率而决定。类似地,可以通过使用s-偏振的基本光并测量p-偏振的shg光强测量ipss来确定χzzz(2)。在ns和αz’z’z’未知的情况下,可以使用在不同偏振组合下测量的强度的比例来消除这些参数,只留下作为θ的三角函数的取向分布本身的比例,其中θ被定义为分子系中z-轴和表面法线之间的平均角度。当取向分布较窄时,可以直接确定θ。通过使用在两个或更多个不同位点处标记的蛋白质(例如,在两个或更多个不同的单位点半胱氨酸突变体中,在这些半胱氨酸位点处),在不同的偏振(例如,izzz和izxx)下重复shg强度的测量,例如可以获得针对可以用作结构确定中的约束的每个标签位点处的不同的θ。每次测量都需要经标记蛋白质,优选在蛋白质中已知位置处与标签位点特异性附接(例如,经由定点半胱氨酸诱变的共价附接)。还通过改变实验条件以产生相对于表面平面的不同取向的蛋白质以及两个或更多个不同位点的标记,可以进行独立测量以确定描述取向分布的多个参数,由此为蛋白质结构测定提供重要的约束。本发明的关键步骤是在两个或更多个不同的实验条件下测量在两个或更多个不同位点处(优选在单独的蛋白质-标签缀合物中)标记的蛋白质,这导致不同的χ(2)值或χ(2)分量的不同比例(例如χzzz(2)/χzxx(2))。通过测量在两个或更多个不同的实验条件下在两个或更多个不同位点处标记的相同蛋白质的χ(2)值,可以获得更准确的θ(在实验系中)的测量值,并且将它们(即在蛋白质系中)之间的差异与蛋白质结构进行关联。
例如,利用各自在一个位点(位点1和位点2)处标记的两种蛋白质(每种蛋白质在不同实验条件下在表面上的取向不同),可以进行能够得到如下所示的两个偏振依赖性shg强度的四次不同测量,以得到总共8个独立的强度测量值:
取向1:在位点1处标记的蛋白质-测量izzz、izxx
在位点2处标记的蛋白质-测量izzz、izxx
取向2:在位点1处标记的蛋白质-测量izzz、izxx
在位点2处标记的蛋白质-测量izzz、izxx
使用本领域技术人员公知的方法,通过izzz和izxx的测量强度的比率和利用适当的菲涅耳(fresnel)因子,可以消除shg活性标签的超极化率和数量密度。由于蛋白质是具有许多潜在标签附接位点的大分子,因此以不同方式标记不同位点并定向蛋白质提供了获得多于一个独立比例的偏振依赖性强度(例如,izzz和izxx)的便利方式,从而允许将(1)式中括号内的取向分布项与多个模型参数进行拟合。
例如,如果使用产生针对在两个不同的半胱氨酸位点处标记的两个独立的蛋白质缀合物的不同蛋白质取向分布的三个不同组或更多不同组实验条件,则获得可以用于确定分子取向分布的参数的(2x3)-1=5的强度比。实验室系中的不同的θ可用于计算蛋白质系中两个标签位点之间的分子内角度差异,即获得蛋白质系中的结构信息。这是因为,虽然蛋白质在c-端与n-端通过his标记物拴系到表面时会在实验室系中取向不同(导致不同的θ和取向分布),但是蛋白质参照系中的标签之间的关系应该保持不变。因此,当所述蛋白质以不同的取向分布拴系到表面时,附加的独立测量允许更准确地确定蛋白质参照系中的角间测量。实际上,每一组实验条件会使蛋白质在表面上重新定向,使得可以获得投影在z轴上的标签的超极化率的实验室系角度的多个独立测量值。每个独立的测量值可用于提供附加约束以确定蛋白质参照系中的结构。实际上,两个半胱氨酸位点之间的平均角度差异应该在整个实验条件下保持恒定,从而允许将取向分布拟合至超过平均角度的附加模型参数,如取向分布宽度(例如,以平均角度为中心的高斯分布的半极大处全宽度(fwhm))。使用这种方法,通过进行针对不同标签位点的两个或更多个独立的χ(2)值测量并且利用这些由shg和未结合(apo)x-射线晶体结构坐标确定的角度约束来确定原子分辨率下的最佳配体结合的结构,而无须配体接合复合体的x射线晶体结构测定,配体结合蛋白质的结构可得以快速确定。这些配体可以是小分子、小分子片段、肽、蛋白质、抗体、寡核苷酸,以及通常本领域技术人员已知的任何配体。
多重构象-平衡取向分布:如果蛋白质以多种构象状态的平衡存在,则所述蛋白质将通过在每个标记位点处的多模态(或多状态)取向分布加以描述。如果所述分布由具有不同权重、平均角度(θs)和分布宽度(δs)的高斯分布的总和组成,则蛋白质构象景象的完整描述将取决于确定这些参数中的每一个。例如,如果标签位点1处的蛋白质的局部结构采用3个构象,则在这些假设下,局部取向分布可以由待确定的3x3参数或描述每个构象的幅度、平均角度和宽度的9个未知量来描述。标签位点2可以仅采用2个局部构象,并且在这种情况下可以类似地由6个参数来描述。对于涉及超极化率的单一优势张量分量、表面平面中的各向同性对称(方位对称性)和临界角处的激发的实验几何形状,可以为每个实验条件确定两个独立的χ(2)分量(例如χzzz(2)和χxzx(2)或χzxx(2));并且可以使用这些值的n-1个独立的比率来消除ns和αz’z’z’。因此,对于在上述假设下涉及两个经标记突变体的实验,应当进行(χ(2)分量的)最少16次独立测量(产生15个χ(2)值的独立比率),其可以用于拟合取向分布。这种方法假定超极化率的单一优势张量分量不会随着标签位点产生幅度或相位变化。本发明的一个方面是,可以通过改变标记物位点(如c-端和n-端)、标记物长度(例如6x、8x、10x和12xhis标记物)、缓冲液条件(例如不同的盐浓度)等,或者通常改变蛋白质在表面上的取向并因此影响χ(2)测量值的任何实验条件来获得附加独立测量值。然后可以使用所有这些独立测量值,例如在全局拟合方法中确定在这两个位点的蛋白质参照系中的基于溶液的构象景象(即多状态取向分布)。在一些实施方式中,蛋白质的x射线晶体结构坐标系可以可选地用作模型构建中的进一步约束。
绝对极性取向测定:尽管可以确定实验室系中的标签的倾斜角方向,但是这个倾斜角分别在指向和离开表面的两个圆锥中是简并的(degenerate)。本发明还公开了一种用于通过简单实验来获得标签的绝对方向(即标签相对于平面表面指向的方向)的新颖方法。在这个实验中,给定偏振条件下的shg信号使用如下项来测量:i)附接至未经标记表面的经标记蛋白质,ii)附接至经标记表面的未经标记蛋白质,和iii)附接至经标记表面的经标记蛋白质。所述标记表面可以以本领域技术人员公知的多种方式来制备,例如通过羧化的非线性活性标签与氨基硅烷官能化的玻璃基底表面的共价碳二亚胺偶合。或者,利用受支承脂双层(slb),可以将经由胺或硫醇(例如,对应于赖氨酸或半胱氨酸残基侧链)与蛋白质附接的相同的非线性活性标签与掺杂有不同摩尔百分比的含胺或硫醇的脂质的双层共价偶合。由于标签与蛋白质标签相同,所以该表面然后提供与蛋白质产生的shg信号同相的自身shg信号。凭借其已知的与表面的定向偶合及其化学结构,附接至受支承双层的标签具有已知的极性取向。确定蛋白质上标签的绝对极性取向(并因此可能是整个蛋白质的极性取向)的实验可以如下进行。首先,测量不存在蛋白质时经标记表面的shg信号(il)。其次,测量附接至未经标记表面的经标记蛋白质的shg信号(ip)。第三,当经标记蛋白质附接至经标记表面时,测量表面的shg信号(itot)。不同shg信号之间的关系如下:
itot=il+ip+sqrt(ilxip)xcos(θ)
其中cos(θ)描述了附接至蛋白质分子的标签与第三次测量(itot)中的表面之间的相位关系(其随着朝向或远离表面的绝对极性取向而在符号上翻转)。通过分别测量itot、il和ip并比较所测量的信号强度,可以确定蛋白质上每个标签的绝对极性取向。在一些情况下,例如当il+ip具有大致相当的量级时,如果itot本身小于il,则可以立即确定在蛋白质标签与表面标签之间发生的相消干涉;因此,标签以相反的极性取向定向;如果itot本身大于il,则发生相长干涉,并且标签在相同极性方向上定向。il+ip的大小可以通过调整例如针对染料的受支承双层上附接位点的密度或附接至表面的蛋白质的密度来改变。
在一些实施方式中,所述受支承脂双层上附接位点的密度可以通过改变包含胺基团或硫醇基团(或任何其他可用于标准缀合物化学的官能团)的双层的脂质组分的百分比来改变。在一些实施方式中,包含胺基团或硫醇基团的脂质组分的百分比可以在约0%至约100%的范围内。在一些实施方式中,包含胺基团或硫醇基团的脂质组分的百分比可以是至少0%、至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或至少100%。在一些实施方式中,包含胺基团或硫醇基团的脂质组分的百分比可以是至多100%、至多90%、至多80%、至多70%、至多60%、至多50%、至多40%、至多30%、至多20%或至多10%。本领域技术人员将认识到包含胺基团或硫醇基团的脂质组分的百分比可以是该范围内的任何值,例如,约12%。
在一些实施方式中,与所述表面附接的非线性活性标记的蛋白质的密度可以随着在与所述受支承脂双层一起温育的溶液中经标记蛋白质的浓度的改变而改变。例如,his标记的经标记蛋白质在与受支承脂双层一起温育的溶液中的浓度可以变化,该受支承脂双层包含进一步含有ni-nta部分的脂质组分。在一些实施方式中,溶液中经标记蛋白质的浓度可以在约1nm至约100μm的范围内。在优选的实施方式中,溶液中经标记蛋白质的浓度可以在约100nm至约5μm的范围内。在一些实施方式中,溶液中经标记蛋白质的浓度可以是至少1nm、至少10nm、至少100nm、至少1μm、至少10μm或至少100μm。在一些实施方式中,溶液中经标记蛋白质的浓度可以是至多100μm、至多10μm、至多1μm、至多100nm、至多10nm或至多1nm。本领域技术人员将认识到溶液中经标记蛋白质的浓度可以是在该范围内的任何值,例如约12μm。
在一些实施方式中,所述表面上的非线性活性标记的蛋白质的密度可以通过使用本领域技术人员已知的多种技术中的任一种技术在约102个分子/cm2至约1014个分子/cm2的范围内改变。在一些实施方式中,所述表面上的非线性活性标记的蛋白质的密度可以是至少102个分子/cm2、至少103个分子/cm2、至少104个分子/cm2、至少105个分子/cm2、至少106个分子/cm2、至少107个分子/cm2、至少108个分子/cm2、至少109个分子/cm2、至少1010个分子/cm2、至少1011个分子/cm2、至少1012个分子/cm2、至少1013个分子/cm2或至少1014个分子/cm2。在一些实施方式中,所述表面上的非线性活性标记的蛋白质的密度可以是至多1014个分子/cm2、至多1013个分子/cm2、至多1012个分子/cm2、至多1011个分子/cm2、至多1010个分子/cm2、至多109个分子/cm2、至多108个分子/cm2、至多107个分子/cm2、至多106个分子/cm2、至多105个分子/cm2、至多104个分子/cm2、至多103个分子/cm2或至多102个分子/cm2。本领域技术人员将认识到所述表面上的非线性活性标记的蛋白质的密度可以是在该范围内的任何值,例如,约4.0x1012个分子/cm2。
背景信号减除:如果由于基底-缓冲液界面而存在背景shg信号,例如,可以以各种方式“减去”该信号。例如,来自蛋白质上标签的shg信号与由背景引起的shg信号之间的相位差可以在干涉实验中测量,如在reider,g.等人(1999),“coherenceartifactsinsecondharmonicmicroscopy”,appliedphysicsb-lasersandoptics68,343-347中所描述的。然后可以确定单独由蛋白质引起的shg信号。
电场取向、强度和特性:可以施加电场来操纵界面处实验室系中的生物分子的取向。电场方向可以横跨表面,与其垂直,或者通常采取相对于表面平面的任何角度。在一个实施方式中,将一个电极置于脂双层膜或其他表面化学品的下面以将蛋白质与基底(例如玻璃基底)附接。将对电极置于基底表面平面的上方,例如在样品孔中液体的顶部。在另一个实施方式中,将两个或更多个电极放置在基底表面平面内,并且电场方向与基底膜的界面平行。
在另一个实施方式中,可将电极阵列放置在拴系的或固定的蛋白质样品的周围,如图9所示。例如,电极的圆形阵列可以平行于玻璃基底表面上的膜界面放置,每个大约彼此间隔10度。施加到彼此分开180度的一对电极上的电压允许电场的方位角方向以任意及快速的方式改变。例如,电场的方位角方向可以在一秒或几分之一秒内绕整个圆周扫描。
可以使用本领域技术人员已知的多种技术中的任一种在基底表面上对电极进行图案化。实例包括但不限于丝网印刷、光刻图案化、溅射镀膜、化学汽相沉积或其任何组合。
如本领域技术人员公知的,电极可以由多种材料中的任何一种制成。合适的电极材料的实例包括但不限于银、金、铂、铜、铝、石墨、铟锡氧化物(ito)、半导体材料、导电聚合物或其任何组合。
在一些实施方式中,可能需要钝化一个或多个电极的表面,例如,使与含水缓冲液接触的电极表面的腐蚀降至最低,并且/或者防止污染或干扰蛋白质或其他生物组分,并且/或者防止样品中的电流流动。可以使用本领域技术人员已知的多种钝化技术中的任一种,并且通常取决于用于制作电极的材料的选择。例如,玻璃基底上的铟锡氧化物电极可以通过生长或沉积30nm的sio2层来钝化。金属或半导体电极通常暴露于空气时会形成可充当钝化层的惰性“天然氧化物”层。这种惰性表面层通常是氧化物或氮化物,铂的单层厚度为
电场可以是dc或ac,即时间不变的或时间变化的。在后一种情况下,它可以采用任何频率的正弦波,或者可以是由许多频率分量组成的复合波(即阶跃函数、锯齿形等),并且该场在正值或负值之间振荡或者保持全部正值或全部负值。在一些实施方式中可以应用非周期的或脉冲电场。shg信号可以在将电场施加到样品之前、期间或之后读取。
在一些实施方式中,所述电场强度可以在约零至约106v/cm或更大的范围内。在一些实施方式中,所述电场强度可以是至少零、至少10v/cm、至少102v/cm、至少103v/cm、至少104v/cm、至少105v/cm或至少106v/cm。在一些实施方式中,所述电场强度可以是至多106v/cm、至多105v/cm、至多104v/cm、至多103v/cm、至多102v/cm、至多10v/cm。本领域技术人员将认识到所述电场强度可以是在该范围内的任何值,例如,约500v/cm。
在一些实施方式中,电场改变的频率可以在约0hz至约105hz的范围内。在一些实施方式中,电场改变的频率可以是至少0hz、至少10hz、至少102hz、至少103hz、至少104hz或至少105hz。在一些实施方式中,电场改变的频率可以是至多105hz、至多104hz、至多103hz、至多102hz或至多10hz。本领域技术人员将认识到电场改变的频率可以是在该范围内的任何值,例如,约125hz。
所述电场可用于操纵蛋白质分子的取向,从而操纵基线信号或shg偏振依赖性。在一些实施方式中,如果在不存在施加的电场的情况下在基底表面平面(即xy表面)中发生取向各向同性,并且在施加电场时保持各向同性,则非线性极化率(χ(2))的两个或三个独立的非零分量将存在。在表面平面上存在取向各向异性的其他实施方式中,在施加电场之前、期间或之后,将存在χ(2)的多于两个或三个独立的非零分量,允许用偏振基本光和二次谐波光的不同组合进行附加独立shg测量。在表面平面(例如与经标记蛋白质附接的脂质生物膜)上存在取向各向异性的一些实施方式中,可以在不同方位角进行多个独立的χ(2)的测量。例如,如果平行于表面施加电场,并且这引起蛋白质分子从各向同性平面到各向异性平面的取向分布的变化,则可以在相对于施加的电场方向的许多方位角方向上进行附加独立光学测量以确定分子的取向分布。
具有集成电极的光学多孔板:如将在下面详细讨论的,在一些实施方式中,本文描述的shg测量优选地使用微孔板形式来进行。在使用384孔板(或其他微孔板或多室形式)的一些实施方式中,电极可以在孔壁的内部和附近的基底表面上被图案化,作为盖的一部分,该盖用于对孔、孔内的基底表面(其可以是玻璃)的其他地方,或允许施加电压以在样品上产生电场和光学读取shg信号二者的任何地方加以密封。
具有半球形棱镜的光学多孔板:在一些实施方式中,特别是在分子的各向异性取向分布存在于表面的情况下,在相对于各向异性轴的不同方位角的方向上光学探测样品将是有用的。作为相对于光轴旋转样品的替代方案,光轴可以相对于固定样品旋转。为了实现这一点,可以使用放置在每个孔的底部或附近的半球形棱镜来将入射到棱镜上的入射光相对于孔以任意角度引导至含有分子的界面区域。在一些实施方式中,半球形棱镜与玻璃底多孔板中的基底结合或集成,如图8所示。所述半球形棱镜与所述多孔板光学接触,从而允许光束以最小损耗传输。在一些实施方式中,所述光学多孔板将包含384孔玻璃底板或其他玻璃底微孔板形式(即,本领域技术人员公知的标准微孔板形式)。
在一些实施方式中,包含与形成孔底部的玻璃基底结合或集成的半球形棱镜阵列的微孔板装置可进一步包含在每个孔内的玻璃基底的上表面上的图案化电极阵列,以便可在施加不同场强的电场时进行偏振shg测量。
构象变化的测量:在一个实施方式中,在蛋白质内的一个或多个标记位点处测量配体诱导的构象变化。在一个实施方式中,使用单位点半胱氨酸残基。偏振的基本光和非线性光的组合被用于确定添加配体之前或之后的χ(2)分量。例如,如果生物分子在表面上各向同性地定向,并且分子超极化率由单张量元素(例如αz’z’z’,或者在一些文献中等同地为βz’z’z’)控制,则可以进行4次独立的χ(2)测量:在将生物分子与配体接触之前两次和接触之后两次(例如,χzzz和χxzx或χzxx)。如果将构象变化之前或之后的取向分布建模为包含三个可调参数(θ1、θ2和σ),其中θ1是构象变化之前的平均实验室系取向,θ2是构象变化之后的平均实验室系取向,并且σ是围绕θ1和θ2二者的高斯定向宽度,即在模型假设的一个非限制性示例中,在构象变化之后取向角度分布的宽度保持相同,那么可以通过确定χ(2)的四个分量(χ1zzz、χ1zxx、χ2zzz、χ2zxx)的三个独立的比例(例如χ1zzz/χ1zxx、χ2zzz/χ2zxx、χ1zzz/χ2zzz)确定这三个参数,其中上标1和2分别表示配体诱导变化之前和之后的构象。由这些测量值和公式1确定的平均角度(θ1和θ2)可以用于确定由于构象变化引起的蛋白质参照系中的标签位点处的标签取向的角度变化。对于使用不同的单位点半胱氨酸突变体的任何数目的标签位点,可以重复该过程,并且可以确定局部或全局配体结合的结构的模型。在一些实施方式中,所述模型可选地并入x-射线晶体结构坐标或其他结构约束(例如来自nmr数据、小角x射线散射数据或本领域技术人员已知的任何其他测量值)。
高通量系统和方法
本文公开了基于利用二次谐波发生或相关非线性光学检测技术来实现对生物实体中的结构或构象的高通量分析的系统和方法。如本文所使用,“高通量”是与利用诸如nmr或x射线晶体学等传统技术进行的结构测量相比的相对术语。如下文更详细描述,本文公开的基于shg的方法和系统能够以至少比常规技术快一个数量级的速率进行结构测定。
在一个方面,本公开内容提供了一种用于一种或多种生物实体的构象或构象变化的高通量检测的方法,该方法包括(i)用非线性活性标签或标记物来标记一个或多个靶生物实体,例如,蛋白质分子;(ii)将所述一个或多个经标记的靶生物实体拴系或固定在平面基底表面的一个或多个非连续区域,其中所述基底表面进一步包含光学界面;(iii)通过改变基底相对于外部光源的位置,依次将每个非连续区域暴露于激发光下;(iv)在每个非连续区域暴露于激发光时收集从该非连续区域发射的非线性光信号;以及(v)处理所述非线性光信号以确定所述一种或多种生物实体中的每一种的取向、构象或构象变化。在另一方面,所述方法进一步包括(vi)继第一次暴露于激发光之后,使所述一种或多种生物实体中的每一种与一种或多种测试实体相接触;(vii)随后将每个非连续区域一次或多次重新暴露于激发光;(viii)在每个非连续区域暴露于激发光时收集来自该非连续区域的非线性光信号;以及(ix)处理所述非线性光信号以确定在所述一种或多种生物实体中是否由于与所述一种或多种测试实体相接触而发生取向或构象变化。在所述方法的一个方面,在所述一种或多种生物实体与一种或多种测试实体相接触之后仅检测一次非线性光信号,并继而将其用于确定是否发生构象变化。在另一方面,在所述一种或多种生物实体与一种或多种测试实体相接触之后以限定的时间间隔反复地收集非线性光信号(即,动力学模式),并继而将其用于确定所述一种或多种生物实体中的构象变化的动力学。在所述方法的一个优选方面,基底的每个非连续区域包括受支承脂双层结构,并且生物实体通过拴系到或嵌入在脂双层内而固定于每个非连续区域中。在所述方法的另一优选方面,通过全内反射将激发光递送到基底表面(即,光学界面),并且沿着与反射的激发光相同的光轴收集从所述基底表面的非连续区域中发射的非线性光信号。
为了实现使用非线性光学检测对蛋白质结构或构象变化进行高通量分析,本文所述系统需要若干组件(图4中示意图示),其包括(i)至少一个适宜的激发光源,以及用于将所述至少一束激发光束递送到光学界面的光学器件;(ii)可互换基底,其包括光学界面,一种或多种生物实体在所述基底的非连续区域中拴系或固定到该光学界面;(iii)高精度平移台,用于将所述基底相对于所述至少一个激发光源进行定位;以及(iv)光学器件,用于收集由于用激发光照射所述基底的每个所述非连续区域而生成的非线性光信号并将所述非线性信号递送到检测器;以及(v)处理器,用于分析从所述检测器接收的非线性光信号数据并确定固定在所述基底上的所述一种或多种生物实体的构象或构象变化。在一些方面,本文公开的系统和方法进一步包括使用(vi)可编程流体分配系统,用于向所述基底的所述非连续区域中的每一个递送测试实体;以及(vii)使用板装卸机器人,用于在与光学系统的界面处自动定位及更换基底。
本文公开的方法和系统可被配置用于对于多种测试实体相接触的单个生物实体的分析,或者用于与单个测试实体相接触的多个生物实体的分析,或者其任意组合。当使一种或多种生物实体与多种测试实体相接触时,可以依次进行接触步骤,即,通过将固定的生物实体在指定时间段内暴露于单个测试实体,随后是可选的冲洗步骤以去除测试实体溶液并在将固定的生物实体引入到下一测试实体之前使所述固定的生物实体再生,或者接触步骤可以并行进行,即,通过让多个非连续区域包含相同的固定生物实体,并使所述多个非连续区域中的每一个中的生物实体暴露于不同的测试实体。本文公开的方法和系统可被配置用于进行针对至少1种生物实体、至少2种生物实体、至少4种生物实体、至少6种生物实体、至少8种生物实体、至少10种生物实体、至少15种生物实体或至少20种生物实体中的构象变化的分析。在一些方面,本文公开的方法和系统可被配置用于进行针对至多20种生物实体、至多15种生物实体、至多10种生物实体、至多8种生物实体、至多6种生物实体、至多4种生物实体、至多2种生物实体或至多1种生物实体中的构象变化的分析。类似地,本文公开的方法和系统可被配置用于在所述一种或多种生物实体暴露于至少1种测试实体、至少5种测试实体、至少10种测试实体、至少50种测试实体、至少100种测试实体、至少500种测试实体、至少1000种测试实体、至少5000种测试实体、至少10000种测试实体或至少100000种测试实体时进行对构象变化的分析。在一些方面,本文公开的方法和系统可被配置用于在所述一种或多种生物测试实体暴露于至多100000种测试实体、至多10000种测试实体、至多5000种测试实体、至多1000测试实体、至多500种测试实体、至多100种测试实体、至多50种测试实体、至多10种测试实体、至多5种测试实体或至多1种测试实体时进行对构象变化的分析。
生物实体和测试实体
如本文所使用,词组“生物实体”包括但不限于细胞、蛋白质、肽、受体、酶、抗体、dna、rna、生物分子、寡核苷酸、溶剂、小分子、合成分子、碳水化合物,或者其任意组合。类似地,词组“测试实体”也包括但不限于细胞、蛋白质、肽、受体、酶、抗体、dna、rna、生物分子、寡核苷酸、溶剂、小分子、合成分子、碳水化合物,或者其任意组合。在一些方面,生物实体可包括药物靶标或其部分,而测试实体可包括候选药物或其部分。
非线性活性标签和标记技术
如上所述,大多数生物分子并非本来就是非线性活性的。例外包括胶原蛋白,这是一种存在于大多数结构或承重组织中的结构蛋白质。shg显微术已在例如角膜等含胶原蛋白结构的研究中得到广泛应用。其他生物分子或实体则必须通过引入诸如标记物或标签等非线性活性部分才成为非线性活性的。在本发明中采用的标签是指可以共价或非共价结合到分子、粒子或相(例如,脂双层)以便使得由此产生的系统更具非线性光学活性的非线性活性部分、标记物、分子或粒子。在分子、粒子或相(例如,脂双层)不具非线性活性的情况下采用标签以使得系统具有非线性活性,或者在已经具有非线性活性的系统中采用标签以向该系统中增加额外的表征参数。可以向分子、粒子或其他生物实体预附接外源性标签,并且在用于本文所述方法之前,任何未结合或未反应标签从经标记实体分离出来。在本文公开的方法的特定方面,在将靶分子或生物实体固定于基底表面的非连续区域中之前,在体外将非线性活性部分附接到靶分子或生物实体。用非线性活性标签标记生物分子或其他生物实体允许在经标记生物分子或实体与另一分子或实体(即,测试实体)之间的相互作用导致该生物分子或实体的取向或构象变化的情况下,利用表面选择性非线性光学技术以直接光学手段检测该相互作用。
在本文所述方法和系统的备选方面,采用至少两种可区分的非线性活性标签。继而将会选择附接的两种或更多种可区分的标签的取向以便有助于发出的相干非线性光束的明确定义的方向。所述两种或更多种可区分的标签能够在如下的测定中使用,在该测定中,采用了相对于光学界面以一个或多个偏振方向入射的、处于一个或多个频率的多个基本光束,得到至少两个非线性光束的发射。在一些实施方式中,所使用的可区分的非线性活性标签的数目可以是至少两种、至少三种、至少四种、至少五种、至少六种、至少七种、至少八种、至少九种或至少十种。
非线性活性标记物或标签的示例包括但不限于表1中所列的化合物及其衍生物。
表1.非线性活性标记物的示例
在评价某一物质是否具有非线性活性时,以下特性可以表明非线性活性的潜力:大偶极矩差(分子的基态与激发态之间的偶极矩差)、荧光中的大斯托克斯位移,或者芳族或共轭结合特性。在进一步评价该物质时,实验者可以利用本领域技术人员已知的简单技术来确认非线性活性,例如,通过检测来自非线性活性物质所分布于的空气-水界面的shg检测来进行确认。一旦已针对所进行的实验选择合适的非线性活性物质,如果需要,可以将该物质缀合到生物分子或实体用于本文公开的表面选择性非线性光学方法。
以下参考文献和其中的参考资料描述了用于由合成染料和许多其他分子产生经标记的生物实体的可行技术:gregt.hermanson,bioconjugatetechniques,academicpress,newyork,1996。
在所公开的方法和系统的一个特定方面,对其金属纳米颗粒和组件进行修饰,以获得生物非线性活性标签。以下参考文献描述了金属纳米颗粒和组件的修饰:j.p.novak和d.l.feldheim,"assemblyofphenylacetylene-bridgedsilverandgoldnanoparticlearrays",j.am.chem.soc.122:3979-3980(2000);j.p.novak等"nonlinearopticalpropertiesofmolecularlybridgedgoldnanoparticlearrays",j.am.chem.soc.122:12029-12030(2000);vance,f.w.,lemon,b.i.和hupp,j.t.,“enormoushyper-rayleighscatteringfromnanocrystallinegoldparticlesuspensions",j.phys.chem.b102:10091-93(1999)。
在本文公开的方法和系统的另一方面,还可以通过向分子信标(即已被修饰以并入非线性活性标签(或其调节剂)而非荧光团或猝灭剂的分子信标探针)引入非线性类似物来操控系统的非线性活性。分子信标的这些非线性光学相似物在本文中称为分子信标类似物(mb类似物或mba)。要在所描述的方法和系统中采用的mb类似物可以根据本领域普通技术人员已知的规程予以合成。
所检测的生物相互作用类型
除了确定蛋白质和其他生物分子的取向或结构,根据对所采用的生物实体、测试实体以及非线性活性标记技术的选择,本文公开的方法和系统还提供了对生物实体之间或者生物实体与测试实体之间的多种相互作用的检测。在一个方面,本公开内容提供了对结合事件的定性检测,所述结合事件例如为如受体中诱导所产生的构象变化所指出的、配体与受体的结合。在另一方面,本公开内容提供了通过使用不同浓度的配体分子进行重复测量并使用所观察到的最大构象变化中的百分比变化生成剂量响应曲线对结合事件(例如,配体与受体的结合)的定量分析。类似地,本公开内容的其他方面可以提供用于对酶-抑制剂相互作用、抗体-抗原相互作用、生物大分子复合物的形成或者受体与变构调节剂的相互作用进行定性或定量测量的方法。
在其他特定实施方式中,可以根据本文公开的方法,将mb类似物用作杂交探针,该杂交探针能够检测互补核酸靶标的存在,而不必像在溶液-相杂交测定中那样从过量探针中分离出探针-靶标杂交体,并且无需标记靶标寡核苷酸。mb类似物探针还可以用于对活细胞内rna的检测,用于监测从生物反应器提取的样品等分试样中的特定核酸的合成,以及用于构建自报告寡核苷酸阵列。它们可以用于进行均匀单孔测定(one-wellassay),用于鉴别dna中的单核苷酸变异,以及用于检测固定到用于界面检测的表面的病原体或细胞。
通过当前公开的方法,可以将生物实体之间或者生物实体与测试实体之间的相互作用(例如,结合反应、构象变化等)与以下可测量非线性信号参数相关联:(i)非线性光的强度;(ii)非线性光的波长或光谱;(iii)非线性光的偏振;(iv)(i)、(ii)或(iii)中的时间进程,以及/或者vi)(i)、(ii)、(iii)和(iv)中的一种或多种组合。
激光光源和激发光学系统
图5图示了本文公开的方法和系统的一个方面,其中通过反射来自包括样品界面(或光学界面)的基底表面上的入射基本激发光来生成二次谐波光。在一些实施方式中,基底光耦合至用于以合适的角度递送激光的棱镜,以在基底表面诱导全内反射(图6)。在一些实施方式中,通过使用折射率匹配流体的薄膜来提供所述光耦合。激光器提供在样品界面处生成二次谐波光所必需的基本光。这通常将会是皮秒或飞秒激光器,其为波长可调式或不可调式,并且可从市场购得(例如,ti:蓝宝石分秒激光器或光纤激光器系统)。处于基频(w)的光射出激光器,并且例如使用适合于该光的频率和强度的半波片来选择其偏振(例如,可从mellesgriot,oriel或newportcorp.购得)。光束继而穿过被设计用于让基本光通过但阻断非线性光(例如,二次谐波光)的谐波分离器。该滤光器用于防止二次谐波光束向激光腔中的背反射,这可能对激光性能造成干扰。继而使用反射镜与透镜的组合,在光束从最终反射镜反射之前对该光束进行转向和塑形,所述最终反射镜经由棱镜引导光束在特定位置并以特定角度θ照射在基底表面上,使得其在该基底表面经历全内反射。如果需要,可以使用电流计控制镜扫描器、旋转多面镜扫描器、布拉格衍射仪、声光偏转器或本领域已知的其他手段来扫描光路中的反射镜中之一,以允许对反射镜位置的控制。包括光学界面和非线性活性样品表面的基底可以安装在(计算机控制的)x-y平移台上,以选择基底表面上的特定位置用于二次谐波光束的生成。在当前描述的方法和系统的一些方面,期望扫描或旋转一个反射镜以便为了全内反射而略微改变入射角,并从而在无需大幅改变照射的激发光斑的位置的情况下使得从基底表面的非连续区域发射的非线性光信号达到最大。在一些方面,可以使用具有不同基频的两个(或更多个)激光器在非线性活性样品所固定于的光学界面处生成和频光或差频光。
基底形式、光学界面和全内反射
如上所述,本公开内容的系统和方法利用平面基底来将一种或多种生物实体拴系或固定在该基底的顶表面上,其中顶部基底表面还包括用于激发非线性光信号的光学界面(或样品界面)。基底可以是玻璃、二氧化硅、熔融石英、塑料,或者任何对基本光束和二次谐波光束透明并且当激发光以适当角度入射时支持基底/样品界面处的全内反射的其他固体材料。在本发明的一些方面,在其内部容纳有生物实体的非连续区域被配置成一维或二维阵列,并且通过疏水涂层或薄金属层彼此隔开。在其他方面,非连续区域可以包括基底表面中的凹坑。在其他方面,非连续区域可以通过孔形成组件而彼此分离,从而使基底形成微孔板(或微板)的底部,并且每个单独的非连续区域形成微孔板中的一个孔的底部。在本公开内容的一个方面,孔形成组件将基底的顶表面分成96个单独的孔。在另一方面,孔形成组件将基底的顶表面分成384个孔。在又一方面,孔形成组件将基底的顶表面分成1536个孔。在所有这些方面中,基底无论配置成平面阵列、凹陷阵列或微孔板形式,都可以包括与高通量系统的其他光学和机械组件相接合的一次性或消耗性装置或筒匣。
本文公开的方法和系统进一步包括对将基底表面划分成的非连续区域或孔的数目加以规定,不论非连续区域或孔之间是如何保持分离的。在基底上具有较大数目的非连续区域或孔在提高所述方法或系统的样品分析通量方面可能是有利的。在本公开内容的一个方面,每基底的非连续区域或孔的数目为10个到1600个之间。在其他方面,非连续区域或孔的数目为至少10个、至少20个、至少50个、至少100个、至少200个、至少300个、至少400个、至少500个、至少750个、至少1000个、至少1250个、至少1500个或至少1600个。在所公开的方法和系统的其他方面,非连续区域或孔的数目为至多1600个、至多1500个、至多1000个、至多750个、至多500个、至多400个、至多300个、至多200个、至多100个、至多50个、至多20个或至多10个。在一个优选方面,非连续区域或孔的数目为96个。在另一优选方面,非连续区域或孔的数目为384个。在又一优选方面,非连续区域或孔的数目为1536个。本领域技术人员将会明白,非连续区域或孔的数目可以在以这些值中的任何一个为界的任何范围内(例如,从约12个到约1400个)。
本文公开的方法和装置还包括对将基底表面划分成的非连续区域或孔的表面积加以规定,不论非连续区域或孔之间是如何保持分离的。具有较大面积的非连续区域或孔可有助于在一些情况下对关联的生物实体的方便进入和操控,而具有较小面积的非连续区域或孔在降低测定试剂量要求和提高所述方法或系统的样品分析通量方面可能有利。在本公开内容的一个方面,非连续区域或孔的表面积为1mm2与100mm2之间。在其他方面,非连续区域或孔的面积为至少1mm2、至少2.5mm2、至少5mm2、至少10mm2、至少20mm2、至少30mm2、至少40mm2、至少50mm2、至少75mm2或至少100mm2。在所公开的方法和系统的其他方面,非连续区域或孔的面积为至多100mm2、至多75mm2、至多50mm2、至多40mm2、至多30mm2、至多20mm2、至多10mm2、至多5mm2、至多2.5mm2或至多1mm2。在一个优选方面,非连续区域或孔的面积约为35mm2。在另一优选方面,非连续区域或孔的面积约为8.6mm2。本领域技术人员将会明白,非连续区域或孔的面积可以在以这些值中的任何一个为界的任何范围内(例如,从约2mm2到约95mm2)。
通过相对于激发光源重新定位基底而将基底表面的非连续区域依次暴露于激发光(用激发光对其进行照射)。入射激发光的全内反射在样品界面产生“迅衰波”,其激发非线性活性标签并导致二次谐波光(或者在一些方面,和频光或差频光)的生成。由于迅衰波的强度并且由此所生成的非线性光信号的强度依赖于激发光束的入射角,因此基底平面相对于激发光束的光轴的精确取向和光束到基底的有效光耦合对于实现整个非连续区域阵列上的最佳shg信号至关重要。在本公开内容的一些方面,通过激发光从基底表面的单一反射来实现全内反射。在其他方面,基底可被配置成波导,使得激发光在其沿着该波导传播时经历多次全内反射。在其他方面,基底可被配置成零模式波导,其中通过纳米工艺结构来创建消逝场。
诸如图5和图6中所示的光学设施中激发光束与基底之间的有效光耦合通常将会通过使用折射率匹配液诸如矿物油、矿物油与氢化三联苯的混合物、全氟化碳液、甘油、丙三醇或具有接近1.5的折射率的类似流体来实现,其中折射率匹配液被芯吸在棱镜与基底的下表面之间。由于在基底的快速重新定位期间有可能破坏折射率匹配液的静态无气泡膜,因此本文公开的系统和方法包括产生高通量系统中激发光束到基底的有效光耦合的备选方法。
图7图示了本公开内容的高通量系统的另一方面,其中使用折射率匹配弹性体材料薄层代替折射率匹配液来保持棱镜与基底之间的有效光耦合。在这种情况下,基底再次封装成微孔板形式(例如,玻璃底微板形式),但具有附接到或相邻于基底的下表面的折射率匹配弹性体材料薄层,以便当置于与棱镜的上表面相接触时,弹性体填充棱镜与基底之间的间隙并提供有效光耦合。可以使用的弹性体材料的实例包括但不限于具有约1.4的折射率的硅氧烷。在本公开内容的一个方面,弹性体材料的折射率为约1.35与约1.6之间。在其他方面,折射率为约1.6或更低、约1.55或更低、约1.5或更低、约1.45或更低、约1.4或更低或者约1.35或更低。在其他方面,折射率为至少约1.35、至少约1.4、至少约1.45、至少约1.5、至少约1.55或者至少约1.6。本领域技术人员将会明白,弹性体层的折射率可以在以这些值中的任何一个为界的任何范围内(例如,从约1.4到约1.6)。在该方法的一个方面,弹性体材料层的厚度为约0.1mm与2mm之间。在其他方面,弹性层的厚度为至少0.1mm、至少0.2mm、至少0.4mm、至少0.6mm、至少0.8mm、至少1.0mm、至少1.2mm、至少1.4mm、至少1.6mm、至少1.8mm或至少2.0mm。在该方法的其他方面,弹性层的厚度为至多2.0mm、至多1.8mm、至多1.6mm、至多1.4mm、至多1.2mm、至多1.0mm、至多0.8mm、至多0.6mm、至多0.4mm、至多0.2mm或至多0.1mm。本领域技术人员将会明白,弹性层的厚度可以在以这些值中的任何一个为界的任何范围内(例如,从约0.1mm到约1.5mm)。在该方法的另一方面,棱镜的上表面具有部分地为圆柱形的凸脊或者呈圆拱形(图9),以集中压力并在基底、弹性体层和棱镜表面之间提供更好的接触。该方法还可需要使用第三平移轴来定位基底,即,在激发步骤与检测步骤之间,将会使基底(微孔板)略微上升,以在将基底重新定位到待分析的下一非连续区域的位置之前消除弹性体层与棱镜之间的接触。
图10a-b和图11a-b图示了本公开内容的高通量系统的优选方面,其中棱镜或光栅阵列与基底(封装成微孔板形式)的下表面进行集成并且用于替代固定式棱镜,从而完全消除对于折射率匹配液或弹性体层的需求。棱镜(或光栅)阵列以这样的方式与基底的上表面上的非连续区域阵列或孔阵列对准:使得入射激发光被“入口棱镜”(“入口光栅”)以实现激发光束从样品界面全内反射的入射角引导至与入口棱镜(入口光栅)相邻但不位于其正上方的非连续区域或孔(见图12),并且使得反射的激发光束以及在照射的非连续区域所生成的非线性光信号被从所探查的非连续区域再度偏移(与之相邻但不位于其正下方)的“出口棱镜”(“出口光栅”)所收集,并且其中针对每个非连续区域的入口棱镜和出口棱镜(入口光栅和出口光栅)是阵列中不同的、非唯一元件。
总体而言,对于包含m行xn列单个特征的非连续区域阵列,对应的棱镜或光栅阵列将具有m+2行xn列或者n+2列xm行单个棱镜或光栅。在一些实施方式中,m的值可以是至少2、至少4、至少6、至少8、至少12、至少14、至少16、至少18、至少20、至少25、至少30、至少35、至少40、至少45或至少50行。在一些实施方式中,m的值可以是至多50、至多45、至多40、至多35、至多30、至多25、至多20、至多18、至多16、至多14、至多12、至多10、至多8、至多6、至多4或至多2行。类似地,在一些实施方式中,n的值可以是至少2、至少4、至少6、至少8、至少12、至少14、至少16、至少18、至少20、至少25、至少30、至少35、至少40、至少45或至少50列。在一些实施方式中,n的值可以是至多50、至多45、至多40、至多35、至多30、至多25、至多20、至多18、至多16、至多14、至多12、至多10、至多8、至多6、至多4或至多2列。对于本领域技术人员显而易见,m和n可以具有相同的值或不同的值,并且可以具有上述指定范围内的任何值,例如,m=15而n=45。
单个棱镜或光栅的几何形状和尺寸,包括棱镜或光栅阵列层的厚度,被优化以确保入射光在基底的选定非连续区域经历全内反射,并且与基底(微孔板)相对于激发光束的位置无关地以高光耦合效率收集在所述选定非连续区域处生成的非线性光信号。棱镜或光栅阵列可以通过本领域技术人员已知的多种技术来制造,例如,在一个优选方面,它们可以由诸如环烯烃共聚物(coc)或环烯烃聚合物(cop)、丙烯酸、聚酯或类似的聚合物等平滑流动的低双折射材料注射成型。在一些方面,棱镜或光栅阵列可以制造成单独的组件,并于随后与基底的下表面进行集成。在其他方面,棱镜和光栅阵列可以基底自身一体化特征予以制造。
固定化学(immobilizationchemistries)
如本文所公开,上述任何形式的基底被进一步配置用于生物实体在指定非连续区域内的固定。生物分子或细胞的固定可以通过本领域技术人员已知的多种技术来实现,例如,通过采用氨丙基硅烷化学以胺官能团使玻璃或熔融石英表面官能化,随后使用胺反应性缀合化学来直接与感兴趣的生物分子共价偶合或者经由中间间隔基或连接体分子来共价偶合。还可以直接或间接地例如通过利用bsa-nhs(bsa-n-羟基琥珀酰亚胺)而采用非特异性吸附,具体是首先将bsa分子层附接到表面,继而用n,n'-二琥珀酰亚胺基碳酸酯将其活化。bsa上的活化赖氨酸、天冬氨酸或谷氨酸残基与蛋白质上的表面胺类反应。
在本公开内容的一个优选方面,生物分子可以通过拴系到或嵌入于“受支承脂双层”中而固定在表面上,后者包含通过疏水或静电相互作用约束于硅或玻璃表面的脂双层小片,其中所述双层“浮”在含水缓冲液薄层上的基底表面上方。还可以使用或不使用膜蛋白或其他膜相关成分来制备受支承磷脂双层,例如在以下文献中所描述:salafsky等人“architectureandfunctionofmembraneproteinsinplanarsupportedbilayers:astudywithphotosyntheticreactioncenters",biochemistry35(47):14773-14781(1996);gennis,r.,biomembranes,springer-verlag,1989;kalb等人“formationofsupportedplanarbilayersbyfusionofvesiclestosupportedphospholipidmonolayers”,biochimicabiophysicaacta.1103:307–316(1992);以及brian等人"allogeneicstimulationofcytotoxict-cellsbysupportedplanarmembranes",pnas-biologicalsciences81(19):6159-6163(1984);上述文献的相关部分通过引用而并入于此。受支承磷脂双层是本领域中公知的,并且有多种技术可以用于其制造。使用受支承脂双层将蛋白质或其他生物实体固定在基底表面或光学界面上的潜在优势包括(i)保留通常跨越细胞膜或细胞的其他膜成分并需要与双层的疏水内芯相互作用的那些蛋白质的膜蛋白质结构以稳定二级和三级结构,(ii)保留二维横向和转动扩散迁移率以研究该双层内蛋白质组分之间的相互作用,和(iii)保持分子取向,这取决于诸如研究中的蛋白质类型(即,膜或可溶性蛋白质)、双层膜如何在基底表面形成,以及蛋白质如何拴系在该双层上(在可溶性蛋白质的情况下)。具有或不具有拴系或嵌入的蛋白质的受支承双层通常应当浸没在水溶液中以防止其在暴露于空气时受损。
可以使用许多不同的锚分子、接头和/或附接化学物质,以定向方式将可溶性蛋白质和其他生物实体拴系或附接至受支承脂双层。如本文所用的,“锚分子”是嵌入至脂双层的分子,并且可以包含脂肪酸、甘油酯、甘油磷脂、鞘脂类或缀合附接部分的其他脂质或非脂质分子。
接头分子是用于提供蛋白质或其他被拴系的生物实体的附接点与嵌入脂双层平面内的锚分子上的附接点之间的空间(“垂直”)分离的分子。合适的接头分子的实例包括但不限于ω-氨基脂肪酸、聚乙二醇等。
附接部分(也称为“亲和标记物”)是提供两个生物实体之间的共价或非共价结合的特定化学结构或结合配偶体。适用于本文公开的方法的附接部分或亲和标记物的实例包括生物素和抗生物素蛋白(或生物素和链霉亲和素)以及his标记物/ni-nta结合配偶体。
高亲和力、非共价生物素-链霉亲和素相互作用被广泛用于生物测定技术以缀合或固定蛋白质或其他生物实体。蛋白质的生物素化作用使得能够通过自身粘附于表面(例如,载玻片或珠子)或与另一分子缀合的多价抗生物素蛋白或链霉亲和素分子(例如,通过使用生物素-链霉亲和素-生物素桥或接头)捕获。该生物素部分足够小,生物素化作用通常不会干扰蛋白质的功能。生物素与抗生物素蛋白或链霉亲和素之间的结合相互作用的高亲和力(kd为10-14m至10-15m)和高特异性使得即使从复杂样品中也能捕获感兴趣的生物素化的蛋白质。由于极强的结合相互作用,需要苛刻的条件从链霉亲和素涂覆的表面洗脱生物素化的蛋白质(通常用6m,ph1.5的盐酸胍),这通常会使感兴趣的蛋白质变性。使用具有降低的~10-8m的生物素结合亲和力的抗生物素蛋白或链霉亲和素的单体形式可以允许生物素化的蛋白质在必要时用过量的游离生物素洗脱。在本文公开的方法中,为了将生物素化的蛋白质和/或其他生物素化的生物实体经由生物素-抗生物素蛋白-生物素(或生物素-链霉亲和素-生物素)桥固定或拴系在该双层内,可以将包含生物素部分的脂质分子并入到受支承脂双层中。
蛋白质和其他生物实体的生物素化可以通过直接偶合来进行,例如通过使用n-羟基琥珀酰亚胺基生物素(nhs-生物素)将蛋白质表面上的伯胺缀合。或者,使用avitag方法可以方便地对重组蛋白进行生物素化,其中通过使用遗传工程和蛋白质表达技术将avitag肽序列(glndifeaqkiewhe)掺入到蛋白质中。avitag序列的存在允许通过用bira酶处理来进行蛋白质的生物素化。
his标记物化学是用于纯化重组蛋白和其他生物分子的另一个广泛使用的工具。在该方法中,例如,可以将指定六至九个组氨酸残基链的dna序列并入到用于产生包含与其n-端或c-端融合的6xhis或聚his标记物的重组蛋白的载体中。然后可以纯化并检测his标记的蛋白质,这是由于在特定的缓冲条件下,组氨酸残基链与若干类型的固定金属离子(包括镍、钴和铜)结合。支持体如琼脂糖小球或磁性颗粒可以用螯合基团衍生以固定所需的金属离子,然后其作为配体用于结合和纯化感兴趣的his标记的生物分子。
最常用于产生his标记物配体的螯合剂是次氮基三乙酸(nta)和亚氨基二乙酸(ida)。一旦制备了nta或ida缀合的支持体,就可以用所需的二价金属(例如,ni、co、cu或fe)来“加载”它们。例如,当使用镍作为金属时,得到的亲和支持体通常称为ni-螯合物、ni-ida或ni-nta支持体。his标记的融合蛋白的亲和纯化是蛋白质生物学研究中金属螯合物最常见的应用。通过nta-螯合化学固定的镍或钴金属是针对该应用的选择系统。在本文公开的方法中,可以将包含ni-nta基团(或其他螯合的金属离子)的脂质分子掺入到受支承脂双层中以用于将his标记的蛋白质和其他his标记的生物实体固定或拴系在该双层中。在一些实施方式中,所述受支承脂双层可以包含1,2-二油酰基-sn-甘油基-3-磷酸胆碱,并且也可以包含各种浓度下的1,2-二油酰基-sn-甘油基-3-[(n-(5-氨基-1-羧基戊基)亚氨基二乙酸)琥珀酰基](镍盐)。
在接近中性的缓冲液条件(生理ph和离子强度)下,聚-his标记物与螯合的金属离子最佳结合。典型的结合/洗涤缓冲液由含有10-25mm咪唑的ph7.2的tris-缓冲盐水(tbs)组成。低浓度的咪唑有助于防止具有组氨酸簇的内源性蛋白质的非特异性结合。在需要时,从螯合的金属离子支持体上洗脱并回收所捕获的his标记的蛋白质通常使用高浓度的咪唑(至少200mm)、低ph(例如0.1mph2.5的甘氨酸-hcl)或过量的强螯合剂(例如edta)来实现。已知免疫球蛋白在其fc区具有多个组氨酸,并可以与螯合的金属离子支持体结合,因此如果免疫球蛋白与感兴趣的his标记的蛋白质相比以较高的相对丰度存在于样品中,则严格的结合条件(例如,使用适当浓度的咪唑)是避免高水平的背景结合所必需的。白蛋白如牛血清白蛋白(bsa)也具有多个组氨酸,并可以在不存在丰度更高的his标记的蛋白质或在结合/洗涤缓冲液中使用咪唑的情况下产生与螯合的金属离子支持体的高水平的背景结合。
收集光学器件和检测器
图5进一步图示了用于检测在依次照射基底的非连续区域时生成的非线性光信号的收集光学器件和检测器。由于表面选择性非线性光学技术是相干技术,意味着基本光束和非线性光学光束具有以明确定义的空间关系和相位关系通过空间传播的波前,因此需要的收集光学器件最少。通过棱镜(或者上述微板装置的集成式棱镜或光栅阵列)收集发射的非线性光信号,并经由分色反射器或反射镜将其引导至检测器。可选地采用附加的光学组件,例如,透镜、光学带通滤光器、反射镜等,在光束到达检测器之前进一步对该光束进行塑形、转向和/或过滤。可以采用多种不同的光检测器,包括但不限于光电二极管、雪崩光电二极管、光电倍增管、cmos传感器或ccd器件。
x-y平移台
如图4中所示,本文公开的高通量系统的实现方案理想情况下利用高精度x-y(或者在一些情况下,x-y-z)平移台来相对于激发光束重新定位基底(上述任何形式的基底)。适宜的平移台可从多个供应商处商购获得,例如,从parkerhannifin购得。精确平移台系统通常包括若干组件的组合,包括但不限于:线性驱动器、光学编码器、伺服和/或步进马达,以及马达控制器或驱动单元。本文所公开的系统和方法要求平台移动的高精度和可重复性,以便确保当布置进行反复的光学检测和/或液体分配步骤时对非线性光信号的准确测量。另外,由于激发光的焦斑的大小[在直径或边长方面为20-200微米]显著小于基底的非连续区域的大小,因此在本公开内容的一些方面,可能还期望在进行重复测量时返回到给定非连续区域内的略微不同的位置,或者在单次测量的过程中跨非连续区域的一部分缓慢扫描激发光束,从而消除关于长时暴露或预先暴露的光漂白效应的潜在担忧。
因此,本文公开的方法和系统进一步包括指定平移台所能够相对于激发光束定位基底的精度。在本公开内容的一个方面,平移台的精度为约1um与约10um之间。在其他方面,平移台的精度为约10um或更低、约9um或更低、约8um或更低、约7um或更低、约6um或更低、约5um或更低、约4um或更低、约3um或更低、约2um或更低或者约1um或更低。本领域技术人员将会明白,平移台的精度可以在以这些值中的任何一个为界的任何范围内(例如,从约1.5um到约7.5um)。
流体分配系统
如图4中所示,本文所公开的高通量系统的一些实施方式还包括用于使固定在基底表面上的生物实体或靶实体与测试实体(或测试化合物)相接触的自动化可编程流体分配(或液体分配)系统,后者通常分配于包含添加或未添加少量有机溶剂成分例如二甲基亚砜(dmso)的水性缓冲液的溶液中。适宜的自动化可编程流体分配系统可从多个供应商处商购获得,例如,从beckmancoulter、perkinelmer、tecan、velocity11以及许多其他供应商购得。在本文所公开的系统和方法的优选方面,流体分配系统还包括多通道分配头,例如,4通道、8通道、16通道、96通道或384通道分配头,用于将可编程体积的液体(例如,范围从约1微升到若干微升)同时递送到基底上的多个孔或位置。
板装卸机器人
在本文公开的高通量系统的其他方面,该系统进一步包括微板装卸(或板装卸)机器人系统(图4),用于相对于光学激发和检测光学器件自动更换和定位基底(上述任何形式的基底),或者用于可选地在光学仪器与流体分配系统之间移动基底。合适的自动化可编程微板装卸机器人系统可从多个供应商处商购获得,包括beckmancoulter、perkinelemer、tecan、velocity11以及许多其他供应商。在本文公开的系统和方法的一个优选方面,自动化微板装卸机器人系统被配置用于从和向冷藏存储单元移动包含固定的生物实体和/或测试化合物的等分试样的多个微孔板。
处理器/控制器和基于约束的调度算法
在本公开内容的另一方面,所公开的高通量系统还包括处理器(或控制器,或者计算机系统)(图4),该处理器被配置用于运行系统软件,该系统软件控制所描述的各个子系统(激发和检测光学系统、x-y(或x-y-z)平移台、流体分配系统,以及板装卸机器人)以及对进行高通量构象分析所涉及的不同操作步骤进行同步。除了处置数据采集过程(即,从检测器收集对应于与构象变化相关联的非线性光信号的输出电子信号)之外,处理器或控制器通常还被配置用于储存数据、执行数据处理和显示功能(包括确定所测试的生物实体或者生物实体与测试实体的组合是否发生了取向或构象变化),以及操作图形用户界面以供操作者进行交互控制。处理器或控制器还可以与其他处理器连网,或者连接到因特网以便与远程位置上的其他仪器和计算机通信。
处理器/控制器的典型输入参数可以包括设置参数,诸如所要分析的微孔板总数;每板的孔数;要针对基底的每个非连续区域或微孔板的孔执行激发和检测步骤的次数(例如,以便指定终点测定或动力学测定模式);应当针对每个非连续区域或孔收集动力学数据的总时间过程;要向每个非连续区域或孔递送的测试化合物溶液的顺序、定时和体积;收集和整合非线性光信号的驻留时间;输出数据文件的一个或多个名称;以及本领域技术人员已知的多种系统设置和控制参数中的任何参数。
在本公开内容的一个优选方面,处理器或控制器进一步被配置用于通过执行基于约束的调度算法来进行系统通量优化。该算法利用上述系统设置参数来确定针对可能彼此相邻或者可能彼此不相邻的非连续区域的穿插激发/检测和液体分配步骤的最佳顺序,从而在每小时分析的生物实体和/或测试实体数目方面使系统的总通量达到最大。系统操作步骤的优化是实现高通量分析的重要方面。在所公开的方法和系统的一些方面,分析系统的平均通量范围可以是从每小时测试约10个测试实体到每小时测试约1000个测试实体。在一些方面,分析系统的平均通量可以是每小时测试至少10个测试实体、每小时测试至少25个测试实体、每小时测试至少50个测试实体、每小时测试至少75个测试实体、每小时测试至少100个测试实体、每小时测试至少200个测试实体、每小时测试至少400个测试实体、每小时测试至少600个测试实体、每小时测试至少800个测试实体或者每小时测试至少1000个测试实体。在其他方面,分析系统的平均通向可以是每小时测试至多1000个测试实体、每小时测试至多800个测试实体、每小时测试至多600个测试实体、每小时测试至多400个测试实体、每小时测试至多200个测试实体、每小时测试至多100个测试实体、每小时测试至多75个测试实体、每小时测试至多50个测试实体、每小时测试至多25个测试实体或者每小时测试至多10个测试实体。
计算机系统和网络
在各个实施方式中,本发明的方法和系统可以进一步包括安装在计算机系统上的软件程序及其用途。相应地,如上文所述,对各个子系统的计算机控制和对进行高通量构象分析所涉及的包括数据分析和显示在内的不同操作步骤的同步都在本发明的范围内。
图15中所示的计算机系统500可以理解为能够从介质511和/或网络端口505读取指令的逻辑装置,所述网络端口505能够可选地连接到具有固定介质512的服务器509上。诸如图15中所示的系统可以包括cpu501、磁盘驱动器503、可选的输入设备诸如键盘515和/或鼠标516以及可选的监视器507。通过图中所示通向本地或远程位置上的服务器的通信介质可以实现数据通信。所述通信介质可以包括任何传输和/或接收数据的手段。例如,通信介质可以是网络连接、无线连接或者因特网连接。这样的连接可以提供通过万维网的通信。可以想到,与本公开内容相关的数据可以通过这样的网络或连接来传输,以供如图15中所示的一方522来接收和/或审核。
图16是图示能够与本发明的示例实施方式相结合使用的计算机系统100的第一示例架构的框图。如图16中所描绘,示例计算机系统可以包括用于处理指令的处理器102。处理器的非限制性示例包括:intelxeontm处理器、amdopterontm处理器、samsung32位riscarm1176jz(f)-sv1.0tm处理器、armcortex-a8samsungs5pc100tm处理器、armcortex-a8applea4tm处理器、marvellpxa930tm处理器,或者功能上等同的处理器。可以利用多线程执行来进行并行处理。在一些实施方式中,还可以使用多个处理器或者具有多个核的处理器,无论是在单一计算机系统中、集群中,还是分布在包括多个计算机、蜂窝电话和/或个人数字助理装置的网路上的系统之间。
如图16中所示,高速缓存104可以连接到或者并入在处理器102中,以便为处理器102最近使用或频繁使用的指令或数据提供高速存储器。处理器102通过处理器总线108连接到北桥106。北桥106通过存储器总线112连接到随机存取存储器(ram)110,并管理处理器102对ram110的访问。北桥106还通过芯片组总线116连接到南桥114。南桥114转而连接到外围总线118。外围总线例如可以是pci、pci-x、pciexpress或其他外围总线。北桥和南桥通常称为处理器芯片组并且管理处理器、ram和外围总线118上的外围组件之间的数据传输。在一些备选架构中,北桥的功能可以并入到处理器中,而不是采用单独的北桥芯片。
在一些实施方式中,系统100可以包括附接到外围总线118的加速器卡122。加速器可以包括现场可编程门阵列(fpga)或其他用于加速某种处理的硬件。例如,加速器可以用于自适应数据重组,或者用于评价扩展集处理中的代数表达式。
外部存储124中的软件和数据可以加载到ram110和/或缓存104中以供处理器使用。系统100包括用于管理系统资源的操作系统;操作系统的非限制性示例包括:linux、windowstm、macostm、blackberryostm、iostm和其他功能上等同的操作系统,以及运行于操作系统之上的应用软件用于管理数据存储和根据本发明的示例实施方式的优化。
在本示例中,系统100还包括网络接口卡(nic)120和121,所述nic120和121连接到外围总线,用于提供通向诸如网络附加存储(nas)等外部存储和其他可用于分布式并行处理的计算机系统的网络接口。
图17为示出网络200的视图,该网络200具有多个计算机系统202a和202b、多个蜂窝电话和个人数据助理202c,以及网络附加存储(nas)204a和204b。在示例实施方式中,系统202a、202b和202c可以管理数据存储和优化对储存在网络附加存储(nas)204a和204b中的数据的数据访问。可以针对数据采用数学模型,并且利用跨计算机系统202a和202b以及蜂窝电话和个人数字助理系统202c的分布式并行处理来对其进行评价。计算机系统202a和202b以及蜂窝电话和个人数字助理系统202c还可以提供用于对储存在网络附加存储(nas)204a和204b中的数据进行自适应数据重组的并行处理。图17仅图示了一个示例,而各种各样的其他计算机架构和系统均可结合本发明的各个实施方式使用。例如,可以使用刀片服务器来提供并行处理。处理器刀片可以通过背板连接,以提供并行处理。存储也可以连接到背板,或者通过单独的网络接口作为网络附加存储(nas)而连接。
在一些示例实施方式中,处理器可以保持单独的存储器空间,并通过网络接口、背板或其他连接器传输数据,以供由其他处理器进行并行处理。在其他实施方式中,一些或所有处理器可以使用共享虚拟地址存储器空间。
图18是根据示例实施方式,利用共享虚拟地址存储器空间的多处理器计算机系统的框图。该系统包括可以访问共享存储器子系统304的多个处理器302a-f。系统在存储器子系统304中并入了多个可编程硬件存储器算法处理器(map)306a-f。每个map306a-f可以包括存储器308a-f以及一个或多个现场可编程门阵列(fpga)310a-f。map提供了可配置的功能单元,并且特定算法或算法部分可被提供给fpga310a-f用于密切协同相应的处理器进行处理。例如,在示例实施方式中,map可以用于评价关于数据模型的代数表达式,以及进行自适应数据重组。在该示例中,每个map可由所有处理器出于这些目的而全局访问。在一种配置下,每个map可以使用直接存储器存取(dma)来访问关联的存储器308a-f,从而允许其与相应的微处理器302a-f独立地和异步地执行任务。在该配置下,map可以直接将结果馈送到另一map以供算法的流水线操作和并行执行。
上述计算机架构和系统仅为示例,并且各种各样的其他计算机、蜂窝电话和个人数字助理架构和系统均可结合示例实施方式来使用,包括采用通用处理器、协处理器、fpga和其他可编程逻辑器件、片上系统(soc)、专用集成电路(asic)以及其他处理和逻辑元件的任意组合的系统。在一些实施方式中,整个计算机系统或其部分能够以软件或硬件来实现。可以结合示例实施方式使用任何种类的数据存储介质,包括随机存取存储器、硬盘驱动器、闪速存储器、磁带驱动器、磁盘阵列、网络附加存储(nas)以及其他本地式或分布式数据存储设备和系统。
在示例实施方式中,计算机系统可以利用执行于任何上述或其他计算机架构和系统上的软件模块来实现。在其他实施方式中,系统的功能可以部分地或全部地实现于固件、可编程逻辑器件诸如参照图18的现场可编程门阵列(fpga)、片上系统(soc)、专用集成电路(asic)或者其他处理和逻辑元件中。例如,可以通过利用硬件加速器卡,诸如图16中所示的加速器卡122,以硬件加速来实现集处理器和优化器。
实施例1-二氢叶酸还原酶(dhfr)突变体的结构参数的确定
玻璃器皿和超声处理的脂质制剂:在开始之前用piranha洗液洗涤所有玻璃器皿(20分钟)。小心使用——piranha洗液大量放热并易于爆炸,特别是与有机物接触时。在通风橱中,在耐热的玻璃器皿如pyrex中,通过首先测量h2o2,然后加入乙酸来制备溶液。用氯仿(chcl3)冲洗真空瓶。确定dopc脂质与dgsnta-ni的所需摩尔比,同时尽可能地小心避免暴露于空气中。将装有脂质混合物的真空瓶放在旋转蒸发仪上。蒸发至干(约30秒),然后在蒸发的制剂上方用n2吹10min以除去残留的chcl3。在2mldih2o中重悬脂质混合物。剧烈涡旋直至形成混浊的悬浮液(约5分钟)。将悬浮液转移至4ml聚苯乙烯试管中。在冰上超声处理脂质混合物直至溶液清澈。在超声发生器设置为25%功率的情况下,这应该需要约60-90秒。
将超声处理的脂质溶液转移到微量离心管中,并在4c下以17,000xg离心30分钟。将上清液转移到干净的微量离心管中,并将成品脂质制剂保存在4℃下,该制剂稳定长达约1个月。
载玻片准备与蛋白质加载:临应用dopc/dgsnta(ni)之前,用piranha洗液清洗显微镜载玻片20分钟。在载玻片染色容器中用dih2o洗涤3x。用压缩的氮气干燥载玻片。通过将粘性垫圈与piranha清洗的载玻片附接来组装shg孔(即,每个载玻片含有1-20μl体积的16个孔)。使用装配夹具对齐垫圈,小心地将载玻片放入装配夹具中并牢牢按压。用pbs或tbs缓冲液1:1稀释dopc/dgsnta(ni)脂质制剂。需要100mmnacl来减少载玻片的流体静力学电荷,并使受支承脂双层(slb)能够形成。将10-20μl稀释的dopc/dgsnta(ni)脂质移液到载玻片的孔中,并在室温下温育5分钟。通过将载玻片浸没在缓冲液浴(pbs或tbs)中,并用200μl移液器搅拌来洗涤孔,小心在任何时候不得将空气引入到孔中。用新鲜的缓冲液更换在浴中的全部体积的缓冲液,并重复洗涤步骤2次以上。向所有孔中加入1:1体积的100mmnicl2溶液,并在室温下温育10分钟。通过将载玻片浸没在缓冲液浴(pbs或tbs)中,并用200μl移液器搅拌来洗涤孔。用新鲜的缓冲液更换在浴中的全部体积的缓冲液,并重复洗涤步骤2次以上。如有必要,将孔中的缓冲液更换为合适的蛋白质加载缓冲液,并将感兴趣的靶蛋白加载到孔上。在室温下温育30-90分钟,然后在开始试验之前用测定缓冲液彻底冲洗孔。
通过如上所述的超声处理制备小型单层水泡(suv),并将其施加到piranha洗涤的fisher载玻片上以制作slb表面。加入nicl210分钟,并在标记缓冲液中洗涤孔。
将经标记蛋白质以3μm(微摩尔)加载到如上所述制作的slb表面上45分钟,然后洗涤。如果添加咪唑或edta或者蛋白质与slb表面在一种或两种蛋白质的存在下温育,则shg信号降至基线水平,表明具体地经由蛋白质的his标记物发生了与表面的附接。
使用本领域已知的方法创建具有n-端或c-端8xhis标记物的大肠杆菌蛋白质二氢叶酸还原酶(dhfr)的突变体(rajagopalan,p.等人(2002),“interactionofdihydrofolatereductasewithmethotrexate:ensembleandsingle-moleculekinetics”,proc.nat.acad.ofsci.(usa)99(21):13481-6;goodey,n.(2008),“allostericregulationandcatalysisemergeviaacommonroute”,natchem.biol.4(8):474-82;antikainen,n.(2005),“conformationcoupledenzymecatalysis:asingle-moleculeandtransientkineticsinvestigationofdihydrofolatereductase”,biochemistry44(51):16835-43)。在第一种情况下,制备半胱氨酸最小化的突变体,其中两个天然半胱氨酸都被除去(c85a和c152a)。然后将两个单一的不同残基(例如,m16c、n23c、q65c、v136c、d142c、a19c等)突变为半胱氨酸,即在该半胱氨酸最小化的背景下产生了两个单位点突变构建体:突变体1和突变体2。为了选择突变的位点,将蛋白质表面上的多个残基突变为半胱氨酸,并测定被shg探针标记的能力。在第二种情况下,标记野生型蛋白质,并且探针与c152的附接通过质谱分析法确认。将野生型或重组蛋白纯化到25mmtrisph7.2,150mmnacl中。按照制造商的说明,用马来酰亚胺染料标记蛋白质,例如,蛋白质以约50μm的20:1的染料:蛋白质的标记比例在25mmtrisph7.2、150mmnacl、1mmtcep和10%甘油中温育(最终dmso浓度为5%)。将蛋白质在4c下搅拌过夜,然后凝胶纯化到25mmtris-hclph7.2、150mmnacl、1mmtcep中。然后经由his标记物将标记并纯化的蛋白质拴系在slb表面。
使用本领域技术人员已知的方法,将shg信号的偏振依赖性测量用于确定针对两个不同突变体的χ(2)的独立非零分量。例如,在最简单的光学几何形状和假定方位角的各向同性及超极化率张量的单一优势分量中,确定χ(2)的两个独立非零分量(χzzz和χxzx或χzxx)。这些进而被用于最佳地确定与每个突变体的θ(即θ1和θ2)相关的取向分布。
例如,对于在c-端经由his标记物拴系于脂双层的单位点半胱氨酸标记的v136c、q65c和n23c,假定取向为δ函数(单一角度和无取向分布宽度),则染料超极化率相对于表面法线(z轴)的平均角度如下:
v136c35.3°
q65c47.5°
n23c38.5°
图13a-b示出了在n-端或c-端通过his标记物标记的或拴系的各种shg标记的单位点半胱氨酸突变体的测量值izzz。显而易见的是,经标记蛋白质的绝对信号幅度(基线信号)随着对于n-端和c-端标记的和拴系的蛋白质的标签位点而变化(分别见图13a和图13b)。
配体的添加引起shg基线信号水平的变化(shg%变化),要么是正值要么是负值,其由标签在蛋白质集合上的重新取向所导致,换句话说,由配体结合引起的标签取向分布的变化所导致。图14a和图14b显示了其中本领域技术人员公知的结合dhfr的1μm(微摩尔)tmp配体产生基线信号(izzz)差异变化的实验结果。从图14a和图14b可以看出,shg信号的方向和大小随着针对常见标记和拴系(例如,n-端或c-端标记)的位点以及在n-端和c-端标记的突变体的结果中变化。例如,如图14a所见,添加tmp引起在n-端经由其his标记物附接和定向的蛋白质突变体的基线信号降低大约70%,但是在c-端经由his标记物附接和定向的突变体则降低大约90%。
对于izxx可以重复类似的测量,并且可以假定窄取向分布,使用两个偏振依赖性强度的比例来根据蛋白质构建体(例如,n-端或c-端标记物)确定标签在每个半胱氨酸位点处的平均角度。
实施例2(预测)
实施例1的实验可以扩展到包括3个或更多个不同的his标记物长度,这导致了待观察的不同的取向分布。这将独立偏振测量值的数目增加到48个,并且增加了角度测量和蛋白质结构模型的精度。
实施例3(预测)
实施例2的实验可以扩展到包括4种不同盐浓度(例如,0、50mm、200mm和300mmnacl)的不同缓冲液,其产生不同的取向分布。这将独立偏振测量值的数目增加到384个,并且增加了角度测量和蛋白质结构模型的精度。
实施例4(预测)
实施例3的实验可以扩展到包括不同浓度的加入到缓冲液中的分子(即添加剂)(例如,peg400(10μm、20μm、40μm和80μm微克分子peg400)),该分子与界面区域关联并产生不同的取向分布。这增加了独立取向分布和偏振测量值的数目,并且增加了角度测量和蛋白质结构模型的精度。
实施例5(预测)
实施例4的实验可以扩展到包括根据本领域技术人员已知的方法,在整个受支承脂双层上施加横向电场。施加四种不同的电场强度(零、低、中和高)。在384孔玻璃底板孔(~3mm直径)中的双层区域中对金属片进行图案化,并且对这些片施加范围为0.1–100v的电压,对应于场强~1v/cm–1e4v/cm。如本领域技术人员已知的,所施加的电场通过电泳和电渗机制改变了蛋白质群体的取向分布;所施加电场的不同大小导致蛋白质的不同取向群体,并允许独立的偏振测量。这增加了角度测量和蛋白质结构模型的精度。
实施例6
实施例5的实验可以扩展到包括dhfr的10个不同突变体,每一个均在不同的单半胱氨酸位点处标记。这增加了独立偏振测量值的数目,以及角度测量和蛋白质结构模型的精度。
尽管本文中已经示出并描述了本发明的优选实施方式,但对于本领域技术人员显而易见的是这些实施方式仅以示例的方式提供。本领域技术人员在不脱离本发明的情况下现将想到多种变化、改变和替代。应当理解本文中所述的本发明实施方式的各种替代方案均可用于实施本发明。旨在由所附权利要求来限定本发明的范围,并由此涵盖这些权利要求范围内的方法和结构及其等同物。
- 还没有人留言评论。精彩留言会获得点赞!