一种基于多功能纳米级蛋白薄膜的石墨烯肿瘤标志物传感器及其制备方法与流程
本发明属于石墨烯生物传感器领域,特别涉及一种基于多功能纳米级蛋白薄膜的石墨烯肿瘤标志物传感器及其制备方法。
背景技术:
随着纳米线、碳纳米管以及石墨烯等纳米材料的出现,通过电学检测方法利用生物自身的电荷可以更加有效地实现生物分子的检测。生物传感界面中传感材料的选择对于构建高灵敏度、价格合理的生物传感器具有关键性的作用。二维石墨烯材料具有sp2杂化的碳原子以蜂巢晶格方式排列成单层原子结构。优异的机械、光学、电学性能以及高比表面积,这些特点使得石墨烯成为一种理想的生物电子传感材料。基于石墨烯的生物传感器在蛋白、dna、纳米金以及细菌等生物分子的检测中已经有了多样化的应用。
为了能够保持石墨烯本身优异的电学性能,非共价的修饰方法通常被用于石墨烯生物传感器的构建中。这些非共价的交联剂通常通过自组装的方式吸附在石墨烯的表面,但存在吸附量很难控制、容易引入假阳性信号等问题。
在传统的石墨烯生物传感器的构建中,器件的制作和界面的修饰通常是两个独立的部分。而在器件的制作中,光刻、刻蚀以及绝缘层的制作等工艺都会在石墨烯表面引入表面污染,影响石墨烯的性能与生物探针的修饰,对石墨烯生物传感器的构建造成不利的影响,因此利用新方法来构建生物传感器具有重要的意义。
技术实现要素:
本发明所要解决的技术问题是提供一种基于多功能纳米级蛋白薄膜的石墨烯肿瘤标志物传感器及其制备方法,该传感器修饰过程简单易于操作,通用性强,可以根据不同的需求进行不同的修饰来实现不同目标分子的高灵敏度和特异性的检测,具有良好的应用前景。
本发明的一种基于多功能纳米级蛋白薄膜的石墨烯肿瘤标志物传感器,所述传感器包括转移至二氧化硅衬底上的石墨烯、多功能纳米级蛋白薄膜以及反应腔;其中,多功能纳米级蛋白薄膜非共价修饰于石墨烯表面;所述多功能纳米级蛋白薄膜为失活bsa蛋白薄膜。
所述失活bsa蛋白薄膜的厚度为9nm-15nm。可以通过改变修饰的条件实现对石墨烯不同类型的掺杂以及不同厚度的修饰,而且利用这种修饰方式可以减小石墨烯对生物分子的非特异性吸附,以避免假阳性信号的出现。
所述失活bsa蛋白薄膜的失活温度为60-90℃,失活时间为1-3min。
所述失活bsa蛋白薄膜表面偶联抗体。
所述抗体通过edc/nhs修饰于失活bsa蛋白薄膜表面。
本发明的一种基于多功能纳米级蛋白薄膜的石墨烯肿瘤标志物传感器的制备方法,包括:
(1)在二氧化硅衬底上制作钛金电极,将石墨烯转移至钛金电极表面;
(2)将bsa溶液滴加在石墨烯的表面进行热失活处理,失活完成后清洗,得到失活bsa蛋白薄膜修饰的石墨烯;
(3)利用光刻定义失活bsa蛋白薄膜修饰的石墨烯的沟道尺寸,利用等离子体进行刻蚀,刻蚀完成后用丙酮将沟道表面光刻胶溶解;
(4)将su-8光刻胶旋涂在失活bsa蛋白薄膜修饰的石墨烯沟道表面作为保护绝缘层;
(5)在失活bsa蛋白薄膜表面偶联抗体,偶联完成后利用bsa溶液进行封闭,将反应腔固定在器件的表面,即得。
所述步骤(1)中的石墨烯为单层石墨烯。钛金电极厚度分别为10nm和100nm。
所述步骤(2)中的bsa溶液的浓度为1%-10%。
所述步骤(3)中的等离子体刻蚀的时间为4min-8min。
所述步骤(3)中利用失活的bsa蛋白薄膜作为石墨烯的保护层,步骤(4)中失活的bsa蛋白薄膜作为石墨烯的保护层避免su-8胶对石墨烯的影响。
所述步骤(5)中利用edc和nhs作为交联剂偶联抗体,edc浓度为3mg/ml-6mg/ml,nhs浓度为0.6mg/ml-1.2mg/ml,抗体浓度为1mg/ml-3mg/ml。
所述步骤(5)中的bsa溶液的浓度为1%,封闭时间为0.5-2小时。
本发明利用失活bsa蛋白薄膜既作为石墨烯器件制作工艺过程的保护层,同时又作为石墨烯的非共价交联剂偶联生物探针,构建石墨烯生物传感器。该传感器的特点是通过多功能的失活bsa薄膜,可以解决器件在制作过程中引入表面污染的问题,提高器件的性能,并利用edc和sulfo-nhs在失活bsa薄膜表面偶联抗体,实现目标分子的高灵敏度和特异性的检测。
有益效果
本发明在石墨烯表面修饰失活bsa蛋白薄膜,不仅可以作为石墨烯器件制作的保护层,同时作为石墨烯的非共价交联剂来偶联生物探针,通过液栅石墨烯场效应管可以实现目标分子的检测;修饰过程简单易于操作,通用性强,可以根据不同的需求进行不同的修饰来实现不同目标分子的高灵敏度和特异性的检测,具有良好的应用前景。
附图说明
图1为本发明的结构示意图;其中,1为硅衬底,2为二氧化硅,3为漏端,4为源端,5为石墨烯,6为失活bsa蛋白薄膜,7和8为su-8光刻胶,9为反应腔,10为抗体,11为电解液,12为目标分子抗原,13为ag/agcl参比电极;
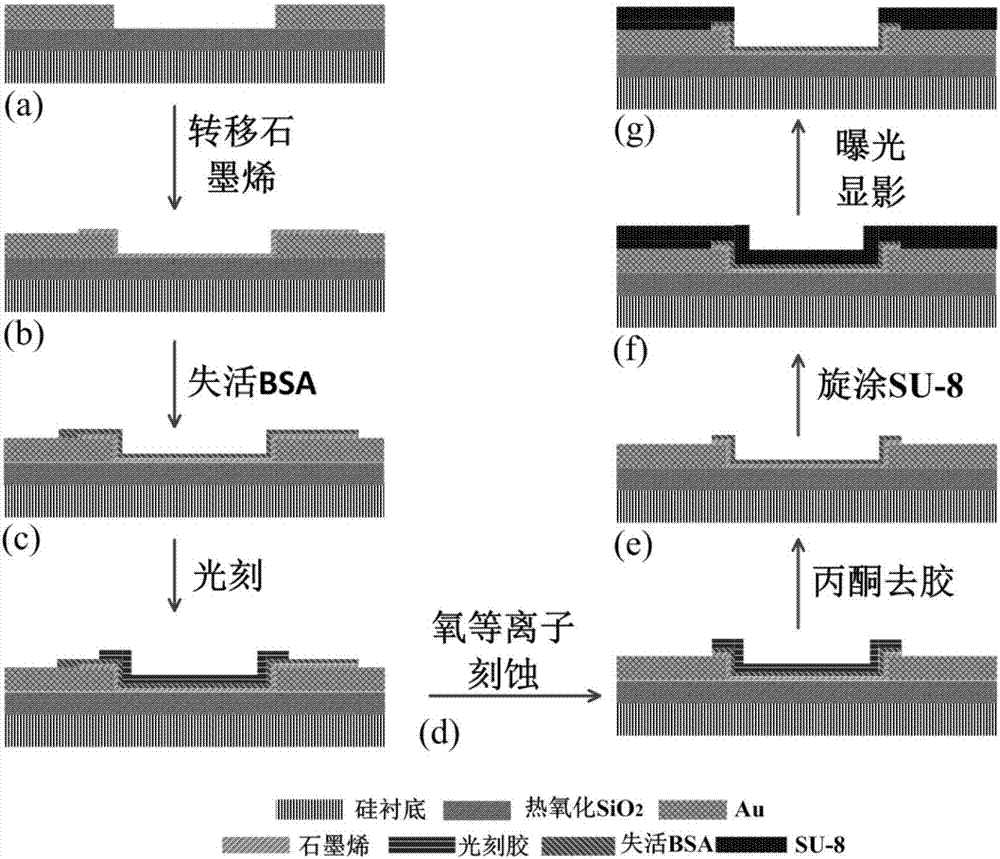
图2(a)~(g)为本发明的制备工艺流程图;
图3为本发明源漏电流的增量随癌胚抗原(carcinoembryonicantigen,cea)浓度的变化曲线;图4为本发明的特异性检测曲线。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1
如图1所示,本实施例的制备过程如下:
在硅衬底上带有300nm的二氧化硅,通过剥离(lift-off)工艺在二氧化硅表面制作钛金电极分别作为漏端和源端,在金电极表面转移单层石墨烯,工艺步骤如图2(a)所示。将bsa溶液滴加在石墨烯表面,在80℃下失活3min石墨烯表面形成失活的bsa蛋白薄膜,工艺步骤如图2(b)所示。通过光刻工艺确定石墨烯沟道尺寸并用氧等离子体刻蚀将沟道以外的部分刻蚀掉,工艺步骤如图2(c)和图2(d)所示。最后用丙酮将沟道保护的光刻胶溶解,工艺如图2(e)所示,旋涂su-8光刻胶作为电极的绝缘保护层,曝光显影后留下电极表面的su-8光刻胶,工艺步骤如图2(f)和2(g)所示。整个工艺流程中失活bsa蛋白薄膜都作为石墨烯的保护层来避免表面污染。
基于失活bsa蛋白薄膜修饰的石墨烯器件制作完成后,利用edc和nhs在失活bsa薄膜表面偶联cea的抗体(anti-cea),修饰完成后用1%bsa封闭1小时,封闭完成后在器件表面固定反应腔,加入1μm的磷酸盐缓冲液作为电解液,采用电化学的ag/agcl参比电极与电解液一起共同构成栅极。通过在石墨烯场效应管的源和漏两端加上固定的电压vds和以及栅源两端加上固定的电压vgs,通过加入不同浓度的目标分子cea抗原,通过测量源漏电流的变化实现目标分子的检测。
具体检测抗原的流程如下:
(1)不同浓度抗原的检测,在反应腔中加入200ul的测试缓冲液,将anti-cea修饰的石墨烯场效应管源极接地,其漏极加上0.1v的电压,栅极加上-0.3v的电压,记录加入不同抗原浓度下源漏电流的增量,如图3所示。由图3可知,随着带负电的目标分子cea被anti-cea捕获数量的增大,石墨烯沟道的电导增大,使得anti-cea修饰的石墨烯场效应管源漏电流增大。
(2)特异性的检测,测试条件与(1)中所述相同,在反应腔中依次加入2ul的血清稀释液(cotrol)、鳞状细胞癌(squamouscellcarcinoma,scc)、细胞角蛋白19片段(cytokerantin-19-fragment,cyfra21-1)以及cea抗原,对gfet源漏两端之间的电流进行实时的监测,电流的变化曲线如图4所示。从结果可以看出基于失活bsa蛋白薄膜修饰的石墨烯场效应管对目标分子cea蛋白的响应明显高于对照组的响应,因此可以确定该器件具有良好的特异性。
- 还没有人留言评论。精彩留言会获得点赞!
- 基于石墨烯/透明导电薄膜的双向吸波透明电磁屏蔽器件的制造方法与工艺
- 基于石墨烯网栅与透明导电薄膜的双向吸波透明电磁屏蔽器件的制造方法与工艺
- 基于石墨烯/透明导电薄膜复合结构的电磁屏蔽光窗的制造方法与工艺
- 基于石墨烯网栅与透明导电薄膜层叠结构的电磁屏蔽光窗的制造方法与工艺
- 石墨烯基复合薄膜、自清洁太阳能薄膜电池及制备方法与制造工艺
- 一种高电容率薄膜电容器用石墨烯钛酸钡聚酰亚胺复合膜材料及其制备方法与制造工艺
- 一种石墨烯基应变传感薄膜及其制备方法和应用与制造工艺
- 一种高温石墨烯薄膜应变片的制造方法与工艺
- 一种高比电容薄膜电容器用石墨烯钛酸钡聚酰亚胺复合膜材料及其制备方法与制造工艺
- 真空蒸镀法制备还原氧化石墨烯薄膜的制造方法与工艺