一种快速评价石油污染土壤生态毒性的方法与流程
本发明属于土壤污染检测领域,具体涉及一种快速评价石油污染土壤生态毒性的方法。
背景技术:
石油是古代海洋或湖泊中的生物经过漫长的演化而形成的由多种化合物组成的复杂混合物。常温下石油为黑色或深棕色的粘稠状液体,密度为829-896kg/m3,其化学组成和物理性质随产地不同而异。石油的主要组成成分为烃类,占总成分的95%以上,其余为微量的氮、氧和硫等杂原子,以及痕量的金属元素钒、镍和铁等。烃类物质按其结构可分为饱和烃(包括正链烷烃、异构烷烃和环烷烃)、芳香烃(包括单环、双环和多环芳烃)、胶质(由嘧啶、喹啉、咔唑、噻吩、亚砜、氨基化合物组成的复合体)及沥青质(由环烷酸、硫化物、多元酚、脂肪酸、金属卟啉组成的复合体)。石油组分中对生物和人体具有毒性效应的成分,称为石油污染物。如芳香烃和重金属,在现有科技水平下,被认为是主要的生态毒性物质。大部分多环芳烃化合物如苯并(a)芘、荧蒽、苯并(b)荧蒽等具有致突变、致畸和致癌的“三致”效应,是环境管理中需要优先控制的污染物。
石油通过原油泄漏和溢油事故、含油固体废弃物、含油废水排放及灌溉、大气污染及汽车尾气排放和药剂使用等方式进入土壤。土壤中的石油含量超过土壤负荷,引起土壤环境质量恶化的过程,称为土壤的石油污染。土壤中的石油污染物,通过一系列的物理、化学和生化反应,在土壤环境中迁移转化,不仅影响土壤中植物和动物的生长和繁殖,还通过呼吸、皮肤接触、饮食摄入等途径危害人类健康。因此,对于石油污染,在避免土壤石油污染事故发生的同时,加强对现有土壤石油污染物的生物毒性进行检测并评价其土壤生态毒性,成为土壤环境管理的当务之急。
然而,由于原油组成的复杂性,传统色谱检测污染物的方法,不仅费用昂贵技术复杂,且以单个污染物浓度为检测对象的方法,很难对多物质混合的石油污染物综合生物毒性做出正确评价。根据研究,以色谱检测单物质为主的检测方法,不仅无法满足原位检测的需求,且容易高估污染物的生物有效性和危害程度。
环境污染物生物毒性评价,就是利用不同生物体或生物细胞暴露在不同剂量的待测污染物环境中,以其行为功能、存活度、适合度或进化进程的变化程度作为评价指标,来反应污染物的毒性水平。石油污染物可以通过生物体代谢、体表渗透和生物链传输、放大,富集于生物体内,引起生物体中毒。在大剂量、高浓度下的中毒反映症状,主要表现为致死性、神经性、对造血功能的损伤和酶活性的抑制。在小剂量、低浓度之下,导致慢性中毒,表现为代谢毒性、生活毒性以及“致癌、致畸、致突变”的三致毒性效应。
石油污染的生物毒性评价在水生生物中有广泛的研究。主要利用海洋微藻、蚤类和卤虫等浮游生物、以斑马鱼为代表的试验鱼,以生长状况、形态变化和致死率等为检测指标,利用指标变化评价水的石油污染生物毒性。
土壤中的石油污染毒性主要采用陆地动物,如蚯蚓、小鼠、猫、狗等的生理变化作为检测和评价指标。蚯蚓处于陆生生物食物链最底层,对大部分污染物都有富集作用。根据我国国家标准《化学品蚯蚓急性毒性试验(gbt21809-2008)》,可利用蚯蚓作为指示生物,以在污染土壤环境培养7d、14d的死亡率作为指标,评价污染土壤的毒性水平。国际标准化组织(iso)提出了利用蚯蚓回避行为反应评价土壤环境质量的标准,即通过回避行为评价污染土壤对的生物毒性。据研究,石油烃污染土壤对蚯蚓的7dlc50和14dlc50分别为32.5、29.4g/kg,土壤中石油烃的浓度为8.0g/kg时,蚯蚓有明显的回避反应(回避率达80%)。在哺乳类实验动物中,小鼠个体小,饲养管理方便,生产繁殖快,具有丰富的实验研究资料参考对比性,是国际认可的急性毒性测试生物。通过小鼠上呼吸道刺激试验,以小鼠的呼吸率变化为毒性评价指标,比较其与污染物吸入前后呼吸效率变化程度,可以判断是否受到上呼吸道刺激作用并进行污染物毒性效应评价。通过大鼠4小时激惹(challenge)实验,观察其吸入石油污染物后抵抗力的增减,利用致死率以及内脏器官病理变化指标,可以判断污染物的毒性效应。通过小鼠、大鼠、猫、狗等生物急性吸入试验、亚急性吸入试验,检测其吸入不同浓度污染物7-14天或13周暴露过程中,血液生化指标、病理指标以及所受到的致病、致死效应,可以判断污染物的生物毒性水平。但上述方法存在实验步骤繁琐、耗时长、效率低等问题,且评估结果仅能反映石油污染物对评价指标生物的毒害作用,无法反映土壤石油污染的综合生物毒性作用。
技术实现要素:
本发明针对现有方法的缺陷,提供了一种快速评价石油污染土壤生态毒性的方法。
本发明所提供的评价石油污染土壤生态毒性的方法,包括下述步骤:
1)以鼠李糖脂溶液为提取剂对待测石油污染土壤中的石油污染物进行提取,得到待测石油污染物提取液;
2)将所述待测石油污染物提取液与发光细菌混合反应,同时以nacl溶液为对照,将nacl溶液与发光细菌混合反应相同的时间,分别记录试样和对照的即时发光量,根据下述公式计算样品的相对发光率(%);
3)根据所述样品的相对发光率,判断土壤样品生态毒性。
上述方法步骤1)中,所述鼠李糖脂溶液的浓度为1-2g/100ml,具体可为1g/100ml。
所述1g/100ml的鼠李糖脂溶液可按照包括下述方法进行制备:氯化钠2g,鼠李糖脂1g,加蒸馏水100ml,于磁力搅拌器搅拌均匀,适当滴加naoh使鼠李糖脂完全溶于溶剂,再加hcl调节ph值为7.5。
所述鼠李糖脂溶液与待测石油污染土壤的配比为:9-11ml:1g,具体可为10ml:1g。
上述方法步骤2)中,所述发光细菌为费氏弧菌。
所述待测石油污染物提取液与发光细菌的配比为:1ml:0.8-1.2ml,具体可为1ml:1.0ml,其中,发光细菌每毫升菌液不低于1.6万个细胞(5ml测试管)或2万个细胞(2ml测试管)。
所述nacl溶液为浓度为2g/100ml的氯化钠溶液。
所述nacl溶液与发光细菌的配比为:1ml:0.8-1.2ml,具体可为1ml:1.0ml。
所述发光细菌为发光细菌菌剂溶液,优选为发光细菌冻干粉复苏液。
所述发光细菌冻干粉复苏液通过下述步骤进行制备:将冷的氯化钠溶液注入发光细菌冻干粉中,充分混合后,静置复苏发光。
其中,所述氯化钠溶液的浓度为2g/100ml。
所述氯化钠溶液与发光细菌冻干粉的配比为2ml:0.5g,其中,发光细菌冻干粉中休眠细胞(冻干粉)密度不低于每克800万个细胞。
所述静置的时间为10min。
步骤2)中,所述反应的时间为14-16min,具体可为15min。
上述方法步骤3)中,相对发光率越高,表明毒性越低。
当相对发光率小于55%时,该样品生态毒性为剧毒;相对发光率在55-65%时,样品生态毒性为高毒;相对发光率在65-75%时,样品生态毒性为低毒;相对发光率在75-90%时,样品生态毒性为微毒;相对发光率大于90%时,该样品生态毒性为无毒。
本发明选择发光细菌作为土壤石油污染的感应菌,通过选择能稳定、灵敏、快速地反映环境中石油污染浓度变化的菌种,以其光强作为检测指标,通过构建光强-石油污染浓度,以及石油污染浓度-毒性关系模型,建立石油污染土壤生物毒性快速检测技术和评价标准。
本发明以土壤环境中总石油烃(tph)含量作为石油污染的表征指标,以发光细菌对不同浓度石油烃的光强响应值(相对发光强度),作为石油污染土壤的检测指标。通过以浓度-光强响应关系为基础的关系模型,建立相应的石油污染土壤生物毒性标准,以快速评价石油污染土壤的生态危害。
本发明根据国家《中长期发展纲要》中提出的推进环保领域核心技术的要求,研发了石油污染物土壤的快速检测方法和毒性评价标准,为综合监测和评价石油污染物的生物毒性,管控和修复石油污染土壤,提供技术支持。
附图说明
图1为费氏弧菌、明亮发光杆菌t3和青海弧菌q67三种发光细菌在0-30min的相对发光度。
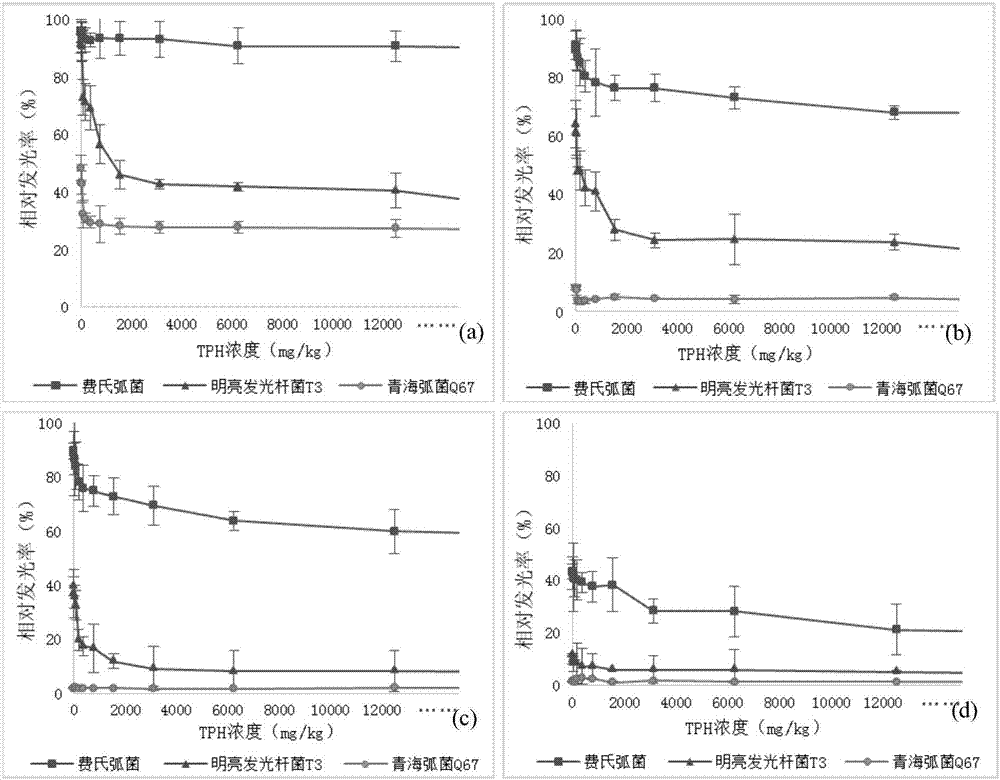
图2为不同发光细菌在不同tph浓度作用下的相对发光率(%),其中a为5min,b为10min,c为15min,c为30min。
图3为费氏弧菌在不同环境和不同浓度tph作用下的相对发光率(%),其中a为ph值,b为盐度(%),c.温度(℃)。
图4-1为发光细菌与浓度0.005%-1%的tween20,tween80,tritonx100,sdbs和rhamnolopid提取的石油污染物提取液作用5、15、30min的发光响应。
图4-2为发光细菌与rhamnolopid提取液在不同rhamnolopid浓度下的发光率。
图5为费氏弧菌不同浓度tph作用15min的相对发光率(%)。
图6为本发明的实验步骤及各步骤的耗时。
具体实施方式
下面通过具体实施例对本发明进行说明,但本发明并不局限于此。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法;下述实施例中所用的试剂、生物材料等,如无特殊说明,均可从商业途径得到。
实施例1、感应菌种的选择
选择三个常见的发光细菌,费氏弧菌(vibriofischeri)、明亮发光杆菌t3(photobacteriumphosphoreumt3)和青海弧菌q67(vibrioqinghaiensisq67),比较其从冻干状态迅速复苏的能力,对石油污染物的浓度感应范围、不同环境因子作用下的发光响应,选择具有复活能力强、灵敏度高、稳定性强的发光细菌作为土壤石油污染物感应菌。
(1)发光细菌的复活能力
比较三种发光细菌从冻干粉状态恢复正常发光的所需的时间和发光亮度(如图1所示),发现费氏弧菌和明亮发光杆菌t3在0-20min有持续稳定的发光,且发光光强度明显高于青海弧菌q67。说明费氏弧菌和明亮发光杆菌t3有较强的复活能力,能从休眠状态迅速恢复到正常生存状态。
(2)发光细菌对不同浓度石油污染的响应
通过复活能力实验发现,费氏弧菌、明亮发光杆菌t3和费氏弧菌q67在无污染物抑制时均能稳定发光。设施tph浓度为12.2-50000mg/kg的暴露条件,比较三种发光细菌对不同浓度tph在5、10、15、30min的发光强度,结果显示于图2。
相对于5、10和30分钟的反应时间,在15分钟的时候,3种测试菌都表现出较好的响应关系(图2,c)。在15分钟的时候,费氏弧菌发光强度在tph浓度为195.3mg/kg出现光强降低的现象,并随tph浓度增加,相对发光率呈现明显的线性变化趋势,到50000mg/kg浓度,光强降低到54%。明亮发光杆菌t3相对发光率随tph浓度变化较10分钟时平稳,在tph浓度为195.3mg/kg光强明显减低,随tph浓度增加,相对发光率持续减小,到50000mg/kg浓度,相对发光率降低到6.2%;而青海弧菌耐受性较弱,暴露在不同浓度tph15分钟后,相对发光率只有1.6-2.4%。由此可见,费氏弧菌与污染物作用15分钟时,其剂量-光强响应效应最好。
实施例2、费氏弧菌的环境指标的确定
环境能影响发光细菌的生长和代谢过程,从而影响其发光强度和稳定性。为了消除环境条件对感应菌种发光效应的影响,在此检测不同环境因子和不同石油污染浓度的双因子作用下,费氏弧菌的发光强度和稳定性(图3)。环境因子包括ph值、盐度、温度。
可见费氏弧菌在ph7-9范围内都没有显著性变化,在ph值大于10时,相对发光率略有下降。费氏弧菌在0-5%盐度条件下,相对发光率趋于稳定,在盐度2-4%时相对发光率略高于平均水平。费氏弧菌在0-10℃的发光响应都较为稳定,温度高于30℃时,费氏弧菌相对发光率有下降趋势。
综上研究结果,选择比明亮发光杆菌t3小种(photobacteriumphosphoreumt3)、和青海弧菌q67(vibrioqinghaiensisq67)复活能力强、发光稳定,且对石油污染的响应浓度范围较广的发光细菌费氏弧菌(vibriofischeri)作为感应菌,以其发光强度作为测定指标,建立石油污染土壤生物毒性快速检测方法和评价标准。费氏弧菌(vibriofischeri)的活性最高的环境条件为酸碱度ph7-9、盐度2-4%、温度0-30℃。由于费氏弧菌是海洋菌,结合实验结果,参考费氏弧菌检测水质毒性的国际iso标准(bseniso11348-3-1999),选择盐度2%、ph值7.5作为费氏弧菌的检测环境条件。
实施例3、土壤石油污染物萃取剂的选择
根据萃取剂既要保持发光细菌活性,又要快速高效的萃取土壤中石油污染物的需求,选择吐温-20(tween20),吐温-80(tween80),聚乙二醇辛基苯基醚(tritonx100),十二烷基硫酸钠(sds),十二烷基苯磺酸钠(sdbs)和鼠李糖脂(rhamnolopid)这6种表面活性剂作为备选萃取剂,挑选土壤中石油污染物的萃取剂。
表1不同表面活性剂中费氏弧菌的相对发光率(%)
比较费氏弧菌在6种浓度为1%的表面活性剂中的发光强度(表1),费氏弧菌在tween20,tween80,tritonx100,sdbs和rhamnolopid环境下相对发光率在92%以上,可以正常生存,说明这些萃取剂对发光细菌毒性较小。
通过进一步比较上述5种表面活性剂对tph的提取效益,选取提取效率高、时间短的表面活性剂用作萃取剂。由于发光细菌用于污染物综合毒性检测时,其在污染物作用下的发光强度随环境中的有毒物浓度提高而降低,有一定的剂量关系。当提取液中含有石油污染物浓度越高,说明该表面活性剂石油污染物提取率越高。因此,可以通过费氏弧菌与表面活性剂石油污染物提取液作用,通过比较费氏弧菌在提取液作用下的相对发光率,比较不同表面活性剂对石油污染物的提取效果。费氏弧菌在表面活性剂污染物提取液作用下的相对发光率越低,说明该表面活性剂具有更高的提取效益。比较发光细菌与浓度0.005%-1%的tween20,tween80,tritonx100,sdbs和rhamnolopid提取的石油污染物提取液作用5、15、30min的发光响应(图4-1)。只有rhamnolopid提取的石油污染物提取液对发光细菌有明显的抑制作用,说明只有rhamnolopid能有效提取土壤中的石油污染物。
比较发光细菌与rhamnolopid提取的石油污染物提取液在不同rhamnolopid浓度下的发光率,判断不同浓度的rhamnolopid的萃取效率(图4-2)。浓度为0.5%的rhamnolopid,在反应5min时提取液对发光细菌发光抑制接近最大值,到15min时,发光抑制才趋于稳定。而浓度为1%时,反应5min时发光抑制达到最大值,并在15min和30min保存发布抑制率不变。考虑到快速稳定地萃取出土壤中的石油污染物,选用1%rhamnolopid作为萃取剂的浓度。
实施例4、基于剂量-光强响应关系的石油污染土壤生态毒性评价标准及其环境意义
基于费氏弧菌与石油污染物浓度响应关系(图5),以及土壤石油污染浓度的生态毒性评价标准,构建中国土壤石油污染生态毒性评价标准(表5)。将石油污染物土壤的生态毒性划分为剧毒、高毒、低毒、微毒和无毒5个等级,不同等级的生态毒性效应各自不同。
表5土壤石油污染物生态毒性标准
4.1高毒石油污染土壤的生态毒性特征
当土壤的石油污染萃取液与费氏弧菌混合后,发光率只有对照的55-60%时,土壤石油污染的生态毒性评定为高毒。
该评定等级的石油污染土壤,对人体具致突变作用和高致畸、致癌风险。基于石油污染毒理研究成果,如果怀孕妇女长期暴露于该污染环境下,影响胎儿的神经发育,造成新生婴儿的体重明显降低,严重的可能导致婴儿畸形。长期暴露在高毒石油污染土壤中,其中有毒成分,如pahs直接接触人体细胞,可以造成dna损伤,直接引起机体的癌变和细胞基因突变。
同时,该级别的污染土壤,石油与土粒粘连影响土壤通透性,从而降低土壤质量。油与无机氮、磷结合并限制消化作用和脱磷酸作用,从而使土壤有效磷、氮的含量减少,影响土壤肥力。石油吸附在植物根表面行程黏膜,阻碍根系呼吸与吸收,引起根系腐烂而影响作物的根系生长。不易被土壤吸附的石油污染物成分,还可能随地面降水渗透到地下水,污染浅层地下水环境进而影响饮用水水质。
石油中许多有机污染成分,如多环芳烃,环烷酸类等,能通过食物链在动植物体内富集和放大,间接危害人体健康。
4.2低毒石油污染土壤的生态毒性效应
当土壤的石油污染萃取液与费氏弧菌混合后,发光率为对照的65%-75%时,土壤石油污染的生态毒性评定为低毒。
低毒等级的石油污染土壤,无急性三致作用,具有104-103的中等长期致癌风险。该等级的石油污染土壤,能在土壤的迁移、转化和降解过程中,通过呼吸道、皮肤、消化道进入人体,对人体健康造成威胁。长期接触该风险等级的污染土壤,具有诱发肺癌、皮肤癌、白血病、膀胱癌、鼻咽癌和胃癌等的风险。长期处于该土壤环境下,可引起多种慢性中毒症状,影响肺、肠胃、肾、中枢神经系统以及造血系统等。
4.3微毒石油污染土壤的生态毒性效应
当土壤的石油污染萃取液与费氏弧菌混合后,发光率为对照的75%-90%时,土壤石油污染的生态毒性评定为低毒。
微毒等级的石油污染土壤,具有106-104的低长期致癌风险。直接接触该类土壤,除了少量敏感者可能出现炎症状态,多数人并没有直接影响。
美国在开展致癌风险评价初期,常以106作为可以接受的风险值。近年根据具体情况,考虑一定社会、经济、技术、自然等多方面因素,逐渐以106-104作为长期致癌风险评价的可接受范围。因此,微毒石油污染土壤,可以作为采油区生态修复的安全标准等级。
4.4剧毒和无毒石油污染土壤生态毒性效应
当土壤的石油污染萃取液与费氏弧菌混合后,发光率小于对照55%时,土壤石油污染的生态毒性评为剧毒。该评定等级的石油污染土壤,对人体具有致畸、致癌和致突变作用。长期暴露在剧毒石油污染土壤中,具有大于103的致癌风险;短期暴露会引起恶心、头痛、眩晕等症状。人体应远离该类别土壤,避免误食以及皮肤的直接接触。并要求有关风险部门采取应急措施降低石油污染土壤毒性。
当土壤的石油污染萃取液与费氏弧菌混合后,发光率大于对照的90%时,土壤石油污染的生态毒性评为无毒。长期暴露在该评定等级土壤中,生物无受到不良影响。该评定等级土壤可以直接用于工业类型再开发利用。
实施例5、评价石油污染土壤生态毒性的方法
5.1试剂和材料
氯化钠nacl,化学纯。
鼠李糖脂。
费氏弧菌(vibriofischeri)冻干粉,安培瓶包装,每瓶0.5g,在-20℃冰箱避光保存有效保存期为6个月。新制备的发光细菌休眠细胞(冻干粉)密度不低于每克800万个细胞;当将冻干粉复苏2min后即发光(可在暗室内检验,肉眼应见微光),稀释成工作液后每毫升菌液不低于1.6万个细胞(5ml测试管)或2万个细胞(2ml测试管)(均为稀释平板测定法)。在水质毒性快速检测仪上测出的初始发光量应在600-1900mv之间,不达标准则更换冻干粉,超过标准则适量稀释工作液。
氯化钠溶液,2g/100ml。
氯化钠2g,加蒸馏水100ml,于试剂瓶内,2-5℃保存。
鼠李糖脂溶液,1g/100ml。
氯化钠2g,鼠李糖脂1g,加蒸馏水100ml,于磁力搅拌器搅拌均匀,鼠李糖脂在碱性环境下更易溶于水,可适当滴加naoh使鼠李糖脂完全溶于溶剂,再加hcl调节ph值为7.5(鼠李糖脂溶液含有氯化钠,且氯化钠的浓度为2g/100ml)。
5.2仪器
生物发光光度计或水质毒性快速检测仪。
2ml或5ml测试样品管(具标准磨口塞,为制造比色管的玻璃料制作,由专业玻璃仪器厂制造),分别适用于响应型号的生物发光光度计或水质毒性快速检测仪。
40目筛(孔径425μm)。
烘箱。
回旋振动器。
高速离心机。
离心管:15ml。
移液枪:100μl、1ml。
试剂瓶:100ml。
量筒:100ml。
5.3样品
样品的采集和保存
采样使用铝质密封袋,务必清洁干燥。取采油区表层土壤,除去杂草、砾石等杂物,将密封袋袋口密封。对采集的土样在烘箱60℃烘干12-15小时后,过40目筛,把过筛土保存在铝质密封袋中。
石油污染物的提取
取1g过筛土于15ml离心管,加入10ml鼠李糖脂溶液。将离心管在回旋振动器上150r/min振荡10分钟后,在高速离心机10℃环境下,以7000r/min离心15分钟。将上层清液倒入新的15ml离心管中。
5.4测定
测定条件
室温
室温20-25℃。
同一批样品在测定过程中温度波动不超过1℃。且所有测试器皿和试剂,溶液测前1h均在控温的测试室内。
ph值
ph值影响土壤急性毒性,不应调节提取液ph值。
测定步骤
加2g/100ml氯化钠溶液对照
用1ml移液枪给每个测试管加1ml氯化钠2g/100ml(根据仪器型号而定)。
加1g/100ml鼠李糖脂溶液对照
用1ml移液枪给每个测试管加1ml鼠李糖脂1g/100ml(根据仪器型号而定)。
加样品液
水质毒性快速检测仪每次能测16个样,取2个测试管作为对照,分别加入1ml2g/100ml氯化钠溶液,其余每个测试管用1ml移液枪加入1ml待测石油污染物提取液每个样品换一个枪头。
发光细菌冻干粉复苏
从冰箱-20℃室取出含有0.5g费氏弧菌冻干粉的安培瓶和2-5℃冰箱中的氯化钠溶液,投入置有冰块的保温瓶(1-1.5l),用1ml移液枪取2ml冷的氯化钠2g/100ml溶液注入已开口的冻干粉安培瓶,充分混匀。2min后发光细菌复苏发光(可在暗室内检验,肉眼可见微光)。备用。
仪器的预热
打开水质毒性快速检测仪电源,预热15min,备用。
给各测试管加复苏液
在发光细菌复苏稳定(约10min后),用100μl移液枪依次给每个测试管加入100μl复苏液。每管在加菌液的当时务必精确计时,记录到秒,即为样品与发光细菌反应起始时间。立即将此时间加15min,记作各管反应中止(也即读发光量)的时间。
费氏弧菌与样品反应达到终止时间的读数
按各管加菌液的先后顺序,把测试管放入仪器待测。当达到记录的反应终止时间,检测该管和对照的即时发光量(以光信号转化的电信号—电压mv数表示)。
测试结果的表达
计算样品相对发光率(%)并算出平均值。
5.5根据测试结果表达土壤样品生态毒性等级
以土壤具有致突变性、长期致癌风险和潜在生态风险的石油污染物浓度(tph表征)为基础,使用浓度-光强响应模型,获得费氏弧菌发光强度对应的土壤石油污染生态毒性评估5级标准(表5)。
将测得样品的相对发光率,参照表5,根据石油污染土壤生态毒性标准,当相对发光率平均值小于55%时,该样品生态毒性为剧毒;相对发光率平均值在55-65%时,样品生态毒性为高毒;相对发光率平均值在65-75%时,样品生态毒性为低毒;相对发光率平均值在75-90%时,样品生态毒性为微毒;相对发光率平均值大于90%时,该样品生态毒性为无毒。
5.6方法的精密度
样品3次重复测定结果的相对偏差应不大于10%。
5.7测定需时
按照图6的实验步骤及各步骤的耗时,计算整个实验的需时。
将土壤样品研磨后过40目筛(10分钟),以1:10的固液比,加入到鼠李糖脂溶液中,在150r/min的回旋振动器上振荡10min,高速离心机10℃环境下,以7000r/min的速度离心15分钟。
同时,将2ml的2%nacl溶液加入到费氏弧菌冻干粉(0.5g)试剂瓶中,轻轻振荡使之充分溶解,静置10分钟复活。取0.1ml冻干粉溶液和1ml2%nacl溶液加入到2ml离心管中,获得测试菌液。
将1ml萃取液和1ml测试菌液加入测试管,轻轻振荡,使之充分摇匀,放置15分钟,而后用发光细菌毒性监测仪检测费氏弧菌发光强度。
整个测试过程需要50分钟。
本发明研发了以费氏弧菌在石油污染物作用下的发光强度响应作为检测指标的石油污染土壤生态毒性的发光细菌快速检测技术方法,并提出了方法应用导则,推进了我国土壤石油污染物的检测水平;
与其它生物毒性检测方法相比(表6),本方法利用费氏弧菌检测石油污染物,从制样、萃取,同时进行生物准备,再到暴露、检测,总需时只50分钟,远比其他生物检测方法需时短,实现了快速检测土壤中石油污染物的需求。另外,与利用气相色谱法等检测石油污染浓度的方法相比,基于费氏弧菌光强的石油污染土壤生态毒性检测方法具有高的检测速度,在检测总需时上有一定的优势。
表6石油污染物检测时间比较表
首次提出以发光细菌对石油污染物的发光强度响应为指标的石油污染土壤生态毒性评价标准,为我国石油污染土壤生态毒性评估和管理,提供了科学支撑。
本评价标准将石油污染土壤划分为剧毒、高毒、低毒、微毒和无毒5个等级(见表5)。比较本研究组和其它学者以蚯蚓为感应物种的研究结果,发现本发明构建的以发光细菌光强为检测指标的石油污染土壤毒性评价方法,对石油污染物土壤的评价结果与其它研究结果非常相似。如,蚯蚓在石油污染物浓度达到8000mg/kg时有明显的回避反应,回避率达到80%。在29400、32000mg/kg时分别达到蚯蚓14天、7天半致死剂量。这个范围的石油污染土壤毒性确定为高毒。而正好与本发明确定的剧毒水平相吻合。
当土壤石油污染生态毒性等级为微毒、无毒时,蚯蚓在48h回避反应实验中未出现任何症状。根据北京市质量技术监督局颁布的《场地土壤环境风险评价筛选值(db11/t811-2011)》,该污染程度土壤中的总石油烃浓度低于其工业用地筛选值(c<16:620mg/kg;c>16:10000mg/kg),该土壤可以直接用于工业类型用地再开发利用。
可见本发明构建的评价标准体系,毒性表征与现有土壤石油污染毒性评价研究的结果相似,能科学、准确地评价不同等级的石油污染土壤的生态毒性。可为加强我国土壤石油污染物的控制,提高石油污染土壤的管理水平,提供可靠的科学依据。
- 还没有人留言评论。精彩留言会获得点赞!