一种以赤藓红B为探针的褪色分光光度法测定壳聚糖含量的方法与流程
本发明涉及一种以赤藓红b为探针的褪色分光光度法准确测定壳聚糖含量的方法,属于大分子检测领域。
背景技术:
壳聚糖(cts)化学名称为聚葡萄糖胺(1-4)-2-氨基-b-d葡萄糖,又称脱乙酰甲壳素,由2-乙酰氨基-2-脱氧-β-d-葡萄糖和2-氨基-2-脱氧-β-d-葡萄糖两类单糖组成,是甲壳类(虾、蟹)动物、昆虫的外骨骼的主要成分,壳聚糖在自然界中分布广泛,属于高分子绿色材料。最近几年,随着不断地研究,对于壳聚糖人们已经有了全新的认识。壳聚糖有控制胆固醇、抑制细菌活性等机能,在医药方面有着多方面的应用。另外,壳聚糖在食品领域也有着非凡的意义,其具有抗菌、抗氧化、保鲜等作用。随着对壳聚糖的深入了解,壳聚糖还具有保湿、提高肌肤免疫力等作用,因此在化妆品方面也有着广泛的应用。随着壳聚糖在医药,食品和化妆品等各个领域中越来越广泛的应用,其与人们生活及健康的联系也越来越密切,因此,壳聚糖的准确定量变得尤为重要,建立简便高效的方法测定壳聚糖含量有着重要的意义,这将进一步推进壳聚糖在各个领域的应用。
壳聚糖是由自然界广泛存在的甲壳素经过脱乙酰作用得到的。具有安全无毒的特性,因而在食品、化妆品、医药等领域已有了广泛应用。目前,测定壳聚糖的方法有分光光度法、荧光法、共振瑞利散射法、电化学法、高效液相法等。在分光光度法中,高珍贵等利用茜素红与壳聚糖在一定酸度条件下的特异性显色反应,其复合物吸光值与壳聚糖含量成线性关系,建立了一种具有高选择性和高灵敏度的简便快速测定壳聚糖的分光光度法,但其具有稳定性不好、专属性较差,测定的线性范围较窄,无法对壳聚糖及其衍生物进行区分等缺点。荧光法虽然具有抗干扰能力强、操作简单、稳定性高的特点,但对荧光条件要求较为严格,否则会对结果造成影响。共振瑞利散射法灵敏度高,但是对仪器要求严格,选择性也相对较差,难以应用于复杂体系中。电化学法中由于壳聚糖黏度较大,对其电位影响较大,因而限制了这方面的发展。而高效液相法成本较高,从经济上考虑实用性较低。
基于此,本发明提供一种简便、快速、灵敏度更高的新方法,即一种以赤藓红b为探针的褪色分光光度法测定壳聚糖含量。
技术实现要素:
为了克服现有技术中对于成品中壳聚糖的含量难以定量,操作技术繁琐的技术不足,本发明提供一种以赤藓红b为探针的褪色分光光度法测定壳聚糖含量的方法,本发明利用壳聚糖在弱酸性条件下,与赤藓红b和聚乙烯醇结合形成较为稳定的三元缔合物,使其在一定波长中的吸收峰梯度下降,聚乙烯醇在其中作为稳定剂作用。用分光光度计在530nm处测定其吸光度较赤藓红b有明显降低,且吸光度的降低值与壳聚糖的浓度成正比,以此作为壳聚糖的定量基础,建立了测定壳聚糖的褪色分光光度法,本方法测定受壳聚糖的分子量的影响,其具有试剂廉价,灵敏度高重现性好的优点,适合在实际应用中推广使用。
一种以赤藓红b为探针的褪色分光光度法测定壳聚糖含量的方法,其包括下述步骤:
1)绘制△a和不同分子量的壳聚糖浓度的标准曲线:
向10ml比色管中加入0.5ml一定浓度梯度的低分子壳聚糖标准溶液,加入0.2ml浓度为1%的增敏剂,1.0ml的br缓冲溶液,以及4.0ml浓度为1.0×10-4mol/l的赤藓红b溶液,使用蒸馏水定容后充分摇匀,在室温中静置1小时后于紫外分光光度计上,在体系的最大褪色波长530nm处以水为参比测量吸光度;其中试剂空白记为a0,含壳聚糖的溶液记为a,并计算△a=a0–a,建立△a与低分子壳聚糖浓度的标准曲线c1;使用中分子量壳聚糖溶液替换低分子壳聚糖溶液,建立△a与中分子壳聚糖浓度的标准曲线c2;使用高分子量壳聚糖溶液替换低分子壳聚糖溶液,建立△a与高分子壳聚糖浓度的标准曲线c3;
在最佳的实验条件下,考察该体系对不同分子量的壳聚糖的测定结果。分别考察了低分子量、中分子量和高分子量的壳聚糖。经过统计学分析,不同分子量的壳聚糖结果存在显著差异性,该方法测定壳聚糖含量受不同分子量的影响。
2)10μg/ml的样品工作液的制备:称取一定量待检测样品的胶囊壳,使用冰醋酸溶解并将其定容得到样品储备液,用漏斗脱脂棉过滤储备液,滤液经6000r/min,离心机离心20min,取上清液2.5ml于100ml容量瓶,定容,得浓度为10μg/ml的样品工作液;
3)根据壳聚糖分子量选择标准曲线:使用步骤1)种检测方法绘制△a和样品工作液的标准曲线,并将其与不同分子量的壳聚糖标准曲线比较,根据样品的△a和样品工作液的标准曲线的回归方程确定样品中的壳聚糖的分子量的大小,根据所对应的壳聚糖的分子量的大小确定所使用的回归方程;
4)样品中壳聚糖含量确定:取样品工作液1ml,按步骤1)检测方法进行测定,在530nm处测定其吸光度值a,并计算△a=a0–a,将△a代入线性回归方程求得样品中壳聚糖的含量,同时做加标回收试验。
如上所述的以赤藓红b为探针的褪色分光光度法测定壳聚糖含量的方法,所述的b-r缓冲溶液由0.04mol/l混合酸[(2.71ml正磷酸+2.36ml冰乙酸+2.47g硼酸)/l]与0.2mol/lnaoh溶液按不同比例配制而成,申请人通过实验发现,体系在ph=4.2的b-r缓冲溶液中灵敏度最高,δa值最大,另外申请人发现b-r缓冲溶液具有较好的抗干扰作用,能掩蔽部分金属离子,故最佳缓冲溶液选择为ph=4.2的b-r缓冲溶液。
如上所述的以赤藓红b为探针的褪色分光光度法测定壳聚糖含量的方法,所述的增敏剂为聚乙烯醇,吐温20,吐温80或op-10,申请人通过实验发现,加入聚乙烯醇作为增敏剂时的△a值最大,故选聚乙烯醇作为增敏剂。
如上所述的以赤藓红b为探针的褪色分光光度法测定壳聚糖含量的方法,步骤1中溶液的加入顺序为首先加入壳聚糖标准溶液,其次加入聚乙烯醇溶液,再次加入br缓冲溶液,最后加入赤藓红b溶液。
如上所述的以赤藓红b为探针的褪色分光光度法测定壳聚糖含量的方法,壳聚糖的浓度范围0.05μg/ml~1.50μg/ml。
样品前处理:取待检测胶囊壳,称取一定量胶囊壳,使用冰醋酸溶解定容得到样品储备液,用漏斗脱脂棉过滤储备液,滤液经6000r/min,离心机离心20min,取上清液2.5ml于100ml容量瓶,定容,得浓度为10μg/ml的样品工作液;
用样品工作液按实验方法绘制样品曲线,与不同分子量的壳聚糖标准曲线比较,根据样品的回归方程确定样品中的壳聚糖的分子量的大小,根据所对应的壳聚糖的分子量的大小确定所使用的△a和壳聚糖浓度的标准曲线;
取样品工作液1ml,按实验方法进行测定,在500nm处测定其吸光度值a,并计算
△a=a0–a,将△a代入线性回归方程求得样品中壳聚糖的含量,同时做加标回收试验。
试验例:
1.cts-赤藓红b体系的在不同cts浓度下的吸收光谱图。
图1为cts-赤藓红b体系的在不同cts浓度下的吸收光谱图,由图可知,该体系在530nm波长处有着吸收峰,当加入壳聚糖时其吸收峰明显降低,在530nm处以零管为参比时有最大吸收峰(倒峰),并且有明显的梯度变化,从上至下壳聚糖浓度(μg/ml):0.4,0.8,1.2。由图中可以看出吸光值随着壳聚糖的浓度的增大,体系的吸光值下降,存在线性关系。
2.稳定时间对于体系吸光度的影响
在较优实验条件下,考察体系的稳定时间,考察时间2h,于室温中每隔一段时间测其吸光度值,结果如图2,体系在1h内即可达到稳定,2h内可保持稳定的吸光度值不变。
3.不同缓冲液对于体系吸光度的影响
分别考察了b-r缓冲溶液,柠檬酸-柠檬酸钠缓冲溶液和醋酸-醋酸钠缓冲溶液3种缓冲溶液对体系吸光度的影响。按照实验方法,改变加入不同ph值的缓冲溶液,得到各个缓冲溶液的吸光度值。
结果见图3、4,加入b-r溶液的体系相对稳定,且δa值较大。根据缓冲范围,选择b-r缓冲液(ph=2.5、3.5、4.5、5.5)为缓冲液做标准曲线,可知溶液的最佳ph应在4.5左右,结果见图3。故继续做了ph的细化实验以及缓冲溶液种类的筛选实验(图4),由图4可以看出体系在ph=4.2的b-r缓冲溶液中灵敏度最高,δa值最大,另外申请人发现b-r具有较好的抗干扰作用,能掩蔽部分金属离子,故最佳缓冲溶液选择为ph=4.2的b-r缓冲溶液。
4.缓冲液的加入量对吸光度值的影响
缓冲溶液为实验体系提供合适的酸度结合环境,其加入量对离子缔合物的形成有着一定的影响,不改变其他实验条件,改变ph=4.2的b-r缓冲溶液的加入量为0.5,1.0,1.5,2.0,3.0ml,测定其吸光度值。
图5为b-r缓冲溶液的加入量对于吸光度值的影响。结果看出,b-r缓冲溶液的加入量对该反应体系的影响较小,在加入量在0.5~3.0ml范围内,吸光值值变化较小,在1.0ml加入量时△a达到最大。故选择br缓冲溶液加入量为1.0ml。5.反应温度对于体系吸光度的影响
在实验条件下,考察了20~100℃不同温度对体系灵敏度的影响,结果表明,如图6示温度对体系的吸光值存在着影响。△a随着温度的升高迅速减小,且在该反应温度下,重现性较好,故反应体系温度选择室温最为合适。
6.增敏剂种类及加入量对于体系吸光度的影响
不改变其他实验条件,改变增敏剂种类(聚乙烯醇,吐温20,吐温80,op-10),测定其吸光度值。结果如图7所示,加入聚乙烯醇(pva)作为增敏剂时的△a值最大,故选pva作为增敏剂。
图8为pva加入量的筛选,可以看出随着pva的加入量增加,其△a值会相应减小,但若不加入pva或者加入量较少的情况,在该反应体系中赤藓红b会自聚形成沉淀,导致无法测定结果。故综合考虑各种因素(0.1ml与0ml都出现了沉淀现象),选择较为合适的pva加入量为0.2ml。在该体系中,pva起到了稳定的作用,使染料在酸性条件下凝聚速度下降,便于检测。
7.赤藓红b加入量对于体系吸光度的影响
赤藓红b作为染料探针与目标物质壳聚糖结合,其加入量直接影响着离子缔合物的形成,不改变其他实验条件,改变浓度为1.0×10-4mol/l的赤藓红b的加入量为1.0,2.0,3.0,4.0,5.0ml,测定其吸光度值。
图9为赤藓红b的加入量对于体系吸光度的影响。结果看出,赤藓红b的加入量对该反应体系有显著影响,由图可知加入4.0ml赤藓红b时其△a最大,故1.0×10-4mol/l的赤藓红b最佳加入量为4.0ml。
8.试剂加入顺序对于体系吸光度的影响
在实验条件下,考察了染料赤藓红b,br缓冲液,壳聚糖及聚乙烯醇的12种不同的加入顺序对体系灵敏度的影响。综合考虑所有加入顺序的结果,结合重现性,线性,吸光值,稳定性,稳定时间等多方面因素,选择了第8种“cts+pva+br+赤藓红b”为最佳加入顺序。
表1加入顺序的影响
9.离子强度对于体系吸光度的影响
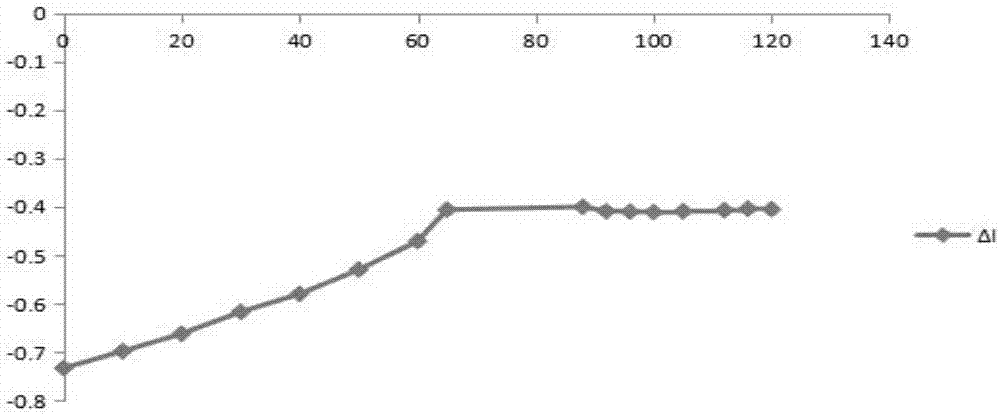
以nacl(0.01~3mol/l)考察离子强度对体系的吸光度值的影响。结果见图10,在0.01-0.07mol/l时离子强度对体系吸光度值影响不大,其相对误差不超过5%;在0.07mol/l后,体系的吸光度值随离子强度的增加而呈缓慢增大趋势,可能是在高浓度时nacl与该体系结合在一起使δi升高。因此,nacl的浓度小于0.007mol/l的时候对实验没有影响。
10.共存物质对于体系吸光度的影响
考察了7种共存物质对该体系的干扰,体系中壳聚糖的浓度为0.5μg/ml。在相对误差在±5%范围内,各种共存物质的允许量见表2。淀粉,β环糊精,甘氨酸对体系的影响很小,允许量较大;抗坏血酸,天冬酰胺,赖氨酸,硫酸锌等允许量相对较小。从反应体系中可以得出其最主要的影响为ph值,在反应中应该严格控制缓冲液的量,控制好ph。
表2共存物质的影响
本发明与现有技术相比具有如下技术优势:
1)线性好、检出限低:在最佳实验条件下,按照实验方法测定不同浓度的壳聚糖对应的△a,绘制标准曲线,结果表明,壳聚糖在浓度0.05μg/ml-1.5μg/ml范围内与△a存在良好的线性关系,检出限0.0441μg/ml。
2)本方法测定受壳聚糖的分子量的影响,在实际样品测定中,需考虑采用相近分子量的标准品做定量标准,具有试剂廉价,灵敏度高重现性好的优点。
附图说明
图1cts-赤藓红b体系的在不同cts浓度下的吸收光谱图。
图2稳定时间对于体系吸光度的影响。
图3反应酸度对于体系吸光度的影响。
图4ph细化及缓冲液种类对于体系吸光度的影响。
图5br缓冲液的加入量对于吸光度值的影响。
图6反应温度对于体系吸光度的影响。
图7不同增敏剂对于体系吸光度的影响。
图8聚乙烯醇加入量对于体系吸光度的影响。
图9赤藓红b加入量对于体系吸光度的影响。
图10离子强度对于体系吸光度的影响
具体实施方式
以下通过具体实施例进一步描述本发明,但所述发明并不以任何方式限定本发明专利保护的范围。
实施例
一种以赤藓红b为探针的褪色分光光度法测定壳聚糖含量的方法,其包括下述步骤:
1)绘制△a和不同分子量的壳聚糖浓度的标准曲线:
向10ml比色管中加入0.5ml一定浓度梯度的低分子壳聚糖标准溶液,加入0.2ml浓度为1%的聚乙烯醇,1.0ml的br缓冲溶液,以及4.0ml浓度为1.0×10-4mol/l的赤藓红b溶液,使用蒸馏水定容后充分摇匀,在室温中静置1小时后于紫外分光光度计上,在体系的最大褪色波长530nm处以水为参比测量吸光度;其中试剂空白记为a0,含壳聚糖的溶液记为a,并计算△a=a0–a,建立△a与低分子壳聚糖浓度的标准曲线c1;使用中分子量壳聚糖溶液替换低分子壳聚糖溶液,建立△a与中分子壳聚糖浓度的标准曲线c2;使用高分子量壳聚糖溶液替换低分子壳聚糖溶液,建立△a与高分子壳聚糖浓度的标准曲线c3;
表3不同分子量的壳聚糖结果
2)10μg/ml的样品工作液的制备:称取一定量待检测样品的胶囊壳,使用冰醋酸溶解并将其定容得到样品储备液,用漏斗脱脂棉过滤储备液,滤液经6000r/min,离心机离心20min,取上清液2.5ml于100ml容量瓶,定容,得浓度为10μg/ml的样品工作液;
3)根据壳聚糖分子量选择标准曲线:使用步骤1)种检测方法绘制△a和样品工作液的标准曲线,并将其与不同分子量的壳聚糖标准曲线比较,根据样品的△a和样品工作液的标准曲线的回归方程确定样品中的壳聚糖的分子量的大小,根据所对应的壳聚糖的分子量的大小确定所使用的回归方程;
用样品工作液按实验方法绘制样品曲线,与不同分子量的壳聚糖标准曲线比较,结果为样品的线性回归方程是△a=-0.6835c-0.0788,相关系数0.9949,结果与中分子量的壳聚糖标准曲线相同,采用中分子量壳聚糖的标准曲线作为定量标准曲线。
4)样品中壳聚糖含量确定:取样品工作液1ml,按步骤1)检测方法进行测定,在530nm处测定其吸光度值a,并计算△a=a0–a,将△a代入线性回归方程求得样品中壳聚糖的含量,同时做加标回收试验。
取样品工作液1ml,按实验方法进行测定,在530nm处测定其吸光度值a,并计算△a=a0–a,将△a代入线性回归方程求得样品中壳聚糖的含量,同时做加标回收试验。结果得出,卫奥开胶囊中壳聚糖的含量为852mg/g,rsd为1.51%,
平均加标回收率为101.65%。
表4样品分析结果
向10ml比色管中加入0.5ml一定浓度梯度的低分子壳聚糖标准溶液,加入0.2ml浓度为1%的聚乙烯醇,1.0ml的br缓冲溶液,以及4.0ml浓度为1.0×10-4mol/l的赤藓红b溶液,使用蒸馏水定容后充分摇匀,在室温中静置1小时后于u-3010型紫外分光光度计上,在体系的最大褪色波长530nm处以水为参比测量吸光度,于2h内测完。其中试剂空白记为a0,含壳聚糖的溶液记为a,并计算△a=a0–a。壳聚糖在浓度0.05μg/ml-1.5μg/ml范围内与a0存在良好的线性关系,检出限为0.0441μg/ml。本方法测定受壳聚糖的分子量的影响,在实际样品测定中,需考虑采用相近分子量的标准品做定量标准,具有试剂廉价,灵敏度高重现性好的优点。
线性范围与检出限
在最佳实验条件下,按照实验方法测定不同浓度的壳聚糖对应的△a,绘制标准曲线,结果表明,壳聚糖在浓度0.05μg/ml-1.5μg/ml范围内与△a存在良好的线性关系,线性回归方程为△a=-0.6835c-0.0788,相关系数0.9949,,检出限0.0441μg/ml。
- 还没有人留言评论。精彩留言会获得点赞!