用于检验嗜碱性细胞活化的方法与流程
用于速发型过敏(也称为i型过敏,其基于ige介导的免疫应答)的诊断,根据详细的既往史首先进行皮试如皮肤点刺测试或诱发测试,这对于过敏诊断学是金标准。作为补充,使用体外测试,用其检验针对一种或多种经定义的过敏原的特异性ige-抗体的存在。
对于这种检验,将过敏原结合到如小海绵、膜或小球的基质上并与患者血清接触。随即借助经标记的抗-人-ige抗体测定经结合的ige的量。
体外特异性ige-测定的优点包括其便利的可操作性、可标准化特性(standardisierbarkeit)和可规模化性(aufskalierbarkeit)。然而,通常不能区分临床相关的过敏和只是敏感。
其它缺点是某些过敏原的不良可支配性和由于过敏原偶合基质而使过敏原构型可能变化,这可改变过敏原对待检验的ige-抗体的亲和性。在很多情况下,过敏原提取物仅艰难地被标准化或根本不能被标准化。较小的过敏原还必须结合到载体分子如血清白蛋白上。此外,对于血清中的ige-抗体与在效应细胞如嗜碱性细胞和肥大细胞上的膜结合的ige-抗体的过敏原特异性不必一致,因为溶解的和结合的ige仅缓慢地发生交换。最后,不能在用于检验特异性ige-抗体的体外测试中反映的额外因素,确定是否确实诱发了细胞性过敏反应,所述因素例如在血液中总ige与特异性ige的总量比或抗体的亲和性。
特别是当ige测试和皮试提供不明确的结果时,就此值得推荐的是,作为补充,采用细胞测试系统如嗜碱性细胞-脱粒测试或嗜碱性细胞-活化测试(bat)。通常,与流式细胞测量法-测试相关地使用术语“bat”。
细胞测试相比于仅测定在血清中溶解的、未生物活化的ige-部分的特异性ige-抗体测定的特别优点是,其确实地反映细胞生物学反应,其通过过敏原在嗜碱性细胞的细胞表面上的受体结合的ige-抗体上的结合及其横向交联(quervernetzung)诱发。所述细胞测试还允许测定脱粒能力的阈值。对此特别需要用于治疗进程监控的免疫治疗。
原则上,细胞测试以如下方式进行,首先使患者血液与过敏原接触。如果患者之前已经过敏了(sensibilisiert),则发生了过敏原在位于嗜碱性细胞表面的受体结合的过敏原特异性ige-抗体上的结合。这导致ige-受体的交联(kreuzvernetzung),其继而诱发嗜碱性粒细胞的脱粒和由此从细胞内颗粒释放介质(mediatoren)。这些介质,例如组胺、白细胞三烯和类胰蛋白酶,可借助于在上清液中的酶免疫分析进行量化。所述介质的溢出(ausschüttung)伴随着在细胞表面上标志物如cd63或cd203c浓度的提高,所述标志物之前位于细胞内颗粒的膜上并由此同样显示细胞反应。所述介质的溢出由此显示对所述过敏原的细胞反应。
至今在常规诊断学中,借助针对活化特异性的细胞表面标志物的与荧光团偶合的抗体,流式细胞测量法地检验这种加强的表面浓度。就此,待检验的细胞在液体射流中逐一流过薄的测量室并通过多个不同波长的激光射线,在此针对每种细胞类型产生表征性散射光并同时(只要存在活化的细胞)取决于激发抗体结合的荧光团的相应波长。由激发的荧光团发射的光且所述散射光被检测器捕获。
这种测试系统的缺点是流式细胞测量仪的高设备成本,测试结果的复杂性,所述测试结果只能由特别培训的技术人员解读,以及困难的可标准化性质。此外,一直只可以用仪器同时测量一种样品。
本发明进一步关注的问题涉及样品质量,其包括可活化的嗜碱性细胞。样品质量和由此其用于诊断方法的适宜度取决于,是否专业地进行获取、运输和储存。例如样品暴露于热或者不适宜的缓冲剂可导致细胞的凋亡。
如果质量不合格,会导致错误的阴性结果,即阴性结果不是由患者没有过敏导致的,而是由患者样品的质量不合格导致的,根本没有或包含过少的可活化的嗜碱性细胞。
如果在进行耗费的方法如流式细胞测量法时才确定样品质量的不合格,则这是特别低效的。
因此需要一种方法和可用于该方法的反应剂,有效(即在对于高通量适宜的方法中)确定样品的质量。这种方法虽然不使用过敏原进行并且因此不提供诊断有用的结果,但允许预言样品质量对于分开批次(ansatz)实施的诊断方法是否是适宜的。这种方法可在所述诊断方法之前、之后或平行实施。这种方法或其中所使用的反应剂可用于测定细胞配制物中可活化的嗜碱性细胞(优选样品)的数量或含量。
de10235310公开了一种测试,其中借助于荧光钙染料检验嗜碱性细胞的活化。其使用通过密度梯度离心分级的血液。
wo2012/044756、us2009/0246805、wo98/32014和ep2037269公开流式细胞测量法的测试用于检验嗜碱性细胞的活化。
出于这些背景,本发明的根本任务在于提供一种方法和对于该方法适宜的反应剂,用其能够克服在现有技术所描述的方法中的上述缺点,特别是可用不同于流式细胞测量仪的其它系统进行的嗜碱性细胞的活化测试。
特别是任务在于创造一种系统,其允许以高通量方法同时处理多个样品。此外确保可再现性和可标准化。
该任务和其它任务通过本发明的主题特别是通过随附独立权利要求的主题完成,其中优选的实施形式由从属权利要求给出。
在第一方面,通过用于诊断过敏的方法解决本发明的根本问题,所述方法优选是对于高通量适宜的方法,其包括以下步骤:
a)在全血的存在下,在水溶液中,使患者全血样品中的嗜碱性细胞与过敏原接触,其中全血与水溶液的体积比为至少20体积%,条件是使所述嗜碱性细胞允许被所述过敏原活化,
b)富集获自步骤a)的嗜碱性细胞并且
c)检验活化的嗜碱性细胞,
其中在步骤c)中的检验经此实现,即借助化学发光法检测活化嗜碱性细胞的表征性标志物。
在第一方面中的所述问题可替代地通过包括以下步骤的诊断方法解决:
a)在全血的存在下,在水溶液中,使患者全血样品中的嗜碱性细胞与过敏原接触,其中全血与水溶液的体积比为至少20体积%,条件是使所述嗜碱性细胞允许被所述过敏原活化,
b)富集获自步骤a)的嗜碱性细胞并且
c)检验活化的嗜碱性细胞,
其中在步骤c)中的所述检验经此实现,即借助化学发光法检测位于嗜碱性细胞表面上的标志物,
其中在步骤b)中经此富集嗜碱性细胞,即所述嗜碱性细胞结合到配体上,所述配体特异性结合到多肽上,所述多肽是对于活化的嗜碱性细胞的表征性标志物,
和/或在步骤c)中的所述检验经此实现,即借助化学发光法检测活化嗜碱性细胞的表征性标志物。
在一个优选的实施形式中,全血是未处理的全血。
在另一个优选实施形式中,步骤a)在具有全血含量为至少30、优选35、更优选40、更优选45体积%的水溶液中进行。
在另一个实施形式中,所述方法包括终止嗜碱性细胞活化的步骤,优选在步骤b)之前。
在另一个实施形式中,在步骤b)中所述嗜碱性细胞经此富集,即它们结合到配体上,所述配体特异性结合到位于嗜碱性细胞表面的多肽上。所述多肽可以是不依赖于嗜碱性细胞的活化状态位于嗜碱性细胞表面的多肽,和/或可以是对于活化的嗜碱性细胞的表征性标志物,优选与根据本发明借助化学发光法检测的标志物不同的其它对于活化的嗜碱性细胞的表征性标志物。在特别优选的实施形式中是不依赖于嗜碱性细胞的活化状态位于嗜碱性细胞表面的多肽。
在另一个实施形式中,特异性结合到不依赖于嗜碱性细胞的活化状态位于嗜碱性细胞表面上的多肽上的配体是针对所述多肽的单克隆抗体。
在一个优选实施形式中,在步骤b)中的嗜碱性细胞是被固定化的。
在一个优选实施形式中,在步骤b)中的嗜碱性细胞被固定在小珠上,优选小磁珠。
在一个优选实施形式中,所述嗜碱性细胞在固定化后被冲洗。
在一个优选实施形式中,在步骤b)中红细胞被胞溶和去除。
在一个优选实施形式中,在固定嗜碱性细胞之前通过离心去除红细胞。
在一个优选实施形式中,在步骤c)中的检验借助针对位于嗜碱性细胞表面上的标志物配有能化学发光的标记的配体进行,优选对于活化的嗜碱性细胞的表征性标志物。
在一个优选实施形式中,所述配有能化学发光的标记的配体是单克隆抗体,所述单克隆抗体自身具有能化学发光的标记或结合在具有能化学发光的标记的次级抗体上。
在一个优选实施形式中,所述步骤a)、b)和c)在微滴定板中进行。
在一个优选实施形式中,步骤a)在步骤b)和c)之前进行。
在另一方面中,本发明的根本任务通过试剂盒完成,所述试剂盒包含用于使嗜碱性细胞与过敏原接触的容器(其中所述容器优选是微滴定板)、任选的过敏原、借助化学发光法检测活化嗜碱性细胞的表征性标志物的试剂(其中优选为针对标志物的配有能化学发光的标记的配体且所述配体更优选是单克隆抗体)、任选的用于终止所述嗜碱性细胞活化的试剂、任选结合到不依赖于嗜碱性细胞活化状态位于嗜碱性细胞表面的多肽上的可固定化的配体(其中所述配体优选是针对所述多肽的单克隆抗体)、和任选的用于胞溶和/或去除红细胞的试剂。
可替代地,在另一方面中通过试剂盒解决所述问题,所述试剂盒包含用于使嗜碱性细胞与过敏原接触的容器(其中所述容器优选是微滴定板),任选的过敏原,用于富集嗜碱性细胞的针对位于嗜碱性细胞表面的多肽的配体和用于检测的针对位于嗜碱性细胞表面上的标志物的配体,其中用于检测的针对位于嗜碱性细胞表面上的标志物的所述配体具有能化学发光的标记,其中所述能化学发光的标记可以是催化化学发光-反应的酶,或者是自身在适宜的条件下产生化学发光信号的分子,其中在第一种情况下所述酶与能化学发光的底物溶液相组合地包含在试剂盒中,且其中位于嗜碱性细胞表面上的多肽和/或位于嗜碱性细胞表面上的标志物对于活化的嗜碱性细胞是表征性的),所述试剂盒任选地包含用于终止嗜碱性细胞活化的试剂。所述试剂盒任选地包含用于胞溶和/或去除红细胞的试剂。
在另一方面,所述问题通过用于富集嗜碱性细胞的针对位于嗜碱性细胞表面上的多肽的配体,与用于检测的针对位于嗜碱性细胞表面上的标志物的配体一起的用途解决,所述用途用于诊断过敏或用于制备用于诊断过敏的试剂盒或用于筛选针对过敏原治疗过敏的候选活性物质,其中用于检测的针对位于嗜碱性细胞表面上的标志物的配体具有能化学发光的标记,其中所述能化学发光的标记可以是催化化学发光-反应的酶,或者是自身在适宜的条件下产生化学发光-信号的分子,其中在第一种情况下与能化学发光的底物溶液相组合地使用所述酶,且其中位于嗜碱性细胞表面上的多肽和/或位于嗜碱性细胞表面上的标志物对于活化的嗜碱性细胞是表征性的。
在另一方面,所述问题通过针对活化嗜碱性细胞的表征性标志物的配体的用途解决,所述用途用于诊断过敏或用于制备用于诊断过敏的试剂盒或用于筛选针对过敏原治疗过敏的候选活性物质,其中所述配体具有能化学发光的标记。
在一个优选实施形式中,所述用途用于提高敏感性,优选在高通量方法中。
本发明的方法涉及用于诊断过敏的方法,其首先包括步骤a)使患者全血样品中的嗜碱性细胞与过敏原在水溶液中接触。所述全血样品优选为具有抗凝结作用的物质的全血。在使嗜碱性细胞与过敏原实际接触前将全血以这样的量加入所述水溶液中,即其最终占所述水溶液的体积含量为至少20、更优选25、30、35、40、45、50、55、60、65、70、75或80体积%。全血的存在导致嗜碱性细胞与过敏原的接触几乎在生理条件下进行。
所述方法优选涉及对于高通量适宜的方法。在一个优选实施形式中,理解为一种方法,其允许平行处理多个样品,例如至少2、4、8、16或32个样品,其中占对于单个样品所需处理时间的至少50、更优选60、70、80或90%的方法步骤,可以多个样品可以实质上同时进行。包括方法,其中实际的测量过程虽然借助测量仪器对所有样品依次地进行,但样品的单独、非平行处理不长于5分钟、优选不长于4、3、2、1分钟或不长于30秒。对于高通量适宜的方法包括例如在对此适宜的微滴定板中的化学发光测量。相反例如流式细胞测量法不是对于高通量适宜的方法。
全血优选是未处理的全血。在一个优选实施形式中,如在本文中使用的术语“未处理的全血”理解为虽然可以稀释血液或向其添加用于保存的化学物质,优选抗凝结作用的物质如肝素,却不进行分级,例如通过离心如密度梯度离心。
步骤a)还可以用多于一种过敏原和/或用一种过敏原的多于一种浓度以不同的平行处理的批次进行。特别是抗原可以以两种或更多种,优选三种或更多种不同的浓度以相应于平行批次的数量使用。优选额外伴随进行阳性对照和阴性对照。在一个优选实施形式中,过敏原选自下组包括的材料:分类学节足动物门(animaliaarthropoda)的蜱蟎培养物和蜱蟎粪便;源自分类学脊索动物门(animaliachordata)的皮屑、毛发、唾液、粪便或其它分泌物;源自分类学子囊菌纲(funghiascomycetes)的孢子或颗粒;源自分类学松柏纲(corniferopsida)的花粉,源自分类学木兰植物(plantaemagnoliopsidae)纲的花粉,源自分类学单子叶植物纲(plantaeliliopsidae)的花粉;源自分类学节足动物门的毒素或分泌物;橡胶或包括这种橡胶的产品,其源自分类学plantaemagnoliopsidae的树木。
在一个优选实施形式中,过敏原是选自下组包括的医药物质:抗生素,优选β-内酰胺,更优选选自包括以下的组:青霉素g、青霉素v、ppl、mdm、阿莫西林和氨比西林;先锋霉素,更优选选自包括以下的组:头孢唑林、头孢孟多、头孢克洛、cefonaxim、头孢他啶、头孢噻肟、头孢他啶、头孢吡肟、卡巴培南、单环内酰胺、β-内酰胺酶-抑试剂、更优选克拉维酸;大环内酯、氨基糖苷、利福霉素、糖肽、多肽、四环素、咪唑、氟喹诺酮、吡唑啉酮、更优选sulfomethoxazol;链阳性霉素、硝基呋喃、异烟肼、喷他眯;防腐剂,优选氯己定、杀真菌剂、抗病毒试剂、抗疟疾-试剂、镇痛剂、cox-2-抑试剂和非甾体抗炎药,优选选自包括以下的组:阿司匹林、lys-阿司匹林、布洛芬、酮洛芬、双氯芬酸、萘普生、对乙酰氨基酚、安乃近、吲哚美辛、甲灭酸、苯基丁氮酮和异丙安替比林;神经肌肉阻滞剂,优选选自包括以下的组:琥珀胆碱、阿曲库铵、顺-阿曲库铵、美维库铵、巴夫龙、罗库溴铵、维库溴铵和琥珀酰胆碱;安眠药和局麻药,优选选自包括以下的组:咪达唑仑、丙泊酚、硫喷妥、芬太尼和利多卡因;镇静剂;鸦片类药剂;射电-造影剂,优选选自包括以下的组:离子型碘造影剂,非离子型碘化造影剂,异硫蓝、专利蓝和亚甲蓝;质子泵抑试剂;抗抽搐药(antikonvulsiva)和抗精神病,优选选自包括以下的组:卡马西平、苯妥英和丙戊酸;抗精神病试剂;抗抑郁药;多巴胺;抗组胺;皮质类固醇和糖皮质激素;化学治疗剂和免疫抑试剂;利尿药;抗凝剂;血管收缩剂和血管舒张剂;心脏药,优选选自包括以下的组:抑胃酶氨酸、ace-抑试剂、α-受体阻滞剂、β-受体阻滞剂;钙拮抗剂和抗高血压药;(抗)溃疡药;(抗)甲状腺试剂;雌激素;肝素及其衍生物;胰岛素;链激酶和尿激酶。
在一个优选实施形式中,过敏原是胶质体-、血浆扩容剂或助剂,优选选自包括以下的组:白蛋白、右旋糖苷、明胶、羟乙基淀粉、喷他淀粉、左旋糖(sinistrin)、聚多卡醇600(乙氧硬化醇),乳糖,羧甲基纤维素、羟丙基纤维素、鱼精蛋白和抑肽酶。
在一个优选实施形式中,过敏原是食品添加剂,优选选自包括以下的组:食品防腐剂、食品色素、食品精炼剂(nahrungsmittelveredelungsmitte)、抗氧化剂和乳化剂。
在一个优选实施形式中,过敏原是环境试剂或有害物质试剂,优选选自包括以下的组:异氰酸盐/酯,异噻唑啉酮,甲醛,氧化乙烯,邻苯二甲酸酐,氯胺t,dmso,在烘培加工、食品加工和洗涤工业中使用的乳液(latex)和酶。
在一个优选实施形式中,过敏原是选自包括以下材料的组:蜱蟎的培养物和/或粪便,其选自下组蜱蟎:粉螨属(acarus)、甜食螨属(glycyphagus)、鳞螨属(lepidoglyphus)、tryophagus、blomia、尘螨属(dermatophagoides)、euroglyphus、小蠊属(blatella)和大蠊属(periplaneta);选自下组动物的皮屑、毛发、唾液或粪便:犬属(canis)、猫属(felis)或马属(equus);选自下组的酵母、霉菌或真菌:枝孢属(cladosporium)、曲霉属(aspergillus)、青霉属(penicillium)、链格孢属(alternaria)和念珠菌属(candida);选自下组的花粉:扁柏属(chamaecyparis)、柳杉属(cryptomeria)、柏木属(cupressus)、刺柏(juniperus)、黄花茅属(anthoxanthum)、狗牙根属(cynodon)、鸭茅属(dactylis)、羊茅属(festuca)、绒毛草属(holcus)、大麦属(hordeum)、黑麦草属(lolium)、稻属(oryza)、雀稗属(paspalum)、虉草属(phalaris)、梯牧草属(phleum)、早熟禾属(poa)、黑麦属(secale)、蜀黍属(sorghum)、小麦属(triticum)、玉蜀黍属(zea)、豚草属(ambrosia)、蒿属(artemisia)、赤杨属(alnus)、桦木属(betula)、榛属(corylus)、梣属(fraxinus)、木犀榄属(olea)和悬铃木属(platanus);选自下组昆虫毒素:蜜蜂属(apis)、熊蜂属(bombus)、长黄胡蜂属(dolichovespula)、马蜂属(polistes)、polybia、大胡蜂属(vespa)和小胡蜂属(vespula);橡胶或包括这种橡胶的产品,其源自橡胶树属(hevea)。
在一个优选实施形式中,过敏原是选自包括以下材料的组:分类学节足动物门的虾或含虾的食物;分类学节足动物门的鳌虾或含鳌虾的食物;源自分类学的植物百合纲(plantaeliliopsidae)的水果、荚果、谷物或豆类,或含有这种水果、荚果、谷物和/或豆类的食品;源自分类学的植物木兰亚纲(plantaemagnoliopsidae)的水果、荚果、谷物或豆类,或含有这种水果、荚果、谷物和/或豆类的食品;分类学的植物木兰亚纲的坚果或含坚果的食物。
在一个优选实施形式中,过敏原是选自包括以下材料的组:牛奶、含牛奶的食物、鸡蛋白、含鸡蛋白的食物、鱼或含鱼的食物。
在一个优选实施形式中,过敏原是选自包括以下材料的组:大麦属(hordeum)、稻属(oryza)、黑麦属(secale)、小麦属(triticum)、玉蜀黍属(zea)、落花生属(arachis)、corylis、核桃属(juglans)、李属(prunus)、腰果属(anacardium)、黄连木属(pistacia)和大豆属(glycine)。
在一个优选实施形式中,过敏原是多肽,其包括抗原或包括以下变体的组:acas13,glyd2,lepd2,lepd5,lepd7,lepd10,lepd13,tyrp2,tyrp3,tyrp10,tyrp13,tyrp24,blot1,blot2blot3,blot4,blot5,blot6,blot10,blot11,blot12,blot13,blot19,blot21,derf1,derf2,derf3,derf6,derf7,derf10,derf11,derf13,derf14,derf15,derf16,derf17,derf18,derf22,derm1,derp1,derp2,derp3,derp4,derp5,derp6derp7,derp8,derp9,derp10,derp11,derp14,derp20,derp21,derp23,eurm1,eurm2,eurm3,eurm4,eurm14,blag1,blag2,blag4,blag5,blag6,blag7,blag8,pera1,pera3,pera6,pera7,pera9,pera10,canf1,canf2,canf3,canf4,canf5,canf6,feld1,feld2,feld3,feld4,feld5w,feld6w,feld7,feld8,equc1,equc2,equc3,equc4和equc5,clac9m,clac14,clah2,clah5,clah6,clah7,cah8,clah9,clah10,clah12,aspfl13,aspf1,aspf2,aspf3,aspf4,aspf5,aspf6,aspf7,aspf8,aspf9,aspf10,aspf11,aspf12,aspf13,aspf15,aspf16,aspf17,aspf18,aspf22,aspf23,aspf27,a5pf28,a5pf29,aspf34,aspn14,aspn18,aspn25,aspo13,aspo21,penb13,penb26,pench13,pench18,pench20,pench31,pench33,pench35,penc3,penc13,penc19,penc22,penc24,penc30,penc32,peno18,fusc1,fusc2,alta1,alta3,alta4,alta5,alta6,alta7,alta8,alta10,alta12,alta13,canda1,canda3和candb2,chao1,chao2,cupa1,cups1,cups3,juna1,juna2,juna3,juno4,juns1,junv1和junv3,anto1,cynd1,cynd7,cynd12,cynd15,cynd22w,cynd23,cynd24,dacg1,dacg2,dacg3,dacg4,dacg5,fesp4,holl1,holl5,horv1,horv5,lolp1,lolp2,lolp3,lolp4,lolp5,lolp11,pasn1,phaa1,phaa5,phlp1,phlp2,phlp4,phlp5,phlp6,phlp7,phlp11,phlp12,phlp13,poap1,poap5,secc1,secc5,secc20,sorh1,tria15,tria21,tria27,tria28,tria29,tria30,tria31,tria32,tria33,tria34,tria35,zeam1,zeam12,amba1,amba2,amba3,amba4,amba5,amba6,amba7,amba8,amba9和amba10,ambp5,ambt5,artv1,artv2,artv3,artv4,artv5,artv6,alng1,alng4,betv1,betv2,betv3,betv4,betv6,betv7,cora10,frae1,olee1,olee2,olee3,olee4,olee5,olee6,olee7,olee8,olee9,olee10,olee11,plaa1,plaa2,plaa3,plaor1,plaor2和plaor3,apic1,apid1,apim1,apim2,apim3,apim4,apim5,apim6,apim7,apim8,apim9,apim10,apim11,bomp1,bomp4,bomt1,bomt4,dola5,dolm1,dolm2,dolm5,pola1,pola2和pola5,pold1,pold4,pold5,pole1,pole4和pole5,poif5,polg1,polg5,polyp1,polys5,vespc1,vespc5,vespma2,vespma5,vespm1,vespm5,vesg5,vesm1,vesm2,vesm5,vesp5,vess1,vess5,vesvi5,vesv1,vesv2,vesv3,vesv5,hevb1,hevb2,hevb3,hevb4,hevb,5,hevb6,hevb7,hevb8,hevb9,hevb10,hevb11,hevb12,hevb13和hevb14,horv12,horv15,horv16,horv17,horv21,orys12,secc20,tria12,tria14,tna18,tria19,tria21,tria25,tria26,tria36,zeam14,zeam25,arah1,arah2,arah3,arah4,arah5,arah6,arah7,arah8,arah9,arah10,arah11,cora1,cora2,cora8,cora9,cora11,cora12,cora13,cora14,jugn1,jugn2,jugr1,jugr2,jugr3,jugr4,prudu3,prudu4,prudu5,prudu6,anao1,anao2,anao3,pisv1,pisv2,pisv3,pisv4,pisv5,glym1,glym2,glym3,glym4,glym5和glym6。
步骤a)可在用于嗜碱性细胞与过敏原接触的容器中进行。在一个优选实施形式中,所述容器是微滴定板。在另一个优选实施形式中,一种或多种所述过敏原以冷冻的形式预置于所述容器中并在添加水溶液和全血样品时转化为液相。
在一个优选实施形式中,所述过敏原是arah7异型7.0201(ep17000245)。在另一个优选实施形式中,所述过敏原是ep16000165.7中描述的夏威夷果的抗原。也可以使用经修饰的多肽作为抗原,例如在ep15001277.1中公开的油质蛋白-构建体。
在一个优选实施形式中,所述方法包括终止嗜碱性细胞活化的步骤,优选在步骤b)之前。技术人员已知各种用于终止活化反应的试剂,例如添加结合钙的试剂如edta、添加叠氮化物(优选叠氮化钠)或冷却样品(优选冷却到最高4℃的温度)。
优选步骤a)后,在步骤b)中富集嗜碱性细胞。在一个优选实施形式中,如在本文中使用的术语“富集”理解为相对于全血样品中的所有细胞总数或白细胞个数(优选相对于全血样品中的白细胞个数)提高嗜碱性细胞的个数,优选提高的倍数为至少2、5、10、20、50、100或1000,优选至少1000。这优选通过它们与配体的结合实现,所述配体特异性地通过第一结合位点结合到多肽上,所述多肽取决于或不取决于(优选不取决于)嗜碱性细胞的活化状态被表达并位于所述嗜碱性细胞的细胞表面,同时仅以微小的量位于或优选根本不位于其它细胞或至少其它细胞的大多数那里。这种多肽还必须适合作为选择剂,以相对于血液样品中的细胞总数富集嗜碱性细胞。在此可接受的是,残留样品中的一小部分其它细胞(例如树突状细胞)的不完全成功地富集。优选所述多肽选自下组不取决于嗜碱性细胞的活化状态位于嗜碱性细胞表面的多肽,该组包括cd123(数据库码nm_002183),cd193(np_001828)、fcεri(nm_002001)、ige、cd203c(nm_005021)和crth2(nm_004778),并优选cd123或ige,更优选cd123。所有在本申请中使用的数据库码是通过在最早优先权基础的申请的申请日的时间点的数字确定的数据库在线可获取的序列。所述配体优选是针对所述多肽的单克隆抗体,优选针对cd123或ige更优选针对cd123的单克隆抗体(agis,h.,füreder,w.,bankl,h.c.,kundi,m.,sperr,w.r.,willheim,m.,...&valent,p.(1996).comparativeimmunophenotypicanalysisofhumanmastcells,bloodbasophilsandmonocytes.immunology,87(4),535-543.;sainte-laudy,j.sabba,a.,vallonc,guerinjc(1998).analysisofanti-igeandallergeninducedhumanbasophilactivationbyflowcytometry.comparisonwithhistaminerelease.inflammres.47(10),401-8.)。在一个进一步优选的实施形式中,其中使用分离的单克隆抗体。在另一个优选实施形式中,嗜碱性细胞结合多种配体,所述配体特异性地通过第一结合位点结合到多肽上,所述多肽取决于或不取决于(优选不取决于)嗜碱性细胞的活化状态被表达的并位于所述嗜碱性细胞的细胞表面,其中所述多肽选自下组不取决于嗜碱性细胞的活化状态位于嗜碱性细胞表面的多肽,该组包括cd123(数据库码nm_002183)、cd193(np_001828)、fcεri(nm_002001)、ige、cd203c(nm_005021)和crth2(nm_004778),优选两种或三种配体,其中更优选配体的一种是cd123。取决于嗜碱性细胞的活化状态被表达的并位于所述嗜碱性细胞的细胞表面的多肽优选选自包括以下的组:basogranulin(mochizukia,mceuenar,buckleymg,wallsaf.thereleaseofbasogranulininresponsetoige-dependentandige-independentstimuli:validityofbasogranulinmeasurementasanindicatorofbasophilactivation.j.allergyclin.immunol.2003jul;112(1):102-8.)、2d7抗原(clkepley,sscraigandlbschwartz.identificationandpartialcharacterizationofauniquemarkerforhumanbasophils.jimmunoljune15,1995,154(12)6548-6555)、结合抗生物素蛋白的媒介物(jouliar,valituttis,didiera,espinosae.directmonitoringofbasophildegranulationbyusingavidin-basedprobes.jallergyclinimmunol.2017)、cd13(nm_001150)、cd45(nm_001150)、cd63(np_001244318.1)、cd107a(nm_00556)、cd11b(nm_000632)、cd62l(nm_000655)、cd11c(xm_011545852)、cd164(nm_001142401)、cd45(nm_001267798)和cd203c(nm_005021),并且优选的是cd63(knol,e.f.,mul,f.p.,jansen,h.,calafat,j.,&roos,d.(1991).monitoringhumanbasophilactivationviacd63monoclonalantibody435.journalofallergyandclinicalimmunology,88(3),328-338)。
优选所述配体具有第二个可使用的结合位点,从而使之固定化到固体载体上,优选特异性的,如果所述载体具有互补结合能力,准确的,特异性结合配体的能力。优选所述配体具有选自下组的具有结合能力的分子,该组包括:生物素、链霉亲和素、histag、gst、抗生物素蛋白、neutravidin、蛋白a、蛋白g、蛋白l、s-tag和mbp。在固体载体的情况下优选是选自下组的载体,该组包括:小珠,优选小磁珠,微滴定板,塑料反应容器和玻璃反应容器。在特别优选的实施形式中,所述载体是小珠,优选小磁珠,并且包含小珠的水溶液在微滴定板的孔中。在一个优选实施形式中,步骤a)和/或步骤b)中的水溶液连续混合,例如通过搅拌或摇晃。
在优选的实施形式中,所述胞溶和随即去除红细胞优选在步骤b)中。技术人员已知用于胞溶红细胞的试剂,例如它们描述于us4902613、us6143567或wo85/05640中。例如单独用水低压胞溶或在二乙二醇、甲醛和柠檬酸的存在下进行(us4902613)。
红细胞的去除优选通过离心进行。
根据本发明经此检验嗜碱性细胞的活化,即借助化学发光检测针对活化的表征性标志物的表面浓度。所述标志物优选选自包括以下的组:basogranulin(mochizukia,mceuenar,buckleymg,wallsaf.thereleaseofbasogranulininresponsetoige-dependentandige-independentstimuli:validityofbasogranulinmeasurementasanindicatorofbasophilactivation.j.allergyclin.immunol.2003jul;112(1):102-8.)、2d7抗原(clkepley,sscraigandlbschwartz.identificationandpartialcharacterizationofauniquemarkerforhumanbasophils.jimmunoljune15,1995,154(12)6548-6555)、结合抗生物素蛋白的媒介物(jouliar,valituttis,didiera,espinosae.directmonitoringofbasophildegranulationbyusingavidin-basedprobes.jallergyclinimmunol.2017)、cd13(nm_001150)、cd45(nm_001150)、cd63(np_001244318.1)、cd107a(nm_00556)、cd11b(nm_000632)、cd62l(nm_000655)、cd11c(xm_011545852)、cd164(nm_001142401)、cd45(nm_001267798)和cd203c(nm_005021),且优选的是cd63(knol,e.f.,mul,f.p.,jansen,h.,calafat,j.,&roos,d.(1991).monitoringhumanbasophilactivationviacd63monoclonalantibody435.journalofallergyandclinicalimmunology,88(3),328-338.)。可能的是检测多于一种的这类标志物。对此优选针对对于活化的嗜碱性细胞的表征性标志物的配体(优选单克隆抗体)配有能化学发光的标记。在更优选的实施形式中,其中使用分离的单克隆抗体。
所述能化学发光的标记可以是催化化学发光-反应的酶,或者是在适宜条件下自身产生荧光-信号的分子,优选后者分子,更优选吖啶酯或吖啶磺酰胺。在先于步骤a)进行的步骤中,可将针对对于嗜碱性细胞的表征性标志物的配体与能化学发光的标记偶合。例如可将单克隆抗体与吖啶酯(ae)混合。ae化合物是已经在临床诊断学的自动分析中使用的高敏标记(iweeks,ibeheshti,fmccapra,akcampbell,jswoodhead.acridiniumestersashighspecificactivitylabelsinimmunoassay.clinchem29:1474-1479(1983))。ae化合物在抗体上的偶合是易于实现的并大多通过官能基团如酚环上的n-羟基琥珀酰亚胺基(nhs)实现。出于此目的将适宜的抗体用ae(例如heliosense公司的nsp-sa-nhs、nsp-dmae或nsp-dmae-nhs)在室温下反应特定时间。随即将经标记的抗体通过柱或其它纯化方法如hplc去除未反应的游离ae。
在一个优选实施形式中,所述吖啶酯具有式:
其中r1是烷基、经取代的烷基、芳基、经取代的芳基且r2和r3彼此独立地选自包括以下的组:氢、烷基、经取代的烷基、卤素、氰化物、羟基、烷氧基、硫醇、烷基巯基,且其中y是离去基团,优选具有pka<12,优选选自包括以下的组:芳氧基、经取代的芳氧基、经取代的烷氧基、巯基、经取代的巯基、磺酰胺基、经取代的磺酰胺基、n-羟基酰胺、经取代的n-羟基酰胺且其中所述吖啶酯包含可使或使吖啶酯偶合到多肽优选抗体上的基团,优选n-羟基琥珀酰亚胺基(nhs)-基团。适宜的化合物和方法描述于wo2012/028167中。
用于检测可使用化学发光-检测试剂盒(例如invitron公司的)。在洗去未结合的抗体后在荧光测定仪中依序自动添加这两种诱发剂(各100μl;诱发剂1:包含过氧化氢;诱发剂2:包含氢氧化钠)。所述吖啶酯混合物就此在碱性条件下氧化,产生发射光的吖啶酮。信号以一般持续1-5秒的闪光(flash-lumineszenz)形式释放。短时间的发射要求反应的引发和测量直接在检测仪上进行。适宜的荧光测定仪允许自动添加诱发剂并检测微滴定板中的信号。对于较高的强度,通常将测量间隔的全部信号积分。
可替代的是抗体与优选选自包括以下的组的酶偶合:过氧化物酶、碱性磷酸酶和β-半乳糖苷酶,其可以转化为能化学发光的底物(krickalj.(2003).clinicalapplicationsofchemiluminescence.analyticachimicaacta,500(1):279-286)。分别根据酶,在此使用选自下组的底物:环状二酰基酰肼,优选发光氨或异氨基苯二酰肼、吖啶、二氧杂环丁烷(dioxetan)和它们的衍生物。对此最常用的酶是辣根过氧化物酶(hrp),其在过氧化氢的存在下催化发光氨的氧化反应。就此释放的光可在波长425nm下被检测。一种可能的操作方式描述于neupert,w.,oelkers,r.,brune,k.,geisslinger,g.anewreliablechemiluminescenceimmunoassay(clia)forprostaglandine2usingenhancedluminolassubstrate.prostaglandins.1996nov;52(5):385-401。
另一种可替代的是使用电致化学发光。三(2,2-二吡啶基)钌(ii)已经在一些免疫分析中使用(xiaomingzhou,debinzhu,yuhuiliao,weipengliu,hongxingliu,zhaokuima&daxing(2014).synthesis,labelingandbioanalyticalapplicationsofatris(2,2-bipyridyl)ruthenium(ii)-basedelectrochemi-luminescenceprobe.natureprotocolsvolume9,pages:1146–1159)。在电压激发后,在钌络合物与周围介质中的三丙胺(tpa)的反应下释放具有620nm的发射最大值的化学发光。优选所述能化学发光的标记在此为能化学发光的金属络合物,优选包含钌。
在一个优选实施形式中,所述能化学发光的标记催化通过其它基团的发射或自身发射于具有波长为400nm或更大、优选400nm至650nm、更优选400nm至550nm、更优选405nm至500nm、更优选405nm至490nm、更优选410至490nm、更优选410至450nm、最优选415至445nm的发射最大值。适宜的化合物和方法描述于natrajanetal.(2010)enhancedimmunoassaysensitivityusingchemiluminescentacridiniumesterswithincreasedlightoutput,analyticalbiochemistry,27july2010)。
优选在微滴定板中的不同孔中平行进行多个反应并且借助平板荧光测定仪检测化学发光-信号,所述平板荧光测定仪是商购可得的(例如bertholdtechnologies的)。嗜碱性细胞的活化程度与相对于未激活的对照的化学发光-信号的强度或增加相关。对于阳性值,必须超过依赖于测试物质的阈值,所述阈值是技术人员可常规确定的。
优选顺序进行所述方法,首先进行步骤a),然后步骤b)和最后步骤c)。然而也可能的是首先进行步骤b)并随即进行步骤a)和之后进行步骤c)。可替代地可以同时或叠加进行步骤b)和步骤c)。
在特别优选的实施形式中,在步骤a)后向具有嗜碱性细胞的水溶液添加特异性结合到不依赖于嗜碱性细胞的活化状态位于嗜碱性细胞表面的多肽上的配体和针对对于活化的嗜碱性细胞的表征性标志物配有能化学发光的标记的配体。更优选在载体的存在下进行,其中所述配体特异性结合到不依赖于嗜碱性细胞的活化状态位于嗜碱性细胞表面的多肽上,更优选在固体载体如小珠上固定化的或被固定化。随即可以交换水溶液并洗涤未固定化的嗜碱性细胞,其中过量的配体和未结合的细胞被去除。剩余的,只要存在,嗜碱性细胞,通过特异性结合到不依赖于嗜碱性细胞的活化状态位于嗜碱性细胞表面的多肽上的配体被固定化在载体上。这些固定化的嗜碱性细胞通过与过敏原接触而确实被活化,其特征在于,在所述嗜碱性细胞上结合了针对对于活化的嗜碱性细胞的表征性标志物的配体。只要后一种配体不自身配有能化学发光的标记,可任选地在去除过量配体的洗涤步骤后,在后续步骤中按需要添加具有能化学发光的标记的次级抗体,所述次级抗体结合后提及的配体,其中所述配体仅在活化的嗜碱性细胞上保持结合,而不在未活化的嗜碱性细胞上。在进一步的洗涤步骤中可以去除过量的次级抗体。
随即测量化学发光。借助于这种方法,特别是与红细胞的去除相结合,即使嗜碱性细胞的含量低,也可在检验活化方面实现与借助流式细胞测量法的方法可比的敏感性。
根据本发明的方法和或根据本发明的试剂盒或一种或多种试剂(如在根据本发明的试剂盒中可包含的),还可以用于筛选候选活性物质从而在候选活性物质的选择中鉴定治疗有效的活性物质。在这种情况下,在嗜碱性细胞与候选活性物质接触后进行步骤a)。在治疗有效的候选活性物质的情况下,相对于没有候选活性物质的批次或具有无效的候选活性物质的批次,确定出较低的活化。
在一个优选实施形式中,其中如本文中所使用的术语“候选活性物质”被理解为如下化合物,即假设或待研究其是否对于患者而言具有治疗效果,优选旨在减弱或阻止过敏反应。在一个优选实施形式中,研究一种或多种已知的活性物质,其任选地仅在患有过敏症的患者的亚组中显示,其是否对于特定的患者是治疗有效的。
本发明涉及针对对于活化的嗜碱性细胞的表征性标志物具有能化学发光的标记的配体的用途,其用于诊断过敏或用于制备用于诊断过敏的试剂盒。同样用于过敏的诊断可以使用根据本发明的试剂盒。所述制备可包括将能化学发光的标记偶合到配体上。所述配体可在试剂盒中或在组合物中或其它与配体的组合中使用,所述配体特异性结合到不依赖于嗜碱性细胞的活化状态位于嗜碱性细胞表面的多肽上。
根据本发明的试剂盒可包含不取决于过敏原的存在活化嗜碱性细胞的试剂。这类试剂被描述于现有技术中,包括但不限于甲酰基-蛋氨酰-亮氨酰-苯丙氨酸(fmlp)、罗奴霉素、12-豆蔻酸酯-13-乙酸酯(pma)、fmlp和a23187、抗人igg、抗ige受体-抗体c40/80和青藤碱。优选是fmlp和/或抗fcepsilon-ri,更优选fmlp。
本发明还涉及方法和对此适宜的试剂,用以高效(即在对于高通量适宜的方法中)确定样品质量。这种方法虽然不用过敏原进行并因此不提供诊断用的结果,但允许预言样品质量对于分开批次实施的诊断方法是否是适宜的。
出于该目的实施根据本发明的方法,其中所述过敏原被一种试剂替代,所述试剂已知不依赖于过敏原的存在活化可活化的嗜碱性细胞。
作为额外的或可替代的阳性对照,在与过敏原或与试剂的组合中可使用嗜碱性细胞配制物替代患者的样品,所述试剂已知不依赖于过敏原的存在活化可活化的嗜碱性细胞,其中已知所述嗜碱性细胞配制物具有足够的反应性,即是通过过敏原可活化的。所述嗜碱性细胞配制物可单独或与过敏原或与试剂组合使用,并被包含在根据本发明的试剂盒中,所述试剂已知不依赖于过敏原的存在活化可活化的嗜碱性细胞。
该方法可在诊断方法之前、之后或平行实施,或不依赖于诊断方法地实施。
本发明进一步涉及确认或检验用于检验嗜碱性细胞活化的方法的可靠性或确定包含嗜碱性细胞的样品质量(优选在样品中包含的嗜碱性细胞的可活化性)的非诊断方法,其包括以下步骤:
a)使患者全血样品中的嗜碱性细胞与反应试剂接触,所述嗜碱性细胞不依赖于过敏原的存在而活化,条件是,使嗜碱性细胞通过所述过敏原活化,
b)富集获自步骤a)的嗜碱性细胞并
c)检验活化的嗜碱性细胞,
其中在步骤c)中的检验经此实现,即借助化学发光法检测活化嗜碱性细胞的表征性标志物。
所述不依赖于过敏原的存在活化嗜碱性细胞的试剂可以是甲酰基-蛋氨酰-亮氨酰-苯丙氨酸(fmlp;例如获自sigma,stlouis,mo)和/或是抗ige受体-抗体。
下文中,本发明参照附图依据实施例进行阐述。所描述的实施形式在各个方面仅是示例性的并不理解为限定性的,并且所说明的特征的各种组合是包括于本发明的范围内的。
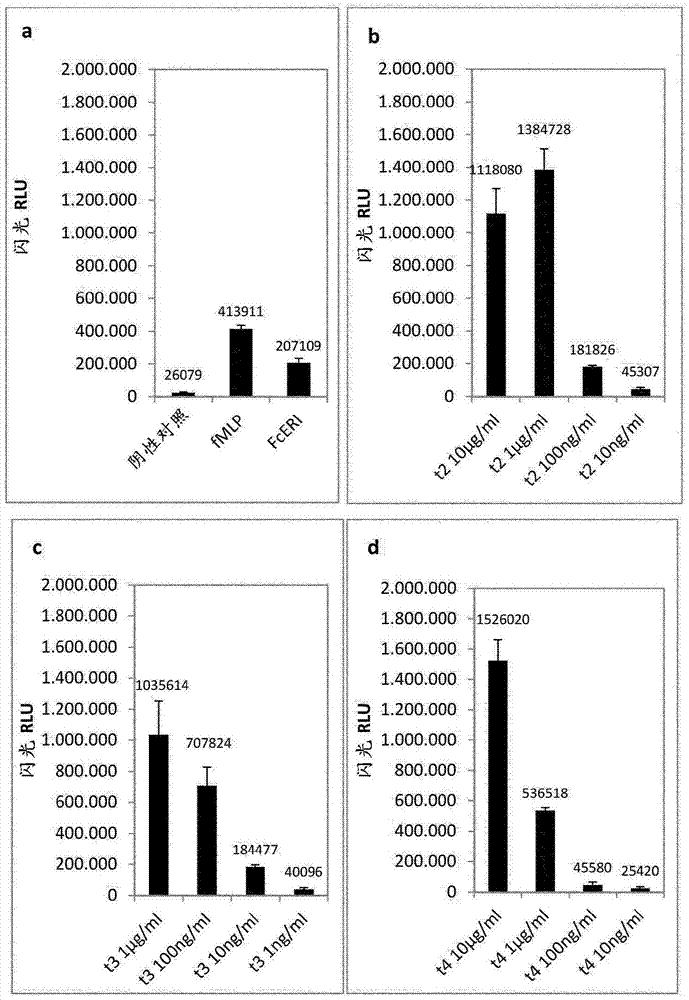
图1展示根据本发明的方法在闪光化学发光法中所测量的相对光单位(rlu;图1a-d)的结果。花粉过敏患者的全血各50μl,用过敏原提取物(t2:桤木花粉提取物;t3:桦木花粉提取物;t4:榛树花粉提取物)以不同浓度(10μg-1ng)或对照(抗fcεri和fmlp)刺激,并且借助化学发光测试来测定嗜碱性细胞的活化。柱形图分别展示取决于过敏原浓度或对照的rlu绝对测量值。所述测量值还通过柱显示。图1a展示不加以刺激的对照(阴性对照)以及用抗fcεri和fmlp的对照刺激下的反应。图1b展示用不同浓度(10μg/ml、1μg/ml、100ng/ml、10ng/ml)的桤木花粉提取物刺激的样品的反应。图1c展示用不同浓度(1μg/ml、100ng/ml、10ng/ml、1ng/ml)的桦木花粉提取物刺激的样品的反应。图1d展示用不同浓度(10μg/ml、1μg/ml、100ng/ml、10ng/ml)的榛木花粉提取物刺激的样品的反应。所述测定以三批次进行。计算平均值和标准偏差。在图1e-h中展示通过(平均值rlu活化的样品)/(平均值rlu阴性对照)计算在图1a-d中所显示的样品的刺激指数(si)。
图2以%(图2a-d)或者作为平均荧光强度(mfi;图2e-h)展示用流式细胞测量法测定活化的嗜碱性细胞的嗜碱性细胞活化测试。花粉过敏患者的全血各50μl,用如在对应图1的测试中的相同过敏原提取物(t2:桤木花粉提取物;t3:桦木花粉提取物;t4:榛树花粉提取物)以不同浓度(10μg-1ng)或对照(抗fcεri和fmlp)刺激,并且借助流式细胞测量法来测定嗜碱性细胞的活化。柱形图分别展示取决于过敏原浓度或对照的活化的嗜碱性细胞份额。所述测量值还通过柱显示。图2a展示不加以刺激的对照(阴性对照)以及用抗fcεri和fmlp的对照刺激下的反应。就此在这两种阳性对照中约30%的嗜碱性细胞被活化。自大于10%的刺激作用起,反应被评价为阳性。图2b展示用不同浓度(10μg/ml、1μg/ml、100ng/ml、10ng/ml)的桤木花粉提取物刺激的样品的反应。图2c展示用不同浓度(1μg/ml、100ng/ml、10ng/ml、1ng/ml)的桦木花粉提取物刺激的样品的反应。图2d展示用不同浓度(10μg/ml、1μg/ml、100ng/ml、10ng/ml)的榛木花粉提取物刺激的样品的反应。具有cd123+/hla-dr-表现型的细胞被鉴定为嗜碱性细胞,其活化通过抗cd63-vio-蓝检测。
取决于花粉提取物,分别在最高使用浓度的情况下嗜碱性细胞的最大反应性为80-88%并且随着过敏原提取物的稀释度增加而下降。
图3展示根据本发明的方法在闪光化学发光法中所测量的相对光单位(rlu;图3a-d)的结果。花粉过敏患者的全血各50μl,用过敏原提取物(f49:苹果提取物;g6:梯牧草花粉提取物;t3:桦木花粉提取物)以不同浓度(10μg-1ng)或对照(抗fcεri和fmlp)刺激,并且借助化学发光测试来测定嗜碱性细胞的活化。柱形图分别展示取决于过敏原浓度或对照的rlu绝对测量值。所述测量值还通过柱显示。图3a展示不加以刺激的对照(阴性对照)以及用抗fcεri和fmlp的对照刺激下的反应。图3b展示用不同浓度(10μg/ml、1μg/ml、100ng/ml、10ng/ml)的苹果提取物刺激的样品的反应。图3c展示用不同浓度(1μg/ml、100ng/ml、10ng/ml、1ng/ml)的梯牧草花粉提取物刺激的样品的反应。图3d展示用不同浓度(1μg/ml、100ng/ml、10ng/ml、1ng/ml)的桦木花粉提取物刺激的样品的反应。所述测定以三批次进行。计算平均值和标准偏差。在图3e-h中展示通过(平均值rlu活化的样品)/(平均值rlu阴性对照)计算在图3a-d中所显示的样品的刺激指数(si)。
图4以%(图4a-d)或者作为平均荧光强度(mfi;图4e-h)展示用流式细胞测量法测定活化的嗜碱性细胞的嗜碱性细胞活化测试。花粉过敏患者的全血各50μl,用过敏原提取物(f49:苹果提取物;g6:梯牧草花粉提取物;t3:桦木花粉提取物)以不同浓度(10μg-1ng)或对照(抗fcεri和fmlp)刺激,并且借助流式细胞测量法来测定嗜碱性细胞的活化。柱形图分别展示取决于过敏原浓度或对照的活化的嗜碱性细胞份额。所述测量值还通过柱显示。图4a展示不加以刺激的对照(阴性对照)以及用抗fcεri和fmlp的对照刺激下的反应。就此在这两种阳性对照中约30%的嗜碱性细胞被活化。自大于10%的刺激作用起,反应被评价为阳性。图4b展示用不同浓度(10μg/ml、1μg/ml、100ng/ml、10ng/ml)的苹果提取物刺激的样品的反应。图4c展示用不同浓度(1μg/ml、100ng/ml、10ng/ml、1ng/ml)的梯牧草花粉提取物刺激的样品的反应。图4d展示用不同浓度(1μg/ml、100ng/ml、10ng/ml、1ng/ml)的桦木花粉提取物刺激的样品的反应。具有cd123+/hla-dr-表现型的细胞被鉴定为嗜碱性细胞,其活化通过抗cd63-vio-蓝检测。
取决于提取物,分别在最高使用浓度的情况下嗜碱性细胞的最大反应性为96-65%并且随着过敏原提取物的稀释度增加而下降。
图5展示根据本发明的方法在闪光化学发光法中所测量的相对光单位(rlu;图5a-d)的结果。花粉过敏患者的全血各50μl,用过敏原提取物(e94:rfeldd1;t3:桦木花粉提取物;w6:艾草花粉提取物)以不同浓度(10μg-1ng)或对照(抗fcεri和fmlp)刺激,并且借助化学发光测试来测定嗜碱性细胞的活化。柱形图分别展示取决于过敏原浓度或对照的rlu绝对测量值。所述测量值还通过柱显示。图5a展示不加以刺激的对照(阴性对照)以及用抗fcεri和fmlp的对照刺激下的反应。图5b展示用不同浓度(1μg/ml、100ng/ml、10ng/ml、1ng/ml)的rfeld1刺激的样品的反应。图5c展示用不同浓度(10μg/ml、1μg/ml、100ng/ml、10ng/ml)的桦木花粉提取物刺激的样品的反应。图5d展示用不同浓度(10μg/ml、1μg/ml、100ng/ml、10ng/ml)艾草花粉提取物刺激的样品的反应。所述测定以三批次进行。计算平均值和标准偏差。在图5e-h中展示通过(平均值rlu活化的样品)/(平均值rlu阴性对照)计算在图5a-d中所显示的样品的刺激指数(si)。
图6以%(图6a-d)或者作为平均荧光强度(mfi;图6e-h)展示用流式细胞测量法测定活化的嗜碱性细胞的嗜碱性细胞活化测试。花粉过敏患者的全血各50μl,用过敏原提取物(e94:rfeldd1;t3:桦木花粉提取物;w6:艾草花粉提取物)以不同浓度(10μg-1ng)或对照(抗fcεri和fmlp)刺激,并且借助流式细胞测量法来测定嗜碱性细胞的活化。柱形图分别展示取决于过敏原浓度或对照的活化的嗜碱性细胞份额。所述测量值还通过柱显示。图6a展示不加以刺激的对照(阴性对照)以及用抗fcεri和fmlp的对照刺激下的反应。就此在这两种阳性对照中约40%的嗜碱性细胞被活化。自大于10%的刺激作用起,反应被评价为阳性。图6b展示用不同浓度(1μg/ml、100ng/ml、10ng/ml、1ng/ml)的rfeld1刺激的样品的反应。图6c展示用不同浓度(10μg/ml、1μg/ml、100ng/ml、10ng/ml)的桦木花粉提取物刺激的样品的反应。图6d展示用不同浓度(10μg/ml、1μg/ml、100ng/ml、10ng/ml)的艾草花粉提取物刺激的样品的反应。具有cd123+/hla-dr-表现型的细胞被鉴定为嗜碱性细胞,其活化通过抗cd63-vio-蓝检测。
取决于提取物,嗜碱性细胞的最大反应性为73-12%。
图7展示根据本发明的方法在闪光化学发光法中所测量的相对光单位(rlu;图7a-d)的结果。花粉过敏患者的全血各50μl,用过敏原提取物(e2:狗毛提取物;i3:黄蜂毒液提取物;i209:rvesv5)以不同浓度(10μg-1ng)或对照(抗fcεri和fmlp)刺激,并且借助化学发光测试来测定嗜碱性细胞的活化。柱形图分别展示取决于过敏原浓度或对照的rlu绝对测量值。所述测量值还通过柱显示。图7a展示不加以刺激的对照(阴性对照)以及用抗fcεri和fmlp的对照刺激下的反应。图7b展示用不同浓度(10μg/ml、1μg/ml、100ng/ml、10ng/ml)的狗毛提取物刺激的样品的反应。图7c展示用不同浓度(10μg/ml、1μg/ml、100ng/ml、10ng/ml)的黄蜂毒液提取物刺激的样品的反应。图7d展示用不同浓度(10μg/ml、1μg/ml、100ng/ml、10ng/ml)的rvesv5刺激的样品的反应。所述测定以三批次进行。计算平均值和标准偏差。在图7e-h中展示通过(平均值rlu活化的样品)/(平均值rlu阴性对照)计算在图7a-d中所显示的样品的刺激指数(si)。
图8以%(图8a-d)或者作为平均荧光强度(mfi;图8e-h)展示用流式细胞测量法测定活化的嗜碱性细胞的嗜碱性细胞活化测试。花粉过敏患者的全血各50μl,用过敏原提取物(e2:狗毛提取物;i3:黄蜂毒液提取物;i209:rvesv5)以不同浓度(10μg-1ng)或对照(抗fcεri和fmlp)刺激,并且借助流式细胞测量法来测定嗜碱性细胞的活化。柱形图分别展示取决于过敏原浓度或对照的活化的嗜碱性细胞份额。所述测量值还通过柱显示。图8a展示不加以刺激的对照(阴性对照)以及用抗fcεri和fmlp的对照刺激下的反应。就此在这两种阳性对照中约30%的嗜碱性细胞被活化。自大于10%的刺激作用起,反应被评价为阳性。图8b展示用不同浓度(1μg/ml、100ng/ml、10ng/ml、1ng/ml)的狗毛提取物刺激的样品的反应。图8c展示用不同浓度(1μg/ml、100ng/ml、10ng/ml、1ng/ml)的黄蜂毒液提取物刺激的样品的反应。图8d展示用不同浓度(10μg/ml、1μg/ml、100ng/ml、10ng/ml)的rvesv5刺激的样品的反应。具有cd123+/hla-dr-表现型的细胞被鉴定为嗜碱性细胞,其活化通过抗cd63-vio-蓝检测。
取决于提取物,嗜碱性细胞的最大反应性为25-8%。
图9展示根据本发明的方法在闪光化学发光法中所测量的相对光单位(rlu;图9a-d)的结果。花粉过敏患者的全血各50μl,用过敏原提取物(w8:蒲公英花粉提取物;f17:榛树坚果提取物;f49:苹果提取物;e94rfeld1)以不同浓度(10μg-100ng)或对照(抗fcεri和fmlp)刺激,并且借助化学发光测试来测定嗜碱性细胞的活化。柱形图分别展示取决于过敏原浓度或对照的rlu绝对测量值。所述测量值还通过柱显示。图9a展示不加以刺激的对照(阴性对照)以及用抗fcεri和fmlp的对照刺激下的反应。图9b展示用不同浓度(10μg/ml、1μg/ml、100ng/ml)的蒲公英花粉提取物刺激的样品的反应。图9c展示用不同浓度(10μg/ml、1μg/ml、100ng/ml)的榛树坚果提取物刺激的样品的反应。图9d展示用不同浓度(10μg/ml、1μg/ml、100ng/ml)的苹果提取物刺激的样品的反应。图9e展示用不同浓度(10μg/ml、1μg/ml、100ng/ml)的rfeld1刺激的样品的反应。所述测定以三批次进行。计算平均值和标准偏差。在图9f-j中展示通过(平均值rlu活化的样品)/(平均值rlu阴性对照)计算在图9a-e中所显示的样品的刺激指数(si)。
图10以%(图10a-e)或者作为平均荧光强度(mfi;图10f-j)展示用流式细胞测量法测定活化的嗜碱性细胞的嗜碱性细胞活化测试。花粉过敏患者的全血各50μl,用过敏原提取物(w8:蒲公英花粉提取物;f17:榛树坚果提取物;f49:苹果提取物;e94rfeld1)以不同浓度(10μg-100ng)或对照(抗fcεri和fmlp)刺激,并且借助流式细胞测量法来测定嗜碱性细胞的活化。柱形图分别展示取决于过敏原浓度或对照的活化的嗜碱性细胞份额。所述测量值还通过柱显示。图10a展示不加以刺激的对照(阴性对照)以及用抗fcεri和fmlp的对照刺激下的反应。就此在这两种阳性对照中约30%的嗜碱性细胞被活化。自大于10%的刺激作用起,反应被评价为阳性。图10b展示用不同浓度(10μg/ml、1μg/ml、100ng/ml)的蒲公英花粉提取物刺激的样品的反应。图10c展示用不同浓度(10μg/ml、1μg/ml、100ng/ml)的榛树坚果提取物刺激的样品的反应。图10d展示用不同浓度(10μg/ml、1μg/ml、100ng/ml)的苹果提取物刺激的样品的反应。图10e展示用不同浓度(10μg/ml、1μg/ml、100ng/ml)的rfeld1刺激的样品的反应。具有cd123+/hla-dr-表现型的细胞被鉴定为嗜碱性细胞,其活化通过抗cd63-vio-蓝检测。
取决于提取物,嗜碱性细胞的最大反应性为89-37%。
图11展示用不同检测系统在用fmlp或不加以刺激的对照(阴性对照)刺激后患者样品的结果。图11a展示根据本发明的方法在闪光化学发光法中所测量的相对光单位(rlu)的结果。图11b展示按照根据本发明的方法实施的嗜碱性细胞的富集,按照用荧光标记的抗体(抗cd63-fitc;2μg/ml)检测的作为荧光强度(fi)的结果。图11c展示用流式细胞测量法测定活化的嗜碱性细胞的嗜碱性细胞活化测试。花粉过敏患者的全血各50μl,用fmlp刺激或不加以刺激(阴性对照)。嗜碱性细胞的活化则用上述方法测定。柱形图分别以rlu(图11a)或fi(图11b)展示绝对测量值或以%展示嗜碱性细胞的活化(图11c)。
图12展示在使用用于嗜碱性细胞的富集和检验的不同抗体组合下,在用fmlp或不加以刺激的对照(阴性对照)刺激后患者样品的结果。不使用过敏原。图12a展示根据本发明的方法在闪光化学发光法中所测量的相对光单位(rlu)的结果。图12b展示通过(平均值rlu活化的样品)/(平均值rlu阴性对照)计算在图12a中所显示的样品的刺激指数(si)。图12c展示用流式细胞测量法测定活化的嗜碱性细胞的嗜碱性细胞活化测试。图12d展示通过活化依赖性标志物cd63通过抗cd63-生物素嗜碱性细胞的富集和用抗ige-nsp-sa检验的结果。所述抗cd63-生物素抗体以0.2-1μg/ml的浓度使用,而检验抗体抗ige-nsp-sa以0.5μg/ml的固定浓度使用。图12e展示通过(平均值rlu活化的样品)/(平均值rlu阴性对照)计算在图12d中所显示的样品的刺激指数(si)。
实施例:
1a.过敏原稀释的准备:
用于检验嗜碱性细胞的活化,将抗cd63抗体(klon7g3,bdbioscience#353014)与nsp-sa-nhs吖啶酯(heliosensebiotechnologies,#199293-83-9)依据制造商的说明共价偶合。随即将所述抗体通过pd-10柱(gehealthcare,#383420)纯化。以相同方式用nsp-sa-nhs标记biomolgmbh的ige。
1b.过敏原稀释的准备:
t2桤木花粉提取物(squarix,#t-4402)、t3桦木花粉提取物(squarix,#t-4400)和t4榛树花粉提取物(squarix,#t-4404)以10μg/ml、1μg/ml、100ng/ml、10ng/ml、1ng/ml的浓度在稀释缓冲液(1xhanks平衡盐溶液(thermofisherscientific#14065056),40mmhepes,ph7,4)中稀释。稀释缓冲液用作为阴性对照。作为阳性对照使用浓度为10-6m的fmlp(sigma,#f3506-5mg)和浓度为100ng/ml的抗fcεri抗体(klonaer-37,ebioscience,#14-5899-82)。此外作为抗原使用苹果提取物(squarix#f-2327)、梯牧草花粉提取物(squarix#g-5501)、e94(依据rogersetal.(1993)recombinantfeld.i:expression,purification,igebindingandreactionwithcat-allergichumantcells.,molecularimmunology,30april2010(6),559-568进行纯化)、艾草花粉提取物(squarix#w-3400)、狗毛提取物(squarix#e-6617)、黄蜂毒液提取物(squarix#i-7804)、i209(依据seismannetal.2010,clinicalandmolecularallergy,8:7进行纯化)、蒲公英花粉提取物(squarix#w-3404)和榛树坚果提取物(squarix,#t-4404)。
1c.刺激:
在微滴定板中将各50μl外周全血(肝素化的)与各50μl过敏原或对照稀释液混合并在温箱中于37℃下温育20分钟。通过添加10μl的浓edta-溶液(100mmedta于pbs中)终止反应。
2a1.温育抗体:
随即将两种抗体加入样品:
1)抗cd123-生物素(klonh5c6,biolegend#353014)终浓度为0,5μg/ml
2)抗cd63-nsp-sa(klon7g3,bdbioscience#353014)终浓度为2μg/ml
所述样品被混合并在室温下温育10分钟。
可替代地使用抗cd63-生物素(biolegend353017)和抗cd63-fitc(miltenyi130-100-160)。
2a2.红细胞胞溶:
通过添加100μl的含皂甙的胞溶缓冲液(0.14%皂甙于pbs中)并在室温下温育10分钟使红细胞胞溶。随即将所述微滴定板在500g下离心5分钟并去除上清液。
2a3.温育小珠:
所述样品各与10μg链霉亲和素-涂覆的小磁珠(链霉亲和素封闭的sera-magspeedbeads,ge-healthcare,#21152104010350)混合并在室温下温育10分钟。
2a4.洗涤:
将结合到小珠上的细胞5次用300μl洗涤缓冲液(0.05%tween,2mmedta,150mmnacl,0.05%nan3)在平板洗涤器(例如配有mbs96磁铁的tecanhydroflex)上洗涤。
2a5.检测:
在随即的检测中,通过两种溶液(h2o2;0.1mhno3和0.25mnaoh(化学发光检测试剂盒,invitronltd.,#iv1-001))引发cd63抗体上的nsp-sa吖啶-酯。在平板荧光测定仪(例如bertholdcentrolb960)上在425nm的波长下检测所产生的化学发光信号(flash-lumineszenz)。
2a6.评价:
通过与未刺激的对照相比,化学发光信号的增加计算嗜碱性细胞的活化强度。由活化样品的相对光单位(rlu)/未刺激的样品的rlu可计算刺激指数(si)。在此待超过的阈值是取决于测试物质的。
2b.流式细胞测量法的测量:
用于流式细胞测量法的测定,将样品在用抗cd123-pe(miltenyibiotec,#130-098-894)、抗hla-dr-percpvio700(miltenyibiotec,#130-103-873)和抗cd63-vio-蓝(miltenyibiotec,#130-100-154)抗体根据制造商的说明活化后在4℃下避光温育15分钟。
在添加1ml1xfacs-胞溶-溶液(bdbioscience,#349202)和室温下温育10分钟后,将所述样品在500g下离心5分钟,去除上清液并将所述样品重新用各500μl洗涤缓冲液(无ca2+/mg2+的pbs、0.5%bsa、2mmedta、0.05%nan3)洗涤。在流式细胞测量仪例如macsquant(miltenyibiotec)上在2小时内测量。具有cd123+/hla-dr-表现型的细胞被鉴定为嗜碱性细胞。如果cd63信号超过一个选定的阈值,嗜碱性细胞被活化。总活化度≥10%被评价为阳性。
2c.荧光测量
用bmglabtechfluostar(485nm/520nm)-仪器测量抗cd63-fitc的荧光。
结论:
如果经刺激的样品的信号相比对照翻倍(si≥2),则所述化学发光测试(图1)被评价为阳性。在所述流式细胞测量法的测定评价中(图2),所有样品被评价为阳性,它们显示≥10%的活化度。化学发光测试与流式细胞测量法测试的对比显示这两种测试系统的结果的良好关联性以及良好的可再现性。化学发光信号的动态测量范围在此明显比荧光信号宽。
在流式细胞测量法的评价中,必须设定用于定义活化的和非活化的细胞群的分析窗(设门),其必须为每一患者单独匹配并被相应评价主观地设定。这种评价变化的可能性在化学发光测试中不会发生,因为在此仅生成经刺激的样品与对照的关系。这使得标准化的评价成为可能,标准化的评价在流式细胞测量法的测试中是无法实现的。由于以微滴定板规格准备样品,快速测量和简单的评价此外允许明显较高的样品通量(probendurchsatz)。
此外这种试验显示,使用化学发光法作为检测系统表现出决定性优点:嗜碱性细胞和其它细胞仅显示非常小的自身化学发光。在测量中由此不需要靶细胞的绝对纯净度。
相反,特别是死细胞和粒细胞具有高自身荧光,其在流式细胞测量法中引起所希望的信号的叠加并因此预设相应的设门(gating)。在使用cd123-生物素抗体纯化嗜碱性细胞时,在样品中包含一小部分特别是同样在表面表达cd123的树突细胞。然而这种表达没有cd63,从而检测到的抗-cd63化学发光信号仅归因于嗜碱性细胞。所述测量本身不受其它未标记的细胞的存在影响。
化学发光作为检验方法与存在不分级的全血的组合由此导向一种高敏检验方法,用其可在最大可再现性和可标准化的情况下平行处理多个样品。
在图3-10中抗原和样品供体的宽泛选择表明根据本发明的方法是广泛可用的。其中每种情况下的第一个图,用化学发光法(例如图3)与用流式细胞测量法的随后的(图4)的测试相同,从而显示可比性。结论是可比性是令人吃惊地高的。根据本发明的方法可以由此替代流式细胞测量法。
在图11中直接对比化学发光法、荧光法和流式细胞测量法三种检测方法。其中可明显确定,化学发光法与流式细胞测量法在敏感性方面是大约相当的并且明显比荧光法适用,根据本发明的方法可以替代流式细胞测量法。
在图12中展示的测试最后证明,如果针对富集使用依赖于活化的配体并针对检测使用不依赖于活化的配体,而非如在其它测试中相反的那样,则根据本发明的方法也是可行的。虽然在化学发光法的情况下的背景相比信号较高,但背景信号仍是明显区别的。
- 还没有人留言评论。精彩留言会获得点赞!